修回日期: 2025-01-24
接受日期: 2025-02-20
在线出版日期: 2025-02-28
近年有研究报道长链非编码RNA(lncRNA) HOTAIR、微小RNA(miRNA)-302b-3p表达异常与恶性肿瘤发生发展有关, 但其其与循环肿瘤细胞关系及对预后预测价值的研究较少, 值得进一步研究.
探究LncRNA HOTAIR、miR-302b-3p表达与结肠癌循环肿瘤细胞的关系及对预后预测的价值.
选取2019-05/2023-05临海市中医院行根治性切除术治疗的结肠癌患者160例作为观察组, 另选取同期本院体检中心160例体检健康志愿者作为对照组. 比较两组LncRNA HOTAIR、miR-302b-3p表达, 分析LncRNA HOTAIR、miR-302b-3p表达与病理特征的关系, 记录结肠癌患者术后复发转移情况, 并评价LncRNA HOTAIR、miR-302b-3p表达对结肠癌术后复发转移的预测价值.
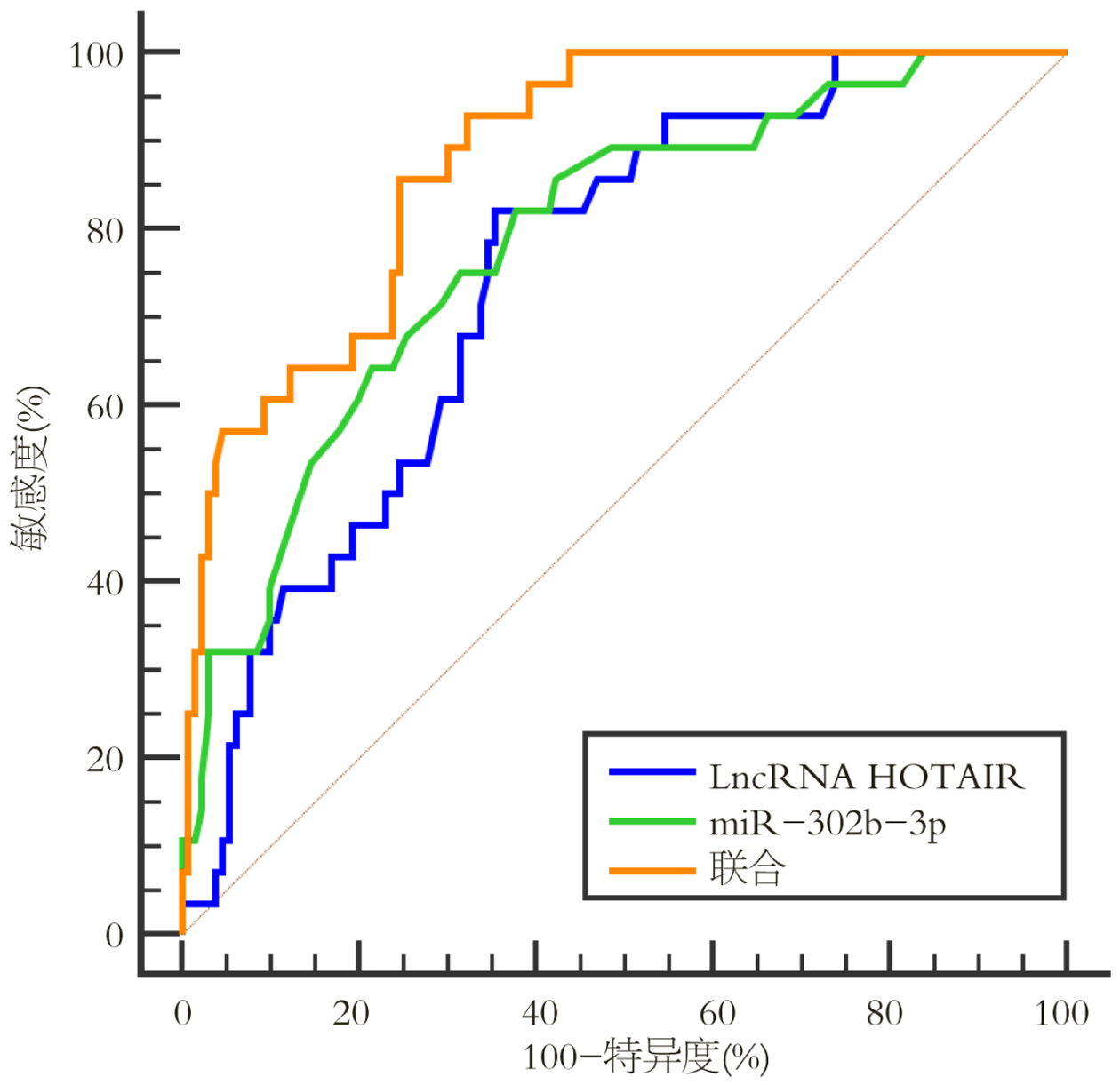
观察组血清LncRNA HOTAIR表达高于对照组, miR-302b-3p表达低于对照组(P<0.05); 多元线性回归分析显示, 临床分期、淋巴结转移及循环肿瘤细胞均为结肠癌患者血清LncRNA HOTAIR、miR-302b-3p表达的影响因素(P<0.05); 160例结肠癌患者失访2例, 共有28例患者出现复发转移. 复发转移患者血清LncRNA HOTAIR表达高于未复发转移患者, miR-302b-3p表达低于未复发转移患者(P<0.05); 血清LncRNA HOTAIR、miR-302b-3p预测结肠癌患者术后复发转移风险的曲线下面积(AUC)分别为0.747(0.672-0.813)、0.785(0.713-0.846), 最佳截断值分别为3.14、0.48, 二者联合预测术后复发转移风险的AUC为0.880(0.919-0.926), 此时敏感度与特异度分别为85.71%、75.38%, 预测效能优于各指标单独预测.
结肠癌患者血清LncRNA HOTAIR表达上调, miR-302b-3p表达下调, 与临床分期、淋巴结转移、循环肿瘤细胞阳性有关, 检测二者水平, 有助于预测其预后.
核心提要: 长链非编码RNA(lncRNA) HOTAIR、微小RNA(miRNA)-302b-3p在结肠癌患者血清中表达与健康志愿者存在明显差异; 同时患者血清LncRNA HOTAIR、miR-302b-3p与循环肿瘤细胞阳性及预后具有显著相关性, 推测LncRNA HOTAIR、miR-302b-3p可作为结肠癌患者预后预测生物标志物.
引文著录: 王凌, 林霞, 戚国勇, 陈贵平. LncRNA HOTAIR、miR-302b-3p表达与结肠癌循环肿瘤细胞的关系及对预后预测的价值研究. 世界华人消化杂志 2025; 33(2): 140-147
Revised: January 24, 2025
Accepted: February 20, 2025
Published online: February 28, 2025
In recent years, studies have reported that the abnormal expression of the long non-coding RNA (lncRNA) HOTAIR and microRNA (miRNA)-302b-3p is associated with the occurrence and development of malignant tumors. However, there is limited research on their relationship with circulating tumor cells and their prognostic value, which warrants further investigation.
To investigate the relationship between the expression of HOTAIR and miR-302b-3p and circulating tumour cells in colon cancer, and to explore their value for prognostic prediction.
A total of 160 patients with colon cancer who underwent radical resection at the Traditional Chinese Medicine Hospital of Linhai City from May 2019 to May 2023 were selected as an observation group, and another 160 healthy volunteers who underwent physical examination at the same hospital's physical examination center during the same period were selected as a control group. The expression of HOTAIR and miR-302b-3p in the two groups was compared. The relationship between the expression of HOTAIR and miR-302b-3p and pathological characteristics was analyzed. The recurrence and metastasis of colon cancer patients were recorded, and the predictive value of HOTAIR and miR-302b-3p expression for the recurrence and metastasis of colon cancer was evaluated.
The expression of serum HOTAIR in the observation group was higher than that of the control group, while the expression of miR-302b-3p was lower than that of the control group (P < 0.05). Multiple linear regression analysis showed that clinical stage, lymph node metastasis, and circulating tumor cells were all factors affecting the expression of serum HOTAIR and miR-302b-3p in colon cancer patients (P < 0.05). Among the 160 patients with colon cancer, 2 were lost to follow-up, and 28 experienced recurrence or metastasis. The expression of serum HOTAIR in patients with recurrence or metastasis was higher than that of patients without recurrence or metastasis, while the expression of miR-302b-3p was lower than that of patients without recurrence or metastasis (P < 0.05). The area under the curve (AUC) of serum HOTAIR and miR-302b-3p for predicting the risk of postoperative recurrence and metastasis in patients with colon cancer was 0.747 (0.672-0.813) and 0.785 (0.713-0.846), respectively. The optimal cutoff values were 3.14 and 0.48, respectively. The AUC of the combination of the two for predicting the risk of postoperative recurrence and metastasis was 0.880 (0.919-0.926), with a sensitivity and specificity of 85.71% and 75.38%, respectively. The predictive efficacy was superior to that of each indicator alone.
The expression of serum HOTAIR is up-regulated and the expression of miR-302b-3p is down-regulated in patients with colon cancer, which is related to clinical stage, lymph node metastasis, and positive circulating tumor cells. Detecting the levels of both can help predict patient prognosis.
- Citation: Wang L, Lin X, Qi GY, Chen GP. Relationship between expression of lncRNA HOTAIR and miR-302b-3p and circulating tumor cells in colon cancer and their value for prognostic prediction. Shijie Huaren Xiaohua Zazhi 2025; 33(2): 140-147
- URL: https://www.wjgnet.com/1009-3079/full/v33/i2/140.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v33.i2.140
结肠癌为临床常见胃肠道恶性肿瘤之一, 近年来, 其发病率及病死率呈明显增长趋势[1,2]. 根治性切除术为结肠癌主要治疗手段, 但仍有10%-50%的患者存在术后复发与转移[3,4], 导致其生命质量下降及生存时间缩短. 因此, 早期预测结肠癌患者预后情况尤为关键. 非编码RNA虽不参与编码蛋白质, 但可调控转录或转录后基因表达, 在多种生理病理过程中发挥重要作用, 其包括长链非编码RNA(lncRNA)、微小RNA(miRNA)等, 是近年来研究热点, 与恶性肿瘤发生、发展也密切相关, 主要通过调控不同靶基因在增殖、凋亡、侵袭及转移等中扮演原癌基因与抑癌基因角色[5-7]. HOTAIR来自同源盒基因X基因簇, 是LncRNA成员之一, 可通过调控肿瘤细胞的侵袭及转移, 参与肿瘤进展[8]. miR-302b-3p是miRNA家族成员之一, 在肝癌、前列腺癌、胃癌、上皮性卵巢癌等多种恶性肿瘤中扮演抑癌基因角色, 参与其发生发展[9-11]. 循环肿瘤细胞检测是一种非侵入液体活检方法, 近年来开展的一种新型检测技术, 对食管癌、胃癌等消化系统肿瘤诊断及预后预测重要指导价值[12,13]. 然而, 关于LncRNA HOTAIR、miR-302b-3p表达与结肠癌及其循环肿瘤细胞关系的相关报道较为鲜见. 本研究观察组结肠癌患者血清LncRNA HOTAIR、miR-302b-3p表达, 并分析其与循环肿瘤细胞的关系及对预后预测的价值, 旨在为临床工作提供更多可能性.
选取2019-05/2023-05临海市中医院行根治性切除术治疗的结肠癌患者160例作为观察组, 其中男91例, 女69例, 年龄(25-80)岁, 平均年龄(60.56±9.41)岁. 纳入标准: 经病理学诊断确诊为结肠癌, 初次确诊; 年龄>18岁; 术前未接受抗肿瘤相关治疗; 预计生存期>3个月. 排除标准: 转移性结肠癌; 合并其他部位恶性肿瘤; 伴有心脑血管功能障碍及肝肾功能不全; 合并血液系统疾病、内分泌性疾病、全身炎症反应综合征及自身免疫性疾病; 妊娠期、哺乳期等特殊时期女性. 另选取同期本院体检中心160例体检健康志愿者作为对照组, 男87例, 女73例, 年龄28-78(58.27±9.23)岁. 两组资料比较无统计学差异. 本研究通过医学伦理委员会审核批准, 两组受试者均签署知情同意书.
观察组术前1周采集空腹肘静脉血6 mL, 其中3 mL采用荧光定量PCR法测定血清LncRNA HOTAIR、miR-302b-3p表达, Trizol法提取血清总RNA, 反转获取cDNA, 采用荧光定量PCR法检测, PCR反应条件: 95 ℃ 15 min预变性, 94 ℃ 15 s变性, 55 ℃ 30 s退火、70 ℃ 30 s延伸, 共40个循环, 收集循环阈值(CT)数, 以GAPDH或U6为内参, 采用2-ΔΔCT法计算LncRNA HOTAIR、miR-302b-3p表达; 另外3 mL采用免疫磁珠负向筛选, 去除红细胞、白细胞及巨噬细胞, 收集上层清液中循环肿瘤细胞, 加入含肿瘤特异性配体的寡核苷酸偶合物的探针标记液, 之后采用靶向荧光定量PCR法, PCR反应条件: 95 ℃ 2 min预变性, 40 ℃ 30 s变性, 70 ℃ 30 s退火、8 ℃ 5 min延伸, 共40个循环, 计算叶酸受体阳性循环肿瘤细胞表达情况, 其中>10.1 FU/3 mL判定为循环细胞阳性. 对照组采集空腹肘静脉血3 mL, 荧光定量PCR法测定血清LncRNA HOTAIR、miR-302b-3p表达, 操作同观察组.
160例结肠癌患者均行根治性切除术治疗, 均顺利出院, 患者出院当天即开始随访, 随访方式采用门诊复查, 每3个月随访1次, 行腹部B超、CT及组织病理学检查, 随访结束时间为患者出现复发转移或2024-05-31, 统计患者复发转移情况.
统计学处理 SPSS 24.0分析数据, 符合正态分布的计量资料用(mean±SD)表示, 比较以t检验或单因素方差分析; 计数资料用n(%)表示, 比较以χ2检验; 多元线性回归模型分析血清LncRNA HOTAIR、miR-302b-3p表达与病理特征的关系; 受试者工作特征(Receiver operating characteristic, ROC)曲线评价血清LncRNA HOTAIR、miR-302b-3p表达对结肠癌患者预后的预测价值. 检验水准α = 0.05. P<0.05表示差异有统计学意义.
观察组血清LncRNA HOTAIR表达高于对照组, miR-302b-3p表达低于对照组, 差异有统计学意义(P<0.05), 见表1.
| 组别 | 例数 | LncRNA HOTAIR | miR-302b-3p |
| 观察组 | 160 | 3.23±0.87 | 0.47±0.10 |
| 对照组 | 160 | 1.05±0.14 | 1.03±0.15 |
| t | 31.293 | 39.292 | |
| P值 | <0.001 | <0.001 |
结肠癌患者血清LncRNA HOTAIR、miR-302b-3p表达在临床分期、淋巴结转移、循环细胞结果方面比较, 差异有统计学意义(P<0.05), 见表2.
| 病理特征 | 例数 | LncRNA HOTAIR | miR-302b-3p | ||||
| 表达量 | F/t | P值 | 表达量 | F/t | P值 | ||
| 性别 | |||||||
| 男 | 90 | 3.19±0.85 | 0.648 | 0.518 | 0.47±0.10 | 0.000 | 1.000 |
| 女 | 70 | 3.28±0.90 | 0.47±0.12 | ||||
| 年龄 | |||||||
| <60岁 | 74 | 3.22±0.87 | 0.143 | 0.886 | 0.48±0.14 | 1.050 | 0.295 |
| ≥60岁 | 86 | 3.24±0.89 | 0.46±0.10 | ||||
| 肿瘤大小 | |||||||
| <5 cm | 79 | 3.15±0.86 | 1.149 | 0.252 | 0.49±0.12 | 1.860 | 0.065 |
| ≥5 cm | 81 | 3.31±0.90 | 0.45±0.15 | ||||
| 肿瘤部位 | |||||||
| 左半结肠 | 84 | 3.12±0.84 | 1.681 | 0.095 | 0.48±0.12 | 1.095 | 0.275 |
| 右半结肠 | 76 | 3.35±0.89 | 0.46±0.11 | ||||
| 临床分期 | |||||||
| Ⅰ期 | 40 | 2.74±0.74 | 11.792 | <0.001 | 0.54±0.15 | 9.389 | <0.001 |
| Ⅱ期 | 90 | 3.29±0.85 | 0.46±0.13 | ||||
| Ⅲ期 | 30 | 3.70±0.92 | 0.41±0.09 | ||||
| 分化程度 | |||||||
| 高分化 | 43 | 3.02±0.84 | 1.780 | 0.172 | 0.50±0.17 | 1.097 | 0.336 |
| 中分化 | 80 | 3.29±0.87 | 0.46±0.15 | ||||
| 低分化 | 37 | 3.34±0.86 | 0.46±0.13 | ||||
| 淋巴结转移 | |||||||
| 无 | 130 | 3.09±0.85 | 4.203 | <0.001 | 0.50±0.14 | 5.423 | <0.001 |
| 有 | 30 | 3.82±0.89 | 0.35±0.12 | ||||
| 循环肿瘤细胞 | |||||||
| 阴性 | 65 | 2.74±0.74 | 6.289 | <0.001 | 0.57±0.15 | 8.605 | <0.001 |
| 阳性 | 95 | 3.57±0.87 | 0.40±0.10 | ||||
以结肠癌患者血清LncRNA HOTAIR、miR-302b-3p表达为因变量, 以临床分期(Ⅰ期 = 1, Ⅱ期 = 2, Ⅲ期 = 2)、淋巴结转移(无 = 0, 有 = 1)、循环肿瘤细胞(阴性 = 0, 阳性 = 1)为自变量, 进行多元线性回归分析, 结果显示, 临床分期、淋巴结转移及循环肿瘤细胞均为结肠癌患者血清LncRNA HOTAIR、miR-302b-3p表达的影响因素(P<0.05), 见表3.
| 项目 | 偏回归系数 | 标准误差 | 偏回归系数(标准化) | t值 | P值 |
| LncRNA HOTAIR | |||||
| 临床分期 | 0.720 | 0.034 | 0.768 | 21.176 | <0.001 |
| 淋巴结转移 | 0.745 | 0.029 | 0.792 | 25.690 | <0.001 |
| 循环肿瘤细胞 | 0.732 | 0.037 | 0.784 | 19.784 | <0.001 |
| miR-302b-3p | |||||
| 临床分期 | -0.715 | 0.030 | -0.760 | -23.833 | <0.001 |
| 淋巴结转移 | -0.756 | 0.032 | -0.804 | -23.625 | <0.001 |
| 循环肿瘤细胞 | -0.703 | 0.035 | -0.769 | -20.086 | <0.001 |
160例结肠癌患者失访2例, 共有28例患者出现复发转移. 复发转移患者血清LncRNA HOTAIR表达高于未复发转移患者, miR-302b-3p表达低于未复发转移患者, 差异有统计学意义(P<0.05), 见表4.
| 组别 | 例数 | LncRNA HOTAIR | miR-302b-3p |
| 复发转移 | 28 | 3.94±0.92 | 0.40±0.10 |
| 未复发转移 | 130 | 3.05±0.77 | 0.49±0.14 |
| t | 5.353 | 3.225 | |
| P值 | <0.001 | <0.001 |
以术后复发转移患者为阳性样本, 未复发转移为阴性样本, 血清LncRNA HOTAIR、miR-302b-3p表达为源数据, 绘制ROC曲线, 结果显示, 血清LncRNA HOTAIR、miR-302b-3p表达预测结肠癌患者术后复发转移风险的曲线下面积(area under the curve, AUC)分别为0.747(0.672-0.813)、0.785(0.713-0.846), 最佳截断值分别为3.14、0.48, 二者联合预测术后复发转移风险的AUC为0.880(0.919-0.926), 此时敏感度与特异度分别为85.71%、75.38%, 预测效能优于各指标单独预测, 见图1.
据调查, 我国左、右半结肠癌患者5年生存率均较低[14], 结肠癌根治性切除术后复发转移是影响患者生存率的重要因素[15]. 既往研究表明[16,17], 结肠癌病理指标临床分期、淋巴结转移等与其预后有关, 但这些指标虽具有描述具体、分期明确等优势, 但大多数来自术后病理报告, 无法及时预测肿瘤复发转移. 结肠癌的发生、发展与多种因素有关, 其中原癌基因激活与抑癌基因失活占据主要地位. 因此, 探寻可早期准确预测结肠癌根治性切除术后复发转移的生物标志物尤为关键.
研究证实, LncRNAs作为表观遗传学调控因子, 参与恶性肿瘤细胞增殖、侵袭及转移等多种生物学行为进程[18]. 目前关于血清LncRNAs能否应用于恶性肿瘤患者诊断及预后预测受到了研究者的关注, 如楼衷晗等[19]指出, 血清LncRNA HOTAIR表达与原发性肝癌患者病理特征有关, 可能参与其发生发展. 刘蜜等[20]发现, 前列腺癌患者血清LncRNA HOTAIR与肿瘤血管生成有关, 同时其表达上调可作为该病患者根治术后短期预后的独立危险因素. HOTAIR是一种具有致癌基因作用的LncRNA, 研究显示[21], 血清LncRNA HOTAIR表达与结肠癌密切的相关, 范长儒等[22]表明, 结肠癌患者外周血LncRNA HOTAIR阳性率明显高于健康体检者, 与本研究结果一致, 提示LncRNA HOTAIR高表达参与结肠癌发生. 体外研究显示[23], HOTAIR的沉默会促进肿瘤细胞凋亡, 对肿瘤细胞增殖具有明显抑制作用, 这或许可反向解释本研究结果. 此外, 本研究中血清LncRNA HOTAIR表达在结肠癌患者临床分期、淋巴结转移、循环肿瘤细胞结果方面存在差异, 说明结肠癌恶性程度越高, 血清LncRNA HOTAIR表达越高, 提示血清LncRNA HOTAIR可能参与了结肠癌的恶性转化及增殖转移过程. 值得注意的是, 有研究表明[24], 循环肿瘤细胞是指原发灶或转移灶进入外周血液循环的肿瘤细胞, 参与恶性肿瘤发生及复发转移, 而临床分期、淋巴结转移为恶性肿瘤复发转移的独立影响因素, 结合本研究中临床分期、淋巴结转移及循环肿瘤细胞均可影响结肠癌患者血清LncRNA HOTAIR表达这一结论, 推测血清LncRNA HOTAIR或许可作为结肠癌患者术后复发转移的生物标志物.
miRNAs作为一种可在转录后调节几乎所有生物学过程的内源性非编码RNA, 在细胞状态转变及干细胞分化期间扮演重要角色. miR-302基因簇中miR-302b-3p属于胚胎干细胞周期调节miRNA, 可提高胚胎干细胞活力, 调节细胞分化、凋亡[25]. 近年来, 越来越多的研究报道其在胃肠道恶性肿瘤中的作用. 有学者表明, 胃癌组织中miR-302b-3p明显下调, 并可通过对含有Rho相关卷曲螺旋蛋白激酶2表达的抑制作用, 干预肿瘤细胞侵袭、迁移, 并加速其凋亡[26]. 另一项大肠癌相关研究显示, miR-302b-3p在结肠癌中发挥抑癌基因作用, 其转染后, 可抑制肿瘤细胞侵袭, 促进细胞凋亡[27]. 本研究中观察组血清miR-302b-3p表达低于对照组, 与上述研究结果一致, 提示miR-302b-3p可能为结肠癌抑癌基因. 另外, 本研究还显示, 结肠癌患者血清miR-302b-3p表达受临床分期、淋巴结转移、循环肿瘤细胞影响, 提示血清miR-302b-3p参与结肠癌进展, 其表达下调, 预示着肿瘤侵袭性更强, 患者术后可能出现复发转移.
本研究中预后不良患者血清LncRNA HOTAIR表达高于预后良好患者, miR-302b-3p表达低于预后不良患者, 这可能是由于HOTAIR可通过与PRC2结合, 促进Wnt/β-eatenin信号通路关键抑制因子WIF-1甲基化, 促使WIF基因沉默或表达下调, 进而调控肿瘤血管新生相关因子, 诱导肿瘤细胞侵袭及转移, 增加术后复发转移风险[28]; 而miR-302b-3p可通过靶控EphA2, 削弱Wnt/β-eatenin信号通路作用, 进而对肿瘤细胞增殖、侵袭及转移发挥抑制作用[29], 同时还可直接靶控Akt2, 抑制肿瘤血管新生相关因子表达, 对肿瘤细胞侵袭及转移发挥抑制作用[30], 因此, 其表达降低提示复发转移风险增加. 进一步ROC曲线显示, 血清LncRNA HOTAIR、miR-302b-3p表达联合预测结肠癌患者术后复发风险的AUC为0.880, 此时敏感度与特异度分别为85.71%、75.38%, 预测效能优于各指标单独预测, 分析原因, 可能是由于LncRNA HOTAIR表达升高, miR-302b-3p表达下调, 可共同促进肿瘤细胞侵袭及转移, 增加结肠癌术后复发转移风险有关, 但其具体机制有待临床日后进一步证实.
综上所述, 结肠癌患者血清LncRNA HOTAIR表达上调, miR-302b-3p表达下调, 与临床分期、淋巴结转移、循环肿瘤细胞阳性有关, 检测二者水平, 有助于预测其预后.
近年有研究报道长链非编码RNA(lncRNA) HOTAIR、微小RNA(miRNA)-302b-3p表达异常与恶性肿瘤发生发展有关, 但其与循环肿瘤细胞关系及对预后预测价值的研究较少, 值得进一步研究.
结肠癌近年来, 其发病率及病死率呈明显增长趋势. 根治性切除术为结肠癌主要治疗手段, 但仍有10%-50%的患者存在术后复发与转移, 导致其生命质量下降及生存时间缩短. 因此, 早期预测结肠癌患者预后情况尤为关键. 非编码RNA虽不参与编码蛋白质, 但可调控转录或转录后基因表达, 在多种生理病理过程中发挥重要作用, 其包括长链非编码RNA(lncRNA)、微小RNA(miRNA)等, 是近年来研究热点, 与恶性肿瘤发生、发展也密切相关, 主要通过调控不同靶基因在增殖、凋亡、侵袭及转移等中扮演原癌基因与抑癌基因角色.
本研究观察组结肠癌患者血清LncRNA HOTAIR、miR-302b-3p表达, 并分析其与循环肿瘤细胞的关系及对预后预测的价值, 旨在为临床工作提供更多可能性.
选取2019-05/2023-05临海市中医院行根治性切除术治疗的结肠癌患者160例作为观察组, 另选取同期本院体检中心160例体检健康志愿者作为对照组. 比较两组LncRNA HOTAIR、miR-302b-3p表达, 分析LncRNA HOTAIR、miR-302b-3p表达与病理特征的关系, 记录结肠癌患者术后复发转移情况, 并评价LncRNA HOTAIR、miR-302b-3p表达对结肠癌术后复发转移的预测价值.
血清LncRNA HOTAIR、miR-302b-3p表达预测结肠癌患者术后复发转移风险的曲线下面积(area under the curve, AUC)分别为0.747(0.672-0.813)、0.785(0.713-0.846), 最佳截断值分别为3.14、0.48, 二者联合预测术后复发转移风险的AUC为0.880(0.919-0.926), 此时敏感度与特异度分别为85.71%、75.38%, 预测效能优于各指标单独预测.
结肠癌患者血清LncRNA HOTAIR表达上调, miR-302b-3p表达下调, 与临床分期、淋巴结转移、循环肿瘤细胞阳性有关, 检测二者水平, 有助于预测其预后.
本研究观察组结肠癌患者血清LncRNA HOTAIR、miR-302b-3p表达, 并分析其与循环肿瘤细胞的关系及对预后预测的价值, 旨在为临床工作提供更多可能性.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B, B
C级 (良好): C
D级 (一般): 0
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Siegel RL, Wagle NS, Cercek A, Smith RA, Jemal A. Colorectal cancer statistics, 2023. CA Cancer J Clin. 2023;73:233-254. [PubMed] [DOI] |
| 2. | Zheng RS, Chen R, Han BF, Wang SM, Li L, Sun KX, Zeng HM, Wei WW, He J. [Cancer incidence and mortality in China, 2022]. Zhonghua Zhong Liu Za Zhi. 2024;46:221-231. [PubMed] [DOI] |
| 3. | Li M, Hu J, Suo L, Wu H, Li Z, Xu X, Zhang S. Efficacy of laparoscopic radical resection of right-sided colon cancer by different surgical approaches: network-meta-analysis. BMC Surg. 2024;24:347. [PubMed] [DOI] |
| 5. | Wang Y, Huang X, Chen S, Jiang H, Rao H, Lu L, Wen F, Pei J. In Silico Identification and Validation of Cuproptosis-Related LncRNA Signature as a Novel Prognostic Model and Immune Function Analysis in Colon Adenocarcinoma. Curr Oncol. 2022;29:6573-6593. [PubMed] [DOI] |
| 6. | Han L, Chen S, Luan Z, Fan M, Wang Y, Sun G, Dai G. Immune function of colon cancer associated miRNA and target genes. Front Immunol. 2023;14:1203070. [PubMed] [DOI] |
| 7. | Hu D, Zhang B, Yu M, Shi W, Zhang L. Identification of prognostic biomarkers and drug target prediction for colon cancer according to a competitive endogenous RNA network. Mol Med Rep. 2020;22:620-632. [PubMed] [DOI] |
| 8. | Amicone L, Marchetti A, Cicchini C. The lncRNA HOTAIR: a pleiotropic regulator of epithelial cell plasticity. J Exp Clin Cancer Res. 2023;42:147. [PubMed] [DOI] |
| 9. | 刘 景云, 杨 斌, 熊 丽, 周 静, 王 倩, 张 月. 上皮性卵巢癌患者血清miR-302b-3p、lncRNA SNHG16水平变化及其临床意义. 山东医药. 2022;62:9-13. [DOI] |
| 10. | Niu H, Dong S, Li G, Wu S, Sun W. Metformin promotes the normalization of abnormal blood vessels after radiofrequency ablation deficiency in hepatocellular carcinoma by microRNA-302b-3p targeting thioredoxin-interacting protein. Acta Biochim Pol. 2023;70:1005-1014. [PubMed] [DOI] |
| 11. | Wang D, Jiang X, Liu Y, Cao G, Zhang X, Kuang Y. Circular RNA circ_HN1 facilitates gastric cancer progression through modulation of the miR-302b-3p/ROCK2 axis. Mol Cell Biochem. 2021;476:199-212. [PubMed] [DOI] |
| 13. | 路 帅, 崔 庆, 赵 强, 周 成富, 刘 承奎, 薛 令凯, 毛 鸿屯. 胃癌患者循环肿瘤细胞检测的临床意义. 中国现代普通外科进展. 2023;26:304-306, 309. [DOI] |
| 17. | Lun W, Luo C. Second primary colorectal cancer in adults: a SEER analysis of incidence and outcomes. BMC Gastroenterol. 2023;23:253. [PubMed] [DOI] |
| 18. | Luo Y, Huang S, Wei J, Zhou H, Wang W, Yang J, Deng Q, Wang H, Fu Z. Long noncoding RNA LINC01606 protects colon cancer cells from ferroptotic cell death and promotes stemness by SCD1-Wnt/β-catenin-TFE3 feedback loop signalling. Clin Transl Med. 2022;12:e752. [PubMed] [DOI] |
| 20. | 刘 蜜, 李 宗清. 血清lncRNA HULC、lncRNA HOTAIR水平与前列腺癌肿瘤血管生成及根治术后短期预后的关联性探讨. 国际泌尿系统杂志. 2024;44:431-436. [DOI] |
| 21. | 杨 歆, 黎 伯胜, 胡 长江, 邓 西尹, 游 扬, 常 杏, 杨 仕明, 凌 贤龙. 血清中lncRNA HOTAIR检测方法的建立及其在结肠癌诊断中的应用价值. 第三军医大学学报. 2016;38:1148-1153. [DOI] |
| 23. | Chao P, Yongheng F, Jin Z, Yu Z, Shiyong Y, Kunxing Y, Yong M. lncRNA HOTAIR knockdown suppresses gastric cancer cell biological activities. Food Sci Nutr. 2021;9:123-134. [PubMed] [DOI] |
| 24. | 伍 远浩, 黄 平, 李 来春. 平均血小板体积和循环肿瘤细胞对结直肠癌术后复发转移的预测价值. 中国现代普通外科进展. 2023;26:873-877. [DOI] |
| 25. | Moradi S, Braun T, Baharvand H. miR-302b-3p Promotes Self-Renewal Properties in Leukemia Inhibitory Factor-Withdrawn Embryonic Stem Cells. Cell J. 2018;20:61-72. [PubMed] [DOI] |
| 26. | Guo B, Zhao Z, Wang Z, Li Q, Wang X, Wang W, Song T, Huang C. MicroRNA-302b-3p Suppresses Cell Proliferation Through AKT Pathway by Targeting IGF-1R in Human Gastric Cancer. Cell Physiol Biochem. 2017;42:1701-1711. [PubMed] [DOI] |
| 27. | Hu F, Li M, Mo L, Xiao Y, Wang X, Xie B. SOX-17 is involved in invasion and apoptosis of colorectal cancer cells through regulating miR-302b-3p expression. Cell Biol Int. 2021;45:1296-1305. [PubMed] [DOI] |
| 28. | Nazari M, Babakhanzadeh E, Mollazadeh A, Ahmadzade M, Mohammadi Soleimani E, Hajimaqsoudi E. HOTAIR in cancer: diagnostic, prognostic, and therapeutic perspectives. Cancer Cell Int. 2024;24:415. [PubMed] [DOI] |
| 29. | Huang J, He Y, Mcleod HL, Xie Y, Xiao D, Hu H, Chen P, Shen L, Zeng S, Yin X, Ge J, Li L, Tang L, Ma J, Chen Z. miR-302b inhibits tumorigenesis by targeting EphA2 via Wnt/ β-catenin/EMT signaling cascade in gastric cancer. BMC Cancer. 2017;17:886. [PubMed] [DOI] |
| 30. | Wang L, Yao J, Sun H, Sun R, Chang S, Yang Y, Song T, Huang C. miR-302b suppresses cell invasion and metastasis by directly targeting AKT2 in human hepatocellular carcinoma cells. Tumour Biol. 2016;37:847-855. [PubMed] [DOI] |