修回日期: 2025-01-20
接受日期: 2025-02-20
在线出版日期: 2025-02-28
肝硬化的发病率和死亡率逐年上升, 已成为威胁人类健康的重要因素. 肝硬化早期常缺乏明显症状, 随着疾病的发展, 肝移植已成为肝硬化终末期阶段唯一有效的治疗方法. 然而, 由于肝移植手术成本高、并发症多且供体资源有限, 导致肝移植手术的应用范围受限. 目前, 干细胞疗法已发展成为治疗肝硬化的一种替代方法. 干细胞的来源及类型不一, 自体骨髓来源的间充质干细胞(bone marrow mesenchymal stem cells, BMSCs)因其分化潜力大、含量丰富、易于获取和制备等优势已成为参与组织再生的重要细胞之一. 本文通过回顾相关文献, 对BMSCs治疗肝硬化的机制、移植途径、安全性、有效性、细胞来源、优势及其局限性作一综述.
核心提要: 骨髓间充质干细胞能通过直接分化或旁分泌等作用修复肝脏功能, 已成为肝硬化患者极具前景的替代疗法. 本文着重回顾了骨髓间充质干细胞在肝硬化患者中的应用, 以指导临床实践.
引文著录: 阮梦凡, 尹宇航, 邵晓冬, 祁兴顺. 骨髓间充质干细胞移植治疗肝硬化的研究进展. 世界华人消化杂志 2025; 33(2): 106-113
Revised: January 20, 2025
Accepted: February 20, 2025
Published online: February 28, 2025
The incidence and mortality of cirrhosis have been increasing year by year, making it become an important factor threatening human health. Cirrhosis in the early stage often lacks obvious symptoms, and liver transplantation has become the only effective treatment for end-stage cirrhosis. However, due to the high cost of liver transplantation, the high incidence of complications, and limited donor resources, the application of liver transplantation has been limited. Currently, stem cell therapy has been considered an alternative treatment for cirrhosis. The sources and types of stem cells are diverse, and autologous bone marrow mesenchymal stem cells (BMSCs) have become one of the important cell types involved in tissue regeneration due to their great differentiation potential, abundant content, and ease of obtaining and preparation. This review summarizes the mechanisms, transplantation routes, safety, effectiveness, cell origin, advantages, and limitations of BMSCs in the treatment of cirrhosis by reviewing the relevant literature.
- Citation: Ruan MF, Yin YH, Shao XD, Qi XS. Bone marrow mesenchymal stem cell transplantation for treatment of liver cirrhosis: Recent advances. Shijie Huaren Xiaohua Zazhi 2025; 33(2): 106-113
- URL: https://www.wjgnet.com/1009-3079/full/v33/i2/106.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v33.i2.106
肝硬化是最常见的慢性肝病之一, 其病因诸多, 包括病毒性肝炎、脂肪性肝炎和自身免疫性肝炎等[1]. 代偿期肝硬化患者常无明显症状, 而失代偿期肝硬化患者常因进行性加重的门静脉高压、腹水、肝性脑病、全身性炎症和肝衰竭等并发症进而导致生活质量下降, 生存期明显缩短[2]. 目前除肝移植外, 终末期肝病尚缺乏有效的治疗方法[3,4]. 然而, 考虑到肝移植供体的短缺以及术后长期应用免疫抑制剂造成的并发症, 现迫切需要寻找新的治疗方法. 鉴于干细胞具有自我更新速度快及分化潜能突出的独特优势, 其可被用于受损肝组织的再生. 干细胞的来源广泛, 而骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMSCs)是来源于骨髓的一类多能干细胞, 在一众干细胞中它有着突出的优势, 包括分化潜能高、细胞来源充足、体外培育便利、遗传背景稳定、免疫排斥较小、安全性较高和移植成本较低等, 是除肝移植外临床治疗肝硬化的潜在之选. 截至目前, 它们已广泛应用于基础实验和临床研究[5-9]. 近年来, 越来越多的研究也证实, BMSCs在一定的条件下可向肝细胞分化并发挥多重作用, 帮助延缓肝硬化患者的疾病进展, 进而改善肝硬化患者预后[10]. 本文将回顾现有相关文献, 针对BMSCs移植治疗肝硬化的研究进展作一综述.
BMSCs是骨髓腔中骨髓基质细胞的重要组成部分, 其分化潜能好, 能够分化为多种类型的细胞, 如肝细胞、胆管上皮细胞和肝细胞样细胞(hepatocyte-like cells, HLCs)等, 同时还能产生兼具免疫调节和抗炎等多重功能的细胞因子[11-13]. 人体骨髓组织中分布着一定数量的BMSCs, 这种干细胞获取难度低且体外增殖能力强, 具备其他干细胞所不具备的优势, 现已经成为肝硬化患者极具前景的替代疗法[14].
在肝脏受到损害时, BMSCs能够分化为健康肝细胞和HLCs, 从而替代功能受损的肝细胞, 避免因肝细胞增殖和分化不足而影响肝脏功能. 同时, BMSCs能够迅速适应并改善肝脏微环境, 抑制肝纤维化的进程, 缓解氧化应激反应及肝脏炎症. 这为BMSCs在治疗肝硬化中的应用提供了理论依据[15]. 目前BMSCs移植治疗肝硬化潜在机制主要为以下两个方面.
首先, BMSCs移植后在肝脏组织释放的细胞因子, 例如肝细胞生长因子(hepatocyte growth factor, HGF)和转化生长因子β(transforming growth factor-β, TGF-β)的影响下, 可直接分化为HLCs和肝细胞[16]. 并且, Xing等[17]的一项研究证实BMSCs分化生成的HLCs, 有着和肝细胞基本相似的功能, 可存储糖原、分泌尿素、产生白蛋白和摄取脂蛋白. Sakaida等[18]的研究也表明, BMSCs会迁移至受损的肝脏细胞附近, 分化出HLCs, 替代受损的肝细胞, 修复受损的肝脏功能, 避免肝脏纤维化加剧. 同样, Li等[19]在肝硬化大鼠中输注BMSCs并进行标记追踪也证实了采用BMSCs移植治疗肝硬化的效果, 并发现自体BMSCs能在多种细胞因子的作用下直接分化为肝细胞, 同时促进大鼠的肝细胞再生, 修复肝损伤.
其次, BMSCs可以在受损肝脏中表达多种生长因子, 如HGF、表皮生长因子(epidermal growth factor, EGF)和血管内皮细胞生长因子(vascular endothelial growth factor, VEGF)等. 肌成纤维细胞的生成是肝纤维化的基础, HGF可以在促进肝细胞生成的同时抑制肝纤维化的进程, 其可以阻断TGF-β1/Smads信号通路, 抑制肝星状细胞(hepatic stellate cells, HSCs)向肌成纤维细胞转化, 抑制肝纤维化的加剧. 同时, HGF能激活caspase-8和死亡受体-5等的表达, 并在肿瘤坏死因子的作用下, 抑制HSCs分化、加速HSCs凋亡, 延缓肝脏纤维化进程[20]. 并且, Parekkadan等[21]研究发现, 在适宜的环境中同时培养BMSCs和HSCs, BMSCs能分泌抑制纤维化的细胞因子, 加速HSCs的凋亡, 避免因为外基质过度沉积而引发肝脏炎症、促进肝纤维化. EGF是一种重要的细胞信号分子, 主要参与调节细胞的生长、增殖和分化并能够促进细胞的迁移, 这对于组织再生至关重要[22]. 此外, Olsen等[23,24]建立了肝损伤大鼠模型, 以研究EGF对大鼠部分肝切除术后肝脏再生的影响. 他们发现, 内源性EGF在大鼠部分肝切除术后显著促进了肝脏再生. VEGF能刺激内皮细胞的增殖和迁移, 促进新血管及淋巴管的形成, 改善肝脏血供, 从而促进供氧和营养物质的输送, 促进创伤愈合和组织再生; 还可增强血管的通透性, 使得营养物质和免疫细胞更容易通过血管壁进入组织[24,25]. 同时, Taniguchi等[26]在肝部分切除术后的大鼠模型中检测到其门静脉周围的肝细胞中表达了大量VEGF, 并且发现VEGF可通过促进肝窦内皮细胞的增殖来重建肝窦, 从而促进肝细胞的增殖, 有效改善肝功能. 综上所述, BMSCs可以通过直接分化或分泌促再生因子等途径, 促进肝脏再生并抑制肝纤维化的进程.
肝硬化的发病机制是一个复杂的过程, 涉及各种免疫细胞和细胞因子的相互作用, 它们共同作用最终导致肝脏环境稳态的失衡[27]. 一些研究表明[28], 肝硬化免疫微环境的改变与该病的发生和预后密切相关. BMSCs的旁分泌作用能够抑制炎症反应、诱导免疫耐受、调节巨噬细胞极化和促进抗氧化作用, 进而维持肝脏微环境的稳态, 抑制肝损伤进程并为肝脏修复提供有利环境[29]. 目前BMSCs已知的旁分泌作用主要包括以下几点: (1)BMSCs可以通过分泌多种细胞因子抑制炎症反应. BMSCs可以分泌IL-10、HGF和TGF-β等细胞因子, 这些因子能够抑制促炎因子的产生, 抑制T细胞和巨噬细胞的活性, 促进抗炎因子分泌, 从而降低炎症反应水平[30,31]. 同时, Roord等[32]研究也发现, BMSCs可抑制炎症反应, 其原因在于BMSCs能阻断T细胞的分化路径, 加速T细胞凋亡进程, 避免因T细胞过度繁殖加重炎症反应; (2)BMSCs可以诱导调节性T细胞的产生, 这类细胞可以抑制其他免疫细胞的活性, 促进免疫耐受, 并且能够在各种免疫反应后维持长期的免疫耐受状态, 防止发生自体免疫反应[33]. 此外, Kassis等[34]的研究结果也表明, BMSCs能抑制B淋巴、T淋巴细胞分化, 减少NK细胞, 并通过分泌诱导调节性T细胞等因子, 加强细胞间作用规避免疫排斥, 延缓肝脏纤维化; (3)BMSCs还可以提升超氧化物歧化酶活性, 分泌抗氧化酶和因子, 降低氧化应激对肝细胞的损伤, 这在肝硬化的发展中起着重要作用. 氧化应激的减少有助于减轻肝细胞的损伤和凋亡[35,36]. 最后, BMSCs可释放外泌体, 源于BMSCs的外泌体不仅能参与机体血管新生、免疫调节、细胞迁移的进程, 并且可以抑制肿瘤坏死因子-α、白介素-6、γ干扰素等促炎因子分泌, 还能促进IL-10等抗炎因子分泌, 避免肝脏炎症加剧[36-39]. 总之, BMSCs能通过多种机制调节肝脏微环境, 这些机制相互作用并产生级联反应, 从而在治疗肝硬化方面展现出良好的前景. 然而, 具体的机制仍需要在进一步的研究中深入探讨.
当前, BMSCs移植治疗肝硬化的输注途径多样, 主要包括经肝动脉、脾静脉、门静脉、内镜下及外周静脉输注等, 但临床最常用的主要是经肝动脉、外周静脉和门静脉输注.
经肝动脉移植最常用的是数字减影血管下造影技术, 指在造影剂及影像设备的支持下经股动脉穿刺, 将导管开口至肝动脉处, 然后将BMSCs经导管注入到肝脏病变部位. 肝动脉血流丰富, 可直达病灶, 经肝动脉移植的BMSCs定植及成活率高, 有利于将分离纯化后的BMSCs悬液直接输送至病变部位发挥作用. 现已有研究发现经肝动脉行自体BMSCs移植可改善肝功能[40]. 同时, Pai等[41]将BMSCs经肝动脉移植至肝硬化患者肝内, 发现患者肝功能有明显改善. 可能是经肝动脉移植可以使干细胞在受损肝脏局部更好的归巢, 有利于其在肝脏中定植存活并发挥作用. 此外, 当前也有大量的荟萃分析结果证实, 经肝动脉输注BMSCs治疗肝硬化是最佳治疗策略[42]. 但是, 经肝动脉行BMSCs移植可能会发生造影剂过敏及造影剂肾病等并发症, 严重者可发生肾功能衰竭和肝肾综合征[43]. 因此, 还需要进行更多大规模的临床试验以确定经肝动脉输注BMSCs的安全性.
经外周静脉移植难度相对较小, 是指经外周静脉将BMSCs注入体内, 利用体循环将其输送至肝脏发挥作用. 此方法的优点主要包括操作简单、快速便利, 对患者的创伤相对较小, 并且术后不良反应较少. 然而, 也有报道称, 经外周静脉移植BMSCs的肝病患者可能会出现发热及过敏反应, 并且其到达靶器官的靶向归巢能力略低, 疗效尚不明确[44]. 尽管如此, 仍有大量研究结果证实了经外周静脉输注BMSCs治疗肝脏相关疾病的安全性及有效性[45].
门静脉是肝脏的主要供血系统, 占全肝供血的四分之三, 协助机体运送营养物质及多种细胞因子, 有利于移植的BMSCs进入血窦定植分化[46]. 并且, 门静脉内含高浓度的嗜肝细胞因子和局部生长因子, 这有利于移植入机体的BMSCs存活. 王平等[47]将标记后的大鼠骨髓基质细胞经门静脉输注入受体后第4周发现标记的细胞几乎全部散在分布于肝实质内并与肝细胞紧密结合, 而在大鼠肺脏的冰冻切片中未见明显标记细胞, 这表明经门静脉输注BMSCs可起到良好的选择性分布作用. 然而, 失代偿期肝硬化患者常合并门静脉高压, 故经门静脉输注干细胞可能会引起肝硬化患者门脉压进一步升高, 加剧肝损伤[48]. 此外, 一次性注射大量BMSCs易在门静脉形成微血栓[49]. 因此, 为降低栓塞等并发症的发生, 需考虑控制BMSCs的输注数量及输注速度.
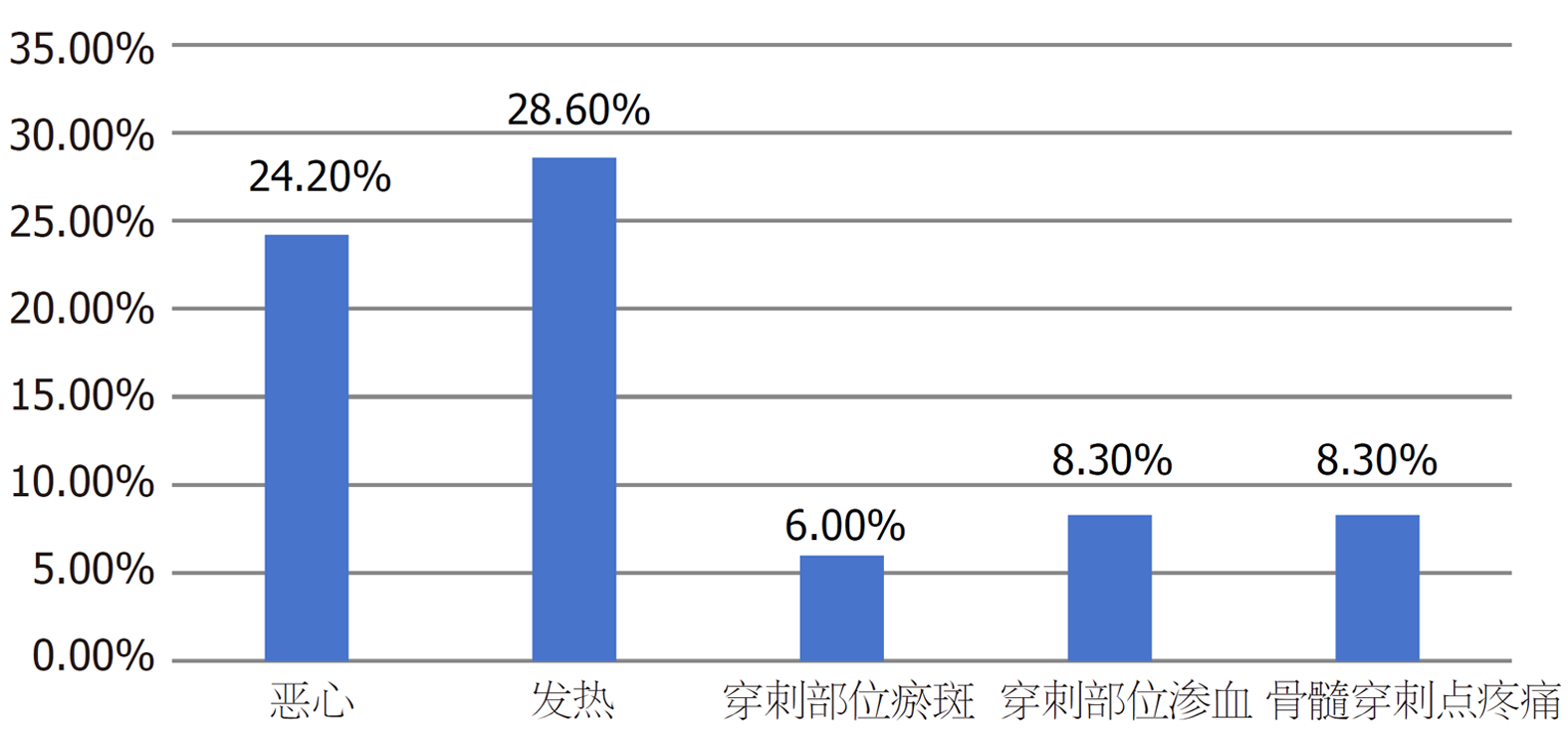
BMSCs移植治疗肝硬化患者的安全性一直是众多学者关注的问题, 其中以致瘤性及移植过程中的病毒传播为甚. 在BMSCs移植用于肝硬化患者治疗的过程中, 常见并发症及其发生率如下: 恶心的发生率为0%-24.2%[44,45,50-58]、发热的发生率为0%-28.6%[44,50,52-57]、穿刺部位瘀斑的发生率为0%-6.0%[44,45,49-51,53,55-57]、穿刺部位渗血的发生率为0%-8.3%[44,45,50-52,54-57,59,60]、骨髓穿刺点疼痛的发生率为0%-8.3%[44,45,50-52,54-57,59,60](见图1). 此外, 有学者也关注肿瘤的发生与风险, 但研究表明在随访期间未发现与BMSCs相关的肿瘤发展的证据[44,45,50-53,55,57,59,61,62], 并且在研究过程中, 血清甲胎蛋白水平没有变化[44]. 同时, 在一项包含700例患者的大型研究中[59], 患者在接受BMSCs治疗后, 长期随访期间未出现新的肿瘤, 这些证据可作为该治疗方法安全性的合理证明.
目前已有许多研究表明BMSCs在治疗各种原因导致的失代偿期肝硬化中均取得了显著效果[63], 其有效性已得到高度认可[64,65]. 大量临床试验结果表明, BMSCs治疗肝硬化可以改善患者预后, 大部分患者其包括ALB、腹水、TBIL、ALT、AST、PTA、INR、MELD评分和Child-Pugh评分等实验室指标及临床症状分别得到显著改善, 经BMSCs治疗后患者的生存率及生活质量也得到了明显的提高, 然而, 也有部分指标未出现明显改善(见表1).
| 第一作者 | 纳入 | 随访时间 | 生存率 | ALB | 腹水 | TBIL | ALT | AST | PTA | INR | MELD评分 | Child-Pugh评分 |
| 自身前后对照研究 | ||||||||||||
| Kharaziha[44] | 20 | 24 wk | 90% | 增加a | 改善 | - | - | - | - | 改善a | 改善a | - |
| Terai[45] | 9 | 24 wk | 100% | 增加a | 改善a | - | - | - | - | - | - | 改善a |
| 王振常[72] | 120 | 24 wk | - | 增加a | - | 减少 | - | - | 改善a | - | - | - |
| 苏毅[73] | 36 | 24 wk | 100% | 增加a | 改善 | 减少a | 减少a | 减少a | 改善a | - | NS | 改善 |
| Wang[56] | 10 | 12 mo | 100% | - | - | - | 减少a | 减少a | - | - | - | - |
| 吴锋[52] | 17 | 12 wk | 100% | 增加a | 改善 | - | 减少a | 减少a | 改善a | - | - | - |
| 郭晓钟[74] | 78 | 4 wk | 100% | 增加a | 改善 | 减少a | 减少a | 减少a | - | - | - | 改善 |
| 何金秋[75] | 39 | 8 wk | 100% | 增加a | 改善 | 减少a | 减少a | 减少 | 改善a | 改善a | 改善a | 改善a |
| 空白对照研究 | ||||||||||||
| Suk[61] | 55(37) | 12 mo | 100% | NS | - | NS | 减少a | NS | - | NS | - | 改善a |
| Xu[76] | 39(20) | 24 wk | 100% | 增加a | - | 减少a | 减少 | - | - | - | 改善a | - |
| 郑盛[54] | 84(36) | 48 wk | 83.30% | 增加a | 改善a | 减少a | 减少a | - | - | - | 改善a | - |
| 王方[50] | 38(18) | 8 wk | 100% | 增加a | 改善a | 减少 | 减少 | - | 改善a | 改善 | - | - |
| 魏开鹏[77] | 60(34) | 24 wk | N.S | 增加a | - | 减少a | NS | - | - | - | 改善a | - |
| 蒋锐[60] | 25(12) | 24 wk | 100% | 增加a | 改善a | 减少a | 减少a | 减少a | - | - | - | - |
| 欧阳石[53] | 67(33) | 24 wk | 100% | 增加a | 改善a | 减少a | 减少a | - | 改善a | - | 改善a | 改善a |
| 彭蕾[78] | 90(50) | 24 wk | 100% | 增加a | 改善 | 减少a | 减少a | 减少a | 改善a | - | - | 改善a |
| 荟萃分析 | ||||||||||||
| 张小燕[79] | 8 | 6 mo | - | 增加 | - | - | 减少a | 减少a | - | 改善a | 改善a | - |
| Pan[80] | 5 | 48 wk | - | 增加 | - | 减少 | 减少 | - | - | - | 改善 | - |
BMSCs主要有自体与异体两大来源.
自体BMSCs优势显著: (1)自体干细胞移植能够避免免疫排斥反应, 减少了免疫抑制药物的需求及其相关副作用, 更加安全[66,67]; (2)自体干细胞不需要依赖于供体细胞, 不涉及伦理争议; (3)自体干细胞与患者的免疫系统兼容性较好, 存活率通常较高, 从而提高治疗效果[68]. 然而, 自体干细胞采集过程具有侵入性, 可能导致患者不适或并发症, 如感染、出血等. 另外, 患者的年龄、骨髓健康状态等因素可能影响自体干细胞的数量和质量, 部分患者可能无法获取足够的干细胞.
与自体干细胞相比, 异体BMSCs的来源相对丰富, 通过供体库和干细胞库可以迅速获取大量高质量的干细胞, 适用于更多患者, 尤其是在自体干细胞获取受限的情况下(如老年患者或骨髓功能衰竭的患者). 此外, 异体干细胞具有较强的免疫调节功能, 从而促进肝脏修复和再生[69]. 异体BMSCs在修复受损组织方面可能具备更强的增殖潜力和修复能力, 尤其是在老年患者中可能更为有效[70]. 然而, 异体干细胞移植可能引发免疫排斥反应, 因此可能需要患者使用免疫抑制药物来降低排斥反应的风险. 这可能带来长期的免疫抑制副作用[71]. 此外, 使用异体干细胞的使用可能会引发伦理问题, 尤其是在捐献者和接受者之间的配对、干细胞来源等方面. 其次, 使用异体干细胞可能会增加由供体细胞传播的感染风险, 特别是在未严格筛查的供体中. 同时, 异体干细胞的获取、存储和分配需要较为复杂的过程, 这可能增加治疗的成本.
综上, 自体和异体BMSCs各有其独特的优势. 自体干细胞治疗的免疫排斥反应的风险较小, 适用于骨髓功能良好的患者, 但其来源有限, 且采集过程具有侵入性. 异体干细胞则具有较广泛的适用性和免疫调节作用, 适用于更多患者, 但存在免疫排斥、伦理争议和感染风险等问题. 因此, 选择自体还是异体干细胞治疗肝硬化, 应根据患者的年龄、骨髓功能、免疫状态以及治疗的可行性等具体情况来决定.
BMSCs能通过直接分化或旁分泌作用修复肝脏功能, 且从自身提取出的BMSCs存活率高、安全性好、分化潜能高, 无论在体内或体外, BMSCs均具有分化归巢能力和旁分泌效应, 同时具有费用较为低廉及无免疫排异反应等优点. BMSCs移植是肝硬化极具前景的替代疗法. 因此, 未来需要更多大规模的研究来探索BMSCs的确切疗效及安全性, 以便能常规应用于临床来以延长患者的生存周期, 提升患者生存质量.
虽然BMSCs移植治疗肝硬化有着多重优势, 但目前还存在一定的局限性: (1)BMSCs相关研究均样本量较小, 且长时间随访数据不足; (2)BMSCs移植的途径、移植频次、最佳的移植剂量及最佳治疗窗口尚未完全确定; (3)移植的BMSCs治疗肝病的具体机制还未完全清楚, 如移植术后的定位跟踪及在体内的分化、在体内的存活生效时间及是否可能癌变等; (4)BMSCs纯度相对较低, 且患者年龄越大, BMSCs含量越低, 分离难度越大, 尤其是伴有肝炎病毒感染的患者, 其骨髓增生、骨髓造血及细胞分化能力显著下降, 以至于无法分离出能达到移植治疗需求的BMSCs, 虽然体外培养可克服这一缺点, 但安全性尚待证明; 最后, 肝衰竭患者的肝细胞大面积坏死, 即便采取BMSCs移植治疗方案, 也无法繁殖出足以修复肝脏功能的细胞. 未来尚需更多的研究来对以上问题进行探讨.
学科分类: 胃肠病学和肝病学
手稿来源地: 辽宁省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): 0
D级 (一般): D, D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Ginès P, Krag A, Abraldes JG, Solà E, Fabrellas N, Kamath PS. Liver cirrhosis. Lancet. 2021;398:1359-1376. [PubMed] [DOI] |
| 2. | Lu F, Thévenot T, Mancuso A, Li Y, Liu L, Qi X. Editorial: Treatment and prognostic assessment of liver cirrhosis and its complications. Front Med (Lausanne). 2023;10:1359036. [PubMed] [DOI] |
| 3. | Qi X, Arora A, Tang S, Mancuso A, Romeiro FG. Prognostic Assessment and Management of Liver Cirrhosis. Biomed Res Int. 2017;2017:5326898. [PubMed] [DOI] |
| 4. | Sugawara Y, Hibi T. Recent trends and new developments in liver transplantation. Biosci Trends. 2024;18:206-211. [PubMed] [DOI] |
| 5. | Wang J, Cen P, Chen J, Fan L, Li J, Cao H, Li L. Role of mesenchymal stem cells, their derived factors, and extracellular vesicles in liver failure. Stem Cell Res Ther. 2017;8:137. [PubMed] [DOI] |
| 6. | Qingqing M, Xin Z, Meizhong S. Bone marrow mesenchymal stem cells altered the immunoregulatory activities of hepatic natural killer cells. Clin Res Hepatol Gastroenterol. 2014;38:689-698. [PubMed] [DOI] |
| 7. | Dominici M, Le Blanc K, Mueller I, Slaper-Cortenbach I, Marini F, Krause D, Deans R, Keating A, Prockop Dj, Horwitz E. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy. 2006;8:315-317. [PubMed] [DOI] |
| 8. | Qi X, Guo X, Su C. Clinical outcomes of the transplantation of stem cells from various human tissue sources in the management of liver cirrhosis: a systematic review and meta-analysis. Curr Stem Cell Res Ther. 2015;10:166-180. [PubMed] [DOI] |
| 9. | Wang J, Li Q, Li W, Méndez-Sánchez N, Liu X, Qi X. Stem Cell Therapy for Liver Diseases: Current Perspectives. Front Biosci (Landmark Ed). 2023;28:359. [PubMed] [DOI] |
| 10. | Shi M, Li YY, Xu RN, Meng FP, Yu SJ, Fu JL, Hu JH, Li JX, Wang LF, Jin L, Wang FS. Mesenchymal stem cell therapy in decompensated liver cirrhosis: a long-term follow-up analysis of the randomized controlled clinical trial. Hepatol Int. 2021;15:1431-1441. [PubMed] [DOI] |
| 11. | Tuan RS, Boland G, Tuli R. Adult mesenchymal stem cells and cell-based tissue engineering. Arthritis Res Ther. 2003;5:32-45. [PubMed] [DOI] |
| 12. | Liu ZJ, Zhuge Y, Velazquez OC. Trafficking and differentiation of mesenchymal stem cells. J Cell Biochem. 2009;106:984-991. [PubMed] [DOI] |
| 13. | Prockop DJ. Marrow stromal cells as stem cells for nonhemato-poietic tissues. Science. 1997;276:71-74. [PubMed] [DOI] |
| 14. | Kholodenko IV, Kurbatov LK, Kholodenko RV, Manukyan GV, Yarygin KN. Mesenchymal Stem Cells in the Adult Human Liver: Hype or Hope? Cells. 2019;8:1127. [PubMed] [DOI] |
| 15. | Li TZ, Kim JH, Cho HH, Lee HS, Kim KS, Lee SW, Suh H. Therapeutic potential of bone-marrow-derived mesenchymal stem cells differentiated with growth-factor-free coculture method in liver-injured rats. Tissue Eng Part A. 2010;16:2649-2659. [PubMed] [DOI] |
| 16. | Watanabe Y, Tsuchiya A, Seino S, Kawata Y, Kojima Y, Ikarashi S, Starkey Lewis PJ, Lu WY, Kikuta J, Kawai H, Yamagiwa S, Forbes SJ, Ishii M, Terai S. Mesenchymal Stem Cells and Induced Bone Marrow-Derived Macrophages Synergistically Improve Liver Fibrosis in Mice. Stem Cells Transl Med. 2019;8:271-284. [PubMed] [DOI] |
| 17. | Xing XK, Feng HG, Yuan ZQ. Differentiation of bone mesenchymal stem cells into hepatocyte-like cells induced by liver tissue homogenate. Genet Mol Res. 2016;15. [PubMed] [DOI] |
| 18. | Sakaida I, Terai S, Nishina H, Okita K. Development of cell therapy using autologous bone marrow cells for liver cirrhosis. Med Mol Morphol. 2005;38:197-202. [PubMed] [DOI] |
| 19. | Li T, Zhu J, Ma K, Liu N, Feng K, Li X, Wang S, Bie P. Autologous bone marrow-derived mesenchymal stem cell transplantation promotes liver regeneration after portal vein embolization in cirrhotic rats. J Surg Res. 2013;184:1161-1173. [PubMed] [DOI] |
| 20. | 张 君红, 姜 海行, 孟 云超, 宁 琳, 杨 文, 沈 妍华, 韦 柳萍. 大鼠骨髓间充质干细胞旁分泌HGF上调肝星状细胞DR5及caspase-8的表达. 基础医学与临床. 2012;32:804-808. [DOI] |
| 21. | Parekkadan B, van Poll D, Megeed Z, Kobayashi N, Tilles AW, Berthiaume F, Yarmush ML. Immunomodulation of activated hepatic stellate cells by mesenchymal stem cells. Biochem Biophys Res Commun. 2007;363:247-252. [PubMed] [DOI] |
| 22. | Marti U, Burwen SJ, Jones AL. Biological effects of epidermal growth factor, with emphasis on the gastrointestinal tract and liver: an update. Hepatology. 1989;9:126-138. [PubMed] [DOI] |
| 23. | Skov Olsen P, Boesby S, Kirkegaard P, Therkelsen K, Almdal T, Poulsen SS, Nexø E. Influence of epidermal growth factor on liver regeneration after partial hepatectomy in rats. Hepatology. 1988;8:992-996. [PubMed] [DOI] |
| 24. | Wang H, Zhao T, Xu F, Li Y, Wu M, Zhu D, Cong X, Liu Y. How important is differentiation in the therapeutic effect of mesenchymal stromal cells in liver disease? Cytotherapy. 2014;16:309-318. [PubMed] [DOI] |
| 25. | Wei S, Li Z, Shi Q, Luan X, Yuan X, Li Y, Guo C, Wu X, Shi C, Di G. Collagenbinding vascular endothelial growth factor (CBDVEGF) promotes liver regeneration in murine partial hepatectomy. Mol Med Rep. 2022;26:26. [PubMed] [DOI] |
| 26. | Taniguchi E, Sakisaka S, Matsuo K, Tanikawa K, Sata M. Expression and role of vascular endothelial growth factor in liver regeneration after partial hepatectomy in rats. J Histochem Cytochem. 2001;49:121-130. [PubMed] [DOI] |
| 27. | Friedman SL. Mechanisms of hepatic fibrogenesis. Gastroenterology. 2008;134:1655-1669. [PubMed] [DOI] |
| 28. | Yi Q, Yang J, Wu Y, Wang Y, Cao Q, Wen W. Immune microenvironment changes of liver cirrhosis: emerging role of mesenchymal stromal cells. Front Immunol. 2023;14:1204524. [PubMed] [DOI] |
| 29. | Vainshtein JM, Kabarriti R, Mehta KJ, Roy-Chowdhury J, Guha C. Bone marrow-derived stromal cell therapy in cirrhosis: clinical evidence, cellular mechanisms, and implications for the treatment of hepatocellular carcinoma. Int J Radiat Oncol Biol Phys. 2014;89:786-803. [PubMed] [DOI] |
| 30. | Huang B, Cheng X, Wang H, Huang W, la Ga Hu Z, Wang D, Zhang K, Zhang H, Xue Z, Da Y, Zhang N, Hu Y, Yao Z, Qiao L, Gao F, Zhang R. Mesenchymal stem cells and their secreted molecules predominantly ameliorate fulminant hepatic failure and chronic liver fibrosis in mice respectively. J Transl Med. 2016;14:45. [PubMed] [DOI] |
| 31. | Wang L, Zhao Y, Shi S. Interplay between mesenchymal stem cells and lymphocytes: implications for immunotherapy and tissue regeneration. J Dent Res. 2012;91:1003-1010. [PubMed] [DOI] |
| 32. | Roord ST, de Jager W, Boon L, Wulffraat N, Martens A, Prakken B, van Wijk F. Autologous bone marrow transplantation in autoimmune arthritis restores immune homeostasis through CD4+CD25+Foxp3+ regulatory T cells. Blood. 2008;111:5233-5241. [PubMed] [DOI] |
| 33. | Wang Y, Fang J, Liu B, Shao C, Shi Y. Reciprocal regulation of mesenchymal stem cells and immune responses. Cell Stem Cell. 2022;29:1515-1530. [PubMed] [DOI] |
| 34. | Kassis I, Vaknin-Dembinsky A, Karussis D. Bone marrow mesenchymal stem cells: agents of immunomodulation and neuroprotection. Curr Stem Cell Res Ther. 2011;6:63-68. [PubMed] [DOI] |
| 35. | Cho KA, Woo SY, Seoh JY, Han HS, Ryu KH. Mesenchymal stem cells restore CCl4-induced liver injury by an antioxidative process. Cell Biol Int. 2012;36:1267-1274. [PubMed] [DOI] |
| 36. | Koosha F, Alimohammadi N, Rafeian-Kopaei M. The Exosomes: Staring Biomarkers and Novel Therapeutic Strategies. Curr Pharm Des. 2021;27:3714-3721. [PubMed] [DOI] |
| 37. | Roefs MT, Sluijter JPG, Vader P. Extracellular Vesicle-Associated Proteins in Tissue Repair. Trends Cell Biol. 2020;30:990-1013. [PubMed] [DOI] |
| 38. | Rong X, Liu J, Yao X, Jiang T, Wang Y, Xie F. Human bone marrow mesenchymal stem cells-derived exosomes alleviate liver fibrosis through the Wnt/β-catenin pathway. Stem Cell Res Ther. 2019;10:98. [PubMed] [DOI] |
| 39. | Wu HH, Lee OK. Exosomes from mesenchymal stem cells induce the conversion of hepatocytes into progenitor oval cells. Stem Cell Res Ther. 2017;8:117. [PubMed] [DOI] |
| 40. | Zhou GP, Jiang YZ, Sun LY, Zhu ZJ. Therapeutic effect and safety of stem cell therapy for chronic liver disease: a systematic review and meta-analysis of randomized controlled trials. Stem Cell Res Ther. 2020;11:419. [PubMed] [DOI] |
| 41. | Pai M, Zacharoulis D, Milicevic MN, Helmy S, Jiao LR, Levicar N, Tait P, Scott M, Marley SB, Jestice K, Glibetic M, Bansi D, Khan SA, Kyriakou D, Rountas C, Thillainayagam A, Nicholls JP, Jensen S, Apperley JF, Gordon MY, Habib NA. Autologous infusion of expanded mobilized adult bone marrow-derived CD34+ cells into patients with alcoholic liver cirrhosis. Am J Gastroenterol. 2008;103:1952-1958. [PubMed] [DOI] |
| 42. | Zhu CH, Zhang DH, Zhu CW, Xu J, Guo CL, Wu XG, Cao QL, Di GH. Adult stem cell transplantation combined with conventional therapy for the treatment of end-stage liver disease: a systematic review and meta-analysis. Stem Cell Res Ther. 2021;12:558. [PubMed] [DOI] |
| 43. | Mohamadnejad M, Namiri M, Bagheri M, Hashemi SM, Ghanaati H, Zare Mehrjardi N, Kazemi Ashtiani S, Malekzadeh R, Baharvand H. Phase 1 human trial of autologous bone marrow-hematopoietic stem cell transplantation in patients with decompensated cirrhosis. World J Gastroenterol. 2007;13:3359-3363. [PubMed] [DOI] |
| 44. | Kharaziha P, Hellström PM, Noorinayer B, Farzaneh F, Aghajani K, Jafari F, Telkabadi M, Atashi A, Honardoost M, Zali MR, Soleimani M. Improvement of liver function in liver cirrhosis patients after autologous mesenchymal stem cell injection: a phase I-II clinical trial. Eur J Gastroenterol Hepatol. 2009;21:1199-1205. [PubMed] [DOI] |
| 45. | Terai S, Ishikawa T, Omori K, Aoyama K, Marumoto Y, Urata Y, Yokoyama Y, Uchida K, Yamasaki T, Fujii Y, Okita K, Sakaida I. Improved liver function in patients with liver cirrhosis after autologous bone marrow cell infusion therapy. Stem Cells. 2006;24:2292-2298. [PubMed] [DOI] |
| 46. | Fan TX, Hisha H, Jin TN, Yu CZ, Lian ZX, Guo SB, Cui YZ, Feng B, Yang GX, Li Q, Ikehara S. Successful allogeneic bone marrow transplantation (BMT) by injection of bone marrow cells via portal vein: stromal cells as BMT-facilitating cells. Stem Cells. 2001;19:144-150. [PubMed] [DOI] |
| 47. | 王 平, 王 建华, 颜 志平, 胡 美玉, 王 艳红, 李 文涛, 林 根来. 大鼠骨髓基质细胞分离培养和经门静脉途径移植的初步研究. 中华放射学杂志. 2004;2:17-20. [DOI] |
| 50. | 王 方, 张 静, 周 新人, 云 升浩, 王 可敬, 寇 俊峰, 蔡 国芳, 孙 厚坦. 经门静脉自体骨髓干细胞移植治疗失代偿期肝硬化18例疗效观察. 实用肝脏病杂志. 2011;14:200-201+206. [DOI] |
| 51. | 曾 芝雨, 李 东良, 方 坚, 阮 梅, 夏 磊, 张 志强, 张 世安. 脐带间充质干细胞联合骨髓干细胞移植治疗失代偿期肝硬化: 1年随访对照. 中国组织工程研究. 2015;19:1533-1538. [DOI] |
| 52. | 吴 锋, 蒲 春文, 张 勇. 自体骨髓间充质干细胞移植治疗失代偿期肝硬化的临床疗效观察. 中国肝脏病杂志(电子版). 2015;7:130-134. [DOI] |
| 53. | 欧阳 石, 刘 树人, 程 涛, 陈 阳述, 孔 祥平, 周 赤龙, 穆 良静. 自体骨髓间充质干细胞肝动脉移植治疗失代偿期肝硬化. 中国组织工程研究. 2013;17:6455-6461. [DOI] |
| 55. | 王 迪, 郭 晓钟, 刘 峰, 赵 佳军, 邵 晓冬, 李 宏宇, 崔 忠敏. 经肝动脉自体骨髓干细胞移植治疗失代偿期肝硬化40例. 现代消化及介入诊疗. 2008;13:258-261. [DOI] |
| 56. | Wang L, Han Q, Chen H, Wang K, Shan GL, Kong F, Yang YJ, Li YZ, Zhang X, Dong F, Wang Q, Xu D, Hu ZJ, Wang SH, Keating A, Bi YL, Zhang FC, Zhao RC. Allogeneic bone marrow mesenchymal stem cell transplantation in patients with UDCA-resistant primary biliary cirrhosis. Stem Cells Dev. 2014;23:2482-2489. [PubMed] [DOI] |
| 57. | Mohamadnejad M, Alimoghaddam K, Bagheri M, Ashrafi M, Abdollahzadeh L, Akhlaghpoor S, Bashtar M, Ghavamzadeh A, Malekzadeh R. Randomized placebo-controlled trial of mesenchymal stem cell transplantation in decompensated cirrhosis. Liver Int. 2013;33:1490-1496. [PubMed] [DOI] |
| 58. | Mohamadnejad M, Alimoghaddam K, Mohyeddin-Bonab M, Bagheri M, Bashtar M, Ghanaati H, Baharvand H, Ghavamzadeh A, Malekzadeh R. Phase 1 trial of autologous bone marrow mesenchymal stem cell transplantation in patients with decompensated liver cirrhosis. Arch Iran Med. 2007;10:459-466. [PubMed] |
| 59. | Casiraghi F, Remuzzi G, Abbate M, Perico N. Multipotent mesenchymal stromal cell therapy and risk of malignancies. Stem Cell Rev Rep. 2013;9:65-79. [PubMed] [DOI] |
| 61. | Suk KT, Yoon JH, Kim MY, Kim CW, Kim JK, Park H, Hwang SG, Kim DJ, Lee BS, Lee SH, Kim HS, Jang JY, Lee CH, Kim BS, Jang YO, Cho MY, Jung ES, Kim YM, Bae SH, Baik SK. Transplantation with autologous bone marrow-derived mesenchymal stem cells for alcoholic cirrhosis: Phase 2 trial. Hepatology. 2016;64:2185-2197. [PubMed] [DOI] |
| 63. | Bihari C, Anand L, Rooge S, Kumar D, Saxena P, Shubham S, Sukriti, Trehanpati N, Kumar G, Pamecha V, Sharma S, Rastogi A, Kumar A, Sarin SK. Bone marrow stem cells and their niche components are adversely affected in advanced cirrhosis of the liver. Hepatology. 2016;64:1273-1288. [PubMed] [DOI] |
| 64. | Forbes SJ, Gupta S, Dhawan A. Cell therapy for liver disease: From liver transplantation to cell factory. J Hepatol. 2015;62:S157-S169. [PubMed] [DOI] |
| 65. | Ryu KH, Kim SY, Kim YR, Woo SY, Sung SH, Kim HS, Jung SC, Jo I, Park JW. Tonsil-derived mesenchymal stem cells alleviate concanavalin A-induced acute liver injury. Exp Cell Res. 2014;326:143-154. [PubMed] [DOI] |
| 66. | Wang H, Yao W, Wang Y, Dong H, Dong T, Zhou W, Cui L, Zhao L, Zhang Y, Shi L, Jiang Y. Meta-analysis on last ten years of clinical injection of bone marrow-derived and umbilical cord MSC to reverse cirrhosis or rescue patients with acute-on-chronic liver failure. Stem Cell Res Ther. 2023;14:267. [PubMed] [DOI] |
| 67. | Sukowati CHC, Tiribelli C. Adult Stem Cell Therapy as Regenerative Medicine for End-Stage Liver Disease. Adv Exp Med Biol. 2022;1401:57-72. [PubMed] [DOI] |
| 68. | Schacher FC, Martins Pezzi da Silva A, Silla LMDR, Álvares-da-Silva MR. Bone Marrow Mesenchymal Stem Cells in Acute-on-Chronic Liver Failure Grades 2 and 3: A Phase I-II Randomized Clinical Trial. Can J Gastroenterol Hepatol. 2021;2021:3662776. [PubMed] [DOI] |
| 69. | Zaripova LN, Midgley A, Christmas SE, Beresford MW, Pain C, Baildam EM, Oldershaw RA. Mesenchymal Stem Cells in the Pathogenesis and Therapy of Autoimmune and Autoinflammatory Diseases. Int J Mol Sci. 2023;24:16040. [PubMed] [DOI] |
| 70. | Wang LT, Liu KJ, Sytwu HK, Yen ML, Yen BL. Advances in mesenchymal stem cell therapy for immune and inflammatory diseases: Use of cell-free products and human pluripotent stem cell-derived mesenchymal stem cells. Stem Cells Transl Med. 2021;10:1288-1303. [PubMed] [DOI] |
| 71. | Abdel Fattah AA, Abdul-Hamid M, Almanaa TN, Alhaber LA, Abdel-Kawi SH, Abdel Rahman FES, Ahmed OM. Ameliorative effects of allogeneic and xenogenic bone marrow-derived mesechymal stem cells on carbon tetrachloride-induced rat liver injury and cirrhosis via modulation of oxidative stress, apoptosis, inflammation, and Nrf2 expression. Am J Transl Res. 2023;15:6381-6403. [PubMed] |
| 72. | 王 振常, 黄 贵华, 黄 晶晶, 吕 建林, 藩 哲. 纯化自体骨髓干细胞经肝动脉移植治疗失代偿期肝硬化的疗效及安全性分析. 胃肠病学和肝病学杂志. 2014;23:497-500. [DOI] |
| 75. | 何 金秋, 潘 兴南, 王 崇国, 杨 文龙, 熊 墨龙, 涂 鸣汉, 熊 志群, 杨 玲玲. 自体骨髓间充质干细胞移植治疗终末期肝病39例. 中国组织工程研究与临床康复. 2010;14:8521-8525. [DOI] |
| 76. | Xu L, Gong Y, Wang B, Shi K, Hou Y, Wang L, Lin Z, Han Y, Lu L, Chen D, Lin X, Zeng Q, Feng W, Chen Y. Randomized trial of autologous bone marrow mesenchymal stem cells transplantation for hepatitis B virus cirrhosis: regulation of Treg/Th17 cells. J Gastroenterol Hepatol. 2014;29:1620-1628. [PubMed] [DOI] |
| 77. | 魏 开鹏, 潘 兴南. 人骨髓间充质干细胞治疗失代偿性肝硬化患者的3年随访研究. 第7届全国疑难及重症肝病大会. 2013. |
| 78. | 彭 蕾, 汤 磊, 叶 珺, 郜 玉峰, 邹 桂舟. 自体骨髓间充质干细胞移植治疗失代偿期肝硬化的疗效. 中国肝脏病杂志(电子版). 2017;9:83-86. [DOI] |
| 80. | Pan XN, Zheng LQ, Lai XH. Bone marrow-derived mesenchymal stem cell therapy for decompensated liver cirrhosis: a meta-analysis. World J Gastroenterol. 2014;20:14051-14057. [PubMed] [DOI] |