修回日期: 2024-09-08
接受日期: 2024-09-19
在线出版日期: 2024-09-28
Polo样激酶1(polo-like kinase 1, PLK1)是一种调节细胞周期的蛋白激酶, 研究发现PLK1能介导调控与肝细胞癌(hepatocellular carcainoma, HCC)发生发展相关的信号通路, 从而影响肝肿瘤细胞的增殖、迁移和侵袭等生物学行为. 因此, PLK1可能是治疗HCC的一个非常有潜力的靶点, 该文就PLK1在HCC发生中的相关信号通路与PLK1抑制剂在治疗HCC方面进行综述.
核心提要: Polo样激酶1(polo-like kinase 1, PLK1)可通过介导有关信号通路参与肝细胞癌(hepatocellular carcinoma, HCC)的增殖、迁移、侵袭和上皮间质转化等生物学过程. PLK1作为HCC的一个有价值的治疗靶点, 目前有10余种PLK1抑制剂已经进入临床试验. 该文就PLK1在HCC发生中的相关信号通路与PLK1抑制剂在治疗HCC方面进行综述.
引文著录: 梁秋菊, 龙勤琴, 田丰琴, 龙喜带. PLK1在肝细胞癌中的研究进展. 世界华人消化杂志 2024; 32(9): 652-659
Revised: September 8, 2024
Accepted: September 19, 2024
Published online: September 28, 2024
Polo-like kinase 1 (PLK1) is a protein kinase that regulates the cell cycle, and it has been found that PLK1 mediates the regulation of signaling pathways associated with hepatocellular carcinoma (HCC) development, thereby affecting the biological behaviors of hepatic tumor cells such as cell proliferation, migration, and invasion. Therefore, PLK1 may be a very promising target for the treatment of HCC. This article reviews the relevant signaling pathways of PLK1 in HCC development and PLK1 inhibitors in the treatment of HCC.
- Citation: Liang QJ, Long QQ, Tian FQ, Long XD. Progress in research of polo-like kinase 1 in hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2024; 32(9): 652-659
- URL: https://www.wjgnet.com/1009-3079/full/v32/i9/652.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v32.i9.652
肝细胞癌(hepatocellular carcinoma, HCC)是常见的人类恶性肿瘤之一, 占原发性肝癌的90%, GLOBOCAN 2020显示新增肝癌病例数905677例, 死亡人数830180例, 具有预后差, 死亡率高的特点[1]. 早期发现并接受治疗, 五年生存率为70%以上. 但是大多数患者在被诊断时已经是晚期, 肝移植或者手术切除后五年生存率约为12.5%[2]. HCC由于发病机制极其复杂, 临床治疗手段有限, 因此筛选有效治疗HCC的靶点至关重要. Polo样激酶1(polo-like kinase 1, PLK1)是一种高度保守的丝氨酸/苏氨酸蛋白激酶, 主要在细胞周期中发挥作用, 通过介导有关信号通路参与HCC的增殖、迁移、侵袭和上皮间质转化等生物学过程. PLK1作为HCC的一个有价值的治疗靶点, 目前有10余种PLK1抑制剂已经进入临床试验. 该文就PLK1在HCC发生中的相关信号通路与PLK1抑制剂在治疗HCC方面进行综述.
PLK1基因定位于16p12, 分子量约为66KD, 是Polo样激酶(PLKs)家族中的成员之一, PLKs家族目前已被鉴定出有五个亚型, 其中PLK1的研究是最为广泛的. PLK1结构高度保守, 它是由N端一个激酶结构域(kinase domain, KD)和C端的两个调节底物结合polo-box结构域(polo-box domain, PBD)组成, KD和PBD相互作用, 通过抑制Thr210磷酸化来抑制PLK1的激酶活性, 一旦PBD与配体结合后, KD和PBD之间的抑制作用解除, PLK1被激活[3]. 这两个结构域都可作为PLK1抑制剂的靶点, 它们共同控制PLK1在有丝分裂过程中的作用. PLK1在有丝分裂期表现出最大的激酶活性, 通过磷酸化Cdc25C、WEE1和MYT1来激活CyclinB1/CDK1复合物, 使细胞进入有丝分裂期[4,5]. 同时也在中心体成熟、纺锤体组装、染色体分离和胞质分裂中发挥关键作用[6]. 另外, PLK1参与许多信号通路, 它可通过不同的信号通路来影响肝癌细胞的生物学过程, 从而促进或者抑制HCC的发生发展. PLK1作为一个有潜力的抗肿瘤药物靶点, 尽管目前已开发出多种PLK1抑制剂, 甚至PLK1抑制剂与其他化疗药物联合使用相对于单药治疗来说效果更佳, 但PLK1在HCC中的确切作用机制尚未阐明, 还需进一步深入研究.
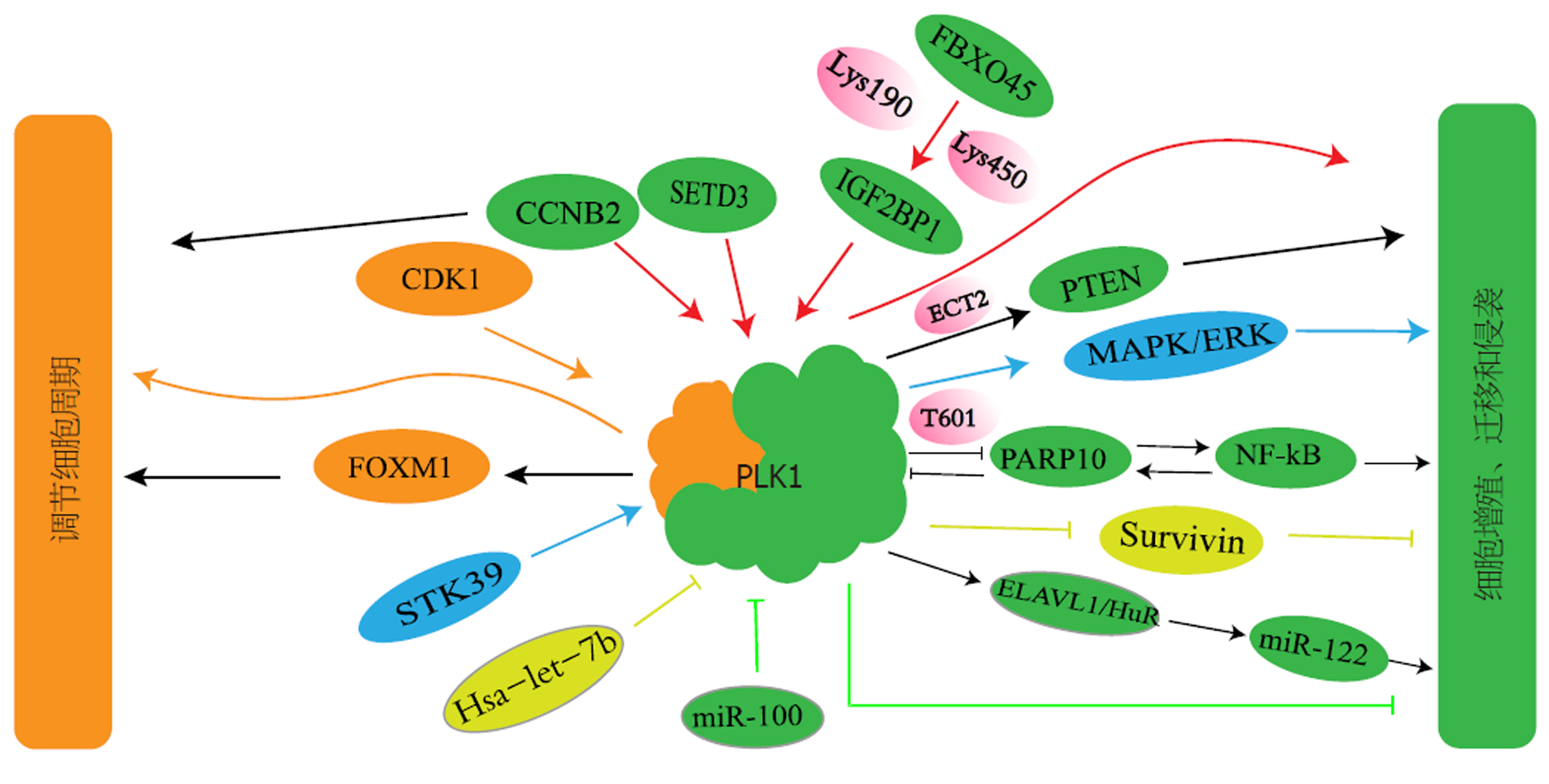
PLK1主要调节细胞周期, 除此之外它还在细胞信号传导中发挥作用, 控制多个关键转录因子并促进细胞增殖、迁移和侵袭[7](见图1).
Fan等[8]通过研究发现HCC中PLK1可通过直接磷酸化来激活FOXM1的转录活性, 促进细胞有丝分裂. 体外实验发现, 敲低PLK1后, 细胞增殖受到抑制, 大部分细胞被阻滞在S和G2/M期. 值得注意的是, FOXM1被敲低后表现出与之相似的现象, 这说明PLK1和FOXM1都是肝癌细胞增殖所必需的, 通过协同表达可促进肝肿瘤生成. Li等[9]通过GO和KEGG分析发现, PLK1和CDK1都在调控细胞周期方面发挥重要作用. PLK1可由CDK1介导调控. CDK1下调抑制PLK1的表达使细胞明显阻滞在G2/M期. CDK1/PLK1轴通过介导细胞分裂异常导致细胞周期发生混乱, 促使肝细胞癌变. 此外, 还有研究报道表明CCNB2/PLK1通路参与HCC细胞周期调控, 并促进细胞增殖和迁移. 但CCNB2/PLK1通路在HCC中的发生机制还有待进一步研究[10].
PLK1被一些信号分子激活上调后可促进肝癌细胞的生物学行为发生, 本课题组发现黄曲霉毒素B1(aflatoxin B1, AFB1)能增加PLK1表达, 并促进HCC细胞增殖、迁移和侵袭, AFB1具体何种机制诱导上调PLK1目前我们的实验正在探索中, 以期更深入了解PLK1与HCC发生发展的关系. Xu等[11]研究发现PLK1/PTEN信号通路被 ECT2激活后, 肝癌细胞的增殖和迁移能力增强. Cheng等[12]研究证实在HCC中PLK1启动子可与SETD3结合从而激活PLK1的转录活性, SETD3表达上调通过增强PLK1的表达来加速HCC进展. SETD3高表达促进肝癌细胞的增殖、迁移和侵袭, 沉默PLK1后上述表型被逆转. 因此, SETD3-PLK1轴可能是HCC发生的关键信号通路之一. 通过联合抑制PLK1和SETD3的表达可能是治疗HCC的一种新选择. Lin等[13]研究发现在HCC中PLK1上调可通过FBXO45激活IGF2BP1来实现. FBXO45是一种E3泛素连接酶, 在肝癌组织中表达升高. 它可以与IGF2BP1特异性结合, 在Lys190和Lys450位点激活IGF2BP1泛素化, 随后IGF2BP1可以显著增强PLK1的表达, 从而肝癌细胞增殖, 诱导HCC的发生. FBXO45-IGF2BP1-PLK1轴与HCC进展呈正相关, 因此通过靶向FBXO45-IGF2BP1-PLK1信号通路可能是治疗HCC的新策略.
此外, 研究表明PLK1通过影响其他因子从而促进肝癌发展, Zhang等[14]研究发现PLK1可被STK39介导其磷酸化, 它们相互作用, 可激活MAPK/ERK信号通路, 从而促进肝癌进展. STK39/PLK1/ERK信号轴可能是治疗HCC的潜在通路. Tian等[15]研究发现HCC中PLK1与PARP10的表达呈负相关. PARP10是一种肿瘤抑制因子, 可抑制肝癌细胞增殖. PLK1通过在T601位点处磷酸化PARP10 抑制其表达, 从而增强NF-κB的转录活性, 诱导肝肿瘤发生. 有趣的是, 靶向NF-κB后可激活PARP10启动子活性使其表达上调, 进而PLK1被PARP10单ADP核糖基化和MAR酰化抑制其激酶活性, 肝肿瘤生长和转移受到抑制. 这表明三者间存在负反馈回路. PLK1/PARP10/NF-κB轴在HCC中相互调控, 进一步深入了解PLK1/PARP10/NF-κB通路如何相互作用可能是HCC的潜在有效治疗途径.
另一些研究表明, microRNA参与PLK1对肝癌的调控作用. Chen等[16]发现在肝癌中PLK1与miR-100表达呈负相关, miR-100是一个抑癌基因, 在HCC中低表达. 它直接靶向PLK1可以抑制肝癌细胞的生长和迁移. He等[17]研究发现 Hsa-let-7b通过靶向PLK1使其介导的Survivin下调, 从而实现体内外抑制肝癌细胞增殖, 细胞凋亡增多. Seo等[18]研究发现PLK1上调后通过调控ELAVL1/HuR-miR-122轴来促进HCV的增殖, 进而诱导HCC的发生. 而PLK1抑制剂Rigosertib可以直接靶向PLK1-ELAVL1/HuR-miR-122轴抑制HCV增殖, 因此深入了解PLK1-ELAVL1/HuR-miR-122信号通路有利于更好的治疗HCV相关HCC.
PLK1小分子抑制剂主要分为两种类型, 一种是以激酶结构域(KD)为靶点的腺苷三磷酸(adenosine-triphosphate, ATP)竞争性抑制剂, 另一种是以PBD结构域为靶点的非ATP竞争性抑制剂.
PLK1-KD为靶点代表的抑制剂主要有BI2536和Volasertib(BI6727), BI2536是第一代PLK1抑制剂, 一种以二氢蝶啶酮衍生的ATP竞争性抑制剂. 大量的临床试验研究表明其临床疗效有限且有着明显的不良反应, 不适用于单药治疗. 值得注意的是, 有研究证实它与其它化疗药物联合使用时可以显示更好的疗效[4,19]. Volasertib(BI6727)是一种基于BI2536改良的ATP竞争性抑制剂, 目前已进入Ⅲ期临床研究, 具有更好的安全性和药代动力学特征. El-Khobar等[20]通过研究发现PLK1 可以通过介导β-肌动蛋白重塑来促进HCV-HCC的发生发展, 从而促进肝癌细胞的迁移、侵袭和转移, 但早期用PLK1抑制剂Volasertib(BI6727)来处理HCV感染过的细胞后发现这些细胞运动能力显著降低. 这说明早期通过靶向PLK1可以减少肝肿瘤细胞的侵犯和转移. 相比之下, Deng等[21]研究表明PLK1抑制剂化合物31表现出更好的抗肿瘤能力, 它抑制某些肝癌细胞生长的能力显著于Volasertib. 化合物31通过直接抑制PLK1激酶活性来诱导G2/M期细胞阻滞从而促进细胞凋亡, 在体内外都能抑制肿瘤生长, 是作为治疗以PLK1-KD为靶点的HCC的一种良好药物.
尽管ATP竞争类药物显示出一定的治疗效果, 但ATP竞争性抑制剂具有选择性较差、毒副反应大和耐药性等缺点, 而探索开发以PBD为位点的非ATP竞争性抑制剂则可以比较好的解决这些问题[22], 非ATP竞争性PLK1抑制剂通过靶向PBD的磷酸肽结合位点促进相应的磷酸肽基序之间相互作用[23]. Poloxin是最早研发出的靶向PLK1-PBD非ATP竞争性抑制剂, 但目前在用于治疗HCC方面报道较少. PLK1抑制剂Rigosertib(RGS, ON01910)是另一种非ATP竞争性抑制剂, 属于苯乙烯苄砜类化合物[24]. Dietrich等[25]研究提示Rigosertib可以作为一种RAS模拟器, 通过阻断HCC中RAS-RAF-ERK的信号转导来抑制PLK1的表达, 从而诱导细胞阻滞在G2/M期, 细胞增殖能力下降. 进一步研究表明, Rigosertib与索拉非尼或瑞戈非尼联合使用治疗HCC, 抗肿瘤效果可能会更好.
对于单药治疗来说, PLK1抑制剂与其他化疗药物联合使用治疗HCC已成为另一种主流. Li等[26]发现PLK1抑制剂BI2536和化疗药物ADM联合使用可显著抑制体内外肝癌细胞的生长. PLK1抑制剂BI2536通过下调PLK1来降低HCC中ADM的IC50, 使多药耐药性(multidrugresistance, MDR)肝癌细胞重新对ADM敏感, 这表明PLK1 抑制剂BI2536和化疗药物协同作用可以减弱肝癌细胞的耐药性, 对于治疗MDR HCC患者来说是一种新策略. Zhou等[27]发现PLK1抑制剂Volasertib通过下调Cdc25C表达使肝癌细胞阻滞在G2/M期, 肝癌细胞增殖受到抑制, 而当PLK1抑制剂Volasertib与EGFR抑制剂吉非替尼联合使用时, 吉非替尼可以显著增强PLK1抑制剂Volasertib抑制肝癌细胞生长的能力. 此外, 最新研究报道[28]PLK1抑制剂Volasertib可与薯蓣皂苷元(DG)联合使用通过降低PLK1和PCNA的表达, 上调P53和活性胱天蛋白酶-3水平来增强抗HCC的肿瘤活性.
在HCC中, 通过RNA干扰阻断PLK1表达, 可抑制肝癌细胞生长. TKM-080301是一种以siRNA靶向PLK1为机制的脂质纳米颗粒(LNP)制剂, 旨在转录后通过RNA干扰来实现基因抑制. El Dika等[29]研究发现HCC患者通过静脉注射TKM-080301药物后, 表现出良好的耐受性和安全性, 但是单药治疗并没有表现出良好的临床抗肿瘤活性, 不足以支持进行进一步评估. Wang等[30]研究发现PLK1 siRNA通过GCP纳米颗粒递送到肝癌细胞后, 通过介导P53/P21信号通路从而将细胞阻滞在G2/M期, 诱导抗凋亡蛋白Bcl-2表达来促进细胞凋亡, 同时PLK-siRNA-GCP纳米颗粒还可以阻碍体内肿瘤的生长. 进一步研究表明, PLK1-siRNA纳米颗粒抑制细胞增殖的能力比PLK1抑制剂BI2536强. 因此, PLK-siRNA-GCP纳米颗粒将会是治疗HCC一个有前途的方向, 上述两项研究结果不同之处主要在于递送PLK1-siRNA进入HCC细胞的治疗载体, 说明载体可能是影响PLK1-siRNA治疗HCC的重要因素, 因此未来应该寻求更优质的载体材料.
通过其他机制抑制PLK1表达延缓HCC进展. Song等[31]研究结果证实在HCC中新型草药HO-1089和HO-1197(源自HO-1089的新型草药配方)可以抑制PLK1的表达, 体外实验发现HO-1089可通过诱导ROS的产生从而促使DNA损伤, 抑制细胞有丝分裂并促进细胞凋亡, 同时还会以剂量依赖性方式来减弱肝癌细胞的迁移能力. 体内实验发现口服HO-1089后, 肿瘤生长减慢. 而HO-1197是基于HO-1089草药上的新配方, 在治疗HCC方面可能会发生更有效的作用.
Xu等[32]发现在HCC中PLK1可被达沙替尼和伊立替康/SN38联合抑制表达从而增强抗肿瘤效果. 该研究证明了达沙替尼可以通过阻断PLK1蛋白合成来抑制PLK1, 而不是通过阻断激酶活性或者抑制其基因水平表达. 而单独使用伊立替康时由于剂量依赖性的特点对于抑制HCC中PLK1的表达不是很明显, 它与达沙替尼联合使用时, 既可以解决伊立替康剂量依赖性细胞毒性的问题又可以增强它们在体内体外抑制肝癌细胞增殖的能力. 值得注意的是, 达沙替尼抑制PLK1表达的方式与现有的PLK1抑制剂不同, 如Volasertib和Rigosertib这两个PLK1小分子抑制剂针都是针对PLK1激酶活性而不是减少其用量, 这一特点在一定程度上限制了现有PLK1抑制剂的应用范围, 因为并非所有的PLK1高表达的肿瘤都会必然表现出激酶活性, 在此情况下, 达沙替尼能够抑制PLK1蛋白合成的发现, 为针对PLK1提供了一种新方法, 尤其对HCC可能具有更好的普适性(见表1).
| 抑制剂名称 | 所属种类 | 作用机制 | 作用效果 |
| BI2536 | 小分子抑制剂 | 抑制激酶活性 | 不适用于单药治疗, 与化疗药物ADM联合使用抑制HCC效果较好 |
| Volasertib (BI6727) | 小分子抑制剂 | 抑制激酶活性 | 单药治疗时体内外能抑制肝肿瘤生长, 与吉非替尼联合使用抗肿瘤活性更好 |
| 化合物31 | 小分子抑制剂 | 抑制激酶活性 | 诱导G2/M期细胞阻滞从而促进HCC细胞凋亡 |
| Poloxin | 小分子抑制剂 | 抑制PLK1-PBD结构域 | 在治疗HCC方面报道较少 |
| Rigosertib | 小分子抑制剂 | 抑制激酶活性 | 阻断HCC中RAS-RAF-ERK的信号转导来抑制PLK1的表达, 与索拉非尼或瑞戈非尼联合使用抗肿瘤活性更好 |
| TKM-080301 | RNAi抑制剂 | RNA干扰阻断PLK1表达 | 抑制肝癌细胞生长, 单药治疗没有表现出良好的临床抗肿瘤活性 |
| PLK-siRNA-GCP纳米颗粒 | RNAi抑制剂 | RNA干扰阻断PLK1表达 | 介导P53/P21信号通路从而将细胞阻滞在G2/M期, 诱导抗凋亡蛋白Bcl-2表达来促进细胞凋亡, 体内实验能抑制肝肿瘤生长 |
| HO-1089 HO-1197 | 药物抑制剂 | 诱导DNA损伤 | 体内实验发现口服HO-1089后, HCC肿瘤生长减慢 |
| 达沙替尼 | 药物抑制剂 | 抑制PLK1蛋白合成 | 与伊立替康联合使用后, 体内体外抑制肝癌细胞增殖的能力增强 |
目前为止, 至少有10余种PLK1抑制剂已经进入临床试验中, 其中包括BI 2536、Volasertib(BI6727)、GSK461364、TAK-960、Rigosertib(ON-01910.Na)和Onvansertib、CFI-400945、HMN-214和CYC140是小分子抑制剂, TKM-080301是RNA干扰(RNAi)药物. 二氢蝶啶酮BI 2536是一种强效、高选择性小分子PLK1抑制剂, 一项I期研究通过对21名晚期实体瘤患者在每21天疗程的第1-3天接受一次BI 2536(50毫克-70毫克)60分钟静脉输注后, 从而评估其安全性、药代动力学特征和抗肿瘤活性[33]. 该项研究在晚期实体瘤(肝癌、黑色素瘤、结直肠癌和卵巢癌)患者身上未观察到客观反应或显著的肿瘤消退, 且伴有中性粒细胞减少症、恶心、疲劳、厌食和血液方面等不良反应. BI2536的Ⅱ期研究中, 在21名复发性小细胞肺癌(small cell lung cancer, SCLC)患者中并未观察到任何反应, BI 2536对敏感复发性SCLC的治疗无效, 缺乏抗肿瘤活性, 未达到将试验扩展至第二阶段的标准, BI 2536作为单药治疗的临床试验已经终止[34].
Volasertib相较于BI 2536具有分布容积大、组织深层渗透性好、终末半衰期长的优点[35]. 临床试验主要在急性髓性白血病(acute myeloid leukemia, AML), 尿路上皮癌和非小细胞肺癌中进行, 而HCC并不在临床试验范围内. Volasertib Ⅰ期研究在AML患者的临床试验中报告了良好的安全性和患者耐受性, 单药治疗确定了最大耐受剂量为每两到三周400-450毫克. 最常见的副作用是中性粒细胞减少和血小板减少. 然而作为单药治疗的II期研究仅展示适度的临床抗肿瘤活性[36].
GSK461364是一种ATP竞争性PLK1抑制剂, I期临床试验中以递增剂量通过两种方案给药于实体恶性肿瘤患者(包括肝癌、结直肠癌、食管癌和乳腺癌), 6名(15%)患者表现出的最佳反应是病情长期稳定超过16周, 血液学毒性和静脉栓塞为较为常见的不良反应[37].
TAK-960是ATP竞争性PLK1抑制剂, 一种口服药物, 具有PLK1选择性. 体内实验表明TAK-960在几种肿瘤类型的细胞系异种移植模型中表现出强大的抗肿瘤活性, 具有良好的药物耐受性[38]. 在一项1期临床试验中, TAK-960被证明在单药治疗时对实体瘤无效. 临床试验已被终止[39].
Rigosertib(ON-01910.Na)是一种非环氧合酶抑制剂砜代谢物, 是一种非ATP竞争性激酶抑制剂, 可作为Ras模拟物. 在Ⅰ/Ⅱ期试验中, 在晚期实体瘤患者和血液系统疾病患者中表现出一定抗肿瘤活性, 药物耐受性良好, 最常见的副作用是排尿困难和血尿[40]. Ⅲ期试验主要针对骨髓增生异常综合征. 晚期Ⅱ期和Ⅲ期研究也已与其他化疗药物联合进行试验, 以期为这些患者实现更好的反应[41]. Onvansertib是一种高效、可逆且选择性的PLK1激酶抑制剂, 在一项晚期实体瘤的研究中, Onvansertib表现出良好的抗肿瘤活性, 另外, Onvansertib与低剂量阿糖胞苷(LDAC)或地西他滨联合使用治疗复发或难治性(R/R)AML患者时, 联合用药表现出良好耐受性, 具有抗白血病活性[42]. 一项Ib期试验, Onvansertib联合FOLIFRI/贝伐单抗在KRAS突变转移性结直肠癌患者的二线治疗中表现出良好的疗效. 但患者也会出现贫血和中性粒细胞减少症等剂量限制性不良反应[43].
CFI-400945是一种PLK4抑制剂, 临床前研究发现口服PLK4抑制剂CFI-400945可干扰着丝粒复制从而有效抑制HCC细胞增殖[44]. 一项对晚期实体瘤的Ⅰ期临床研究发现, CFI-400945在64毫克剂量时耐受性良好, 但伴有剂量依赖性中性粒细胞减少症[45].
HMN-214是HMN-176的前药, 是一种口服PLK1抑制剂, 在临床试验中, HMN-214用于治疗晚期实体瘤, 但超过最大耐受剂量会导致严重的肌痛/骨痛综合征和高血糖[46]. CYC140在食管癌和急性白血病等多种肿瘤表现出较高的抗肿瘤活性. 目前正在进行CYC140的Ⅰ期研究, 以探索其在晚期白血病、骨髓增生异常综合征和慢性骨髓单核细胞白血病中的安全性和治疗潜力[46]. TKM-080301是一种siRNA抑制PLK1表达的药物, 在一项Ⅰ/Ⅱ期临床研究中对43名晚期HCC患者每周静脉输注一次TKM-080301, 连续3周, 每28天重复一次, 发现TKM 080301的抗肿瘤作用有限, 因此认为没必要作为单一药物进行一步评估[29].
总而言之, 这10种药物在晚期实体瘤和血液系统疾病方面都表现出一定的安全性和耐受性, 在药物试验期间出现许多不良反应, 包括恶心、呕吐、中性粒细胞减少、贫血等. 目前来说许多药物的研发仍处于早期阶段, 因此PLK1抑制剂在HCC临床疗效上还需要进一步验证.
目前对于HCC的治疗仍是有限的, 尤其是晚期的HCC. 而PLK1在细胞有丝分裂中发挥重要, 它已被认为是治疗HCC一个有前景的靶点, 如抑制剂BI6727作为PLK1抑制剂的作用优于传统的DNA损伤诱导剂, 这表明低副作用的分子靶向药物是治疗HCC的有希望的药物. 因此, 开发用于治疗HCC的PLK1小分子抑制剂具有重大的意义. PLK1由KD和PBD两个结构域组成, 目前在临床研究中评估的几乎所有PLK1抑制剂都是PLK1 KD. 该类抑制剂虽然活性高, 但由于蛋白激酶在ATP结合位点方面具有高度相似性, 使得其选择性低. 其中最大的问题在于特异性低而引发的剂量限制性毒性作用, 因此现在迫切需要研发出具有特异性的抑制剂[47]. PBD作为PLK1所特有的结构, 开发针对PBD结构域的PLK1抑制剂通过干扰PLK1与底物结合和蛋白定位, 可被多肽、拟肽物和小分子有效抑制, 从而发挥更好的抗肿瘤活性, 因此以PBD为靶点的抑制剂更具有特异性和选择性, 但此类抑制剂与PBD结合水平较低, 未来需研发出高结合率高稳定性的PLK1-PBD抑制剂[46,48].
PLK1靶向治疗在初步研究中显示出良好的前景,在基于PLK1抑制剂的靶向治疗时发现与p53缺陷细胞相比, 具有野生型TP53的癌症对联合疗法的抵抗力更强, 在使用BI6727与杆状病毒凋亡重复序列抑制因子5(BIRC5)抑制剂YM155治疗TP53突变HCC时发现在体外和体内均显示出对HCC的抗增殖作用, 该研究为针对p53突变的HCC患者以及其他癌症模型中具有PLK1/BIRC5共表达特征的HCC患者群体使用PLK1和BIRC5治疗开发提供了宝贵的见解[22,49]. 但仍需要进一步研究以确定它们与其他癌症靶向疗法联合使用时的疗效以及在临床研究中的疗效.
此外, 在PLK1高表达的肿瘤中, 与许多其他靶向疗法一样, 小分子PLK1抑制剂似乎普遍存在耐药性问题, 这可能是由于Plk1s在细胞周期中发挥多种相互作用的原因, 也许能通过联合疗法来解决. 目前许多联合治疗已在HCC临床前研究中取得成功, 在临床研究中也显示出联合用药的优越性. 因此未来应重点开展单一疗法和组合疗法的临床研究.
综上所述, PLK1已成为治疗HCC的研究热点之一, 它可通过与FOXM1、CDK1、CCNB2、SETD3、FBXO45、IGF2BP1、STK39、MAPK/ERK、PARP10、NF-κB、miR-100、Hsa-let-7b、Survivin、ELAVL1/HuR、miR-122等相关信号分子相互作用来影响肝癌细胞生长、侵袭和转移等生物学行为, 从而促进或者抑制HCC进展. 此外, PLK1抑制剂如BI2536、BI6727等在治疗HCC方面的临床前研究已经取得重要进展, 同时许多PLK1抑制剂已经进入临床试验, 但令人惋惜的是, 它们在治疗效果方面仍有许多局限性, PLK1抑制剂的临床前成功并没有很好地转化为临床成功, 未来需进一步探索, 继续研发出高效低毒的PLK1抑制剂. 另外, 为了克服单药治疗的局限性, 针对PLK1的其他相关途径的联合疗法可能对于解决单一疗法中观察到的问题(尤其是耐药性)至关重要, 基于PLK1抑制剂的联合治疗策略与化疗和靶向治疗可能优于现有的各种癌症治疗方法, 深入挖掘PLK1抑制剂与其他化疗和靶向药物联合使用的潜力迫在眉睫, 这将是用于治疗HCC一个新的突破口. 此外, 研究还应着眼于了解PLK1的机制, 并设计更多下一代特异性、有效的PLK1抑制剂来针对HCC. 然而, 目前PLK1具体通过何种机制诱导HCC发生尚未了解清楚, 进一步深入研究PLK1与肝肿瘤发生发展之间的联系将对治疗HCC提供新的研究思路.
学科分类: 胃肠病学和肝病学
手稿来源地: 广西壮族自治区
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C, C
D级 (一般): 0
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Sung H, Ferlay J, Siegel RL, Laversanne M, Soerjomataram I, Jemal A, Bray F. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021;71:209-249. [PubMed] [DOI] |
| 2. | Wang W, Wei C. Advances in the early diagnosis of hepatocellular carcinoma. Genes Dis. 2020;7:308-319. [PubMed] [DOI] |
| 4. | Gutteridge RE, Ndiaye MA, Liu X, Ahmad N. Plk1 Inhibitors in Cancer Therapy: From Laboratory to Clinics. Mol Cancer Ther. 2016;15:1427-1435. [PubMed] [DOI] |
| 5. | Schmucker S, Sumara I. Molecular dynamics of PLK1 during mitosis. Mol Cell Oncol. 2014;1:e954507. [PubMed] [DOI] |
| 6. | Kalous J, Aleshkina D. Multiple Roles of PLK1 in Mitosis and Meiosis. Cells. 2023;12. [PubMed] [DOI] |
| 7. | Iliaki S, Beyaert R, Afonina IS. Polo-like kinase 1 (PLK1) signaling in cancer and beyond. Biochem Pharmacol. 2021;193:114747. [PubMed] [DOI] |
| 8. | Fan W, Ma H, Jin B. Expression of FOXM1 and PLK1 predicts prognosis of patients with hepatocellular carcinoma. Oncol Lett. 2022;23:146. [PubMed] [DOI] |
| 9. | Li L, Huang K, Zhao H, Chen B, Ye Q, Yue J. CDK1-PLK1/SGOL2/ANLN pathway mediating abnormal cell division in cell cycle may be a critical process in hepatocellular carcinoma. Cell Cycle. 2020;19:1236-1252. [PubMed] [DOI] |
| 10. | Li R, Jiang X, Zhang Y, Wang S, Chen X, Yu X, Ma J, Huang X. Cyclin B2 Overexpression in Human Hepatocellular Carcinoma is Associated with Poor Prognosis. Arch Med Res. 2019;50:10-17. [PubMed] [DOI] |
| 11. | Xu D, Wang Y, Wu J, Zhang Z, Chen J, Xie M, Tang R, Chen C, Chen L, Lin S, Luo X, Zheng J. ECT2 overexpression promotes the polarization of tumor-associated macrophages in hepatocellular carcinoma via the ECT2/PLK1/PTEN pathway. Cell Death Dis. 2021;12:162. [PubMed] [DOI] |
| 12. | Cheng M, Yang Q, Liu Y, Zhao MJ, Du X, Sun J, Shu WJ, Huang Z, Bi J, Xu X, Du HN. SETD3 Methyltransferase Regulates PLK1 Expression to Promote In Situ Hepatic Carcinogenesis. Front Oncol. 2022;12:882202. [PubMed] [DOI] |
| 13. | Lin XT, Yu HQ, Fang L, Tan Y, Liu ZY, Wu D, Zhang J, Xiong HJ, Xie CM. Elevated FBXO45 promotes liver tumorigenesis through enhancing IGF2BP1 ubiquitination and subsequent PLK1 upregulation. Elife. 2021;10. [PubMed] [DOI] |
| 14. | Zhang C, Wang X, Fang D, Xu P, Mo X, Hu C, Abdelatty A, Wang M, Xu H, Sun Q, Zhou G, She J, Xia J, Hui KM, Xia H. STK39 is a novel kinase contributing to the progression of hepatocellular carcinoma by the PLK1/ERK signaling pathway. Theranostics. 2021;11:2108-2122. [PubMed] [DOI] |
| 15. | Tian L, Yao K, Liu K, Han B, Dong H, Zhao W, Jiang W, Qiu F, Qu L, Wu Z, Zhou B, Zhong M, Zhao J, Qiu X, Zhong L, Guo X, Shi T, Hong X, Lu S. PLK1/NF-κB feedforward circuit antagonizes the mono-ADP-ribosyltransferase activity of PARP10 and facilitates HCC progression. Oncogene. 2020;39:3145-3162. [PubMed] [DOI] |
| 16. | Chen P, Zhao X, Ma L. Downregulation of microRNA-100 correlates with tumor progression and poor prognosis in hepatocellular carcinoma. Mol Cell Biochem. 2013;383:49-58. [PubMed] [DOI] |
| 17. | He Z, Deng W, Jiang B, Liu S, Tang M, Liu Y, Zhang J. Hsa-let-7b inhibits cell proliferation by targeting PLK1 in HCC. Gene. 2018;673:46-55. [PubMed] [DOI] |
| 18. | Seo Y, Kang Y, Ham Y, Kim MH, Kim SJ, Yoon SK, Jang SK, Park JB, Cho S, Kim JH. PLK1-ELAVL1/HuR-miR-122 signaling facilitates hepatitis C virus proliferation. Proc Natl Acad Sci USA. 2022;119:e2214911119. [PubMed] [DOI] |
| 20. | El-Khobar KE, Tay E, Diefenbach E, Gloss BS, George J, Douglas MW. Polo-like kinase-1 mediates hepatitis C virus-induced cell migration, a drug target for liver cancer. Life Sci Alliance. 2023;6. [PubMed] [DOI] |
| 21. | Deng Z, Chen G, Liu S, Li Y, Zhong J, Zhang B, Li L, Huang H, Wang Z, Xu Q, Deng X. Discovery of methyl 3-((2-((1-(dimethylglycyl)-5-methoxyindolin-6-yl)amino)-5-(trifluoro-methyl) pyrimidin-4-yl)amino)thiophene-2-carboxylate as a potent and selective polo-like kinase 1 (PLK1) inhibitor for combating hepatocellular carcinoma. Eur J Med Chem. 2020;206:112697. [PubMed] [DOI] |
| 22. | Su S, Chhabra G, Singh CK, Ndiaye MA, Ahmad N. PLK1 inhibition-based combination therapies for cancer management. Transl Oncol. 2022;16:101332. [PubMed] [DOI] |
| 25. | Dietrich P, Freese K, Mahli A, Thasler WE, Hellerbrand C, Bosserhoff AK. Combined effects of PLK1 and RAS in hepatocellular carcinoma reveal rigosertib as promising novel therapeutic "dual-hit" option. Oncotarget. 2018;9:3605-3618. [PubMed] [DOI] |
| 26. | Li HY, Luo F, Li XY, Fu XF, He JF, Tian YZ, Zhu JJ, Chu XY, Zhao HL. Inhibition of Polo-Like Kinase 1 by BI2536 Reverses the Multidrug Resistance of Human Hepatoma Cells In Vitro and In Vivo. Anticancer Agents Med Chem. 2019;19:740-749. [PubMed] [DOI] |
| 27. | Zhou Q, Chen T. BI6727, a polo-like kinase 1 inhibitor, synergizes with gefitinib to suppress hepatocellular carcinoma cells via a G2/M arrest mechanism. Pharmazie. 2022;77:230-235. [PubMed] [DOI] |
| 28. | Yousef EH, El-Mesery ME, Habeeb MR, Eissa LA. Diosgenin potentiates the anticancer effect of doxorubicin and volasertib via regulating polo-like kinase 1 and triggering apoptosis in hepatocellular carcinoma cells. Naunyn Schmiedebergs Arch Pharmacol. 2024;397:4883-4894. [PubMed] [DOI] |
| 29. | El Dika I, Lim HY, Yong WP, Lin CC, Yoon JH, Modiano M, Freilich B, Choi HJ, Chao TY, Kelley RK, Brown J, Knox J, Ryoo BY, Yau T, Abou-Alfa GK. An Open-Label, Multicenter, Phase I, Dose Escalation Study with Phase II Expansion Cohort to Determine the Safety, Pharmacokinetics, and Preliminary Antitumor Activity of Intravenous TKM-080301 in Subjects with Advanced Hepatocellular Carcinoma. Oncologist. 2019;24:747-e218. [PubMed] [DOI] |
| 30. | Wang D, Chang R, Wang G, Hu B, Qiang Y, Chen Z. Polo-like Kinase 1-targeting Chitosan Nanoparticles Suppress the Progression of Hepatocellular Carcinoma. Anticancer Agents Med Chem. 2017;17:948-954. [PubMed] [DOI] |
| 31. | Song Y, Lee SY, Kim S, Choi I, Kim N, Park J, Seo HR. HO-1089 and HO-1197, Novel Herbal Formulas, Have Antitumor Effects via Suppression of PLK1 (Polo-like Kinase 1) Expression in Hepatocellular Carcinoma. Cancers (Basel). 2023;15. [PubMed] [DOI] |
| 32. | Xu L, Zhu Y, Shao J, Chen M, Yan H, Li G, Zhu Y, Xu Z, Yang B, Luo P, He Q. Dasatinib synergises with irinotecan to suppress hepatocellular carcinoma via inhibiting the protein synthesis of PLK1. Br J Cancer. 2017;116:1027-1036. [PubMed] [DOI] |
| 33. | Frost A, Mross K, Steinbild S, Hedbom S, Unger C, Kaiser R, Trommeshauser D, Munzert G. Phase i study of the Plk1 inhibitor BI 2536 administered intravenously on three consecutive days in advanced solid tumours. Curr Oncol. 2012;19:e28-e35. [PubMed] [DOI] |
| 34. | Awad MM, Chu QS, Gandhi L, Stephenson JJ, Govindan R, Bradford DS, Bonomi PD, Ellison DM, Eaton KD, Fritsch H, Munzert G, Johnson BE, Socinski MA. An open-label, phase II study of the polo-like kinase-1 (Plk-1) inhibitor, BI 2536, in patients with relapsed small cell lung cancer (SCLC). Lung Cancer. 2017;104:126-130. [PubMed] [DOI] |
| 35. | Rudolph D, Steegmaier M, Hoffmann M, Grauert M, Baum A, Quant J, Haslinger C, Garin-Chesa P, Adolf GR. BI 6727, a Polo-like kinase inhibitor with improved pharmacokinetic profile and broad antitumor activity. Clin Cancer Res. 2009;15:3094-3102. [PubMed] [DOI] |
| 36. | Stadler WM, Vaughn DJ, Sonpavde G, Vogelzang NJ, Tagawa ST, Petrylak DP, Rosen P, Lin CC, Mahoney J, Modi S, Lee P, Ernstoff MS, Su WC, Spira A, Pilz K, Vinisko R, Schloss C, Fritsch H, Zhao C, Carducci MA. An open-label, single-arm, phase 2 trial of the Polo-like kinase inhibitor volasertib (BI 6727) in patients with locally advanced or metastatic urothelial cancer. Cancer. 2014;120:976-982. [PubMed] [DOI] |
| 37. | Olmos D, Barker D, Sharma R, Brunetto AT, Yap TA, Taegtmeyer AB, Barriuso J, Medani H, Degenhardt YY, Allred AJ, Smith DA, Murray SC, Lampkin TA, Dar MM, Wilson R, de Bono JS, Blagden SP. Phase I study of GSK461364, a specific and competitive Polo-like kinase 1 inhibitor, in patients with advanced solid malignancies. Clin Cancer Res. 2011;17:3420-3430. [PubMed] [DOI] |
| 38. | Hikichi Y, Honda K, Hikami K, Miyashita H, Kaieda I, Murai S, Uchiyama N, Hasegawa M, Kawamoto T, Sato T, Ichikawa T, Cao S, Nie Z, Zhang L, Yang J, Kuida K, Kupperman E. TAK-960, a novel, orally available, selective inhibitor of polo-like kinase 1, shows broad-spectrum preclinical antitumor activity in multiple dosing regimens. Mol Cancer Ther. 2012;11:700-709. [PubMed] [DOI] |
| 39. | Klauck PJ, Bagby SM, Capasso A, Bradshaw-Pierce EL, Selby HM, Spreafico A, Tentler JJ, Tan AC, Kim J, Arcaroli JJ, Purkey A, Messersmith WA, Kuida K, Eckhardt SG, Pitts TM. Antitumor activity of the polo-like kinase inhibitor, TAK-960, against preclinical models of colorectal cancer. BMC Cancer. 2018;18:136. [PubMed] [DOI] |
| 40. | Navada SC, Fruchtman SM, Odchimar-Reissig R, Demakos EP, Petrone ME, Zbyszewski PS, Holland JF, Silverman LR. A phase 1/2 study of rigosertib in patients with myelodysplastic syndromes (MDS) and MDS progressed to acute myeloid leukemia. Leuk Res. 2018;64:10-16. [PubMed] [DOI] |
| 41. | Monfort-Vengut A, de Cárcer G. Lights and Shadows on the Cancer Multi-Target Inhibitor Rigosertib (ON-01910.Na). Pharmaceutics. 2023;15. [PubMed] [DOI] |
| 42. | Zeidan AM, Ridinger M, Lin TL, Becker PS, Schiller GJ, Patel PA, Spira AI, Tsai ML, Samuëlsz E, Silberman SL, Erlander M, Wang ES. A Phase Ib Study of Onvansertib, a Novel Oral PLK1 Inhibitor, in Combination Therapy for Patients with Relapsed or Refractory Acute Myeloid Leukemia. Clin Cancer Res. 2020;26:6132-6140. [PubMed] [DOI] |
| 43. | Ahn DH, Barzi A, Ridinger M, Samuëlsz E, Subramanian RA, Croucher PJP, Smeal T, Kabbinavar FF, Lenz HJ. Onvansertib in Combination with FOLFIRI and Bevacizumab in Second-Line Treatment of KRAS-Mutant Metastatic Colorectal Cancer: A Phase Ib Clinical Study. Clin Cancer Res. 2024;30:2039-2047. [PubMed] [DOI] |
| 44. | Chan CY, Yuen VW, Chiu DK, Goh CC, Thu KL, Cescon DW, Soria-Bretones I, Law CT, Cheu JW, Lee D, Tse AP, Tan KV, Zhang MS, Wong BP, Wong CM, Khong PL, Ng IO, Bray MR, Mak TW, Yau TC, Wong CC. Polo-like kinase 4 inhibitor CFI-400945 suppresses liver cancer through cell cycle perturbation and eliciting antitumor immunity. Hepatology. 2023;77:729-744. [PubMed] [DOI] |
| 45. | Veitch ZW, Cescon DW, Denny T, Yonemoto LM, Fletcher G, Brokx R, Sampson P, Li SW, Pugh TJ, Bruce J, Bray MR, Slamon DJ, Mak TW, Wainberg ZA, Bedard PL. Safety and tolerability of CFI-400945, a first-in-class, selective PLK4 inhibitor in advanced solid tumours: a phase 1 dose-escalation trial. Br J Cancer. 2019;121:318-324. [PubMed] [DOI] |
| 46. | Zhang J, Zhang L, Wang J, Ouyang L, Wang Y. Polo-like Kinase 1 Inhibitors in Human Cancer Therapy: Development and Therapeutic Potential. J Med Chem. 2022;65:10133-10160. [PubMed] [DOI] |
| 48. | Chiappa M, Petrella S, Damia G, Broggini M, Guffanti F, Ricci F. Present and Future Perspective on PLK1 Inhibition in Cancer Treatment. Front Oncol. 2022;12:903016. [PubMed] [DOI] |
| 49. | Li Y, Zhao ZG, Luo Y, Cui H, Wang HY, Jia YF, Gao YT. Dual targeting of Polo-like kinase 1 and baculoviral inhibitor of apoptosis repeat-containing 5 in TP53-mutated hepatocellular carcinoma. World J Gastroenterol. 2020;26:4786-4801. [PubMed] [DOI] |