修回日期: 2024-06-12
接受日期: 2024-06-26
在线出版日期: 2024-07-28
长链非编码RNA(long non-coding RNA, LncRNA)生长停滞特异性转录本5反义RNA(growth arrest specific transcript 5 antisense RNA, GAS5-AS1)被发现在多种癌症中扮演肿瘤抑制因子的作用. 但是其在结直肠癌(colorectal cancer, CRC)进展中的作用和机制尚不清楚.
探讨LncRNA GAS5-AS1靶向miR-106a-5p在CRC进展中的作用.
实时荧光定量聚合酶链反应分析LncRNA GAS5-AS1和miR-106a-5p在43对CRC组织和癌旁组织样本中的表达. 分别转染pcDNA、pcDNA-LncRNA GAS5-AS1、anti-miR-NC、anti-miR-106a-5p、si-NC、si-LncRNA GAS5-AS1、pcDNA-LncRNA GAS5-AS1+miR-NC、pcDNA-LncRNA GAS5-AS1+miR-106a-5p mimics至HCT8细胞. 细胞计数试剂盒-8法检测细胞活力; Transwell小室法检测迁移和侵袭细胞数. 通过双荧光素酶报告实验确定LncRNA GAS5-AS1和miR-106a-5p的靶向关系.
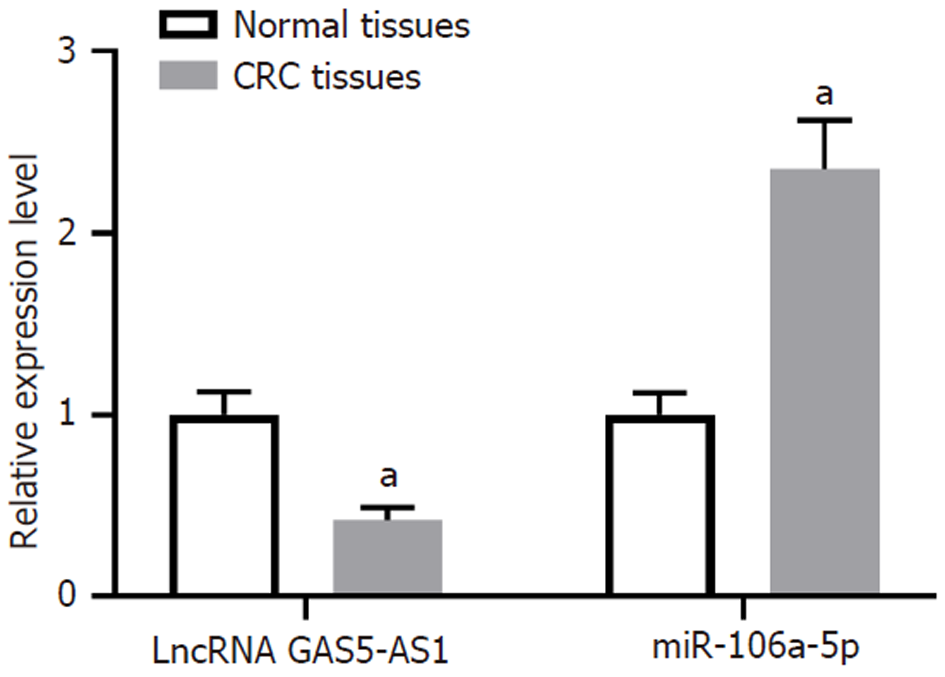
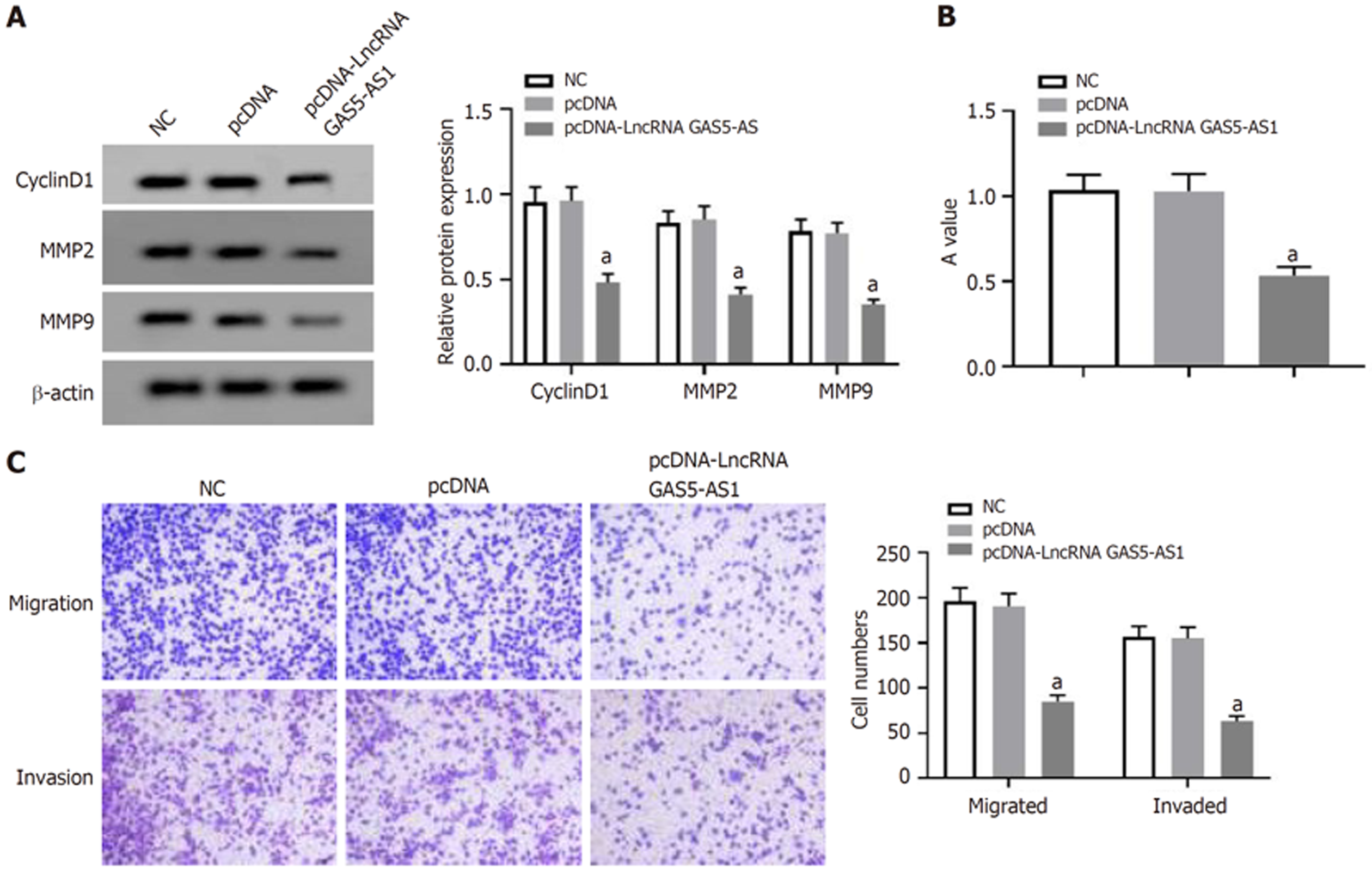
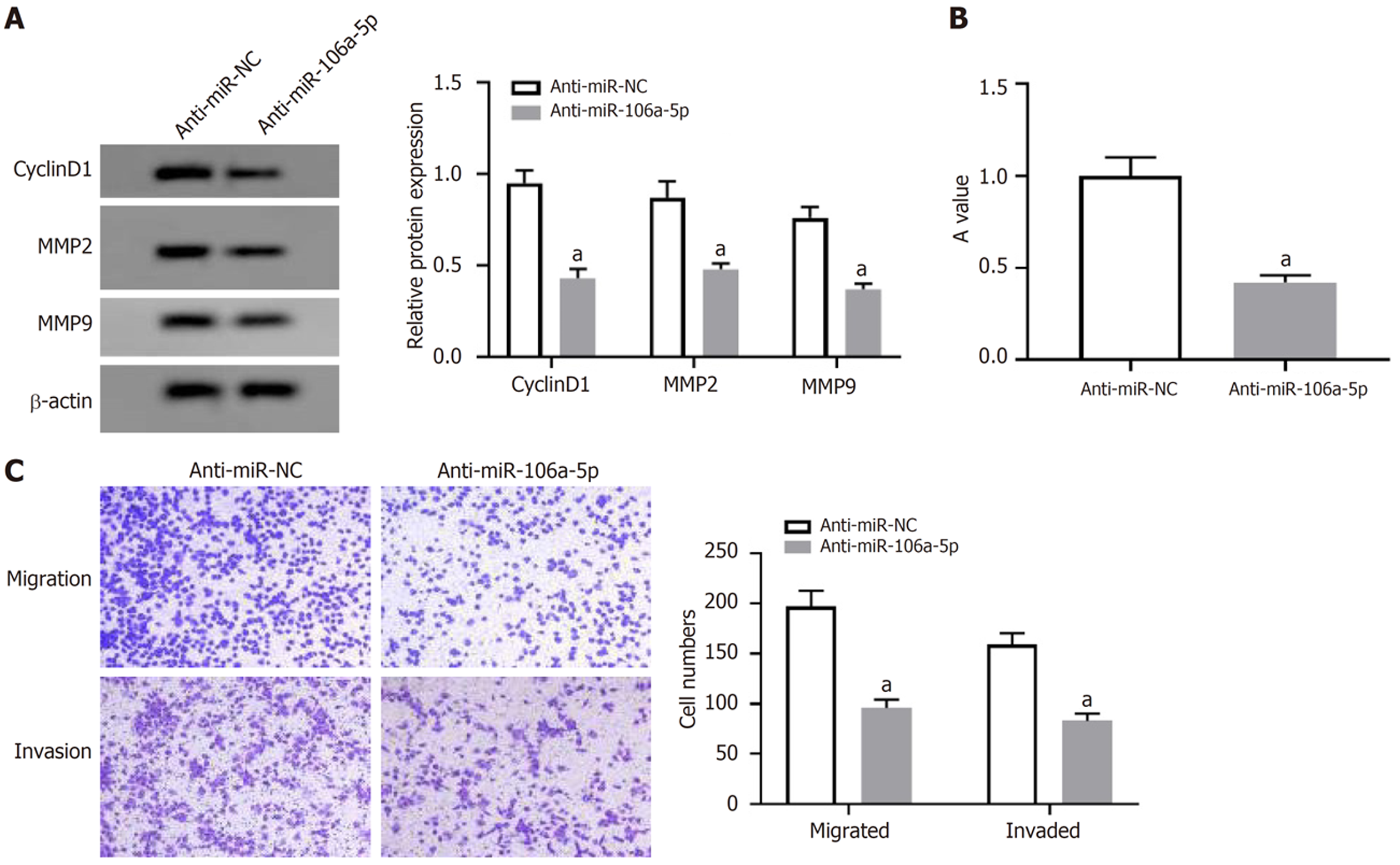
与癌旁组织比较, CRC组织中LncRNA GAS5-AS1表达降低(P<0.05), miR-106a-5p表达升高(P<0.05). 与转染pcDNA比较, 转染pcDNA-LncRNA GAS5-AS1后HCT8细胞活力、迁移、侵袭、miR-106a-5p表达显著降低(P<0.05). 与转染anti-miR-NC比较, 转染anti-miR-106a-5p后HCT8细胞活力、迁移和侵袭细胞数显著降低(P<0.05). 与转染si-NC比较, 转染si-LncRNA GAS5-AS1后miR-106a-5p表达水平显著升高(P<0.05). 与转染miR-NC比较, 转染miR-106a-5p能显著降低LncRNA GAS5-AS1-WT载体的荧光素酶活性, 表明miR-106a-5p是LncRNA GAS5-AS1的直接靶点. 与转染pcDNA-LncRNA GAS5-AS1+miR-NC比较, 转染pcDNA-LncRNA GAS5-AS1+miR-106a-5p mimics后HCT8细胞活力、迁移和侵袭细胞数显著升高(P<0.05).
LncRNA GAS5-AS1通过靶向miR-106a-5p来抑制CRC细胞增殖、迁移和侵袭.
核心提要: 本研究揭示长链非编码RNA生长停滞特异性转录本5反义RNA(growth arrest specific transcript 5 antisense RNA, GAS5-AS1)通过靶向miR-106a-5p来抑制结直肠癌(colorectal cancer, CRC)细胞增殖、迁移和侵袭, 表明GAS5-AS1可能是CRC治疗的潜在分子靶点.
引文著录: 余周, 胡满溢, 戴剑. LncRNA GAS5-AS1靶向miR-106a-5p调控结直肠癌细胞增殖、迁移和侵袭. 世界华人消化杂志 2024; 32(7): 525-533
Revised: June 12, 2024
Accepted: June 26, 2024
Published online: July 28, 2024
The long non-coding RNA (lncRNA) growth arrest specific transcript 5 antisense RNA (GAS5-AS1) has been found to act as a tumor suppressor in a variety of cancers. However, its role and mechanism in colorectal cancer (CRC) progression remain unclear.
To investigate the role of the lncRNA GAS5-AS1 targeting miR-106a-5p in the progression of CRC.
GAS5-AS1 and miR-106a-5p expression levels in 43 pairs of CRC tissues and adjacent tissue samples were determined by real-time quantitative PCR. After pcDNA, pcDNA-GAS5-AS1, anti-miR-NC, anti-miR-106a-5p, si-NC, si-GAS5-AS1, pcDNA-GAS5-AS1 + miR-NC, and pcDNA-GAS5-AS1 + miR-106a-5p mimic were transfected into HCT8 cells, cell counting kit-8 method was used to detect cell viability, and transwell assays were used to detect the number of migrating and invading cells. The target relationship between GAS5-AS1 and miR-106a-5p was determined by dual-luciferase reporter assay.
Compared with adjacent normal tissues, GAS5-AS1 expression in CRC tissue was decreased (P < 0.05), and miR-106a-5p expression was increased (P < 0.05). Compared with cells transfected with pcDNA, cell viability, migration, and invasion and miR-106a-5p expression in HCT8 cells were significantly reduced after transfection of with pcDNA-GAS5-AS1 (P < 0.05). Compared with cells transfected with anti-miR-NC, cell viability, migration, and invasion in HCT8 transfected with anti-miR-106a-5p were significantly reduced (P < 0.05). Compared with cells transfected with si-NC, the expression level of miR-106a-5p was significantly increased in cells transfected with si-GAS5-AS1 (P < 0.05). Compared with cells transfected with miR-NC, transfection of miR-106a-5p significantly reduced the luciferase activity of the GAS5-AS1-WT vector, indicating that miR-106a-5p is the direct target of GAS5-AS1. Compared with cells transfected with pcDNA-GAS5-AS1 + miR-NC, cell viability, migration, and invasion were significantly increased in cells transfected with pcDNA-GAS5-AS1 + miR-106a-5p mimic (P < 0.05).
GAS5-AS1 inhibits CRC cell proliferation, migration, and invasion by targeting miR-106a-5p.
- Citation: Yu Z, Hu MY, Dai J. LncRNA GAS5-AS1 regulates colorectal cancer cell proliferation, migration, and invasion by targeting miR-106a-5p. Shijie Huaren Xiaohua Zazhi 2024; 32(7): 525-533
- URL: https://www.wjgnet.com/1009-3079/full/v32/i7/525.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v32.i7.525
结直肠癌(colorectal cancer, CRC)是全球最常见的癌症之一, 虽然目前已有手术、放化疗等治疗策略, 但多数患者在接受一系列治疗后仍存在较大复发风险[1]. 因此, 进一步了解CRC的分子机制, 识别潜在的生物标志物对开发新型治疗方法至关重要. 长链非编码RNA(long non-coding RNA, LncRNA)是基因表达的主要调节因子, 其通过与微小RNA(microRNA, miRNA)和蛋白编码mRNA相互作用, 影响增殖、转移、血管生成、自噬、凋亡、放化疗抵抗等肿瘤生物学过程, 是肿瘤治疗的候选靶标[2,3]. 研究报道LncRNA生长停滞特异性转录本5反义RNA(growth arrest specific transcript 5 antisense RNA, GAS5-AS1)表达降低与肝癌低分化、TNM分期增高、预后差显著相关[4]. 非小细胞肺癌中LncRNA GAS5-AS1表达下调, LncRNA GAS5-AS1异位表达可抑制肿瘤转移[5]. 然而, LncRNA GAS5-AS1在CRC中的功能未见报道. miR-106a-5p是前列腺癌、肺癌的致癌因子, miR-106a-5p高表达有助于前列腺癌肿瘤形成, 并促进肺癌转移[6,7]. 在CRC中miR-106a-5p介导肿瘤转移和5-氟尿嘧啶耐药[8]. 生物信息学预测显示miR-106a-5p是LncRNA GAS5-AS1的潜在靶点, 但LncRNA GAS5-AS1是否靶向miR-106a-5p调控CRC进展仍需研究. 本研究分析了CRC中LncRNA GAS5-AS1、miR-106a-5p表达情况, 并通过功能获得或缺失实验分析其在CRC进展中功能.
1.1.1 组织: 以2021-03/2023-10在我院接受手术治疗43例(男27例, 女16例, 年龄45岁-76岁, 平均年龄65岁±6.85岁)CRC患者的CRC组织和癌旁组织对研究对象. 纳入标准: 经病理检查诊断为CRC; 术前未进行治疗; 排除标准: 患有其他疾病者; 入院前接受抗肿瘤治疗者. 所有患者均签署书面知情同意书, 本研究经本医院伦理委员会批准.
1.1.2 细胞和试剂: 人正常结直肠上皮细胞NCM460以及CRC细胞(HCT8、Caco-2、DLD-1)购自中国科学院生化与细胞所; QuantiTect逆转录试剂盒、MiScript II逆转录试剂盒购自北京金泰宏达科技公司; SYBR Green荧光定量染料法试剂盒购自美国ABI公司; 野生型(wild-type, WT)LncRNA GAS5-AS1荧光素酶报告质粒(LncRNA GAS5-AS1-WT)、突变型(mutant-type, MUT)LncRNA GAS5-AS1荧光素酶报告质粒(LncRNA GAS5-AS1-MUT)、pcDNA、pcDNA-LncRNA GAS5-AS1购自上海生工公司; si-NC、si-LncRNA GAS5-AS1、anti-miR-NC、anti-miR-106a-5p、miR-106a-5p mimics、miR-NC购自南京金斯瑞生物公司; 细胞周期蛋白D1(CyclinD1)兔多克隆抗体(ab226977)、基质金属蛋白酶2(matrix metalloproteinase 2, MMP2)兔多克隆抗体(ab97779)、β-肌动蛋白(β-actin)兔多克隆抗体(ab8227)、基质金属蛋白酶9(matrix metalloproteinase 9, MMP9)兔多克隆抗体(ab73734)购自美国Abcam公司; 细胞计数试剂盒(cell counting kit-8, CCK-8)购自大连美仑生物公司; TRIzol试剂购自上海联迈生物公司; Transwell小室购自美国BD公司.
1.2.1 细胞培养: NCM460、HCT8、DLD-1细胞采用RPMI-1640培养基培养, Caco-2细胞采用MEM培养基置于37 ℃、80%湿度、含5%CO2温箱孵育. 培养基中均添加10%胎牛血清和1%青-链霉素双抗. 胰酶消化80%融合细胞1:4传代.
1.2.2 实时荧光定量聚合酶链反应(real-time quantitative PCR, RT-qPCR)检测LncRNA GAS5-AS1、miR-106a-5p表达: TRIzol法提取组织样本和细胞中的总RNA, QuantiTect逆转录试剂盒、MiScript II逆转录试剂盒分别合成circRNA、miRNA的cDNA, 再用SYBR Green法进行RT-qPCR. 用2-ΔΔCt方法定量基因表达水平.
1.2.3 转染和实验分组: 对数生长期HCT8细胞按2×104个/孔接种24孔板, 用Lipofectamine 2000将质粒或寡核苷酸转染HCT8细胞. 收集转染48 h细胞, RT-qPCR法检测LncRNA GAS5-AS1或miR-106a-5p表达. 未转染HCT8细胞记为对照(NC)组. 其他根据转染物不同分为pcDNA组、pcDNA-LncRNA GAS5-AS1组、si-NC组、si-LncRNA GAS5-AS1组、anti-miR-106a-5p组、anti-miR-NC组、pcDNA-LncRNA GAS5-AS1+miR-NC组、pcDNA-LncRNA GAS5-AS1 +miR-106a-5p组.
1.2.4 CCK-8法检测细胞活力: 将转染的HCT8细胞以5×103个/孔接种于96孔板, 培养过夜后检测细胞活力. 在每孔中加入10 μL CCK-8溶液, 孵育2 h后, 在450 nm处用酶标仪测定吸光度值(A值), 评估细胞活力.
1.2.5 Transwell法检测细胞迁移和侵袭: 迁移测定: 转染的HCT8细胞重新悬浮在无血清培养基中, 取200 μL(含1×105个转染细胞)细胞悬液加入上室, 将600 μL含血清培养基加入到下室. 培养24 h后, 用甲醇固定下室细胞, 结晶紫染色. 每组随机选择5个计数染色细胞数, 取均值表示迁移数. 侵袭测定: 将适量体积Matrigel和8倍体积无血清培养基混合, 取500稀释液包被Transwell上室, 室温凝固后备用, 其他步骤和迁移测定相同.
1.2.6 Western blot检测CyclinD1、MMP2和MMP9蛋白表达: RIPA裂解液用于提取细胞总蛋白, 100 V的SDS-PAGE电泳110 min分离蛋白, 400 mA电流转膜30 min. 洗膜缓冲液漂洗2 min, 5%脱脂牛奶封闭膜后, 立即加入CyclinD1、MMP2和MMP9一抗稀释液, 室温孵育1 h. 洗膜缓冲液漂洗10 min, 立即加入二抗稀释液室温孵育1 h. 用化学发光试剂检测蛋白, Image J软件分析目的条带的相对灰度值.
1.2.7 双荧光素酶报告实验: 利用LncBase Predicted v.2网站预测LncRNA GAS5-AS1和miR-106a-5p之间的结合位点. 将报告质粒LncRNA GAS5-AS1-MUT、LncRNA GAS5-AS1-WT分别与miR-NC或miR-106a-5p mimics共转染HCT8细胞. 48 h后测定萤火虫和海肾荧光素酶活性值, 计算相对荧光素酶活性.
统计学处理 每次检测时设置3个复孔, 实验独立重复进行3次, 数据以平均数±标准差(mean±SD)表示. 采用SPSS 20.0进行统计分析. 独立样本t检验用于评估两组数据差异, 单因素方差分析和SNK-q检验用于分析多组数据差异. aP<0.05或bP<0.05为差异有统计学意义.
结直肠癌组织中LncRNA GAS5-AS1水平显著低于癌旁组织(P<0.05), 而miR-106a-5p水平显著高于癌旁组织(P<0.05), 见图1.
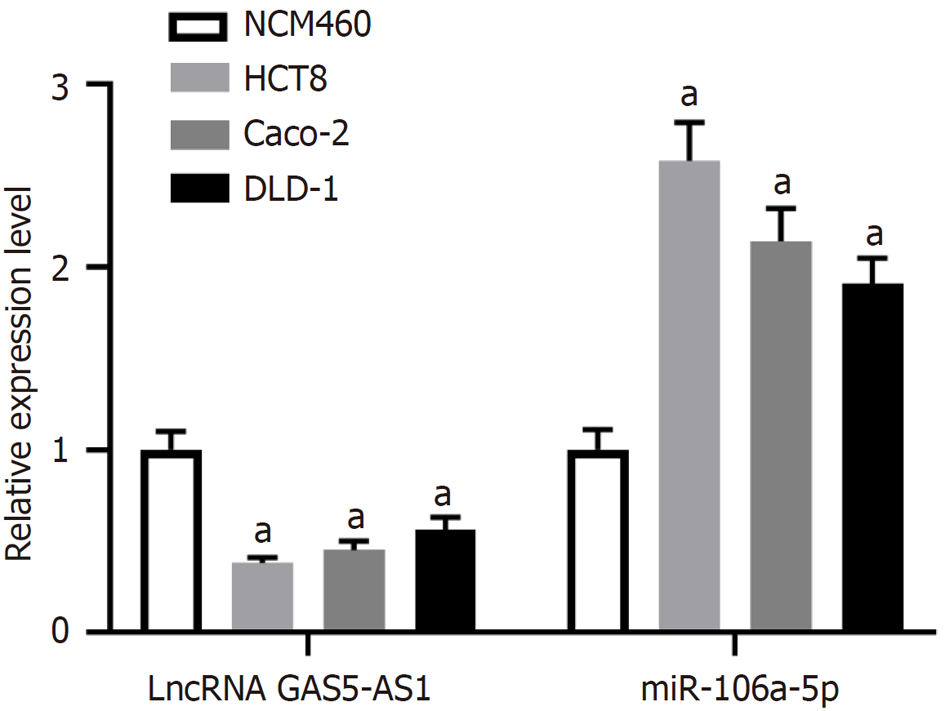
与人正常结直肠上皮细胞NCM460比较, 结直肠癌细胞系HCT8、Caco-2、DLD-1中LncRNA GAS5-AS1表达水平显著降低(P<0.05), miR-106a-5p表达水平显著升高(P<0.05), 见图2. 选择表达差异较大的HCT8细胞进行功能实验.
与pcDNA组比较, pcDNA-LncRNA GAS5-AS1组HCT8细胞LncRNA GAS5-AS1表达量显著升高(P<0.05), A值、CyclinD1、MMP2和MMP9蛋白表达、细胞迁移和侵袭数量显著减少(P<0.05), 见图3和表1.
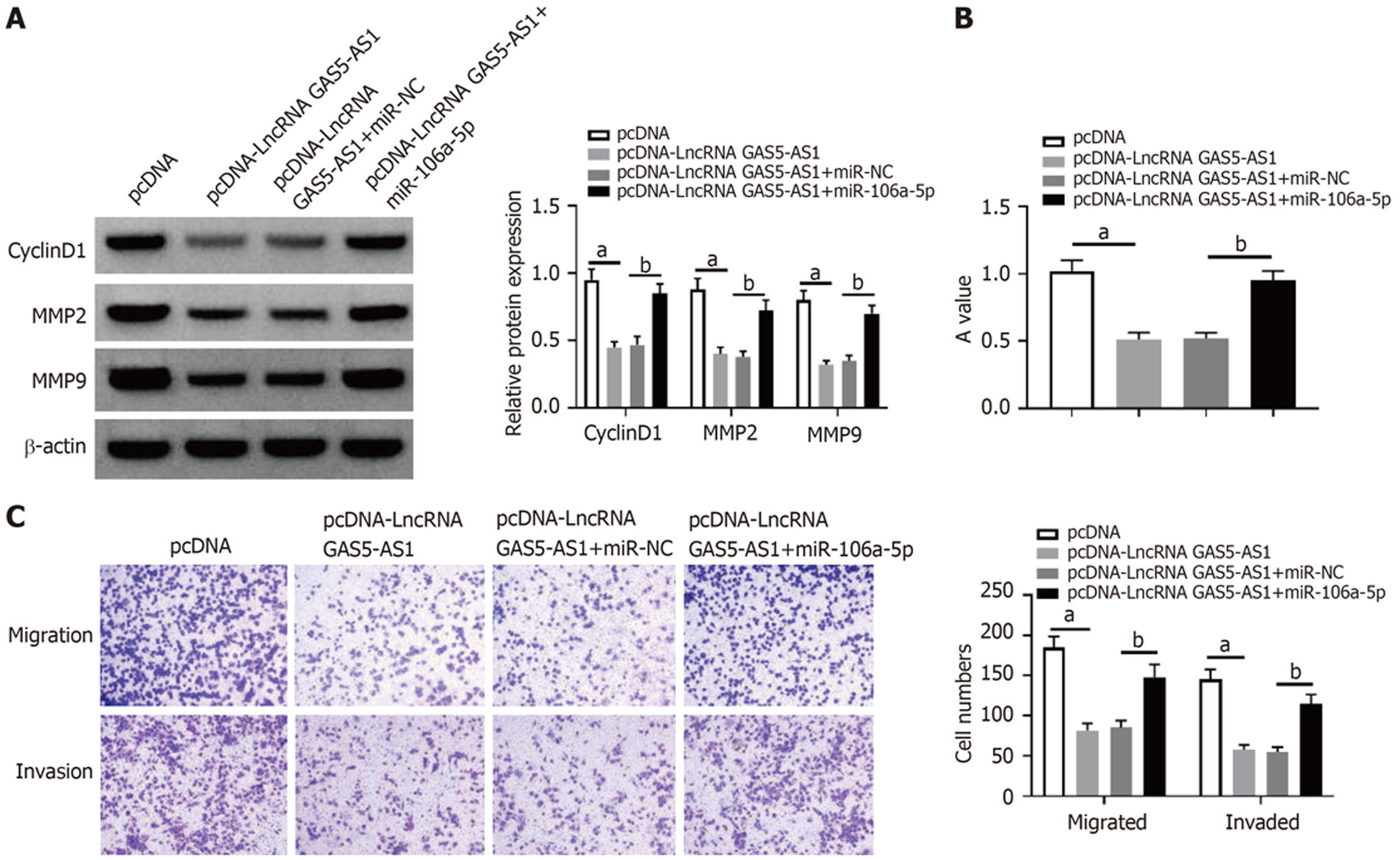
与anti-miR-NC组比较, miR-106a-5p组HCT8细胞miR-106a-5p表达量、A值、CyclinD1、MMP2和MMP9蛋白表达、细胞迁移和侵袭数量显著减少(P<0.05), 见图4和表2.
LncBase Predicted v.2预测到LncRNA GAS5-AS1与miR-106a-5p存在结合位点, 见图5. 与转染miR-NC比较, 转染miR-106a-5p可以显著降低LncRNA GAS5-AS1-WT细胞相对荧光素酶活性(P<0.05), 见表3. pcDNA-LncRNA GAS5-AS1组HCT8细胞LncRNA GAS5-AS1表达量显著高于pcDNA组(P<0.05), miR-106a-5p表达量显著低于pcDNA组(P<0.05); si-LncRNA GAS5-AS1组HCT8细胞LncRNA GAS5-AS1表达量显著低于si-NC组(P<0.05), miR-106a-5p表达量显著高于si-NC组(P<0.05), 见表4.
| 组别 | 相对荧光素酶活性 | |
| LncRNA GAS5-AS1-WT | LncRNA GAS5-AS1-MUT | |
| miR-NC | 1.00±0.10 | 1.00±0.11 |
| miR-106a-5p | 0.41±0.04a | 0.97±0.07 |
| t | 16.434 | 0.690 |
| P | 0.000 | 0.500 |
与pcDNA-LncRNA GAS5-AS1+miR-NC组比较, pcDNA-LncRNA GAS5-AS1+ miR-106a-5p组HCT8细胞miR-106a-5p表达量、A值、CyclinD1、MMP2和MMP9蛋白表达、细胞迁移和侵袭数量显著上调(P<0.05), 见图6和表5.
| 组别 | miR-106a-5p | CyclinD1 | MMP2 | MMP9 |
| pcDNA | 1.00±0.08 | 0.95±0.08 | 0.88±0.08 | 0.80±0.07 |
| pcDNA-LncRNA GAS5-AS1 | 0.44±0.05a | 0.45±0.04a | 0.40±0.05a | 0.32±0.03a |
| pcDNA-LncRNA GAS5-AS1+miR-NC | 1.00±0.09 | 0.46±0.04 | 0.40±0.04 | 0.36±0.02 |
| pcDNA-LncRNA GAS5-AS1+miR-106a-5p | 1.98±0.16b | 0.87±0.07b | 0.82±0.08b | 0.73±0.07b |
| t | 16.015 | 15.256 | 14.087 | 15.247 |
| P | 0.000 | 0.000 | 0.000 | 0.000 |
LncRNA GAS5-AS1表达失调与多种肿瘤进展相关, 研究指出LncRNA GAS5-AS1在宫颈癌表达下调, 联合检测LncRNA GAS5-AS1以及其他5个LncRNA表达水平可预测宫颈癌患者的预后, 上调LncRNA GAS5-AS1表达可抑制宫颈癌的致瘤性和转移能力[9,10]. 另一项研究显示LncRNA GAS5-AS1是胃癌预后的生物标志物[11]. 此外, 有报道称[12]上调LncRNA GAS5-AS1对胶质瘤生长和转移亦具有抑制作用. 本研究检测到CRC组织、细胞中LncRNA GAS5-AS1表达下调, 提示LncRNA GAS5-AS1低表达可能促进CRC进展. 功能获得实验显示, 上调LncRNA GAS5-AS1表达显著可降低HCT8细胞的增殖、迁移和侵袭能力, 并下调促增殖蛋白CyclinD1以及促转移蛋白MMP2、MMP9的表达水平, 这与之前研究报道LncRNA GAS5-AS1的抗增殖、抗转移作用吻合, 表明LncRNA GAS5-AS1在CRC中发挥抑癌功能.
LncRNA可与特异性miRNA结合, 从而隔离miRNA并改变其下游靶基因的表达, 这种由lncRNA-miRNA-mRNA相互作用形成的竞争性内源性RNA网络广泛参与调控CRC生物学过程[13]. 例如, LINC01278通过靶向miR-134-5p、上调赖氨酸脱甲基酶2A(KDM2A)表达促进CRC细胞增殖和迁移[14]. LncRNA尿路上皮癌相关1(UCA1)调控miR-23b-3p/锌指蛋白281(ZNF281)轴介导CRC细胞5-氟尿嘧啶耐药[15]. miR-106a-5p是一种小型非编码RNA, 其在肝癌组织中表达上调, 且下调其表达能够抑制肝癌细胞侵袭转移[16]. miR-106a-5p还是LncRNA人类白细胞抗原复合体18(human leukocyte antigen complex group 18, HCG18)的下游靶点, miR-106a-5p下调介导LncRNA HCG18对乳头状甲状腺癌细胞存活、上皮-间质转化、侵袭的抑制作用[17]. 本研究检测到CRC组织、细胞中miR-106a-5p表达上调, 且下调miR-106a-5p表达可降低HCT8细胞的增殖、迁移和侵袭能力, 这与上述研究中下调miR-106a-5p表达的抗癌功能一致. 然而, 乳腺癌、肾细胞癌miR-106a-5p表达降低, miR-106a-5p在癌症进程中发挥抑癌作用, 这种差异可能与肿瘤异质性有关[18,19]. 深入分析显示, miR-106a-5p是LncRNA GAS5-AS1的直接靶点. 下调miR-106a-5p表达和上调LncRNA GAS5-AS1表达的抗肿瘤作用类似, 且miR-106a-5p表达受到LncRNA GAS5-AS1负性调控, 提示LncRNA GAS5-AS1可能通过lncRNA-miRNA网络发挥作用. 过表达miR-106a-5p显著削弱上调LncRNA GAS5-AS1对HCT8细胞行为的影响, 这表明LncRNA GAS5-AS1通过靶向miR-106a-5p参与CRC进展. 然而, 本研究尚存在不足之处. 通过生信分析, 我们发现miR-106a-5p的下游靶点有很多, 靶基因筛选流程还需要仔细规划. 因此, LncRNA GAS5-AS1/miR-106a-5p轴的具体下游靶基因还需要进一步的实验分析才能确定. 此外, 仍需要开展动物实验来验证LncRNA GAS5-AS1/miR-106a-5p轴的功能, 进一步丰富研究结果.
综上所述, CRC中LncRNA GAS5-AS1表达降低. 上调LncRNA GAS5-AS1通过靶向miR-106a-5p抑制CRC细胞生物学行为. 这为阐明CRC进展机制提供理论基础, 并为CRC治疗提供潜在靶点.
结直肠癌(colorectal cancer, CRC)是常见的消化道肿瘤, 严重威胁患者生命, 因此有必要阐明影响其进展的分子机制.
探究影响CRC进展的分子机制可能为其治疗提供潜在分子靶点.
揭示长链非编码RNA(long non-coding RNA, LncRNA)生长停滞特异性转录本5反义RNA(growth arrest specific transcript 5 antisense RNA, GAS5-AS1)在CRC进展中的作用及潜在分子机制.
通过转染pcDNA-LncRNA GAS5-AS1分析LncRNA GAS5-AS1对CRC细胞增殖、迁移和侵袭的影响; 通过转染anti-miR-106a-5p确定miR-106a-5p敲低对CRC细胞增殖、迁移和侵袭的影响; 双荧光素酶报告实验确定LncRNA GAS5-AS1和miR-106a-5p的靶向关系; 通过共转染pcDNA-LncRNA GAS5-AS1和miR-106a-5p mimics确定LncRNA GAS5-AS1是否通过调控miR-106a-5p介导CRC细胞增殖、迁移和侵袭.
LncRNA GAS5-AS1过表达或miR-106a-5p敲低均可以抑制CRC细胞增殖、迁移和侵袭; LncRNA GAS5-AS1可以靶向miR-106a-5p, 且miR-106a-5p mimics可以逆转LncRNA GAS5-AS1对CRC细胞增殖、迁移和侵袭的抑制作用.
上调LncRNA GAS5-AS1通过靶向miR-106a-5p抑制CRC细胞增殖、迁移和侵袭, 这可能为CRC的治疗提供潜在分子靶点.
未来仍需要探究CRC的发病机制, 为CRC临床治疗提供新思路.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B, B
C级 (良好): C
D级 (一般): D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Johdi NA, Sukor NF. Colorectal Cancer Immunotherapy: Options and Strategies. Front Immunol. 2020;11:1624. [PubMed] [DOI] |
| 2. | Tang XJ, Wang W, Hann SS. Interactions among lncRNAs, miRNAs and mRNA in colorectal cancer. Biochimie. 2019;163:58-72. [PubMed] [DOI] |
| 4. | Wang Y, Jing W, Ma W, Liang C, Chai H, Tu J. Down-regulation of long non-coding RNA GAS5-AS1 and its prognostic and diagnostic significance in hepatocellular carcinoma. Cancer Biomark. 2018;22:227-236. [PubMed] [DOI] |
| 5. | Wu Y, Lyu H, Liu H, Shi X, Song Y, Liu B. Downregulation of the long noncoding RNA GAS5-AS1 contributes to tumor metastasis in non-small cell lung cancer. Sci Rep. 2016;6:31093. [PubMed] [DOI] |
| 6. | Wei P, Yang J, Zhang D, Cui M, Li L. lncRNA HAND2-AS1 Regulates Prostate Cancer Cell Growth Through Targeting the miR-106a-5p/RBM24 Axis. Onco Targets Ther. 2020;13:4523-4531. [PubMed] [DOI] |
| 8. | Liu J, Huang Y, Wang H, Wu D. MiR-106a-5p promotes 5-FU resistance and the metastasis of colorectal cancer by targeting TGFβR2. Int J Clin Exp Pathol. 2018;11:5622-5634. [PubMed] |
| 9. | Chen Q, Hu L, Huang D, Chen K, Qiu X, Qiu B. Six-lncRNA Immune Prognostic Signature for Cervical Cancer. Front Genet. 2020;11:533628. [PubMed] [DOI] |
| 10. | Wang X, Zhang J, Wang Y. Long noncoding RNA GAS5-AS1 suppresses growth and metastasis of cervical cancer by increasing GAS5 stability. Am J Transl Res. 2019;11:4909-4921. [PubMed] |
| 11. | Cheng C, Wang Q, Zhu M, Liu K, Zhang Z. Integrated analysis reveals potential long non-coding RNA biomarkers and their potential biological functions for disease free survival in gastric cancer patients. Cancer Cell Int. 2019;19:123. [PubMed] [DOI] |
| 12. | Huang W, Shi Y, Han B, Wang Q, Zhang B, Qi C, Liu F. LncRNA GAS5-AS1 inhibits glioma proliferation, migration, and invasion via miR-106b-5p/TUSC2 axis. Hum Cell. 2020;33:416-426. [PubMed] [DOI] |
| 13. | Wang L, Cho KB, Li Y, Tao G, Xie Z, Guo B. Long Noncoding RNA (lncRNA)-Mediated Competing Endogenous RNA Networks Provide Novel Potential Biomarkers and Therapeutic Targets for Colorectal Cancer. Int J Mol Sci. 2019;20. [PubMed] [DOI] |
| 14. | Xi C, Ye NY, Wang YB. LncRNA LINC01278 accelerates colorectal cancer progression via miR-134-5p/KDM2A axis. Eur Rev Med Pharmacol Sci. 2020;24:10526-10534. [PubMed] [DOI] |
| 15. | Xian Z, Hu B, Wang T, Zeng J, Cai J, Zou Q, Zhu P. lncRNA UCA1 Contributes to 5-Fluorouracil Resistance of Colorectal Cancer Cells Through miR-23b-3p/ZNF281 Axis. Onco Targets Ther. 2020;13:7571-7583. [PubMed] [DOI] |
| 16. | Luo LH, Jin M, Wang LQ, Xu GJ, Lin ZY, Yu DD, Yang SL, Ran RZ, Wu G, Zhang T. Long noncoding RNA TCL6 binds to miR-106a-5p to regulate hepatocellular carcinoma cells through PI3K/AKT signaling pathway. J Cell Physiol. 2020;235:6154-6166. [PubMed] [DOI] |
| 17. | Zhu Y, Zhao J, Tan L, Lin S, Long M, Peng X. LncRNA-HCG18 regulates the viability, apoptosis, migration, invasion and epithelial-mesenchymal transition of papillary thyroid cancer cells via regulating the miR-106a-5p/PPP2R2A axis. Pathol Res Pract. 2021;221:153395. [PubMed] [DOI] |
| 18. | 夏 丽琴, 冯 忠明, 陈 旭, 李 妍, 王 艳梅, 卢 丁烯, 古 骄阳, 孙 建国. 网络筛选乳腺癌相关miRNAs及miR-106a-5p对乳腺癌细胞侵袭迁移能力的影响. 第三军医大学学报. 2017;39:130-136. [DOI] |
| 19. | Pan YJ, Wei LL, Wu XJ, Huo FC, Mou J, Pei DS. MiR-106a-5p inhibits the cell migration and invasion of renal cell carcinoma through targeting PAK5. Cell Death Dis. 2017;8:e3155. [PubMed] [DOI] |