修回日期: 2024-02-06
接受日期: 2024-03-14
在线出版日期: 2024-03-28
肝纤维化是一种肝脏组织在长期炎症状态下持续损伤和自我修复形成纤维化瘢痕的过程, 以细胞外基质过度沉积为特征的病理综合征. 目前肝纤维化常见的病因包括酒精性脂肪肝炎、非酒精性肝炎、胆汁淤积性肝病、化学性肝损伤、病毒性肝炎等. 肝纤维化是肝硬化和肝功能衰竭的主要前期阶段, 在持续炎症刺激下, 若不加以控制, 可能会进一步发展成肝硬化, 乃至肝癌, 对患者的治疗负担和生存质量产生重要影响. 近年来, 研究表明色氨酸及其代谢产物在肝纤维化的发生和进展中起着重要的调控作用, 本文将综述色氨酸代谢与肝纤维化的相关研究进展, 以期深入了解其潜在的治疗价值.
核心提要: 色氨酸代谢与肝纤维化之间的微妙关系, 近年来在生物医学领域引起了广泛关注. 色氨酸, 作为人体不可或缺的氨基酸之一, 其代谢途径在维持生理稳态中发挥着至关重要的作用. 而肝纤维化, 作为多种慢性肝病的共同病理基础, 其发展过程涉及复杂的细胞与分子机制. 本文将深入探讨色氨酸代谢与肝纤维化之间的内在联系, 以期为相关疾病的治疗提供新的启示.
引文著录: 吴辉星, 龙昌锐, 张振华, 陈宇莲, 王炎玉, 乡世健, 周本杰. 色氨酸代谢与肝纤维化. 世界华人消化杂志 2024; 32(3): 192-198
Revised: February 6, 2024
Accepted: March 14, 2024
Published online: March 28, 2024
Liver fibrosis is a pathological syndrome characterized by continuous damage and self-repair of liver tissue under prolonged inflammatory conditions, resulting in the formation of fibrotic scars with excessive deposition of the extracellular matrix. Common causes of liver fibrosis include alcoholic fatty liver disease, non-alcoholic hepatitis, cholestatic liver disease, chemical liver injury, viral hepatitis, and others. Liver fibrosis, if left uncontrolled under persistent inflammatory stimuli, may further progress to cirrhosis and even hepatocellular carcinoma, significantly impacting the treatment burden and quality of life for patients. In recent years, research has indicated that tryptophan and its metabolic products play a crucial regulatory role in the occurrence and progression of liver fibrosis. This article aims to review the progress in the understanding of the relationship between tryptophan metabolism and liver fibrosis, in order to provide some clues to the treatment of this condition.
- Citation: Wu HX, Long CR, Zhang ZH, Chen YL, Wang YY, Xiang SJ, Zhou BJ. Tryptophan metabolism and liver fibrosis. Shijie Huaren Xiaohua Zazhi 2024; 32(3): 192-198
- URL: https://www.wjgnet.com/1009-3079/full/v32/i3/192.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v32.i3.192
色氨酸代谢与肝纤维化之间的关系近年来逐渐成为生物医学领域的研究热点. 色氨酸, 作为一种必需氨基酸, 在人体内参与多种重要的生理过程, 其代谢途径的异常往往与多种疾病的发生发展密切相关[1]. 肝纤维化是慢性肝病最常见的病理过程, 每年导致全球超过100万人死亡[2], 而作为慢性肝病的一个共同病理过程, 其发生机制复杂, 涉及多种细胞及分子的相互作用[3]. 本文旨在对色氨酸代谢与肝纤维化的相关研究进行综述, 探讨二者之间的潜在联系.
肝纤维化是一种肝脏组织在长期炎症状态下持续损伤和自我修复形成纤维化瘢痕的过程, 以细胞外基质(extracellular matrix, ECM)过度沉积为特征导致正常肝组织逐渐被纤维组织所取代的病理综合征. 目前肝纤维化常见的病因包括酒精性脂肪肝炎、非酒精性肝炎、胆汁淤积性肝病、化学性肝损伤、病毒性肝炎等. 肝纤维化是肝硬化和肝功能衰竭的主要前期阶段, 在持续炎症刺激下, 若不加以控制, 可能会进一步发展成肝硬化, 乃至肝癌, 对患者的治疗负担和生存质量产生重要影响[3]. 肝纤维化的发病机制涉及多种分子、细胞和生理过程的交互作用, 目前认为肝纤维化的发病机制主要如下.
肝纤维化的初始触发因素通常是肝脏遭受长期、持续的炎症和细胞损伤. 这种损伤可以由各种原因引发, 包括病毒感染(如乙型肝炎病毒和丙型肝炎病毒)、酒精滥用、非酒精性脂肪性肝病、药物或毒物曝露以及自身免疫性肝炎等. 当肝脏受到损伤时, 炎症介质如肿瘤坏死因子-α、白细胞介素(interlenkin IL, IL)-1β和IL-6等被释放出来, 吸引免疫细胞进入受损区域. 这些免疫细胞包括巨噬细胞、自然杀伤细胞和T淋巴细胞, 它们发挥着炎症和免疫反应的关键作用; 这些细胞因子可以进一步促进炎症反应, 并刺激肝星状细胞的活化[4-6].
肝星状细胞的活化是肝纤维化的一大特征[7], 慢性炎症刺激可导致肝内星状细胞的激活, 这是肝脏中的主要细胞类型之一. 活化的星状细胞会分化成肌成纤维细胞进而开始合成和分泌胶原蛋白、纤维连接蛋白和脂质等细胞外基质蛋白质. 这些蛋白质在肝组织中逐渐积累, 形成纤维疤痕.
肝细胞损伤与凋亡在肝纤维化中起着重要的作用. 一方面, 细胞凋亡可导致肝细胞数量减少, 为肝细胞纤维化提供空间. 在肝细胞凋亡的过程中, 受损细胞逐步死亡, 机体对损伤细胞的反应会导致肝细胞数量的减少, 从而为肝纤维化的发生提供空间. 此外, 细胞凋亡在肝纤维化的炎症环境中具有诱导作用. 细胞凋亡产生的相关信号会引起机体的免疫反应, 迅速启动肝纤维化的发生过程, 进一步代替受损的正常肝细胞[8]. 另一方面, 尤其是反复的或持续的损伤, 可以引发肝脏的炎症反应, 进而导致纤维化的发生. 损伤的肝细胞会释放一系列的炎症信号分子(IL-6, IL-1β等), 这些信号分子可以吸引免疫细胞到损伤部位, 引发炎症反应. 持续的炎症反应会刺激肝脏中的星状细胞活化, 转化为肌成纤维细胞, 产生大量的细胞外基质, 最终导致肝纤维化的形成, 从而加剧了纤维化的进展[6].
活化的星状细胞分化而成的肌成纤维细胞不仅合成胶原蛋白, 还分泌其他细胞外基质成分, 如纤维连接蛋白. 这些物质在肝组织中沉积, 形成初级纤维疤痕. 逐渐, 这些疤痕不断增多, 扩展, 并且可导致肝脏结构的紊乱和功能的丧失, 而一旦开始形成纤维疤痕, 它们可以成为炎症的循环点. 炎症继续诱导星状细胞活化和胶原沉积, 导致纤维疤痕的扩展和加重. 基质金属蛋白酶(matrix metalloproteinases, MMPs)能够降解细胞外基质, 而基质金属蛋白酶抑制剂(tissue inhibitor of metal protease, TIMPs)能够抑制MMPs的活性. 在激活态的肝星状细胞中高度表达TIMPs, 抑制激活态的肝星状细胞的凋亡, 这种正反馈循环是肝纤维化进展的关键[9,10].
生长因子如转化生长因子-beta和血小板衍生生长因子(platelet-derived growth factor, PDGF)在肝纤维化中发挥关键作用[11], 它们刺激了胶原的合成. 其他细胞因子如IL-13也涉及在纤维化的调控中[4,5]. 巨噬细胞中的卵泡抑素样蛋白(follistatin-like protein 1, FSTL1)被证明在人和小鼠的巨噬细胞中表达明显升高[12]. 巨噬细胞中表达的IL-17A被认为可能是一个潜在的饮酒导致的肝脏疾病的靶点[13,14].
氧化应激是肝纤维化的另一个重要机制. 氧化应激是由自由基和抗氧化失衡引起的, 可以导致细胞膜和DNA的氧化损伤, 促进炎症和细胞死亡, 加剧纤维化的进程[15].
总之, 肝纤维化的发病机制是一个高度复杂的过程, 涉及多个细胞类型、分子通路和互相作用的事件. 深入了解这些机制有助于开发更有效的治疗策略, 以干预和减缓肝纤维化的进展. 这些治疗策略可能包括药物、营养支持、生物学疗法和干细胞治疗等.
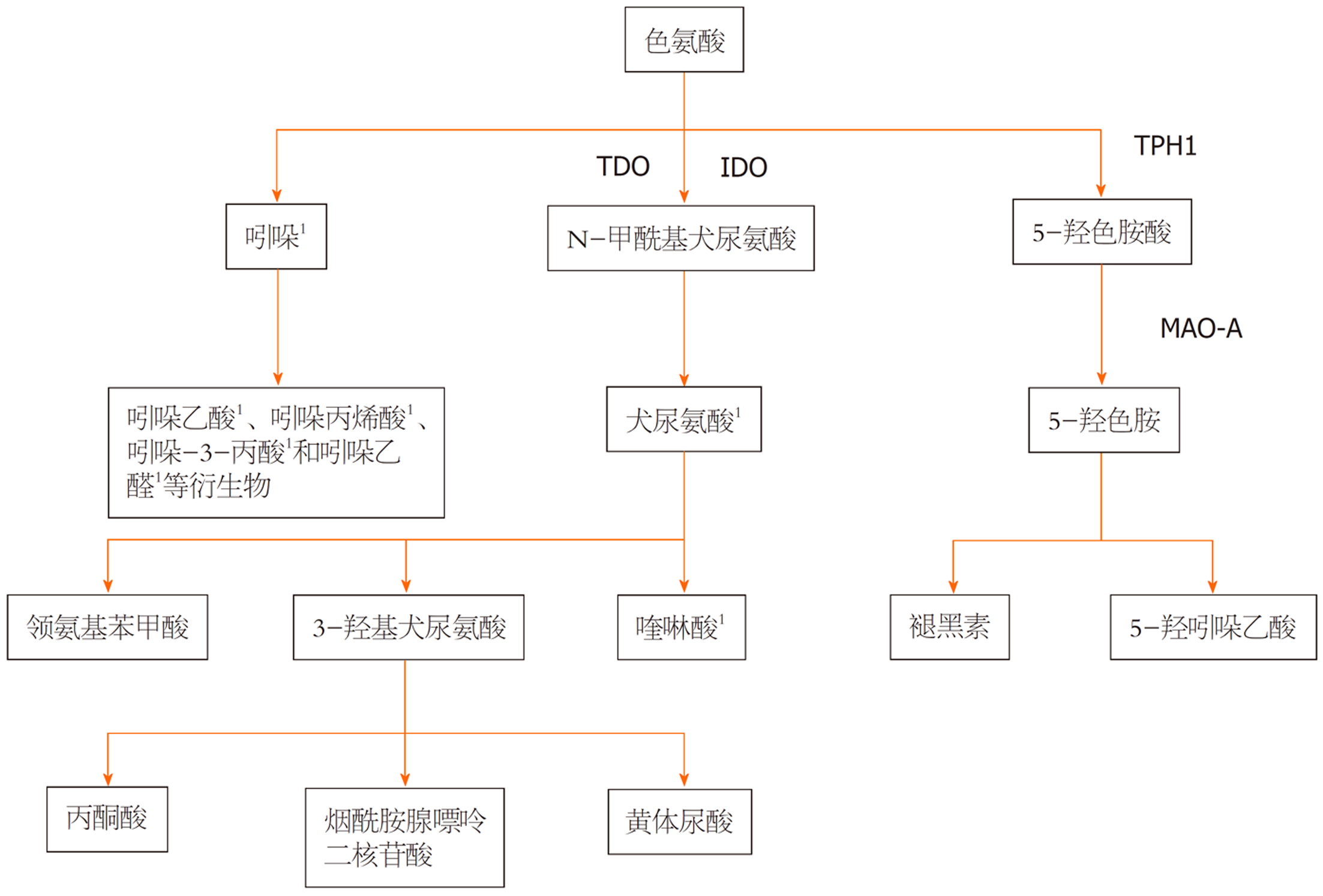
色氨酸是一种带有芳香基团的人类必需氨基酸, 对于人类和动物来说, 它是无法自身合成而必须从食物中获取的, 通过食物摄入后在体内经过多种代谢途径生成多种生物活性物质. 色氨酸代谢主要涉及犬尿氨酸、5-羟色胺和吲哚等途径. 这些代谢产物在人体内发挥重要的生理功能, 如调节免疫应答、参与神经递质合成等. 在肝病方面, 研究发现色氨酸代谢紊乱与肝纤维化的发生和发展密切相关. 有研究报道[16], 在严重酒精性肝炎患者中, 血清色氨酸水平与天门冬氨酸氨基转移酶(aspartate aminotransferase, AST)、胆红素等成反比, 提示酒精性肝炎患者色氨酸代谢受损. 总的来说, 色氨酸可以通过多种途径影响肝脏内的炎症反应和氧化应激反应, 从而参与肝纤维化的形成过程. 另一方面, 色氨酸还可以影响肝脏内的胶原合成和降解平衡, 进一步加剧肝纤维化的程度[17,18].
犬尿氨酸代谢途径是色氨酸的主要代谢途径之一, 超过95%的色氨酸通过该途径在肝脏进行代谢. 在这个过程中, 色氨酸首先被色氨酸-2,3-双加氧酶(tryptophan-2,3-dioxygenase, TDO)或吲哚胺-2,3-双加氧酶(indoleamine-2,3-dioxygenase, IDO)催化开环, 生成N-甲酰基犬尿氨酸. 随后, N-甲酰基犬尿氨酸经过一系列酶促反应, 最终转化为犬尿氨酸[19]. 犬尿氨酸可以进一步代谢为其他化合物, 如尼克酸(维生素B3)等, 参与能量代谢和细胞信号传导等过程[20]. 代谢酶TDO和IDO1/2, TDO主要存在于肝脏中, IDO在各个组织均有分布[17]; 有研究表明[21,22]IDO1缺乏和使用IDO1抑制剂会加重CCl4诱导的肝纤维化, 同时在血清中发现IDO1水平下降时, TDO会代偿性升高, 这是一个值得令人注意的信号. 犬尿氨酸被证明能提高成纤维细胞中MMPs的表达, 减弱组织纤维化的反应[23]. 令人意外的是在肝脏急性失代偿和急性-慢性肝衰竭的患者与健康人群比较发现, 肝脏急性失代偿和急性-慢性肝衰竭的患者犬尿氨酸和IDO水平偏高[24].
在吲哚代谢途径中, 吲哚代谢和肝纤维化之间存在一定的关系, 但是这种关系并不是直接的, 而是通过多种机制相互作用. 色氨酸在肠道内被肠道细菌分解代谢, 生成吲哚和吲哚衍生物, 包括吲哚乙酸、吲哚丙烯酸、吲哚-3-丙酸和吲哚乙醛等, 这些化合物在肠道内发挥重要的生理功能[25]. 有研究表明[26-28], 这类吲哚衍生物为芳香烃受体(aryl hydrocarbon receptor, AhR)的配体, 能够对AhR具有激活作用, 进而产生抗炎等作用, 在体内对结肠炎和代谢综合征显示出了良好的效果. AhR在肝脏中高表达, 是一种成熟的异生物质受体, 可感知环境毒物并调节异生物质代谢[29]. AhR的激动与免疫系统的调节密切相关, 已有研究表明在AhR低表达的致病性Th17细胞可促进组织炎症, 同时AhR可促进Th17细胞分化和γδT细胞产生IL-22, 这表明AhR具有调节炎症反应的能力, 且可能与IL-22的合成相关[30]. IL-22是IL-10细胞因子家族的成员, 主要由Th17/22细胞、γδT细胞、自然杀伤T细胞和先天淋巴样细胞分泌[31], 主要靶向非造血细胞, 如肝、肺、肾、胰腺和肠[32,33]. 大量研究表明[34-36], IL-22并对不同病因引起实验小鼠模型中对肝纤维化具有保护作用. 另一方面, 吲哚是一种具有特殊气味的化合物, 它在肠道内与肠道菌群相互作用, 对肠道健康有一定影响. 此外, 一些吲哚衍生物还具有生物活性, 如抗炎、抗氧化等作用. 吲哚-3-丙酸(indole-3-propionic acid, IPA)主要通过抗氧化、抗炎作用和维护肠道稳态来改善肝纤维化[37,38]. 首先, IPA具有抗氧化的特性, 可以帮助清除体内的氧化应激产物, 减少氧化应激反应对细胞的损伤. 氧化应激是炎症反应的一个重要环节, 因此, 通过抗氧化作用, IPA可以间接地抑制炎症反应. 其次, IPA还可以直接抑制炎症反应. 它可以调节炎症相关基因的表达, 减少炎症介质的产生和释放, 从而降低炎症反应的强度和持续时间. 另一方面, 色氨酸代谢产物吲哚丙烯酸(indoleacrylic acid, IA)在脂多糖激活的人外周血单个核细胞中具有抗炎和抗氧化作用, 可减少IL-6和IL-1β的分泌并激活NRF2-ARE通路, 提示IA具有抗炎作用并对可调节宿主的免疫[39]. 总的来说, 炎症反应、氧化应激损伤和细胞凋亡等是激活肝星状细胞(hepatic stellate cell, HSCs)的重要因素, 而HSCs的激活是肝纤维化形成过程中的关键事件. 吲哚代谢产物的抗炎和抗氧化作用可能有助于减轻肝脏的炎症反应和氧化应激, 从而抑制HSCs的激活和减少肝纤维化的发生. 再者, 肠道-微生物群-肝轴是预防和治疗肝纤维化进展的一个潜在靶点[40,41], 有研究报道[42,43], 灵芝的提取物熊果酸可以调节肠道菌群, 维持肠道微生物稳态, 抑制肝脏炎症, 保护肝细胞. 拟杆菌属、产气荚膜杆菌属、丁酸弧菌属、乳杆菌属和双歧杆菌属等能够在肠道中将色氨酸分解代谢成吲哚及其衍生物进一步发挥维护肠道稳态, 保护肠屏障功能和改善肝纤维化的作用[44,45]. 目前对于吲哚代谢途径与肝纤维化之间关系的研究还处于初级阶段, 具体的分子机制和信号通路尚不完全清楚. 未来的研究需要进一步深入探索吲哚代谢途径在肝纤维化中的作用, 以及开发基于该途径的治疗策略来预防和治疗肝纤维化.
5-羟色胺代谢途径是色氨酸在神经系统中的重要代谢途径. 在这个过程中, 色氨酸首先被色氨酸羟化酶催化, 生成5-羟色胺酸. 随后, 5-羟色胺酸经过脱羧反应, 生成神经递质5-羟色胺(5-HT也被称为血清素). 5-HT是一种在中枢神经系统以及胃肠道的肠嗜铬细胞中合成的神经内分泌激素, 其广泛存在于中枢神经系统和外周组织中, 包括肝脏. 在肝脏中, 5-HT可以通过其受体介导的信号通路影响肝细胞的生长、增殖和凋亡等生物学过程[46,47]. 这些过程与肝纤维化的发生和发展密切相关. 色氨酸羟化酶1和单胺氧化酶分别是5-HT合成和分解代谢的关键酶. 先前的研究表明[48,49], 5-羟色胺受体(5HTR)1A/1B受体激动剂可抑制胆管结扎大鼠的胆道增生, 而5HTR2B受体拮抗剂可减轻小鼠的肝纤维化. 有研究报道[50]5-HT可通过5HTR2B受体激活可以活化大鼠的肝星状细胞促进肝纤维化. 有趣的是, 5-羟色胺7受体在四氯化碳诱导的肝纤维化模型中低表达, 而5-羟色胺7受体激动剂能够改善肝纤维化[51]. 由此表明, 5-羟色胺不同受体在肝纤维化中起着不同的作用.
总的来说, 犬尿氨酸代谢途径、吲哚代谢途径和5-HT代谢途径, 这三条代谢途径在机体内相互交织、相互影响, 共同维持色氨酸代谢的平衡. 色氨酸代谢的异常可能导致一系列疾病的发生和发展, 如神经精神疾病、免疫系统疾病和肝脏疾病等. 因此, 对色氨酸代谢的研究具有重要的理论和实际意义(图1).
基于色氨酸代谢的5-HT、犬尿氨酸和吲哚代谢三条代谢途径, 针对色氨酸代谢紊乱与肝纤维化的关系, 潜在的治疗策略主要包括调节限速酶的活性、补充或抑制相关代谢产物等.
对于犬尿氨酸途径, 补充犬尿氨酸或其前体物质可能有助于减轻肝细胞损伤和延缓肝纤维化的进展[52], 过表达IDO能够增加犬尿氨酸的表达和MMPs的表达, 从而改善肝纤维化[53].
对于5-HT途径, 使用5-HT受体拮抗剂或抑制5-HT合成酶的药物可能有助于减缓肝纤维化的进程[54]; 5-羟色胺2A受体拮抗剂可以改善肝纤维化[55]等, 进一步研究相关受体在肝纤维化中的作用.
对于吲哚代谢途径, 调节肠道微生物菌群平衡以改善吲哚代谢可能有助于预防和治疗肝纤维化[56]. 犬尿氨酸、吲哚及其衍生物为AhR配体, 能够与AhR结合发挥抗炎调节免疫作用, 直接给予吲哚及其衍生物或直接激活AhR可成为治疗肝纤维化的新方向.
然而, 目前关于色氨酸代谢与疾病的研究仍处于初级阶段, 尚需进一步深入探讨其具体机制和潜在治疗策略的有效性及安全性. 未来研究方向可包括进一步揭示色氨酸代谢在肝脏疾病中的具体作用机制、开展大规模临床试验以验证潜在治疗策略的疗效和安全性以及探索针对不同患者群体的个性化治疗方案. 通过综合研究和实践应用, 有望为疾病的预防和治疗提供更多有效途径.
本文综述了色氨酸代谢与肝纤维化关系的研究进展, 重点探讨了色氨酸代谢途径、代谢产物以及其在肝纤维化中的作用机制. 随着对色氨酸代谢紊乱与疾病关系的深入研究, 有望为疾病的预防和治疗提供更多有效途径. 然而, 目前关于色氨酸代谢与肝纤维化的研究仍处于初级阶段, 尚需进一步深入探讨其具体机制和潜在治疗策略的有效性及安全性. 未来研究方向可包括进一步揭示色氨酸代谢在疾病中的具体作用机制、开展大规模临床试验以验证潜在治疗策略的疗效和安全性以及探索针对不同患者群体的个性化治疗方案.
学科分类: 胃肠病学和肝病学
手稿来源地: 广东省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B, B
C级 (良好): 0
D级 (一般): D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Comai S, Bertazzo A, Brughera M, Crotti S. Tryptophan in health and disease. Adv Clin Chem. 2020;95:165-218. [PubMed] [DOI] |
| 2. | Mokdad AA, Lopez AD, Shahraz S, Lozano R, Mokdad AH, Stanaway J, Murray CJ, Naghavi M. Liver cirrhosis mortality in 187 countries between 1980 and 2010: a systematic analysis. BMC Med. 2014;12:145. [PubMed] [DOI] |
| 3. | Roehlen N, Crouchet E, Baumert TF. Liver Fibrosis: Mechanistic Concepts and Therapeutic Perspectives. Cells. 2020;9. [PubMed] [DOI] |
| 4. | Kisseleva T, Brenner D. Molecular and cellular mechanisms of liver fibrosis and its regression. Nat Rev Gastroenterol Hepatol. 2021;18:151-166. [PubMed] [DOI] |
| 5. | Caligiuri A, Gentilini A, Pastore M, Gitto S, Marra F. Cellular and Molecular Mechanisms Underlying Liver Fibrosis Regression. Cells. 2021;10. [PubMed] [DOI] |
| 6. | Peiseler M, Schwabe R, Hampe J, Kubes P, Heikenwälder M, Tacke F. Immune mechanisms linking metabolic injury to inflammation and fibrosis in fatty liver disease - novel insights into cellular communication circuits. J Hepatol. 2022;77:1136-1160. [PubMed] [DOI] |
| 7. | Nakano Y, Kamiya A, Sumiyoshi H, Tsuruya K, Kagawa T, Inagaki Y. A Deactivation Factor of Fibrogenic Hepatic Stellate Cells Induces Regression of Liver Fibrosis in Mice. Hepatology. 2020;71:1437-1452. [PubMed] [DOI] |
| 8. | Jiang M, Huang C, Wu Q, Su Y, Wang X, Xuan Z, Wang Y, Xu F, Ge C. Sini San ameliorates CCl4-induced liver fibrosis in mice by inhibiting AKT-mediated hepatocyte apoptosis. J Ethnopharmacol. 2023;303:115965. [PubMed] [DOI] |
| 9. | Parola M, Pinzani M. Liver fibrosis: Pathophysiology, pathogenetic targets and clinical issues. Mol Aspects Med. 2019;65:37-55. [PubMed] [DOI] |
| 10. | Iredale JP, Thompson A, Henderson NC. Extracellular matrix degradation in liver fibrosis: Biochemistry and regulation. Biochim Biophys Acta. 2013;1832:876-883. [PubMed] [DOI] |
| 11. | Gao J, Wei B, de Assuncao TM, Liu Z, Hu X, Ibrahim S, Cooper SA, Cao S, Shah VH, Kostallari E. Hepatic stellate cell autophagy inhibits extracellular vesicle release to attenuate liver fibrosis. J Hepatol. 2020;73:1144-1154. [PubMed] [DOI] |
| 12. | Rao J, Wang H, Ni M, Wang Z, Wang Z, Wei S, Liu M, Wang P, Qiu J, Zhang L, Wu C, Shen H, Wang X, Cheng F, Lu L. FSTL1 promotes liver fibrosis by reprogramming macrophage function through modulating the intracellular function of PKM2. Gut. 2022;71:2539-2550. [PubMed] [DOI] |
| 13. | Ma HY, Yamamoto G, Xu J, Liu X, Karin D, Kim JY, Alexandrov LB, Koyama Y, Nishio T, Benner C, Heinz S, Rosenthal SB, Liang S, Sun M, Karin G, Zhao P, Brodt P, Mckillop IH, Quehenberger O, Dennis E, Saltiel A, Tsukamoto H, Gao B, Karin M, Brenner DA, Kisseleva T. IL-17 signaling in steatotic hepatocytes and macrophages promotes hepatocellular carcinoma in alcohol-related liver disease. J Hepatol. 2020;72:946-959. [PubMed] [DOI] |
| 14. | Piobbico D, Bartoli D, Pieroni S, De Luca A, Castelli M, Romani L, Servillo G, Della-Fazia MA. Role of IL-17RA in the proliferative priming of hepatocytes in liver regeneration. Cell Cycle. 2018;17:2423-2435. [PubMed] [DOI] |
| 15. | Liu Y, Lu T, Zhang C, Xu J, Xue Z, Busuttil RW, Xu N, Xia Q, Kupiec-Weglinski JW, Ji H. Activation of YAP attenuates hepatic damage and fibrosis in liver ischemia-reperfusion injury. J Hepatol. 2019;71:719-730. [PubMed] [DOI] |
| 16. | Wrzosek L, Ciocan D, Hugot C, Spatz M, Dupeux M, Houron C, Lievin-Le Moal V, Puchois V, Ferrere G, Trainel N, Mercier-Nome F, Durand S, Kroemer G, Voican CS, Emond P, Straube M, Sokol H, Perlemuter G, Cassard AM. Microbiota tryptophan metabolism induces aryl hydrocarbon receptor activation and improves alcohol-induced liver injury. Gut. 2021;70:1299-1308. [PubMed] [DOI] |
| 17. | Xue C, Li G, Zheng Q, Gu X, Shi Q, Su Y, Chu Q, Yuan X, Bao Z, Lu J, Li L. Tryptophan metabolism in health and disease. Cell Metab. 2023;35:1304-1326. [PubMed] [DOI] |
| 18. | Mysliwiec P, Pawlak D. [Kynurenic pathway in health and disease]. Postepy Hig Med Dosw. 2000;54:239-252. [PubMed] |
| 19. | Yeung AW, Terentis AC, King NJ, Thomas SR. Role of indoleamine 2,3-dioxygenase in health and disease. Clin Sci (Lond). 2015;129:601-672. [PubMed] [DOI] |
| 20. | Chini CCS, Zeidler JD, Kashyap S, Warner G, Chini EN. Evolving concepts in NAD(+) metabolism. Cell Metab. 2021;33:1076-1087. [PubMed] [DOI] |
| 21. | Fatokun AA, Hunt NH, Ball HJ. Indoleamine 2,3-dioxygenase 2 (IDO2) and the kynurenine pathway: characteristics and potential roles in health and disease. Amino Acids. 2013;45:1319-1329. [PubMed] [DOI] |
| 22. | Ogiso H, Ito H, Ando T, Arioka Y, Kanbe A, Ando K, Ishikawa T, Saito K, Hara A, Moriwaki H, Shimizu M, Seishima M. The Deficiency of Indoleamine 2,3-Dioxygenase Aggravates the CCl4-Induced Liver Fibrosis in Mice. PLoS One. 2016;11:e0162183. [PubMed] [DOI] |
| 23. | Poormasjedi-Meibod MS, Hartwell R, Kilani RT, Ghahary A. Anti-scarring properties of different tryptophan derivatives. PLoS One. 2014;9:e91955. [PubMed] [DOI] |
| 24. | Claria J, Moreau R, Fenaille F, Amoros A, Junot C, Gronbaek H, Coenraad MJ, Pruvost A, Ghettas A, Chu-Van E, Lopez-Vicario C, Oettl K, Caraceni P, Alessandria C, Trebicka J, Pavesi M, Deulofeu C, Albillos A, Gustot T, Welzel TM, Fernandez J, Stauber RE, Saliba F, Butin N, Colsch B, Moreno C, Durand F, Nevens F, Banares R, Benten D, Gines P, Gerbes A, Jalan R, Angeli P, Bernardi M, Arroyo V; CANONIC Study Investigators of the EASL Clif Consortium, Grifols Chair and the European Foundation for the Study of Chronic Liver Failure (EF Clif). Orchestration of Tryptophan-Kynurenine Pathway, Acute Decompensation, and Acute-on-Chronic Liver Failure in Cirrhosis. Hepatology. 2019;69:1686-1701. [PubMed] [DOI] |
| 25. | Beaumont M, Neyrinck AM, Olivares M, Rodriguez J, de Rocca Serra A, Roumain M, Bindels LB, Cani PD, Evenepoel P, Muccioli GG, Demoulin JB, Delzenne NM. The gut microbiota metabolite indole alleviates liver inflammation in mice. FASEB J. 2018;32:fj201800544. [PubMed] [DOI] |
| 26. | Zhuang H, Ren X, Jiang F, Zhou P. Indole-3-propionic acid alleviates chondrocytes inflammation and osteoarthritis via the AhR/NF-κB axis. Mol Med. 2023;29:17. [PubMed] [DOI] |
| 27. | Zhuang H, Li B, Xie T, Xu C, Ren X, Jiang F, Lei T, Zhou P. Indole-3-aldehyde alleviates chondrocytes inflammation through the AhR-NF-κB signalling pathway. Int Immunopharmacol. 2022;113:109314. [PubMed] [DOI] |
| 28. | Krishnan S, Ding Y, Saeidi N, Choi M, Sridharan GV, Sherr DH, Yarmush ML, Alaniz RC, Jayaraman A, Lee K. Gut Microbiota-Derived Tryptophan Metabolites Modulate Inflammatory Response in Hepatocytes and Macrophages. Cell Rep. 2019;28:3285. [PubMed] [DOI] |
| 29. | Yan J, Tung HC, Li S, Niu Y, Garbacz WG, Lu P, Bi Y, Li Y, He J, Xu M, Ren S, Monga SP, Schwabe RF, Yang D, Xie W. Aryl Hydrocarbon Receptor Signaling Prevents Activation of Hepatic Stellate Cells and Liver Fibrogenesis in Mice. Gastroenterology. 2019;157:793-806.e14. [PubMed] [DOI] |
| 30. | Veldhoen M, Hirota K, Westendorf AM, Buer J, Dumoutier L, Renauld JC, Stockinger B. The aryl hydrocarbon receptor links TH17-cell-mediated autoimmunity to environmental toxins. Nature. 2008;453:106-109. [PubMed] [DOI] |
| 31. | Eyerich K, Dimartino V, Cavani A. IL-17 and IL-22 in immunity: Driving protection and pathology. Eur J Immunol. 2017;47:607-614. [PubMed] [DOI] |
| 32. | Sonnenberg GF, Fouser LA, Artis D. Border patrol: regulation of immunity, inflammation and tissue homeostasis at barrier surfaces by IL-22. Nat Immunol. 2011;12:383-390. [PubMed] [DOI] |
| 33. | Dudakov JA, Hanash AM, van den Brink MR. Interleukin-22: immunobiology and pathology. Annu Rev Immunol. 2015;33:747-785. [PubMed] [DOI] |
| 34. | Ki SH, Park O, Zheng M, Morales-Ibanez O, Kolls JK, Bataller R, Gao B. Interleukin-22 treatment ameliorates alcoholic liver injury in a murine model of chronic-binge ethanol feeding: role of signal transducer and activator of transcription 3. Hepatology. 2010;52:1291-1300. [PubMed] [DOI] |
| 35. | Zhao J, Zhang Z, Luan Y, Zou Z, Sun Y, Li Y, Jin L, Zhou C, Fu J, Gao B, Fu Y, Wang FS. Pathological functions of interleukin-22 in chronic liver inflammation and fibrosis with hepatitis B virus infection by promoting T helper 17 cell recruitment. Hepatology. 2014;59:1331-1342. [PubMed] [DOI] |
| 36. | Wu LY, Liu S, Liu Y, Guo C, Li H, Li W, Jin X, Zhang K, Zhao P, Wei L, Zhao J. Up-regulation of interleukin-22 mediates liver fibrosis via activating hepatic stellate cells in patients with hepatitis C. Clin Immunol. 2015;158:77-87. [PubMed] [DOI] |
| 37. | Flannigan KL, Nieves KM, Szczepanski HE, Serra A, Lee JW, Alston LA, Ramay H, Mani S, Hirota SA. The Pregnane X Receptor and Indole-3-Propionic Acid Shape the Intestinal Mesenchyme to Restrain Inflammation and Fibrosis. Cell Mol Gastroenterol Hepatol. 2023;15:765-795. [PubMed] [DOI] |
| 38. | Li J, Zhang L, Wu T, Li Y, Zhou X, Ruan Z. Indole-3-propionic Acid Improved the Intestinal Barrier by Enhancing Epithelial Barrier and Mucus Barrier. J Agric Food Chem. 2021;69:1487-1495. [PubMed] [DOI] |
| 39. | Wlodarska M, Luo C, Kolde R, d'Hennezel E, Annand JW, Heim CE, Krastel P, Schmitt EK, Omar AS, Creasey EA, Garner AL, Mohammadi S, O'Connell DJ, Abubucker S, Arthur TD, Franzosa EA, Huttenhower C, Murphy LO, Haiser HJ, Vlamakis H, Porter JA, Xavier RJ. Indoleacrylic Acid Produced by Commensal Peptostreptococcus Species Suppresses Inflammation. Cell Host Microbe. 2017;22:25-37.e6. [PubMed] [DOI] |
| 40. | Silveira MAD, Bilodeau S, Greten TF, Wang XW, Trinchieri G. The gut-liver axis: host microbiota interactions shape hepatocarcinogenesis. Trends Cancer. 2022;8:583-597. [PubMed] [DOI] |
| 41. | Bosi A, Banfi D, Bistoletti M, Giaroni C, Baj A. Tryptophan Metabolites Along the Microbiota-Gut-Brain Axis: An Interkingdom Communication System Influencing the Gut in Health and Disease. Int J Tryptophan Res. 2020;13:1178646920928984. [PubMed] [DOI] |
| 42. | Wan S, Huang C, Wang A, Zhu X. Ursolic acid improves the bacterial community mapping of the intestinal tract in liver fibrosis mice. PeerJ. 2020;8:e9050. [PubMed] [DOI] |
| 43. | Nie Y, Liu Q, Zhang W, Wan Y, Huang C, Zhu X. Ursolic acid reverses liver fibrosis by inhibiting NOX4/NLRP3 inflammasome pathways and bacterial dysbiosis. Gut Microbes. 2021;13:1972746. [PubMed] [DOI] |
| 44. | Russell WR, Duncan SH, Scobbie L, Duncan G, Cantlay L, Calder AG, Anderson SE, Flint HJ. Major phenylpropanoid-derived metabolites in the human gut can arise from microbial fermentation of protein. Mol Nutr Food Res. 2013;57:523-535. [PubMed] [DOI] |
| 45. | Devlin AS, Marcobal A, Dodd D, Nayfach S, Plummer N, Meyer T, Pollard KS, Sonnenburg JL, Fischbach MA. Modulation of a Circulating Uremic Solute via Rational Genetic Manipulation of the Gut Microbiota. Cell Host Microbe. 2016;20:709-715. [PubMed] [DOI] |
| 46. | Choi W, Namkung J, Hwang I, Kim H, Lim A, Park HJ, Lee HW, Han KH, Park S, Jeong JS, Bang G, Kim YH, Yadav VK, Karsenty G, Ju YS, Choi C, Suh JM, Park JY, Park S, Kim H. Serotonin signals through a gut-liver axis to regulate hepatic steatosis. Nat Commun. 2018;9:4824. [PubMed] [DOI] |
| 47. | Kimura M, Moteki H, Ogihara M. Role of Hepatocyte Growth Regulators in Liver Regeneration. Cells. 2023;12. [PubMed] [DOI] |
| 48. | Kyritsi K, Chen L, O'Brien A, Francis H, Hein TW, Venter J, Wu N, Ceci L, Zhou T, Zawieja D, Gashev AA, Meng F, Invernizzi P, Fabris L, Wu C, Skill NJ, Saxena R, Liangpunsakul S, Alpini G, Glaser SS. Modulation of the Tryptophan Hydroxylase 1/Monoamine Oxidase-A/5-Hydroxytryptamine/5-Hydroxytryptamine Receptor 2A/2B/2C Axis Regulates Biliary Proliferation and Liver Fibrosis During Cholestasis. Hepatology. 2020;71:990-1008. [PubMed] [DOI] |
| 49. | Berbets AM, Davydenko IS, Barbe AM, Konkov DH, Albota OM, Yuzko OM. Melatonin 1A and 1B Receptors' Expression Decreases in the Placenta of Women with Fetal Growth Restriction. Reprod Sci. 2021;28:197-206. [PubMed] [DOI] |
| 50. | Ruddell RG, Oakley F, Hussain Z, Yeung I, Bryan-Lluka LJ, Ramm GA, Mann DA. A role for serotonin (5-HT) in hepatic stellate cell function and liver fibrosis. Am J Pathol. 2006;169:861-876. [PubMed] [DOI] |
| 51. | Polat B, Halici Z, Cadirci E, Karakus E, Bayir Y, Albayrak A, Unal D. Liver 5-HT7 receptors: A novel regulator target of fibrosis and inflammation-induced chronic liver injury in vivo and in vitro. Int Immunopharmacol. 2017;43:227-235. [PubMed] [DOI] |
| 52. | Zeybel M, Altay O, Arif M, Li X, Yang H, Fredolini C, Akyildiz M, Saglam B, Gonenli MG, Ural D, Kim W, Schwenk JM, Zhang C, Shoaie S, Nielsen J, Uhlen M, Boren J, Mardinoglu A. Combined metabolic activators therapy ameliorates liver fat in nonalcoholic fatty liver disease patients. Mol Syst Biol. 2021;17:e10459. [PubMed] [DOI] |
| 53. | Liu H, Liu L, Fletcher BS, Visner GA. Sleeping Beauty-based gene therapy with indoleamine 2,3-dioxygenase inhibits lung allograft fibrosis. FASEB J. 2006;20:2384-2386. [PubMed] [DOI] |
| 54. | Choi WG, Choi W, Oh TJ, Cha HN, Hwang I, Lee YK, Lee SY, Shin H, Lim A, Ryu D, Suh JM, Park SY, Choi SH, Kim H. Inhibiting serotonin signaling through HTR2B in visceral adipose tissue improves obesity-related insulin resistance. J Clin Invest. 2021;131. [PubMed] [DOI] |
| 55. | Kim DC, Jun DW, Kwon YI, Lee KN, Lee HL, Lee OY, Yoon BC, Choi HS, Kim EK. 5-HT2A receptor antagonists inhibit hepatic stellate cell activation and facilitate apoptosis. Liver Int. 2013;33:535-543. [PubMed] [DOI] |
| 56. | Sun M, Ma N, He T, Johnston LJ, Ma X. Tryptophan (Trp) modulates gut homeostasis via aryl hydrocarbon receptor (AhR). Crit Rev Food Sci Nutr. 2020;60:1760-1768. [PubMed] [DOI] |