修回日期: 2024-01-27
接受日期: 2024-02-06
在线出版日期: 2024-02-28
胃肠神经内分泌肿瘤(gastrointestinal neuroendocrine neoplasms, GI-NENs)临床表现多样, 部分具有高侵袭性及转移性, 预后差.收集我院诊治的GI-NENs患者的临床病理资料, 免疫组化检测CD155、T细胞免疫球蛋白和ITIM结构域蛋白(T cell immunoreceptor with Ig and ITIM domains, TIGIT)的表达量, 探讨其与临床病理和预后的关系, 为患者的治疗提供一个新的方向.
探讨CD155、TIGIT在GI-NENs中的表达量与临床病理特征的关系.
收集2016-11/2020-08经我院诊治的168例GI-NENs患者的临床病理资料. 免疫组化检测CD155、TIGIT的表达量, 探讨其与临床病理和预后的关系.
CD155和TIGIT在病理分级高的GI-NENs组织中, 表达量也较高, 差异有统计学意义(P<0.05); CD155表达量与年龄、肿瘤位置、肿瘤最大直径、病理分级、T分期、淋巴结转移、远处转移、TNM分期、Ki-67指数有关(P<0.05); TIGIT表达量与肿瘤最大直径、病理分级、T分期、淋巴结转移、TNM分期、Ki-67指数有关(P<0.05); CD155和TIGIT表达量高的患者预后较表达量低者差, 差异有统计学意义(P<0.05).
CD155和TIGIT表达量在不同分级、分期的GI-NENs患者存在差异, 可能参与了GI-NENs的发生及进展的调控过程, 高表达可能提示预后不佳.
核心提要: 收集经我院诊治的168例胃肠神经内分泌肿瘤(gastrointestinal neuroendocrine neoplasms, GI-NENs)患者的临床病理资料, 免疫组化检测CD155、T细胞免疫球蛋白和ITIM结构域蛋白(T cell immunoreceptor with Ig and ITIM domains, TIGIT)的表达量, 结果表明CD155和TIGIT表达量在不同分级、分期的GI-NENs患者存在差异, 可能参与了GI-NENs的发生及进展的调控过程, 高表达可能提示预后不佳.
引文著录: 谢伟, 余松, 侯能易, 严力, 曹钦兴, 旦真甲, 袁兴梅, 陆河江, 刘杰, 庞明辉. CD155、TIGIT在胃肠神经内分泌肿瘤中的表达及与临床病理特征的关系. 世界华人消化杂志 2024; 32(2): 123-133
Revised: January 27, 2024
Accepted: February 6, 2024
Published online: February 28, 2024
Gastrointestinal neuroendocrine neoplasms (GI-NENs) have various clinical manifestations, some of which are highly invasive and metastatic, with a poor prognosis. We collected the clinicopathologic data of GI-NENs patients treated at our hospital and detected the expression of CD155 and T cell immunoreceptor with Ig and ITIM domains (TIGIT) by immunohistochemistry to explore their relationship with clinicopathological characteristics and prognosis, in order to provide a new direction for the treatment of such patients.
To investigate the relationship between the expression of CD155 and TIGIT and clinicopathologic features in GI-NENs.
The clinicopathologic data of 168 patients with GI-NENs who were treated at our hospital from November 2016 to August 2020 were collected. Immunohistochemistry was used to detect the expression of CD155 and TIGIT, and their relationship with clinicopathological characteristics and prognosis was explored.
CD155 and TIGIT expression was significantly higher in GI-NENs tissues with high pathological grade (P < 0.05). CD155 expression was correlated with age, tumor location, maximum tumor diameter, pathological grade, T stage, lymph node metastasis, distant metastasis, TNM stage, and Ki-67 index (P < 0.05). TIGIT expression was correlated with maximum tumor diameter, pathological grade, T stage, lymph node metastasis, TNM stage, and Ki-67 index (P < 0.05). The prognosis of patients with high CD155 and TIGIT expression was significantly poorer than that of patients with low expression (P < 0.05).
CD155 and TIGIT expression differs in patients with GI-NENs of different grades and stages, and they may be involved in the occurrence and progression of GI-NENs. High expression of CD155 and TIGIT may suggest a poor prognosis in GI-NENs.
- Citation: Xie W, Yu S, Hou NY, Yan L, Cao QX, Dan ZJ, Yuan XM, Lu HJ, Liu J, Pang MH. Relationship between expression of CD155 and TIGIT and clinicopathological features in gastrointestinal neuroendocrine tumors. Shijie Huaren Xiaohua Zazhi 2024; 32(2): 123-133
- URL: https://www.wjgnet.com/1009-3079/full/v32/i2/123.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v32.i2.123
神经内分泌肿瘤(neuroendocrine neoplasms, NENs)是一类起源于肽能神经元和神经内分泌细胞, 具有神经内分泌分化并表达神经内分泌标记物的少见肿瘤. 胃肠神经内分泌肿瘤(gastrointestinal neuroendocrine neoplasms, GI-NENs)是最常见的类型之一[1,2]. 病理学方面, 根据分化程度, 分为分化良好的神经内分泌瘤(neuroendocrine tumor, NET)、分化差的神经内分泌癌(neuroendocrine carcinoma, NEC)和特殊类型的混合性神经内分泌肿瘤-非神经内分泌肿瘤(mixed neuroendocrine-non-neuroendocrine neoplasm, MiNEN). 近40年来全球各地区的NENs的发病率呈持续上升趋势[3]. NENs的临床表现多样, 大部分NENs生物行为表现为惰性, 恶性程度低, 预后较好; 但部分具有高侵袭性及转移性, 预后差. 因此, 探索早期诊断指标、预后指标仍然是NENs防治不可忽视的环节.
CD155是类果胶粘附分子家族的成员, 参与细胞运动、自然杀伤细胞和T细胞介导的免疫. CD155在人体各种正常组织中几乎不表达或弱表达, 在多种癌症类型的肿瘤细胞上高度上调, 包括结肠癌[4]、胃癌[5]、胰腺癌[6]、肺腺癌[7]、乳腺癌[8]、黑色素瘤[9]、胶质母细胞瘤[10]、原发性食道小细胞癌[11]等. T细胞免疫球蛋白和ITIM结构域蛋白(T cell immunoreceptor with Ig and ITIM domains, TIGIT)在肿瘤浸润过程中, 在淋巴细胞中高度表达, 可与树突状细胞上的CD155高亲和力结合, 并通过调节树突状细胞的活性间接抑制T细胞的活化[12]. CD155、TIGIT与GI-NENs发生发展及其预后的关系尚有待进一步研究. 本研究采用免疫组化的方法检测168例GI-NENs患者中CD155、TIGIT的表达情况, 分析其临床病理资料及生存数据, 探讨CD155、TIGIT在GI-NENs诊治中的意义.
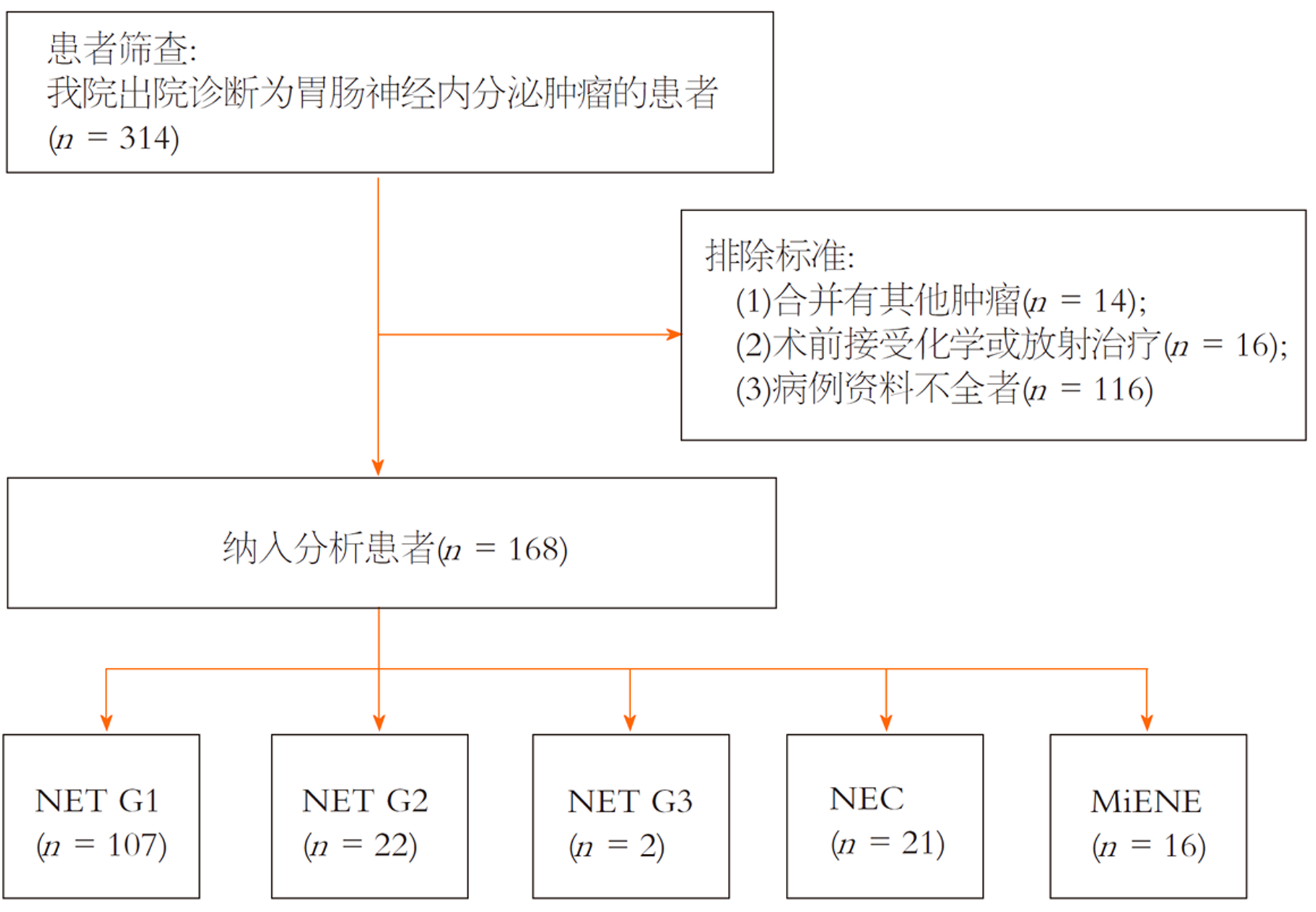
回顾性收集2016-11/2020-08经四川省人民医院诊治的168例GI-NENs患者的临床病理资料. 纳入标准: 经消化内镜或手术切除的原发性肿瘤的患者; 术前未经化学及放射治疗; 有完整的病例资料和病理信息; 病理组织蜡块保存完善. 合并其他类型肿瘤者, 术前接受化学及放射治疗和病例资料不全者排除在外. 根据病理的增殖程度及分化程度, 分为NET G1 107例、NET G2 22例、NET G3 2例、NEC 21例和MiNEN 16例(见图1). 分级标准参照2019年世界卫生组织消化系统肿瘤分类[13].
1.2.1 免疫组化方法: 石蜡切片脱蜡至水: 依次将切片放入二甲苯Ⅰ 15 min, 二甲苯Ⅱ 15 min, 二甲苯Ⅲ 15 min, 无水乙醇Ⅰ 5 min; 无水乙醇Ⅱ 5 min, 85%酒精5 min, 75%酒精5 min, 蒸馏水洗. 抗原修复: 将切片浸入柠檬酸盐缓冲液(pH 6.0), 微波炉高火加热10 min, 停火8 min, 中高火再加热10 min; 冷却后, PBS洗3次, 每次5 min.阻断内源性过氧化物酶: 将切片放入3%双氧水, 室温10 min; PBS洗3次, 每次5 min. 血清封闭: 滴加山羊血清封闭液, 室温20 min. 滴加一抗, 4 ℃过夜. PBS洗3次, 每次5 min, 滴加二抗, 37 ℃ 30 min, PBS洗3次, 每次5 min. DAB显色: 配制新鲜的DAB显色液, 滴加到组织上, 室温显色, 显微镜下控制显色时间, 阳性为棕黄色, 蒸馏水洗涤切片终止显色. 复染细胞核: 苏木素复染3 min, 自来水洗, 清水返蓝后流水冲洗. 脱水封片: 将切片依次置于75%、85%、95%、无水乙醇、二甲苯中分别浸泡10 min, 中性树胶封片.
1.2.2 图像采集及结果判读: 使用显微摄像系统对切片进行图像采集, 每张切片先于100倍下观察全部组织, 再分别采集400倍显微图像, 共采集3张. 采用Image-Pro Plus 6.0图像分析系统测定所采集全部图像的光密度(integrated optical density, IOD)和面积, 并计算每张图像的平均光密度(mean density, MD), 使用3张图像的平均光密度再计算平均数, 得出每例样本的平均光密度. 苏木素染细胞核为蓝色, DAB显出的阳性表达棕黄色.
1.2.3 随访: 患者的联系方式通过病案首页、住院患者随访群等方式查询到, 通过电话、微信、门诊随访等方式进行随访. 随访时间截至2023-09. 从疾病初次确诊时间至当前随访或患者死亡的时间定义为总生存时间.
统计学处理 使用Halo数据分析系统计算每张图像阳性面积占比. 应用SPSS 26.0统计学软件进行数据分析. 符合正态分布的计量资料以均数±标准差(mean±SD)表示, 多组间比较采用单因素方差分析, 两两比较采用SNK-g检验; 绘制受试者操作特征(receiver operating characteristic, ROC)曲线, 计算曲线下面积(area under curve, AUC), 评估CD155和TIGIT与GI-NENs患者预后的相关性, 并确定CD155和TIGIT预测GI-NENs患者预后的最佳截断值. Kaplan-Meier生存曲线、Cox回归进行生存分析; 组间生存分析比较采用Log-rank检验. P<0.05为差异有统计学意义.
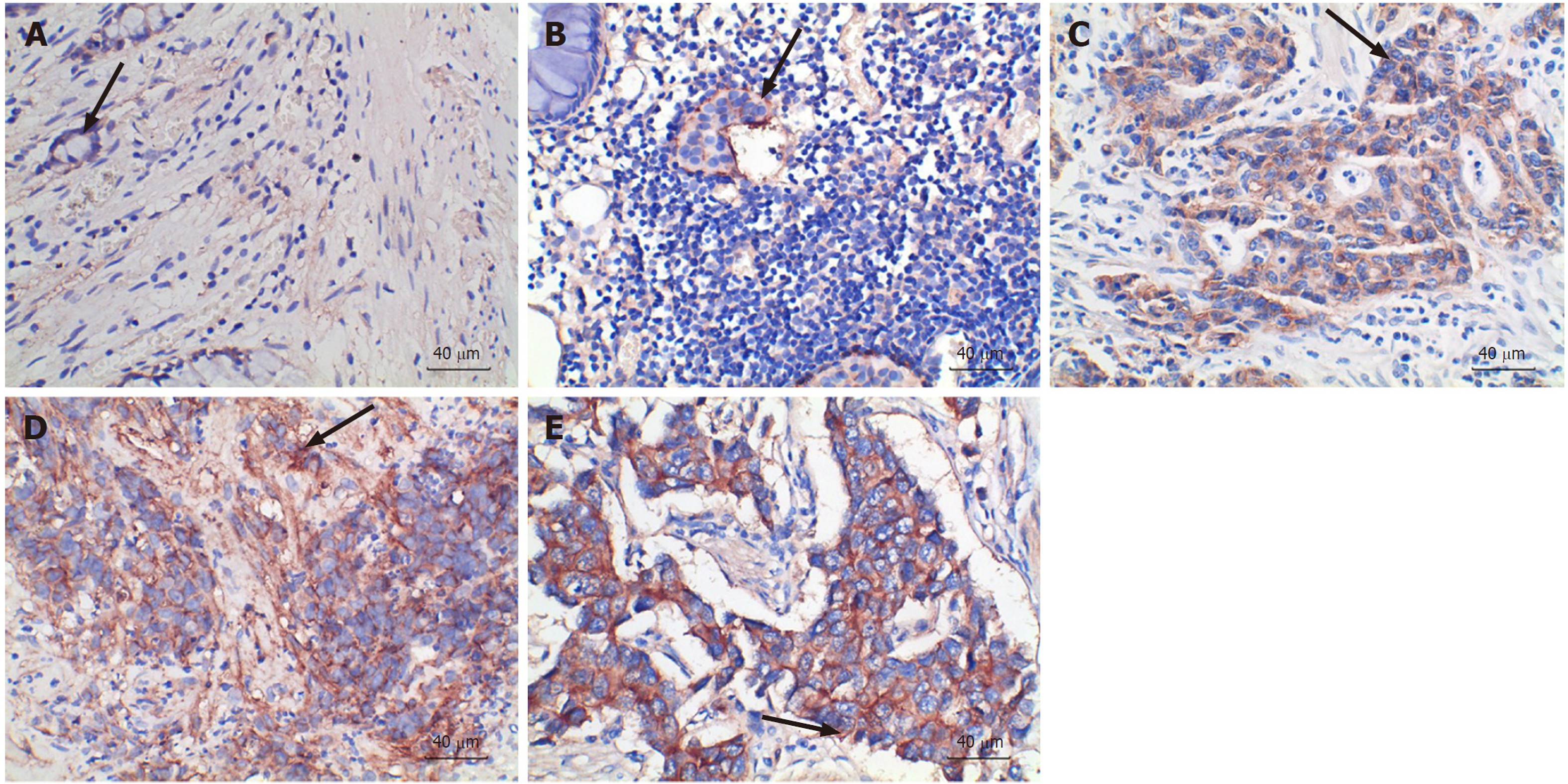
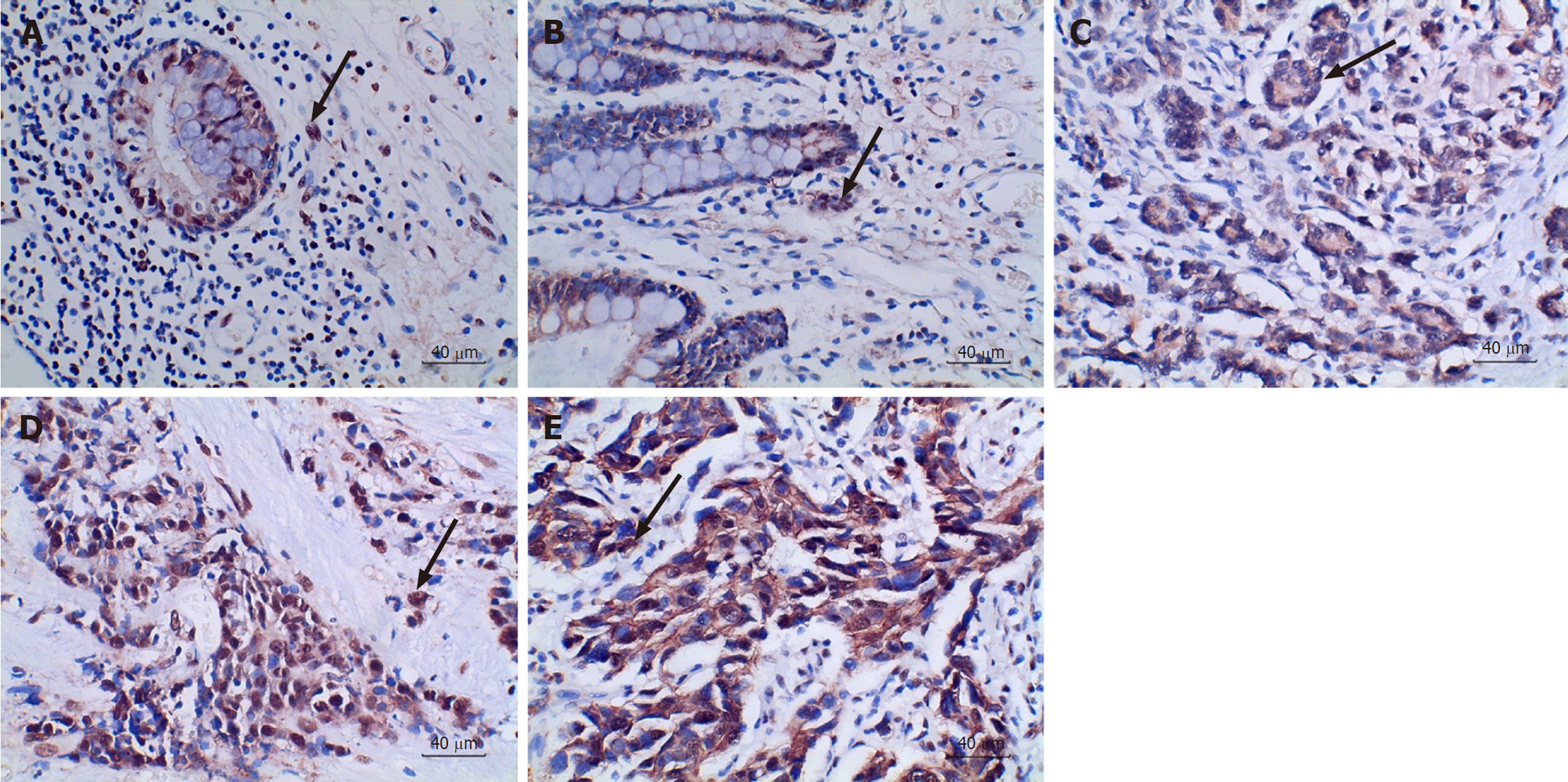
CD155(图2)、TIGIT(图3)主要在细胞质及细胞间质表达, 染色褐色或棕黄色细胞代表阳性, 染色蓝色细胞代表阴性, 底物呈现白色.
G3组由于样本数量较少原因, 不具备统计条件, 故不纳入统计.
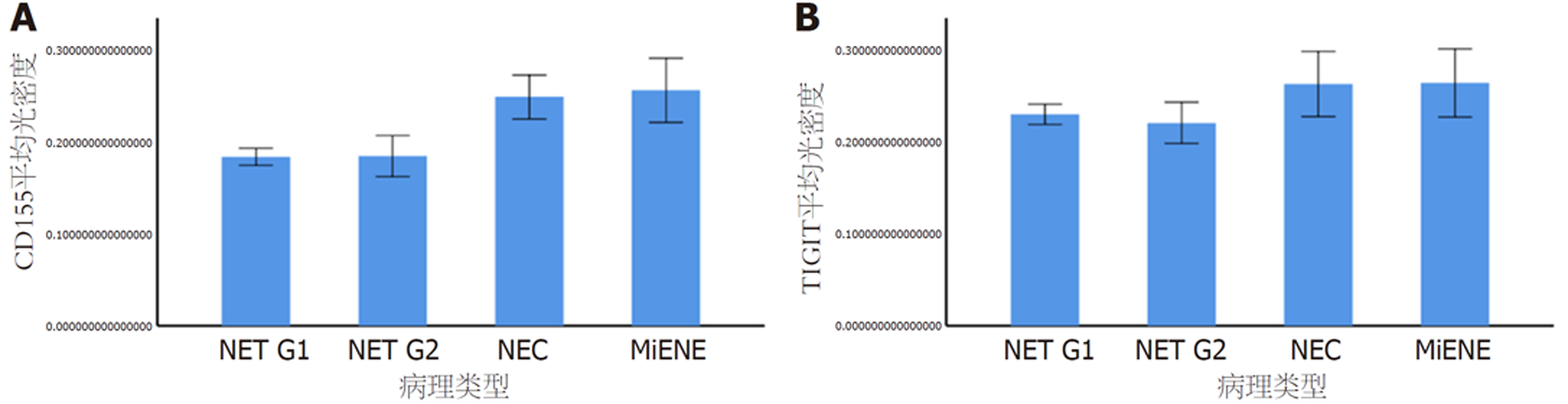
图4显示, GI-NENs组织中CD155的表达量随着病理分级的增高而增高, 与G1、G2组相比, NEC组、MiNEN组肿瘤组织CD155表达量均明显升高; GI-NENs组织中TIGIT的表达量在病理分级中无明显变化趋势, 但与G1、G2组相比, NEC组、MiNEN组肿瘤组织TIGIT表达量均明显升高.
表1显示, 与G1组相比, NEC组、MiNEN组肿瘤组织CD155表达量均明显升高, 具有显著统计学意义(P<0.05); G2组肿瘤组织CD155表达量无明显变化, 不具有统计学意义. 与G2组相比, NEC组、MiNEN组肿瘤组织CD155表达量均明显升高, 具有显著统计学意义(P<0.05). 与NEC组相比, MiNEN组肿瘤组织CD155表达量无明显变化, 不具有统计学意义. 与G1组相比, NEC组、MiNEN组肿瘤组织TIGIT表达量均明显升高, 具有显著统计学意义(P<0.05); G2组肿瘤组织TIGIT表达量无明显变化, 不具有统计学意义. 与G2组相比, NEC组、MiNEN组肿瘤组织TIGIT表达量均明显升高, 具有显著统计学意义(P<0.05). 与NEC组相比, MiNEN组肿瘤组织TIGIT表达量无明显变化, 不具有统计学意义.
患者CD155表达量在年龄、肿瘤位置、肿瘤最大直径、T分期、淋巴结转移、远处转移、TNM分期、Ki-67指数方面比较有统计学差异(P<0.05); 性别与CD155的表达量无统计学意义(见表2).
| 临床病理特征 | n | CD155平均光密度 | 统计量 | P | |
| 性别 | 男 | 97 | 0.2062±0.0629 | t = 1.977 | 0.050 |
| 女 | 71 | 0.1886±0.0484 | |||
| 年龄 | <60岁 | 108 | 0.1893±0.0537 | t = -2.919 | 0.004 |
| ≥60岁 | 60 | 0.2158±0.0612 | |||
| 肿瘤位置 | 胃 | 34 | 0.2481±0.0601 | F = 8.705 | <0.001 |
| 十二指肠 | 19 | 0.2095±0.0544 | |||
| 小肠 | 4 | 0.1786±0.0554 | |||
| 阑尾 | 2 | 0.1528±0.0132 | |||
| 结肠 | 6 | 0.1853±0.0439 | |||
| 直肠 | 103 | 0.1830±0.0492 | |||
| 肿瘤最大直径 | ≤1cm | 101 | 0.1802±0.0464 | t = -5.543 | <0.001 |
| >1cm | 67 | 0.2267±0.0621 | |||
| T分期 | T1-T2 | 128 | 0.1843±0.0490 | t = -6.484 | <0.001 |
| T3-T4 | 40 | 0.2451±0.060 | |||
| 淋巴结转移 | N0 | 131 | 0.1865±0.0541 | t = -5.648 | <0.001 |
| N+ | 37 | 0.2423±0.0491 | |||
| 远处转移 | M0 | 158 | 0.1963±0.0576 | t = -2.209 | 0.029 |
| M1 | 10 | 0.2374±0.0474 | |||
| TNM分期 | Ⅰ-Ⅱ期 | 131 | 0.1858±0.0524 | t = -6.057 | <0.001 |
| Ⅲ-Ⅳ期 | 37 | 0.2449±0.0523 | |||
| Ki-67% | ≤20% | 131 | 0.1828±0.0484 | t = -7.917 | <0.001 |
| >20% | 37 | 0.2555±0.0524 |
患者TIGIT表达量在肿瘤最大直径、T分期、淋巴结转移、TNM分期、Ki-67指数方面比较有统计学差异(P<0.05); 性别、年龄、不同肿瘤位置、远处转移与TIGIT的表达量差异无统计学意义(见表3).
| 临床病理特征 | n | TIGIT平均光密度 | 统计量 | P | |
| 性别 | 男 | 97 | 0.2396±0.0620 | t = 0.830 | 0.407 |
| 女 | 71 | 0.2315±0.0622 | |||
| 年龄 | <60岁 | 108 | 0.2303±0.0589 | t = -1.646 | 0.102 |
| ≥60岁 | 60 | 0.2467±0.0666 | |||
| 肿瘤位置 | 胃 | 34 | 0.2568±0.0734 | F = 2.020 | 0.078 |
| 十二指肠 | 19 | 0.2429±0.0489 | |||
| 小肠 | 4 | 0.2106±0.0333 | |||
| 阑尾 | 2 | 0.3013±0.0388 | |||
| 结肠 | 6 | 0.2017±0.0664 | |||
| 直肠 | 103 | 0.2298±0.0592 | |||
| 肿瘤最大直径 | ≤1cm | 101 | 0.2239±0.0554 | t = -3.221 | 0.002 |
| >1cm | 67 | 0.2546±0.0671 | |||
| T分期 | T1-T2 | 128 | 0.2294±0.0554 | t = -2.590 | 0.010 |
| T3-T4 | 40 | 0.2580±0.0763 | |||
| 淋巴结转移 | N0 | 131 | 0.2300±0.0554 | t = -2.470 | 0.015 |
| N+ | 37 | 0.2581±0.0783 | |||
| 远处转移 | M0 | 158 | 0.2354±0.0612 | t = -0.618 | 0.538 |
| M1 | 10 | 0.2479±0.0762 | |||
| TNM分期 | Ⅰ-Ⅱ期 | 131 | 0.2298±0.0553 | t = -2.533 | 0.012 |
| Ⅲ-Ⅳ期 | 37 | 0.2586±0.0784 | |||
| Ki-67% | ≤20% | 131 | 0.2295±0.0560 | t = -2.652 | 0.009 |
| >20% | 37 | 0.2596±0.0763 |
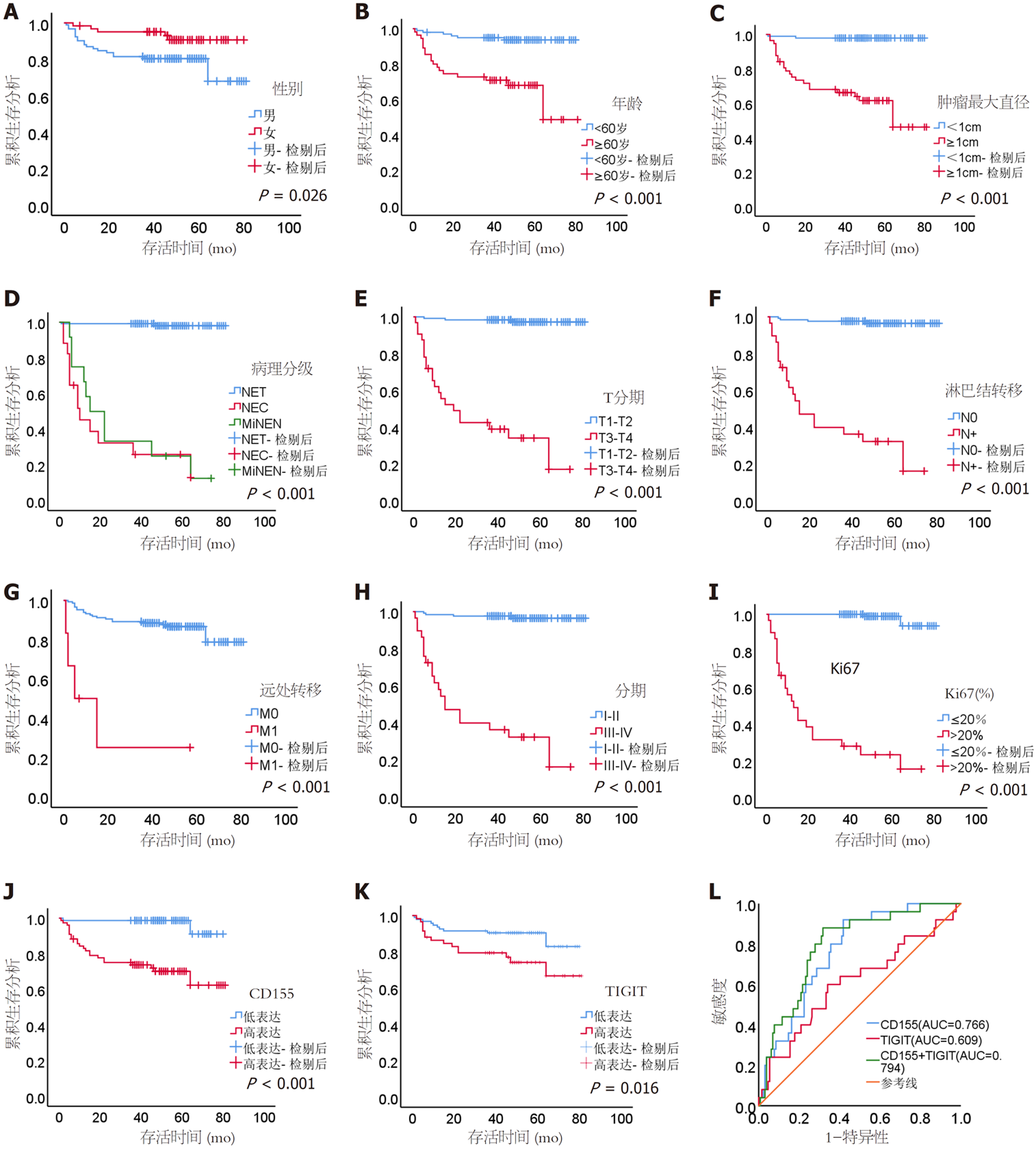
168例GI-NENs患者的随访时间为1-81 mo, 中位随访时间49 mo. 其中GI-NETs、NEC和MiNEN的中位生存时间分别是50 mo、9 mo和18.5 mo. 利用约登指数计算出CD155、TIGIT的最佳截断值, 分为高表达CD155(MD>0.1986)、低表达CD155(MD≤0.1986)、高表达TIGIT(MD>0.2500)、低表达CD155(MD≤0.2500). 利用Kaplan-Meier行单因素生存分析发现, 性别、年龄、肿瘤最大直径、病理分级、T分期、淋巴结转移、远处转移、TNM分期、Ki-67指数、高表达CD155、高表达TIGIT与生存预后较差相关(P<0.05)(见图5A-K). 进一步多因素Cox回归分析, 提示提示病理分级[风险比(hazard ratio, HR) = 2.727]、[95%置信区间(confidence interval, CI): 1.213-6.131]、T分期[HR = 7.552(95%CI: 1.324-43.079)]、远处转移[HR = 12.617(95%CI: 2.786-57.138)]和高表达CD155[HR = 12.441(95%CI: 2.270-68.182)]是患者生存预后差的因素(P<0.05)(见表4). 为了评估CD155、TIGIT对GI-NENs患者预后的预测价值, 进一步绘制ROC曲线, 结果显示CD155的AUC为0.766(95%CI: 0.679-0.853, P<0.001), TIGIT的AUC为0.609(95%CI: 0.479-0.740, P = 0.084), CD155联合TIGIT的AUC为0.794(95%CI: 0.706-0.881, P<0.001), 我们发现CD155联合TIGIT的AUC较单个指标更大(见图5L).
| 变量 | 回归系数 | 标准误 | 瓦尔德 | P | HR | 95%Cl |
| 年龄 | -0.646 | 0.544 | 1.408 | 0.235 | 0.524 | 0.180-1.523 |
| 病理分级 | 1.003 | 0.413 | 5.888 | 0.015 | 2.727 | 1.213-6.131 |
| T分期 | 2.022 | 0.888 | 5.18 | 0.023 | 7.552 | 1.324-43.079 |
| 淋巴结转移 | 0.014 | 0.846 | 0 | 0.986 | 1.015 | 0.193-5.321 |
| 远处转移 | 2.535 | 0.771 | 10.821 | 0.001 | 12.617 | 2.786-57.138 |
| CD155 | 2.521 | 0.868 | 8.436 | 0.004 | 12.441 | 2.270-68.182 |
| TIGIT | -0.598 | 0.494 | 1.464 | 0.226 | 0.55 | 0.209-1.448 |
GI-NENs生长缓慢, 但生物学行为不一, 约有1/4在初次诊断发生转移, 转移灶多位于肝脏[14]. 大部分GI-NETs的发现主要依靠胃肠镜筛查, 并且预后较好. 然而, NEC和MiNEN其恶性程度较高, 易发生远处转移, 总体预后较NET差. 近年来随着群众健康意识提高和临床医师的重视, 更多的GI-NENs患者被发现, 但其发生发展机制以及预后因素的研究较少, 寻找有效的治疗靶点以及精准的预后预测因素, 对GI-NENs的诊疗有着重要的意义.
CD155是类花青素分子家族的第五个成员, 具有脊髓灰质炎病毒受体(poliovirus receptor, PVR)的功能, 因此CD155也被称为连接素样分子-5或PVR. 作为一种免疫球蛋白样粘附分子, CD155参与细胞运动、自然杀伤细胞和T细胞介导的免疫. CD155在人体各种正常组织中几乎不表达或弱表达, 在多种癌症类型的肿瘤细胞上高度上调, 包括结肠癌[4]、胃癌[5]、胰腺癌[6]、肺腺癌[7]、乳腺癌[8]、黑色素瘤[9]、胶质母细胞瘤[10]、原发性食道小细胞癌[11]等. 在本研究中, 我们发现CD155在GI-NENs也有较高的表达, 在不同病理分级中CD155表达有差异, 分级越高, 表达量也升高, 这可能与NEC是一种高度恶性和侵袭性肿瘤有关. 重要的是, 我们的研究结果与其他肿瘤组织类型的研究结果相似, 这表明CD155的表达也可能在GI-NENs的发展和治疗反应中发挥重要作用.
在本研究中我们发现, CD155与肿瘤最大直径、TNM分期、病理分期、病理分级、是否远处转移及淋巴转移有关, 这表明CD155的过表达可能与肿瘤的转移和增殖有关. 此前, Sloan等[10]研究发现, CD155的表达以基质依赖的方式减少了基质粘附、细胞扩散、局灶粘附密度和肌动蛋白应力纤维的数量. 在人类胶质瘤细胞中消耗内源性CD155可抑制其迁移、增加细胞扩散并下调相同的信号通路. NEC和MiNEN是一种高侵袭性肿瘤, 往往显示Ki-67高表达. 在这项研究中, 我们发现CD155的表达与Ki-67表达和肿瘤类型一致, 部分证实了它在肿瘤增殖中的作用. Triki等[8]的研究表明肿瘤细胞质CD155(cyt-CD155)与淋巴管侵袭有关, 而膜CD155(m-CD155)与肿瘤浸润NK细胞的存在密切相关. 本研究中, 我们发现有淋巴结转移的GI-NENs中, 细胞质CD155较阴性组表达量高, 未发现CD155在细胞膜上表达, 表明CD155可能参与了GI-NENs的淋巴结转移过程. Li等[15]的研究表明CD155缺失小鼠分别通过DNAM-1的上调和CD8+ T和NK细胞效应功能的增强减少了肿瘤的生长和转移. CD155缺失的肿瘤细胞也显示出肿瘤生长减缓和转移减少, 这证明了CD155在肿瘤内在作用中的重要性.因此, CD155可能在GI-NENs的增殖和转移过程中扮演重要角色, 但其分子机制还需要进一步研究.
TIGIT是一种抑制性检查点受体, 在肿瘤浸润过程中, 在CD8+T细胞、CD4+T细胞和NK细胞中高度表达[16-18], 可与树突状细胞上的CD155高亲和力结合, 并通过调节树突状细胞的活性间接抑制T细胞的活化[12]. 在这项研究中, 我们发现TIGIT在肿瘤组织中高表达, 而且TIGIT的高表达预示着GI-NENs患者的疾病分期更晚、预后更差. TIGIT最近已成为癌症免疫疗法的一个主要靶点. Wu等[19]发现, CD155/TIGIT信号阻断可逆转头颈部鳞状细胞癌中的T细胞衰竭并增强抗肿瘤能力. 靶向CD155/TIGIT可增强CD8+T细胞反应, 而联合靶向TIGIT和PD-1可进一步增强CD8+T细胞活化[5]. NK细胞是先天性免疫的重要组成部分, 被认为在早期消除癌症和防止转移方面发挥着重要作用[20]. 此外, Zhang等[21]研究发现在几种肿瘤小鼠模型中, TIGIT阻断被证明可防止NK细胞衰竭并促进NK细胞依赖性肿瘤免疫. 在治疗分化较差的肿瘤时, 包括化疗/放疗在内的许多传统治疗策略疗效较差, 然而, 近年来免疫疗法在小细胞肺癌[22]中的应用取得了令人鼓舞的成果. Thibaudin等[23]研究发现联合靶向TIGIT和PD-L1可以重新激活结直肠癌肿瘤中的CD8+T细胞、CD4+T细胞. CD155与TIGIT在GI-NENs表达, 特别是在病理分级较高、分期较晚的患者中高表达, 因此, 阻断CD155与TIGIT之间的相互作用可能是GI-NENs免疫治疗的一个靶点.
在本研究中, 我们发现CD155高表达、病理分级、T分期、远处转移是患者生存预后差的因素, 可预测患者的预后情况. 此前, Yong等[24]发现CD155高表达的乳腺癌患者总生存期较差; Sun等[25]则表明CD155表达是肺腺癌的独立危险因素, CD155高表达的患者总生存期和无进展生存期较短; Zhao等[11]表明CD155表达是原发性食道小细胞癌的独立预后指标, CD155和TIGIT高表达患者的总生存期和无进展生存期明显较短. Triki等[8]的研究发现, 细胞质CD155水平高的患者的总生存期和无进展生存期明显差于低表达的患者, 而膜CD155水平高的患者则预后较好. 本研究与之前报告的结论类似, 然而CD155/TIGIT在肿瘤细胞内及细胞间中的作用, 还需要进一步研究.
综上所述, CD155表达量在病理分级、T分期、淋巴结转移、远处转移、TNM分期、Ki-67指数相关, 病理分级越高, Ki-67指数越高, 分期越晚, 其表达量越高, 提示CD155高表达可能与GI-NENs的增殖和转移有关系. TIGIT表达量在病理分级、T分期、淋巴结转移、TNM分期、Ki-67指数有关, 病理分级越高, Ki-67指数越高, 分期越晚, 其表达量越高, 提示CD155/TIGIT信号通路可能在GI-NENs的增殖和转移过程扮演重要作用, 可能是GI-NENs免疫治疗的一个靶点. GI-NENs的预后与病理分级、T分期、远处转移和CD155高表达有关系, 对患者的预后有一定的预测价值, TIGIT对患者的预后预测价值有限, 但CD155联合TIGIT对患者不良预后的AUC大于两者单用. Kaplan-Meier生存分析显示高表达CD155、TIGIT的GI-NENs患者生存率低于低表达CD155、TIGIT的患者, 说明CD155联合TIGIT对GI-NENs患者的预后具有较好的预测价值. 本研究中NET-G3的患者较少, 原因可能受既往免疫组化的影响以及本研究样本量的不足. 同时随着NENs分级的进一步细化, 有必要将病理切片二次评估肿瘤的分级状态. 由于NEC、MiNEN的细胞来源以及驱动基因和NETs存在明显差异, CD155/TIGIT在异质性高的不同病理分级中的作用仍有待深入研究.
胃肠道神经内分泌肿瘤(gastrointestinal neuroendocrine neoplasm, GI-NENs)的发病率呈持续上升趋势, 其临床表现多样, 部分具有高侵袭性及转移性, 预后差. CD155人体各种正常组织中几乎不表达或弱表达, 在多种癌症类型的肿瘤细胞上高度上调, 参与细胞运动、自然杀伤细胞和T细胞介导的免疫, T细胞免疫球蛋白和ITIM结构域蛋白(T cell immunoreceptor with Ig and ITIM domains, TIGIT)可与树突状细胞上的CD155高亲和力结合, 并通过调节树突状细胞的活性间接抑制T细胞的活化. 分析CD155、TIGIT表达与临床病理特征及预后关系, 探讨GI-NENs免疫治疗有重要的意义.
通过免疫组化检测CD155、TIGIT在GI-NENs中的表达, 分析其与临床病理特征及预后的关系, 为GI-NENs的预后提供帮助, 同时为GI-NENs的免疫治疗提供一个新的方向.
探讨CD155、TIGIT在GI-NENs中的表达量与临床病理特征的关系.
收集2016-11/2020-08经我院诊治的168例GI-NENs患者的临床病理资料, 免疫组化检测CD155、TIGIT的表达量, 分析其与性别、年龄、肿瘤位置、肿瘤最大直径、T分期、淋巴结转移、远处转移、TNM分期、Ki-67指数以及预后的关系.
CD155和TIGIT在病理分级高的GI-NENs组织中, 表达量也较高, 差异有统计学意义(P<0.05); CD155表达量与年龄、肿瘤位置、肿瘤最大直径、病理分级、T分期、淋巴结转移、远处转移、TNM分期、Ki-67指数有关(P<0.05); TIGIT表达量与肿瘤最大直径、病理分级、T分期、淋巴结转移、TNM分期、Ki-67指数有关. 高表达CD155、高表达TIGIT与GI-NENs生存预后较差相关(P<0.05), CD155联合TIGIT的绘制受试者操作特征曲线下面积为0.794(95%置信区间: 0.706-0.881, P<0.001).
CD155和TIGIT表达量在不同分级、分期的GI-NENs患者存在差异, 可能参与了GI-NENs的发生及进展的调控过程, 高表达可能提示预后不佳.
高表达CD155、高表达TIGIT与GI-NENs生存预后较差相关, 为临床医生对GI-NENs的预后提供帮助. CD155与TIGIT表达量与肿瘤最大直径、病理分级、T分期、淋巴结转移、远处转移、TNM分期、Ki-67指数有关, 提示CD155/TIGIT信号通路可能在GI-NENs的增殖和转移过程扮演重要作用, 可能是GI-NENs免疫治疗的一个靶点. 但本研究未进行细胞和动物实验, CD155/TIGIT信号通路在GI-NENs的作用仍需要进一步研究和探索.
学科分类: 胃肠病学和肝病学
手稿来源地: 四川省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Dasari A, Shen C, Halperin D, Zhao B, Zhou S, Xu Y, Shih T, Yao JC. Trends in the Incidence, Prevalence, and Survival Outcomes in Patients With Neuroendocrine Tumors in the United States. JAMA Oncol. 2017;3:1335-1342. [PubMed] [DOI] |
| 2. | Chang JS, Chen LT, Shan YS, Chu PY, Tsai CR, Tsai HJ. An updated analysis of the epidemiologic trends of neuroendocrine tumors in Taiwan. Sci Rep. 2021;11:7881. [PubMed] [DOI] |
| 3. | Chauhan A, Kohn E, Del Rivero J. Neuroendocrine Tumors-Less Well Known, Often Misunderstood, and Rapidly Growing in Incidence. JAMA Oncol. 2020;6:21-22. [PubMed] [DOI] |
| 4. | Masson D, Jarry A, Baury B, Blanchardie P, Laboisse C, Lustenberger P, Denis MG. Overexpression of the CD155 gene in human colorectal carcinoma. Gut. 2001;49:236-240. [PubMed] [DOI] |
| 5. | He W, Zhang H, Han F, Chen X, Lin R, Wang W, Qiu H, Zhuang Z, Liao Q, Zhang W, Cai Q, Cui Y, Jiang W, Wang H, Ke Z. CD155T/TIGIT Signaling Regulates CD8(+) T-cell Metabolism and Promotes Tumor Progression in Human Gastric Cancer. Cancer Res. 2017;77:6375-6388. [PubMed] [DOI] |
| 6. | Nishiwada S, Sho M, Yasuda S, Shimada K, Yamato I, Akahori T, Kinoshita S, Nagai M, Konishi N, Nakajima Y. Clinical significance of CD155 expression in human pancreatic cancer. Anticancer Res. 2015;35:2287-2297. [PubMed] |
| 7. | Nakai R, Maniwa Y, Tanaka Y, Nishio W, Yoshimura M, Okita Y, Ohbayashi C, Satoh N, Ogita H, Takai Y, Hayashi Y. Overexpression of Necl-5 correlates with unfavorable prognosis in patients with lung adenocarcinoma. Cancer Sci. 2010;101:1326-1330. [PubMed] [DOI] |
| 8. | Triki H, Charfi S, Bouzidi L, Ben Kridis W, Daoud J, Chaabane K, Sellami-Boudawara T, Rebai A, Cherif B. CD155 expression in human breast cancer: Clinical significance and relevance to natural killer cell infiltration. Life Sci. 2019;231:116543. [PubMed] [DOI] |
| 9. | Bevelacqua V, Bevelacqua Y, Candido S, Skarmoutsou E, Amoroso A, Guarneri C, Strazzanti A, Gangemi P, Mazzarino MC, D'Amico F, McCubrey JA, Libra M, Malaponte G. Nectin like-5 overexpression correlates with the malignant phenotype in cutaneous melanoma. Oncotarget. 2012;3:882-892. [PubMed] [DOI] |
| 10. | Sloan KE, Stewart JK, Treloar AF, Matthews RT, Jay DG. CD155/PVR enhances glioma cell dispersal by regulating adhesion signaling and focal adhesion dynamics. Cancer Res. 2005;65:10930-10937. [PubMed] [DOI] |
| 11. | Zhao K, Ma L, Feng L, Huang Z, Meng X, Yu J. CD155 Overexpression Correlates With Poor Prognosis in Primary Small Cell Carcinoma of the Esophagus. Front Mol Biosci. 2020;7:608404. [PubMed] [DOI] |
| 12. | Yu X, Harden K, Gonzalez LC, Francesco M, Chiang E, Irving B, Tom I, Ivelja S, Refino CJ, Clark H, Eaton D, Grogan JL. The surface protein TIGIT suppresses T cell activation by promoting the generation of mature immunoregulatory dendritic cells. Nat Immunol. 2009;10:48-57. [PubMed] [DOI] |
| 13. | Nagtegaal ID, Odze RD, Klimstra D, Paradis V, Rugge M, Schirmacher P, Washington KM, Carneiro F, Cree IA; WHO Classification of Tumours Editorial Board. The 2019 WHO classification of tumours of the digestive system. Histopathology. 2020;76:182-188. [PubMed] [DOI] |
| 14. | Zhang M, Zhao P, Shi X, Zhao A, Zhang L, Zhou L. Clinicopatholo-gical features and prognosis of gastroenteropancreatic neuroendo-crine neoplasms in a Chinese population: a large, retrospective single-centre study. BMC Endocr Disord. 2017;17:39. [PubMed] [DOI] |
| 15. | Li XY, Das I, Lepletier A, Addala V, Bald T, Stannard K, Barkauskas D, Liu J, Aguilera AR, Takeda K, Braun M, Nakamura K, Jacquelin S, Lane SW, Teng MW, Dougall WC, Smyth MJ. CD155 loss enhances tumor suppression via combined host and tumor-intrinsic mechanisms. J Clin Invest. 2018;128:2613-2625. [PubMed] [DOI] |
| 16. | Song Y, Wang B, Song R, Hao Y, Wang D, Li Y, Jiang Y, Xu L, Ma Y, Zheng H, Kong Y, Zeng H. T-cell Immunoglobulin and ITIM Domain Contributes to CD8(+) T-cell Immunosenescence. Aging Cell. 2018;17. [PubMed] [DOI] |
| 17. | Josefsson SE, Beiske K, Blaker YN, Førsund MS, Holte H, Østenstad B, Kimby E, Köksal H, Wälchli S, Bai B, Smeland EB, Levy R, Kolstad A, Huse K, Myklebust JH. TIGIT and PD-1 Mark Intratumoral T Cells with Reduced Effector Function in B-cell Non-Hodgkin Lymphoma. Cancer Immunol Res. 2019;7:355-362. [PubMed] [DOI] |
| 18. | Lupo KB, Matosevic S. CD155 immunoregulation as a target for natural killer cell immunotherapy in glioblastoma. J Hematol Oncol. 2020;13:76. [PubMed] [DOI] |
| 19. | Wu L, Mao L, Liu JF, Chen L, Yu GT, Yang LL, Wu H, Bu LL, Kulkarni AB, Zhang WF, Sun ZJ. Blockade of TIGIT/CD155 Signaling Reverses T-cell Exhaustion and Enhances Antitumor Capability in Head and Neck Squamous Cell Carcinoma. Cancer Immunol Res. 2019;7:1700-1713. [PubMed] [DOI] |
| 20. | Jewett A, Kos J, Fong Y, Ko MW, Safaei T, Perišić Nanut M, Kaur K. NK cells shape pancreatic and oral tumor microenvironments; role in inhibition of tumor growth and metastasis. Semin Cancer Biol. 2018;53:178-188. [PubMed] [DOI] |
| 21. | Zhang Q, Bi J, Zheng X, Chen Y, Wang H, Wu W, Wang Z, Wu Q, Peng H, Wei H, Sun R, Tian Z. Blockade of the checkpoint receptor TIGIT prevents NK cell exhaustion and elicits potent anti-tumor immunity. Nat Immunol. 2018;19:723-732. [PubMed] [DOI] |
| 22. | Nishio M, Sugawara S, Atagi S, Akamatsu H, Sakai H, Okamoto I, Takayama K, Hayashi H, Nakagawa Y, Kawakami T. Subgroup Analysis of Japanese Patients in a Phase III Study of Atezolizumab in Extensive-stage Small-cell Lung Cancer (IMpower133). Clin Lung Cancer. 2019;20:469-476.e1. [PubMed] [DOI] |
| 23. | Thibaudin M, Limagne E, Hampe L, Ballot E, Truntzer C, Ghiringhelli F. Targeting PD-L1 and TIGIT could restore intratumoral CD8 T cell function in human colorectal cancer. Cancer Immunol Immunother. 2022;71:2549-2563. [PubMed] [DOI] |
| 24. | Yong H, Cheng R, Li X, Gao G, Jiang X, Cheng H, Zhou X, Zhao W. CD155 expression and its prognostic value in postoperative patients with breast cancer. Biomed Pharmacother. 2019;115:108884. [PubMed] [DOI] |
| 25. | Sun Y, Luo J, Chen Y, Cui J, Lei Y, Cui Y, Jiang N, Jiang W, Chen L, Chen Y, Kuang Y, Tang K, Ke Z. Combined evaluation of the expression status of CD155 and TIGIT plays an important role in the prognosis of LUAD (lung adenocarcinoma). Int Immunopharmacol. 2020;80:106198. [PubMed] [DOI] |