修回日期: 2024-11-08
接受日期: 2024-12-17
在线出版日期: 2024-12-28
随着对糖生物学的不断研究, 发现越来越多的疾病与糖萼相关. 糖萼根据所在部位不同, 大致可分为内皮糖萼与上皮糖萼. 在过去的研究中多为内皮糖萼, 本综述主要介绍肠上皮糖萼的生物学特性、其降解机制、与肠道不同疾病的生物相关性以及模拟糖萼的纳米颗粒文库对器官的靶向递送药物等方面进行分析, 以期为肠上皮糖萼在肠道疾病中潜在的诊断标志物以及治疗靶点的研究提供理论依据.
核心提要: 糖萼存在与人体中的每个细胞表层, 发挥其特定的生物学特性. 肠上皮糖萼在维持肠道黏膜完整性中发挥至关重要的作用, 与肠道菌群相互作用正向或负向的影响人体, 同时根据糖萼的结构模拟的纳米颗粒在众多疾病的诊疗中有广阔应用前景. 本文从肠上皮糖萼的结构及功能与炎症性肠病、结直肠癌、肠易激综合征的内在联系进行综述.
引文著录: 高建伟, 刘艳迪, 靳明星. 肠上皮糖萼与肠道疾病. 世界华人消化杂志 2024; 32(12): 887-896
Revised: November 8, 2024
Accepted: December 17, 2024
Published online: December 28, 2024
With the continuous research on glycobiology, more and more diseases are found to be associated with the glycocalyx. Glycocalyx can be categorized as endothelial glycocalyx and epithelial glycocalyx. Past studies mostly target endothelial glycocalyx, and this review focuses on the structure and function of intestinal epithelial glycocalyx, its degradation mechanism and biological relevance to different diseases of the intestinal tract, as well as the targeted delivery of drugs to organs by nanoparticle libraries mimicking the glycocalyx, in order to provide a theoretical basis for the study of potential diagnostic markers and therapeutic targets of intestinal epithelial glycocalyx in intestinal diseases.
- Citation: Gao JW, Liu YD, Jin MX. Intestinal epithelial glycocalyx and intestinal disease. Shijie Huaren Xiaohua Zazhi 2024; 32(12): 887-896
- URL: https://www.wjgnet.com/1009-3079/full/v32/i12/887.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v32.i12.887
糖萼: 存在与人体中的每个细胞的表层-内皮细胞、免疫细胞、肌肉细胞、血细胞、神经元和所有其他细胞. 糖萼构成的关键单位是各种单糖, 若单糖以多种方式连接形成糖共轭物或糖胺聚糖(glycosaminoglycans, GAGs); 与蛋白质相连, 从而产生糖蛋白和蛋白多糖(proteoglycans, PGs); 与脂质, 从而产生糖脂. 因此, 糖萼是细胞表面存在的全部GAGs、PGs、糖蛋白和糖脂的总称[1]. 根据所在部位不同, 可大致分为在血管内皮上的内皮糖萼(endothelial glycocalyx, eGCX)和在肠道上皮的肠上皮糖萼, 在过去的研究中多为eGCX, 它覆盖于血管内皮细胞管腔侧的多糖蛋白复合物, 其在调节血管通透性、炎症以及剪应力的机械传导等生理功能中起重要作用[2]. 另有研究表明[3]肠道黏膜是位于消化道内的一层薄膜, 是防止有害微生物、毒素和抗原进入血液的屏障, 而肠上皮糖萼在维持肠道黏膜屏障中起到重要支持作用.本文主要介绍了肠上皮糖萼的结构及功能, 与肠道菌群及黏膜屏障的关系, 分析了肠上皮糖萼与炎症性肠病(inflammatory bowel disease, IBD)、结直肠癌(colorectal cancer, CRC)、肠易激综合征(irritable bowel syndrome, IBS)的相关性以及模拟糖萼的纳米颗粒文库对器官的靶向递送药物等, 为肠上皮糖萼在肠道疾病中的潜在诊断和治疗提供理论依据.
eGCX主要由与脂质相连的寡糖链、内在蛋白和细胞膜吸收的外周蛋白组成, 大约 50年前, Luft[4]已经使用透射电镜观察到了eGCX, 它主要包括为GAGs、PGs、糖蛋白、及血浆蛋白等组成. 在糖蛋白、PGs中的组成也各不相同, 其组成型膜糖缀合物结构的多样性, 决定了糖萼的广泛生物学功能[5].
GAGs主要包括: 肝素/硫酸乙酰肝素、透明质酸(hyaluronic acid, HA)、硫酸软骨素、硫酸皮肤素硫酸角质素五大类[6]. 蛋白聚糖由一种或多种GAGs与一个核心蛋白连接组成的特殊糖蛋白, 是糖萼的核心蛋白, 组成糖萼的骨架[7]. 其中主要包括多配体聚糖-1(Syndecan-1)、磷脂酰肌醇聚糖及唾液酸[8].
eGCX具有物理屏障、抗炎、抗凝、参与细胞信号转导等多种作用. 它在多种疾病中发挥重要功能与心血管疾病、肿瘤、脓毒症、新型冠状病毒感染、眼表感染、糖尿病、缺血再灌注损伤、系统性红斑狼疮、强直性脊柱炎、IBD、创伤、炎症等众多相关[9]
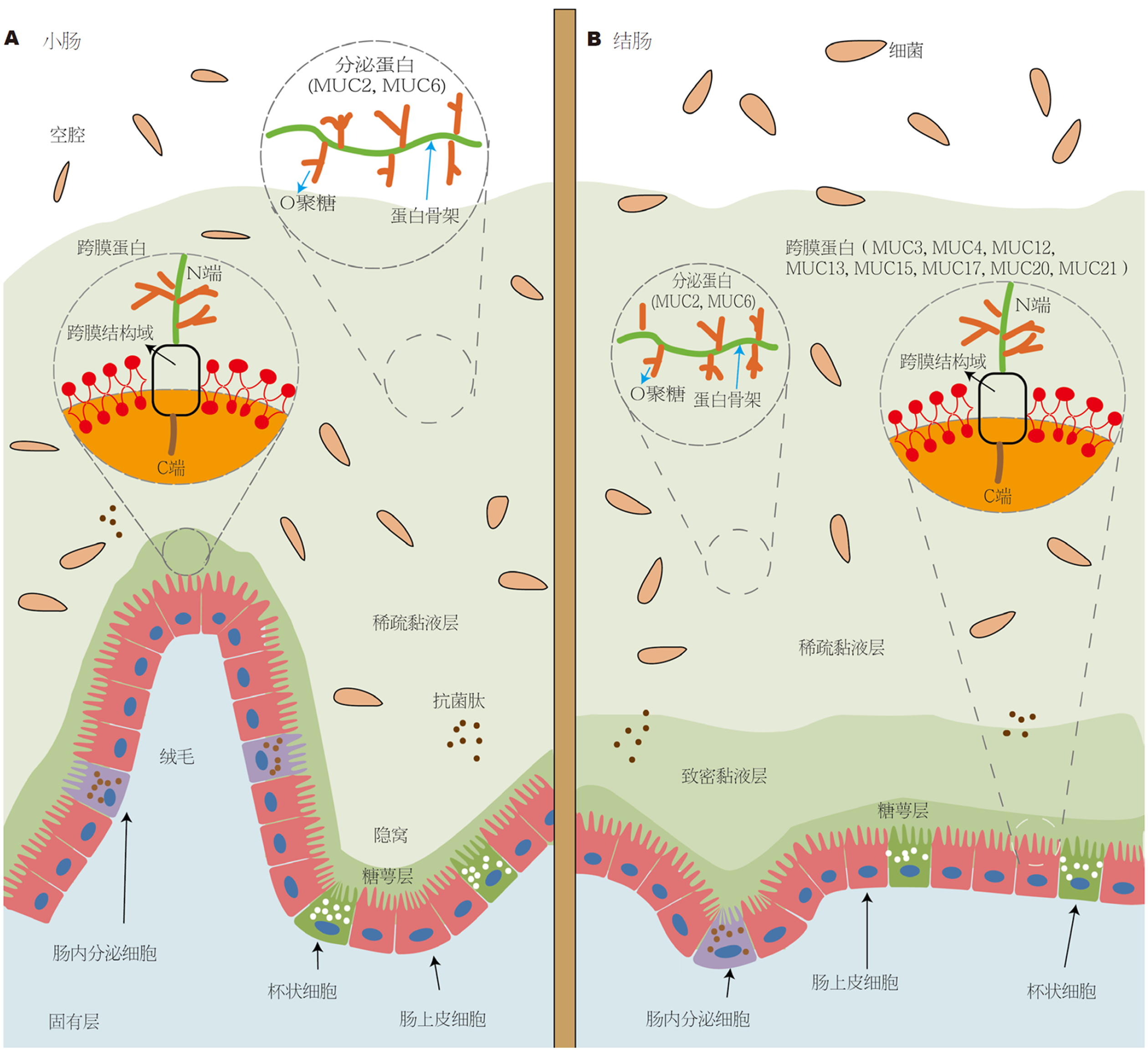
肠上皮糖萼的组成: 肠上皮糖萼在可视化成像中为一层均匀的致密丝状物质, 被肠上皮细胞的微绒毛包围, 是顶端表面的一层高度糖基化的膜黏蛋白组成的致密糖萼[5]. 黏蛋白(mucoprotein, MUC)分为跨模型和分泌型, 分泌型包括MUC2、MUC5、MUC6等为黏液层提供结构骨架的黏蛋白, 跨模型包括MUC1、MUC3、MUC4、MUC12、MUC13、MUC15、MUC17等(形成覆盖底层上皮细胞的糖萼层的黏蛋白), 它通常由两个亚基组成; 高度糖基化且较大的细胞外亚基和较短的亚基由一个胞质区室、一个跨膜结构域和细胞外结构域组成. 细胞外蛋白骨架包含不同长度的串联重复单元, 这些单元由氨基酸脯氨酸、丝氨酸和苏氨酸组成, 它们为O-连接寡糖产生结合位点. 这种蛋白质骨架和O-连接聚糖结构也存在于分泌型黏蛋白中[10]. 见图1. 黏膜屏障的组成: 肠黏膜屏障是抵御病原体、毒素有害物质的主要防线. 它由物理、化学、免疫、微生物屏障组成, 而肠道物理屏障是其他黏膜屏障的结构基础[11], 它由黏液、肠上皮糖萼和肠上皮细胞组成. 其中肠上皮细胞主要包括杯状细胞、潘氏细胞、M细胞和肠内分泌细胞, 可分泌黏液、抗菌蛋白和分泌的免疫球蛋A[12]. 物理屏障中黏液层和糖萼最为重要, 他们主要都是由杯状细胞分泌的黏蛋白组成.
肠上皮糖萼与黏膜屏障的关系. 黏膜层在整个胃肠道中, 是由称为黏蛋白的高度糖基化蛋白质组成的独特黏液层, 在为食物的通过提供润滑、参与细胞信号通路和保护宿主上皮免受共生微生物和入侵病原体以及毒素和其他环境刺激物的侵害方面发挥着至关重要的作用[13]. 但胃结肠与小肠的黏液层特点的不同, 胃和结肠包含双层黏液, 而小肠为单层黏液. 这两层可分为致密的内层和稀疏的外层. 这个稀疏的外层也可以被细菌穿透, 而致密的内层不被细菌穿透. 小肠只包含一层松散的黏液, 细菌可以穿透[14]. 令人感兴趣的是肠上皮糖萼, 它位于黏液层与上皮细胞层之间, 充当分泌的黏液层和上皮之间的屏障. 糖萼是一层动态且脆弱的物质, 还包含特定的水解酶和糖基转移酶以及蛋白质载体, 同时它具有亲水性可以作为一层物理屏障隔绝外部毒素、病原体等对肠上皮细胞的破坏[15].
总而言之, 肠黏膜屏障与肠上皮细胞糖萼的关系是相辅相成的, 上皮细胞中的杯状细胞产生跨膜黏蛋白组成了上皮糖萼, 同时上皮糖萼直接保护了上皮细胞免受细菌、病原体和毒素等多种物质的破坏.
肠道是一个动态而复杂的系统,肠道黏膜屏障的完整性在维持其稳定方面发挥了重要作用. 肠道物理屏障对其他类型的黏膜屏障有支持作用, 而黏液层和肠上皮糖萼层发挥关键作用[12]. (1)肠上皮糖萼的功能首先确保肠上皮细胞膜对蛋白水解降解起保护作用, 与外界细菌毒物的物理屏障作用; (2)此外, 外表面膜上表现出的特异性糖基模式参与细胞识别和黏附, 参与细胞内信号传导[16], 肠上皮糖萼可能发挥类似于抗原的关键作用, 但也可以作为激素、干扰素、凝视素、病原体的受体, 并可能导致周转过程或分子运输.
肠上皮糖萼作为黏膜屏障的一部分, 在维持肠道黏膜屏障发挥重要支持作用. 其保护机制: Honigfort等[17]研究发现: 肠上皮糖萼以大小和密度依赖性方式抑制凝集素(SNA)和病毒(H1N1)黏附的速率, 这与目前认为黏蛋白提供抵御病原体的保护屏障的观点一致. 但与我们直觉相反, 增加黏蛋白模拟物的密度增强了结合的凝集素和病毒的保留. 因此表明聚糖靶向病原体可能利用黏蛋白的生物物理和生物力学特性来克服黏膜糖萼屏障, 但具体机制有待进一步发现.
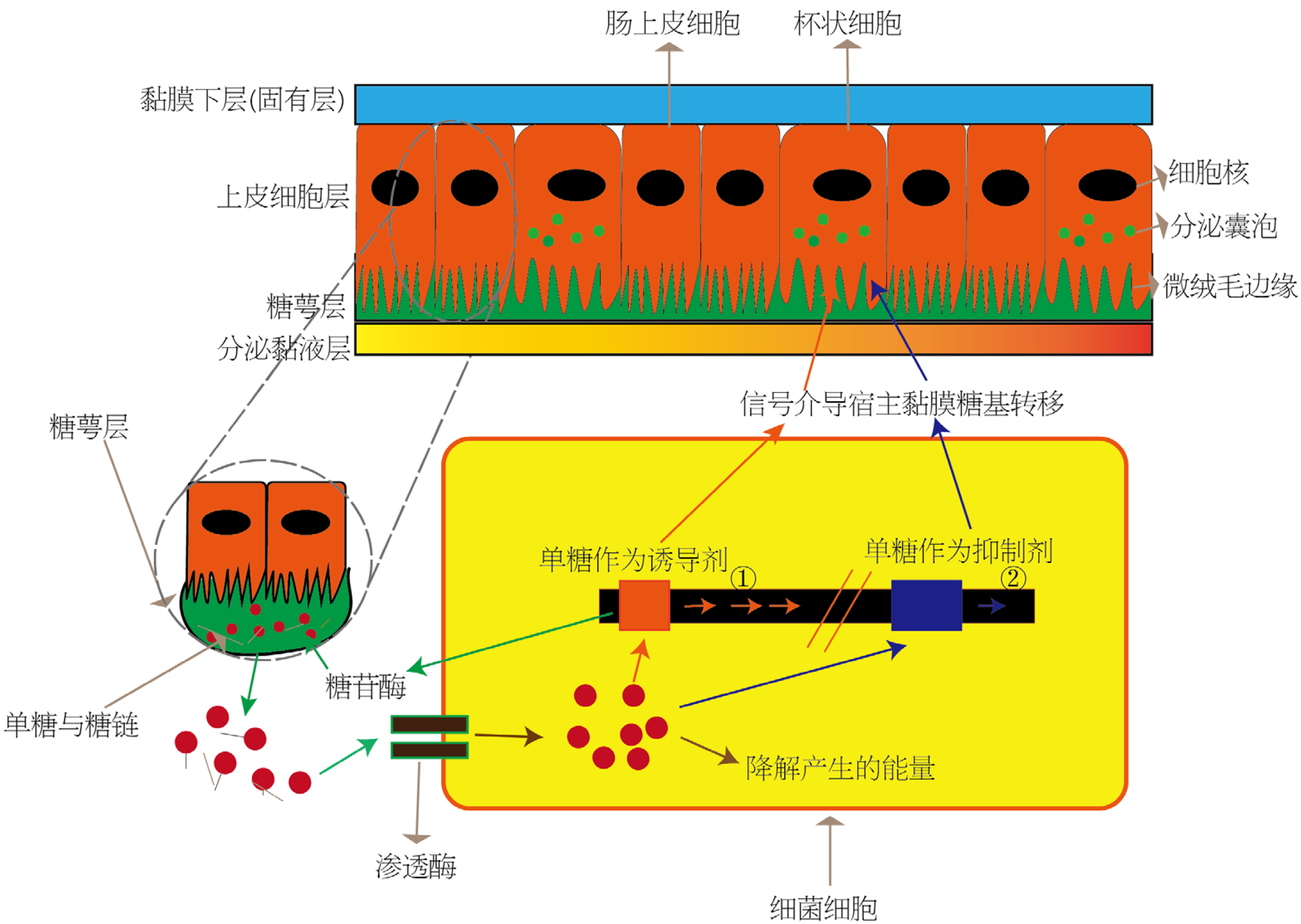
正常情况下肠道的微生物种类及数量动态变化中相互平衡, 这对维持和调节肠黏膜屏障的功能至关重要. 菌群通过释放抗菌物质来提高对致病菌的抵抗力, 另一方面, 肠道微生物组限制了肠道免疫系统的过度反应, 以保证免疫耐受和体内平衡[18]. 根据聚糖立法了解细菌与肠上皮糖萼的相互影响, 图2[19]是众多细菌基因中一个代表性的细菌细胞, 显示了其中2个基因对糖萼的影响. 一个基因编码的酶释放(糖苷酶)并摄取存在于糖萼和分泌黏液中的单个单糖, 以及降解单个单糖以进入已知能量产生途径的酶; 另一个编码化学信号分子的基因, 所述化学信号分子分泌并作用于宿主黏膜上皮细胞以诱导糖萼的生物合成. 见图2.
另外Koropatkin等[20]研究发现共生菌有效利用宿主黏蛋白, 释放的单糖在细菌代谢中产生短脂肪酸, 乙酸盐、丙酸盐和丁酸盐. 短脂肪酸通过内黏液层扩散回去, 并将喂养局部上皮细胞, 并在一定程度上喂养身体. 同时膳食和内源性聚糖丰度的波动, 加上这些分子之间巨大的化学变化, 创造了肠道微生物增殖的动态和异质环境. Jakobsson等[21]研究证明不同微生物群对肠黏膜屏障有着不同的影响, 以此影响人体的健康和疾病. 此外, Yamamoto等[22]研究大鼠发现消化道中糖萼的特殊糖表达非常重要, 因为它为附着在上皮细胞上提供了细菌凝集素的可能配体, 因此糖的表达在消化道的各个部分之间各不相同. 这些位点差异可能反映了大鼠消化道中常驻细菌种类的差异.
由此可推测菌群多样性可能与肠上皮糖萼相关, 为未来肠道菌群研究可能提供新思路. 总之人体与外界可能通过细菌与肠上皮糖萼中的成分相互影响, 以维持黏膜屏障的完整性和肠道菌群的多样性.
肠上皮糖萼在维持肠道物理黏膜完整性中至关重要, 降解增多的可能影响因素及机制.
肠上皮糖萼的降解可能是由管腔细菌驱动的. 肠道病原体(如鼠伤寒沙门氏菌)有水解酶, 可以分解糖萼的聚糖并突破上皮. Arabyan等[23]研究中发现: 沙门氏菌含有47中糖基水解酶(glycoside hydrolases, GH), 其中的两种酶降解宿主糖萼功能较强, 同时宿主细胞在微生物聚糖降解过程中修饰自身的聚糖, 上皮细胞和病原体之间复杂的分子相互作用会导致结合改变, 但如果细菌具有适当的GH可以克服聚糖而占优势, 则感染会继续进行. 另一种机制: 生物鞭毛(微生物毒力的代表)与肠上皮糖萼接触. 这种接触导致糖萼的破坏, 从而导致传导至上皮细胞-细胞连接的信号缺陷, 连接处分解, 屏障不再维持[24]. 另外肠菌群失调或小肠细菌过度生长, 以及可能更多的肠上皮糖萼降解. 同时有研究表明, 细菌脂多糖会破坏糖萼层完整性, 导致通透性增加, 毒素、病原体等物质入血加重机体炎症反应及氧化应激. MUC17是肠上皮糖萼重要的组成部分, 它可抑制革兰氏阴性细菌释放脂多糖, 阻止细菌入血. 同时有研究表明: 白细胞介素-22促进断奶期间出生后小肠中MUC17糖萼屏障的形成[25].
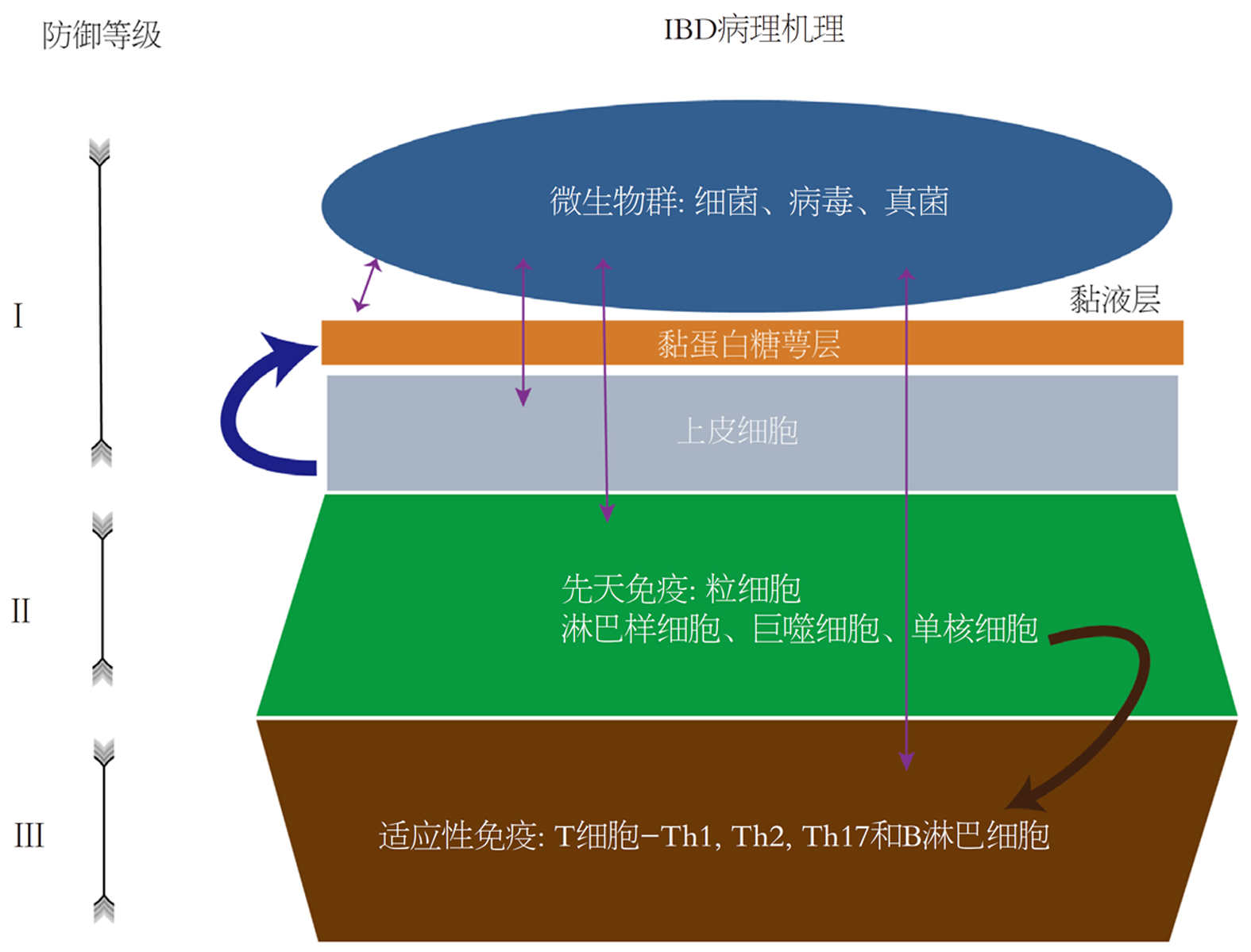
IBD是一组以胃肠道慢性非感染性炎症反应为主要特征的自身免疫性疾病, 其在发达国家及发展中国家的患病率不断增加[31]. 克罗恩病(Crohn's disease, CD)和溃疡性结肠炎(ulcerative colitis, UC)都可以解释为一种慢性病, 其中微生物群占主导地位并成功缓慢侵入宿主结构[32], 从而激活屏障的所有防御水平, 引起炎症反应, 见图3[33].
黏膜屏障缺损: IBD的具体发病机制仍不明确. 但有更多证据表明, 黏膜屏障缺损可能是始动因素, 其中肠上皮糖萼层在黏液层与上皮层之间起屏障作用. Johansson等[34]研究的葡萄糖硫酸钠诱导的鼠模型中, 发现黏液层减少及黏膜通透性增加导致微生物到达肠上皮细胞, 这种早期细菌入侵可能在IBD发病中其关键作用. 近年来, CD中肠黏膜屏障通透性的增加发生在临床复发之前. CD患者的一级亲属发现肠道通透性增加, 这些健康的一级亲属大多最终可能会发展成IBD[35]. 另有研究证明了CD患者非发炎回肠中糖萼层也存在破坏, 糖萼的组成成分MUC17生物合成或运输缺陷是炎症之前的早期上皮缺陷[36]. 另外在Alipour等[37]中发现表明, 在小儿UC中即使在没有炎症部位, 受UC影响的肠道也存在潜在缺陷, 由此可推测可能是由全身性黏膜屏障缺陷伴异常细菌定植引起的, 并且这些变化先于并可能促进炎症. 人类遗传学表明, 由于潘氏细胞、防御素和黏液缺陷引起的黏膜反应中的许多基本缺陷是原发性的[33]. 另外杯状细胞分泌的MUC4是一种跨膜黏蛋白, 是糖萼的重要组成部分, Das等[38]研究表明: 缺乏MUC4的小鼠表现出对DSS结肠炎的抵抗力增强, 重要的机制可能是缺乏Muc4引起黏蛋白Muc2、Muc3的代偿性上调引起对炎症抵抗性, 证明Muc4在驱动IBD和IBD相关肿瘤发生中的作用. Buisine等[39]在CD患者的病理切片中发现组成糖萼的跨膜黏蛋白MUC3和MUC4以及分泌的黏蛋白MUC5B的基因表达降低, 这表明发生局部炎症时, 可能已有肠上皮糖萼层的损伤. 因此糖萼层的黏蛋白作为先天防御成分的区域特异性作用, 这些成分在宿主上皮和肠道微生物群之间创造了一个关键界面. 总之上述研究证明黏膜屏障的缺损在IBD的发展中至关重要.
黏膜屏障缺损与菌群失调的关系: IBD的菌群失调亦是公认的致病因素, 但与黏膜屏障缺损的关系有待进一步研究. 2002年研究中对照组和IBD患者之间的黏膜微生物群存在根本差异. 在患病的黏膜中, 有高浓度的细菌以厚细菌带的形式附着在糖萼上, 而在对照中, 黏膜含有少量细菌[40]. 根据前文的聚糖立法原则, 糖萼与肠道细菌相互影响, 另有研究证明糖萼层的MUC17可实现两个目的: 形成阻断细菌的糖萼并调节宿主对细菌的选择[36]. Raygoza Garay等[41]证明肠道微生物组组成与CD的未来发作有关, 它是CD发病机制的潜在贡献者细菌. 在UC和CD的微生物学也不同, 但其特点是细菌多样性和丰富度降低. 在IBD中, 上皮上方的黏液层被细菌污染, 免疫反应以抗菌反应为主, 菌群失调同时破坏黏膜层. 黏膜屏障缺陷与异常菌群的鸡与蛋的关系引人思考, 但更多证据表明黏膜损伤先与菌群失调[37], 因此重塑黏膜屏障完整性和恢复肠道微生物群的多样性可能会成为预防和治疗途径的目标. 而肠上皮糖萼维持黏膜完整性与菌群隔绝, 起屏障作用. 同时为细菌凝集素提供结合位点, 其糖萼的成分与细菌相互影响, 因此糖萼在维持黏膜屏障和调节细菌菌群中发挥着至关重要的作用.
炎症反应与糖萼的关系: 一旦肠黏膜屏障受损, 大量细菌到达固有层的免疫细胞, 就会触发明显的炎症反应, 进一步驱动黏液分泌并导致UC的急性发作[42], 导致自身免疫耐受被破坏和免疫稳态失衡, 加重IBD的全身炎症反应[16]. 在炎症时期就多与eGCX的损伤相关,其中的硫酸GAGs是细胞因子和生长因子的蓄水池, 参与炎症过程. 非硫酸GAGs的HA与IBD最为相关, 积极参与伤口愈合、增殖、细胞迁移和炎症过程的调节, 其裂解的小片段作为炎症因子在IBD中发挥重要作用, 此外HA还有与胰蛋白酶结合加重炎症反应[43]. Derkacz等[44]研究中发现UC患者治疗12个月前后血液中的透明质酸浓度与Mayo评分得出的疾病活性之间存在相关性. 糖萼中的另一种物质PGs: 属于1型跨膜硫酸肝素蛋白多糖家族syndecans-PGs其中syndecan-1(CD138)在IBD中作为促炎因子和生长因子在炎症过程中发挥重要作用. 因此糖萼损伤标志物HA、syndecans-PGs是在整个IBD的潜在有用的诊断标记物, 可能对诊断和疾病活动度监测有作用, 但其价值仍需进一步检测.
总之, (1)eGCX参与血管通透性的炎症反应. 因此eGCX裂解标志物如HA、syndecans-PGs可作为IBD的诊断潜在生物标志物, 但其他损伤eGCX的炎性疾病可能影响其诊断; (2)而肠上皮糖萼的在黏膜屏障中其关键作用, 其黏膜屏障缺损在IBD发病机制上有很高研究价值. 大胆推测肠上皮糖萼的可视化研究在未来IBD的发病机制、诊断和监测疾病严重程度有很大研究价值, 由它判断黏膜屏障的完整度, 以确定IBD的严重程度.
CRC是全球最普遍和最常见的癌症之一, 也是导致死亡的重要原因. 如果早期发现CRC, 它是可以治愈的. 因此, 早期发现可以降低CRC的死亡率, 癌症的早期诊断至关重要. 目前主要的检测方法有FIT及内窥镜检查, 后补充血液检测的筛选方法新的生物标志物甲基化基因septin9[45]. 在CRC的早期诊断中寻找新标记物, Ramaker等[46]研究使用透射电子显微镜分析了健康和肿瘤性人类结直肠组织的管腔表面是否存在糖萼. 结果显示, 93%的健康黏膜被完整的糖萼覆盖. 相反, 在超过90%的肿瘤细胞表面不存在糖萼. 我们的标志物"无糖萼"的敏感性和特异性非常好, 腺癌为91%(83%-96%)和96%(89%-99%), 癌前息肉为94%(73%-100%)和92%(85%-97%)(平均值和95%置信区间), 因此无糖萼可作为未来的一种诊断早期CRC的手段. 虽然在结直肠组织层面无糖萼层覆盖, 但在癌细胞表面的糖萼过表达. 透明质酸、跨膜黏蛋白、糖蛋白、糖脂等糖萼的组成成分在上皮细胞肿瘤中(包括CRC)严重上调, 肿瘤细胞可以构建具有物理和生化属性的糖萼, 通过监视免疫细胞和工程细胞疗法来抵御免疫细胞攻击[47]. 在癌症治疗相关方面, Park等[48]研究发现自然杀伤细胞介导的细胞毒性与肿瘤靶细胞的糖萼厚度呈负相关, 糖萼厚度约10 nm的变化可以改变对免疫细胞攻击的易感性. 因此可以通过工程效应细胞来显示糖萼编辑酶(包括黏蛋白酶和唾液酸酶)以克服癌细胞的糖萼盔甲, 从而增强细胞毒性. 如果可以通过蛋白质工程识别或开发优先切割癌症相关黏蛋白的选择性黏蛋白酶, 则为效应免疫细胞配备破坏糖萼结构的酶以增强肿瘤细胞杀伤[49]. 这种方法可能为嵌合抗原受体T细胞提供补充或替代策略, 增强细胞介导的对癌细胞的细胞毒性.
另外Paszek研究发现[50]恶性肿瘤产生大块的糖萼促进整合素聚集, 通过增强细胞表面受体功能来促进转移. 糖萼组成成分Syndecan-1(SDC1/CD138)是一种细胞表面硫酸乙酰肝素蛋白聚糖, 与多种恶性肿瘤相关, 通过与肿瘤细胞存活、增殖、血管生成和转移的分子介质相互作用来影响肿瘤发生[51]. 另外Akca等[52]研究发现消化系统另外一疾病: 食管腺癌, 很大一部分是强CD138阳性(13.3%), 其表达是食管腺癌中独立的有利预后标志物, 可通过此靶点进行靶向药物治疗. 在晚期结肠癌预后中, Tanaka等[53]研究发现, 血清SDC1水平的动态变化可作为可切除晚期CRC的预后生物标志物, 当术后SDC1水平高于术前SDC1水平时, 在可切除的晚期CRC患者中观察到无病生存期延长.
因此糖萼在CRC的早期发现和晚期预后中都有较大的帮助, 同时肿瘤细胞糖萼成分的上调可帮助细胞进行免疫逃逸. 效应免疫细胞配备破坏糖萼结构的酶以增强肿瘤细胞杀伤的研究, 在未来有很大的研究前景, 可能破除目前癌症免疫治疗的障壁.
IBS是我们社会上最普遍的胃肠道疾病之一, 其特征是反复发作的腹痛、不适和排便习惯改变为主要表现[54]. 病因因素尚不清楚, 但目前包括内脏超敏反应、肠上皮通透性增加、菌群失调、炎症、遗传学以及脑-肠道相互作用改变[55]. IBS目前分为四个亚型分别是: 将IBS分为腹泻型肠易激综合征(irritable bowel syndrome with predominant diarrhea, IBS-D)、便秘型肠易激综合征、混合型肠易激综合征和未定型肠易激综合征4种亚型[56]. 本综述主要介绍IBS-D型, 发现其黏膜屏障完整性降低为主要病理特征. IBS中, 肠上皮完整性降低主要的影响因素包括: 细胞骨架浓缩、细胞间隙增加、细胞连蛋白的表达、磷酸化和定位改变[57-60], 这可能是上皮通透性增加的原因.
尽管黏液层在防止管腔细菌与上皮细胞直接接触方面发挥着重要作用, 但黏液层对IBS屏障防御的作用具体机制仍然未知[15]. 让人们感到好奇的是肠上皮糖萼, 充当分泌的黏液层和上皮之间的屏障, 影响多种细胞信号通路, 调节炎症反应, 并调节增殖、分化和细胞凋亡[10]. 事实上, 上皮屏障缺损一直是IBS的病理生理的中心机制, 但导致疾病的具体机制尚未可知. 在肠道损伤的研究中, 糖萼层减少与微生物对上皮的通透性和黏附性增加有关[61]. 在Pardo-Camacho等[62]的研究中在IBS-D, 首次确定了空肠糖萼的减少及其与黏膜浆细胞活化和靠近神经的关联. 糖萼层的减少促进了管腔抗原的通过, 这可能会触发局部体液反应. 因此, 在以肠道通透性增加、低度黏膜炎症及糖萼层减少为特征的情况下, 加强糖萼可能至关重要. 未来可能会有潜在的治疗靶点来挽救糖萼的完整性, 或者通过黏膜保护剂、牛奶低聚糖或不易消化的碳水化合物来补充糖萼完整性[63,64].
简单介绍下纳米颗粒(nanoparticles, NP)介导的药物递送系统在疾病治疗中的优势, 目前NP介导的药物递送系统已应用于慢性炎症疾病的治疗. 如在IBD治疗中的优势: (1)在NP负载的药物较常规药物(片剂、胶囊)可在较低浓度下发挥相应的作用; (2)NPs可改善负载药物的药代动力学, 减轻毒副作用、全身分布和给药频次剂量等[65]. 但在NP的结构设计中存在很大的困难. 目前在IBD的治疗中采用多响应的NP系统来靶向递送药物[66](多响应系统是指: 感染肠道和健康肠道之间的这些单一的差异因素如: 酶、pH、时间、压力、受体、超声等相互组合而成的影响因素). 复杂NP设计领域的一个热门话题是开发基于双功能(即同时具有诊断和治疗能力)NP的递送系统[67].
肠上皮糖萼是肠道上皮细胞上一种富含碳水化合物的保护涂层, 是共生菌黏附的主要部位, 在特定病理条件下发生转变, 病原体通过糖萼介导的相互作用黏附并渗透黏液层[1], 根据此构建了模拟糖萼的纳米颗粒库. 糖纳米颗粒(glyconanoparticles, GlyNPs), 它是最丰富的5中天然糖(β-葡萄糖、β-半乳糖、α-甘露糖、β-N-乙酰氨基葡萄糖和β-N-乙酰半乳糖胺)随机组合而成的糖共聚物库. 在IBD的治疗中, 其中构建了急性结肠炎小鼠模型, 口服GlyNPs比药物5-氨基水杨酸能更能减轻结肠炎症, 其中含有甘露糖和N-乙酰氨基葡萄糖的纳米颗粒疗效最佳; 另外GlyNPs干预还可显著降低小鼠炎症因子浓度, 刺激抗炎因子产生, 并减少氧化应激; 同时GlyNPs干预的免疫抑制作用仅限于肠道发炎区域, 能最大限度减少不利的全身副作用[68], 因此在IBD的治疗中拥有更好的前景的治疗方式.
在其他器官的靶向递送中, Whang等[69]证明GlyNP文库是一个多功能平台, 使用新型 GlyNP 平台开发靶向癌症纳米药物的潜力, 模拟糖萼的GlyNPs作为能够筛选和鉴定针对各种类型癌症的糖纳米颗粒的平台. 另外Kim等[70]研究的含五个随机组合的糖部分的模拟糖萼纳米颗粒(GlyNPs)文库, 用来筛选识别在肝、脾、肺、肾、心脏和脑中具有优先生物分布的GlyNPs. 发现每个靶向器官的GlyNP命中都显示器官内的细胞趋向性. 目前基于糖萼模拟纳米颗粒(GlyNPs)可能在未来实现器官、细胞靶向治疗货物的递送和癌症筛查与鉴定. 总之, GlyNPs在疾病治疗和诊断中有很大的研究前景, GlyNPs可以克服常规药物的全身毒副作用, 增加靶向递送药物的药物利用率, 亦可用于各类癌症的筛选和鉴定的工具.
综上所述, 本文主要介绍了肠上皮糖萼的基本结构及功能, 它处于在消化道的黏液层和上皮细胞之间, 在维持肠道黏膜完整性中发挥至关重要的作用, 同时与肠道菌群相互作用正向或负向影响人体. 与IBD、IBS-D、CRC等疾病有着紧密关系. 另外根据糖萼的生物学结构及功能, 建立了模拟糖萼的纳米颗粒文库, 在靶向药物递送及其他疾病的筛选和鉴别中拥有重大研究前景.
感谢本次科研及论文协作过程中导师及科室同事的指导和大力支持.
学科分类: 胃肠病学和肝病学
手稿来源地: 天津市
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Möckl L. The Emerging Role of the Mammalian Glycocalyx in Functional Membrane Organization and Immune System Regulation. Front Cell Dev Biol. 2020;8:253. [PubMed] [DOI] |
| 2. | Chignalia AZ, Yetimakman F, Christiaans SC, Unal S, Bayrakci B, Wagener BM, Russell RT, Kerby JD, Pittet JF, Dull RO. THE GLYCOCALYX AND TRAUMA: A REVIEW. Shock. 2016;45:338-348. [PubMed] [DOI] |
| 3. | Pelaseyed T, Hansson GC. Membrane mucins of the intestine at a glance. J Cell Sci. 2020;133. [PubMed] [DOI] |
| 4. | Luft JH. The structure and properties of the cell surface coat. Int Rev Cytol. 1976;45:291-382. [PubMed] [DOI] |
| 5. | Chevalier L, Selim J, Genty D, Baste JM, Piton N, Boukhalfa I, Hamzaoui M, Pareige P, Richard V. Electron microscopy approach for the visualization of the epithelial and endothelial glycocalyx. Morphologie. 2017;101:55-63. [PubMed] [DOI] |
| 6. | Ricard-Blum S, Perez S. Glycosaminoglycan interaction networks and databases. Curr Opin Struct Biol. 2022;74:102355. [PubMed] [DOI] |
| 7. | Jin J, Fang F, Gao W, Chen H, Wen J, Wen X, Chen J. The Structure and Function of the Glycocalyx and Its Connection With Blood-Brain Barrier. Front Cell Neurosci. 2021;15:739699. [PubMed] [DOI] |
| 8. | Reitsma S, Slaaf DW, Vink H, van Zandvoort MA, oude Egbrink MG. The endothelial glycocalyx: composition, functions, and visualization. Pflugers Arch. 2007;454:345-359. [PubMed] [DOI] |
| 10. | Grondin JA, Kwon YH, Far PM, Haq S, Khan WI. Mucins in Intestinal Mucosal Defense and Inflammation: Learning From Clinical and Experimental Studies. Front Immunol. 2020;11:2054. [PubMed] [DOI] |
| 11. | Turner JR. Intestinal mucosal barrier function in health and disease. Nat Rev Immunol. 2009;9:799-809. [PubMed] [DOI] |
| 12. | An J, Liu Y, Wang Y, Fan R, Hu X, Zhang F, Yang J, Chen J. The Role of Intestinal Mucosal Barrier in Autoimmune Disease: A Potential Target. Front Immunol. 2022;13:871713. [PubMed] [DOI] |
| 13. | Kim JJ, Khan WI. Goblet cells and mucins: role in innate defense in enteric infections. Pathogens. 2013;2:55-70. [PubMed] [DOI] |
| 14. | Hansson GC. Role of mucus layers in gut infection and inflammation. Curr Opin Microbiol. 2012;15:57-62. [PubMed] [DOI] |
| 15. | Pelaseyed T, Bergström JH, Gustafsson JK, Ermund A, Birchenough GM, Schütte A, van der Post S, Svensson F, Rodríguez-Piñeiro AM, Nyström EE, Wising C, Johansson ME, Hansson GC. The mucus and mucins of the goblet cells and enterocytes provide the first defense line of the gastrointestinal tract and interact with the immune system. Immunol Rev. 2014;260:8-20. [PubMed] [DOI] |
| 16. | Singh PK, Hollingsworth MA. Cell surface-associated mucins in signal transduction. Trends Cell Biol. 2006;16:467-476. [PubMed] [DOI] |
| 17. | Honigfort DJ, Altman MO, Gagneux P, Godula K. Glycocalyx crowding with mucin mimetics strengthens binding of soluble and virus-associated lectins to host cell glycan receptors. Proc Natl Acad Sci USA. 2021;118. [PubMed] [DOI] |
| 18. | Martens EC, Neumann M, Desai MS. Interactions of commensal and pathogenic microorganisms with the intestinal mucosal barrier. Nat Rev Microbiol. 2018;16:457-470. [PubMed] [DOI] |
| 19. | Patsos G, Corfield A. Management of the human mucosal defensive barrier: evidence for glycan legislation. Biol Chem. 2009;390:581-590. [PubMed] [DOI] |
| 20. | Koropatkin NM, Cameron EA, Martens EC. How glycan metabolism shapes the human gut microbiota. Nat Rev Microbiol. 2012;10:323-335. [PubMed] [DOI] |
| 21. | Jakobsson HE, Rodríguez-Piñeiro AM, Schütte A, Ermund A, Boysen P, Bemark M, Sommer F, Bäckhed F, Hansson GC, Johansson ME. The composition of the gut microbiota shapes the colon mucus barrier. EMBO Rep. 2015;16:164-177. [PubMed] [DOI] |
| 22. | Yamamoto K, Qi WM, Yokoo Y, Miyata H, Udayanga KG, Kawano J, Yokoyama T, Hoshi N, Kitagawa H. Lectin histochemical detection of special sugars on the mucosal surfaces of the rat alimentary tract. J Vet Med Sci. 2010;72:1119-1127. [PubMed] [DOI] |
| 23. | Arabyan N, Park D, Foutouhi S, Weis AM, Huang BC, Williams CC, Desai P, Shah J, Jeannotte R, Kong N, Lebrilla CB, Weimer BC. Salmonella Degrades the Host Glycocalyx Leading to Altered Infection and Glycan Remodeling. Sci Rep. 2016;6:29525. [PubMed] [DOI] |
| 24. | Rescigno M. Mucosal immunology and bacterial handling in the intestine. Best Pract Res Clin Gastroenterol. 2013;27:17-24. [PubMed] [DOI] |
| 25. | Layunta E, Jäverfelt S, Dolan B, Arike L, Pelaseyed T. IL-22 promotes the formation of a MUC17 glycocalyx barrier in the postnatal small intestine during weaning. Cell Rep. 2021;34:108757. [PubMed] [DOI] |
| 26. | Villalba N, Baby S, Yuan SY. The Endothelial Glycocalyx as a Double-Edged Sword in Microvascular Homeostasis and Pathogenesis. Front Cell Dev Biol. 2021;9:711003. [PubMed] [DOI] |
| 27. | Hu C, Liao S, Lv L, Li C, Mei Z. Intestinal Immune Imbalance is an Alarm in the Development of IBD. Mediators Inflamm. 2023;2023:1073984. [PubMed] [DOI] |
| 28. | Da Silva S, Robbe-Masselot C, Ait-Belgnaoui A, Mancuso A, Mercade-Loubière M, Salvador-Cartier C, Gillet M, Ferrier L, Loubière P, Dague E, Theodorou V, Mercier-Bonin M. Stress disrupts intestinal mucus barrier in rats via mucin O-glycosylation shift: prevention by a probiotic treatment. Am J Physiol Gastrointest Liver Physiol. 2014;307:G420-G429. [PubMed] [DOI] |
| 29. | Basivireddy J, Jacob M, Ramamoorthy P, Balasubramanian KA. Alterations in the intestinal glycocalyx and bacterial flora in response to oral indomethacin. Int J Biochem Cell Biol. 2005;37:2321-2332. [PubMed] [DOI] |
| 30. | Chassaing B, Koren O, Goodrich JK, Poole AC, Srinivasan S, Ley RE, Gewirtz AT. Dietary emulsifiers impact the mouse gut microbiota promoting colitis and metabolic syndrome. Nature. 2015;519:92-96. [PubMed] [DOI] |
| 31. | GBD 2017 Inflammatory Bowel Disease Collaborators. The global, regional, and national burden of inflammatory bowel disease in 195 countries and territories, 1990-2017: a systematic analysis for the Global Burden of Disease Study 2017. Lancet Gastroenterol Hepatol. 2020;5:17-30. [PubMed] [DOI] |
| 32. | Guo X, Huang C, Xu J, Xu H, Liu L, Zhao H, Wang J, Huang W, Peng W, Chen Y, Nie Y, Zhou Y, Zhou Y. Gut Microbiota Is a Potential Biomarker in Inflammatory Bowel Disease. Front Nutr. 2021;8:818902. [PubMed] [DOI] |
| 33. | Stange EF, Schroeder BO. Microbiota and mucosal defense in IBD: an update. Expert Rev Gastroenterol Hepatol. 2019;13:963-976. [PubMed] [DOI] |
| 34. | Johansson ME, Gustafsson JK, Sjöberg KE, Petersson J, Holm L, Sjövall H, Hansson GC. Bacteria penetrate the inner mucus layer before inflammation in the dextran sulfate colitis model. PLoS One. 2010;5:e12238. [PubMed] [DOI] |
| 35. | Xu P, Elamin E, Elizalde M, Bours PPHA, Pierik MJ, Masclee AAM, Jonkers DMAE. Modulation of Intestinal Epithelial Permeability by Plasma from Patients with Crohn's Disease in a Three-dimensional Cell Culture Model. Sci Rep. 2019;9:2030. [PubMed] [DOI] |
| 36. | Layunta E, Jäverfelt S, van de Koolwijk FC, Sivertsson M, Dolan B, Arike L, Thulin S, Vallance BA, Pelaseyed T. MUC17 is an essential small intestinal glycocalyx component that is disrupted in Crohn's disease. bioRxiv. 2024. [PubMed] [DOI] |
| 37. | Alipour M, Zaidi D, Valcheva R, Jovel J, Martínez I, Sergi C, Walter J, Mason AL, Wong GK, Dieleman LA, Carroll MW, Huynh HQ, Wine E. Mucosal Barrier Depletion and Loss of Bacterial Diversity are Primary Abnormalities in Paediatric Ulcerative Colitis. J Crohns Colitis. 2016;10:462-471. [PubMed] [DOI] |
| 38. | Das S, Rachagani S, Sheinin Y, Smith LM, Gurumurthy CB, Roy HK, Batra SK. Mice deficient in Muc4 are resistant to experimental colitis and colitis-associated colorectal cancer. Oncogene. 2016;35:2645-2654. [PubMed] [DOI] |
| 39. | Buisine MP, Desreumaux P, Debailleul V, Gambiez L, Geboes K, Ectors N, Delescaut MP, Degand P, Aubert JP, Colombel JF, Porchet N. Abnormalities in mucin gene expression in Crohn's disease. Inflamm Bowel Dis. 1999;5:24-32. [PubMed] [DOI] |
| 40. | Swidsinski A, Ladhoff A, Pernthaler A, Swidsinski S, Loening-Baucke V, Ortner M, Weber J, Hoffmann U, Schreiber S, Dietel M, Lochs H. Mucosal flora in inflammatory bowel disease. Gastroenterology. 2002;122:44-54. [PubMed] [DOI] |
| 41. | Raygoza Garay JA, Turpin W, Lee SH, Smith MI, Goethel A, Griffiths AM, Moayyedi P, Espin-Garcia O, Abreu M, Aumais GL, Bernstein CN, Biron IA, Cino M, Deslandres C, Dotan I, El-Matary W, Feagan B, Guttman DS, Huynh H, Dieleman LA, Hyams JS, Jacobson K, Mack D, Marshall JK, Otley A, Panaccione R, Ropeleski M, Silverberg MS, Steinhart AH, Turner D, Yerushalmi B, Paterson AD, Xu W; CCC GEM Project Research Consortium, Croitoru K. Gut Microbiome Composition Is Associated With Future Onset of Crohn's Disease in Healthy First-Degree Relatives. Gastroenterology. 2023;165:670-681. [PubMed] [DOI] |
| 42. | Hansson GC. Mucins and the Microbiome. Annu Rev Biochem. 2020;89:769-793. [PubMed] [DOI] |
| 43. | Derkacz A, Olczyk P, Olczyk K, Komosinska-Vassev K. The Role of Extracellular Matrix Components in Inflammatory Bowel Diseases. J Clin Med. 2021;10. [PubMed] [DOI] |
| 44. | Derkacz A, Olczyk P, Jura-Półtorak A, Olczyk K, Komosinska-Vassev K. The Diagnostic Usefulness of Circulating Profile of Extracellular Matrix Components: Sulfated Glycosaminoglycans (sGAG), Hyaluronan (HA) and Extracellular Part of Syndecan-1 (sCD138) in Patients with Crohn's Disease and Ulcerative Colitis. J Clin Med. 2021;10. [PubMed] [DOI] |
| 45. | Zygulska AL, Pierzchalski P. Novel Diagnostic Biomarkers in Colorectal Cancer. Int J Mol Sci. 2022;23. [PubMed] [DOI] |
| 46. | Ramaker K, Bade S, Röckendorf N, Meckelein B, Vollmer E, Schultz H, Fröschle GW, Frey A. Absence of the Epithelial Glycocalyx As Potential Tumor Marker for the Early Detection of Colorectal Cancer. PLoS One. 2016;11:e0168801. [PubMed] [DOI] |
| 47. | Ghasempour S, Freeman SA. The glycocalyx and immune evasion in cancer. FEBS J. 2023;290:55-65. [PubMed] [DOI] |
| 48. | Park S, Colville MJ, Paek JH, Shurer CR, Singh A, Secor EJ, Sailer CJ, Huang LT, Kuo JC, Goudge MC, Su J, Kim M, DeLisa MP, Neelamegham S, Lammerding J, Zipfel WR, Fischbach C, Reesink HL, Paszek MJ. Immunoengineering can overcome the glycocalyx armour of cancer cells. Nat Mater. 2024;23:429-438. [PubMed] [DOI] |
| 49. | Pedram K, Shon DJ, Tender GS, Mantuano NR, Northey JJ, Metcalf KJ, Wisnovsky SP, Riley NM, Forcina GC, Malaker SA, Kuo A, George BM, Miller CL, Casey KM, Vilches-Moure JG, Ferracane MJ, Weaver VM, Läubli H, Bertozzi CR. Design of a mucin-selective protease for targeted degradation of cancer-associated mucins. Nat Biotechnol. 2024;42:597-607. [PubMed] [DOI] |
| 50. | Paszek MJ, DuFort CC, Rossier O, Bainer R, Mouw JK, Godula K, Hudak JE, Lakins JN, Wijekoon AC, Cassereau L, Rubashkin MG, Magbanua MJ, Thorn KS, Davidson MW, Rugo HS, Park JW, Hammer DA, Giannone G, Bertozzi CR, Weaver VM. The cancer glycocalyx mechanically primes integrin-mediated growth and survival. Nature. 2014;511:319-325. [PubMed] [DOI] |
| 51. | Lendorf ME, Manon-Jensen T, Kronqvist P, Multhaupt HA, Couchman JR. Syndecan-1 and syndecan-4 are independent indicators in breast carcinoma. J Histochem Cytochem. 2011;59:615-629. [PubMed] [DOI] |
| 52. | Akca D, Simon A, Buettner R, Bruns C, Schroeder W, Zander T, Gebauer F, Quaas A. Syndecan1 expression is an independent favourable prognostic marker in oesophageal adenocarcinoma and represents a potential therapeutic target. Oncol Lett. 2023;26:356. [PubMed] [DOI] |
| 53. | Tanaka H, Hayashi H, Tomita H, Tokumaru Y, Fukada M, Tajima JY, Yokoi R, Tsuchiya H, Kuno M, Sato Y, Yasufuku I, Asai R, Mori R, Tanaka Y, Okumura N, Futamura M, Matsuhashi N. Association of Preoperative and Postoperative Plasma Syndecan-1 and Colorectal Cancer Outcome. Anticancer Res. 2024;44:1611-1618. [PubMed] [DOI] |
| 54. | Drossman DA. Functional Gastrointestinal Disorders: History, Pathophysiology, Clinical Features and Rome IV. Gastroenterology. 2016. [PubMed] [DOI] |
| 55. | Enck P, Aziz Q, Barbara G, Farmer AD, Fukudo S, Mayer EA, Niesler B, Quigley EM, Rajilić-Stojanović M, Schemann M, Schwille-Kiuntke J, Simren M, Zipfel S, Spiller RC. Irritable bowel syndrome. Nat Rev Dis Primers. 2016;2:16014. [PubMed] [DOI] |
| 56. | Ford AC, Lacy BE, Talley NJ. Irritable Bowel Syndrome. N Engl J Med. 2017;376:2566-2578. [PubMed] [DOI] |
| 57. | Rodiño-Janeiro BK, Martínez C, Fortea M, Lobo B, Pigrau M, Nieto A, González-Castro AM, Salvo-Romero E, Guagnozzi D, Pardo-Camacho C, Iribarren C, Azpiroz F, Alonso-Cotoner C, Santos J, Vicario M. Decreased TESK1-mediated cofilin 1 phosphorylation in the jejunum of IBS-D patients may explain increased female predisposition to epithelial dysfunction. Sci Rep. 2018;8:2255. [PubMed] [DOI] |
| 58. | Martínez C, Lobo B, Pigrau M, Ramos L, González-Castro AM, Alonso C, Guilarte M, Guilá M, de Torres I, Azpiroz F, Santos J, Vicario M. Diarrhoea-predominant irritable bowel syndrome: an organic disorder with structural abnormalities in the jejunal epithelial barrier. Gut. 2013;62:1160-1168. [PubMed] [DOI] |
| 59. | Martínez C, Vicario M, Ramos L, Lobo B, Mosquera JL, Alonso C, Sánchez A, Guilarte M, Antolín M, de Torres I, González-Castro AM, Pigrau M, Saperas E, Azpiroz F, Santos J. The jejunum of diarrhea-predominant irritable bowel syndrome shows molecular alterations in the tight junction signaling pathway that are associated with mucosal pathobiology and clinical manifestations. Am J Gastroenterol. 2012;107:736-746. [PubMed] [DOI] |
| 60. | Piche T, Barbara G, Aubert P, Bruley des Varannes S, Dainese R, Nano JL, Cremon C, Stanghellini V, De Giorgio R, Galmiche JP, Neunlist M. Impaired intestinal barrier integrity in the colon of patients with irritable bowel syndrome: involvement of soluble mediators. Gut. 2009;58:196-201. [PubMed] [DOI] |
| 61. | Wu J, Yin Y, Qin M, Li K, Liu F, Zhou X, Song X, Li B. Vagus Nerve Stimulation Protects Enterocyte Glycocalyx After Hemorrhagic Shock Via the Cholinergic Anti-Inflammatory Pathway. Shock. 2021;56:832-839. [PubMed] [DOI] |
| 62. | Pardo-Camacho C, Ganda Mall JP, Martínez C, Pigrau M, Expósito E, Albert-Bayo M, Melón-Ardanaz E, Nieto A, Rodiño-Janeiro B, Fortea M, Guagnozzi D, Rodriguez-Urrutia A, Torres I, Santos-Briones I, Azpiroz F, Lobo B, Alonso-Cotoner C, Santos J, González-Castro AM, Vicario M. Mucosal Plasma Cell Activation and Proximity to Nerve Fibres Are Associated with Glycocalyx Reduction in Diarrhoea-Predominant Irritable Bowel Syndrome: Jejunal Barrier Alterations Underlying Clinical Manifestations. Cells. 2022;11. [PubMed] [DOI] |
| 63. | Alonso-Cotoner C, Abril-Gil M, Albert-Bayo M, Mall JG, Expósito E, González-Castro AM, Lobo B, Santos J. The Role of Purported Mucoprotectants in Dealing with Irritable Bowel Syndrome, Functional Diarrhea, and Other Chronic Diarrheal Disorders in Adults. Adv Ther. 2021;38:2054-2076. [PubMed] [DOI] |
| 64. | Kong C, Elderman M, Cheng L, de Haan BJ, Nauta A, de Vos P. Modulation of Intestinal Epithelial Glycocalyx Development by Human Milk Oligosaccharides and Non-Digestible Carbohydrates. Mol Nutr Food Res. 2019;63:e1900303. [PubMed] [DOI] |
| 65. | Melero A, Draheim C, Hansen S, Giner E, Carreras JJ, Talens-Visconti R, Garrigues TM, Peris JE, Recio MC, Giner R, Lehr CM. Targeted delivery of Cyclosporine A by polymeric nanocarriers improves the therapy of inflammatory bowel disease in a relevant mouse model. Eur J Pharm Biopharm. 2017;119:361-371. [PubMed] [DOI] |
| 66. | Yang C, Merlin D. Nanoparticle-Mediated Drug Delivery Systems For The Treatment Of IBD: Current Perspectives. Int J Nanomedicine. 2019;14:8875-8889. [PubMed] [DOI] |
| 67. | Xiao B, Ma L, Merlin D. Nanoparticle-mediated co-delivery of chemotherapeutic agent and siRNA for combination cancer therapy. Expert Opin Drug Deliv. 2017;14:65-73. [PubMed] [DOI] |
| 68. | Yoo D, Whang CH, Hong J, Kim D, Prayogo MC, Son Y, Jung W, Lee S, Lee HS, Jon S. Anti-inflammatory Glycocalyx-Mimicking Nanoparticles for Colitis Treatment: Construction and In Vivo Evaluation. Angew Chem Int Ed Engl. 2023;62:e202304815. [PubMed] [DOI] |