修回日期: 2024-11-06
接受日期: 2024-12-17
在线出版日期: 2024-12-28
口腔和肠道是人体中两个重要的微生物栖息地, 被认为是人类中生态最丰富, 分类最多样化的微生物群落, 它们在微生物组相关疾病中起着关键的作用. 近年来, 口-肠-脑轴这一新兴的概念在神经科学, 消化科学和微生物学等领域引起了广泛关注. 它不仅仅是一个解剖学上的描述, 更是一个涵盖了多重生理功能与病理机制的综合性概念. 简而言之, 口-肠-脑轴是指通过神经连接, 激素和免疫途径, 将口腔, 肠道和大脑紧密连接在一起的复杂网络. 随着对口-肠-脑轴理论研究的不断深入, 越来越多证据表明其在抑郁症, 帕金森病等精神神经疾病的发生发展及治疗中发挥重要作用. 本文对口-肠-脑轴在精神神经疾病中的最新进展进行综述.
核心提要: 口腔及肠道微生物群落在多种神经疾病患者中发生了变化,而调控这些微生物可以减轻小鼠模型中的神经疾病症状. 本文拓展了口-肠-脑轴在神经疾病中的认识, 加强了对保护黏膜及血脑屏障、改善局部菌群及其代谢产物进而调节脑神经功能重要性的理解.
引文著录: 段志敏, 吴灵飞. 口-肠-脑轴在精神神经疾病中的作用. 世界华人消化杂志 2024; 32(12): 878-886
Revised: November 6, 2024
Accepted: December 17, 2024
Published online: December 28, 2024
The oral cavity and gut are two important microbial habitats in the human body, harboring the most ecologically rich and taxonomically diverse microbial communities in humans, which play a key role in microbiome related diseases. In recent years, the emerging concept of the oral-gut-brain axis has attracted widespread attention in the fields of neuroscience, digestive science, and microbiology. It is not only an anatomical description, but also a comprehensive concept that covers multiple physiological functions and pathological mechanisms. Simply put, the oral-gut-brain axis refers to the complex network that connects the mouth, gut, and brain tightly together through neural connections and hormonal and immune pathways. With the deepening of research on the oral-gut-brain axis theory, more and more evidence shows that it plays an important role in depression, Parkinson's disease, and other neurodegenerative diseases. This article reviews the recent progress in research of the oral-gut-brain axis in psychiatric and neurological diseases.
- Citation: Duan ZM, Wu LF. Role of oral-gut-brain axis in psychiatric and neurological disorders. Shijie Huaren Xiaohua Zazhi 2024; 32(12): 878-886
- URL: https://www.wjgnet.com/1009-3079/full/v32/i12/878.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v32.i12.878
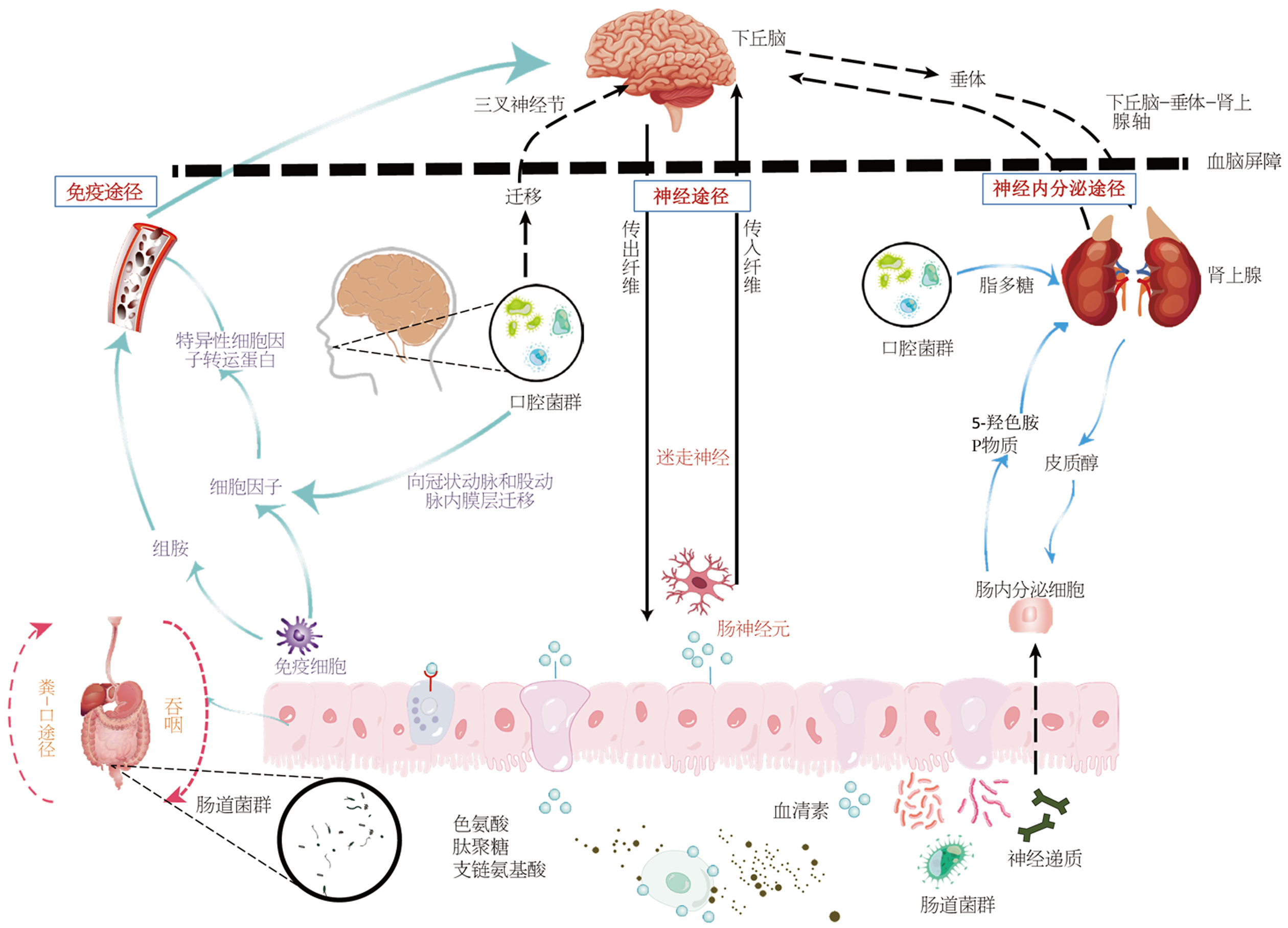
目前, 精神神经疾病的高发病率已成为严重威胁人类健康的公共卫生问题. 胃肠道微菌群作为一重要媒介, 通过口-肠-脑轴在多种精神神经疾病中发挥重要作用. 大量研究表明, 精神神经疾病往往与功能性胃肠病共存, 它们通过双向交流而产生"菌-肠-脑轴"的异常互动. 例如, 功能性胃肠疾病患者常伴随焦虑, 抑郁及睡眠障碍, 与之相对应的是老年神经疾病病人早期常出现便秘, 腹胀, 消化不良或口腔炎症. 据统计, 牙周炎患者出现认知或精神障碍的比例明显高于口腔健康的人群, 这在帕金森病患者更为常见[1]. 在人体微生物系统中, 口腔和肠道拥有最密集和多样化的微生物群落, 占人体微生物总量的78.68%, 其中, 胃肠道大约有5亿个神经元, 70%的人体免疫细胞和多达400-1000种不同种类的菌种, 是人体微生物最重要的组成部分. 1921年英国生理学家Langley在研究哺乳动物胃肠道的神经支配时, 发现胃肠道有一个独立于中枢神经系统(central nervous system, CNS)的神经结构, 首次提出肠神经系统(enteric nervous system, ENS)概念. Schroeder等[2]报道, 肠道菌群失调不仅会引起ENS功能障碍, 亦会导致牙周病和神经退行性疾病的发生. 1989年英国剑桥皇后学院举行大脑-肠道互动研讨会, 全面总结了脑-肠相互作用的神经解剖学及病理生理学基础, 正式确立了"肠-脑轴"这一概念[3]. 2014年Braniste通过无菌小鼠实验首次发现肠道微生物可影响血脑屏障(blood-brain barrier, BBB)通透性[4]. 德国学者Möhle进一步证实杀灭肠道正常细菌后可影响大脑海马区的神经功能[5]. 上述研究为口腔、肠道菌群参与ENS和CNS的信息传递提供了实验依据, 因此产生出"口-肠-脑轴"这一新概念[1,6-8].
口腔作为消化道的起始部, 主要由牙齿、牙龈、颊粘膜、软腭、硬腭以及舌头各部分组成, 前者口裂与外界环境相通, 后者经咽峡与咽、气管及食管相连, 是人体内部与外界环境进行物质交换的关键场所, 也是病原微生物及毒物侵入机体的重要门户. 口腔适宜的温度、湿度和弱碱环境为微生物生长繁殖提供了条件. 健康人群口腔约有700多种细菌, 其中94%为放线菌、拟杆菌、厚壁菌、梭杆菌、变形菌和螺旋体, 它们形成了一个物种丰富的异质生态系统[9]. 这些细菌多为非致病菌, 部分为条件致病菌, 它们相互依存, 彼此拮抗, 保持动态的平衡. 当细菌种类的数量平衡被打乱, 遭受致病菌侵袭或免疫系统功能损伤时就会产生疾病. 口腔菌群失调不仅可诱发龋齿, 牙周病, 冠周炎等多种疾病, 还与糖尿病, 动脉粥样硬化, 神经退行性疾病及肿瘤等全身疾病紧密相关[1]. 作为消化道的两端, 口腔和肠道有着解剖学, 微生物学和免疫学的密切联系. 口腔来源的细菌, 如牙龈卟啉单胞菌(porphyromonas gingivalis, Pg), 聚集杆菌和梭杆菌等可跨越消化道胃酸及黏膜屏障, 逃避肠内抗菌肽, 溶酶体的拦截而进入肠道定植, 成为肠道致病菌[10]. 口腔微生物群落不仅包含大量细菌, 还包括真菌, 病毒及古生菌等. 这些微生物定植在口腔表面, 被自身分泌的黏性物质包裹, 共同构成了生物膜. 龋齿和牙周病是由生物膜引发的最常见口腔感染性疾病. Konkel等[11]研究发现, 口腔生物膜可免受胃酸消化而到达肠道定殖, 改变肠道微生物的群落结构[7]. 患有严重牙周炎的患者每天吞咽大量Pg, 可诱发肠道菌群失调, 激活肠道中的Toll样受体(Toll-like receptors, TLRs)导致肠道黏膜通透性增加而产生局部炎症[12]. Bao等[13]发现将重度牙周炎患者的唾液移植到小鼠体内, 结果肠道菌群结构改变, 有害的Pg和梭杆菌增多, 有益的嗜黏蛋白阿克曼菌减少. Li等[14]通过Spearman相关性分析, 证实口腔中克蓝姆氏菌丰度与肠道肠球菌, 链球菌之间存在明显正相关, 它们均属于肠道有害菌群. 正常情况下, 肠道益生菌与有害菌群保持相对平衡的比例, 正常菌群不仅能够帮助人体分解和储存脂肪, 调节免疫功能与促进血管生成, 还可以通过神经及内分泌机制调控机体代谢和神经功能. 一旦有害菌群比例增加, 则可释放炎性介质进入血液导致局部肠道或系统性炎症发生.
三叉神经是口腔与大脑之间(口-脑轴)的重要神经连接. Banks等[15]在AD患者的三叉神经节, 脑桥和海马组织中发现密螺旋体, 提示口腔细菌可能沿三叉神经侵犯脑组织. Sundar等[16]还证实不仅肺炎衣原体能够经嗅球进入嗅觉皮层和海马组织, 密螺旋体也可以沿嗅丝和嗅束进入CNS. 表明口腔及鼻咽部细菌可通过神经传导通路进入大脑. 此外, 直接侵入脑组织的口腔细菌及其代谢产物如肿瘤坏死因子-α、白细胞介素-1、脂多糖(lipopolysaccharides, LPS)等均可激活小胶质细胞或产生β淀粉样蛋白(amyloid β, Aβ)沉积而诱发神经炎症, 产生免疫级联反应, 造成脑神经损伤.
迷走神经和脊髓中的自主神经系统是肠道和大脑之间(肠-脑轴)双向交通的桥梁之一, 从脑干发出的迷走神经延伸到胃和肠道, 传递感觉信息, 参与消化功能的调控. 细菌及其代谢产物通过迷走神经和ENS传入神经元的刺激, 可及时将肠道信息传递到CNS, 以产生适应性或不适应等调节反应(图1). 在小鼠临床试验中, 鼠李糖乳杆菌可显著降低小鼠体内皮质酮水平以及应激产生的焦虑, 而一旦迷走神经被切断, 食用鼠李糖乳杆菌的小鼠则不降低皮质酮水平, 也不产生抗焦虑效果[17]. 基于迷走神经与大脑之间信息传递的研究结果, 迷走神经刺激术已被美国食品药品监督管理局批准治疗难治性癫痫和抑郁症等疾病.
神经内分泌网络如下丘脑-垂体-肾上腺轴(hypothalamic-pituitary-adrenal axis, HPA axis)是一个直接作用和反馈互动的复杂集合系统, 主要在各种应激反应中发挥作用. HPA轴可因胃肠道应激反应的发生或促炎细胞因子的增加而激活, 刺激垂体分泌促肾上腺皮质激素使皮质醇分泌增加, 进而激活大脑小胶质细胞[18,19]. 文献报道[20], 牙周血管系统通透性增加可导致LPS"渗漏". 口腔病原体产生的LPS或牙龈蛋白酶可与小胶质细胞和星形胶质细胞相互作用, 导致神经炎症反应. 其他肠道菌群代谢物如短链脂肪酸(short chain fatty acids, SCFAs)等亦可通过血液循环和神经途径作用于大脑, 激活小胶质细胞并加剧神经炎性损伤[21]. 肠内分泌细胞能够产生多种激素, 如色氨酸、5-羟色胺(5-hydroxytryptamine, 5-HT)、褪黑素等, 这些激素和神经活性肽亦可以通过血液到达大脑, 影响人体情绪和食欲. 一旦菌群失调, 致病菌产生的多种代谢产物即可活化 HPA轴, 增加应急激素和神经递质的产生[22]; 或诱导小胶质细胞有丝分裂原活化蛋白激酶以及核因子κB(nuclear factor kappa-B, NF-κB)信号通路, 加剧神经炎症反应[23], 见图1.
口腔微生物群可通过其代谢产物或神经递质影响宿主的免疫系统. 牙龈卟啉单胞菌可通过血流迁移到冠状动脉和股动脉内膜层, 引起局部炎症反应并产生多种细胞因子. 这些细胞因子通过特定的转运蛋白穿过血脑屏障而进入大脑. 正常情况下, 小胶质细胞是CNS内主要的免疫效应细胞. 一旦受到LPS, 细胞因子及组胺的刺激, 小胶质细胞表面的CD14、TLRs即可与LPS等发生特异性结合, 促进炎症因子释放, 发挥神经保护作用. 如果炎症反应加重或持续时间较长, "渗漏"的LPS则可损伤血脑屏障, 导致口腔细菌直接进入大脑, 加重脑神经损伤[24].
肠道是人体最大的免疫器官, 肠道微生物群落与免疫系统紧密相连. 肠道菌群可以通过代谢产生SCFAs、色氨酸、胆汁酸等代谢产物, 它们通过激活特定的神经元和免疫细胞来调节免疫反应, 从而维持肠黏膜的免疫稳态. 一些细菌的代谢产物, 如 4-甲基苯甲酸、3,4-二甲基苯甲酸、己酸和庚酸等, 则会加重黏膜上皮损伤, 从而影响机体的免疫功能[25]. 除了产生酶和其他代谢物之外, 细菌本身的成分, 包括LPS、细胞囊碳水化合物和其他内毒素, 也可能被释放并对宿主产生二次影响(图1). 在婴儿和儿童阶段, 肠道微生物群落还对大脑的发育产生影响[26]. 研究证实, 对肠道菌群进行干预能够影响小胶质细胞的成熟和功能, 有效抑制神经炎症的发生. Erny等[22]发现, 小鼠微生物群的根除可显著改变其大脑小胶质细胞的生理特性, 无菌小鼠的小胶质细胞常呈现整体缺陷, 如细胞比例改变、表型不成熟及先天免疫功能受损; 而微生物群的再定植则可部分恢复小胶质细胞的生理特征, 表明调节肠道微生物菌群可影响颅内神经细胞的免疫功能.
神经退行性疾病是一组以大脑特定区域神经元进行性减少为特征, 最终导致运动或认知功能障碍的疾病[27]. 据报道, 全球10亿以上人群受到此病的影响, 每年约有700万人死于此类疾病. 神经系统疾病已经成为全球第二大死亡原因[28,29]. 图1所示, 氧化应激和神经炎症是触发和延续神经系统退行性病变的关键病理事件[30,31]. 大脑神经元对能量需求较高, 大部分属于有丝分裂后细胞, 其细胞膜富含多不饱和脂肪酸, 这导致了大脑对活性氧(reactive oxidative species, ROS)介导的氧化损伤作用更为敏感[32]. ROS在神经元细胞膜上持续蓄积会刺激小胶质细胞活化并产生炎症反应. 正常情况下, 小胶质细胞能感应并及时清除炎性因子及各种ROS以减轻炎症反应. 当炎症持续时间较长或程度较剧烈时, 小胶质细胞会出现功能障碍, 导致脑神经疾病进展.
阿尔茨海默病(alzheimer's disease, AD)是神经退行性疾病的主要类型, 其临床特征是不可逆的学习和记忆功能损害, 渐进性认知障碍和行为能力失调[33], 病理学主要表现为脑细胞外Aβ沉积、细胞内Tau蛋白过度磷酸化、神经原纤维缠结(neurofibrillary tangle, NFT)及神经炎症[34]. 研究发现口腔微生物和肠道菌群可在Aβ斑块和NFT形成中发挥作用[35]. 口腔细菌感染会通过直接和间接作用造成大脑内Aβ代谢失衡、Tau蛋白过磷酸化、沉积形成老年斑并损伤神经元[36]. AD患者的脑组织和脑脊液尸检中均可发现口腔细菌[37]. 另外, AD患者的三叉神经节和海马中亦可找到齿状密螺旋体. 通过基因组测序并进行口腔菌群多样性分析, 发现AD患者梭杆菌属和卟啉单胞菌属的多样性显著高于健康对照组[38]. AD患者常伴有肠道菌群失调和血脑屏障通透性增加, 促使大量细菌淀粉样蛋白和LPS进入循环系统和CNS, 导致患者认知功能障碍[39]. 牙周病患者通过循环或神经系统产生的Aβ进入颅内可增加AD的患病风险[40,41]. AD患者菌群失调可导致病情进展, 其机制与细菌内毒素到达大脑后激活TLR4并下调髓系细胞触发受体2有关[34].
慢性牙周炎能够产生轻度全身炎症并通过血液和神经途径将病原体传播到大脑[42]. 牙周病原体Pg产生的外膜囊泡可参与神经胶质细胞的活化, 导致神经炎症及记忆力减退[43]. Peng等[44]研究表明, LPS活化小胶质细胞能显著增强神经毒素MPP+介导的多巴胺神经元退行性病变, 增加细胞内的JNK及NF-κB表达而加重神经损伤. 与肠道微生物群相比, 一旦血脑屏障受损, 口腔微生物群可更直接和快速到达大脑, 导致Aβ清除障碍并诱导AD发生[45]. 文献报道[37], 杀灭颅内Pg病原菌可阻断Aβ产生, 减轻神经炎症并挽救海马区受损的神经细胞. 将AD模型小鼠的肠道细菌种植于无菌小鼠体内, 可导致无菌小鼠脑组织中出现更多的斑块沉积. 与正常小鼠相比, 无菌小鼠表现出学习和记忆功能降低, 而给予益生菌治疗则可改善无菌小鼠的记忆功能[46], 说明肠道菌群在调控小鼠学习及认知功能方面发挥重要作用.
生理条件下, Tau调节微管动力并参与细胞内运输. 在AD发作期间, 过度磷酸化的Tau蛋白影响了神经元骨架微管蛋白的稳定性, 导致神经原纤维缠结, 进而破坏了神经元及突触的正常功能[47]. AD患者大脑中可发现牙龈蛋白酶与Tau缠结共定位[37]. 牙周病患者牙龈卟啉单胞菌衍生的LPS可诱导Tau过度磷酸化[48]. 在小鼠实验中, Pg释放的OMVs会激活NLRP3炎症小体, 导致大脑Tau蛋白过度磷酸化及认知障碍[43]. 轻度认知障碍的AD患者肠道菌群失调率显著高于正常人群, 其消化不良症状常始于AD早期[49]. 通过调节肠道微生物群、靶向改变小胶质细胞功能状态, 对于抑制神经炎症, 改善神经退行性疾病具有潜在的应用价值[50,51].
PD是一种进行性神经系统疾病, 可导致震颤、肌肉僵硬、行走不稳以及平衡失调. PD的发生与黑质多巴胺能神经元变性坏死, 线粒体功能障碍, α-突触核蛋白(α-Syn)错误折叠和聚集等密切相关[52,53]. 将帕金森病人的肠道菌群移植到小鼠体内会加剧小鼠运动缺陷[52]. 口服Pg可导致LRRK2 R1441G小鼠结肠通透性增加及肠道神经元中α-Syn聚集[54,55], α-Syn蛋白则以类似朊病毒的方式通过迷走神经从肠道传播到大脑[56], 加剧了α-Syn蛋白在大脑中错误折叠及沉积[57]. Pg还可活化小胶质细胞, 导致小鼠黑质多巴胺能神经元减少[58,59]. Xiang等[60]建立了一种全新的转基因诱导肠道神经元表达α-Syn的帕金森病小鼠模型, 发现肠源性α-Syn可出现自发性聚集, 并通过迷走神经播散至脑内迷走神经背核, 孤束核等儿茶酚胺类, 乙酰胆碱能神经元区, 甚至更远的脑区, 这些都揭示了菌群失调在PD中的作用. 人群研究表明, PD患者乙状结肠黏膜与正常人群存在差异, 产生抗丁酸盐的细菌低于正常人群, 而促炎的变形杆菌种类明显增多[61]. 此外, α-Syn神经元病变首先出现在乙状结肠, 2-5年后才出现PD的特征性神经症状[62]. Zhao等[63]发现, 粪菌移植可减轻BBB损伤并降低LPS水平, 抑制黑质区域的神经炎症, 减少多巴胺能神经元的损伤. 上述研究均提示, 肠道菌群失调, 肠道病变与神经退行性疾病相关[64]. 肠道系统发生病变的时点往往早于神经系统, 表明菌群失调导致的肠道病变参与了神经退行性疾病的发病机制.
亨廷顿病(huntington's disease, HD)是亨廷顿蛋白HTT基因中CAG重复序列扩增引起的神经退行性疾病, 于1872年由亨廷顿首次提出[65], 典型症状包括舞蹈样不自主运动, 认知障碍及精神行为异常三联征. HTT基因在整个大脑和身体病变部位, 包括肠道上皮和肠道神经细胞均表达.
研究发现, HD患者龋齿和牙菌斑较正常人群明显增多[66]. HD患者肠道微生物群数量和丰度均明显下降[67]. 肠道菌群比例失调[68], 拟杆菌门比例增加, 厚壁菌门比例减少[69-73], 这些特定肠道微生物的丰度变化与HD疾病的严重程度明显相关[74]. 微生物衍生的代谢物(如短链脂肪酸)的变化及线粒体功能和氧化应激均可加剧HD进展[75]. 因此, 预防牙科疾病是亨廷顿病治疗中的重要环节[66].
抑郁, 焦虑是现代社会中严重影响人类健康的疾病. 根据世界卫生组织的一份报告, 全球抑郁症患者每年都在急剧增加[76]. 重度抑郁症是最具致残性的精神障碍疾病之一, 影响着全球超过3500万人. 重度抑郁障碍(major depressive disorder, MDD)的特征是显著且持续的情绪低落, 并由遗传和环境因素共同驱动[73]. MDD可能与许多生物途径和系统的变化有关, 包括菌群失调、免疫系统、激素和氧化应激[77].
牙周炎患者重度抑郁症的患病率较高[78]. 慢性牙周炎可能干扰HPA轴, 通过炎症级联反应诱发皮质醇增加并产生神经炎症[79,80]. 色氨酸代谢在抑郁症发病中具有重要作用.人体内95%的色氨酸通过犬尿途径被代谢, 其关键代谢酶吲哚胺2,3-双加氧酶及色氨酸2,3-双加氧酶均可被炎症因子激活, 导致具有特定神经活性的代谢产物(如5-HT)过多[81,82]. Hsu等[83]通过多因素Cox回归模型证实牙周炎是抑郁症患者的独立危险因素. 牙周炎患者口腔微生物群通过直接影响宿主肠道微生物群而加重抑郁症状[84]. Kelly等[85]研究发现, 抑郁症患者肠道菌群的丰度和多样性显著降低, 若将抑郁症患者的粪便移植给无菌小鼠, 小鼠则出现狂躁和焦虑等行为, 同时伴有色氨酸代谢的变化. 肠道菌群失调及炎症反应还可影响肠嗜铬细胞活性, 而嗜铬细胞产生5-HT等神经递质不仅可调节肠蠕动, 还影响着人体的情绪[86]. MDD患者拟杆菌门/厚壁菌门比例的增加, 其比例变化与亨廷顿病患者一致[87]. Yu等[88]采用16SrRNA基因测序技术结合代谢组学方法对大鼠抑郁模型进行研究, 结果发现抑郁症能够影响肠道菌群并改变宿主的代谢表型. 文献报道[89], 补充乳酸杆菌可减轻小鼠因压力而导致焦虑的行为. 使用人类的共生脆弱拟杆菌可保持肠道菌群趋于稳态并改善自闭症状[90]. 在动物及人体实验中, 给予益生菌治疗可缓解抑郁及焦虑症状[91-94], 为神经精神疾病的治疗探索了一种新的方法, 有待于临床大规模、多中心进一步验证.
口腔, 肠道微生物群通过神经系统、免疫系统和神经内分泌相关通路的双向调节, 在维持口腔、肠道内环境和大脑神经稳态发挥重要作用. 通过保护黏膜上皮及血脑屏障的完整性, 改善局部菌群组成、菌群多样性及其代谢产物进而在表观遗传层面调节脑神经功能, 将有助于改变宿主的生物学行为并影响疾病的发生和进展. "口-肠-脑轴"这一新概念的提出有助于找到神经疾病的原始或伴随病因, 为预防及治疗这类疾病提供了新的手段. 目前, 关于菌群失调与神经精神疾病病理变化的时序关系还未充分证明. 表观遗传机制在脑神经发育及功能调节中的作用研究尚少, 不同疾病的菌群失调表达谱特征尚未绘制, 基于病理学基础的有效药物报道也不多, 仅少数基因的多样性被发现在菌群紊乱与神经精神疾病之间存在作用. 未来采用生物信息技术及多组学手段对肠道菌群、免疫系统与表观遗传之间的关系进行研究, 同时开展大规模益生菌对神经精神系统疾病治疗, 以期筛选出有效改善神经系统疾病的优良菌株, 为早期防治精神神经疾病开启新的篇章.
学科分类: 胃肠病学和肝病学
手稿来源地: 广东省
同行评议报告学术质量分类
A级 (优秀): A
B级 (非常好): 0
C级 (良好): C
D级 (一般): D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Yamazaki K. Oral-gut axis as a novel biological mechanism linking periodontal disease and systemic diseases: A review. Jpn Dent Sci Rev. 2023;59:273-280. [PubMed] [DOI] |
| 2. | Schroeder BO, Bäckhed F. Signals from the gut microbiota to distant organs in physiology and disease. Nat Med. 2016;22:1079-1089. [PubMed] [DOI] |
| 3. | Shanahan F. The Brain-Gut Axis and the Mucosal Immunoinflammatory Response[M/OL]//Szabo S, Taché Y, Glavin GB. Neuroendocrinology of Gastrointestinal Ulceration. Boston, MA: Springer US, 1995: 103-108. [DOI] |
| 4. | Braniste V, Al-Asmakh M, Kowal C, Anuar F, Abbaspour A, Tóth M, Korecka A, Bakocevic N, Ng LG, Kundu P, Gulyás B, Halldin C, Hultenby K, Nilsson H, Hebert H, Volpe BT, Diamond B, Pettersson S. The gut microbiota influences blood-brain barrier permeability in mice. Sci Transl Med. 2014;6:263ra158. [PubMed] [DOI] |
| 5. | Möhle L, Mattei D, Heimesaat MM, Bereswill S, Fischer A, Alutis M, French T, Hambardzumyan D, Matzinger P, Dunay IR, Wolf SA. Ly6C(hi) Monocytes Provide a Link between Antibiotic-Induced Changes in Gut Microbiota and Adult Hippocampal Neurogenesis. Cell Rep. 2016;15:1945-1956. [PubMed] [DOI] |
| 6. | Ilievski V, Zuchowska PK, Green SJ, Toth PT, Ragozzino ME, Le K, Aljewari HW, O'Brien-Simpson NM, Reynolds EC, Watanabe K. Chronic oral application of a periodontal pathogen results in brain inflammation, neurodegeneration and amyloid beta production in wild type mice. PLoS One. 2018;13:e0204941. [PubMed] [DOI] |
| 7. | Narengaowa, Kong W, Lan F, Awan UF, Qing H, Ni J. The Oral-Gut-Brain AXIS: The Influence of Microbes in Alzheimer's Disease. Front Cell Neurosci. 2021;15:633735. [PubMed] [DOI] |
| 8. | Bowland GB, Weyrich LS. The Oral-Microbiome-Brain Axis and Neuropsychiatric Disorders: An Anthropological Perspective. Front Psychiatry. 2022;13:810008. [PubMed] [DOI] |
| 9. | Dewhirst FE, Chen T, Izard J, Paster BJ, Tanner AC, Yu WH, Lakshmanan A, Wade WG. The human oral microbiome. J Bacteriol. 2010;192:5002-5017. [PubMed] [DOI] |
| 10. | du Teil Espina M, Gabarrini G, Harmsen HJM, Westra J, van Winkelhoff AJ, van Dijl JM. Talk to your gut: the oral-gut microbiome axis and its immunomodulatory role in the etiology of rheumatoid arthritis. FEMS Microbiol Rev. 2019;43:1-18. [PubMed] [DOI] |
| 11. | Konkel JE, O'Boyle C, Krishnan S. Distal Consequences of Oral Inflammation. Front Immunol. 2019;10:1403. [PubMed] [DOI] |
| 12. | Taati Moghadam M, Amirmozafari N, Mojtahedi A, Bakhshayesh B, Shariati A, Masjedian Jazi F. Association of perturbation of oral bacterial with incident of Alzheimer's disease: A pilot study. J Clin Lab Anal. 2022;36:e24483. [PubMed] [DOI] |
| 13. | Bao J, Li L, Zhang Y, Wang M, Chen F, Ge S, Chen B, Yan F. Periodontitis may induce gut microbiota dysbiosis via salivary microbiota. Int J Oral Sci. 2022;14:32. [PubMed] [DOI] |
| 14. | Li Y, Liu P. Characteristics of Oral-Gut Microbiota in Model Rats with CUMS-Induced Depression. Neuropsychiatr Dis Treat. 2024;20:221-232. [PubMed] [DOI] |
| 15. | Banks WA, Farr SA, Morley JE. Entry of blood-borne cytokines into the central nervous system: effects on cognitive processes. Neuroimmunomodulation 2002-. 2003;10:319-327. [PubMed] [DOI] |
| 16. | Sundar S, Battistoni C, McNulty R, Morales F, Gorky J, Foley H, Dhurjati P. An agent-based model to investigate microbial initiation of Alzheimer's via the olfactory system. Theor Biol Med Model. 2020;17:5. [PubMed] [DOI] |
| 17. | Kaelberer MM, Rupprecht LE, Liu WW, Weng P, Bohórquez DV. Neuropod Cells: The Emerging Biology of Gut-Brain Sensory Transduction. Annu Rev Neurosci. 2020;43:337-353. [PubMed] [DOI] |
| 18. | Rea K, Dinan TG, Cryan JF. The microbiome: A key regulator of stress and neuroinflammation. Neurobiol Stress. 2016;4:23-33. [PubMed] [DOI] |
| 19. | Rusch JA, Layden BT, Dugas LR. Signalling cognition: the gut microbiota and hypothalamic-pituitary-adrenal axis. Front Endocrinol (Lausanne). 2023;14:1130689. [PubMed] [DOI] |
| 20. | Li X, Kiprowska M, Kansara T, Kansara P, Li P. Neuroinflammation: A Distal Consequence of Periodontitis. J Dent Res. 2022;101:1441-1449. [PubMed] [DOI] |
| 21. | Marizzoni M, Cattaneo A, Mirabelli P, Festari C, Lopizzo N, Nicolosi V, Mombelli E, Mazzelli M, Luongo D, Naviglio D, Coppola L, Salvatore M, Frisoni GB. Short-Chain Fatty Acids and Lipopolysaccharide as Mediators Between Gut Dysbiosis and Amyloid Pathology in Alzheimer's Disease. J Alzheimers Dis. 2020;78:683-697. [PubMed] [DOI] |
| 22. | Erny D, Hrabě de Angelis AL, Jaitin D, Wieghofer P, Staszewski O, David E, Keren-Shaul H, Mahlakoiv T, Jakobshagen K, Buch T, Schwierzeck V, Utermöhlen O, Chun E, Garrett WS, McCoy KD, Diefenbach A, Staeheli P, Stecher B, Amit I, Prinz M. Host microbiota constantly control maturation and function of microglia in the CNS. Nat Neurosci. 2015;18:965-977. [PubMed] [DOI] |
| 23. | Dhapola R, Hota SS, Sarma P, Bhattacharyya A, Medhi B, Reddy DH. Recent advances in molecular pathways and therapeutic implications targeting neuroinflammation for Alzheimer's disease. Inflammopharmacology. 2021;29:1669-1681. [PubMed] [DOI] |
| 24. | Geerts SO, Nys M, De MP, Charpentier J, Albert A, Legrand V, Rompen EH. Systemic release of endotoxins induced by gentle mastication: association with periodontitis severity. J Periodontol. 2002;73:73-78. [PubMed] [DOI] |
| 25. | Furness JB. The enteric nervous system and neurogastroenterology. Nat Rev Gastroenterol Hepatol. 2012;9:286-294. [PubMed] [DOI] |
| 26. | Sprockett D, Fukami T, Relman DA. Role of priority effects in the early-life assembly of the gut microbiota. Nat Rev Gastroenterol Hepatol. 2018;15:197-205. [PubMed] [DOI] |
| 27. | Cummings J. Disease modification and Neuroprotection in neurodegenerative disorders. Transl Neurodegener. 2017;6:25. [PubMed] [DOI] |
| 29. | Logroscino G, Urso D, Savica R. Descriptive Epidemiology of Neurodegenerative Diseases: What Are the Critical Questions? Neuroepidemiology. 2022;56:309-318. [PubMed] [DOI] |
| 30. | Batista CRA, Gomes GF, Candelario-Jalil E, Fiebich BL, de Oliveira ACP. Lipopolysaccharide-Induced Neuroinflammation as a Bridge to Understand Neurodegeneration. Int J Mol Sci. 2019;20. [PubMed] [DOI] |
| 31. | Askari VR, Shafiee-Nick R. The protective effects of β-caryophyllene on LPS-induced primary microglia M(1)/M(2) imbalance: A mechanistic evaluation. Life Sci. 2019;219:40-73. [PubMed] [DOI] |
| 32. | Wang X, Michaelis EK. Selective neuronal vulnerability to oxidative stress in the brain. Front Aging Neurosci. 2010;2:12. [PubMed] [DOI] |
| 33. | Prince M, Ali GC, Guerchet M, Prina AM, Albanese E, Wu YT. Recent global trends in the prevalence and incidence of dementia, and survival with dementia. Alzheimers Res Ther. 2016;8:23. [PubMed] [DOI] |
| 34. | Leng F, Edison P. Neuroinflammation and microglial activation in Alzheimer disease: where do we go from here? Nat Rev Neurol. 2021;17:157-172. [PubMed] [DOI] |
| 35. | Barbour A, Elebyary O, Fine N, Oveisi M, Glogauer M. Metabolites of the oral microbiome: important mediators of multikingdom interactions. FEMS Microbiol Rev. 2022;46. [PubMed] [DOI] |
| 36. | Zhang M, Mi N, Ying Z, Lin X, Jin Y. Advances in the prevention and treatment of Alzheimer's disease based on oral bacteria. Front Psychiatry. 2023;14:1291455. [PubMed] [DOI] |
| 37. | Dominy SS, Lynch C, Ermini F, Benedyk M, Marczyk A, Konradi A, Nguyen M, Haditsch U, Raha D, Griffin C, Holsinger LJ, Arastu-Kapur S, Kaba S, Lee A, Ryder MI, Potempa B, Mydel P, Hellvard A, Adamowicz K, Hasturk H, Walker GD, Reynolds EC, Faull RLM, Curtis MA, Dragunow M, Potempa J. Porphyromonas gingivalis in Alzheimer's disease brains: Evidence for disease causation and treatment with small-molecule inhibitors. Sci Adv. 2019;5:eaau3333. [PubMed] [DOI] |
| 38. | Mao S, Huang CP, Lan H, Lau HG, Chiang CP, Chen YW. Association of periodontitis and oral microbiomes with Alzheimer's disease: A narrative systematic review. J Dent Sci. 2022;17:1762-1779. [PubMed] [DOI] |
| 39. | La Rosa F, Clerici M, Ratto D, Occhinegro A, Licito A, Romeo M, Iorio CD, Rossi P. The Gut-Brain Axis in Alzheimer's Disease and Omega-3. A Critical Overview of Clinical Trials. Nutrients. 2018;10. [PubMed] [DOI] |
| 40. | Dibello V, Lozupone M, Manfredini D, Dibello A, Zupo R, Sardone R, Daniele A, Lobbezoo F, Panza F. Oral frailty and neurodegeneration in Alzheimer's disease. Neural Regen Res. 2021;16:2149-2153. [PubMed] [DOI] |
| 41. | Sureda A, Daglia M, Argüelles Castilla S, Sanadgol N, Fazel Nabavi S, Khan H, Belwal T, Jeandet P, Marchese A, Pistollato F, Forbes-Hernandez T, Battino M, Berindan-Neagoe I, D'Onofrio G, Nabavi SM. Oral microbiota and Alzheimer's disease: Do all roads lead to Rome? Pharmacol Res. 2020;151:104582. [PubMed] [DOI] |
| 42. | Guerrero-Carrasco M, Targett I, Olmos-Alonso A, Vargas-Caballero M, Gomez-Nicola D. Low-grade systemic inflammation stimulates microglial turnover and accelerates the onset of Alzheimer's-like pathology. Glia. 2024;72:1340-1355. [PubMed] [DOI] |
| 43. | Ma L, Cao Z. Membrane vesicles from periodontal pathogens and their potential roles in periodontal disease and systemic illnesses. J Periodontal Res. 2021;56:646-655. [PubMed] [DOI] |
| 44. | Peng Z, Luchtman DW, Wang X, Zhang Y, Song C. Activation of microglia synergistically enhances neurodegeneration caused by MPP(+) in human SH-SY5Y cells. Eur J Pharmacol. 2019;850:64-74. [PubMed] [DOI] |
| 45. | Cockerill I, Oliver JA, Xu H, Fu BM, Zhu D. Blood-Brain Barrier Integrity and Clearance of Amyloid-β from the BBB. Adv Exp Med Biol. 2018;1097:261-278. [PubMed] [DOI] |
| 46. | Savignac HM, Tramullas M, Kiely B, Dinan TG, Cryan JF. Bifidobacteria modulate cognitive processes in an anxious mouse strain. Behav Brain Res. 2015;287:59-72. [PubMed] [DOI] |
| 47. | García-Escudero V, Ruiz-Gabarre D, Gargini R, Pérez M, García E, Cuadros R, Hernández IH, Cabrera JR, García-Escudero R, Lucas JJ, Hernández F, Ávila J. A new non-aggregative splicing isoform of human Tau is decreased in Alzheimer's disease. Acta Neuropathol. 2021;142:159-177. [PubMed] [DOI] |
| 48. | Li R, Wang J, Xiong W, Luo Y, Feng H, Zhou H, Peng Y, He Y, Ye Q. The oral-brain axis: can periodontal pathogens trigger the onset and progression of Alzheimer's disease? Front Microbiol. 2024;15:1358179. [PubMed] [DOI] |
| 49. | Zhang X, Wang Y, Liu W, Wang T, Wang L, Hao L, Ju M, Xiao R. Diet quality, gut microbiota, and microRNAs associated with mild cognitive impairment in middle-aged and elderly Chinese population. Am J Clin Nutr. 2021;114:429-440. [PubMed] [DOI] |
| 50. | Molinero N, Antón-Fernández A, Hernández F, Ávila J, Bartolomé B, Moreno-Arribas MV. Gut Microbiota, an Additional Hallmark of Human Aging and Neurodegeneration. Neuroscience. 2023;518:141-161. [PubMed] [DOI] |
| 51. | Boeri L, Perottoni S, Izzo L, Giordano C, Albani D. Microbiota-Host Immunity Communication in Neurodegenerative Disorders: Bioengineering Challenges for In Vitro Modeling. Adv Healthc Mater. 2021;10:e2002043. [PubMed] [DOI] |
| 52. | Sampson TR, Debelius JW, Thron T, Janssen S, Shastri GG, Ilhan ZE, Challis C, Schretter CE, Rocha S, Gradinaru V, Chesselet MF, Keshavarzian A, Shannon KM, Krajmalnik-Brown R, Wittung-Stafshede P, Knight R, Mazmanian SK. Gut Microbiota Regulate Motor Deficits and Neuroinflammation in a Model of Parkinson's Disease. Cell. 2016;167:1469-1480.e12. [PubMed] [DOI] |
| 53. | Spires-Jones TL, Attems J, Thal DR. Interactions of pathological proteins in neurodegenerative diseases. Acta Neuropathol. 2017;134:187-205. [PubMed] [DOI] |
| 54. | Braak H, Sastre M, Bohl JR, de Vos RA, Del Tredici K. Parkinson's disease: lesions in dorsal horn layer I, involvement of parasympathetic and sympathetic pre- and postganglionic neurons. Acta Neuropathol. 2007;113:421-429. [PubMed] [DOI] |
| 55. | Kim S, Kwon SH, Kam TI, Panicker N, Karuppagounder SS, Lee S, Lee JH, Kim WR, Kook M, Foss CA, Shen C, Lee H, Kulkarni S, Pasricha PJ, Lee G, Pomper MG, Dawson VL, Dawson TM, Ko HS. Transneuronal Propagation of Pathologic α-Synuclein from the Gut to the Brain Models Parkinson's Disease. Neuron. 2019;103:627-641.e7. [PubMed] [DOI] |
| 56. | Irwin DJ, Lee VM, Trojanowski JQ. Parkinson's disease dementia: convergence of α-synuclein, tau and amyloid-β pathologies. Nat Rev Neurosci. 2013;14:626-636. [PubMed] [DOI] |
| 57. | Karstens AJ, Tussing-Humphreys L, Zhan L, Rajendran N, Cohen J, Dion C, Zhou XJ, Lamar M. Associations of the Mediterranean diet with cognitive and neuroimaging phenotypes of dementia in healthy older adults. Am J Clin Nutr. 2019;109:361-368. [PubMed] [DOI] |
| 58. | Wang B, Zhang C, Shi C, Zhai T, Zhu J, Wei D, Shen J, Liu Z, Jia K, Zhao L. Mechanisms of oral microflora in Parkinson's disease. Behav Brain Res. 2024;474:115200. [PubMed] [DOI] |
| 59. | Feng YK, Wu QL, Peng YW, Liang FY, You HJ, Feng YW, Li G, Li XJ, Liu SH, Li YC, Zhang Y, Pei Z. Oral P. gingivalis impairs gut permeability and mediates immune responses associated with neurodegeneration in LRRK2 R1441G mice. J Neuroinflammation. 2020;17:347. [PubMed] [DOI] |
| 60. | Xiang J, Tang J, Kang F, Ye J, Cui Y, Zhang Z, Wang J, Wu S, Ye K. Gut-induced alpha-Synuclein and Tau propagation initiate Parkinson's and Alzheimer's disease co-pathology and behavior impairments. Neuron. 2024. [PubMed] [DOI] |
| 61. | Keshavarzian A, Green SJ, Engen PA, Voigt RM, Naqib A, Forsyth CB, Mutlu E, Shannon KM. Colonic bacterial composition in Parkinson's disease. Mov Disord. 2015;30:1351-1360. [PubMed] [DOI] |
| 62. | Shannon KM, Keshavarzian A, Dodiya HB, Jakate S, Kordower JH. Is alpha-synuclein in the colon a biomarker for premotor Parkinson's disease? Evidence from 3 cases. Mov Disord. 2012;27:716-719. [PubMed] [DOI] |
| 63. | Zhao Z, Ning J, Bao XQ, Shang M, Ma J, Li G, Zhang D. Fecal microbiota transplantation protects rotenone-induced Parkinson's disease mice via suppressing inflammation mediated by the lipopolysaccharide-TLR4 signaling pathway through the microbiota-gut-brain axis. Microbiome. 2021;9:226. [PubMed] [DOI] |
| 64. | Chi L, Cheng X, Lin L, Yang T, Sun J, Feng Y, Liang F, Pei Z, Teng W. Porphyromonas gingivalis-Induced Cognitive Impairment Is Associated With Gut Dysbiosis, Neuroinflammation, and Glymphatic Dysfunction. Front Cell Infect Microbiol. 2021;11:755925. [PubMed] [DOI] |
| 65. | Franklin GL, Teive HAG, Meira AT, Nepomuceno AMT, Tabrizi SJ. "On Chorea": 150 Years of the Beginning of Hope. Mov Disord. 2022;37:2194-2196. [PubMed] [DOI] |
| 66. | Saft C, Andrich JE, Müller T, Becker J, Jackowski J. Oral and dental health in Huntington's disease - an observational study. BMC Neurol. 2013;13:114. [PubMed] [DOI] |
| 67. | Wasser CI, Mercieca EC, Kong G, Hannan AJ, McKeown SJ, Glikmann-Johnston Y, Stout JC. Gut dysbiosis in Huntington's disease: associations among gut microbiota, cognitive performance and clinical outcomes. Brain Commun. 2020;2:fcaa110. [PubMed] [DOI] |
| 68. | Kong G, Lê Cao KA, Hannan AJ. Alterations in the Gut Fungal Community in a Mouse Model of Huntington's Disease. Microbiol Spectr. 2022;10:e0219221. [PubMed] [DOI] |
| 69. | Gerhardt S, Mohajeri MH. Changes of Colonic Bacterial Composition in Parkinson's Disease and Other Neurodegenerative Diseases. Nutrients. 2018;10. [PubMed] [DOI] |
| 70. | Khoshnan A. Gut Microbiota as a Modifier of Huntington's Disease Pathogenesis. J Huntingtons Dis. 2024;13:133-147. [PubMed] [DOI] |
| 71. | Stan TL, Soylu-Kucharz R, Burleigh S, Prykhodko O, Cao L, Franke N, Sjögren M, Haikal C, Hållenius F, Björkqvist M. Increased intestinal permeability and gut dysbiosis in the R6/2 mouse model of Huntington's disease. Sci Rep. 2020;10:18270. [PubMed] [DOI] |
| 72. | Ekwudo MN, Gubert C, Hannan AJ. The microbiota-gut-brain axis in Huntington's disease: pathogenic mechanisms and therapeutic targets. FEBS J. 2024. [PubMed] [DOI] |
| 73. | Kong G, Cao KL, Judd LM, Li S, Renoir T, Hannan AJ. Microbiome profiling reveals gut dysbiosis in a transgenic mouse model of Huntington's disease. Neurobiol Dis. 2020;135:104268. [PubMed] [DOI] |
| 74. | Sharma G, Biswas SS, Mishra J, Navik U, Kandimalla R, Reddy PH, Bhatti GK, Bhatti JS. Gut microbiota dysbiosis and Huntington's disease: Exploring the gut-brain axis and novel microbiota-based interventions. Life Sci. 2023;328:121882. [PubMed] [DOI] |
| 75. | Jodeiri Farshbaf M, Ghaedi K. Huntington's Disease and Mitochondria. Neurotox Res. 2017;32:518-529. [PubMed] [DOI] |
| 76. | Song J, Kim YK. Animal models for the study of depressive disorder. CNS Neurosci Ther. 2021;27:633-642. [PubMed] [DOI] |
| 77. | Kennis M, Gerritsen L, van Dalen M, Williams A, Cuijpers P, Bockting C. Prospective biomarkers of major depressive disorder: a systematic review and meta-analysis. Mol Psychiatry. 2020;25:321-338. [PubMed] [DOI] |
| 78. | Chang KH, Hsu YC, Chiu IM, Chen LC, Hsu CC, Lee CY, Fan HC, Chen HJ, Chou RH. Association between periodontitis and bipolar disorder: A nationwide cohort study. Medicine (Baltimore). 2020;99:e21423. [PubMed] [DOI] |
| 79. | Jelavić S, Bajić Ž, Filipčić IŠ, Čulina IJ, Filipčić I, Aurer A. Periodontal status and the efficacy of the first-line treatment of major depressive disorder. Clin Exp Dent Res. 2022;8:366-373. [PubMed] [DOI] |
| 80. | Hashioka S, Inoue K, Miyaoka T, Hayashida M, Wake R, Oh-Nishi A, Inagaki M. The Possible Causal Link of Periodontitis to Neuropsychiatric Disorders: More Than Psychosocial Mechanisms. Int J Mol Sci. 2019;20. [PubMed] [DOI] |
| 81. | Anderson G, Maes M. Bipolar disorder: role of immune-inflammatory cytokines, oxidative and nitrosative stress and tryptophan catabolites. Curr Psychiatry Rep. 2015;17:8. [PubMed] [DOI] |
| 82. | Kennedy PJ, Cryan JF, Dinan TG, Clarke G. Kynurenine pathway metabolism and the microbiota-gut-brain axis. Neuropharmacology. 2017;112:399-412. [PubMed] [DOI] |
| 83. | Hsu CC, Hsu YC, Chen HJ, Lin CC, Chang KH, Lee CY, Chong LW, Kao CH. Association of Periodontitis and Subsequent Depression: A Nationwide Population-Based Study. Medicine (Baltimore). 2015;94:e2347. [PubMed] [DOI] |
| 84. | Qian J, Lu J, Cheng S, Zou X, Tao Q, Wang M, Wang N, Zheng L, Liao W, Li Y, Yan F. Periodontitis salivary microbiota exacerbates colitis-induced anxiety-like behavior via gut microbiota. NPJ Biofilms Microbiomes. 2023;9:93. [PubMed] [DOI] |
| 85. | Kelly JR, Borre Y, O' Brien C, Patterson E, El Aidy S, Deane J, Kennedy PJ, Beers S, Scott K, Moloney G, Hoban AE, Scott L, Fitzgerald P, Ross P, Stanton C, Clarke G, Cryan JF, Dinan TG. Transferring the blues: Depression-associated gut microbiota induces neurobehavioural changes in the rat. J Psychiatr Res. 2016;82:109-118. [PubMed] [DOI] |
| 86. | Evrensel A, Ünsalver BÖ, Ceylan ME. Immune-Kynurenine Pathways and the Gut Microbiota-Brain Axis in Anxiety Disorders. Adv Exp Med Biol. 2020;1191:155-167. [PubMed] [DOI] |
| 87. | Liu L, Wang H, Zhang H, Chen X, Zhang Y, Wu J, Zhao L, Wang D, Pu J, Ji P, Xie P. Toward a Deeper Understanding of Gut Microbiome in Depression: The Promise of Clinical Applicability. Adv Sci (Weinh). 2022;9:e2203707. [PubMed] [DOI] |
| 88. | Yu M, Jia H, Zhou C, Yang Y, Zhao Y, Yang M, Zou Z. Variations in gut microbiota and fecal metabolic phenotype associated with depression by 16S rRNA gene sequencing and LC/MS-based metabolomics. J Pharm Biomed Anal. 2017;138:231-239. [PubMed] [DOI] |
| 89. | Kim YK, Jeon SW. Neuroinflammation and the Immune-Kynurenine Pathway in Anxiety Disorders. Curr Neuropharmacol. 2018;16:574-582. [PubMed] [DOI] |
| 90. | Hsiao EY, McBride SW, Hsien S, Sharon G, Hyde ER, McCue T, Codelli JA, Chow J, Reisman SE, Petrosino JF, Patterson PH, Mazmanian SK. Microbiota modulate behavioral and physiological abnormalities associated with neurodevelopmental disorders. Cell. 2013;155:1451-1463. [PubMed] [DOI] |
| 91. | Dowling LR, Strazzari MR, Keely S, Kaiko GE. Enteric nervous system and intestinal epithelial regulation of the gut-brain axis. J Allergy Clin Immunol. 2022;150:513-522. [PubMed] [DOI] |
| 92. | Wang H, Li Y, Feng X, Li Y, Wang W, Qiu C, Xu J, Yang Z, Li Z, Zhou Q, Yao K, Wang H, Li Y, Li D, Dai W, Zheng Y. Dysfunctional gut microbiota and relative co-abundance network in infantile eczema. Gut Pathog. 2016;8:36. [PubMed] [DOI] |
| 93. | Ma Q, Xing C, Long W, Wang HY, Liu Q, Wang RF. Impact of microbiota on central nervous system and neurological diseases: the gut-brain axis. J Neuroinflammation. 2019;16:53. [PubMed] [DOI] |
| 94. | Jang HM, Lee HJ, Jang SE, Han MJ, Kim DH. Evidence for interplay among antibacterial-induced gut microbiota disturbance, neuro-inflammation, and anxiety in mice. Mucosal Immunol. 2018;11:1386-1397. [PubMed] [DOI] |