修回日期: 2023-12-02
接受日期: 2023-12-20
在线出版日期: 2024-01-28
慢性乙型肝炎病毒(hepatitis B virus, HBV)感染的防治依然任重而道远. 即使我国新版指南扩大了抗病毒治疗适应证, 依然有一定比例的HBV感染者不符合抗病毒治疗适应证, 称之为不确定期或灰区(grey zone, GZ). 但当前关于不确定期或GZ的解读与判断标准较为混乱, 两者之间的联系与区别还不甚清晰, 不同研究所指向的对象不尽相同. 但无论如何认定不确定期或GZ, 其目的是为了及时、准确判断慢性HBV感染的疾病进展与是否需要及时治疗. 基于GZ对应于"治疗的适应证分类"和不确定期对应于 "自然史分期"的理解, 本文结合国内外的研究进展阐述对慢性HBV感染不确定期与GZ的再认识. GZ即为不治疗对象 (不符合抗病毒治疗适应证), 而不确定期仅为难以明确归于自然史分期(不符合自然史分期)的患者, GZ应包括不确定期, 而不是等同关系. 对应我国新版指南标准, 属于GZ的不确定期患者, 建议抗病毒治疗; 对应欧洲肝病学会2017年指南标准, 免疫控制期与属于GZ的不确定期患者, 建议抗病毒治疗.
核心提要: 当前乙型肝炎不确定期或灰区(grey zone, GZ)的解读与判断标准较为混乱, 两者之间的联系与区别还不甚清晰, 不同研究所指向的对象不尽相同. 基于GZ对应于"治疗的适应证分类"和不确定期对应于"自然史分期"的理解、积极抗病毒治疗和扩大抗病毒治疗适应证的理念, 本文认为, GZ即为不治疗对象(不符合抗病毒治疗适应证), 而不确定期仅为难以明确归于自然史分期(不符合自然史分期)的患者, GZ应包括不确定期, 而不是等同关系.
引文著录: 蒋素文, 胡爱荣. 乙型肝炎不确定期与灰区的再认识. 世界华人消化杂志 2024; 32(1): 8-15
Revised: December 2, 2023
Accepted: December 20, 2023
Published online: January 28, 2024
The prevention and treatment of chronic hepatitis B virus (HBV) infection are still facing great challenges. Even though the Chinese Medical Association (CMA) guidelines for the prevention and treatment of chronic hepatitis B (CHB) (version 2022) have expanded the antiviral treatment indications, there is still a certain proportion of HBV infections that do not meet the antiviral treatment indications, known as the indeterminate phase or the gray zone (GZ). However, the current interpretation and judgment criteria for the indeterminate phase or GZ of HBV infection are not uniform, and their connections and differences are not very clear. Different studies focus on different subjects. Regardless of the identification of the indeterminate phase or GZ, the purpose is to timely and accurately determine the progression of CHB and whether timely treatment is needed. Based on the understanding that the GZ corresponds to the "classification of antiviral treatment indication" and that the indeterminate phase corresponds to the "natural history staging", this article elaborates on the further understanding of CHB in the indeterminate phase or in the GZ. This paper argues that the GZ refers to cases that do not receive treatment for not meeting the antiviral treatment indications, while the indeterminate phase refers to cases that are difficult to be clearly attributed to a natural history stage for not meeting the natural history staging criteria. Thus, the GZ should include the indeterminate phase, and they are not parallel concepts. According to the CMA guidelines (version 2022), patients in the indeterminate phase of GZ are recommended for antiviral treatment; according to the European Association for the Study of the Liver (EASL) guidelines (2017), antiviral therapy is recommended for patients in the immune control phase and the indeterminate phase of GZ.
- Citation: Jiang SW, Hu AR. Further understanding of chronic hepatitis B in the indeterminate phase or in the grey zone. Shijie Huaren Xiaohua Zazhi 2024; 32(1): 8-15
- URL: https://www.wjgnet.com/1009-3079/full/v32/i1/8.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v32.i1.8
乙型肝炎病毒(hepatitis B virus, HBV)感染呈世界性流行, 仍然是全球重大公共卫生问题[1]. 2019年全球一般人群乙型肝炎表面抗原(hepatitis B surface antigen, HBsAg)流行率为3.8%, 约有150万新发HBV感染者, 2.96亿慢性感染者, 82万人死于HBV感染所致的肝衰竭、肝硬化或肝细胞癌等相关疾病[2]. 根据世界卫生组织"2030年消除病毒性肝炎作为公共卫生危害"的战略目标, 届时慢性乙型肝炎(chronic hepatitis B, CHB)新发感染率要减少90%、死亡率减少65%、诊断率达到90%和治疗率达到80%[3]. 据Polaris国际流行病学合作组织推算, 2016年我国一般人群HBsAg流行率为6.1%, 慢性HBV感染者为8600万例; 但当前我国HBV感染的诊断率仅为19%, 治疗率仅为11%, 年死亡人数401000人; 如果按照这样的进程, 我国要在2051年之后才有可能实现世界卫生组织战略目标[4]. 因此, 我国HBV感染的疾病负担依然沉重, 要实现世界卫生组织"2030年消除病毒性肝炎重大公共卫生威胁"目标仍面临巨大挑战.
积极抗病毒治疗对延缓和减轻肝脏疾病进展、改善预后有着关键性作用. 因此, 我国《慢性乙型肝炎防治指南(2022年版)》(简称"新版指南")进一步扩大了抗病毒治疗适应证: 除肝硬化等重症患者(终末期肝病)外, 对于一般性HBV感染者: (1)血清HBV DNA阳性, 丙氨酸转氨酶(alanine aminotransferase, ALT)持续高于正常值上限(upper limits of normal, ULN), 1年内连续随访3次以上, 每次至少间隔3 mo, 且排除其他原因所致者, 建议抗病毒治疗; (2)对于血清HBV DNA阳性者, 无论ALT水平高低, 只要符合下列情况之一, 建议抗病毒治疗: ①有乙型肝炎肝硬化或肝细胞癌家族史. ②年龄>30岁. ③无创指标或肝组织学检查, 提示肝脏存在明显炎症(G≥2)或纤维化(F/S≥2). ④HBV相关肝外表现(肾小球肾炎、血管炎等); (3)对于随访1年以上, HBV DNA和ALT模式难以确定的未经治疗的"不确定期"CHB患者, 建议抗病毒治疗[1]. 慢性HBV感染是否已经进入了全员治疗(Treat-all)或简化治疗[5]时代?显而易见, 扩大抗病毒治疗的适应证并不等于全员治疗. 对于基线HBV DNA水平较高(>107 IU/mL或>2×107 IU/mL)的患者, 治疗后应答不佳或低病毒血症的问题亦可能会日益凸显[6].
即使新版指南扩大了抗病毒治疗适应证, 实际上, 依然有一定比例的HBV感染者不符合抗病毒治疗适应证, 有研究称之为不确定期(indeterminate phase)或灰区(grey zone, GZ), 当然还包括免疫耐受期(immune tolerant, IT). 我国IT期患者约1584万例[7].
从概念上理解, 不确定期对应慢性HBV感染"自然史分期", 而GZ对应慢性HBV感染"治疗的适应证分类". 但当前关于不确定期或GZ的认定还较为凌乱, 两者之间的联系与区别还不甚清晰, 不同研究所指向的对象不尽相同. 本文将从以下几方面阐述对慢性HBV感染不确定期与灰区的再认识.
在阐述不确定期所指向的对象时, 需明确HBV感染自然史分期. 依据我国新版指南, 慢性HBV感染自然史分期划分为4个期(表1): (1)乙型肝炎E抗原 (hepatitis B E antigen, HBeAg)阳性慢性HBV感染(也称IT期、慢性HBV携带状态); (2)HBeAg阳性CHB(也称免疫清除期、免疫活动期); (3)HBeAg阴性慢性HBV感染 (也称非活动期、免疫控制期、非活动性HBsAg携带状态); (4)HBeAg阴性CHB(也称再活动期)[1]. 欧洲肝病学会(EASL)2017年指南划分为5个期(表2): (1)HBeAg阳性慢性HBV感染(也称IT期); (2)HBeAg阳性CHB (HBeAg阳性慢性HBV感染免疫活动期); (3)HBeAg阴性慢性HBV感染 (也称非活动性HBsAg携带状态); (4)HBeAg阴性CHB; (5)HBsAg阴性状态(隐匿性HBV感染)[8]. 美国肝病学会(AASLD)2018年指导划分为3类(表3): (1)IT期CHB; (2)免疫活动期CHB; (3)非活动CHB[9].
| 项目(指标) | HBeAg阳性慢性HBV感染(IT期、慢性HBV携带状态) | HBeAg阳性CHB(免疫清除期、免疫活动期) | HBeAg阴性慢性HBV感染(非活动期、免疫控制期、非活动性HBsAg携带状态) | HBeAg阴性CHB (再活动期) |
| HBsAg(IU/mL) | >1×104 | + | <1×104 | + |
| HBeAg | + | + | - | - |
| HBV DNA(IU/mL) | >2×107 | + | - | + |
| ALT | <1×ULN | 持续或反复升高 | <1×ULN | 持续或反复升高 |
| 肝脏病理学(炎症活动度、肝纤维化程度) | 无明显炎症坏死和纤维化 | 明显炎症坏死和/或纤维化 | 无或仅有轻度炎症, 可有不同程度纤维化 | 明显炎症坏死和/或纤维化 |
| 项目(指标) | HBeAg阳性慢性HBV感染(IT期) | HBeAg阳性CHB(HBeAg阳性慢性HBV感染免疫活动期) | HBeAg阴性慢性HBV感染(非活动性HBsAg携带状态) | HBeAg阴性CHB | HBsAg阴性状态(隐匿性HBV感染) |
| HBsAg(IU/mL) | 高水平 | 中/高水平 | 低水平 | + | - |
| HBeAg | + | + | - | - | - |
| HBV DNA(IU/mL) | >107 | 104-107 | <2×103 | >2×103 | 通常阴性, 但亦可能阳性 |
| ALT | <1×ULN | 持续或反复升高 | <1×ULN | 持续或反复升高 | <1×ULN |
| 肝脏病理学(炎症活动度、肝纤维化程度) | 无/轻度炎症坏死和纤维化 | 中/重度炎症坏死和/或纤维化 | 无/轻度炎症坏死和纤维化 | 中/重度炎症坏死和/或纤维化 | 通常无/轻度炎症坏死和纤维化 |
| 项目(指标) | IT期CHB | 免疫活动期CHB | 非活动CHB |
| HBsAg(IU/mL) | + | + | + |
| HBeAg | + | +/- | -(抗HBe阳性) |
| HBV DNA(IU/mL) | >106 | >2×105(HBeAg阳性); >2×103(HBeAg阴性) | <2×103 |
| ALT(和/或AST) | <1×ULN | 持续或反复升高 | <1×ULN |
| 肝脏病理学(炎症活动度、肝纤维化程度) | 无明显炎症坏死和纤维化 | 明显炎症坏死和/或纤维化 | 无或仅有轻度炎症, 可有不同程度纤维化 |
但自然史分期并未涵盖所有慢性HBV感染者. 依据我国新版指南, (1)ALT正常、肝组织病理学损伤较轻、HBeAg阳性慢性HBV感染者, 当HBV DNA≤2×107 IU/mL和/或HBsAg≤1×104 IU/mL时, 如何归类?(2)ALT正常、肝组织病理学损伤较轻、HBeAg阴性慢性HBV感染者, 当HBV DNA阳性时, 如何归类?
我国新版指南指出, 不确定期慢性HBV感染者是指部分未经治疗的慢性HBV感染者随访1年, 按其病毒学指标(HBV DNA)、生物化学指标(ALT)水平及组织学均难以明确归于以上4期, 主要包括不能明确区分HBeAg阳性慢性HBV感染者与HBeAg阳性CHB患者, 以及不能明确区分HBeAg阴性HBV感染者与HBeAg阴性CHB患者, 约占所有慢性HBV感染者的28%-55%[1]. 但新版指南未明确不确定期慢性HBV感染者的具体人群, 不同研究针对不确定期所指向的对象亦不尽相同[10,11].
Chen等[12]研究将不确定期等同GZ, 1226例慢性HBV感染者中, 259例(21.1%)为IT期, 365例(29.8%)为HBeAg阳性CHB, 128例(10.4%)为HBeAg阴性慢性HBV感染, 33例(2.7%)为HBeAg阴性CHB, 441例(36.0%)为不确定期(GZ); 不确定期(GZ)患者中, 239例(54.2%)肝脏病理学有中/重度炎症坏死(G2-4), 213例(48.3%)有中/重度纤维化(S2-4). 但该研究未指出采用哪个指南的自然史分期. 因为我国指南HBV DNA高载量的定义值为>2×107 IU/mL, 而EASL指南的定义值为>107 IU/mL, AASLD指导的定义值为>106 IU/mL.
另有研究认为, 凡不符合AASLD 2018年指导标准(3类人群)的患者, 则定义为不确定期, 且未接受抗病毒治疗的不确定期患者5年、10年和15年的累计肝细胞癌(hepatocellular carcinoma, HCC)发生率分别为3%、15%和19%, 而抗病毒治疗组分别为3%、4%和9%, 抗病毒治疗可降低不确定期患者70%的HCC风险[13]. 一项回顾性队列研究纳入3366例未接受抗病毒治疗的慢性HBV感染者(美国及我国台湾地区人群), 中位随访时间12.5年, 不确定期仍定义为不符合AASLD 2018年指导标准的患者, 研究发现基线时不确定期患者约占38.7%(1303/3366); 随访至第10年, 不确定期患者中686名患者(52.7%)仍为不确定期, 而283名患者(21.7%)转为免疫活动期CHB;相比转为免疫活动期CHB的患者, 维持不确定期状态患者发生HCC的风险更高[14]. 另一项荟萃分析和系统综述纳入14项研究共计7798例不确定期患者, 同样以AASLD 2018年指导为诊断标准, 并以符合AASLD指导标准的3类人群为对照(10725例), 研究表明不确定期患者的HCC发生率为2.54/1000/年, 显著高于符合AASLD指导标准的3类人群(RR = 1.64, 95%CI: 1.34-2.00)[15].
有研究依据我国2019版指南将ALT正常、HBeAg阳性慢性HBV感染者的不确定期分为4类: (1)HBV DNA>2×107 IU/mL、HBsAg>1×104 IU/mL、以及肝组织病理炎症A 2-3级和(或)纤维化分期F 2-4期; (2)HBV DNA>2×107 IU/mL和HBsAg≤1×104 IU/mL的慢性HBV感染者; (3)HBV DNA≤2×107 IU/mL和HBsAg>1×104 IU/mL的慢性HBV感染者; (4)HBV DNA≤2×107 IU/mL和HBsAg≤1×104 IU/mL的慢性HBV感染者, 这类人群中不确定期患者占比44.7%(72/161), 肝组织炎症坏死分级(A)≥2占33.3%, 纤维化分期(F)≥2占38.9%, A≥2和(或)F≥2占(50.0%)[16].
2022年Choi等[17]认为: HBeAg阳性慢性HBV感染, 如不符合(1)ALT正常、HBV DNA>107 IU/mL(IT期)和(2)ALT>ULN、HBV DNA≥2×104 IU/mL的情况, 为不确定期; HBeAg阴性慢性HBV感染, 如不符合(1)ALT正常、HBV DNA<2×103 IU/mL和(2)ALT>ULN、HBV DNA≥2×103 IU/mL的情况, 为不确定期.
新近Dusheiko等[18]将不确定期定义为: HBsAg阳性(102-103 IU/mL)、HBeAg阴性、HBV DNA 2×103-2×104 IU/mL、ALT接近正常 (在正常水平附近波动)、肝脏病理学无或仅有轻度炎症, 并将不确定期列入慢性HBV感染的自然史分期, 认为不确定期等同灰区.
在阐述GZ所指向的对象时, 需明确HBV感染治疗的适应证分类. 抗病毒治疗是慢性HBV感染者的关键治疗措施, 但是否全员治疗(Treat-all), 还未形成一致共识. 因此, HBV感染者通常分为需治疗对象(即符合治疗适应证)和不治疗对象(即不符合治疗适应证), 治疗对象则及时给予抗病毒、抗肝纤维化等治疗, 而不治疗对象则建议定期复查.
我国新版指南的治疗适应证如上所述, 因此在没有肝脏病理学的情况下, 对应不符合治疗适应证的对象为基线无终末期肝病(肝硬化、肝衰竭、HCC)、ALT持续正常、无乙型肝炎肝硬化或HCC家族史、年龄≤30岁、肝脏炎症活动度或肝纤维化较轻、无HBV相关肝外表现的慢性HBV感染者; 具体包括: (1)所有ALT持续正常的HBeAg阴性慢性HBV感染(包括免疫控制期/非活动性HBsAg携带状态、HBV DNA阳性情况); (2)所有ALT持续正常的HBeAg阳性慢性HBV感染(包括IT期/慢性HBV携带状态、HBV DNA≤2×107 IU/mL情况).
EASL 2017年指南的治疗适应证: (1)HBeAg阳性或阴性, HBV DNA>2×103 IU/mL, ALT>ULN(40 U/L)或/和中度及以上炎症坏死或纤维化; (2)HBV DNA阳性的终末期肝病; (3)HBV DNA>2×104 IU/mL, ALT>2×ULN(40 U/L); (4)HBV DNA阳性, 符合下列情况之一, 有乙型肝炎肝硬化或HCC家族史、年龄>30岁、肝脏存在明显炎症(A≥2)或纤维化(F≥2)、HBV相关肝外表现. 因此在没有肝脏病理学的情况下, 对应不符合治疗适应证的对象与我国新版指南基本相同, 但由于HBV DNA的定义值不同, 具体包括: (1)所有ALT持续正常的HBeAg阴性慢性HBV感染 (包括免疫控制期/非活动性HBsAg携带状态、HBV DNA≥2×103 IU/mL情况); (2)所有ALT持续正常的HBeAg阳性慢性HBV感染 (包括IT期/慢性HBV携带状态、HBV DNA≤107 IU/mL情况); (3)ALT>ULN(40 U/L), 但HBV DNA≤2×103 IU/mL情况.
AASLD 2018年指导的治疗适应证: (1)免疫活动期CHB患者(HBeAg阴性或者HBeAg阳性); (2)HBV DNA阳性的终末期肝病. 因此在没有肝脏病理学的情况下, 对应不符合治疗适应证的对象具体包括: (1)所有ALT持续正常的HBeAg阴性慢性HBV感染 (包括非活动性CHB及HBV DNA≥2×103 IU/mL情况); (2)所有ALT持续正常的HBeAg阳性慢性HBV感染(包括IT期CHB及HBV DNA≤106 IU/mL情况); (3)ALT>ULN(男性35 U/L, 女性25 U/L), 但HBV DNA≤2×103 IU/mL(HBeAg阴性)或HBV DNA≤2×105 IU/mL(HBeAg阳性)情况.
不同研究针对GZ所指向的对象亦不尽相同. 来自澳大利亚的回顾性研究以FibroScan的肝脏硬度值(liver stiffness measurements, LSM)作为判断指标, 将GZ慢性HBV感染者定义为M型探头的LSM值6.1-9.0 kPa(ALT正常)或7.6-12.0 kPa(ALT为1-5×ULN), XL型探头的LSM值6.9-10.0 kPa, 肝脏病理学显示1/3的患者患有进展性纤维化或肝硬化[19].
我国Gan等[20]将不符合EASL 2017年指南自然史分期前4个期的所有HBsAg阳性慢性HBV感染者定义为GZ, 依据EASL 2017年指南, 1391例患者中有50%为GZ人群. 我国Yao等[21]及Wang等[22]将GZ等同不确定期, 并根据AASLD 2018年指导确定GZ患者分为以下4类: GZ-A: HBeAg阳性、ALT正常且HBV DNA≤106 IU/mL, GZ-B: HBeAg阳性、ALT升高且HBV DNA≤2×104 IU/mL; GZ-C: HBeAg阴性、ALT正常且HBV DNA≥2×103 IU/ mL; GZ-D: HBeAg阴性、ALT升高且HBV DNA≤2×103 IU/mL, 研究显示有27.78%(1322/4759)或23.2%(242/1043)的患者为GZ人群. 我国Ren等[23]亦将GZ等同不确定期, 针对肝功能持续正常的慢性HBV感染者, 依据我国2019年版指南[24]标准, 将347例患者分为IT期(108例)、非活动性HBsAg携带状态(61例)、GZ-1(除IT期之外的HBeAg阳性患者, 92例)、GZ-2(除非活动性HBsAg携带状态之外的HBeAg阴性患者, 68例), 研究显示51.3%的患者为GZ. Xu等[25]基于中国乙肝随访与临床科研平台(CR-HepB)的数据, 分别以我国新版指南和AASLD 2018年指导的自然史分期为标准, 凡在自然史分期之外的慢性HBV感染者均为GZ, 该研究同样将GZ等同不确定期, 3462例性HBV感染者中, 符合我国新版指南标准的GZ占56.9%, 符合AASLD2018年指导标准的GZ占41.7%, 符合我国新版指南标准的GZ患者具有更低的ALT与AST水平.
国外研究者认为GZ人群具有异质性, 并不是指向某一特定或某一类患者, GZ人群包括: (1)ALT升高但HBV DNA<2×103 IU/mL和(2)ALT正常、HBV DNA>2×104 IU/mL(包括IT期)两类[26].
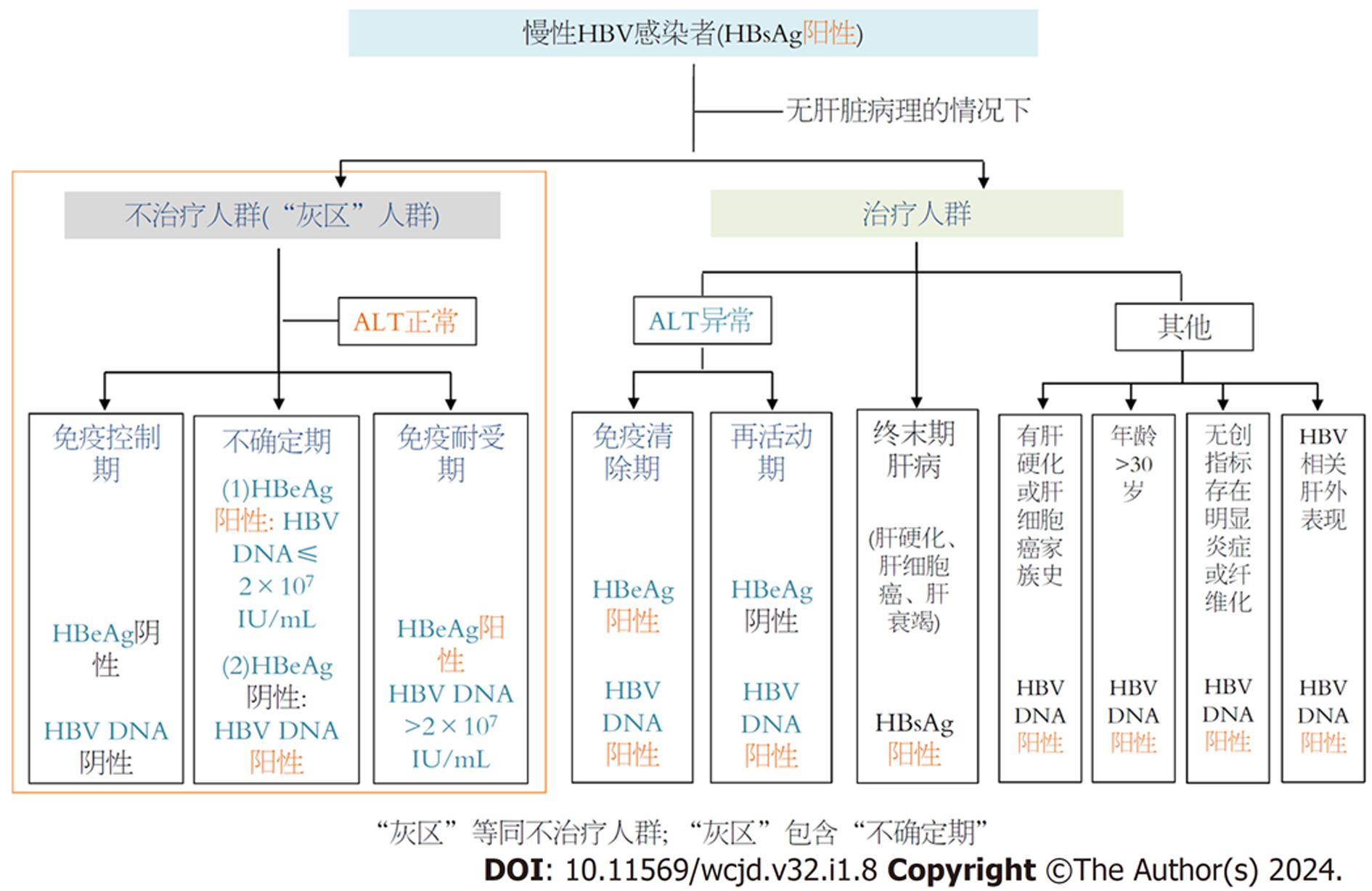
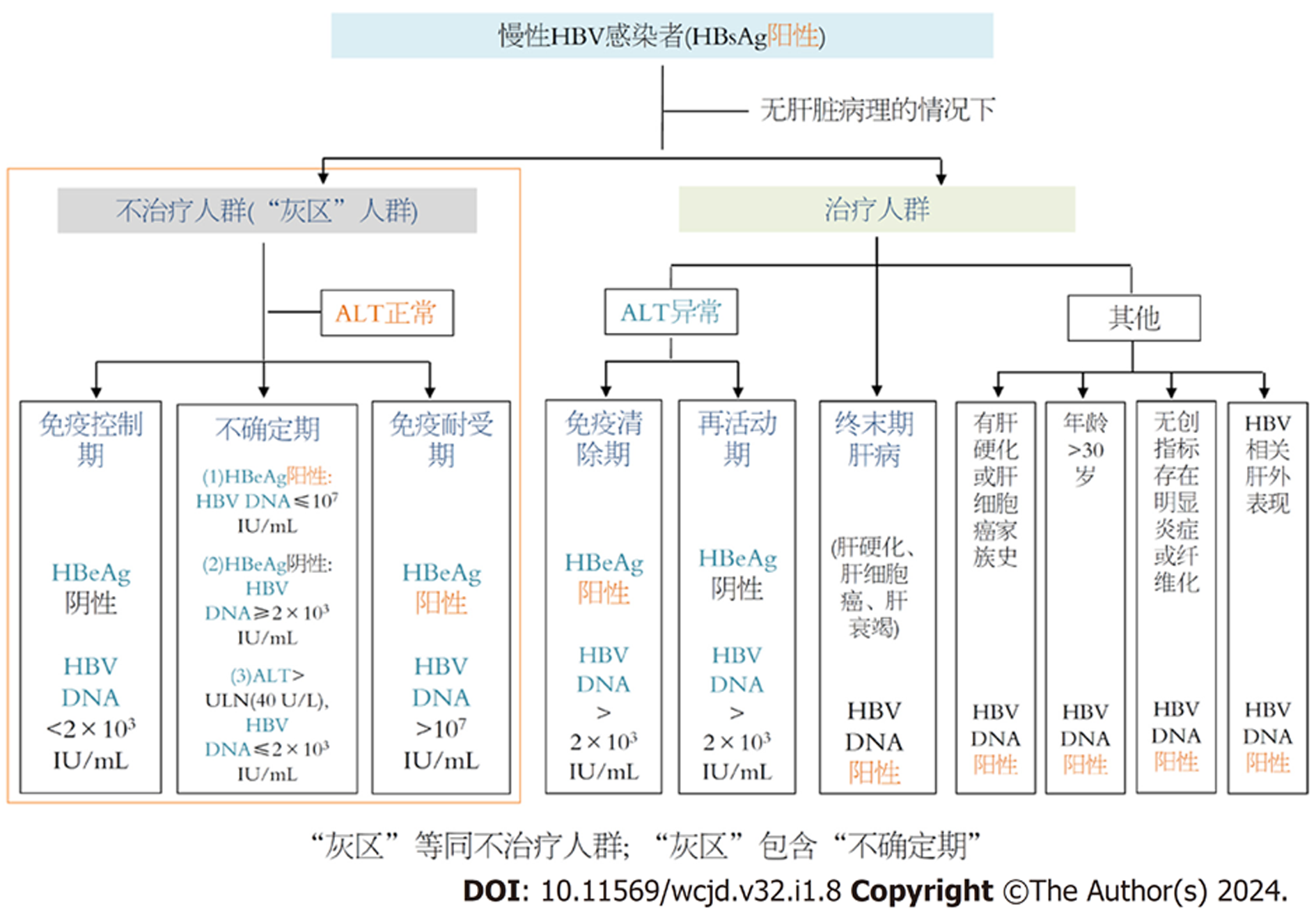
乙型肝炎的疾病分类包括"自然史分期"、"临床诊断分类"、"治疗的适应证分类"等, 但无论如何分类, 其目的是为了及时、准确判断慢性HBV感染的疾病进展与是否需要及时治疗. 因此, 首要任务便是正确、及时判断HBV感染者的治疗适应证, 甄别出疾病进展风险高、亟需抗病毒治疗的患者. 基于GZ对应于慢性HBV感染"治疗的适应证分类"和不确定期对应于"自然史分期"的理解, GZ即为不治疗对象(不符合抗病毒治疗适应证), 而不确定期仅为难以明确归于自然史分期(不符合自然史分期)的患者, 从这个意义上讲, GZ应包括不确定期, 而不是等同关系(图1和图2).
当前不确定期与GZ慢性HBV感染者的解读与判断标准较为混乱, 上述文献中 (文献[12-14], [16], [17], [19-22], [25]), 无论不确定期所指向的人群还是GZ指向的人群, 均或多或少包含了符合抗病毒治疗适应证的人群(即治疗人群). 如文献[21]及[22]中的GZ-B(HBeAg阳性、ALT升高且HBV DNA≤2×104 IU/mL)与GZ-D(HBeAg阴性、ALT升高且HBV DNA≤2×103 IU/mL), 因为ALT升高、HBV DNA阳性(或>2×103 IU/mL)的患者均需要治疗, 不属于GZ. 显然, 这些不确定期或GZ的分类对于临床治疗的指导价值不大. 与此同时, 虽然不确定期或GZ人群具有异质性, 也实则没有必要把不确定期或GZ人群的分类定义得过于复杂.
因此, 在无法获得肝脏组织病理的情况下, GZ人群即为不符合治疗适应证的人群, 一般指血清HBV DNA阳性、ALT水平持续正常的状态.对应我国新版指南标准, 具体包括: (1)免疫控制期(HBeAg阴性、HBV DNA 阴性); (2)IT期(HBeAg阳性、HBV DNA>2×107 IU/mL); (3)不确定期(HBeAg阳性、HBV DNA≤2×107 IU/mL和HBeAg阴性、HBV DNA阳性).对应EASL 2017年指南标准, 具体包括: (1)免疫控制期(HBeAg阴性、HBV DNA<2×103 IU/mL); (2)IT期(HBeAg阳性、HBV DNA>107 IU/mL); (3)不确定期(HBeAg阳性、HBV DNA≤107 IU/mL, HBeAg阴性、HBV DNA≥2×103 IU/mL, ALT>40 U/L、HBV DNA≤2×103 IU/mL)(图1和图2). 可以看出, 相比EASL 2017年指南, 我国新版指南显著减少了GZ人群与不确定期人群的数量, 扩大了抗病毒治疗适应证[25,27].
虽然IT期人群的肝脏病理损伤相对较轻, 也客观存在一定比例的中/重度炎症坏死和/或纤维化. 我们的研究发现, 约20%的IT期慢性HBV感染者(血清HBV DNA>2×107 IU/mL, HBeAg阳性, ALT持续正常) 存在明显肝组织炎症活动或纤维化进展[28,29]. 因此, 在缺少肝脏组织病理的前提下, IT期慢性HBV感染者也属于GZ. 对于我国新版指南定义的免疫控制期, 即便HBV DNA 阴性, 亦可能存在HBV共价闭合环状DNA(cccDNA)和整合HBV DNA[18], 亦归类于GZ. 我们的研究[30]发现: HBV DNA中低水平复制患者(HBV DNA≤107 IU/mL或≤2×107 IU/mL)的肝脏病理损伤较为严重, 与HBV DNA高水平复制患者(HBV DNA>107 IU/mL或>2×107 IU/mL)相比较, ≥A2的比例分别为30.95%(104/336)和10.74%(32/298)(EASL 2017年指南标准)、29.18%(110/377)和10.12%(26/257)(我国2019年版指南标准), ≥F2的比例分别为36.31%(122/336)和10.74%(32/298)(EASL 2017年指南标准)、33.95% (128/377)和10.12%(26/257)(我国2019年版指南标准), ≥A2和/或≥F2的比例分别为43.15%(145/336)和15.77%(47/298)(EASL 2017年指南标准)、40.58% (153/377)和15.18%(39/257)(我国2019年版指南标准); 对于HBV DNA低水平复制患者(HBV DNA<2×103 IU/mL), ≥A2、≥F2、≥A2和/或≥F2的比例分别为32.65% (16/49)、40.82%(20/49)、44.90%(22/49).
对于慢性HBV感染患者, 基于GZ对应于"治疗的适应证分类"和不确定期对应于"自然史分期"的理解, GZ即为不治疗对象(不符合抗病毒治疗适应证), 而不确定期仅为难以明确归于自然史分期(不符合自然史分期)的患者, GZ应包括不确定期, 而不是等同关系. 对应我国新版指南标准, 属于GZ的免疫控制期与IT期人群, 建议定期随访或肝脏穿刺活检病理学检查; 而不确定期患者, 在扩大抗病毒治疗适应证和这部分人群肝脏病理损伤较为严重的背景下, 建议抗病毒治疗, 并积极防范治疗后应答不佳或低病毒血症的问题. 对应EASL 2017年指南标准, 属于GZ的IT期人群, 建议定期随访或肝脏穿刺活检病理学检查; 而免疫控制期与不确定期患者, 建议抗病毒治疗, 并积极防范治疗后应答不佳或低病毒血症的问题.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | You H, Wang F, Li T, Xu X, Sun Y, Nan Y, Wang G, Hou J, Duan Z, Wei L, Jia J, Zhuang H; Chinese Society of Hepatology, Chinese Medical Association; Chinese Society of Infectious Diseases, Chinese Medical Association. Guidelines for the Prevention and Treatment of Chronic Hepatitis B (version 2022). J Clin Transl Hepatol. 2023;11:1425-1442. [PubMed] [DOI] |
| 3. | World Health Organization. Global hepatitis report. [Cited 2017 April. 19] Available from: https://www.who.int/hepatitis/publications/globalhepatitis-report2017/en/. |
| 4. | Country dashboard: China (2020), polaris observatory. CDA foundation. 2023 Available from: https://cdafound.org/polaris-countries-dashboard/. |
| 5. | Wong RJ, Kaufman HW, Niles JK, Kapoor H, Gish RG. Simplifying Treatment Criteria in Chronic Hepatitis B: Reducing Barriers to Elimination. Clin Infect Dis. 2023;76:e791-e800. [PubMed] [DOI] |
| 6. | Liu ZH, Hao X, Hou JL. [Treat-all: challenges of partial response and low-level viremia]. Zhonghua Gan Zang Bing Za Zhi. 2023;31:242-246. [PubMed] [DOI] |
| 8. | European Association for the Study of the Liver. EASL 2017 Clinical Practice Guidelines on the management of hepatitis B virus infection. J Hepatol. 2017;67:370-398. [PubMed] [DOI] |
| 9. | Terrault NA, Lok ASF, McMahon BJ, Chang KM, Hwang JP, Jonas MM, Brown RS, Bzowej NH, Wong JB. Update on prevention, diagnosis, and treatment of chronic hepatitis B: AASLD 2018 hepatitis B guidance. Hepatology. 2018;67:1560-1599. [PubMed] [DOI] |
| 12. | Chen S, Dai X, Zhao Y, Li J, Zou X, Huang H. Clinical Distribution Characteristics and Identification for Significant Liver Inflammation of Patients in Chronic Hepatitis B with Indeterminate Phase. Gastroenterol Res Pract. 2023;2023:7264601. [PubMed] [DOI] |
| 13. | Huang DQ, Tran A, Yeh ML, Yasuda S, Tsai PC, Huang CF, Dai CY, Ogawa E, Ishigami M, Ito T, Kozuka R, Enomoto M, Suzuki T, Yoshimaru Y, Preda CM, Marin RI, Sandra I, Tran S, Quek SXZ, Khine HHTW, Itokawa N, Atsukawa M, Uojima H, Watanabe T, Takahashi H, Inoue K, Maeda M, Hoang JK, Trinh L, Barnett S, Cheung R, Lim SG, Trinh HN, Chuang WL, Tanaka Y, Toyoda H, Yu ML, Nguyen MH. Antiviral therapy substantially reduces HCC risk in patients with chronic hepatitis B infection in the indeterminate phase. Hepatology. 2023;78:1558-1568. [PubMed] [DOI] |
| 14. | Huang DQ, Li X, Le MH, Le AK, Yeo YH, Trinh HN, Zhang J, Li J, Wong C, Wong C, Cheung RC, Yang HI, Nguyen MH. Natural History and Hepatocellular Carcinoma Risk in Untreated Chronic Hepatitis B Patients With Indeterminate Phase. Clin Gastroenterol Hepatol. 2022;20:1803-1812.e5. [PubMed] [DOI] |
| 15. | Liu M, Zhao T, Zhang Y, Zhang AM, Geng J, Xia X. The incidence of hepatocellular carcinoma and clearance of hepatitis B surface for CHB patients in the indeterminate phase: a systematic review and meta-analysis. Front Cell Infect Microbiol. 2023;13:1226755. [PubMed] [DOI] |
| 16. | 辛 杰晶, 东 冰, 任 丹丹, 周 路路, 徐 光华, 刘 娜. ALT正常HBeAg阳性慢性HBV感染者免疫耐受期与不确定期临床特征. 中华临床感染病杂志. 2022;15:285-290. [DOI] |
| 17. | Choi HSJ, Tonthat A, Janssen HLA, Terrault NA. Aiming for Functional Cure With Established and Novel Therapies for Chronic Hepatitis B. Hepatol Commun. 2022;6:935-949. [PubMed] [DOI] |
| 18. | Dusheiko G, Agarwal K, Maini MK. New Approaches to Chronic Hepatitis B. N Engl J Med. 2023;388:55-69. [PubMed] [DOI] |
| 19. | Liu K, Wong VWS, Liang LY, Lui GCY, Chan HLY, Wong GLH. Clinical outcomes and management of patients with chronic hepatitis B and liver stiffness measurement in the grey zone. Liver Int. 2019;39:494-502. [PubMed] [DOI] |
| 20. | Gan QY, Wang JX, Qian F, Wang YL, Huang Y, Zhang ZL, Jiang SW, Zhang CX, Cai MH, Qian C, Fu HS, Zhao S, Zhou HJ, Cao ZJ, Xie Q. Clinical and histological features of patients with chronic hepatitis B virus infection in the grey zone. J Viral Hepat. 2023;30:803-809. [PubMed] [DOI] |
| 21. | Yao K, Liu J, Wang J, Yan X, Xia J, Yang Y, Wu W, Liu Y, Chen Y, Zhang Z, Li J, Huang R, Wu C. Distribution and clinical characteristics of patients with chronic hepatitis B virus infection in the grey zone. J Viral Hepat. 2021;28:1025-1033. [PubMed] [DOI] |
| 22. | Wang J, Yan X, Zhu L, Liu J, Qiu Y, Li Y, Liu Y, Xue R, Zhan J, Jiang S, Geng Y, Wan Y, Li M, Mao M, Gao D, Yin S, Tong X, Xia J, Ding W, Chen Y, Li J, Zhu C, Huang R, Wu C. Significant histological disease of patients with chronic hepatitis B virus infection in the grey zone. Aliment Pharmacol Ther. 2023;57:464-474. [PubMed] [DOI] |
| 23. | Ren S, Wang W, Lu J, Wang K, Ma L, Zheng Y, Zheng S, Chen X. Effect of the change in antiviral therapy indication on identifying significant liver injury among chronic hepatitis B virus infections in the grey zone. Front Immunol. 2022;13:1035923. [PubMed] [DOI] |
| 25. | Xu X, Wang H, Shan S, Sun Y, Xu X, You H, Jia J, Zhuang H, Kong Y, On Behalf Of The China Registry Of Hepatitis B Cr-HepB Group. The Impact of the Definitions of Clinical Phases on the Profiles of Grey-Zone Patients with Chronic Hepatitis B Virus Infection. Viruses. 2023;15. [PubMed] [DOI] |
| 26. | Lim YS. Gray zone of hepatitis B virus infection. Saudi J Gastroenterol. 2023;. [PubMed] [DOI] |
| 28. | 胡 爱荣, 蒋 素文, 石 小军, 朱 德东, 何 哲耘, 陈 凯, 朱 陈倩, 张 露侃, 胡 耀仁. 免疫耐受期慢性乙型肝炎病毒感染者的临床病理分析. 中华内科杂志. 2021;60:891-897. [DOI] |
| 29. | 汪 东辉, 蒋 素文, 胡 爱荣, 石 小军, 朱 德东, 何 哲耘, 朱 陈倩, 张 露侃. 免疫耐受期慢性乙型肝炎病毒感染者显著肝组织损伤的新型诊断模型建立. 中华传染病杂志. 2022;40:275-280. [DOI] |
| 30. | Jiang SW, Lian X, Hu AR, Lu JL, He ZY, Shi XJ, Zhu DD, Wang ZY, Huang GC. Liver histopathological lesions is severe in patients with normal alanine transaminase and low to moderate hepatitis B virus DNA replication. World J Gastroenterol. 2023;29:2479-2494. [PubMed] [DOI] |