修回日期: 2023-04-06
接受日期: 2023-04-23
在线出版日期: 2023-05-08
表浅型食管鳞癌(superficial esophageal squamous cell carcinoma, SESCC)患者的治疗以内镜和外科手术为主. 对于部分患者来说, 单一的手术治疗预后欠佳. 如何筛选出预后不良的患者并给予适当的干预是临床医生面临的难题. 因此, 寻找更便利更有效的预后预测指标对于患者的生存期和指导进一步治疗至关重要.
探讨术前外周血全身炎症反应指数(systemic inflamma-tion response index, SIRI)及预后营养指数(prognostic nutritional index, PNI)对SESCC患者预后的预测价值.
回顾性分析122例SESCC患者的临床、影像及病理等资料. 通过ROC曲线确定SIRI及PNI的最佳截断值, 将其分为低SIRI组和高SIRI组, 低PNI组和高PNI组, Kaplan-Meier法分析生存曲线, Log-rank法比较验证组间生存差异. COX单因素和多因素回归分析SESCC患者术后预后的影响因素.
低SIRI组的总生存时间高于高SIRI组, 差异具有统计学意义(P = 0.001); 高PNI组的总生存时间高于低PNI组, 差异具有统计学意义(P = 0.014). 术前SIRI、PNI是影响患者总生存期的独立危险因素.
术前SIRI和PNI是预测SESCC患者预后简单可靠的生物标志物.
核心提要: 术前外周血全身炎症反应指数及预后营养指数与表浅型食管鳞癌(superficial esophageal squamous cell carcinoma, SESCC)患者的总生存期显著相关, 对预测SESCC患者预后具有重要价值.
引文著录: 王晶, 丁雪丽, 田字彬. 术前全身炎症反应指数及预后营养指数对表浅型食管鳞癌患者预后的预测价值. 世界华人消化杂志 2023; 31(9): 369-376
Revised: April 6, 2023
Accepted: April 23, 2023
Published online: May 8, 2023
The treatment of superficial esophageal squamous cell carcinoma (SESCC) is mainly based on endoscopic and surgical procedures. For some patients, surgical treatment alone is associated with a poor prognosis. How to screen out patients with poor prognosis and give appropriate intervention is a challenge for clinicians. Therefore, it is very important to find more convenient and effective prognostic indicators for the survival of patients to guide further treatment.
To evaluate the prognostic value of peripheral blood systemic inflammatory response index (SIRI) and prognostic nutritional index (PNI) in patients with SESCC.
The clinical, biochemical, and pathological data of 122 patients with SESCC were retrospectively analyzed. The optimal cut-off values of SIRI and PNI were determined using the receiver operating characteristic (ROC) curve. According to the optimal cut-off values of SIRI and PNI, the patients were divided into a low SIRI group and a high SIRI group, and a low PNI group and a high PNI group. The Kaplan-Meier (K-M) method was used for survival analysis, and the Log-rank method was used to evaluate the difference between groups. COX univariate and multivariate regression analyses were performed to determine the predictive factors for the prognosis of patients with SESCC.
The overall survival time of patients in the low SIRI group was significantly longer than that of patients in the high SIRI group (P = 0.001). The overall survival time of patients in the high PNI group was significantly longer than that of patients in the low PNI group (P = 0.014). Preoperative SIRI and PNI were identified to be independent risk factors for the overall survival of patients with SESCC.
Preoperative SIRI and PNI are simple and reliable biomarkers for predicting the prognosis of patients with SESCC.
- Citation: Wang J, Ding XL, Tian ZB. Value of preoperative systemic inflammatory response index and prognostic nutritional index in predicting prognosis of patients with superficial esophageal squamous cell carcinoma. Shijie Huaren Xiaohua Zazhi 2023; 31(9): 369-376
- URL: https://www.wjgnet.com/1009-3079/full/v31/i9/369.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v31.i9.369
食管癌是临床常见的恶性肿瘤之一, 2020年全球新发食管癌约57.2万例, 死亡病例约50.9万例,其全球发病率及死亡率分别居第7位及第6位[1]. 我国是食管癌高发国家, 病理类型以鳞癌为主[2]. 表浅型食管鳞癌(superficial esophageal squamous cell carcinoma, SESCC)是指肿瘤局限于粘膜层或粘膜下层的鳞状细胞癌, 无论是否存在淋巴结转移[3]. 随着内镜技术的发展及人民群众健康意识的提高, 我国SESCC的发现率明显提高[4]. 我国2020年食管癌诊疗指南提出对于SESCC患者的治疗以内镜和外科手术为主[5]. 以往对于SESCC患者预后的预测通常基于肿瘤浸润深度-淋巴结转移-远处转移分期(TNM分期), 但有相同TNM分期的患者术后的预后仍存在较大差异[6], 且评估TNM分期需要依赖于影像、内镜、病理等检查, 具有侵入性、花费大、耗时长等缺点. 对于部分患者来说, 单一的手术治疗预后欠佳[7]. 如何筛选出预后不良的患者并给予适当的干预是临床医生面临的难题. 因此, 寻找更便利更有效的预后预测指标对于患者的生存期和指导进一步治疗至关重要.
炎症在肿瘤的发生、增殖和迁移中起着重要作用[8]. 近年来, 炎性生物标志物已成为肿瘤研究的热点. 既往研究表明多种炎性生物标志物如中性粒细胞/淋巴细胞比率、血小板/淋巴细胞比率和单核/淋巴细胞比率是预测患者预后的有效指标[9-11]. 但这些指标只包含两种免疫炎症细胞, 预测效果欠佳. 全身炎症反应指数(systemic inflammation response index, SIRI)是以中性粒细胞、单核细胞、淋巴细胞计数为基础的新的复合型炎症标志物, 已被证实与多种恶性肿瘤等的预后有关[12-14]. 既往已有研究证实SIRI与进展期食管癌患者预后有关[15].
食管癌患者受进食的影响, 比起其他患者来说更容易发生营养不良, 营养不良会影响患者的治疗耐受性和预后[16]. 因此, 全身营养状况在食管癌患者的预后中具有重要价值. 预后营养指数(prognostic nutritional index, PNI)是基于血清白蛋白和淋巴细胞计数的标志物, 用于评估癌症患者营养状况的新指标, 已被发现与乳腺癌、肺癌、膀胱癌等的预后有关[17-19]. 我研究团队前期研究也发现PNI与进展期食管癌的预后有关[20].
越来越多的证据表明SIRI和PNI反映了免疫炎症反应和全身营养水平, 能准确预测癌症患者的预后, 尤其是对于许多无手术机会、选择放化疗的进展期食管癌患者, 采用炎症及营养指标预测预后更加方便快捷. 但术前SIRI、PNI对SESCC患者预后是否有影响还尚无报道. 本研究在前期研究基础上进一步分析SESCC患者的临床、病理资料和预后情况, 探讨术前SIRI及PNI对患者预后的预测价值.
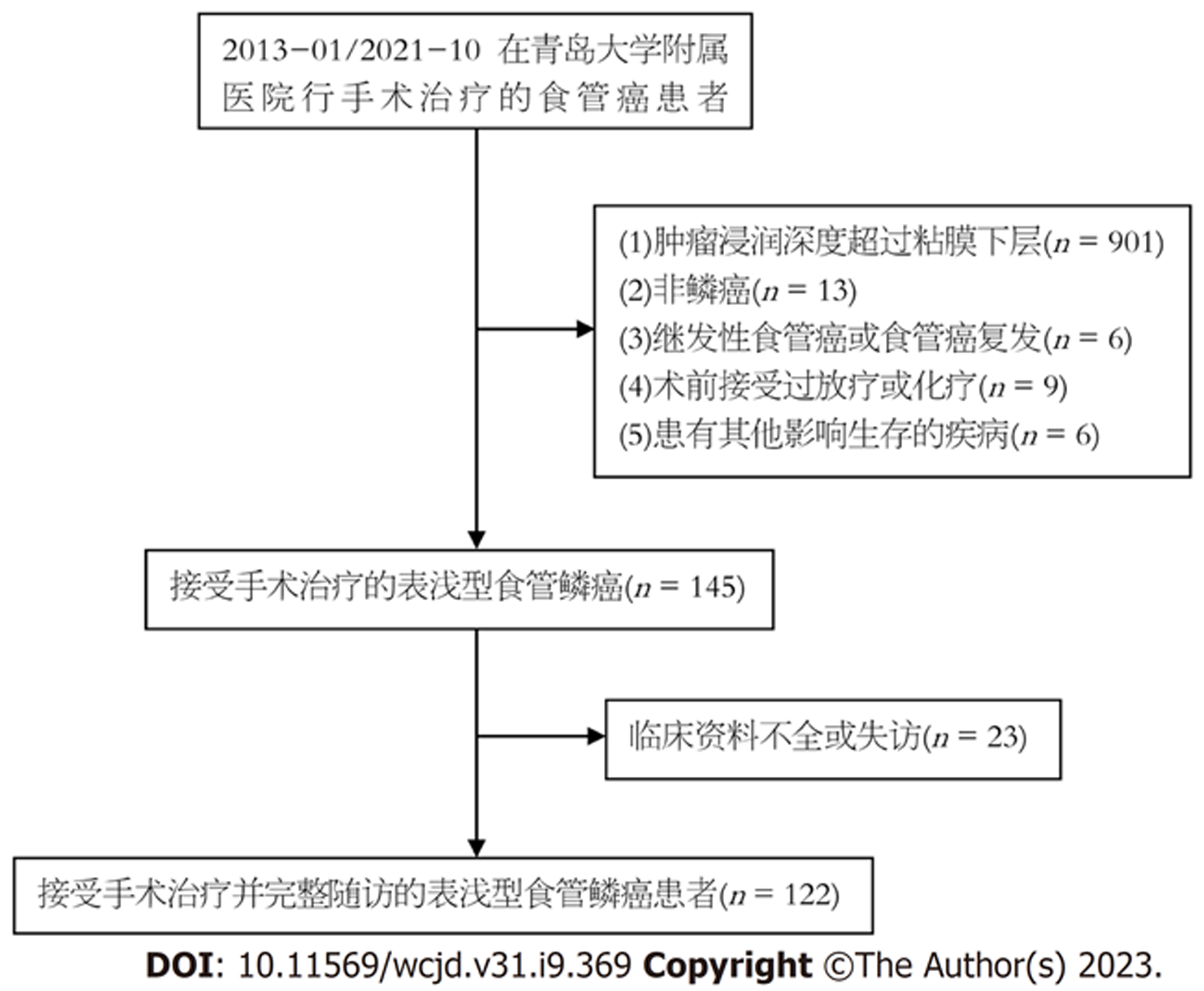
以2013-01/2021-10于青岛大学附属医院行外科手术的122例SESCC患者为研究对象进行回顾性分析. 纳入标准: (1)经内镜及病理诊断为SESCC; (2)行食管癌根治性手术; (3)临床资料完整; (4)无其他急慢性炎症性疾病. 排除标准: (1)术前未接受放化疗; (2)患有其他恶性肿瘤; (3)继发性食管癌或食管癌复发; (4)患有其他影响生存的疾病或失访(图1). 本研究已获得青岛大学附属医院伦理委员会批准(伦理审批号: QYFYWZLL27183), 所有患者知情同意.
1.2.1 临床资料: 通过青岛大学附属医院医渡云数据库收集患者的人口学资料、病史、实验室检查结果(外周血淋巴细胞计数、单核细胞计数、血小板计数、白蛋白等)、影像学资料以及手术病理等资料.
1.2.2 分组: SIRI = (中性粒细胞计数×单核细胞计数)/淋巴细胞计数, PNI = 白蛋白(g/L)+5×中性粒细胞计数(×109/L). 根据最佳截断值将其分别分为高、低SIRI及PNI组. 根据体质量指数(body mass index, BMI)将入选患者分为消瘦组(BMI<18.5 kg/m2)和非消瘦组(BMI≥8.5 kg/m2). 根据第八版美国癌症联合委员会和国际癌症控制联盟制订的TNM分期[21]将肿瘤位置分为上段、中段和下段, 将大体类型分为隆起型、平坦型和凹陷型, 将分化程度分为未分化、高分化、中分化和低分化, 将浸润深度分为粘膜层和粘膜下层. 根据肿瘤大小分为≤2 cm和>2 cm.
1.2.3 随访: 采用门诊、电话等方式对术后患者进行随访, 明确其生存状态. 随访截止时间为2022-08或患者死亡, 中位随访时间为54 mo. 总生存期(overall survival, OS)定义为从手术之日起至任何原因导致患者死亡或随访结束的时间.
统计学处理 采用SPSS 26.0对患者资料进行统计学分析. 通过ROC曲线分析确定SIRI、PNI的最佳截断值, 根据最佳截断值将计量资料转换为二分类资料; 计数资料以例数/%表示, 计量资料以mean±SD表示, 比较采用χ2检验或Fisher确切概率法; 生存分析采用Kaplan-Meier法, 组间比较采用Log-rank检验; 采用COX比例风险回归模型进行单因素和多因素分析以确定与OS相关的预后因素. aP<0.05提示差异有统计学意义.
SESCC患者共122例, 男性109例(89.3%), 女性13例(10.7%), 平均年龄(59.6±6.9)岁(44-79)岁. BMI<18.5 kg/m2者114例(93.4%), BMI≥18.5 kg/m2者8例(6.6%); T1a 41例(33.6%), T1b 81例(66.4%). 肿瘤部位、肿瘤大小、大体类型、分化程度、有无脉管浸润、有无周围神经浸润等临床资料如表1所示.
| 项目 | 例数 | n% |
| 肿瘤部位 | ||
| 上 | 6 | 4.9 |
| 中 | 50 | 41 |
| 下 | 66 | 54.1 |
| 肿瘤大小 | ||
| ≤2 cm | 72 | 59 |
| >2 cm | 50 | 41 |
| 病灶数目 | ||
| 单发 | 108 | 88.5 |
| 多发 | 14 | 11.5 |
| 大体类型 | ||
| 隆起型 | 66 | 54.1 |
| 平坦型 | 39 | 32 |
| 凹陷型 | 17 | 13.9 |
| 分化程度 | ||
| 高分化 | 29 | 23.8 |
| 中分化 | 66 | 54.1 |
| 低分化 | 27 | 22.1 |
| 脉管浸润 | ||
| 无 | 107 | 87.7 |
| 有 | 15 | 12.3 |
| 周围神经浸润 | ||
| 无 | 115 | 94.3 |
| 有 | 7 | 5.7 |
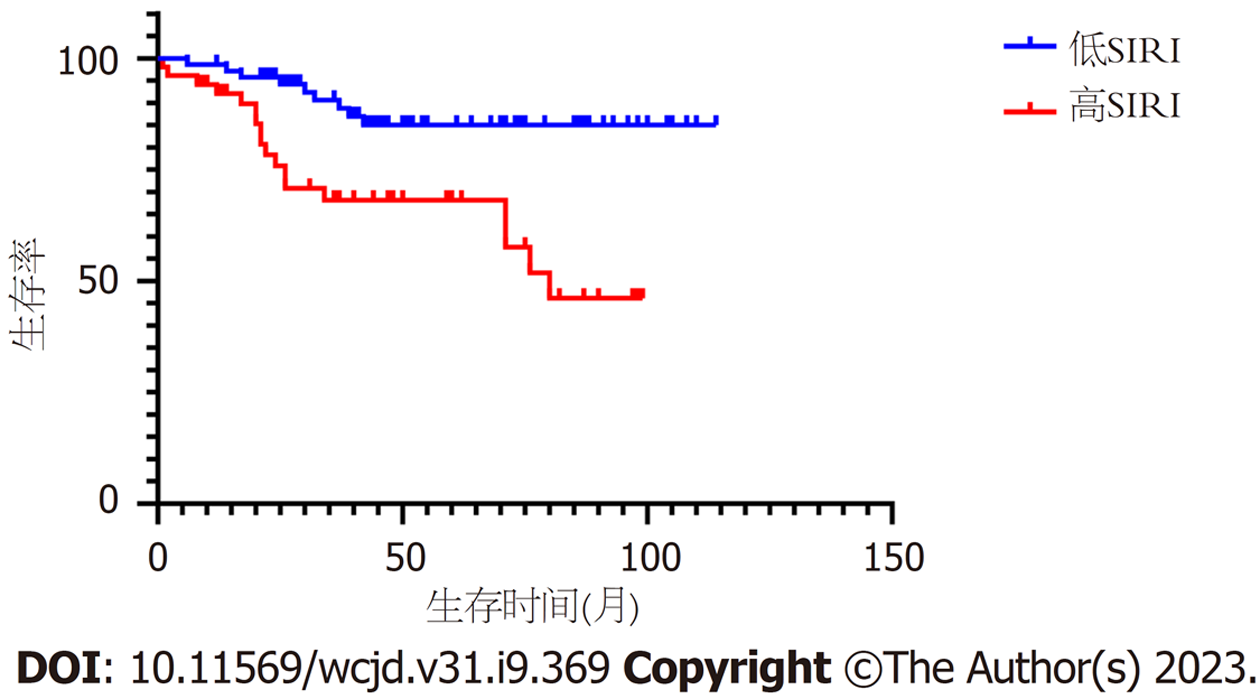
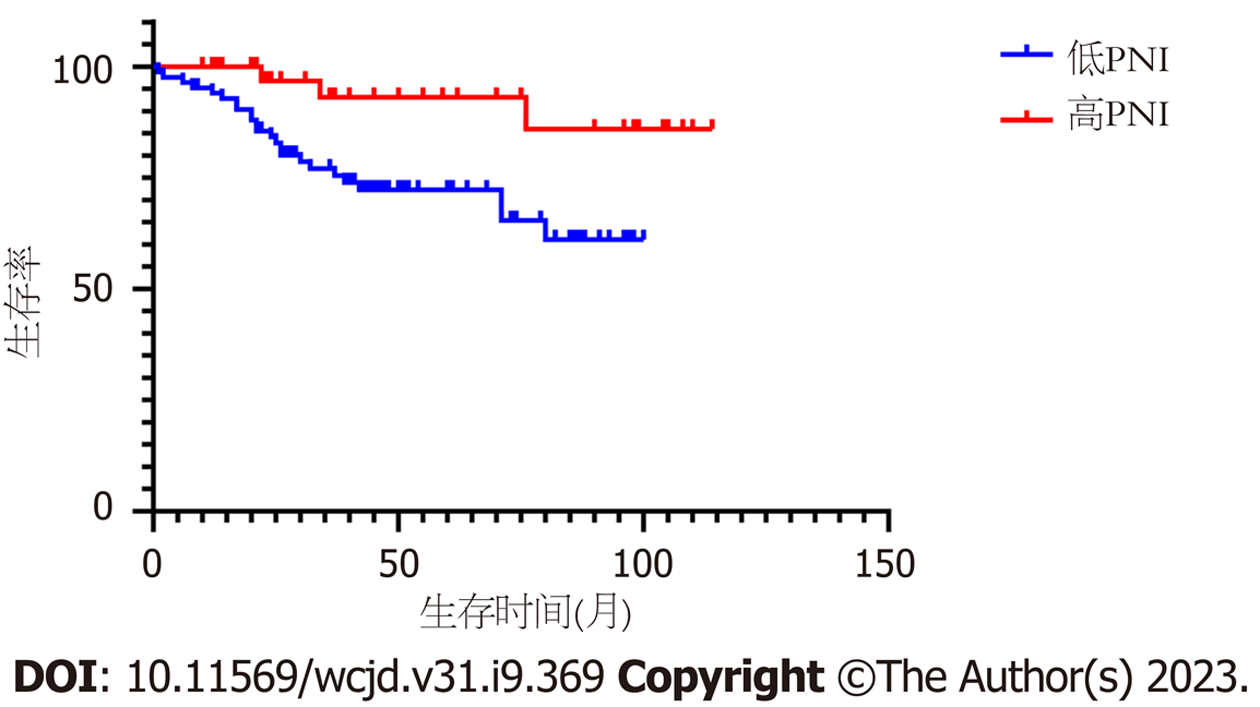
本研究的随访时间为1 mo-114 mo, 中位随访时间为54 mo. 其中27例(22.13%)患者死亡. 低SIRI组和高SIRI组患者的5年生存率分别为85.1%、68.1%, Kaplan-Meier分析结果显示低SIRI组的OS高于高SIRI组, 差异具有统计学意义(aP = 0.001); 低PNI组和高PNI组患者的5年生存率分别为72.3%、93.1%, 高PNI组的OS高于低PNI组, 差异具有统计学意义(aP = 0.014), 结果见图2和3. Spearman相关性分析显示, SIRI和OS呈负相关(相关系数: -0.244), PNI与OS呈正相关(相关系数: 0.152).
COX单因素分析结果显示, 术前SIRI、PNI与病人的OS相关(aP<0.05). 将以上指标纳入COX多因素分析, 结果显示术前SIRI、PNI是影响病人OS的独立危险因素(aP<0.05)(见表2和表3).
| 项目 | β | HR值(95%CI) | P |
| 年龄(≤60岁 vs >60岁) | 0.372 | 1.450(0.678, 3.100) | 0.338 |
| 性别(男 vs 女) | -1.295 | 0.274(0.037, 2.023) | 0.204 |
| BMI(<18.5 kg/m2 vs ≥18.5 kg/m2) | -0.597 | 0.602(0.082, 4.447) | 0.481 |
| SIRI(低SIRI组 vs 高SIRI组) | 1.274 | 3.574(1.603, 7.966) | 0.002 |
| PNI(低PNI组 vs 高PNI组) | -1.395 | 0.248(0.074, 0.825) | 0.023 |
| 肿瘤部位(上-中段 vs 下段) | 0.184 | 1.202(0.557, 2.593) | 0.639 |
| 肿瘤大小(≤2 cm vs >2 cm) | 0.305 | 1.356(0.637, 2.887) | 0.430 |
| 病灶数目(单发 vs 多发) | 1.254 | 3.503(1.390, 8,826) | 0.008 |
| 大体类型(平坦型 vs 非平坦型) | 0.513 | 1.670(0.705, 3.954) | 0.243 |
| 分化程度(高-中分化 vs 低分化) | 0.32 | 1.377(0.582, 3.258) | 0.467 |
| 浸润深度(粘膜层 vs 粘膜下层) | 0.109 | 1.115(0.501, 2.485) | 0.789 |
| 脉管浸润(无 vs 有) | 0.655 | 1.925(0.727, 5.094) | 0.187 |
| 周围神经浸润(无 vs 有) | 0.375 | 1.454(0.344, 6.153) | 0.611 |
| 指标 | B值 | SE值 | Wald值 | HR值(95%CI) | P |
| SIRI(低SIRI组 vs 高SIRI组) | 1.517 | 0.412 | 13.536 | 4.558(2.032, 10.226) | <0.001 |
| PNI(低PNI组 vs 高PNI组) | -1.708 | 0.617 | 7.674 | 0.181(0.054, 0.607) | 0.006 |
炎症细胞作为肿瘤微环境的组成部分之一, 在恶性肿瘤的发生发展过程中发挥着重要的作用[22]. 越来越多的证据表明, 炎症细胞介导的炎症反应促进了肿瘤的发生、发展和转移[23,24]. 浸润于肿瘤微环境中的中性粒细胞又称为肿瘤相关中性粒细胞, 可以通过调控其他免疫细胞的功能、中性粒细胞外诱捕网的形成和极化状态等方式影响肿瘤的形成和发展[25]. 单核细胞是肿瘤相关巨噬细胞的主要来源可以促进肿瘤细胞的侵袭和血管生成, 抑制免疫监视[26]. 淋巴细胞是参与抗肿瘤免疫反应的组成成分之一, 但恶性肿瘤诱导的全身免疫炎症反应抑制了淋巴细胞的功能, 使肿瘤细胞有机会逃脱免疫监视[26]. SIRI作为一种由中性粒细胞、淋巴细胞和单核细胞计数共同组成的复合型炎性标志物, 已被证实与多种恶性肿瘤的预后密切相关. 冯晨曦等[27]研究发现SIRI与食管癌和食管良性疾病的鉴别诊断密切相关; 一项以302例食管胃交界处腺癌患者为研究对象的研究结果显示SIRI是一种新颖、简单的预后指标, 其预测能力优于中性粒细胞/淋巴细胞、血小板/淋巴细胞和淋巴细胞/单核细胞, 可作为TNM分期的重要补充[28]. Geng等[15]对916例食管鳞癌根治术后的患者进行研究, 结果表明SIRI是独立预后指标, 并建立列线图以帮助临床医生筛选高危患者, 为可能预后不佳的患者选择更有效的治疗方式, 如术后辅助放化疗.
SESCC术后患者由于受摄入不足、消耗增多等因素的影响, 容易发生营养不良. 血清白蛋白作为一种重要的营养标志物, 在胆固醇、脂肪酸和其他物质的运输中起着重要作用, 肿瘤相关炎症可抑制白蛋白的合成从来对患者的预后产生负面影响[29]. PNI根据血清白蛋白水平和淋巴细胞计数计算得到, 作为一种评估癌症患者营养状况的新指标, 已被很多研究证实与患者的预后有关. Okadome等[30]通过研究数据库中337例根治性切除的0-Ⅳ期食管癌患者发现PNI和肿瘤浸润性淋巴细胞的表达与患者的预后有关, 营养状况和全身免疫反应可能通过局部免疫反应影响患者的预后. Qi等[31]发现术前低PNI不仅是进展期食管癌患者生存差的独立预后因素, 而且与术后并发症发生率高相关. 一项基于3543例食管癌患者的Meta分析还发现低PNI的食管癌患者可能有更高的复发率[32]. 我们研究团队[20]也发现以进展期食管癌患者为研究对象, 高PNI组患者预后更好. Yan等[33]研究发现SIRI和PNI对Ⅱ-Ⅲ期食管癌患者预后存在影响, 并且将这两个指标结合起来对预后的预测价值要高于单独的预测价值. 而本研究以SESCC患者为研究对象, 发现低PNI是影响SESCC患者预后的独立危险因素.
本研究探讨了术前SIRI和PNI对SESCC患者的预后价值, 有助于临床医生对于术后患者预后的预测和指导进一步治疗. 但本研究存在一定的局限性:(1)本研究为单中心回顾性研究, 纳入的患者数量、地区有限, 可能会造成偏倚; (2)本研究仅分析了术前SIRI和PNI对患者OS的影响, 未对无病生存期进行分析; (3)本研究仅针对SIRI、PNI对SESCC患者预后的影响, 对继发性食管癌或食管癌复发患者没有涉及. 因此, 未来需要进行大规模的多中心、前瞻性研究来进一步分析术前SIRI和PNI对SESCC患者及继发性食管癌或食管癌复发患者的预后的影响.
综上所述, 术前SIRI和PNI是预测SESCC患者预后的简单可靠的生物标志物, 因此可以很好地应用于临床, 为SESCC患者的个体化治疗提供依据.
表浅型食管鳞癌(superficial esophageal squamous cell carcinoma, SESCC)是指肿瘤局限于粘膜层或粘膜下层的鳞状细胞癌.目前对于SESCC患者预后的预测通常基于影像、病理等检查, 具有侵入性、耗时长、花费大等缺点.
如何筛选出预后不良的SESCC患者并给予及时适当的干预是临床医生面临的难题.寻找更便捷有效的预后预测指标对于患者的总生存期(overall survival, OS)和指导进一步治疗至关重要.
探讨术前外周血全身炎症反应指数(systemic inflamma-tion response index, SIRI)及预后营养指数(prognostic nutritional index, PNI)对SESCC患者预后的预测价值.
对122例SESCC患者的临床、影像及病理等资料进行回顾性分析. 分别分析低SIRI组和高SIRI组, 低PNI组和高PNI组与OS之间的关系, 并通过COX单因素及多因素回归分析确定影响SESCC患者预后的独立危险因素.
术前SIRI和PNI与SESCC患者的OS显著相关, 是影响SESCC患者预后的独立危险因素, 对于预测SESCC患者预后及指导进一步治疗具有重要意义.
术前SIRI和PNI是预测SESCC患者预后的简单可靠的生物标志物, 因此可以很好地应用于临床, 为SESCC患者的个体化治疗提供依据.
本研究为单中心回顾性研究, 纳入的患者数量、地区有限, 可能存在一定偏倚. 因此, 未来需要进行大规模的多中心、前瞻性研究来进一步分析术前SIRI和PNI对SESCC患者预后的影响.
学科分类: 胃肠病学和肝病学
手稿来源地: 山东省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): 0
E级 (差): E
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018;68:394-424. [PubMed] [DOI] |
| 2. | Klingelhöfer D, Zhu Y, Braun M, Brüggmann D, Schöffel N, Groneberg DA. A world map of esophagus cancer research: a critical accounting. J Transl Med. 2019;17:150. [PubMed] [DOI] |
| 3. | Japan Esophageal Society. Japanese Classification of Esophageal Cancer, 11th Edition: part I. Esophagus. 2017;14:1-36. [PubMed] [DOI] |
| 4. | Jia R, Luan Q, Wang J, Hou D, Zhao S. Analysis of Predictors for Lymph Node Metastasis in Patients with Superficial Esophageal Carcinoma. Gastroenterol Res Pract. 2016;2016:3797615. [PubMed] [DOI] |
| 6. | Yang S, Lin S, Li N, Deng Y, Wang M, Xiang D, Xiang G, Wang S, Ye X, Zheng Y, Yao J, Zhai Z, Wu Y, Hu J, Kang H, Dai Z. Burden, trends, and risk factors of esophageal cancer in China from 1990 to 2017: an up-to-date overview and comparison with those in Japan and South Korea. J Hematol Oncol. 2020;13:146. [PubMed] [DOI] |
| 7. | Harada K, Rogers JE, Iwatsuki M, Yamashita K, Baba H, Ajani JA. Recent advances in treating oesophageal cancer. F1000Res. 2020;9. [PubMed] [DOI] |
| 8. | Han W, Allam SA, Elsawa SF. GLI2-Mediated Inflammation in the Tumor Microenvironment. Adv Exp Med Biol. 2020;1263:55-65. [PubMed] [DOI] |
| 9. | Templeton AJ, McNamara MG, Šeruga B, Vera-Badillo FE, Aneja P, Ocaña A, Leibowitz-Amit R, Sonpavde G, Knox JJ, Tran B, Tannock IF, Amir E. Prognostic role of neutrophil-to-lymphocyte ratio in solid tumors: a systematic review and meta-analysis. J Natl Cancer Inst. 2014;106:dju124. [PubMed] [DOI] |
| 10. | Li B, Zhou P, Liu Y, Wei H, Yang X, Chen T, Xiao J. Platelet-to-lymphocyte ratio in advanced Cancer: Review and meta-analysis. Clin Chim Acta. 2018;483:48-56. [PubMed] [DOI] |
| 11. | Hu G, Liu G, Ma JY, Hu RJ. Lymphocyte-to-monocyte ratio in esophageal squamous cell carcinoma prognosis. Clin Chim Acta. 2018;486:44-48. [PubMed] [DOI] |
| 12. | Sun L, Hu W, Liu M, Chen Y, Jin B, Xu H, Du S, Xu Y, Zhao H, Lu X, Sang X, Zhong S, Yang H, Mao Y. High Systemic Inflammation Response Index (SIRI) Indicates Poor Outcome in Gallbladder Cancer Patients with Surgical Resection: A Single Institution Experience in China. Cancer Res Treat. 2020;52:1199-1210. [PubMed] [DOI] |
| 13. | Li S, Lan X, Gao H, Li Z, Chen L, Wang W, Song S, Wang Y, Li C, Zhang H, Xue Y. Systemic Inflammation Response Index (SIRI), cancer stem cells and survival of localised gastric adenocarcinoma after curative resection. J Cancer Res Clin Oncol. 2017;143:2455-2468. [PubMed] [DOI] |
| 14. | Xu L, Yu S, Zhuang L, Wang P, Shen Y, Lin J, Meng Z. Systemic inflammation response index (SIRI) predicts prognosis in hepatocellular carcinoma patients. Oncotarget. 2017;8:34954-34960. [PubMed] [DOI] |
| 15. | Geng Y, Zhu D, Wu C, Wu J, Wang Q, Li R, Jiang J, Wu C. A novel systemic inflammation response index (SIRI) for predicting postoperative survival of patients with esophageal squamous cell carcinoma. Int Immunopharmacol. 2018;65:503-510. [PubMed] [DOI] |
| 16. | Cao J, Xu H, Li W, Guo Z, Lin Y, Shi Y, Hu W, Ba Y, Li S, Li Z, Wang K, Wu J, He Y, Yang J, Xie C, Zhou F, Song X, Chen G, Ma W, Luo S, Chen Z, Cong M, Ma H, Zhou C, Wang W, Qi Luo, Shi Y, Qi Y, Jiang H, Guan W, Chen J, Chen J, Fang Y, Zhou L, Feng Y, Tan R, Ou J, Zhao Q, Wu J, Xin Lin, Yang L, Fu Z, Wang C, Deng L, Li T, Song C, Shi H; Investigation on Nutrition Status and Clinical Outcome of Common Cancers (INSCOC) Group, Chinese Society of Nutritional Oncology. Nutritional assessment and risk factors associated to malnutrition in patients with esophageal cancer. Curr Probl Cancer. 2021;45:100638. [PubMed] [DOI] |
| 17. | Chen L, Bai P, Kong X, Huang S, Wang Z, Wang X, Fang Y, Wang J. Prognostic Nutritional Index (PNI) in Patients With Breast Cancer Treated With Neoadjuvant Chemotherapy as a Useful Prognostic Indicator. Front Cell Dev Biol. 2021;9:656741. [PubMed] [DOI] |
| 18. | Xu S, Cao S, Geng J, Wang C, Meng Q, Yu Y. High prognostic nutritional index (PNI) as a positive prognostic indicator for non-small cell lung cancer patients with bone metastasis. Clin Respir J. 2021;15:225-231. [PubMed] [DOI] |
| 19. | 袁 帅, 毕 兴, 牛 越, 冯 富鹏, 毛 莉, 张 荣. 术前预后营养指数联合血清CXCL5、YKL-40对非肌层浸润性膀胱癌患者经尿道膀胱肿瘤电切术后复发的预测价值. 现代生物医学进展. 2022;22:1-6. [DOI] |
| 20. | 刘 思凡, 姜 娜, 丁 雪丽, 田 字彬, 管 甲亮, 金 圣博. 放(或/和)化疗前NLR、SII、PNI对进展期食管癌患者预后的预测价值. 胃肠病学和肝病学杂志. 2021;30:1325-1330. |
| 21. | Rice TW, Ishwaran H, Ferguson MK, Blackstone EH, Goldstraw P. Cancer of the Esophagus and Esophagogastric Junction: An Eighth Edition Staging Primer. J Thorac Oncol. 2017;12:36-42. [PubMed] [DOI] |
| 22. | Li L, Yu R, Cai T, Chen Z, Lan M, Zou T, Wang B, Wang Q, Zhao Y, Cai Y. Effects of immune cells and cytokines on inflammation and immunosuppression in the tumor microenvironment. Int Immunopharmacol. 2020;88:106939. [PubMed] [DOI] |
| 23. | Greten FR, Grivennikov SI. Inflammation and Cancer: Triggers, Mechanisms, and Consequences. Immunity. 2019;51:27-41. [PubMed] [DOI] |
| 24. | Laird BJ, McMillan DC, Fayers P, Fearon K, Kaasa S, Fallon MT, Klepstad P. The systemic inflammatory response and its relationship to pain and other symptoms in advanced cancer. Oncologist. 2013;18:1050-1055. [PubMed] [DOI] |
| 25. | 金 昱彤, 曹 敏, 刘 海朝, 王 怡杨, 赵 舒武, 满 姗姗, 边 育红, 贾 贝田. 肿瘤相关中性粒细胞在肿瘤双向调控作用中的研究进展. 医学综述. 2022;28:2602-2607. [DOI] |
| 26. | Urakawa S, Yamasaki M, Goto K, Haruna M, Hirata M, Morimoto-Okazawa A, Kawashima A, Iwahori K, Makino T, Kurokawa Y, Yamada T, Mori M, Doki Y, Wada H. Peri-operative monocyte count is a marker of poor prognosis in gastric cancer: increased monocytes are a characteristic of myeloid-derived suppressor cells. Cancer Immunol Immunother. 2019;68:1341-1350. [PubMed] [DOI] |
| 27. | 冯 晨曦, 费 素娟. 术前纤维蛋白原与前白蛋白比值与食管癌患者病理特征关系及对其诊断价值的研究. 中国中西医结合消化杂志. 2021;29:725-730. [DOI] |
| 28. | Chen Y, Jin M, Shao Y, Xu G. Prognostic Value of the Systemic Inflammation Response Index in Patients with Adenocarcinoma of the Oesophagogastric Junction: A Propensity Score-Matched Analysis. Dis Markers. 2019;2019:4659048. [PubMed] [DOI] |
| 29. | Kühn T, Sookthai D, Graf ME, Schübel R, Freisling H, Johnson T, Katzke V, Kaaks R. Albumin, bilirubin, uric acid and cancer risk: results from a prospective population-based study. Br J Cancer. 2017;117:1572-1579. [PubMed] |
| 30. | Okadome K, Baba Y, Yagi T, Kiyozumi Y, Ishimoto T, Iwatsuki M, Miyamoto Y, Yoshida N, Watanabe M, Baba H. Prognostic Nutritional Index, Tumor-infiltrating Lymphocytes, and Prognosis in Patients with Esophageal Cancer. Ann Surg. 2020;271:693-700. [PubMed] [DOI] |
| 31. | Qi Q, Song Q, Cheng Y, Wang N. Prognostic Significance of Preoperative Prognostic Nutritional Index for Overall Survival and Postoperative Complications in Esophageal Cancer Patients. Cancer Manag Res. 2021;13:8585-8597. [PubMed] [DOI] |
| 32. | Hao J, Chen C, Wan F, Zhu Y, Jin H, Zhou J, Chen N, Yang J, Pu Q. Prognostic Value of Pre-Treatment Prognostic Nutritional Index in Esophageal Cancer: A Systematic Review and Meta-Analysis. Front Oncol. 2020;10:797. [PubMed] [DOI] |
| 33. | Yan K, Wei W, Shen W, Du X, Zhu S, Zhao H, Wang X, Yang J, Zhang X, Deng W. Combining the systemic inflammation response index and prognostic nutritional index to predict the prognosis of locally advanced elderly esophageal squamous cell carcinoma patients undergoing definitive radiotherapy. J Gastrointest Oncol. 2022;13:13-25. [PubMed] [DOI] |