修回日期: 2023-01-15
接受日期: 2023-04-23
在线出版日期: 2023-04-28
lncRNA PVT1基因作为lncRNAs的一种, 已经被证实在多种肿瘤中发挥促癌作用, 但对于该基因在直肠癌中的生物学行为报道较少, 因此, 本研究在结合国内外研究的基础上, 探讨lncRNA PVT1在直肠癌中表达以及与预后的关系, 以及对直肠癌自噬的调控机制和增殖凋亡的影响, 为直肠癌的靶向治疗提供可靠的靶点.
探究lncRNA PVT1在直肠癌组织中的表达及对直肠癌细胞自噬和增值侵袭的影响.
通过TCGA数据库获得92例直肠癌, 318例健康样本的lncRNA PVT1表达水平, 并且通过定量实时PCR检测直肠癌细胞SW837, HR8348, SW1463和FHC中lncRNA PVT1表达水平. 通过R语言包(survival, survminer)分析TCGA数据库分析lncRNA PVT1表达高低与直肠癌预后的关系. 过表达SW837, HR8348中的lncRNA PVT1. 利用transwell, CCK-8试剂盒、流式细胞实验分析其侵袭, 增值能力及凋亡的改变. 然后Western blot实验分析LC3-II/LC3-I的表达, 免疫荧光实验分析LC3荧光斑点的改变, 透射电镜分析形态学判断自噬小体的改变. 之后共转染si-Atg5分析直肠癌细胞自噬水平的变化.
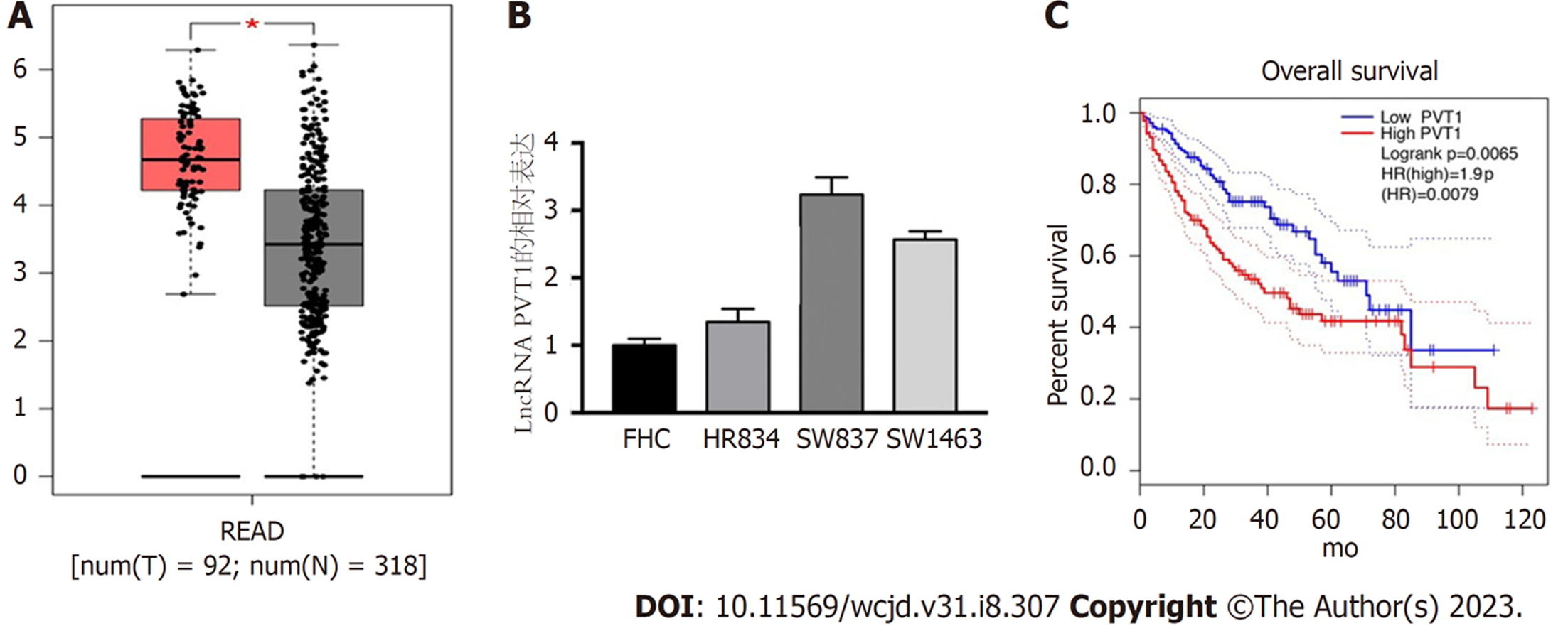
LncRNA PVT1在直肠癌组织和细胞中表达都显著增加. 并且lncRNA PVT1的表达直肠癌预后相关, 过表达lncRNA PVT1后激活直肠癌自噬和诱导肿瘤细胞增殖, 侵袭并且抑制其凋亡(P<0.05).
LncRNA PVT1在直肠癌组织和细胞中均高表达, 且与其预后显著相关, 过表达lncRNA PVT1诱导直肠癌细胞增殖, 侵袭并抑制其凋亡. LncRNA PVT1通过调控Atg5的表达参与直肠癌自噬水平的调控, 其可能参与直肠癌的发生发展.
核心提要: LncRNA PVT1基因作为lncRNAs的一种, 已经被证实在多种肿瘤中发挥促癌作用, 但对于该基因在直肠癌中的生物学行为报道较少, 因此, 本研究在结合国内外研究的基础上, 探讨lncRNA PVT1在直肠癌中表达以及与预后的关系, 以及对直肠癌自噬的调控机制和增殖凋亡的影响, 为直肠癌的靶向治疗提供可靠的靶点. 统计分析结果显示LncRNA PVT1在直肠癌组织和细胞中表达都显著增加. 并且lncRNA PVT1的表达直肠癌预后相关, 过表达lncRNA PVT1后激活直肠癌自噬和诱导肿瘤细胞增殖, 侵袭并且抑制其凋亡.
引文著录: 朱渊东, 刘海源, 雷鑫明, 彭雪强. 长链非编码RNA PVT1诱导直肠癌细胞增殖、抑制凋亡并通过上调Atg5诱导其自噬. 世界华人消化杂志 2023; 31(8): 307-315
Revised: January 15, 2023
Accepted: April 23, 2023
Published online: April 28, 2023
As a long noncoding RNA (lncRNA), PVT1 has been proved to play a role in promoting cancer in many tumors, but there are few reports on its impact on the biological behavior of rectal cancer. Therefore, this study investigated the expression of lncRNA PVT1 in rectal cancer and its relationship with prognosis, as well as its effect on rectal cancer cell autophagy, proliferation, and apoptosis, so as to provide a reliable target for treatment of rectal cancer.
To investigate the expression of lncRNA PVT1 in rectal cancer and its effects on autophagy and proliferation of rectal cancer cells.
The expression data of lncRNA PVT1 in 92 rectal cancer samples and 318 healthy control samples were obtained from the GEPIA database, and the expression levels of lncRNA PVT1 in rectal cancer cell lines SW837, HR8348, SW1463, and FHC were detected by quantitative real-time PCR. The relationship between the expression level of lncRNA PVT1 and the prognosis of rectal cancer was analyzed using the R packages (survival and survminer) based on the TCGA database. Overexpression of lncRNA PVT1 was then induced in SW837 and HR8348 cells. Transwell assay, CCK-8 assay, and flow cytometry were used to analyze the changes of cell invasion, proliferation, and apoptosis. Western blot analysis was performed to detect the expression of LC3-II/LC3-I, immunofluorescence was used to analyze the change of LC3 expression, and transmission electron microscopy was used to determine the change of autophagosomes. After co-transfection with si-Atg5, the changes of rectal cancer cell autophagy were analyzed.
The expression of lncRNA PVT1 in rectal cancer tissues and cells increased significantly. The expression of lncRNA PVT1 was related to the prognosis of rectal cancer. Overexpression of lncRNA PVT1 activated autophagy of rectal cancer cells and induced tumor cell proliferation, invasion, and apoptosis inhibition (P < 0.05).
LncRNA PVT1 is highly expressed in rectal cancer tissues and cells, and is significantly related to the prognosis of rectal cancer. Overexpression of lncRNA PVT1 induces rectal cancer cell proliferation and invasion, and inhibits their apoptosis. LncRNA PVT1 participates in the regulation of rectal cancer cell autophagy by regulating the expression of Atg5, which may be involved in the occurrence and development of rectal cancer.
- Citation: Zhu YD, Liu HY, Lei XM, Peng XQ. Long non-coding RNA PVT1 induces proliferation, inhibits apoptosis, and induces autophagy by up-regulating Atg5 in rectal cancer cells. Shijie Huaren Xiaohua Zazhi 2023; 31(8): 307-315
- URL: https://www.wjgnet.com/1009-3079/full/v31/i8/307.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v31.i8.307
结直肠癌(colorectal cancer, CRC)是最常见的恶性肿瘤之一, 其死亡率较高. 且大多数患者确诊CRC时已经处于中晚期, 已失去手术机会. 对于此类的患者多采用靶向治疗联合放化疗的方法, 因此, 寻找合适的生物学靶点显得格外重要[1,2].
长链非编码RNA(lncRNAs)被定义为具有200个核苷酸的大小和有部分蛋白质编码的潜力的非编码RNA, 在肿瘤形成和进展中发挥重要作用[3]. LncRNA在多个水平上调节基因表达, 包括通过转录前调控, 以及通过与miRNA, mRNA或蛋白质相互作用来进行转录后调控[4,5]
目前已经证实的是lncRNAs参与结直肠恶性肿瘤的发展[6], 例如, lncRNA H19与结直肠癌的预后显著相关, 并在进一步的研究中发现其通过诱导肿瘤上皮间质化过程促进肿瘤转移[7]. 另外lncRNA MALAT1通过诱导癌基因DCP1A表达促进大肠癌的肿瘤生长和转移[8]. LncRNA CASC2通过"海绵效应"下调miR-18a表达从而抑制CRC细胞增殖和肿瘤生长[9]. LncRNA CPS1-IT1通过使调控HIF-1α诱导的自噬, 从而抑制结直肠癌的EMT和转移[10], 总之以往的研究证实, lncRNAs可以参与结肠癌细胞的增殖, 凋亡, 侵袭转移, 自噬等许多过程从而在结直肠癌的发生发展中发挥重要作用.
lncRNA PVT1基因作为lncRNAs的一种, 已经被证实在多种肿瘤中发挥促癌作用, 但对于该基因在直肠癌中的生物学行为报道较少, 因此, 本研究在结合国内外研究的基础上, 经义乌市中心医院伦理委员会审批(批号: K2020-IRB-037), 探讨lncRNA PVT1在直肠癌中表达以及与预后的关系, 以及对直肠癌自噬的调控机制和增殖凋亡的影响, 为直肠癌的靶向治疗提供可靠的靶点.
TCGA数据库: 从TCGA数据库获得92例直肠癌和318例健康正常样本. R语言包(survival, survminer)用于分析来源于TCGA数据库lncRNA PVT1的表达与预后的关系.
1.2.1 细胞培养和转染: 三种直肠癌细胞系(SW837, HR8348和SW1463)和正常人结肠直肠上皮细胞系(FHC)购自中国科学院细胞库(中国, 上海). 所有细胞用含有10%胎儿DMEM培养基(Gibco, USA)中培养的牛血清中, 在5%CO2在37 ℃培养. 从GenePharma(上海)购买特异性靶向pcDNA3.1-PVT1和阴性对照pcDNA3.1使用Lipofectamine 3000 Reagents(Invitrogen)将这些质粒转染到SW837和HR8348细胞系中. siRNA由中国上海Genepharma合成. si-Atg5的RNA序列: si-Atg5#, 5'-GAUCACAAGCAACUCUGGAUGGGAU-3. si-NC#, 5'-UUCUCCGAACU-GUCACGUTT-3'.
1.2.2 Transwell实验: 使用带有Matrigel(BD)的24孔Transwell板检测过表达lncRNA PVT1后SW837, HR8348细胞的侵袭能力. 将无血清培养基中的细胞(1×105)铺在顶室中. 将含10%FBS的高葡萄糖Dulbecco改良的Eagle培养基(DMEM)添加到底部腔室中. 孵育24 h后, 将膜用PBS洗涤, 后4%多聚甲醛固定, 并用0.1%结晶紫溶液染色. 每个实验重复三次.
1.2.3 细胞克隆实验: pcDNA3.1-PVT1转染的SW837和HR8348细胞后, 分别接种在六孔板里, 每空接种200个肿瘤细胞. 继续培养2 wk后, 4%多聚甲醛固定20 min后, 并用0.1%结晶紫溶液染色. 每个实验重复三次.
1.2.4 CCK-8法测定细胞增殖能力: 通过CCK-8细胞增殖测定法定量细胞增殖. 将细胞以每孔(2-4)×103个细胞的密度接种在96孔板中(第0天)后继续培养(24、48、72) h, 分别加入10% CCK-8溶液. 然后, 将10 μL CCK-8溶液加入每个孔中, 并将细胞在37 ℃、50 mL/L CO2下再保持1 h-2 h. 用酶标仪(Bio Tek Synergy2美国)测量450 nm处的吸光度.
1.2.5 流式细胞术: 转染后48 h, 通过胰蛋白酶消化收获pcDNA3.1-PVT1转染的SW837和HR8348细胞. 根据生产商的操作步骤, 使用FITC Annexin V细胞凋亡检测试剂盒(BD Biosciences)对FITC-Annexin V和碘化丙锭进行了双重染色后, 通过流式细胞仪(FACScan BD Biosicences)进行细胞凋亡分析. 所有样品均一式三份测定.
1.2.6 实时定量PCR: 根据制造商的实验步骤, 使用TRIZOL试剂(Invitrogen)从组织或培养的细胞中提取总RNA. 对于qRT-PCR, 使用逆转录试剂盒(中国, 大连, Takara)将RNA反转录为cDNA. 使用SYBR Premix Ex Taq(Takara)进行实时PCR分析. 将结果标准化为GAPDH的表达. 在ABI 7500(ABI美国)上进行qRT-PCR测定, 并用该仪器收集数据. 分析我们的qRT-PCR结果并相对于阈值循环(CT)值进行表达, 然后转换为倍数变化. 每个样品进行三次重复分析. qRT-PCR用于引物序列: lncRNA PVT1的正向5'-TGAGAACTGTCCTTACGTGACC -3'和反向5'-AGAGCACCAAGACTGGCTCT-3'; ATG3正向引物: 5'-ACTGATGCTGGCGGTGAAGATG-3'; 反向引物: 5'-GTGCTCAACTGTTAAA GGCTGCC-3'; ATG5 正向引物: 5'-TGTGCTTCGAGATGTGTGGTT-3'; 反向引物: 5'-ACCAACGTCAAATAGCTGACT-3'; ATG7正向引物: 5ʹ-GATCCGGGGATTTCTTTCACG-3ʹ; 反向引物: 5ʹ-CAGCAATGTAAGACCAGTCAAGT-3ʹ; ATG9正向引物: 5'-CGTGTGGGAAGGACAG-3'; 反向引物: 5'-GGCGCTTTCTCCACTC-3'; ATG10 5-3'-ATGGATTCAGCTCGAGAGGTCAGCGAT-3'反向引物: 5'CAGTCCTCAGTCCCACAGGGA-TGTAG-3'; ATG12正向引物: 5'-TTGTGGCCTCAGAACAGTTG-3'; 反向引物: 5'GAGAGTTCCAACTTCTTGGTCTG-3-3'; ATG14正向引物: 5'-ACCAGCATTAGCATCACG-3'; 反向引物: 5'-AGGTCCTTGGGTTGTTTT-3'; Beclin-1正向引物: 5'-GGATCAGGAGGAAGC-3'; 反向引物: 5'-GATGTGGAAGGTTGC-3'; GAPDH正向引物: 5'-CCTGGTATGACA-ACGAATTTG-3'; 反向引物: 5'-CAGTGAGGGTCTCTCTCTTCC-3'.
1.2.7 蛋白质印迹: 蛋白质印迹分析, 约30 μg变性的目的蛋白通过SDS-聚丙烯酰胺凝胶中分离并转移到PVDF膜上. 然后在室温下用5%BSA将膜封闭2 h, 将膜与稀释的抗体在PBS中于4 ℃孵育过夜. 将膜用TBST(含0.5%Tween 20的PBS)洗涤3次, 每次10 min, 然后在室温下用过氧化物酶偶联的山羊抗兔二抗(CST)再次孵育1 h. 再次用TBST清洗膜3次, 每次10 min, 最后通过ECL发光夜通过Tanon-5200仪器进行显色. 相应抗体: LC3B(CST #3868), Atg5(CST #12994), β-actin(proteintech #66009-1-Ig)
1.2.8 免疫荧光: 对于免疫荧光实验, 首先将在6孔板中的玻片上培养的细胞固定在4%多聚甲醛室温下10 min, 然后用5%Triton透膜20 min. 并用5%BSA在室温下封闭30 min, 添加第一抗体(过夜, 4 ℃)和荧光第二抗体(2 h, 室温). 最后, 使用DAPI用于染色细胞核. 而且在使用不同试剂的步骤之间, 将载玻片上的细胞用PBS中洗涤3次, 每次10 min. 使用抗萃灭剂封片后, 用共聚焦激光扫描显微镜(日本Nikon A1)观察载玻片. 在该实验中, 使用的抗体: LC3(CST, 1:100)的抗体和荧光二抗FITC(CST, 1:100).
1.2.9 透射电镜实验: 首收集适量培养细胞离心后迅速用2.5%戊二醛固定细胞2 h. 然后样品用乙醇脱水, 并包埋在树脂中. 通过金刚石刀切割超薄切片后, 将切片安装在铜网上, 用乙酸铀酰和柠檬酸双重染色. 样品的观察和拍照通过透射电子显微镜(H7605日本).
统计学处理 所有统计分析均使用SPSS 17软件(美国SPSS)进行. 使用Student's t检验估计两组之间差异的显着性, 所有结果均报告为mean±SD. P<0.05被认为具有统计学意义.
为了分析lncRNA PVT1在直肠癌细胞中的功能, 我们首先明确其表达水平. 我们发现, 在与TCGA数据库中与318个正常组织相比, 92例直肠癌细胞组织lncRNA PVT1显著水平上调(图1A). 同时我们进一步确认SW837, HR8348、SW1463和FHC中lncRNA PVT1表达, 结果显示lncRNA PVT1在直肠癌细胞中表达同样也显著上调(图1B). 通过预后分析显示lncRNA PVT1表达水平与其预后负性相关(图1C), 我们进一步通过过表达lncRNA PVT1在SW837, HR8348的表达进行下一步功能实验.
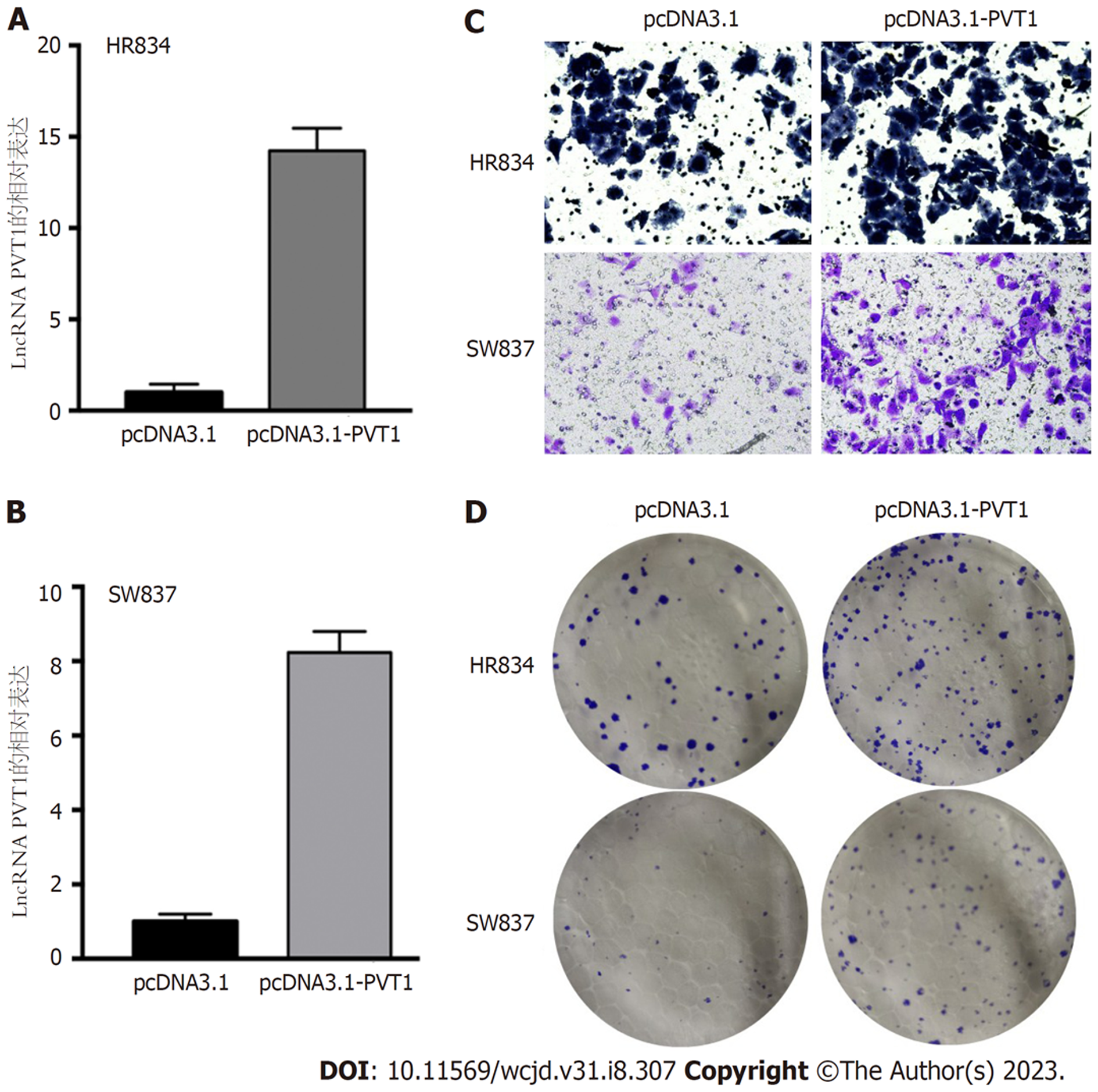
通过转染过表达质粒成功过表达lncRNA PVT1在SW837, HR8348细胞中(图2A和B), 上述细胞用于后续实验. Transwell实验显示, 过表达lncRNA PVT1显著增加其侵袭能力(图2C). 我们进一步通过克隆实验证实过表达lncRNA PVT1显著诱导SW837, HR8348细胞克隆形成(图2D). 这些实验表明过表达lncRNA PVT1调控直肠癌细胞侵袭和克隆形成能力.
过表达lncRNA PVT1的SW837, HR8348细胞中, CCK8实验显示: 过表达lncRNA PVT1细胞增殖能力显增加(P<0.05;图3A和B). 流式细胞术结果显示: 相比于NC组, lncRNA PVT1过表达组细胞凋亡显著降低(P<0.05; 图3C和D).
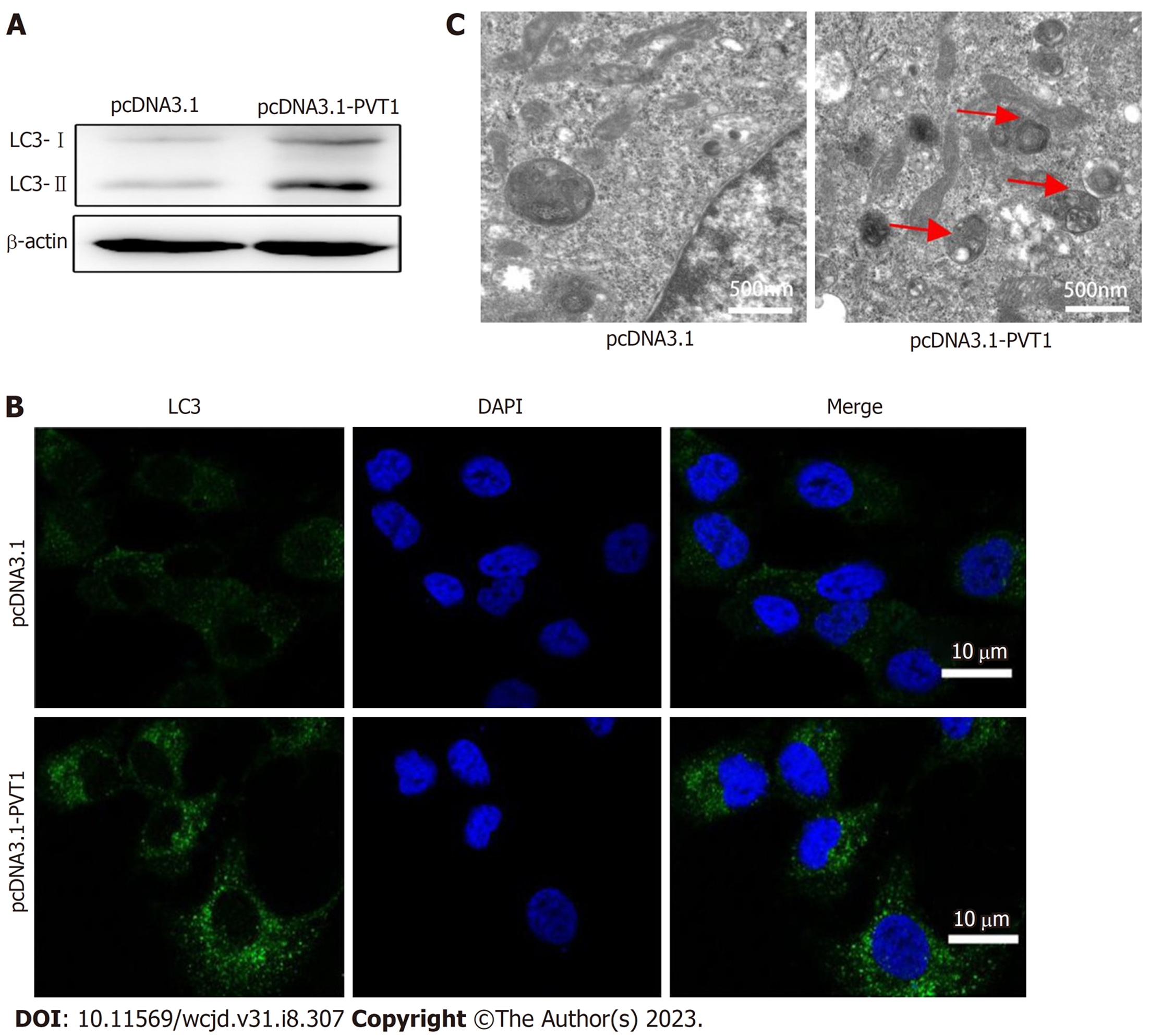
自噬在结肠癌的作用已经被广泛证实[11,12], 为了探究lncRNA PVT1对直肠癌细胞(SW837)自噬水平的调控, 通过western blot实验检测lncRNA PVT1直肠癌细胞LC3II/LC3-I的相对表达. 结果显示: 与NC组相比, lncRNA PVT1组LC3-II/LC3-I的表达显着增加(图4A), 通过免疫荧光共聚焦发现lncRNA PVT1显著诱导LC3荧光斑点的比例(图4B). 最后透射电镜用于检测过表达lncRNA PVT1自噬小体或自噬溶酶体水平在亚细胞器水平评估lncRNA PVT1对自噬的调控(图4C). 因此, lncRNA PVT1诱导直肠癌自噬, 可能参与直肠癌的发生发展.
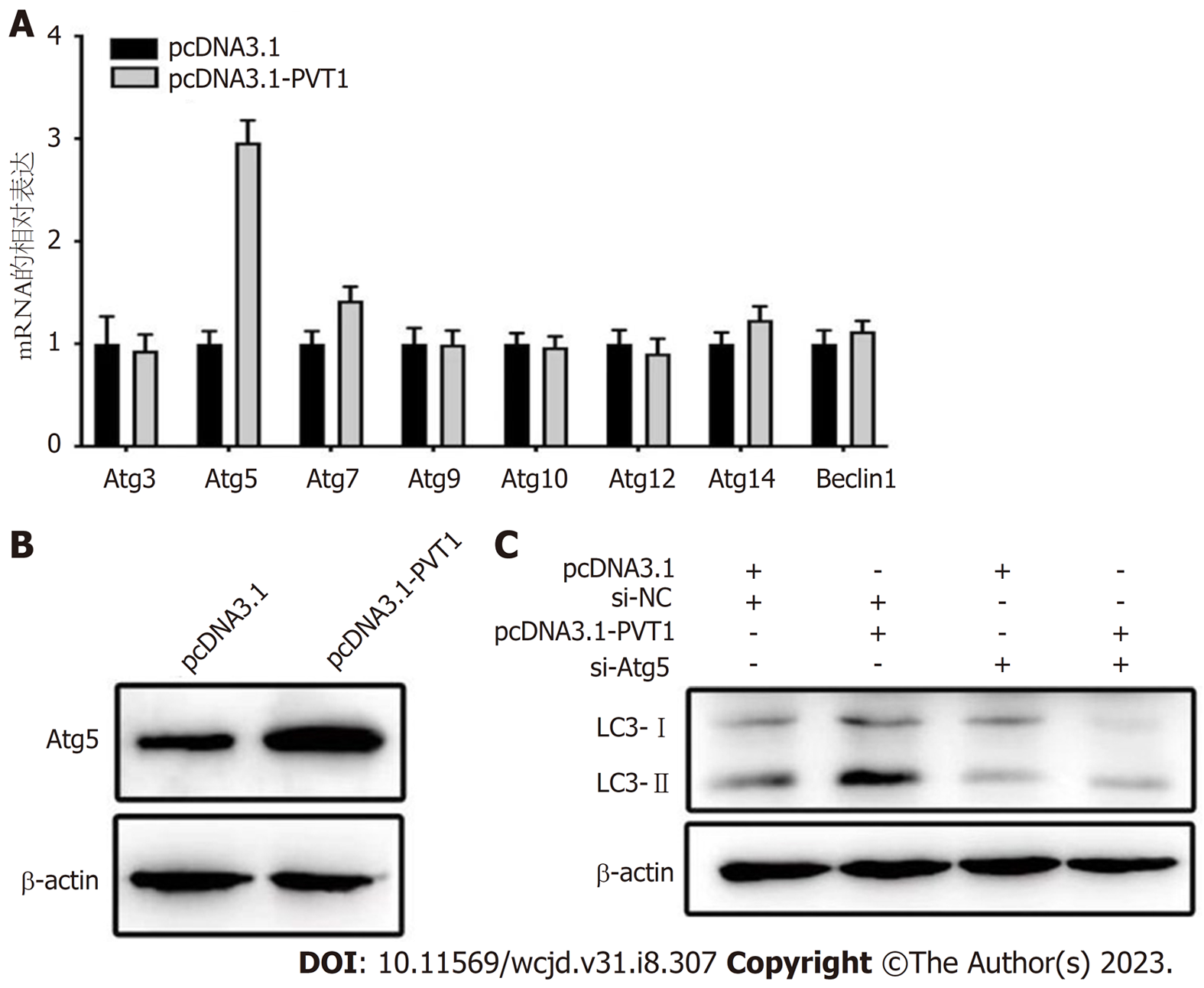
自噬是真核生物高度保守的自我调控的过程, 其发生依赖于自噬相关基因(Atgs)不断激活形成自噬小体并且与溶酶体融合形成自噬溶酶体的过程[12]. 为了探究lncRNA PVT1诱导自噬的机制, 首先使用qRT-PCR检测过表达lncRNA PVT1直肠癌细胞(SW837)中主要的自噬相关基因表达变化. 结果显示在Atg3, Atg5, Atg7, Atg9, Atg10, Atg12, Atg14和Beclin1的自噬相关基因中, PVT1显著诱导了Atg5 mRNA的表达(图5A). 在过表达lncRNA PVT1的直肠癌细胞(SW837)中检测Atg5 蛋白表达的变化, 显示Atg5显著表达上调(图5B). 最后在直肠癌细胞(SW837)中转染pcDNA3.1-PVT1 与si-Atg5, 运用WB检测LC3评估其自噬水平的改变(图5C), 证实lncRNA PVT1通过Atg5调控直肠癌自噬.
长链非编码RNA(lncRNA)在结直肠癌领域中已被广泛研究[13-15], 常见的基因有SOX2OT[16], MIR17HG[17], GLCC1[18], MALAT1[19]. 有研究表明[16]SOX2OT的表达上调可以促进直肠癌的细胞增殖、侵袭等恶性生物学行为. MIR17HG在直肠癌中可以调控miR-17-5p表达进而促进大肠癌的发生发展[17]. GLCC1可以通过稳定c-Myc进而发挥促进结直肠癌变和肿瘤细胞代谢[18]. MALAT1可以诱导结直肠癌细胞自噬进而促进细胞增殖并抑制细胞凋亡, 其机制通过抑制结肠直肠癌中miR-101对自噬的负性调控作用[8].
自噬在正常和肿瘤细胞中起着维持细胞稳态和适应应力关键作用[12,20]. 自噬的每个步骤都受特定自噬复合物的控制, 这些自噬复合物的活性直接或间接受到应激信号通路的调控[20]. 目前多项研究已经证实自噬在肿瘤细胞的恶性生物学行为中发挥重要作用[20]. 尤其是在肿瘤生长期间, 包括CRC在内的各种肿瘤细胞都将自噬作为重要的营养来源[20,21]. 值得注意的是肿瘤细胞中异常表达的LncRNAs广泛参与肿瘤自噬水平的调控, 并且在肿瘤细胞抵御各种不利因素如低氧、饥饿、化疗药物等发挥重要作用[22]. 关于lncRNA SNHG6的研究证实其可能在CRC细胞中ceRNA调控miR-26a-5p间接诱导ULK1介导的自噬促进化学抗性[23]等. Lnc RNA PVT1基因已经被证实在多种肿瘤中发挥促癌作用[24], 例如lncRNA PVT1通过激活KAT2A乙酰转移酶和稳定HIF-1α从而诱导鼻咽癌恶性生物学行为并诱发放射的抵抗性[24]. 在宫颈癌中lncRNA PVT1通过激活NFκB途径抑制miR16的作用, 最终促进宫颈癌细胞的细胞增殖并抑制细胞凋亡[25]. 然后目前对于lncRNA PVT1在直肠癌中的作用尚不明确. 因此本研究在结合国内外研究的基础上, 探讨lncRNA PVT1在直肠癌中表达以及与预后的关系, 以及对直肠癌自噬的调控机制和增殖凋亡的影响.
本研究首先通过TCGA数据库获得直肠癌的lncRNA PVT表达情况, 显示在肿瘤细胞中lncRNA PVT显著上调. 之后在直肠癌细胞系中证实了lncRNA PVT在直肠癌细胞中表达同样显著增加. 通过R语言包(survival, survminer)进行预后分析显示lncRNA PVT1的表达水平与直肠癌预后显著相关(P<0.05). 随后在直肠癌细胞中过表达lncRNA PVT1, 分别通过transwell实验, 细胞克隆实验, 流式实验, 细胞增殖实验分析lncRNA PVT1对直肠癌细胞增殖, 凋亡的影响. 结果显示, 过表达lncRNA PVT1后激活直肠癌自噬和诱导肿瘤细胞增殖, 侵袭并且抑制其凋亡(P<0.05). 之后通过WB, 免疫荧光和电镜实验分析了过表达lncRNA PVT1对直肠癌细胞自噬影响. 结果显示WB显示LC3-II/LC3-I比例上调, 免疫荧光结果显示LC3荧光斑点显著增加, 电镜结构显示自噬小体显著增加. 提示过表达lncRNA PVT1显著诱导直肠癌细胞自噬水平. 为了探究lncRNA PVT1调控自噬的具体机制, PCR结果显示lncRNA PVT1诱导Atg5 mRNA上调. 进一步通过western blot证实过表达lncRNA PVT1显著诱导Atg5蛋白水平上调, 然后共转染pcDNA3.1-PVT1与si-Atg5质粒, western blot显示lncRNA PVT1在Atg5干扰组自噬水平无明显改变. 因此证实lncRNA PVT1可以通过Atg5调控直肠癌细胞自噬水平.
本研究的不足之处在于, 本研究通过对于数据库数据分析lncRNA PVT1的表达与预后的关联性, 并未搜集单位直肠癌术后标本进行分析, 结论说服力尚不足; 另外本研究中实验室培养三种直肠癌细胞系(SW837, HR8348和SW1463)只能代表部分直肠癌细胞的情况, 得到的结论有以偏概全的可能, 因此希望今后有更多对于直肠癌手术后标本、以及更多直肠癌细胞系进行分析.
综上所述, lncRNA PVT1在直肠癌组织和细胞中显著表达上调, 而且高表达的lncRNA PVT1与肿瘤细胞的细胞分裂周期和自噬显著相关. 细胞实验水平证实lncRNA PVT1促进直肠癌细胞增殖, 抑制其凋亡等恶性生物学行为. 同时也证实lncRNA PVT1诱导直肠癌细胞自噬通过上调Atg5, 这些表明lncRNA PVT1作为在直肠癌的发生发展中具有重要意义, 而且有望成直肠癌有效的治疗靶点.
lncRNA PVT1基因作为lncRNAs的一种, 已经被证实在多种肿瘤中发挥促癌作用, 但对于该基因在直肠癌中的生物学行为报道较少.
本研究在结合国内外研究的基础上, 探讨lncRNA PVT1在直肠癌中表达以及与预后的关系, 以及对直肠癌自噬的调控机制和增殖凋亡的影响, 为直肠癌的靶向治疗提供可靠的靶点.
探究lncRNA PVT1在直肠癌组织中的表达及对直肠癌细胞自噬和增值侵袭的影响.
通过TCGA数据库获得92例直肠癌, 318例健康样本的lncRNA PVT1表达水平, 并且通过定量实时PCR检测直肠癌细胞SW837, HR8348, SW1463和FHC中lncRNA PVT1表达水平. 通过R语言包(survival, survminer)分析TCGA数据库分析lncRNA PVT1表达高低与直肠癌预后的关系. 过表达SW837, HR8348中的lncRNA PVT1. 利用transwell, CCK-8试剂盒、流式细胞实验分析其侵袭, 增值能力及凋亡的改变. 然后Western blot实验分析LC3-Ⅱ/LC3-Ⅰ的表达, 免疫荧光实验分析LC3荧光斑点的改变, 透射电镜分析形态学判断自噬小体的改变. 之后共转染si-Atg5分析直肠癌细胞自噬水平的变化.
LncRNA PVT1在直肠癌组织和细胞中表达都显著增加. 并且lncRNA PVT1的表达直肠癌预后相关, 过表达lncRNA PVT1后激活直肠癌自噬和诱导肿瘤细胞增殖, 侵袭并且抑制其凋亡(P<0.05).
lncRNA PVT1在直肠癌组织和细胞中显著表达上调, 而且高表达的lncRNA PVT1与肿瘤细胞的细胞分裂周期和自噬显著相关. 细胞实验水平证实lncRNA PVT1促进直肠癌细胞增殖, 抑制其凋亡等恶性生物学行为. 同时也证实lncRNA PVT1诱导直肠癌细胞自噬通过上调Atg5, 这些表明lncRNA PVT1作为在直肠癌的发生发展中具有重要意义, 而且有望成直肠癌有效的治疗靶点.
希望今后有更多对于直肠癌手术后标本、以及更多直肠癌细胞系进行分析.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C, C
D级 (一般): 0
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Wang H. MicroRNAs and Apoptosis in Colorectal Cancer. Int J Mol Sci. 2020;21. [PubMed] [DOI] |
| 2. | Venugopal A, Stoffel EM. Colorectal Cancer in Young Adults. Curr Treat Options Gastroenterol. 2019;17:89-98. [PubMed] [DOI] |
| 3. | Peng HX, Yang L, He BS, Pan YQ, Ying HQ, Sun HL, Lin K, Hu XX, Xu T, Wang SK. Combination of preoperative NLR, PLR and CEA could increase the diagnostic efficacy for I-III stage CRC. J Clin Lab Anal. 2017;31. [PubMed] [DOI] |
| 5. | Mohanty V, Gökmen-Polar Y, Badve S, Janga SC. Role of lncRNAs in health and disease-size and shape matter. Brief Funct Genomics. 2015;14:115-129. [PubMed] [DOI] |
| 6. | Zhu Y, Gu L, Lin X, Cui K, Liu C, Lu B, Zhou F, Zhao Q, Shen H, Li Y. LINC00265 promotes colorectal tumorigenesis via ZMIZ2 and USP7-mediated stabilization of β-catenin. Cell Death Differ. 2020;27:1316-1327. [PubMed] [DOI] |
| 7. | Liang WC, Fu WM, Wong CW, Wang Y, Wang WM, Hu GX, Zhang L, Xiao LJ, Wan DC, Zhang JF, Waye MM. The lncRNA H19 promotes epithelial to mesenchymal transition by functioning as miRNA sponges in colorectal cancer. Oncotarget. 2015;6:22513-22525. [PubMed] [DOI] |
| 8. | Wu C, Zhu X, Tao K, Liu W, Ruan T, Wan W, Zhang C, Zhang W. MALAT1 promotes the colorectal cancer malignancy by increasing DCP1A expression and miR203 downregulation. Mol Carcinog. 2018;57:1421-1431. [PubMed] [DOI] |
| 9. | Li J, Ma X, Chakravarti D, Shalapour S, DePinho RA. Genetic and biological hallmarks of colorectal cancer. Genes Dev. 2021;35:787-820. [PubMed] [DOI] |
| 10. | Zhang W, Yuan W, Song J, Wang S, Gu X. LncRNA CPS1-IT1 suppresses EMT and metastasis of colorectal cancer by inhibiting hypoxia-induced autophagy through inactivation of HIF-1α. Biochimie. 2018;144:21-27. [PubMed] [DOI] |
| 11. | Kosumi K, Masugi Y, Yang J, Qian ZR, Kim SA, Li W, Shi Y, da Silva A, Hamada T, Liu L, Gu M, Twombly TS, Cao Y, Barbie DA, Nosho K, Baba H, Garrett WS, Meyerhardt JA, Giovannucci EL, Chan AT, Fuchs CS, Ogino S, Nishihara R. Tumor SQSTM1 (p62) expression and T cells in colorectal cancer. Oncoimmunology. 2017;6:e1284720. [PubMed] [DOI] |
| 12. | Savini M, Wang MC. Does Autophagy Promote Longevity? It Depends. Cell. 2019;177:221-222. [PubMed] [DOI] |
| 13. | Sung H, Ferlay J, Siegel RL, Laversanne M, Soerjomataram I, Jemal A, Bray F. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021;71:209-249. [PubMed] [DOI] |
| 14. | Zhu XT, Yuan JH, Zhu TT, Li YY, Cheng XY. Long noncoding RNA glypican 3 (GPC3) antisense transcript 1 promotes hepatocellular carcinoma progression via epigenetically activating GPC3. FEBS J. 2016;283:3739-3754. [PubMed] [DOI] |
| 15. | Bhan A, Soleimani M, Mandal SS. Long Noncoding RNA and Cancer: A New Paradigm. Cancer Res. 2017;77:3965-3981. [PubMed] [DOI] |
| 16. | Liu S, Xu B, Yan D. Enhanced expression of long non-coding RNA Sox2ot promoted cell proliferation and motility in colorectal cancer. Minerva Med. 2016;107:279-286. [PubMed] |
| 17. | Xu J, Meng Q, Li X, Yang H, Xu J, Gao N, Sun H, Wu S, Familiari G, Relucenti M, Zhu H, Wu J, Chen R. Long Noncoding RNA MIR17HG Promotes Colorectal Cancer Progression via miR-17-5p. Cancer Res. 2019;79:4882-4895. [PubMed] [DOI] |
| 18. | Tang J, Yan T, Bao Y, Shen C, Yu C, Zhu X, Tian X, Guo F, Liang Q, Liu Q, Zhong M, Chen J, Ge Z, Li X, Chen X, Cui Y, Chen Y, Zou W, Chen H, Hong J, Fang JY. LncRNA GLCC1 promotes colorectal carcinogenesis and glucose metabolism by stabilizing c-Myc. Nat Commun. 2019;10:3499. [PubMed] [DOI] |
| 19. | Si Y, Yang Z, Ge Q, Yu L, Yao M, Sun X, Ren Z, Ding C. Long non-coding RNA Malat1 activated autophagy, hence promoting cell proliferation and inhibiting apoptosis by sponging miR-101 in colorectal cancer. Cell Mol Biol Lett. 2019;24:50. [PubMed] [DOI] |
| 20. | Poillet-Perez L, Xie X, Zhan L, Yang Y, Sharp DW, Hu ZS, Su X, Maganti A, Jiang C, Lu W, Zheng H, Bosenberg MW, Mehnert JM, Guo JY, Lattime E, Rabinowitz JD, White E. Autophagy maintains tumour growth through circulating arginine. Nature. 2018;563:569-573. [PubMed] [DOI] |
| 21. | Wang Z, Jin J. LncRNA SLCO4A1-AS1 promotes colorectal cancer cell proliferation by enhancing autophagy via miR-508-3p/PARD3 axis. Aging (Albany NY). 2019;11:4876-4889. [PubMed] [DOI] |
| 22. | Frankel LB, Lubas M, Lund AH. Emerging connections between RNA and autophagy. Autophagy. 2017;13:3-23. [PubMed] [DOI] |
| 23. | Wang X, Lan Z, He J, Lai Q, Yao X, Li Q, Liu Y, Lai H, Gu C, Yan Q, Fang Y, Zhang Y, Li A, Liu S. LncRNA SNHG6 promotes chemoresistance through ULK1-induced autophagy by sponging miR-26a-5p in colorectal cancer cells. Cancer Cell Int. 2019;19:234. [PubMed] [DOI] |
| 24. | Zhang L, Mao J. Long-Chain Noncoding RNA PVT1 Gene Polymorphisms Are Associated with the Risk and Prognosis of Colorectal Cancer in the Han Chinese Population. Genet Test Mol Biomarkers. 2019;23:728-736. [PubMed] [DOI] |
| 25. | Wang C, Zou H, Yang H, Wang L, Chu H, Jiao J, Wang Y, Chen A. Long noncoding RNA plasmacytoma variant translocation 1 gene promotes the development of cervical cancer via the NFκB pathway. Mol Med Rep. 2019;20:2433-2440. [PubMed] [DOI] |