修回日期: 2023-02-26
接受日期: 2023-03-27
在线出版日期: 2023-04-08
炎症性肠病是一种慢性肠道炎性疾病, Toll样受体(toll-like receptor, TLRs)属I型跨膜蛋白, 在肠粘膜组织广泛表达, 提示TLRs可参与炎症性肠病发生, 本研究尝试探究炎症性肠病患者结肠粘膜组织中TLR2、TLR4、TLR9与菌群改变、血清免疫球蛋白的相关性.
探究炎症性肠病患者结肠黏膜组织TLRs表达与菌群改变、血清免疫球蛋白的关系.
选择2020-06/2022-06我院收治的139例炎症性肠病患者作为研究组, 其中克罗恩病(Crohn's disease, CD)患者61例、溃疡性结肠炎(ulcerative colitis, UC)患者78例, 并招募46例健康志愿者作为对照组. 比较2组菌群改变、血清免疫球蛋白[免疫球蛋白G(immunoglobulin G, IgG)、IgM、IgA]、TLR2、TLR4、TLR9 mRNA和蛋白水平, Pearson分析研究中各指标与菌群改变、血清免疫球蛋白相关性, 比较CD、UC不同发病状态结肠粘膜组织TLR2、TLR4、TLR9 mRNA和蛋白水平, ROC分析研究组各指标对CD、UC的诊断价值.
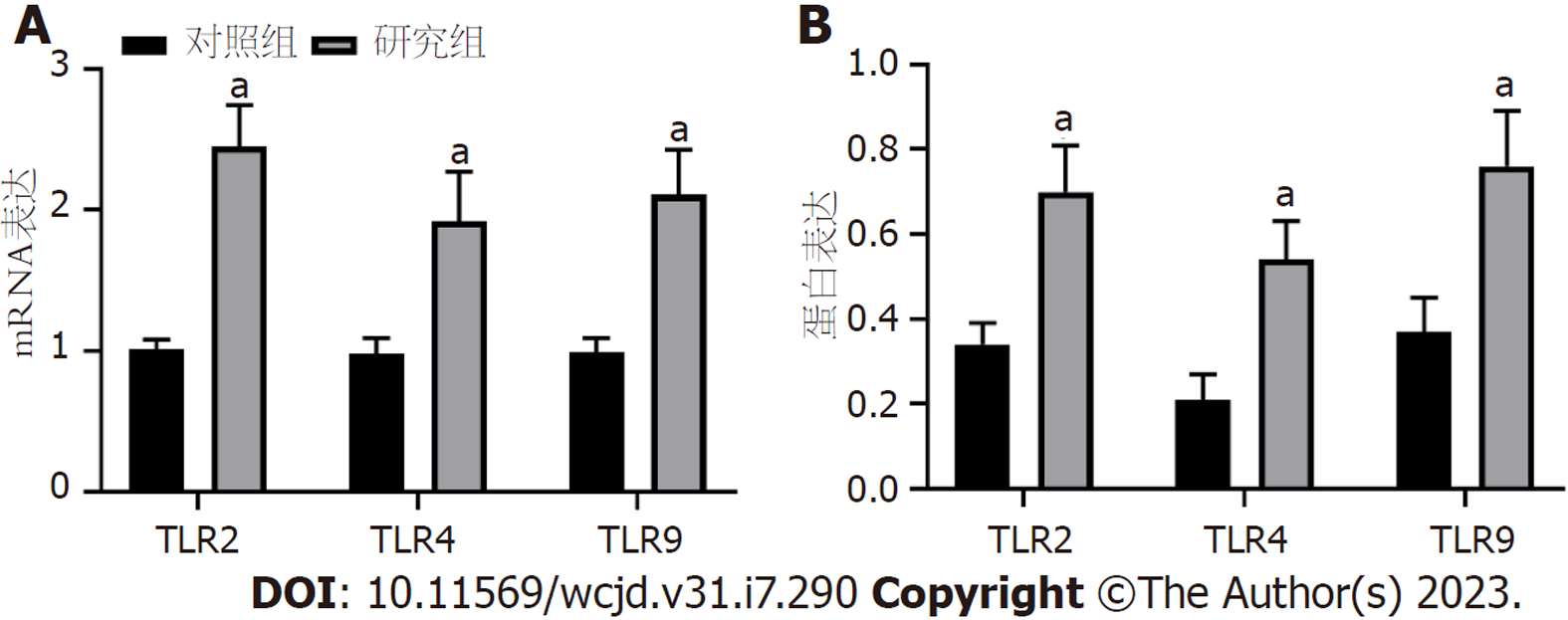
与对照组比较, 研究组双歧杆菌、乳酸杆菌、拟杆菌、TLR2、TLR4、TLR9 mRNA和蛋白水平显著增加, 肠球菌、IgG、IgM、IgA显著降低(P<0.05); 研究组肠粘膜组织TLR2、TLR4、TLR9 mRNA与菌群改变、血清免疫球蛋白呈负相关; CD、UC不同发病状态TLR2、TLR4、TLR9 mRNA和蛋白水平比较, 差异有统计学意义(P<0.05), 轻度<中度<重度; CD、UC患者结肠粘膜组织TLR2、TLR4、TLR9 mRNA联合诊断优于单独诊断(P<0.05).
在炎症性肠病患者结肠粘膜组织内TLR2、TLR4、TLR9高表达, 并与菌群改变、血清免疫球蛋白显著相关, 且联合检测对炎症性肠病具有一定诊断效能.
核心提要: 炎症性肠病患者结肠粘膜组织内Toll样受体高表达, 并与菌群改变、血清免疫球蛋白有关, 且联合检测对炎症性肠病具有一定诊断效能.
引文著录: 郭丽丽, 吴中平, 杨碧锋. TLRs在炎症性肠病结肠黏膜组织中的表达及意义. 世界华人消化杂志 2023; 31(7): 290-298
Revised: February 26, 2023
Accepted: March 27, 2023
Published online: April 8, 2023
Toll-like receptors (TLRs) are type I transmembrane proteins that are widely expressed in intestinal mucosal tissues, suggesting that they may be involved in inflammatory bowel disease. The present study was conducted to investigate the correlation of the expression of TLR2, TLR4, and TLR9 in the colonic mucosa of patients with inflammatory bowel disease with altered bacterial flora and serum immunoglobulins.
To investigate the relationship of the expression of TLRs in colonic mucosal tissues of patients with inflammatory bowel disease with altered bacterial flora and serum immunoglobulins.
A total of 139 patients with inflammatory bowel disease admitted to our hospital from June 2020 to June 2022 were selected as a study group, including 61 patients with Crohn's disease (CD) and 78 patients with ulcerative colitis (UC), and 46 healthy volunteers were recruited as a control group. Bacterial flora alteration, serum immunoglobulins [(immunoglobulin (Ig)G, IgM, and IgA], and mRNA and protein expression of TLR2, TLR4, and TLR9 were compared between the two groups, and their correlation was assessed by Pearson analysis. The levels of TLR2, TLR4, and TLR9 mRNA and protein in colonic mucosal tissues of CD and UC patients in different disease states were also compared. The diagnostic value of each index for CD and UC was analyzed by ROC analysis.
Compared with the control group, the levels of bifidobacterium, lactobacillus, anaplasma, and TLR2, TLR4, and TLR9 mRNA and protein expression were significantly increased and those of enterococci, IgG, IgM, and IgA were significantly decreased in the study group (P < 0.05). TLR2, TLR4, and TLR9 mRNA expression in intestinal mucosal tissue was negatively correlated with altered flora and serum immunoglobulins in the study group. TLR2, TLR4, and TLR9 mRNA and protein levels differed significantly among different morbidity states of UC and CD (mild < moderate < severe). The performance of combined diagnosis of TLR2, TLR4, and TLR9 mRNA in colonic mucosal tissues of CD and UC patients was better than that of either of alone (P < 0.05).
High expression of TLR2, TLR4, and TLR9 in colonic mucosal tissues of patients with inflammatory bowel disease is significantly correlated with altered flora and serum immunoglobulins, and the combined assay is diagnostically effective in inflammatory bowel disease.
- Citation: Guo LL, Wu ZP, Yang BF. Significance of expression of Toll-like receptors in colonic mucosal tissue of patients with inflammatory bowel disease. Shijie Huaren Xiaohua Zazhi 2023; 31(7): 290-298
- URL: https://www.wjgnet.com/1009-3079/full/v31/i7/290.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v31.i7.290
炎症性肠病是一种慢性肠道炎性疾病, 临床根据病理类型分为克罗恩病(Crohn's disease, CD)、溃疡性结肠炎(ulcerative colitis, UC), 相关报道认为, CD、UC发病可能与环境、遗传、菌群改变、免疫系统损伤等有关[1,2]. 最近调查数据显示, 我国炎症性肠病发病率呈上升趋势增加, 也是当前消化医学研究的热点[3]. Toll样受体(toll-like receptor, TLRs)属于I型跨膜蛋白, 在多种组织和细胞上广泛表达, 包括肠粘膜组织, 能识别机体多种病原体, 且有10个成员在人体内表达, 如TLR2、TLR4、TLR9等[4]. 有报道称, TLRs可介导参与炎症性肠病发生, 并通过调控髓样分化因子88、核转录因子κB(nuclear transcription factor κB, NF-κB)蛋白表达影响炎症性肠病发生发展[5,6]. 鉴于此, 本研究尝试探究TLR2、TLR4、TLR9在炎症性肠病患者结肠粘膜组织中的表达, 并分析其与菌群改变、血清免疫球蛋白相关性, 旨在为临床研究炎症性肠病提供参考.
选择2020-06/2022-06我院收治的139例炎症性肠病患者作为研究对照, 61例CD患者设为CD组, 其中男39例, 女22例, 年龄21-52(33.92±5.96); 78例UC患者设为UC组, 其中男43例, 女35例, 年龄21-53(34.19±6.23)岁. 纳入标准: 均符合《炎症性肠病诊断与治疗的共识意见(2018年)》相关诊断标准[6]; 经内镜、临床相关指标、组织病理检查确诊; 均为首次发病, 且疾病处于活性期. 排除标准: 自身免疫性疾病; 伴有肠穿孔、巨结肠、肠梗阻等其他肠道疾病; 妊娠期女性或哺乳期女性; 近1个月内接受免疫抑制、激素、抗生素等治疗; 血液系统疾病; 存在肠道或全身感染疾病者; 严重心脑血管疾病; 内分泌系统疾病; 恶性肿瘤; 既往存在肠道手术史. 并招募46例健康志愿者作为对照组, 年龄20-53(34.52±6.15)岁. 2组年龄、性别比较, 差异无统计学意义.
1.2.1 菌群改变、血清免疫球蛋白检测: 取2组受试者静脉血3 mL, 3000 rpm/min离心15 min后取上清液, 采用免疫比浊法检测免疫球蛋白G(immunoglobulin G, IgG)、IgM、IgA.
取2组受试者新鲜粪便0.5 g, 按照10倍稀释法将标本稀释至10-8, 取10 μL稀释标液接种, 采用需氧培养基培养肠球菌, 用厌氧培养基培养双歧杆菌、拟杆菌、乳酸杆菌, 培养2 d, 温度为37 ℃, 计菌落数. 用革兰染色, 并鉴定细菌, 计算每克粪便所含菌群数量(CFU/g), 结果以logN/g表示.
1.2.2 RT-PCR检测TLR2、TLR4、TLR9 mRNA水平: 取CD组、UC组患者明显病变结肠粘膜组织及对照组结肠粘膜组织, 利用RNA提取试剂盒(北京天根生化)抽提总RNA, 并将RNA在紫光分光光度计下检测浓度和纯度, 利用逆转录试剂盒(北京天根生化)合成cDNA, 在PCR仪上进行扩增反应, 反应体系共10 μL:5.0 μL SYBR Green Mix, 1.0 μL cDNA (50 ng/μL), 上、下游引物各0.5 μL, ddH2O 3.0 μL. 采用2-ΔΔCT法计算TLR2、TLR4、TLR9 mRNA水平. 引物由上海吉玛设计合成, 引物序列见表1.
| 基因 | 引物 |
| TLR2 mRNA | 上游: 5′-CTCCTGAAGCTGTTGCGTTAC-3′ |
| 下游: 5′-TACTTTACCCAGCTCGCTCACTAC-3′ | |
| TLR4 mRNA | 上游: 5′-CGCTTTCACCT CTGCCTTCACTACAG-3′ |
| 下游: 5′-ACACTACCACAATAACCTTCCGGCTC-3′ | |
| TLR9 mRNA | 上游: 5′-TGGTTACCTGGCAAGACGC-3′ |
| 下游: 5′-GGAAACTGGCACGCAAGAG -3′ | |
| β-actin | 上游: 5′-CATCCGTA AAGACCTCTATGCCAAC-3′ |
| 下游: 5′-ATGGAGCCACCGATCCACA-3′ |
1.2.3 蛋白免疫印迹法检测TLR2、TLR4、TLR9蛋白: 在CD组、UC组患者明显病变结肠粘膜组织及对照组结肠粘膜组织内加放射免疫沉淀法试剂(北京索莱宝)用于提取总蛋白, 离心后取上清液, 用二喹啉甲酸法测定蛋白浓度, 取1×蛋白上样缓冲液与蛋白样品混合, 高温煮沸5 min, 上样凝胶孔槽内分离处理样品, 80 V电泳30 min, 并转为120 V电泳120 min至溴酚蓝到分离胶底部, 电泳结束后迅速转膜, 封闭培养120 min, 加一抗TLR2、TLR4、TLR9、β-actin(英国Abcam)4 ℃过夜孵育, 次日与带标记的二抗(英国Abcam)37 ℃孵育120 min, 加发光试剂、显色、拍照, 用Image J分析目的蛋白表达.
1.2.4 疾病活动评估: 根据改良Mayo评分标准[7]评估UC受试者临床活动度, 其中11-12分为重度活动(n = 19)、6-10分为中度活动(n = 23), 3-5分为轻度活动(n = 36); 根据CD活动指数(CDAI)[8]评估CD受试者临床活动度, 总分600分, 其中>450分为重度活动(n = 15)、221-450分为中度活动(n = 19), 150-220分为轻度活动(n = 27).
1.2.5 观察指标: (1)比较2组菌群改变、血清免疫球蛋白; (2)比较2组结肠粘膜组织TLR2、TLR4、TLR9 mRNA和蛋白水平; (3)Pearson分析研究组结肠粘膜组织TLR2、TLR4、TLR9 mRNA与菌群改变、血清免疫球蛋白相关性; (4)比较CD、UC结肠粘膜组织TLR2、TLR4、TLR9 mRNA和蛋白表达; (5)比较CD、UC不同疾病活动TLR2、TLR4、TLR9mRNA和蛋白表达; (6)采用受试者工作特征曲线(receiver operating characteristic curve, ROC)分析结肠粘膜组织TLR2、TLR4、TLR9 mRNA对CD、UC的诊断价值.
统计学处理 采用统计学软件SPSS 24.0分析数据, 计数资料用n(%)表示, χ2检验, 计量资料用(mean±SD)表示, 多组间比较用单因素方差分析, 组内比较用LSD-t检验, 两组间比较采用独立样本t检验; 应用Pearson分析相关性; ROC分析结肠粘膜组织TLR2、TLR4、TLR9 mRNA对炎症性肠病的诊断价值. P<0.05为差异有统计学意义.
与对照组比较, 研究组双歧杆菌、乳酸杆菌、拟杆菌增加(P<0.05), 肠球菌、IgG、IgM、IgA显著降低(P<0.05). 见表2.
与对照组比较, 研究组TLR2、TLR4、TLR9 mRNA和蛋白水平显著增加(P<0.05). 见图1、表3.
TLR2 mRNA与双歧杆菌、乳酸杆菌、拟杆菌、IgM、IgA呈负相关(P<0.05), 与肠球菌呈正相关(P<0.05); TLR4 mRNA与双歧杆菌、乳酸杆菌、IgG、IgM呈负相关(P<0.05), 与肠球菌呈正相关(P<0.05); TLR9 mRNA与双歧杆菌、乳酸杆菌、拟杆菌、IgG、IgA呈负相关(P<0.05), 与肠球菌呈正相关(P<0.05). 见表4.
| 指标 | TLR2 mRNA | TLR4 mRNA | TLR9 mRNA | |||
| r | P | r | P | r | P | |
| 双歧杆菌 | -0.456 | <0.05 | -0.452 | <0.05 | -0.367 | <0.05 |
| 乳酸杆菌 | -0.411 | <0.05 | -0.485 | <0.05 | -0.452 | <0.05 |
| 肠球菌 | 0.526 | <0.05 | 0.437 | <0.05 | 0.388 | <0.05 |
| 拟杆菌 | -0.346 | <0.05 | -0.219 | >0.05 | -0.410 | <0.05 |
| IgG | -0.247 | >0.05 | -0.315 | <0.05 | -0.358 | <0.05 |
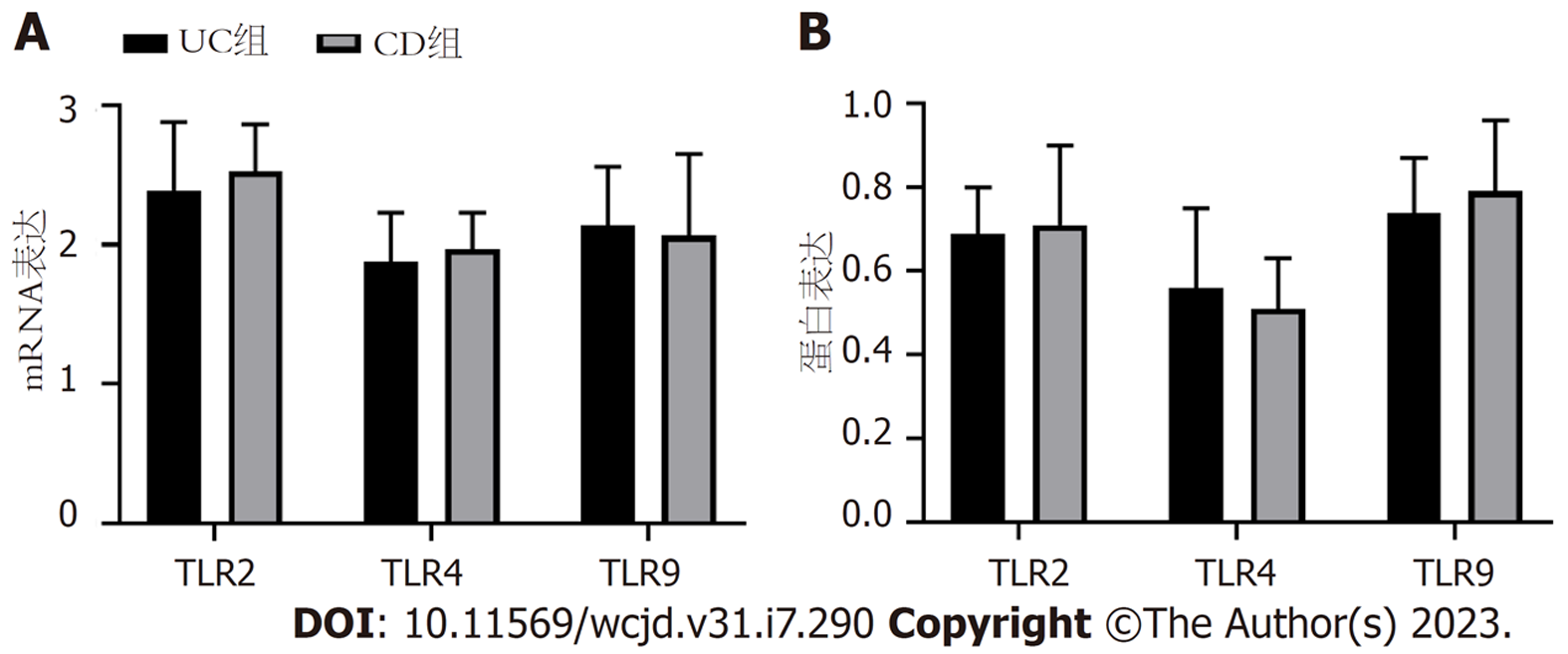
UC组、CD组TLR2、TLR4、TLR9 mRNA和蛋白水平比较, 差异无统计学意义. 见图2、表5.
| 组别 | 例数 | TLR2 mRNA | TLR4 mRNA | TLR9 mRNA | TLR2蛋白 | TLR4蛋白 | TLR9蛋白 |
| UC | 78 | 2.39±0.49 | 1.88±0.35 | 2.14±0.42 | 0.69±0.11 | 0.56±0.19 | 0.74±0.13 |
| CD | 61 | 2.53±0.34 | 1.97±0.26 | 2.07±0.58 | 0.71±0.19 | 0.51±0.12 | 0.79±0.17 |
| t | 1.901 | 1.678 | 0.825 | 0.778 | 1.794 | 1.965 | |
| P | 0.059 | 0.096 | 0.411 | 0.438 | 0.075 | 0.051 |
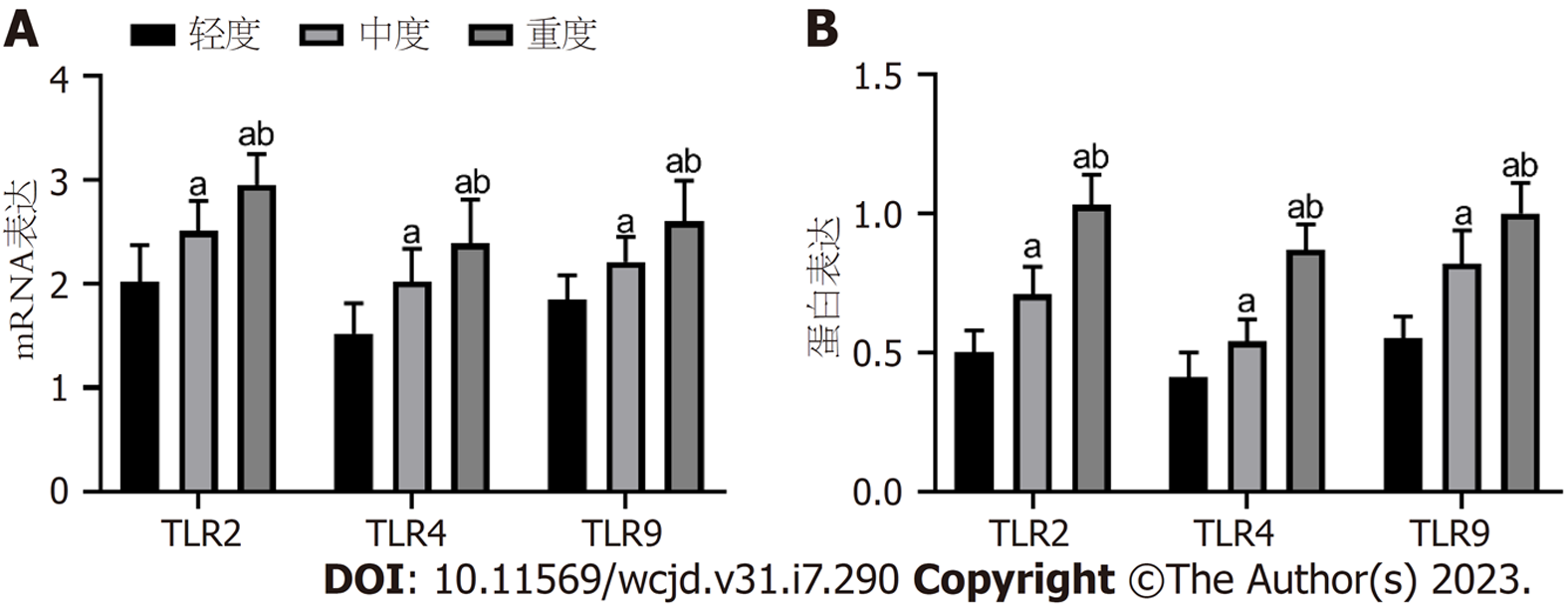
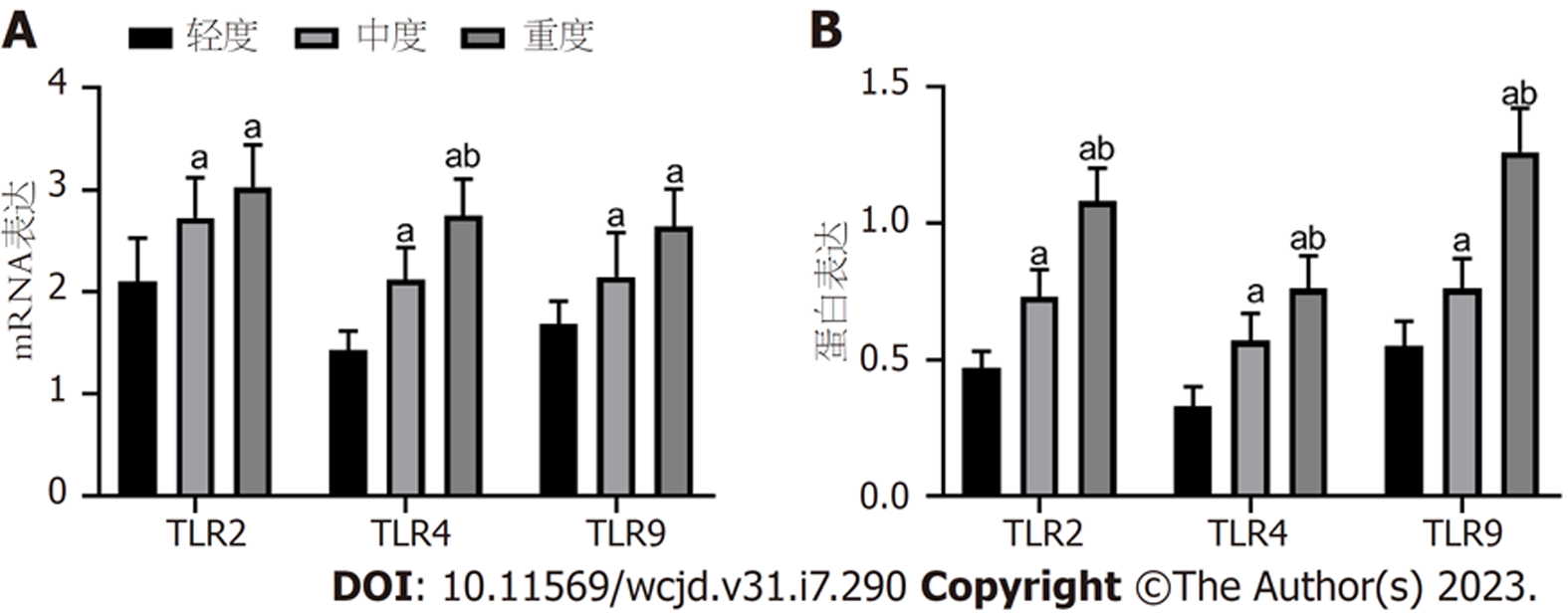
CD、UC不同疾病活动TLR2、TLR4、TLR9 mRNA和蛋白水平比较, 差异有统计学意义(P<0.05), 轻度<中度<重度(P<0.05). 见图3、图4、表6.
| 组别 | 例数 | TLR2 mRNA | TLR4 mRNA | TLR9 mRNA | TLR2蛋白 | TLR4蛋白 | TLR9蛋白 |
| UC组 | |||||||
| 轻度 | 36 | 2.02±0.35 | 1.52±0.29 | 1.85±0.23 | 0.50±0.08 | 0.41±0.09 | 0.55±0.08 |
| 中度 | 23 | 2.51±0.29a | 2.02±0.32a | 2.21±0.24a | 0.71±0.10a | 0.54±0.08a | 0.82±0.12a |
| 重度 | 19 | 2.95±0.30a | 2.39±0.42ab | 2.60±0.39a | 1.03±0.11ab | 0.87±0.09ab | 1.00±0.11ab |
| F | 54.226 | 45.056 | 45.850 | 198.613 | 173.988 | 135.010 | |
| P | <0.05 | <0.05 | <0.05 | <0.05 | <0.05 | <0.05 | |
| CD组 | |||||||
| 轻度 | 27 | 2.11±0.42 | 1.43±0.19 | 1.69±0.22 | 0.47±0.06 | 0.33±0.07 | 0.55±0.09 |
| 中度 | 19 | 2.73±0.39a | 2.12±0.32a | 2.15±0.43a | 0.73±0.10a | 0.57±0.10a | 0.76±0.11a |
| 重度 | 15 | 3.03±0.41ab | 2.75±0.36ab | 2.65±0.36ab | 1.08±0.12ab | 0.76±0.12ab | 1.26±0.16ab |
| F | 35.889 | 144.619 | 54.335 | 289.178 | 140.337 | 233.400 | |
| P | <0.05 | <0.05 | <0.05 | <0.05 | <0.05 | <0.05 |
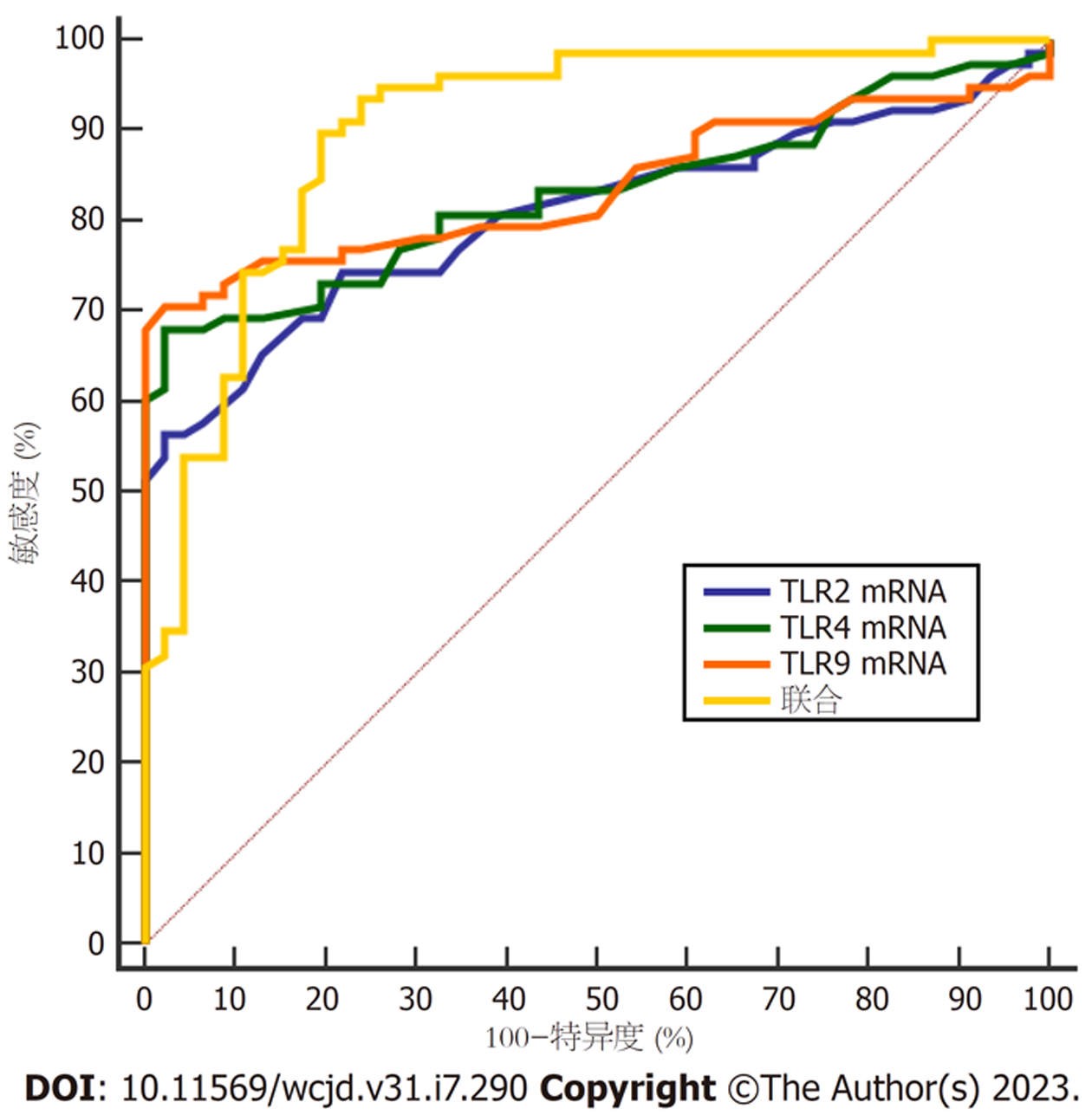
以78例UC患者为阳性样本, 46例健康志愿者为阴性样本, 绘制ROC结果显示, 结肠粘膜组织TLR2、TLR4、TLR9 mRNA水平单独诊断UC的AUC分别为0.695、0.809、0.740, 对以上各指标进行综合回归, 得到联合诊断UC的AUC为0.882. 见图5、表7.
| 指标 | AUC | 95%CI | Cut-off | P | 敏感度(%) | 特异度(%) |
| TLR2 mRNA | 0.695 | 0.687-0.716 | >1.78 | <0.05 | 62.82 | 76.09 |
| TLR4 mRNA | 0.809 | 0.782-0.825 | >1.62 | <0.05 | 76.92 | 84.78 |
| TLR9 mRNA | 0.740 | 0.721-0.753 | >1.55 | <0.05 | 65.38 | 82.61 |
| 联合 | 0.882 | 0.873-0.912 | <0.05 | 87.18 | 89.13 |
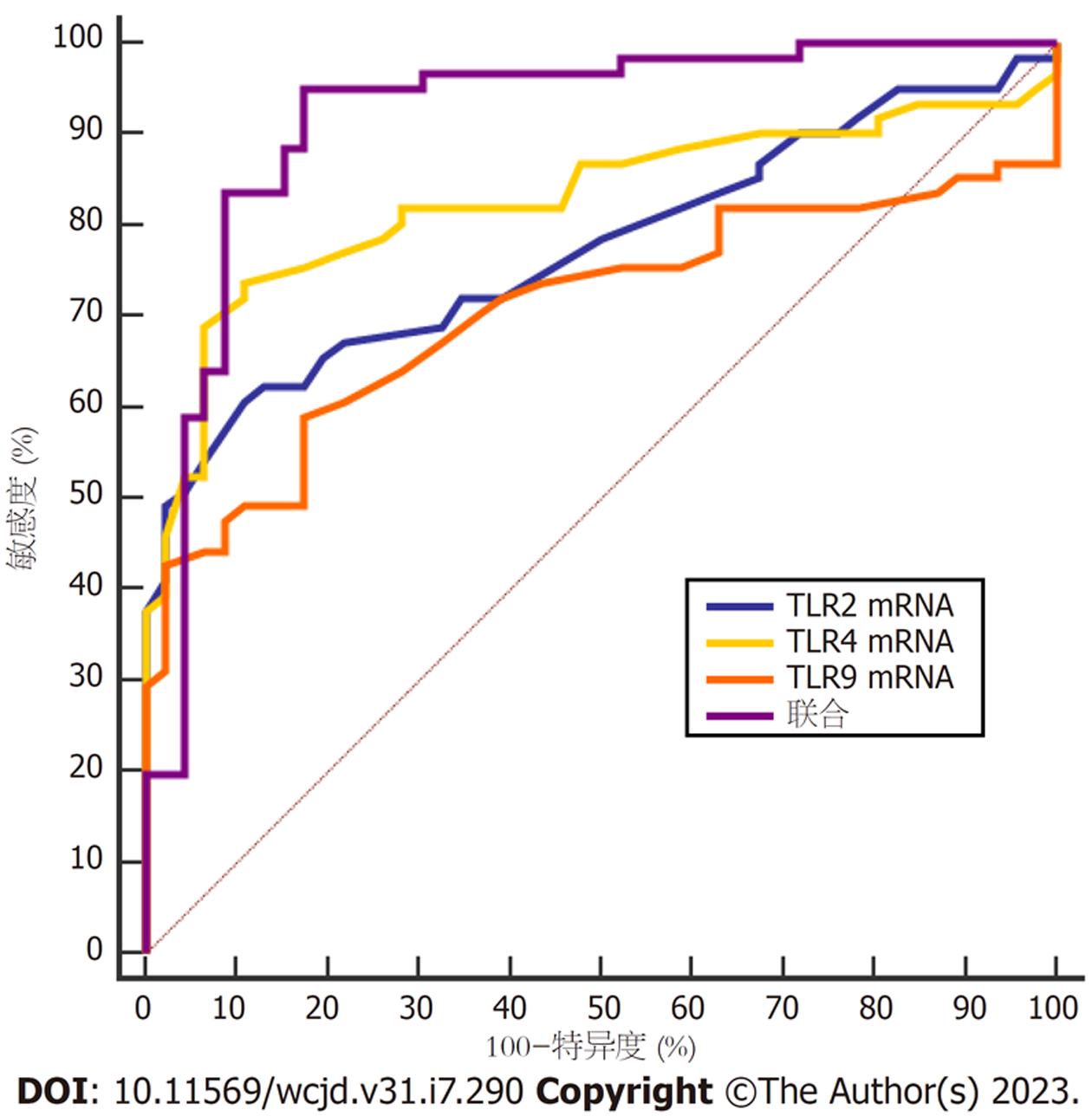
以61例CD患者为阳性样本, 46例健康志愿者为阴性样本, 绘制ROC曲线显示, 结肠粘膜组织TLR2、TLR4、TLR9 mRNA水平单独诊断UC的AUC分别为0.741、0.733、0.703, 对以上各指标进行综合回归, 得到联合诊断UC的AUC为0.894. 见图6、表8.
| 指标 | AUC | 95%CI | Cut-off | P | 敏感度(%) | 特异度(%) |
| TLR2 mRNA | 0.741 | 0.712-0.753 | >1.85 | <0.05 | 65.57 | 82.61 |
| TLR4 mRNA | 0.733 | 0.720-0.769 | >1.60 | <0.05 | 70.49 | 76.09 |
| TLR9 mRNA | 0.703 | 0.682-0.715 | >1.72 | <0.05 | 68.85 | 71.74 |
| 联合 | 0.894 | 0.886-0.921 | <0.05 | 85.25 | 93.48 |
目前研究普遍认为, 菌群改变、免疫系统受损与炎症性肠病发展密切相关, 正常情况下, 肠道菌群处于动态平衡, 利于肠道营养代谢、免疫调节、抵抗感染等[10]; 当人体抵抗力降低, 可引起肠道菌群异常, 破坏肠道免疫耐受性、激活机体免疫系统, 导致患者炎症免疫系统失常[11]. 而本研究发现, 研究组双歧杆菌、乳酸杆菌、拟杆菌高于对照组, 而肠球菌、IgG、IgM、IgA低于对照组, 这与何启卓等[12]研究相似, 提示菌群改变、免疫功能改变可能参与炎症性肠道发生发展.
TLRs是先天性免疫受体, 识别不同细菌、真菌、病毒等进而激活细胞内炎症因子, 从而诱导机体发生炎症反应[13]; TLRs还可诱导多个基因表达参与信号转导途径, 如核因子κB(nuclear factor kappa-B, NF-κB)、干扰素调节因子-3、c-Jun氨基末端激酶等[14]. 研究发现[15], TLRs能有效阻碍病原微生物入侵胃肠细胞, 且对细胞吞噬、凋亡、增殖等过程有影响. TLR2是TLRs家族成员, 可在肠粘膜细胞上表达, 并能识别脂蛋白、细胞壁酵母聚糖和脂磷壁酸, TLR2活化后可诱导NF-κB活化, 进而诱导细胞炎症因子、趋化因子表达[16,17]. 本研究发现, 在炎症性肠病患者肠粘膜组织内TLR2 mRNA和蛋白水平高于对照组, 故笔者认为, 炎症性肠病发生发展可能与TLR2变化有关. 本研究还发现, TLR2与菌群改变、血清免疫球蛋白负相关, 笔者推测可能是因为肠粘膜组织内TLR2表达增加, 可能影响组织发生炎症反应, 释放更多炎症因子和介质, 继而机体肠菌群改变及免疫功能改变.
TLR4是TLRs家族典型识别受体, 可在免疫细胞、胃肠道细胞等多种细胞内表达, 且对胃肠道细胞作用较复杂, 即可抵抗病原微生物又可维持共生菌的免疫耐受[18]. 相关研究发现, TLR4通过识别脂多糖, 并介导肠上皮细胞增殖、凋亡等, 低表达TLR4可减轻脂多糖刺激的肠上皮细胞凋亡和炎症反应[19,20]. TLR9也是TLRs家族成员, 在溃疡性结肠炎患者结肠粘膜中高表达, TLR9活化后可促进炎症因子生成, 诱导细胞免疫应答过程[21]. 但TLR9在炎症性肠病中的研究较少. 本研究发现, TLR4、TLR9在炎症性肠病组织中表达均上调, 且表现趋势与TLR2一致, 由此可见, TLR4、TLR9可能参与炎症性肠病发展. 究其原因, 机体抵抗力降低, 导致肠道内厌氧菌和需氧菌动态平衡破坏, 激活肠道组织炎症反应[22], 促进TLR4、TLR9水平增加; 此外, 免疫系统改变, 机体难以抵抗病原微生物入侵, 也可影响疾病发展. 本研究分析显示, UC、CD患者内TLR2、TLR4、TLR9表达无明显差异, 但各指标不同疾病活动比较, 差异有统计学意义(P<0.05), 轻度<中度<重度; 通过绘制ROC曲线, 发现结肠粘膜组织TLR2、TLR4、TLR9 mRNA水平联合诊断CD、UC优于单独诊断, 表明以上指标联合有助于提高临床炎症性肠病的诊断. 但本研究也存在不足之处, 关于TLR2、TLR4、TLR9与炎症性肠病具体作用机制有待进一步考究.
综上所述, TLR2、TLR4、TLR9在炎症性肠病患者结肠粘膜组织中表达上调, 并与菌群改变、血清免疫球蛋白密切有关, 可为临床诊断炎症性肠病提供数据支撑.
炎症性肠病是一种慢性肠道炎性疾病, 临床根据病理类型分为克罗恩病(Crohn's disease, CD)、溃疡性结肠炎(ulcerative colitis, UC). Toll样受体(toll-like receptor, TLRs)属I型跨膜蛋白, 在包括肠粘膜组织广泛表达, 能识别机体多种病原体, 且有10个成员在人体内表达, 如TLR2、TLR4、TLR9等. 有报道称, TLRs可介导参与炎症性肠病发生.
本研究尝试探究TLR2、TLR4、TLR9在炎症性肠病患者结肠粘膜组织中的表达, 并分析其与菌群改变、血清免疫球蛋白相关性, 旨在为临床研究炎症性肠病提供参考.
探究炎症性肠病患者结肠黏膜组织TLRs表达与菌群改变、血清免疫球蛋白的关系. 在炎症性肠病患者结肠粘膜组织内TLR2、TLR4、TLR9高表达, 并与菌群改变、血清免疫球蛋白显著相关, 且联合检测对炎症性肠病具有一定诊断效能.
选择2020-06/2022-06我院收治的139例炎症性肠病患者作为研究组, 其中CD患者61例、UC患者78例, 并招募46例健康志愿者作为对照组. 比较2组菌群改变、血清免疫球蛋白、TLR2、TLR4、TLR9 mRNA和蛋白水平, Pearson分析研究中各指标与菌群改变、血清免疫球蛋白相关性, 比较CD、UC不同发病状态结肠粘膜组织TLR2、TLR4、TLR9 mRNA和蛋白水平, ROC分析研究组各指标对CD、UC的诊断价值.
研究组双歧杆菌、乳酸杆菌、拟杆菌、TLR2、TLR4、TLR9 mRNA和蛋白水平较对照组高, 肠球菌、免疫球蛋白G(immunoglobulin G, IgG)、IgM、IgA较对照组高低(P<0.05); 研究组肠粘膜组织TLR2、TLR4、TLR9 mRNA与菌群改变、血清免疫球蛋白呈负相关; CD、UC不同发病状态TLR2、TLR4、TLR9 mRNA和蛋白水平比较, 差异有统计学意义(P<0.05), 轻度<中度<重度; CD、UC患者结肠粘膜组织TLR2、TLR4、TLR9 mRNA联合诊断优于单独诊断(P<0.05).
在炎症性肠病患者结肠粘膜组织内TLR2、TLR4、TLR9高表达, 并与菌群改变、血清免疫球蛋白显著相关, 且联合检测对炎症性肠病具有一定诊断效能.
TLR2、TLR4、TLR9在炎症性肠病患者结肠粘膜组织中表达上调, 并与菌群改变、血清免疫球蛋白密切有关, 可为临床诊断炎症性肠病提供数据支撑.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Xiao Q, Li X, Li Y, Wu Z, Xu C, Chen Z, He W. Biological drug and drug delivery-mediated immunotherapy. Acta Pharm Sin B. 2021;11:941-960. [PubMed] [DOI] |
| 2. | Liu D, Saikam V, Skrada KA, Merlin D, Iyer SS. Inflammatory bowel disease biomarkers. Med Res Rev. 2022;42:1856-1887. [PubMed] [DOI] |
| 3. | 李 瑶, 黄 金莉, 黄 娟, 李 华军. 肠道菌群与肠道屏障互作在炎症性肠病中的作用研究进展. 胃肠病学和肝病学杂志. 2021;30:10-15. [DOI] |
| 4. | Orlacchio A, Mazzone P. The Role of Toll-like Receptors (TLRs) Mediated Inflammation in Pancreatic Cancer Pathophysiology. Int J Mol Sci. 2021;22. [PubMed] [DOI] |
| 5. | Larabi A, Barnich N, Nguyen HTT. New insights into the interplay between autophagy, gut microbiota and inflammatory responses in IBD. Autophagy. 2020;16:38-51. [PubMed] [DOI] |
| 10. | Tanaka S, Nemoto Y, Takei Y, Morikawa R, Oshima S, Nagaishi T, Okamoto R, Tsuchiya K, Nakamura T, Stutte S, Watanabe M. High-fat diet-derived free fatty acids impair the intestinal immune system and increase sensitivity to intestinal epithelial damage. Biochem Biophys Res Commun. 2020;522:971-977. [PubMed] [DOI] |
| 12. | 何 启卓, 郭 彩霞. 溃疡性结肠炎与克罗恩病患者肠道优势菌群的特征及与发病关系的研究. 中国中西医结合消化杂志. 2019;27:844-849. [DOI] |
| 13. | Mehta P, Ray A, Mazumder S. TLRs in Mycobacterial Pathogenesis: Black and White or Shades of Gray. Curr Microbiol. 2021;78:2183-2193. [PubMed] [DOI] |
| 14. | Vidya MK, Kumar VG, Sejian V, Bagath M, Krishnan G, Bhatta R. Toll-like receptors: Significance, ligands, signaling pathways, and functions in mammals. Int Rev Immunol. 2018;37:20-36. [PubMed] [DOI] |
| 15. | Chang CW, Lee HC, Li LH, Chiang Chiau JS, Wang TE, Chuang WH, Chen MJ, Wang HY, Shih SC, Liu CY, Tsai TH, Chen YJ. Fecal Microbiota Transplantation Prevents Intestinal Injury, Upregulation of Toll-Like Receptors, and 5-Fluorouracil/Oxaliplatin-Induced Toxicity in Colorectal Cancer. Int J Mol Sci. 2020;21. [PubMed] [DOI] |
| 17. | Lu BL, Williams GM, Brimble MA. TLR2 agonists and their structure-activity relationships. Org Biomol Chem. 2020;18:5073-5094. [PubMed] [DOI] |