修回日期: 2022-12-03
接受日期: 2023-01-17
在线出版日期: 2023-02-28
慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)易引起上消化道出血, 本研究拟通过Logistic多因素回归模型分析COPD患者发生上消化道出血的影响因素, 并根据影响因素构建Logistic回归模型方程预测COPD患者发生上消化道出血的概率.
探讨COPD患者上消化道出血发生率及其影响因素.
随机选取2016-10/2021-10我院400例COPD患者, 其中240例作为建模组, 统计建模组患者上消化道出血发生率, 对比发生与未发生上消化道出血患者临床资料, 通过构建Logistic回归模型方程分析上消化道出血发生的影响因素, 以另160例作为验证组, 用于验证Logistic回归预测模型.
建模组240例COPD患者中上消化道出血发生率为19.58%(47/240); 出血患者年龄≥60岁者占比、COPD病情严重程度、病程、萎缩性胃炎者占比、消化道溃疡者占比、冠心病者占比、严重感染者占比、肺性脑病者占比、ALB占比均高于非出血患者, 差异有统计学意义(P<0.05); 年龄≥60岁、COPD病情Ⅲ级、病程≥4.3年、伴有萎缩性胃炎、消化道溃疡、冠心病、严重感染、肺性脑病、ALB水平均为COPD患者上消化道出血发生的独立危险因素(P<0.05); Logistic回归预测模型预测COPD患者上消化道出血的曲线下面积(area under the curve, AUC)为0.867(95%CI: 0.818-0.907), 预测敏感度为85.11%, 特异度为75.13%; 将Logistic回归预测模型应用于验证组160例COPD患者中, Hosmer-Lemeshow χ2 = 3.142(P = 0.514), AUC为0.900(95%CI: 0.855-0.935), 提示模型鉴别效度及校准度较好.
COPD患者上消化道出血发生率较高, 其发生与患者年龄、COPD病情和病程、萎缩性胃炎、消化道溃疡、冠心病、严重感染、肺性脑病、ALB升高等多方面因素有关, 通过建立Logistic回归预测模型对预测COPD患者上消化道出血发生风险具有良好的鉴别效度和校准度.
核心提要: 上消化道出血是慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)严重并发症之一, 可导致患者病情加重甚至恶化. COPD并发上消化道出血的发病机制较为复杂. 本研究重点探讨COPD患者上消化道出血发生率及其影响因素, 发现年龄、COPD病情及病程、萎缩性胃炎、消化道溃疡、冠心病、严重感染、肺性脑病、ALB浓度均为COPD患者上消化道出血发生的独立危险因素. 通过建立Logistic回归预测模型对预测COPD患者上消化道出血发生风险具有良好的鉴别效度和校准度.
引文著录: 余碧芸, 王辉, 林媛媛. 慢性阻塞性肺疾病患者上消化道出血发生率及其影响因素的Logistic回归分析. 世界华人消化杂志 2023; 31(4): 143-149
Revised: December 3, 2022
Accepted: January 17, 2023
Published online: February 28, 2023
Chronic obstructive pulmonary disease (COPD) can cause upper gastrointestinal bleeding. In this study we identified the risk factors for upper gastrointestinal bleeding in patients with COPD by logistic regression analysis and established a logistic regression equation to predict the probability of upper gastrointestinal bleeding in COPD patients.
To investigate the prevalence and risk factors of upper gastrointestinal bleeding in patients with COPD.
A total of 400 COPD patients treated at our hospital from October 2016 to October 2021 were selected, of which 240 were used for modeling. The prevalence of upper gastrointestinal bleeding in the modeling group was counted, the clinical data of patients with and without upper gastrointestinal bleeding were compared, and the factors influencing the occurrence of upper gastrointestinal bleeding were identified by logistic regression analysis. The rest 160 cases were included in a validation group to verify the performance of the logistic regression model developed.
Among the 240 COPD patients in the modeling group, the prevalence of upper gastrointestinal bleeding was 19.58% (47/240). The proportions of patients with coronary heart disease, severe infection, pulmonary encephalopathy, low ALB, and Helicobacter pylori infection were significantly higher in patients with upper gastrointestinal bleeding than in those without (P < 0.05). Age ≥ 60 years, COPD grade III, disease duration ≥ 4.3 years, gastritis, peptic ulcer, coronary heart disease, severe infection, pulmonary encephalopathy, and Helicobacter pylori infection were identified to be independent risk factors for upper gastrointestinal bleeding in COPD patients, while ALB elevation was a protective factor (P < 0.05). The area under the curve (AUC) of the logistic regression prediction model for predicting upper gastrointestinal bleeding in COPD patients was 0.867 (95% confidence interval [CI]: 0.818-0.907), with a sensitivity of 85.11% and specificity of 75.13%. When the logistic regression prediction model was applied to the validation group (160 COPD patients), the Hosmer-Lemeshow χ2 value was 3.142 (P = 0.514) and the AUC was 0.900 (95%CI: 0.855-0.935), suggesting good discriminant validity and calibration of the model.
The prevalence of upper gastrointestinal bleeding in COPD patients is relatively high, and its occurrence is related to many factors such as patient age, COPD severity and course, gastritis, peptic ulcer, coronary heart disease, severe infection, pulmonary encephalopathy, Helicobacter pylori infection, and elevated ALB. The logistic regression prediction model developed has good discriminant validity and calibration for predicting the risk of upper gastrointestinal bleeding in COPD patients.
- Citation: Yu BY, Wang H, Lin YY. Prevalence and risk factors of upper gastrointestinal bleeding in chronic obstructive pulmonary disease patients. Shijie Huaren Xiaohua Zazhi 2023; 31(4): 143-149
- URL: https://www.wjgnet.com/1009-3079/full/v31/i4/143.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v31.i4.143
慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)是临床最常见的慢性气流受限性疾病, 进入21世纪以来, 我国慢阻肺的发病率从8.2%增至13.6%-13.7%, 已成为我国重点防治的慢性呼吸系统疾病之一[1,2]. COPD以持续气流受限为主要特征, 伴随不同程度气道炎症反应, 其病情呈进行性、不可逆性进展, 患者可反复发生呼吸衰竭, 从而引发多种并发症[3]. 研究显示, 上消化道出血是COPD严重并发症之一, 上消化道出血可导致患者病情加重甚至恶化, 是导致COPD患者住院病死率升高的独立危险因素之一[4,5]. COPD并发上消化道出血的发病机制较为复杂, 国内针对本病的研究多集中在临床治疗方面[6,7], 针对并发消化道出血影响因素的研究较少, 导致其防治缺乏临床依据. 本研究重点探讨COPD患者上消化道出血发生率及其影响因素, 旨在为临床防治COPD患者上消化道出血提供参考. 报告如下.
经我院伦理委员会审批通过, 随机选取2016-10/2021-10我院400例COPD患者, 进行回顾性分析.
纳入标准: (1)参照《慢性阻塞性肺疾病基层诊疗指南(实践版·2018)》[8]诊断为COPD; (2)年龄18-80岁; (3)无老年痴呆、精神分裂症等精神疾病; (4)患者或家属知晓本研究, 已签署同意书. 排除标准: (1)临床资料不全者; (2)因胃部肿瘤、肝硬化等引起的消化道出血者; (3)严重心血管疾病、肝肾功能不全者; (4)非消化性溃疡患者; (5)妊娠期或哺乳期女性. 将其中随机选择240例作为建模组, 用于分析单因素、多因素及模型构建. 另160例作为验证组, 用于验证Logistic回归预测模型. 建模组与验证组在年龄、性别、出血者比例等一般资料数据的差异均无统计学意义, 具有可比性.
资料收集: 采用我院自制的临床资料调查问卷统计患者临床资料, 包括性别、年龄、COPD病程、COPD严重程度、基础疾病(萎缩性胃炎、消化道溃疡、冠心病)、严重感染、肺性脑病、右心衰、吸烟史、饮酒史、血小板计数(platelet count, PLT)、白蛋白(albumin, ALB)、职业、文化程度、居住地、居住方式. COPD严重程度[8]: Ⅰ级(轻度): 第1秒用力呼气容积(forced expiratory volume in first second, FEV1)与用力肺活量(forced vital capacity, FVC)比值FEV1/FVC<70%, FEV1占预计值百分比(FEV1%)≥80%; Ⅱ级(中度): FEV1/FVC<70%, 50%≤FEV1%<80%; Ⅲ级(重度): FEV1/FVC<70%, 30%≤FEV1%<50%; Ⅳ级(极重度): FEV1/FVC<70%, FEV1%<30%, 或FEV1%<50%且伴有慢性呼吸衰竭. 萎缩性胃炎、消化道溃疡根据胃镜检查结果判断, COPDⅢ级(重度)、肺性脑病、严重感染不用胃镜, 采用粪便检测. 冠心病诊断标准参照《中国心血管病风险评估和管理指南》[9]诊断, 一周内未服用抗凝药或抗血小板药. 严重感染: 临床肺部感染评分(clinical pulmonary infection score, CPIS)[10]分值10-12分. 肺性脑病: 动脉血二氧化碳分压明显升高, >7.3 kPa(55 mmHg), 伴有嗜睡、谵妄、昏迷等意识改变. 右心衰: 有肺心病, 同时伴有双下肢水肿. 吸烟史: 每天抽烟≥1支, 且连续吸烟6 mo以上. 饮酒史: 每日饮白酒≥2两或啤酒≥2瓶, 且连续饮酒一年以上. 并采集空腹静脉血3 mL, 采用OTA-400型全自动生化分析仪(沈阳万泰医疗设备有限责任公司)检测PLT、ALB水平. 统计COPD患者上消化道出血发生率, 上消化道出血定义: 大便隐血试验呈阳性, 排黑便和(或)呕血, 经胃镜检查确认为上消化道出血. 萎缩性胃炎或溃疡的病史通过查询既往病历获得, 均有胃镜报告支撑.
质量控制, 由经过培训的调查员对临床资料进行调查和收集, 对所有收集资料进行统一处理, 双人录入、核实.
统计学处理 数据处理采用SPSS 22.0软件, 计数资料以例数描述, 采用χ2检验, 等级资料以u表示, 采用Ridit检验. 计量资料均确认具备方差齐性且服从正态分布, 以平均数±标准差描述, 采用独立样本t检验. 通过Logistic进行多因素回归分析. 采用似然比卡方、Wald χ2、拟合优度检验评价Logistic回归模型. 模型的校准度采用Hosmer-Lemeshow χ2检验, P>0.05为校准度较好; 鉴别效度采用受试者工作特征(receiver operating characteristic, ROC)曲线进行验证, 获取曲线下面积(area under the curve, AUC), 以AUC>0.7为鉴别效度较好. P<0.05为差异有统计学意义.
建模组240例COPD患者中, 发生上消化道出血47例, 发生率为19.58%(47/240), 其中呕血15例, 黑便20例, 血便8例, 黑便和呕血4例. 胃镜检查显示出血病因均为消化性溃疡.
单因素分析可知, 出血患者年龄、COPD病情严重程度及病程、萎缩性胃炎、消化道溃疡、冠心病、严重感染、肺性脑病、ALB与非出血患者比较, 差异有统计学意义(P<0.05). 见表1.
| 因素 | 出血患者(n = 47) | 非出血患者(n = 193) | χ2/u/t | P |
| 性别 | 0.516 | 0.642 | ||
| 男 | 27(57.45) | 118(61.14) | ||
| 女 | 20(42.55) | 75(38.86) | ||
| 年龄(岁) | 4.043 | 0.044 | ||
| <60岁 | 15(31.91) | 93(48.19) | ||
| ≥60岁 | 32(68.09) | 100(51.81) | ||
| COPD病程(年) | 5.79±1.32 | 3.87±1.06 | 10.247 | <0.001 |
| COPD严重程度 | 2.796 | 0.005 | ||
| Ⅰ | 5(10.64) | 61(31.61) | ||
| Ⅱ | 32(68.09) | 112(58.03) | ||
| Ⅲ | 10(21.28) | 20(10.36) | ||
| 基础疾病 | ||||
| 萎缩性胃炎 | 25(53.19) | 51(26.42) | 12.514 | <0.001 |
| 消化道溃疡 | 14(29.79) | 20(10.36) | 11.728 | 0.001 |
| 冠心病 | 19(40.43) | 38(19.69) | 8.974 | 0.003 |
| 严重感染 | 20(42.55) | 30(15.54) | 16.717 | <0.001 |
| 肺性脑病 | 25(53.19) | 59(30.57) | 8.502 | 0.004 |
| 右心衰 | 27(57.45) | 114(59.07) | 0.041 | 0.840 |
| 吸烟史 | 24(51.06) | 105(54.40) | 0.170 | 0.680 |
| 饮酒史 | 15(31.91) | 82(42.49) | 1.754 | 0.185 |
| PLT(×109/L) | 87.25±21.69 | 85.43±20.89 | 0.532 | 0.596 |
| ALB(g/L) | 27.63±5.27 | 33.26±6.07 | 5.843 | <0.001 |
| 职业 | 2.238 | 0.135 | ||
| 脑力劳动 | 31(65.96) | 104(53.89) | ||
| 体力劳动 | 16(34.04) | 89(46.11) | ||
| 文化程度 | 0.634 | 0.526 | ||
| 初中及以下 | 28(59.57) | 104(53.89) | ||
| 高中或中专 | 15(31.91) | 69(35.75) | ||
| 大专及以上 | 4(8.51) | 20(10.36) | ||
| 居住地 | 0.750 | 0.386 | ||
| 城镇 | 31(65.96) | 114(59.07) | ||
| 农村 | 16(34.04) | 79(40.93) | ||
| 居住方式 | 0.125 | 0.724 | ||
| 独居 | 11(23.40) | 50(25.91) | ||
| 非独居 | 36(76.60) | 143(74.09) |
以建模组COPD患者是否发生消化道出血作为因变量(未发生 = 0, 发生 = 1), 单因素分析差异有统计学意义的因素(年龄、COPD病情及病程、萎缩性胃炎、消化道溃疡、冠心病、严重感染、肺性脑病、ALB)作为自变量(赋值方法见表2), 构建Logistic回归方程, 结果显示, 年龄、COPD病情及病程、萎缩性胃炎、消化道溃疡、冠心病、严重感染、肺性脑病、ALB浓度均为COPD患者上消化道出血发生的独立危险因素(P<0.05). 见表3.
| 自变量 | 赋值方法 |
| 年龄 | <60岁 = 1, ≥60岁 = 2 |
| COPD病程 | <平均值 = 1, ≥平均值 = 2 |
| COPD病情 | Ⅰ级 = 1, Ⅱ级 = 2, Ⅲ级 = 3 |
| 萎缩性胃炎 | 无 = 0, 有 = 1 |
| 消化道溃疡 | 无 = 0, 有 = 1 |
| 冠心病 | 无 = 0, 有 = 1 |
| 严重感染 | 无 = 0, 有 = 1 |
| 肺性脑病 | 无 = 0, 有 = 1 |
| ALB | <平均值 = 1, ≥平均值 = 2 |
| 因素 | β | S.E. | Wald χ2 | OR | 95%CI | P |
| 年龄 | 2.786 | 0.452 | 37.982 | 16.210 | 12.874-21.363 | <0.001 |
| COPD病程 | 2.954 | 0.444 | 44.279 | 19.192 | 14.333-27.695 | <0.001 |
| COPD病情 | 2.836 | 0.439 | 41.742 | 17.052 | 15.941-30.122 | <0.001 |
| 萎缩性胃炎 | 2.951 | 0.415 | 50.566 | 19.126 | 14.236-34.852 | <0.001 |
| 消化道溃疡 | 2.939 | 0.498 | 34.835 | 18.902 | 14.963-35.872 | <0.001 |
| 冠心病 | 3.059 | 0.454 | 45.408 | 21.313 | 15.069-32.841 | <0.001 |
| 严重感染 | 2.629 | 0.421 | 38.986 | 13.856 | 12.119-28.631 | <0.001 |
| 肺性脑病 | 2.937 | 0.504 | 33.967 | 18.866 | 13.526-26.314 | <0.001 |
| ALB | -0.935 | 0.201 | 21.618 | 0.393 | 0.274-0.563 | <0.001 |
似然比卡方 = 184.31, DF = 8, P<0.001, 提示模型建立具有统计学意义. Wald χ2 = 115.27, DF = 9, P<0.001, 提示模型构建有效. 采用Hosmer-Lemeshow拟合优度检验显示, χ2 = 9.237, DF = 10, P = 0.847, 提示模型拟合效果较好.
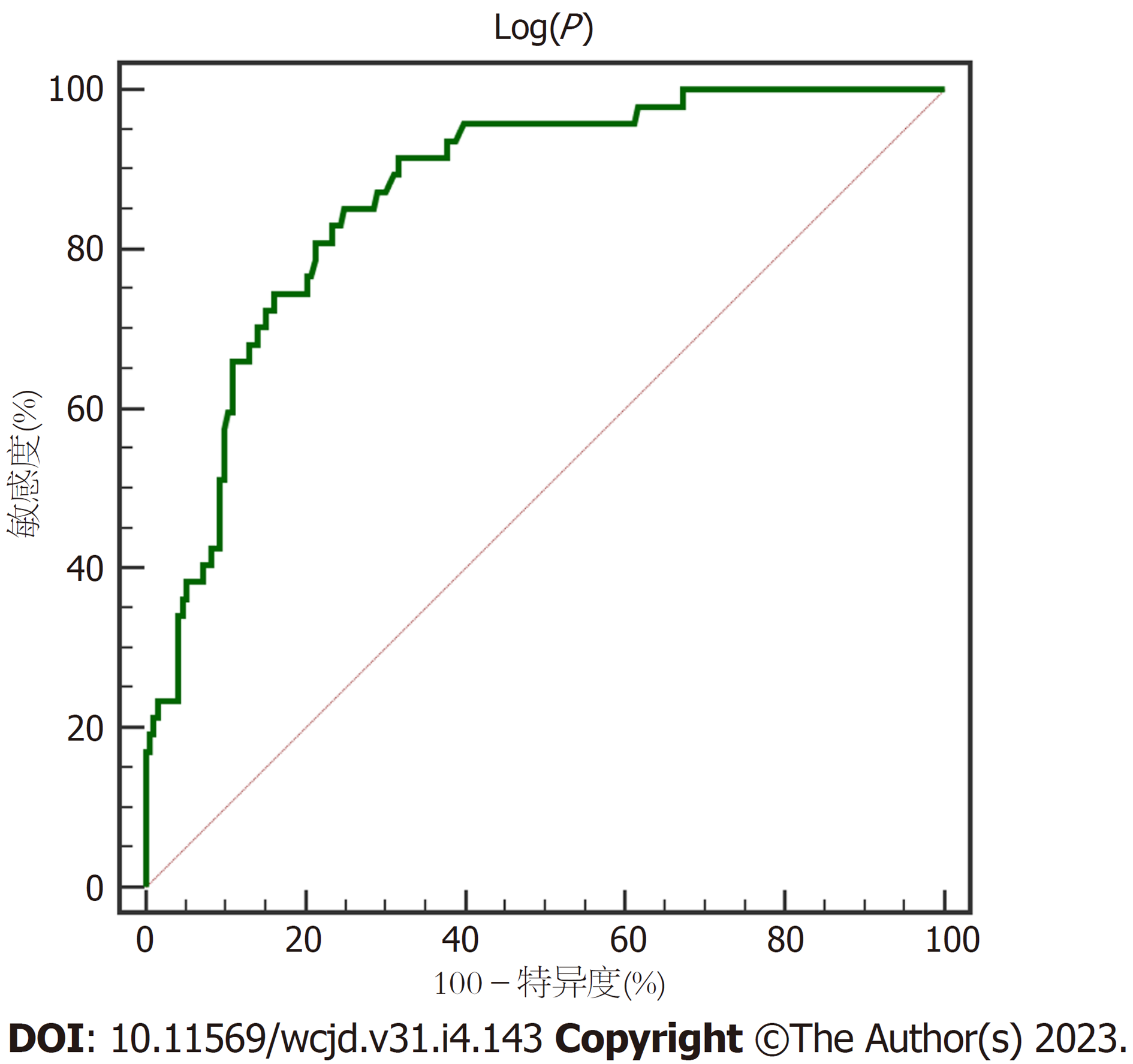
采用Logistic回归模型统计分析数据集, 得到COPD患者上消化道出血发生的预测概率P. 根据预测值和真实值绘制ROC曲线, AUC为0.867(95%CI: 0.818-0.907), 预测敏感度为85.11%, 特异度为75.13%. 见图1.
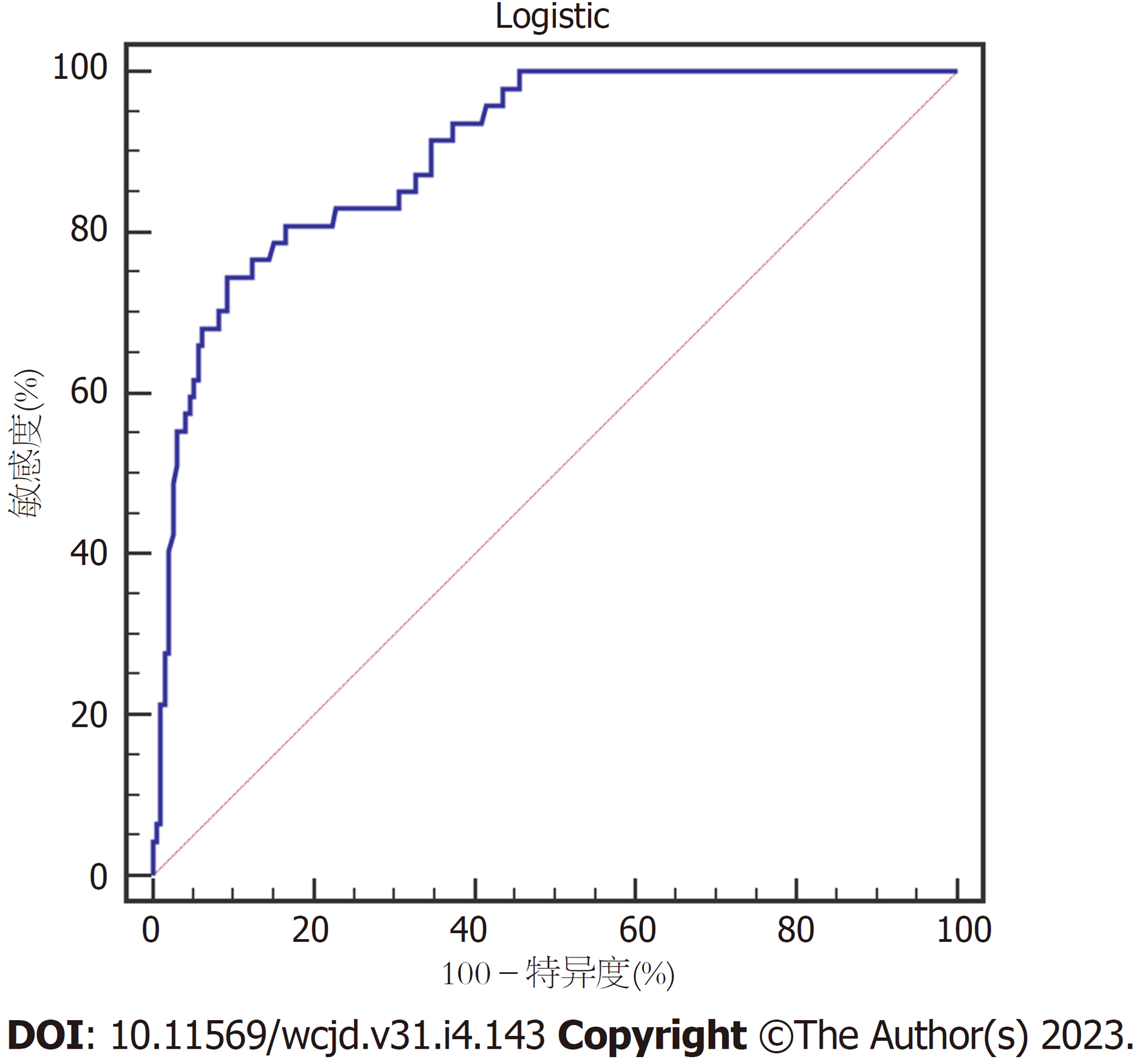
将上述建立的Logistic回归预测模型应用于验证组160例COPD患者中, 采用Hosmer-Lemeshow χ2检验及ROC曲线炎症预测模型的鉴别效度及校准度, 其中Hosmer-Lemeshow χ2 = 3.142(P = 0.514), ROC曲线AUC为0.900(95%CI: 0.855-0.935), 提示模型鉴别效度及校准度较好. 见图2.
COPD是一种可导致呼吸困难的肺部疾病, 研究显示, COPD处于急性加重期呼吸衰竭时, 机体缺氧状态严重, 可导致胃壁血管收缩, 损伤胃黏膜, 从而增加消化道出血风险[11]. 既往研究显示, COPD呼吸衰竭引发上消化道出血的概率约为8%-22%[12]. 本研究结果显示, 建模组240例COPD患者中上消化道出血发生率为19.58%, 在上述报道数据范围内, 进一步说明COPD患者上消化道出血发生率较高, 应给予足够重视.
本研究通过多因素分析, 发现年龄≥60岁是COPD发生上消化道出血的独立危险因素. 分析其原因在于, 老年患者胃黏膜发生退行性改变, 导致胃肠道屏障功能减弱, 且多伴有心肺等基础疾病, 最终导致上消化道出血风险增加[13]. 且有研究显示, 高龄COPD更易发生上消化道出血[14]. 支持本研究结果结论. 由于老年人群体质较弱, 且COPD会进一步降低患者体质, 当并发上消化道出血时会导致器官衰竭或多器官功能不全, 进一步加重病情, 增加病死率[15], 因此对于老年COPD患者应重点加强上消化道出血的预防. 本研究结果中, COPD病情及病程均为COPD患者上消化道出血发生的独立危险因素. 这是因为COPD病情越严重, 其急性发作期对胃黏膜的损伤越严重, 而病程越长, 对患者胃黏膜损伤的作用越明显, 从而增加上消化道出血发生率. 本研究发现, 合并萎缩性胃炎、消化道溃疡的COPD患者发生上消化道出血的概率明显增加, 其原因在于萎缩性胃炎、消化道溃疡均会胃酸分泌异常增加, 而胃酸过多是导致胃黏膜损伤的重要因素[16,17], 最终会增加消化道出血发生风险. 由此可见, 通过抑制胃酸分泌可能是降低COPD患者上消化道出血发生风险的有效途径. 冠心病、严重感染、肺性脑病也是COPD患者上消化道出血发生的独立危险因素, 其原因在于冠心病需长期服用阿司匹林治疗, 会对胃肠道产生强烈刺激作用, 易引起上消化道出血[18]. 而严重感染可引起血液中内毒素含量增加, 导致毛细血管内皮细胞损伤, 进而引起胃部血管功能受损, 引发出血、糜烂[19]. 而肺性脑病可引发低渗血症、上消化道出血等一系列并发症[20]. 相关研究显示[21], 凝血功能紊乱是肝硬化门静脉高压患者发生上消化道出血的因素, 表现为ALB明显降低. 本研究结果显示, ALB为COPD患者上消化道出血的风险因素, 这是因为ALB降低提示凝血功能紊乱加重, 可加重胃壁血管损伤, 增加出血发生风险.
此外, 本研究创新性采用Hosmer-Lemeshow拟合优度检验Logistic回归预测模型预测COPD患者上消化道出血的价值, 显示其拟合效果较好, 当Log(P) = 3.24时, 其预测敏感度为85.11%, 特异度为75.13%. 将上述Logistic回归预测模型应用于验证组160例COPD患者中, 通过Hosmer-Lemeshow χ2和ROC曲线验证可知, 其预测AUC为0.900, 提示模型鉴别效度及校准度较好, 可作为临床初步评估COPD患者发生上消化道出血的参考依据, 对预防上消化道出血的发生具有一定的指导作用.
综上可知, COPD患者上消化道出血的发生受患者年龄、COPD病情及病程等多方面因素影响, 通过建立Logistic回归预测模型对预测COPD患者上消化道出血发生风险具有较高的灵敏度和特异性, 可为临床预防上消化道出血提供参考依据.
上消化道出血是慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)严重并发症之一, 是导致COPD患者住院病死率升高的独立危险因素之一. COPD并发上消化道出血的发病机制较为复杂, 国内研究较少, 导致其防治缺乏临床依据.
本研究重点探讨COPD患者上消化道出血发生率及其影响因素, 旨在为临床防治COPD患者上消化道出血提供参考.
探讨COPD患者上消化道出血发生率及其影响因素.
随机选取2016-10/2021-10我院400例COPD患者, 其中240例作为建模组, 统计建模组患者上消化道出血发生率, 对比发生与未发生上消化道出血患者临床资料, 通过构建Logistic回归模型方程分析上消化道出血发生的影响因素,采用似然比卡方、Wald χ2、拟合优度检验评价Logistic回归模型. 模型的校准度采用Hosmer-Lemeshow χ2检验, P>0.05为校准度较好; 鉴别效度采用受试者工作特征(receiver operating characteristic, ROC)曲线进行验证, 获取曲线下面积(area under the curve, AUC), 以AUC>0.7为鉴别效度较好. P<0.05为差异有统计学意义.
建模组240例COPD患者中上消化道出血发生率为19.58%(47/240); 年龄≥60岁、COPD病情Ⅲ级、病程≥4.3年、伴有萎缩性胃炎、消化道溃疡、冠心病、严重感染、肺性脑病、ALB水平均为COPD患者上消化道出血发生的独立危险因素(P<0.05); Logistic回归预测模型预测COPD患者上消化道出血的曲线下面积(area under the curve, AUC)为0.867(95%CI: 0.818-0.907), 预测敏感度为85.11%, 特异度为75.13%; 将Logistic回归预测模型应用于验证组160例COPD患者中, Hosmer-Lemeshow χ2 = 3.142(P = 0.514), AUC为0.900(95%CI: 0.855-0.935).
年龄、COPD病情及病程、萎缩性胃炎、消化道溃疡、冠心病、严重感染、肺性脑病、ALB浓度均为COPD患者上消化道出血发生的独立危险因素. 通过建立Logistic回归预测模型对预测COPD患者上消化道出血发生风险具有良好的鉴别效度和校准度.
通过建立Logistic回归预测模型对预测COPD患者上消化道出血发生风险从临床和实验证明是有效的, 临床医生应特别注意高龄、COPD病情严重及病程长、合并萎缩性胃炎、消化道溃疡、冠心病、严重感染、肺性脑病、ALB浓度高的COPD患者容易发生上消化道出血, 本研究设计合理, 数据详实, 值得推广继承和研究. Logistic回归预测模型的建立对预防上消化道出血的发生具有一定的指导作用.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B, B
C级 (良好): 0
D级 (一般): 0
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 3. | Ritchie AI, Wedzicha JA. Definition, Causes, Pathogenesis, and Consequences of Chronic Obstructive Pulmonary Disease Exacerbations. Clin Chest Med. 2020;41:421-438. [PubMed] [DOI] |
| 5. | Huang KW, Kuan YC, Chi NF, Huang YH, Luo JC, Chien LN. Chronic obstructive pulmonary disease is associated with increased recurrent peptic ulcer bleeding risk. Eur J Intern Med. 2017;37:75-82. [PubMed] [DOI] |
| 8. | 中华医学会; 中华医学会杂志社; 中华医学会全科医学分会; 中华医学会呼吸病学分会慢阻肺学组; 中华医学会《中华全科医师杂志》编辑委员会; 呼吸系统疾病基层诊疗指南编写专家组. 慢性阻塞性肺疾病基层诊疗指南(实践版·2018). 中华全科医师杂志. 2018;17:871-877. [DOI] |
| 10. | Wang Y, Zhang S, Li L, Xie J. The usefulness of serum procalcitonin, C-reactive protein, soluble triggering receptor expressed on myeloid cells 1 and Clinical Pulmonary Infection Score for evaluation of severity and prognosis of community-acquired pneumonia in elderly patients. Arch Gerontol Geriatr. 2019;80:53-57. [PubMed] [DOI] |
| 12. | Miilunpohja S, Kärkkäinen J, Hartikainen J, Jyrkkä J, Rantanen T, Paajanen H. Need of Emergency Surgery in Elderly Patients with Upper Gastrointestinal Bleeding: Survival Analysis during 2009-2015. Dig Surg. 2019;36:20-26. [PubMed] [DOI] |
| 13. | 何 红见, 董 顺宝, 邵 玉东, 杨 川江, 张 洪艳, 崔 逊进, 杨 粟, 张 峻凡, 陈 晓. 老年性上消化道出血临床分析. 临床消化病杂志. 2020;32:367-370. [DOI] |
| 16. | Patel V, Nicastro J. Upper Gastrointestinal Bleeding. Clin Colon Rectal Surg. 2020;33:42-44. [PubMed] [DOI] |
| 17. | Wang JX, Cao YP, Su P, He W, Li XP, Zhu YM. Serum gastrin-17 concentration for prediction of upper gastrointestinal tract bleeding risk among peptic ulcer patients. World J Clin Cases. 2021;9:10948-10955. [PubMed] [DOI] |
| 18. | 敖 俪元. 肠溶阿司匹林治疗冠心病的临床疗效及其诱发上消化道出血的相关因素分析. 心血管病防治知识(学术版). 2020;10:26-28. [DOI] |
| 20. | Gupta H, Alrohimi A, Nathoo N, Nowacki T, Siddiqi ZA. Posterior Reversible Encephalopathy Syndrome Due to Chronic Obstructive Pulmonary Disease. Can J Neurol Sci. 2020;47:569-571. [PubMed] [DOI] |