修回日期: 2023-10-27
接受日期: 2023-11-01
在线出版日期: 2023-11-08
肝纤维化是各种慢性肝病的关键阶段, 其发生发展与肠道微生物菌群失调密切相关. 在治疗方面, 目前尚缺乏理想的化学药物, 然而中药在该领域显示出独特的临床疗效. 近年来中医药在肠道菌群调节方面的研究备受学术界关注, 中药复方抗肝纤维化有效成分的首要作用靶点可能是肠道菌群, 或者通过肠道菌群媒介、菌群特征性重构发挥生物学效应. "肠肝轴"视角下, 中医药通过"肝脾同治"调节肠道菌群, 与抗肝纤维化紧密相连. 本文立足"肠肝轴", 以调和肝脾为落脚点, 讨论中药及其活性成分通过调节肠道菌群从而发挥其抗肝纤维化作用, 为中医药抗肝纤维化提供新的研究视角.
核心提要: 从"肠肝轴"、"肝脾理论"以及"肝肠同治"等相关理论出发, 探讨中药及其活性成分如何通过调节肠道菌群来发挥其抗肝纤维化作用, 可能为中医药抗肝纤维化提供新的研究视角.
引文著录: 吕生霞, 王章程, 朱颖, 贾玲娟, 朱梦, 陶凌辉, 王一科, 朱飞叶, 张永生. 基于肠道菌群的视角探讨中医药治疗肝纤维化. 世界华人消化杂志 2023; 31(21): 889-895
Revised: October 27, 2023
Accepted: November 1, 2023
Published online: November 8, 2023
Liver fibrosis is the key stage of various chronic liver diseases, and its occurrence and development are closely related to the imbalance of the gut microbiota. In terms of treatment, there is still a lack of ideal chemical drugs, but traditional Chinese medicine has shown unique clinical efficacy in the treatment of hepatic fibrosis. In recent years, research on the regulation of the gut microbiota by traditional Chinese medicine has attracted widespread attention in the academic community. The primary target of the active ingredients of traditional Chinese medicine compound in hepatic fibrosis may be the gut microbiota, or they exert biological effects through the intestinal flora medium and the characteristic reconstruction of the gut microbiota. From the perspective of the "gut-liver axis", the therapetuic effect of traditional Chinese medicine on liver fibrosis is closely connected with regulating the intestinal flora and "treating the liver and spleen together". Based on the viewpoint of the gut-liver axis, this paper discusses the anti-hepatic fibrosis effects of traditional Chinese medicine and its active ingredients by regulating the gut microbiota, with an aim to provide a new research perspective for the therapetuic effect of traditional Chinese medicine on hepatic fibrosis.
- Citation: Lv SX, Wang ZC, Zhu Y, Jia LJ, Zhu M, Tao LH, Wang YK, Zhu FY, Zhang YS. Discussion on treatment of liver fibrosis with traditional Chinese medicine from the perspective of gut microbiota. Shijie Huaren Xiaohua Zazhi 2023; 31(21): 889-895
- URL: https://www.wjgnet.com/1009-3079/full/v31/i21/889.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v31.i21.889
肝纤维化是各类致病因素引起肝脏发生损伤-修复反应的结果之一, 其进程与肝星状细胞(hepatic stellate cell, HSC)的激活及其平滑肌肌动蛋白α(smooth muscle alpha actin, α-SMA)表型转变密切相关, 激活的HSC分泌胶原为主要成分的细胞外基质(extra cellular matrix, ECM), 导致ECM沉积与降解衡, 最终造成胶原含量增多, 而其病理过程迁延不愈, 久之则可以发展成为肝硬化, 甚至肝癌[1].我国是慢性肝病高发的国家之一, 有超过700万的慢性肝病相关的肝硬化患者[2], 除了肝移植外, 目前尚无理想的治疗方法[3,4]. 早期肝硬化(微癥结)[5]阶段能够在祛除致病因子、得到有效治疗后获得一定程度的缓解和逆转, 但其进程一旦到了肝硬化阶段则无法实现有效逆转, 所以及早实施针对性的干预是慢性肝病肝纤维化治疗的关键[6]. 根据中华医学会2019年发布的《肝纤维化诊断及治疗共识》[7], 目前缺乏被广泛认可的有效抗肝纤维化化学药物或生物制剂, 而中医药在抗肝纤维化治疗方面展现了独特的疗效.
肠道菌群平衡是维持人体健康的重要保障, 其生态失调会导致多种疾病的发生. 大量研究证实, 肝纤维化患者普遍存在肠道菌群结构和种群比例的异常变化, 这种肠道菌群失调不仅与肝纤维化的发生有关, 也会加剧疾病的进展[8,9]. 中医学认为, 肝脏疏泄功能障碍和脾胃运化功能减退是肝纤维化的关键病机之一. 本文基于中医"调和肝脾"的理论, 立足于"肠肝轴"视角, 以调节肠道菌群为切入点, 深入探讨中医调理肝脾、肝肠同治的方法对预防和治疗肝纤维化的积极作用, 这将为中西医结合治疗肝纤维化提供新思路.
肠道菌群是指定居在宿主肠道内的微生物群落的总称, 近年来成为微生物学、医学、基因组学等领域研究热点. 人体内微生物总数达1万亿(包括50个细菌门和约100-1000个细菌物种), 是人体细胞的10倍之多, 编码的基因数比人体基因组多100倍[10], 被认为是人体内一个"沉默的器官". 研究显示[11], 整个胃肠道被大量具有不同功能的共生体定殖, 在健康和疾病中发挥着重要作用. 肠道微生物群动态变化, 参与免疫、代谢、内分泌和神经调节, 对身体和心理健康影响显著. 宿主与肠道菌群相互作用, 也同样在健康和疾病发展中具有重大意义[12,13].
肝脏和肠道在胚胎发育中源自同一胚层, 它们之间存在着多种解剖和功能上的联系. 自从1998年Marshall提出"肠肝轴"的概念后, 关于肠道与肝脏疾病关系的研究日益受到学术界的关注. 在生理学上, 肠道与肝脏起源于共同的胚胎组织, 即前肠; 在人体解剖学上, 肠道和肝脏通过门脉系统紧密连接在一起. 肝脏接收的血液约70%来自门静脉系统, 其中包含来自肠道的营养物质和代谢产物, 同时这些物质也包括食物抗原和肠道细菌产物等有害物质, 可激活肝脏的固有免疫系统. 肝脏不仅拥有内分泌、免疫应答和代谢功能, 还能通过分泌胆汁并参与肝肠循环, 对肠道产生作用[14]. 此外, 菌群平衡和肠屏障的稳定对于维持肠道和人体的代谢与免疫功能至关重要.
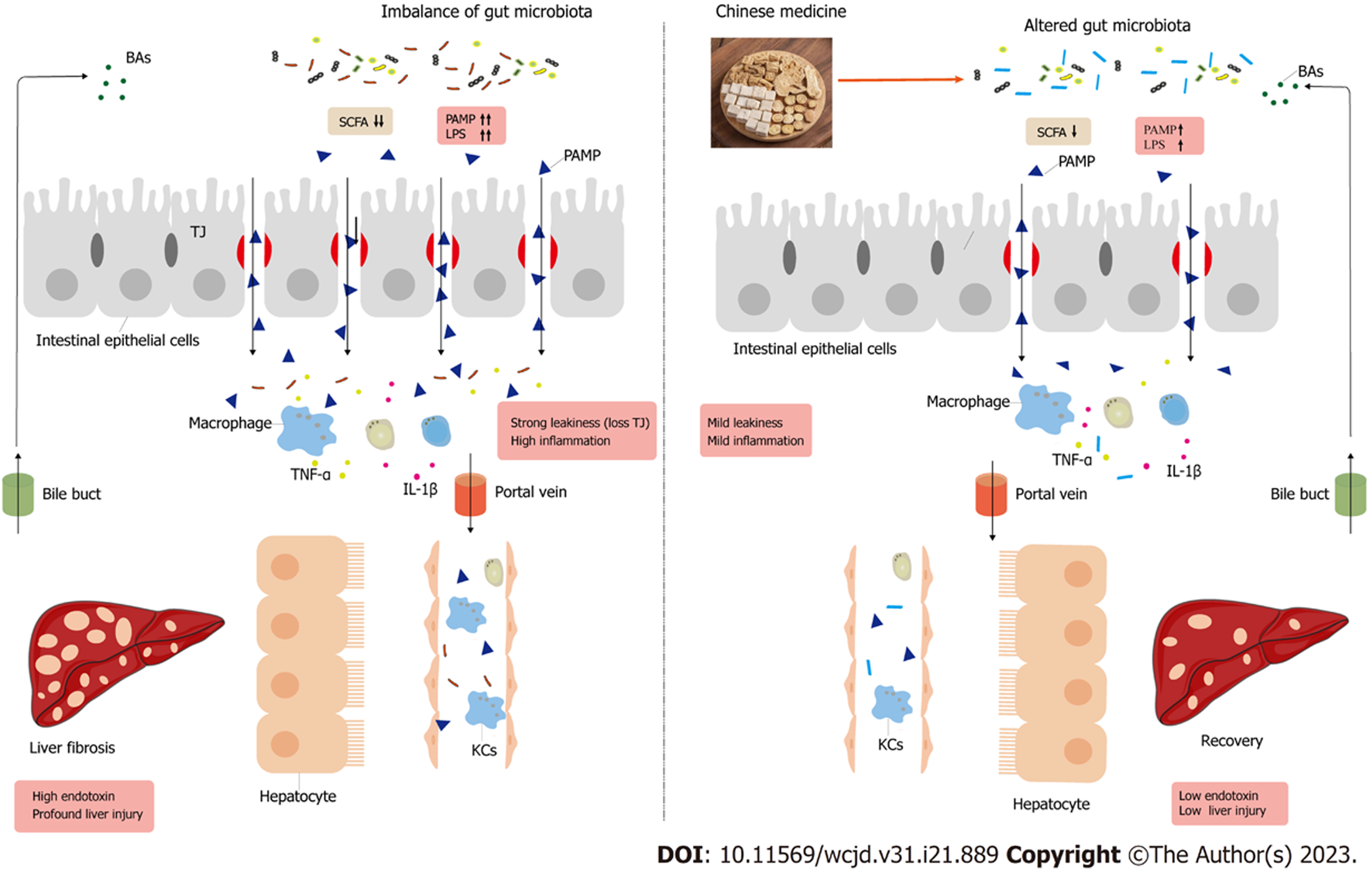
最近研究指出[15], 肝纤维化的发生和发展与肠道屏障功能密切相关. 一方面, 肠道受到多种因素引起的损伤, 导致肠道通透性增加和肠屏障功能障碍, 肠内细菌及其代谢产物(如脂多糖)可通过受损的肠黏膜进入肝脏, 从而加重肝纤维化的进程. 在肝脏内, 细菌DNA和内毒素能够通过与病原体相关分子模式(pathogen-associated molecular patterns, PAMPs)或损伤相关分子模式(damage-associated molecular patterns, DAMPs)相互作用, 直接作用于HSC; 同时, 它们也可通过激活肝内枯否细胞(kupffer cells, KCs), 间接促进HSC的活化, 导致与纤维化相关的基因表达水平上调, 进而加重肝纤维化的进展[16,17]. 另一方面, 肝纤维化的进程中, 炎症反应不仅直接损伤肝细胞, 还通过激活KCs和单核细胞来释放促炎介质, 如白细胞介素-1β(interleukin-1β, IL-1β)、肿瘤坏死因子ɑ(tumor necrosis factor α, TNF-α)等, 这些促炎因子可能随着胆汁进入肠道, 破坏肠道的机械屏障, 引发肠黏膜上皮之间紧密连接蛋白水平下降[18]. 因此, 肝纤维化与肠道屏障之间存在相互影响和相互促进的关系, 二者互为因果.
作为构成"肠肝轴"的核心元素, 肠道微生物群及其代谢产物对肠道和肝脏的生理学和病理生理学方面产生深远影响[19]. 肠道菌群在调控代谢紊乱的多方面扮演着关键角色, 这种调节依赖于微生物产生的多种代谢物以及它们与宿主细胞受体的相互作用. 参与相互作用的细菌代谢物种类繁多, 主要包括短链脂肪酸(short chain fatty acids, SCFAs)和细菌完整性所需的复杂大分子, 如肽聚糖和脂多糖(lipopolysaccharide, LPS). 由此可见, 保护肠黏膜屏障, 防止细菌及其产物的移位, 对于调节肝纤维化的病理进程至关重要(图1).
肠道菌群失调可对机体的正常生理功能造成损害, 甚至引发多种疾病[20]. 近年来随着研究的深入, 发现肠道微生物群不仅对肠道环境的稳定性产生直接影响, 还可能导致许多肠外病变[21,22]. 我们所关注的慢性肝脏疾病所致的肝纤维化与肠道菌群更有着千丝万缕的关系. 肠道微生物菌群的作用在慢性肝脏疾病研究领域有了新的发现, 其中关注点大多在于各种疾病发生、发展过程中肠道菌群的改变, 胆道分泌物对肠道微生物的作用等方面. 例如, 对于非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)、脂代谢等方面的研究, 国内学者胡义扬等认为肠道微生态可能成为NAFLD的重要治疗目标, 提示肠道菌群及其代谢物和肠屏障功能均与中药干预相关. 已有研究表明[23], 肠道微生物菌群失调与肝纤维化病情进展密切相关. 肝纤维化往往伴随着肠道菌群的紊乱, 而这种菌群紊乱可能加剧肝纤维化的程度[9]. 课题组在前期实验中发现, 经过肠道菌群清除后的大鼠, 在肝纤维化模型诱导中呈现出了病理改变的明显加剧(研究结果未发表, 见后研究基础), 提示肠道菌群与维持正常肝脏组织学的重要作用不容忽视. 然而, 尽管"肠肝轴"的双向相互作用已成为肝病的实验和临床研究的关键因素, 但对于肠道屏障、膳食成分、肠道微生物及其相关代谢产物构成的复杂宿主-微生物相互作用机制, 以及"肠肝轴"上的双向通信反馈作用, 我们对其了解仍然不足. 例如, 在这一概念中, 早期的关键因素是什么, 机体健康状态下是否在肠道具备无菌环境等问题仍然未知[24]. 因此, 从"肠肝轴"的视角来分析, 抗肝纤维化的有效药物是否能够通过调节肝纤维化患者肠道的微生物菌群, 通过微生物菌群的重构, 从而起到调理肝脾的作用?与肝纤维化相关特征性微生物菌群改变又是什么?这些问题仍值得深入探索.
关于肝与肠之间的脏腑关系, 早在《内经·五脏别论篇》中就有关于"肝肠同源"的表述, 从脏腑归属理论来看, 肝属于五脏, 肠属于六腑, 肝主疏泄, 肠主传导, 肝通过疏泄气机的作用, 对肠道的蠕动起推动作用; 从物质归属来看, 肝藏血, 血液运行依靠肝的推动作用, 而血液运行则提供肠道营养, 肠道健康则反过来滋养肝血; 从精神活动来看, 情绪变化直接影响肝气的调畅, 而肝气的畅达又影响胃肠道气机的运行, 因此肝主疏泄功能的延伸蕴含着肝肠同病、肝肠同治的思想. 明代医家李梴首次提出了"肝与大肠相通"的理论, 他在《医学入门脏腑相通篇》中指出: "心与胆相通......肝与大肠相通......此合一之妙也." 提出了肝与大肠的关系是阴阳、脏腑、经络、手足相通的关系. 在脏腑相通理论指导下, 后世医家广泛验证了"肝病肠治"、"肠病肝治"、"肝肠同治"的法则. 中医藏象理论认为, 五脏之中, 脾主要包括现代医学中整个消化系统, 而肠道则是脾实现功能的主要部位[25]. 肠道微环境是从脾论治肝病的重要生物学基础[26], 因此肠道菌群在一定程度上体现了中医理论中的"脾土思想"[27], 并进一步丰富了"肠肝轴"理论.
肝纤维化一病在中医古籍中并没有明确记载, 依其临床表现可归属于中医学"积聚""胁痛""黄疸"等范畴, 临床以慢性乙型肝炎、非酒精性脂肪肝、酒精性脂肪肝为主要病因. 从中医病因病机来分析, 病位多累及五脏之肝、脾, 多责之于毒、痰、瘀三者相互滋生, 病理基础是肝郁络阻, 早期以湿、毒为主要证候表现, 迁延日久, 则可以出现气滞血瘀、脉络瘀阻等证候. 《难经》指出: "所以治未病者, 见肝之病, 则知肝当传之于脾, 故先实其脾气......故曰治未病焉", 这是首次明确提出了肝病当"实脾"的指导思想. 《金匮要略》在此基础上进一步指出"治未病者, 见肝之病, 知肝传脾, 当先实脾", 指出肝病"实脾"谓之上工之举. 在治疗肝纤维化方面, 当肝肠同病发展到一定病理阶段, 患者常出现乏力、腹胀、少食、右上腹触及包块等症状, 病情重者可出现腹水. 中医辨证多将其归纳为肝脾失和、肝郁脾虚等证, 治疗上当以调和肝脾为要. 肝肠学说与中医以五脏为核心"肝脾"理论有异曲同源之理. "肠肝轴"是基于中医"肝脾理论"框架下, 并对其理论的细化和延伸, 肝、脾、肠等消化系统之间的作用相辅相成, 故调和肝脾类中药的药理作用可能与其对"肠肝轴"的调控密不可分. 对肝肠同病相关疾病, 如NAFLD肝脾不和证, 该类中药通常显示出较好的治疗效果[28].
从临床诊疗来看, 在尚未到达肝硬化的进一步发展之前, 抗肝纤维化有效的中药品种多与健脾、疏肝、理气相关, 归经也以肝、脾两脏为主. 从中药的性、味、归经等特性来分析, 临床有效的药物多与调理肝脾相关, 与现代医学的胃肠道密切相关, 从这个角度来看, 调理肝脾的治则与肠道的微生物菌群之间密切相关, 阐明调和肝脾类中药治疗功效的科学内涵将为中医药诊治"肠肝轴"相关疾病提供思路, 同时拓宽临床治疗用药选择.
近来研究发现, 中药可通过减少肠道内毒素的产生和移位, 调节肠道菌群平衡, 改善肠道功能障碍, 促进并维护免疫系统的正常发育和活动等, 发挥其抗肝纤维化作用. 李楠楠等[29]研究表明, 软肝冲剂在治疗CCl4引起的大鼠肝纤维化, 通过影响肠道菌群的多样性和丰富度, 发挥了抗肝纤维化作用. 张禹等[30]的研究表明, 软肝散加味方可能通过降低内毒素生成以及调整肝纤维化大鼠的肠道菌群结构, 具有抗肝纤维化的潜力. 徐宝贵等[31]的研究发现, 桂枝茯苓丸对肝纤维化模型小鼠的肠道菌群多样性和菌群结构具有调节作用, 增加了结肠紧密连接蛋白的表达, 降低了肠道通透性, 从而通过调节"肠肝轴"改善了肝纤维化.周雅等[32]的研究表明, 白术-白芍药对可能通过显著改善白藜芦菌科、乳酸杆菌科、蔗糖单胞菌科的变化, 减轻CCl4诱导的大鼠肝纤维化. 王成等[33]研究发现, 连翘提取物通过抑制炎症、调节肠道微生物群稳态以及促进肠黏膜屏障的修复减轻CCl4诱导的小鼠肝纤维化. 任海霞等[34]探讨了双氢青蒿素对肝纤维化大鼠影响, 发现治疗后大肠杆菌相对表达量减少, 而双歧杆菌和乳酸杆菌相对表达量增加. 总体而言, 中药在抗肝纤维化方面具有多种作用机制发挥其作用, 相关的中药制剂在动物实验中也取得了良好的效果. 这些研究为中药在肝纤维化治疗中的应用提供了理论依据, 并为未来开发新的治疗方法提供了启示. 然而, 这些作用机制亟需进一步的研究来验证, 并进行相关临床试验, 以确保其在人体中的安全性和有效性.
在肝纤维化的临床研究中, 徐俊等[35]探讨了抗纤软肝颗粒对慢乙肝肝纤维化患者肝硬度值及肠道菌群的影响, 结果提示, 治疗组对患者肠道菌群具有调节作用, OTU数量明显增加, Chao1指数、Shannon指数显著增高. 吴波明等[36]运用疏肝理气方对肝郁脾虚型慢性乙型肝炎治疗6月后, 观察组患者肝郁脾虚症状、肝功能指标和肝纤维化指标明显优于对照组, 且观察组患者的双歧杆菌和乳酸杆菌水平明显高于对照组, 大肠杆菌和肠球菌水平明显低于对照组. 江鸿等[37]研究了茵芪三黄解毒汤联合双歧杆菌三联活菌胶囊对慢性乙型肝炎患者肝纤维化、免疫功能的效果, 结果表明, 茵芪三黄解毒汤联合双歧杆菌三联活菌胶囊可明显改善CHB患者肝功能及肝纤维化水平, 有效调节患者免疫功能及肠道菌群. 中药及其活性成分可通过调节肠道菌群、改善肠道功能发挥其抗肝纤维化作用. 而在临床中, 基于"肝肠同治"理论, 见肝之病, 知肝传脾, 当先实脾, 注重疏肝健脾, 兼以化痰活血, 即为调节肠道菌群, 改善肠道屏障, 可防止疾病进一步传变, 改善患者肝纤维化的病情.
近来研究表明肠道菌群稳态失衡与肝纤维化的发生和发展密切相关, 针对肠道菌群稳态的干预逐渐成为当前宿主疾病防治的前沿策略和研究热点. 同时, 随着多组学检测技术的发展, 越来越多的高水平杂志报道了中医药调控肠道菌群改善宿主疾病的作用机制研究进展. 中医作为一种整体性的医疗体系, 其在调节肠道菌群和改善肝脏疾病方面具有潜在的优势, 因此在中医药治疗肝纤维化方面的应用前景备受关注. 肝纤维化发生时, 肠道微生物的组成及丰度发生明显变化. 越来越多的标志性菌群被发现, 并有望在未来的临床诊断中发挥一定的辅助作用. 研究显示[38], 当阿克曼菌属(Akkermansia muciniphila)的数量减少时, 会导致肠道黏液层变薄并增加肠道通透性, 进而可能导致细菌及其代谢产物的渗漏, 从而增加罹患肝纤维化的风险. 此外, 研究还发现在肝纤维化患者的粪便样本中, 变形菌门和大肠杆菌的丰度明显增加, 而厚壁菌门的数量则减少[39]. 肝纤维化的发展受到多种因素的影响, 其中包括遗传因素、生活方式和环境等. 中医药治疗强调个体化, 将根据每个患者的不同体质和病情制定相应的治疗方案, 结合肠道菌群调节的信息, 可以实现更加个体化的治疗策略, 提高治疗效果.
中药已成为临床干预疾病的有效治疗手段之一, 中药成分进入人体后, 肠道微生态系统是其重要靶点, 中药可通过调节肠道菌群的种类和数量比例, 促进肠道菌群平衡, 从而发挥治疗作用, 因此, 中药和肠道菌群在调节人体功能方面有共通之处, 可以看作一种"药菌同源"的关系. 将具有调节肠道菌群功效的中药组分与特定的益生菌菌株相结合, 可以更加有针对性地调节肠道菌群, 加强中医药治疗肝纤维化的效果. "药菌同源"为中医药提供了新的研究视角, 也为指导临床提供了新思路.
与现代医学不同, 中医药是以辨证论治、个体化治疗为主体的整体医学体系. 越来越多的证据表明, 中医药在心血管疾病、代谢疾病、传染病等多种复杂疾病中具有独特的治疗作用, 然而, 早期缺乏解释化学成分复杂性的分析策略, 严重阻碍了中医药的现代研究和应用. 中药以其多成分、多靶点的特性而著称, 因此通过单一通路的研究难以完全诠释中医药独有的"整体观念"治疗思想, 相比之下, 多组学联用研究则更加契合这一观点. 利用基因组、转录组、蛋白质组和代谢组等现代组学技术全面阐释中医药, 使其不仅能保持传统的理论和诊疗方法, 又具备现代科学的表征指标, 易于被国际学术界理解和接纳, 简言之, 就是利用现代科学技术来解读传统中医药原理, 从而推动中医药现代化和国际化.
加强微生态学、中医药学、系统生物学等领域的交叉研究, 深入挖掘肠道菌群与中医证型、中药药效之间的内在联系. 建立基于微生物组和代谢组的中医药证型分类和药效评价模式, 为开发微生态调控型中医药提供理论支撑. 积极应用高通量测序、生物统计等手段, 解析不同中医证型患者的肠道菌群特征; 运用机器学习等方法, 建立基于微生态标志的中医证型判别及治疗反应预测模型, 促进中医药经典理论与新兴技术的有机结合; 加强转化医学和中西医结合研究, 运用多组学技术, 阐明中药的多靶点调节机制, 同时探索中西医结合应用菌群制剂的策略, 拓展中医药在肠道菌群调节领域的应用, 为临床提供循证医学证据.
总的来说, 中医药在抗肝纤维化中具有潜在的治疗作用. 肝纤维化作为慢性肝脏疾病的关键阶段, 其发生发展与肠道菌群的失衡密切相关. 中医药强调"肝肠同治", 通过调节肝脾功能和改善肠道菌群平衡来对抗肝纤维化的进展. 同时, 肠道菌群与中医药在抗肝纤维化领域的研究和应用为中医药现代化和国际化提供了新的发展机遇. 多学科合作和研究交叉的努力将进一步推动肝纤维化治疗方法的创新和优化, 可以为患者提供更有效和个性化的抗肝纤维化治疗策略.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): A
B级 (非常好): 0
C级 (良好): C, C, C
D级 (一般): D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Zhang J, Liu Q, He J, Li Y. Novel Therapeutic Targets in Liver Fibrosis. Front Mol Biosci. 2021;8:766855. [PubMed] [DOI] |
| 2. | Lurie Y, Webb M, Cytter-Kuint R, Shteingart S, Lederkremer GZ. Non-invasive diagnosis of liver fibrosis and cirrhosis. World J Gastroenterol. 2015;21:11567-11583. [PubMed] [DOI] |
| 3. | Ginès P, Krag A, Abraldes JG, Solà E, Fabrellas N, Kamath PS. Liver cirrhosis. Lancet. 2021;398:1359-1376. [PubMed] [DOI] |
| 4. | Lee YA, Wallace MC, Friedman SL. Pathobiology of liver fibrosis: a translational success story. Gut. 2015;64:830-841. [PubMed] [DOI] |
| 6. | Gill US, Bertoletti A. Clinical Trial Design for Immune-Based Therapy of Hepatitis B Virus. Semin Liver Dis. 2017;37:85-94. [PubMed] [DOI] |
| 8. | Qi X, Yang M, Stenberg J, Dey R, Fogwe L, Alam MS, Kimchi ET, Staveley-O'Carroll KF, Li G. Gut microbiota mediated molecular events and therapy in liver diseases. World J Gastroenterol. 2020;26:7603-7618. [PubMed] [DOI] |
| 9. | Liu S, Wu J, Chen P, Mohammed SAD, Zhang J, Liu S. TAK-242 Ameliorates Hepatic Fibrosis by Regulating the Liver-Gut Axis. Biomed Res Int. 2022;2022:4949148. [PubMed] [DOI] |
| 10. | Ley RE, Peterson DA, Gordon JI. Ecological and evolutionary forces shaping microbial diversity in the human intestine. Cell. 2006;124:837-848. [PubMed] [DOI] |
| 11. | Lee JY, Tsolis RM, Bäumler AJ. The microbiome and gut homeostasis. Science. 2022;377:eabp9960. [PubMed] [DOI] |
| 12. | Adak A, Khan MR. An insight into gut microbiota and its functionalities. Cell Mol Life Sci. 2019;76:473-493. [PubMed] [DOI] |
| 13. | van Best N, Rolle-Kampczyk U, Schaap FG, Basic M, Olde Damink SWM, Bleich A, Savelkoul PHM, von Bergen M, Penders J, Hornef MW. Bile acids drive the newborn's gut microbiota maturation. Nat Commun. 2020;11:3692. [PubMed] [DOI] |
| 14. | Tripathi A, Debelius J, Brenner DA, Karin M, Loomba R, Schnabl B, Knight R. The gut-liver axis and the intersection with the microbiome. Nat Rev Gastroenterol Hepatol. 2018;15:397-411. [PubMed] [DOI] |
| 15. | Albillos A, de Gottardi A, Rescigno M. The gut-liver axis in liver disease: Pathophysiological basis for therapy. J Hepatol. 2020;72:558-577. [PubMed] [DOI] |
| 16. | Yu S, Chen X, Xiu M, He F, Xing J, Min D, Guo F. The regulation of Jmjd3 upon the expression of NF-κB downstream inflammatory genes in LPS activated vascular endothelial cells. Biochem Biophys Res Commun. 2017;485:62-68. [PubMed] [DOI] |
| 17. | Wang H, Liu S, Wang Y, Chang B, Wang B. Nod-like receptor protein 3 inflammasome activation by Escherichia coli RNA induces transforming growth factor beta 1 secretion in hepatic stellate cells. Bosn J Basic Med Sci. 2016;16:126-131. [PubMed] [DOI] |
| 18. | De Simone G, Andreata F, Bleriot C, Fumagalli V, Laura C, Garcia-Manteiga JM, Di Lucia P, Gilotto S, Ficht X, De Ponti FF, Bono EB, Giustini L, Ambrosi G, Mainetti M, Zordan P, Bénéchet AP, Ravà M, Chakarov S, Moalli F, Bajenoff M, Guidotti LG, Ginhoux F, Iannacone M. Identification of a Kupffer cell subset capable of reverting the T cell dysfunction induced by hepatocellular priming. Immunity. 2021;54:2089-2100.e8. [PubMed] [DOI] |
| 19. | Trebicka J, Bork P, Krag A, Arumugam M. Utilizing the gut microbiome in decompensated cirrhosis and acute-on-chronic liver failure. Nat Rev Gastroenterol Hepatol. 2021;18:167-180. [PubMed] [DOI] |
| 20. | Lynch SV, Pedersen O. The Human Intestinal Microbiome in Health and Disease. N Engl J Med. 2016;375:2369-2379. [PubMed] [DOI] |
| 21. | Tilg H, Cani PD, Mayer EA. Gut microbiome and liver diseases. Gut. 2016;65:2035-2044. [PubMed] [DOI] |
| 22. | Chen D, Le TH, Shahidipour H, Read SA, Ahlenstiel G. The Role of Gut-Derived Microbial Antigens on Liver Fibrosis Initiation and Progression. Cells. 2019;8. [PubMed] [DOI] |
| 23. | Yu LX, Schwabe RF. The gut microbiome and liver cancer: mechanisms and clinical translation. Nat Rev Gastroenterol Hepatol. 2017;14:527-539. [PubMed] [DOI] |
| 24. | Tilg H, Adolph TE, Trauner M. Gut-liver axis: Pathophysiological concepts and clinical implications. Cell Metab. 2022;34:1700-1718. [PubMed] [DOI] |
| 25. | 张 旭, 赵 宇峰, 胡 义扬, 刘 平, 赵 立平. 基于功能元基因组学的人体系统生物学新方法:中医药现代化的契机. 世界科学技术(中医药现代化). 2011;13:202-212. [DOI] |
| 28. | Sun Q, Xin X, An Z, Hu Y, Feng Q. Therapeutic Potential of Natural Plants Against Non-Alcoholic Fatty Liver Disease: Targeting the Interplay Between Gut Microbiota and Bile Acids. Front Cell Infect Microbiol. 2022;12:854879. [PubMed] [DOI] |
| 30. | 张 禹, 张 弓, 杨 沈秋, 黄 秋思, 李 佳泽, 邵 忠林. 基于"肝肠同治"理论探讨软肝散加味方调控肠道菌群治疗肝纤维化的作用机制. 中国中医药科技. 2022;29:947-951. |
| 34. | 任 海霞, 郭 永泽, 李 淑霞, 王 建华, 郭 晓会, 平 付敏, 王 恩雨, 单 铁强. 双氢青蒿素对肝纤维化大鼠肠道菌群及NLRP3炎性小体的影响. 现代中西医结合杂志. 2023;32:915-919+925. [DOI] |
| 35. | 徐 俊, 戚 璐, 周 涛, 胡 聪, 郭 晟, 张 凡, 程 良斌. 从肠道菌群探讨抗纤软肝颗粒防治慢性乙型肝炎肝纤维化的临床研究. 中西医结合肝病杂志. 2021;31:776-780. [DOI] |
| 36. | 吴 波明, 胡 爱荣, 应 茵, 夏 建萍, 周 洋. 疏肝理气方改善肝郁脾虚型慢性乙型肝炎肝功能、肝纤维化的作用以及对肠道菌群的影响. 中华中医药学刊. 2020;38:206-209. [DOI] |
| 38. | Schneider KM, Mohs A, Gui W, Galvez EJC, Candels LS, Hoenicke L, Muthukumarasamy U, Holland CH, Elfers C, Kilic K, Schneider CV, Schierwagen R, Strnad P, Wirtz TH, Marschall HU, Latz E, Lelouvier B, Saez-Rodriguez J, de Vos W, Strowig T, Trebicka J, Trautwein C. Imbalanced gut microbiota fuels hepatocellular carcinoma development by shaping the hepatic inflammatory microenvironment. Nat Commun. 2022;13:3964. [PubMed] [DOI] |
| 39. | Loomba R, Seguritan V, Li W, Long T, Klitgord N, Bhatt A, Dulai PS, Caussy C, Bettencourt R, Highlander SK, Jones MB, Sirlin CB, Schnabl B, Brinkac L, Schork N, Chen CH, Brenner DA, Biggs W, Yooseph S, Venter JC, Nelson KE. Gut Microbiome-Based Metagenomic Signature for Non-invasive Detection of Advanced Fibrosis in Human Nonalcoholic Fatty Liver Disease. Cell Metab. 2017;25:1054-1062.e5. [PubMed] [DOI] |