修回日期: 2023-10-05
接受日期: 2023-10-23
在线出版日期: 2023-10-28
由于黄色肉芽肿性胆囊炎(xanthogranulomatous chole-cystitis, XGC)和胆囊癌(gallbladder carcinoma, GBC)临床及影像学特征过于相似, 故在临床诊疗过程中两者常常难以区别. 本研究基于腹部超声及增强CT, 分析两者人口学特征、实验室指标、肿瘤标志物以及影像学特征的差异. 进而构建诊断模型, 辅助临床医生诊疗.
回顾性分析黄色肉芽肿性胆囊炎和胆囊癌病人临床及影像学特征的差异, 归纳鉴别二者的危险因素并构建诊断模型.
回顾性分析浙江省人民医院2011-01/2022-09本院术前行腹部超声联合腹部增强CT且术后病理诊断明确的67例XGC患者和139例GBC患者, 分析2组患者的临床表现、实验室和影像学表检查的差异.
分析两组患者临床及影像学特征, 性别、γ-谷氨酰胺转移酶(γ-glutamyl transpeptadase, GGT)、癌胚抗原(carcinoembryonic antigen, CEA)、平均胆囊壁厚度、胆囊壁增厚方式(胆囊壁受累<50%)、是否合并胆囊结石和腹膜后淋巴结肿大是鉴别XGC与GBC的独立危险因素. GGT和CEA的最佳临界值分别为28 U/L、CEA3.2 ug/L.
XGC与GBC的部分临床及影像学特征存在显著差异, 可以为术前鉴别诊断提供参考价值.
核心提要: 本研究纳入单中心较大样本量黄色肉芽肿性胆囊炎(xanthogranulomatous cholecystitis, XGC)和胆囊癌(gallbladder carcinoma, GBC)患者. 性别、γ-谷氨酰胺转移酶(γ-glutamyl transpeptadase, GGT)、癌胚抗原(carcinoembryonic antigen, CEA)、平均胆囊壁厚度、胆囊壁增厚方式(受累<50%)、是否合并胆囊结石和腹膜后淋巴结肿大是鉴别XGC与GBC的独立危险因素. GGT和CEA的最佳临界值分别为28 U/L、CEA3.2 ug/L.
引文著录: 傅天炜, 张成武, 方海星. 黄色肉芽肿性胆囊炎与胆囊癌的术前鉴别. 世界华人消化杂志 2023; 31(20): 863-870
Revised: October 5, 2023
Accepted: October 23, 2023
Published online: October 28, 2023
Because the clinical and imaging features of xanthogranu-lomatous cholecystitis (XGC) and gallbladder carcinoma (GBC) are very similar, it is often difficult to distinguish them clinically. Based on abdominal ultrasound and contrast-enhanced CT, this study analyzed the differences in demographic characteristics, laboratory indicators, tumor markers, and imaging features between patients with XGC and those with GBC. Then a diagnostic model was constructed to assist clinicians in the diagnosis and treatment of the two conditions.
To analyze the differences in clinical and imaging features between XGC and GBC patients, and to establish a diagnostic model for the two conditions.
From January 2011 to September 2022, 67 patients with XGC and 139 patients with GBC who underwent abdominal ultrasonography and abdominal contrast-enhanced CT and had definite postoperative pathological diagnosis at Zhejiang Provincial People's Hospital were retrospectively analyzed. The differences in clinical manifestations and laboratory and imaging findings between the two groups were analyzed.
Gender, γ-glutamyl transpeptadase (GGT), carcinoembryonic antigen (CEA), mean gallbladder wall thickness, gallbladder wall thickening pattern (gallbladder wall involvement < 50%), gallstones, and retroperitoneal lymphadenopathy were independent risk factors for differentiating XGC from GBC. The cut-off values for GGT and CEA were 28 U/L and 3.2 ug/L, respectively.
There are significant differences in some clinical and imaging features between XGC and GBC, which can provide reference value for their preoperative differential diagnosis.
- Citation: Fu TW, Zhang CW, Fang HX. Preoperative differential diagnosis of xanthogranulomatous cholecystitis and gallbladder carcinoma. Shijie Huaren Xiaohua Zazhi 2023; 31(20): 863-870
- URL: https://www.wjgnet.com/1009-3079/full/v31/i20/863.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v31.i20.863
黄色肉芽肿性胆囊炎(xanthogranulomatous cholecystitis, XGC), 即纤维性黄色肉芽肿性胆囊炎或蜡质样组织细胞肉芽肿, 是一种以胆囊慢性炎症为基础、较为少见的特殊类型的良性胆囊炎性病变[1]. 其病因目前尚不明确, 可能与急慢性胆管结石和胆囊压力升高引起的胆道梗阻相关[2]. 也有不少学者认为与罗-阿氏窦破裂或溃疡相关, 胆汁进入胆囊壁并向组织间隙浸润, 导致组织对胆汁进行吞噬的炎症反应. 镜下表现为泡沫细胞、多核巨细胞及纤维组织增生, 切片中可见胞浆内含脂质的吞噬细胞[2,3]. 广泛的炎性纤维导致胆囊壁增厚和形成多个黄褐色结节[4]. 炎症过程通常扩散到邻近的器官, 从而在胆囊周围形成一个类似肿瘤的肿块[5]. 由于XGC的临床表现及影像学特征与胆囊癌(gallbladder carcinoma, GBC)极为相似, 两者在临床工作中鉴别诊断较为困难. 而正确的临床诊断对XGC和GBC病人的下一步治疗至关重要, 早期识别和鉴别这两类疾病可以显著改善患者预后.
回顾性分析浙江省人民医院2011-01/2022-09术后病理诊断明确的67例XGC患者和139例GBC患者, 纳排标准如下.
纳入标准: (1)术后病理诊断明确为XGC和GBC; (2)临床表现、实验室检查、影像学检查包括腹部超声联合腹部增强CT等资料完整; (3)年龄18-90岁.
排除标准: (1)除去XGC合并GBC患者; (2)GBC组除去继发性胆囊恶性肿瘤患者; (3)XGC组除去合并恶性肿瘤患者.
所有实验均按照《赫尔辛基宣言》进行, 涉及人类参与者的研究中进行的所有程序均按照伦理委员会的伦理标准进行. 由于本研究是回顾性研究, 使用并分析了回顾性数据, 因此放弃IRB书面知情同意.
回顾性分析2组患者的临床资料: (1)基本资料和临床表现, 包括性别、年龄、BMI, 有无腹痛、黄疸、发热、恶心呕吐; (2)实验室检查结果, 包括白细胞计数(white blood cell count, WBC)、白蛋白(albumin, ALB)、血红蛋白(hemoglobin, HB)、血小板(platelet, PLT)、丙氨酸转氨酶(alanine transaminase, ALT)、天冬氨酸转氨酶(aspartate transaminase, AST)、γ-谷氨酰胺转移酶(γ-glutamyl transpeptadase, GGT)、碱性磷酸酶(alkaline phosphatase, ALP)、总胆红素(total bilirubin, TBIL)、总胆汁酸(total bile acid, TBA)和凝血酶原时间(prothrombin time, PT), 血清肿瘤标志物包括癌胚抗原(carcinoembryonic antigen, CEA)、糖类抗原19-9(carbohydrate antigen 19-9, CA19-9)、糖类抗原125(carbohydrate antigen 125, CA125)和糖类抗原125(carbohydrate antigen 15-3, CA15-3); (3)纳入患者既往行腹部超声和腹部增强CT检查, 影像学特征包括平均胆囊壁厚度、胆囊壁增厚方式(局部增厚定义为胆囊所有CT层面增厚的胆囊壁受累<50%, 弥漫增厚定义为任一平面胆囊壁受累≥50%), 以及有无胆囊粘膜中断、胆囊结石、肝内外胆管扩张、胆囊颈和腹膜后淋巴结肿大. 分析比较XGC患者和GBC患者术前临床及影像学特征差异, 构建诊断模型, 明确鉴别两者的独立危险因素, 为临床医生诊断提供参考信息.
统计学处理 研究数据采用SPSS 26.0软件进行分析. 计量资料中, 满足正态分布者以平均值(mean)±标准差(SD)表示, 偏态分布者以中位数以及其四分位数范围(IQR)表示, 并使用Mann-Whitney U检验进行比较. 计数资料则以频数及百分比表示, 适当情况下行卡方检验或费舍尔精确检验进行比较. 统计学显著性用aP<0.05或bP<0.001, 取双尾.
本研究最终收录浙江省人民医院2011-01/2022-09术后病理诊断明确的69例XGC患者和139例GBC患者, 其临床及影像学特征如表1、表2所示.
| 合计(n = 206) | XGC组(n = 67) | GBC组(n = 139) | P | |
| 性别, 女(%) | 117(57.8%) | 24(35.8%) | 93(66.9%)a | <0.001 |
| 年龄, 岁 | 65.0±12.56 | 63.7±15.3 | 65.7±11.0 | 0.575 |
| BMI, kg/m2 | 22.8±3.3 | 22.9±2.86 | 22.7±3.57 | 0.391 |
| 上腹痛(%) | 154(74.8%) | 63(94.0%) | 91(65.5%)a | <0.001 |
| 腹胀(%) | 59(28.6%) | 26(38.8%) | 33(23.7%)b | 0.025 |
| 发热(%) | 59(28.6%) | 26(38.8%) | 33(23.7%)b | 0.025 |
| 恶心呕吐(%) | 55(26.7%) | 23(34.3%) | 32(23.0%) | 0.086 |
| 黄疸(%) | 43(20.9%) | 15(22.4%) | 28(20.1%) | 0.711 |
| WBC, 109/L | 6.52(4.90, 8.95) | 8.19(5.86, 11.54) | 6.05(4.70, 7.72)b | <0.001 |
| HB, g/L | 124.3±18.7 | 126.4±18.6 | 123.2±18.7 | 0.419 |
| PLT, 109/L | 223(174, 282) | 233(176, 290) | 218(173, 278) | 0.612 |
| ALB, g/L | 38.0±5.3 | 36.1±5.2 | 39.0±5.1a | <0.001 |
| ALT, U/L | 29(14, 98) | 39(16, 127) | 26(13, 92) | 0.266 |
| AST, U/L | 28(21, 77) | 31(19, 85) | 27(21, 75) | 0.584 |
| GGT, U/L | 66(26, 296) | 125(39, 280) | 56(22, 306)b | 0.010 |
| ALP, U/L | 121(85, 240) | 129(96, 284) | 112(82, 235) | 0.119 |
| TB, μmol/L | 16.4(11.9, 38.2) | 18.5(13.0, 38.1) | 16.0(11.8, 39.7) | 0.466 |
| TBA, μmol/L | 6.9(3,8, 18.0) | 7.0(4.1, 14.5) | 6.9(3.5, 27.2) | 0.829 |
| PT, s | 11.9(11.1, 12.6) | 12.2(11.6, 12.9) | 11.8(11.1, 12.3)a | 0.008 |
| AFP, μg/L | 2.4(1.8, 3.4) | 2.1(1.6, 3.3) | 2.5(1.8, 3.7)b | 0.026 |
| CEA, μg/L | 2.6(1.6, 4.6) | 2(1.1, 3.1) | 3.2(1.7, 5.5)a | <0.001 |
| CA19-9, U/mL | 43.5(13.2, 223.1) | 60(16.1, 275.8) | 35.1(12.1, 191.6) | 0.564 |
| CA125, U/mL | 22.2(12.0, 35.7) | 23.1(12.0, 34.2) | 21.6(11.7, 37.8) | 0.106 |
| CA15-3, U/mL | 11.1(8.3, 16.1) | 10.1(7.9, 16.1) | 11.5(8.6, 16.2) | 0.099 |
| 合计(n = 206) | XGC组(n = 67) | GBC组(n = 139) | P | |
| 胆囊壁厚度, mm | 11(5, 20) | 6(4, 9) | 14(8, 28)a | <0.001 |
| 胆囊壁增厚方式 | <0.001 | |||
| 局灶性增厚 | 113(54.9%) | 25(37.3%) | 88(63.3%)a | |
| 弥漫性增厚 | 93(45.1%) | 42(62.7%) | 51(36.7%)a | |
| 胆囊壁粘膜中断 | 162(78.6%) | 32(47.8%) | 130(93.5%)a | <0.001 |
| 合并胆囊结石 | 121(58.7%) | 58(86.6%) | 63(45.3%)a | <0.001 |
| 肝内外胆管扩张 | 81(39.3%) | 22(32.8%) | 59(42.4%) | 0.187 |
| 胆囊颈淋巴结肿大 | 61(29.6%) | 17(25.4%) | 44(31.7%) | 0.417 |
| 腹膜后淋巴结肿大 | 34(16.5%) | 2(3.0%) | 32(23.0%)a | <0.001 |
胆囊炎组女性患者24例(35.8%), 平均年龄65.7岁±11.0岁. 胆囊癌组女性患者93例(66.9%), 平均年龄63.7岁±15.3岁. 两组对比下, 患者年龄及体重BMI指数无统计学差异, 性别构成比差异存在统计学意义(P<0.001).
2组比较, 入院时上腹部疼痛、腹胀、发热存在统计学意义(P<0.05), 而恶心呕吐及外观黄疸无统计学差异.
两组比较WBC、ALB、GGT、PT、AFP、CEA存在统计学差异(P<0.05), 剩余实验室检查未见统计学差异.
2组患者比较, XGC组和GBC组患者胆囊壁较正常胆囊均存在不同程度胆囊壁的增厚, XGC组胆囊壁厚度中位数及其四分位间距为6(4,9) mm, GBC组胆囊壁厚度中位数及其四分位间距为14(8,28) mm, 两组患者胆囊壁平均厚度比较差异具有统计学意义(Z = -6.16, P<0.001). 本研究中XGC组患者胆囊壁由62.7%弥漫性增厚和37.3%局限性增厚构成. 而在GBC组中, 胆囊壁增厚方式为36.7%弥漫性增厚和63.3%局限性增厚构成. 比较两组患者胆囊壁增厚方式, 其差异存在统计学意义(P<0.001). 除此之外, 合并胆囊粘膜壁中断、胆囊结石及腹膜后淋巴结肿大在XGC组和GBC组患者中的差异均具有统计学意义(P<0.05), 而两者合并肝内外胆管扩张和胆囊颈淋巴结肿大无统计学差异.
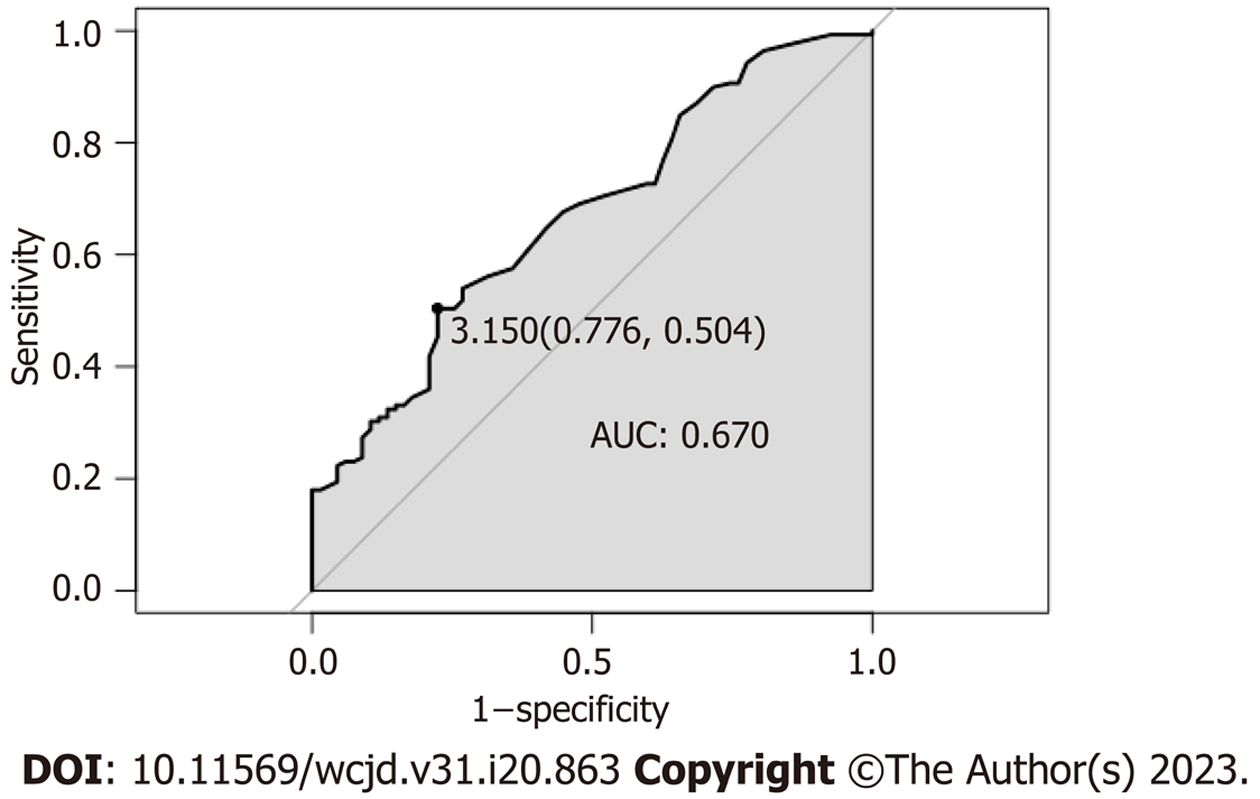
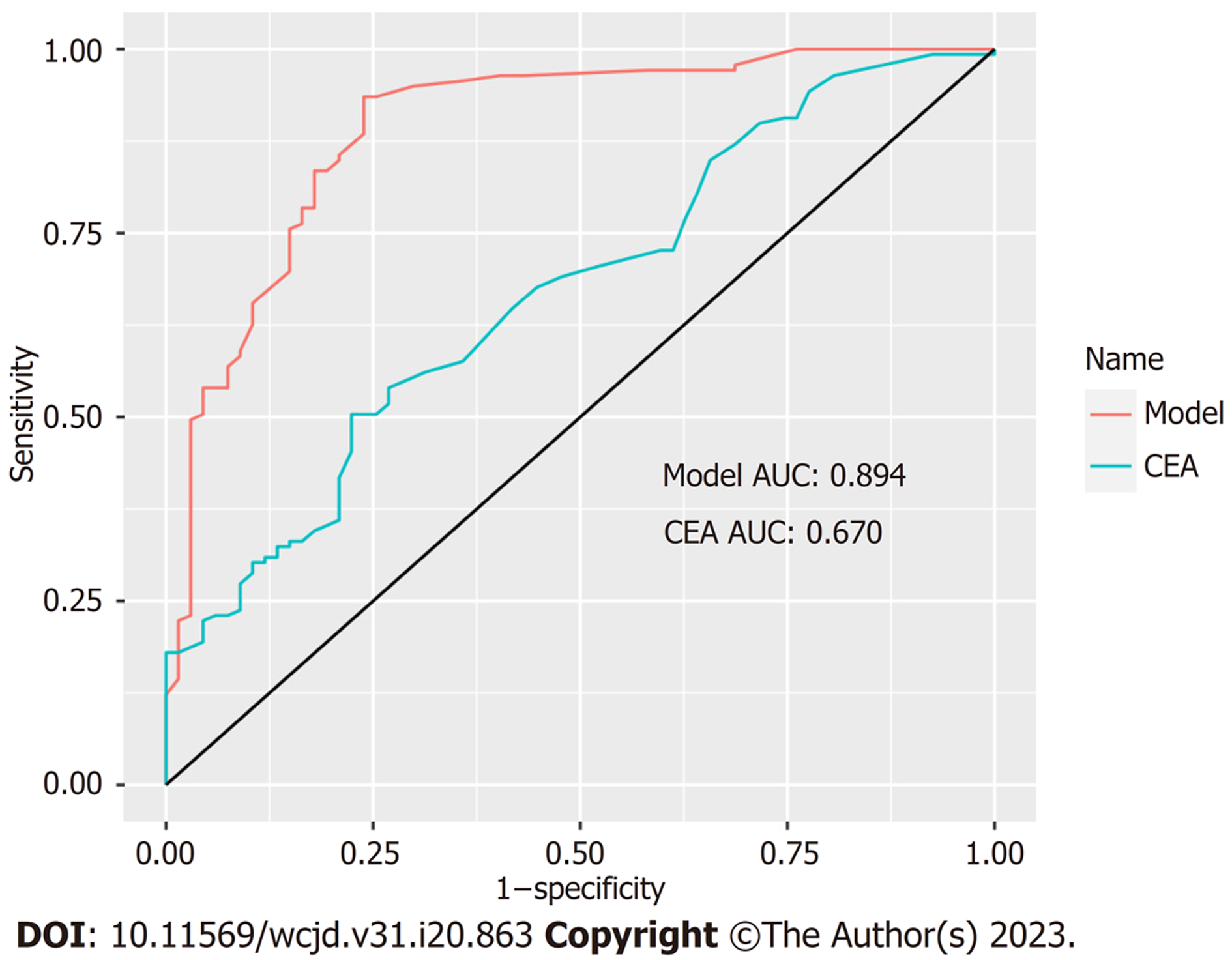
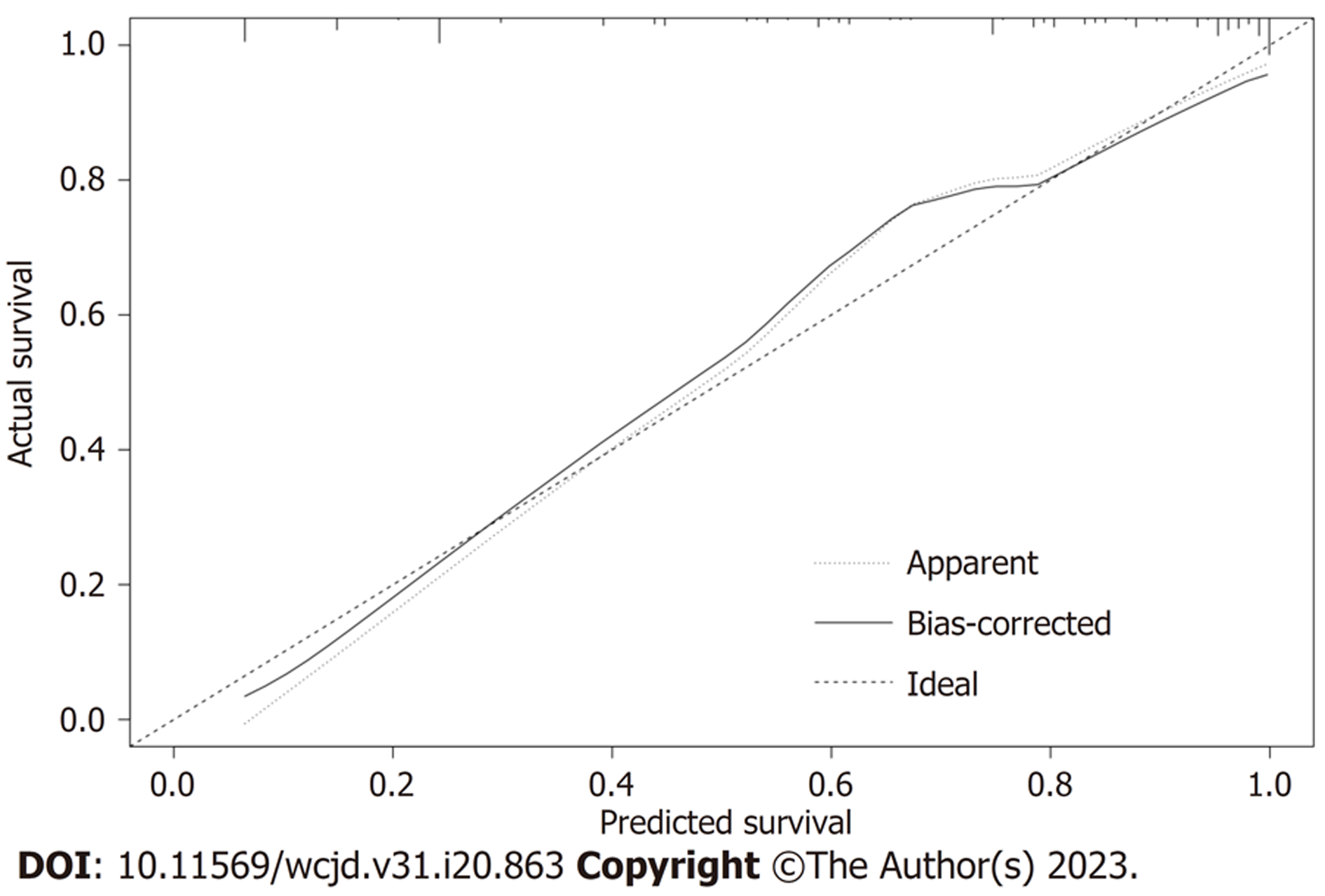
存在显著统计学意义的连续变量通过ROC曲线分析选择最佳并转换为二分类变量. 本研究中CEA最佳临界值为3.15 ug/L(图1), GGT和平均胆囊壁厚度最佳临界值分别为27.5 U/L、9.25 mm. CEA、GGT及平均胆囊壁厚度依次按照3.2 ug/L、28 U/L、10 mm转换为二分类变量, 转换后的变量在两组间的差异仍具备显著统计学(如表3所示). 逐步将变量纳入二元Logistic回归模型, 性别女、GGT<28 U/L、CEA≥3.2 ug/L、平均胆囊壁厚度≥10 mm、胆囊壁局灶性增厚(胆囊壁受累<50%)、不合并胆囊结石和腹膜后淋巴结肿大是诊断GBC的独立预测危险因素(表4). 通过ROC曲线评估CEA数值和诊断模型诊断效能, 模型ROC曲线下面积为0.894(95%CI: 0.845-0.943)(图2), 其校正曲线如图3所示.
| 变量 | 单因素OR值(95%CI) | P | 多因素OR值(95%CI) | P |
| 性别, 女 | 3.62(1.97-6.68) | <0.001 | 4.54(1.95-10.58) | <0.001 |
| GGT≥28 U/L | 0.15(0.06-0.39) | <0.001 | 0.21(0.07-0.65) | 0.007 |
| CEA≥3.2 ug/L | 3.52(1.81-6.83) | <0.001 | 4.42(1.83-10.65) | 0.001 |
| 胆囊壁厚度≥10 mm | 7.24(3.69-14.23) | <0.001 | 3.70(1.58-8.68) | 0.003 |
| 胆囊壁增厚方式 | 0.30(0.17-0.56) | <0.001 | 0.40(0.18-0.90) | 0.027 |
| 合并胆囊结石 | 0.13(0.06-0.28) | <0.001 | 0.16(0.06-0.44) | <0.001 |
| 腹膜后淋巴结肿大 | 9.72(2.25-41.91) | <0.001 | 5.91(1.04-33.6) | <0.001 |
XGC是一类病因机制不明确且少见的胆囊良性疾病, 病理可见胆囊壁增厚伴有黄色肉芽肿形成, 囊壁呈重度增生及纤维化, 可见泡沫状组织细胞, 部分可出现囊壁钙化及出血等表现[6]. 伴随XGC慢性炎症的进展, 其肝脏及周边邻近器官粘连致密, 局部纤维组织增多, 部分患者病灶侵犯附近器官继而形成内瘘[7]. GBC存在肿瘤的局部浸润和肝脏侵犯, 故XGC和GBC在形态学和影像学上都极为相似. 而XGC和GBC临床均可表现急性或慢性胆囊炎的特征, 如右上腹痛、寒战发热、恶心呕吐、黄疸等表现.
XGC治疗理论上行单纯胆囊切除即可达到治疗效果, 但其常侵犯邻近器官, 包括肝脏、十二指肠、结肠肝区等, 继发的内瘘、炎性狭窄、胆囊穿孔和Mirizzi综合症等极大地提高了手术难度[8], 且XGC术后并发症概率高达20%[9], 术前评估尤其重要. 而GBC患者的手术治疗重点在于评估肿瘤分期, 考虑浆膜侵犯甚至肝脏侵犯患者应该扩大切除范围完整切除肿瘤并行术中冰冻病理检查切缘, 预期的术式是包括淋巴结清扫在内的胆囊癌根治术[9]. 因此, 正确的术前诊断至关重要, XGC患者误诊为GBC将大大增加手术切除范围、手术难度及术后并发症的概率, 而可根治切除的GBC患者误诊为XGC行单纯的胆囊切除将严重影像患者生存预后.
XGC纳入研究的病例数有限且地区差异性大, 因此各个中心患病年龄及性别构成的报道差异也较大, 有文献报道XGC男性发病率较女性高[10]. 而较为共识的是GBC在女性中的发病率是男性的2到6倍[11], 本研究中XGC患者男性多见, 而GBC患者则以女性更为多见. 其次, 模型纳入CEA和GGT两个实验室指标. XGC组患者血清GGT普遍高于GBC组患者, 本研究中最佳临界值为28 U/L, 与临床常用临界值较为接近. 血清GGT多反映胆道受累情况[12], 作者认为这可能与XGC胆囊壁肉芽肿压迫胆管、侵犯周围肝脏、甚至与肝内胆管形成瘘管相关. XGC的侵袭性预示着其大多数患者伴随着GGT数值升高, 而早期GBC患者可不累犯胆管, 甚至不表现为胆囊炎症. 不少学者对XGC和GBC患者肿瘤标志物表达差异进行研究, Yu等[13]认为XGC中肿瘤标志物的升高加大了其与GBC鉴别的难度, 胆管结石合并胆管炎、胆道梗阻、GBC以及XGC引起的胆道损伤等均可能导致肿瘤标志物如CA19-9升高[14]. 一项包含240例XGC和GBC患者的回顾性研究显示, GBC患者血CEA水平显著高于XGC(P = 0.007)[15], 本研究中两者CEA数值存在显著差异且最佳临界值为3.2 ug/L, 作者认为GBC患者CEA临界值降低可能有助于其与其他胆囊疾病相鉴别.
腹部超声及腹部增强CT是胆囊手术术前较为普及的影像学检查, 但两者可用于鉴别诊断的影像学特征目前尚且存在较大争议[15,16], XGC和GBC均可伴随胆囊壁弥漫性增厚和胆囊结石[7]. XGC患者合并胆囊结石的比例可高达85%-100%[17], 胆管结石也是XGC形成机制中的重要一环. 而长期胆囊结石伴慢性炎症是GBC公认的发生机制, 近60%-90%合并有胆囊结石. 本项研究胆囊所有CT层面增厚胆囊壁是否受累50%为界限, GBC胆囊壁以局灶性增厚为主, 而XGC则以弥漫性为主, 以上结果同既往文献相似[18], 且GBC组平均胆囊壁厚度显著大于XGC组. 先前研究证实此分类标准在鉴别XGC和GBC中的可行性[19], 而胆囊壁厚度临界值划分包括10 mm[16]以及20 mm[7]等, 本项研究最佳临界值接近前者. 此外, 本研究中两者胆囊颈部及周围淋巴结肿大的差异未见统计学差异, 而腹膜后淋巴结肿大预示着GBC进展导致的淋巴结转移, 在GBC中晚期患者中多见. Zhou等[16]影像学特征的机器学习的研究报道中, 是否合并胆囊结石、粘膜线中断、外周淋巴结节肿大(>10 mm)、胆管扩张和壁内结节是腹部增强CT鉴别XGC和GBC的典型征象. 而本研究中两者合并肝内外胆管扩张无显著差异, 这可能与未进行肝内和肝外胆管扩张分类相关.
仍有许多存在统计学差异的变量未纳入诊断模型. 腹痛多见于XGC患者, 这可能与肉芽肿压迫继发梗阻性黄疸、与邻近器官的内瘘形成以及胆囊慢性炎症急性发作相关, 而部分GBC患者可无明显腹痛. 其次, XGC和GBC患者实WBC、ALB、PT数值均存在统计学差异. WBC升高和PT延长多与胆囊炎症相关. 两组患者ALB也存在显著差异, 出乎我们意料的是GBC组ALB数值普遍比XGC组高. 尽管如此, 作者认为ALB与个体营养状况相关且个体差异大, 纳入模型仍需要进一步论证. 胆囊粘膜线中断存在统计学差异, XGC因结石或胆汁淤积等因素致使胆汁渗入到胆囊壁内产生胆固醇和脂质, 形成的黄色肉芽肿性病变推压胆囊上皮使其移位, 故挤压较少造成粘膜中断, 粘膜中断多提示GBC[20,21].
随着影像学研究进展, 腹部增强MR、DWI信号和ADC信号等影像学特征在鉴别XGC和GBC方面起重要作用[16], 基于机器学习的影像学算法也多有报道[22,23], 甚至有文献报道XGC和GBC血清样本外泌体mRNA、lncRNA和circRNA存在差异表达[24]. 尽管目前在影像学上诊断 XGC的准确率有所提高, 但两者的术前鉴别诊断仍不令人满意. XGC在临床工作中较为罕见, 且大多数XGC患者因影像学特征不显著而诊断为胆囊炎症, 仅有少部分难以鉴别的患者行进一步的增强MR检查. 所以作者认为高敏感度及特异性的检查难以在该类人群中普及是两者难以鉴别的原因之一, 目前有效鉴别两者仍依赖于术前检查和术中冰冻切片. 在两者难以鉴别时, 手术方式仍偏向过度治疗. 然而, 一项胆囊癌病理的回顾性研究中, 8%的GBC患者术中因术中大体观正常而漏诊[25], 术中冰冻切片尚且存在取样的误差. 本研究构建的模型旨在识别诊断GBC的危险因素, 辅助术中冰冻切片结果的判读.
综上所述, XGC和GBC术前鉴别仍十分非常困难, 目前尚无完全可靠的确定性诊断手段, 需结合患者各方面信息综合分析, 也期待未来更大样本量以及更多影像学特征的研究.
回顾性分析单中心较大样本量的黄色肉芽肿胆囊炎(xanthogranulomatous cholecystitis, XGC)和胆囊癌(gallbladder carcinoma, GBC)患者病例, 纳入多项人口学、实验室以及影像学特征, 总结归纳了鉴别两者的独立危险因素. XGC和GBC在临床工作中难以区别, 两者存在相似的症状和影像学特征. 目前两者术前鉴别仍是难点, 术者需要多方面评估鉴别这两类病人.
关于XGC和GBC鉴别的术前鉴别, 当前国内外大多数文献局限于肿瘤标志物和影像学特征, 少有文献报道两者实验室指标的差别. 而腹部超声及腹部增强CT是胆囊炎最为常见的术前检查.
构建涵盖人口学、实验室以及影像学特征的模型, 并对连续变量划分最佳临界值.
对病例诊断明确的患者进行筛选, 统计分析XGC和GBC患者存在统计学差异的变量, 对纳入多因素模型的连续变量根据最佳临界值进行二分类转换, 最终构建术前诊断模型.
本研究达到预期目标, 发现XGC和GBC患者在人口学、实验室以及影像学特征存在统计学意义(P<0.05). γ-谷氨酰胺转移酶(γ-glutamyl transpeptadase, GGT)、癌胚抗原(carcinoembryonic antigen, CEA)及平均胆囊壁厚度最佳临界值为3.2 ug/L、28 U/L、10 mm. 验证了CEA及胆囊壁厚度在先前研究中的差异. 创新性得引入GGT以及CEA的最佳临界值.
本研究创新性提出GGT在XGC与GBC间的差异表达, 首次提出鉴别两者的CEA、GGT最佳临界值, 分别为3.2 ug/L、28 U/L. 最终纳入模型的变量, 性别、GGT、癌胚抗原、平均胆囊壁厚度、胆囊壁增厚方式、是否合并胆囊结石以及腹膜后淋巴结肿大.
尽管高准确性的影像学检查和术中冰冻切片仍是鉴别XGC和GBC的最可靠方式, 但是我们仍可以从多方面发现两者存在差异. 如何更科学筛选两者存在差异的变量纳入模型, 如何运用临床模型弥补影像学以及术中冰冻的局限性, 以上都是我们前进的方向.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B, B
C级 (良好): 0
D级 (一般): D, D, D
E级 (差): E
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Zhao F, Lu PX, Yan SX, Wang GF, Yuan J, Zhang SZ, Wang YX. CT and MR features of xanthogranulomatous cholecystitis: an analysis of consecutive 49 cases. Eur J Radiol. 2013;82:1391-1397. [PubMed] [DOI] |
| 2. | Benbow EW. Xanthogranulomatous cholecystitis associated with carcinoma of the gallbladder. Postgrad Med J. 1989;65:528-531. [PubMed] [DOI] |
| 3. | Roberts KM, Parsons MA. Xanthogranulomatous cholecystitis: clinicopathological study of 13 cases. J Clin Pathol. 1987;40:412-417. [PubMed] [DOI] |
| 4. | Kwon AH, Matsui Y, Uemura Y. Surgical procedures and histopathologic findings for patients with xanthogranulomatous cholecystitis. J Am Coll Surg. 2004;199:204-210. [PubMed] [DOI] |
| 5. | Garcea G, Rajesh A, Dennison AR. Surgical management of cystic lesions in the liver. ANZ J Surg. 2013;83:E3-E20. [PubMed] [DOI] |
| 6. | Jordan AR, Becker N, Johren HP, Zimmer S. Early Childhood Caries and Caries Experience in Permanent Dentition: A 15-year Cohort Study. Swiss Dent J. 2016;126:114-119. [PubMed] |
| 7. | 严 焕军, 忻 畅, 卓 奇峰, 陈 磊, 陈 明良. 黄色肉芽肿性胆囊炎与胆囊癌的特征鉴别分析. 中国中西医结合外科杂志. 2016;22:485-487. [DOI] |
| 8. | 郑 渤伟, 李 丹. 黄色肉芽肿性胆囊炎223例诊治分析. 中国中西医结合外科杂志. 2015;21:35-38. [DOI] |
| 11. | Randi G, Franceschi S, La Vecchia C. Gallbladder cancer worldwide: geographical distribution and risk factors. Int J Cancer. 2006;118:1591-1602. [PubMed] [DOI] |
| 12. | Sotil EU, Jensen DM. Serum enzymes associated with cholestasis. Clin Liver Dis. 2004;8:41-54. [PubMed] [DOI] |
| 13. | Yu H, Yu TN, Cai XJ. Tumor biomarkers: help or mislead in the diagnosis of xanthogranulomatous cholecystitis?-analysis of serum CA 19-9, carcinoembryonic antigen, and CA 12-5. Chin Med J (Engl). 2013;126:3044-3047. [PubMed] |
| 14. | Shetty GS, Abbey P, Prabhu SM, Narula MK, Anand R. Xanthogranulomatous cholecystitis: sonographic and CT features and differentiation from gallbladder carcinoma: a pictorial essay. Jpn J Radiol. 2012;30:480-485. [PubMed] [DOI] |
| 15. | Xiao J, Zhou R, Zhang B, Li B. Noninvasive preoperative differential diagnosis of gallbladder carcinoma and xanthogranu-lomatous cholecystitis: A retrospective cohort study of 240 patients. Cancer Med. 2022;11:176-182. [PubMed] [DOI] |
| 16. | Zhou QM, Liu CX, Zhou JP, Yu JN, Wang Y, Wang XJ, Xu JX, Yu RS. Machine Learning-Based Radiological Features and Diagnostic Predictive Model of Xanthogranulomatous Cholecystitis. Front Oncol. 2022;12:792077. [PubMed] [DOI] |
| 17. | 张 旭日, 崔 乃强, 赵 二鹏, 张 毓青, 么 国旺. 45例黄色肉芽肿性胆囊炎临床治疗分析. 中国中西医结合外科杂志. 2011;17:352-354. [DOI] |
| 22. | Fujita H, Wakiya T, Ishido K, Kimura N, Nagase H, Kanda T, Matsuzaka M, Sasaki Y, Hakamada K. Differential diagnoses of gallbladder tumors using CT-based deep learning. Ann Gastroenterol Surg. 2022;6:823-832. [PubMed] [DOI] |
| 23. | Rana P, Gupta P, Kalage D, Soundararajan R, Kumar-M P, Dutta U. Grayscale ultrasonography findings for characterization of gallbladder wall thickening in non-acute setting: a systematic review and meta-analysis. Expert Rev Gastroenterol Hepatol. 2022;16:59-71. [PubMed] [DOI] |
| 24. | Ren J, Chen S, Ye F, Gong X, Lu Y, Cai Q, Chen Y. Exploration of differentially-expressed exosomal mRNAs, lncRNAs and circRNAs from serum samples of gallbladder cancer and xantho-granulomatous cholecystitis patients. Bioengineered. 2021;12:6134-6143. [PubMed] [DOI] |
| 25. | Jamal K, Ratansingham K, Siddique M, Nehra D. Routine histological analysis of a macroscopically normal gallbladder--a review of the literature. Int J Surg. 2014;12:958-962. [PubMed] [DOI] |