修回日期: 2023-10-03
接受日期: 2023-10-23
在线出版日期: 2023-10-28
"黄连-木香-肉豆蔻"(Huanglian-Muxiang-Roudoukou, HMR)组方出自《小儿药证直诀》, 能改善溃疡性结肠炎(ulcerative colitis, UC)临床症状, 采用网络药理学等方法研究其具体的生物学作用机制有助于更好地挖掘中医药资源, 促进中药防治UC的现代化开发与应用.
通过基因表达综合数据库(gene expression omnibus, GEO)中的基因芯片分析结合网络药理学及分子对接方法探究HMR治疗UC的潜在分子机制.
采用GEO数据库获取UC芯片数据, 运用R语言综合分析筛选出疾病差异表达基因, 获得UC的疾病靶标数据库; 利用中药系统药理学数据库与分析平台(traditional Chinese medicine systems pharmacology database and analysis platform, TCMSP)分别检索HMR的活性成分及其作用靶点; 取疾病差异表达基因与药物作用靶点间的交集基因, 通过Cytoscape 3.9.1软件构建"中药-活性成分-疾病-靶点"网络和蛋白互作(protein-protein interaction, PPI)网络并进行拓扑分析, 以此筛选出主要活性成分及核心靶点; 同时利用Metascapes数据库进行基因本体(gene ontology, GO)富集分析和京都基因与基因组百科全书通路(kyoto encyclopedia of genes and genomes, KEGG)富集分析; 最后使用AutoDock vina软件对主要活性成分和核心靶点进行分子对接.
共筛选得到UC差异表达基因967个, HMR活性成分29种, 对应的靶点163个. "中药-活性成分-疾病-靶点"网络中有活性成分24个, 主要活性成分涉及槲皮素、豆甾醇、小檗碱、β-谷甾醇、巴马汀等; PPI网络中有蛋白26个, 核心靶点涉及白介素1β(interleukin-1β, IL-1β)、白介素6(interleukin-6, IL-6)、CC趋化因子配体2[chemokine (C-C motif) ligand 2, CCL2]、肿瘤坏死因子(tumor necrosis factor, TNF)、基质金属蛋白酶9(matrix metallopeptidase 9, MMP9)等; GO富集分析主要涉及脂多糖刺激变化等生物过程, 质膜外侧面等细胞成分, 细胞因子活性等分子功能; KEGG通路分析主要涉及TNF信号通路、核转录因子κB(nuclear factor kappa-B, NF-κB)通路、Toll样受体(toll-like receptor, TLR)信号通路等; 运用分子对接模拟证实排名前5的主要活性成分与核心靶点之间均具有较强的结合活性.
HMR可能是通过槲皮素、豆甾醇及小檗碱等多成分, 作用于IL-1β、IL-6、CCL2等多靶点, 调节TNF信号通路、NF-κB信号通路、TLR信号通路等多条信号通路, 从抗炎和调节肠道免疫等方面发挥对UC的治疗作用.
核心提要: 本研究基于生物信息学与网络药理学方法研究中医经典组方"黄连-木香-肉豆蔻"治疗溃疡性结肠炎的分子机制, 结果显示该组方治疗溃疡性结肠炎的作用机制可能与抑制炎症反应和调节肠道免疫功能有关.
引文著录: 朱文瑞, 王铁烽, 徐洪锋. GEO基因芯片分析结合网络药理学及分子对接技术探析"黄连-木香-肉豆蔻"组方治疗溃疡性结肠炎的分子机制. 世界华人消化杂志 2023; 31(20): 852-862
Revised: October 3, 2023
Accepted: October 23, 2023
Published online: October 28, 2023
Huanglian-Muxiang-Roudoukou (HMR) formula was recorded in the book of "Pediatric Medicine Prescription". It can improve the clinical symptoms of ulcerative colitis (UC). Using network pharmacology and other methods to study its biological mechanism is helpful to better explore the resources of traditional Chinese medicine and promote the modern development and application of traditional Chinese medicine in the prevention and treatment of UC.
To explore the potential molecular mechanism of HMR in the treatment of UC based on gene expression omnibus (GEO) chip data mining, network pharmacology, and molecular docking technology.
The GEO database was used to obtain UC gene expression data. Then, differentially expressed genes were identified using R software. The active components of Myristicae Semen (Roudoukou), Aucklandiae Radix (Muxiang), and Coptidis Rhizoma (Huanglian) were searched by using the traditional Chinese medicine systems pharmacology database and analysis platform (TCMSP) database, and the corresponding targets were identified. The intersections of HMR and ulcerative colitis disease targets were obtained. The "drug-active ingredients-disease-target" network and protein-protein interaction (PPI) network were constructed to screen out the core components and targets using Cytoscape 3.9.1 software. Gene ontology (GO) and Kyoto encyclopedia of genes and genomes (KEGG) enrichment analyses were performed for the intersection targets by Metascapes database. Molecular docking between main active components and core targets was performed using AutoDock vina software.
A total of 967 differential genes were identified, and there were 29 active components and 163 active targets in UC. There were 24 active components in the "drug-active ingredients-disease-target" network, including quercetin, stigmasterol, berberine, beta-sitosterol, palmatine, and so on. There were 26 proteins in the PPI network, including interleukin-1β (IL-1β), interleukin-6 (IL-6), C-C motif chemokine 2 (CCL2), tumor necrosis factor (TNF), matrix metallopeptidase 9 (MMP9), and so on. GO enrichment analysis demonstrated that the intersection targets were mainly concentrated in biological processes such as lipopolysaccharide response, in cellular components such as external side of plasma membrane, and in molecular functions such as cytokine activity. KEGG analysis demonstrated that the intersection targets mainly involved the TNF signal pathway, nuclear factor kappa-B (NF-κB) pathway, Toll-like receptor (TLR) signal pathway, and so on. The results of molecular docking showed that the top five main active components had strong binding ability with the core targets IL-1β, IL-6, CCL2, TNF, and MMP9.
HMR may act on the expression of IL-1β, IL-6, CCL2, and other proteins through quercetin, stigmasterol, berberine, and other active components, regulate the TNF signaling pathway, and play a role in the treatment of UC via many mechanisms such as anti-inflammatory and intestinal immunity regulation.
- Citation: Zhu WR, Wang TF, Xu HF. Exploration of molecular mechanism of Huanglian-Muxiang-Roudoukou formula in treating ulcerative colitis based on gene expression omnibus chip data mining combined with network pharmacology and molecular docking. Shijie Huaren Xiaohua Zazhi 2023; 31(20): 852-862
- URL: https://www.wjgnet.com/1009-3079/full/v31/i20/852.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v31.i20.852
溃疡性结肠炎(ulcerative colitis, UC)是一种以腹痛、腹泻、脓血便等肠道症状为主要临床表现的慢性非特异性肠道炎症性疾病[1]. 目前, UC的西药治疗以5-氨基水杨酸、糖皮质激素、免疫抑制和生物制剂为主, 但长期应用易出现药物不良反应、药物依赖及停药后易复发等问题[2,3], 而类似粪菌移植[4]、干细胞移植[5]等治疗手段多仅在临床起步阶段, 价格昂贵且疗效欠稳定. 中医药治疗UC有其特有的优势[6], 从中医药宝库中挖掘安全有效的UC治疗手段迫在眉睫. "黄连-木香-肉豆蔻"(Huanglian-Muxiang-Roudoukou, HMR)组方出自经典名方豆蔻香连丸, 据记载可用于"治泄泻, 腹痛, 不拘寒热赤白.", 其治疗症状与UC的临床表现大体相符. 进一步通过数据挖掘分析姚乃礼等[7-9]全国名老中医在治疗UC方面的用药规律, 结果发现黄连、木香、肉豆蔻是临证治疗中的高频药物. 姚乃礼教授[10]、谢晶日教授[11]在治疗UC的经验方中, 用HMR以清肠燥湿, 涩肠止泻. 综上所述, HMR是中医药治疗UC的常用药物组合, 但其治疗UC的主要成分及潜在作用机制尚不明确, 导致其在临床中的使用受到限制. 中药复方成分多, 靶点复杂, 既往逐一靶点验证的研究方式太过于繁琐, 需要消耗大量的人力及物力, 无法全面性地探索药物机制. 基因表达谱、网络药理学等技术的出现, 使系统全面分析探索中药治疗疾病的机制实现了可能. 因此, 本文利用基因表达综合数据库(gene expression omnibus, GEO)中的芯片数据挖掘与UC发病相关的特异性表达基因, 获取健康人群和UC患者的核心差异表达基因, 再运用网络药理学和分子对接技术预测HMR治疗UC的可能作用机制, 以期为该组方的进一步研究与临床应用提供依据.
UC差异表达基因分析: 在GEO数据库(http://www.ncbi.nlm.nih.gov/geo/)中以"ulcerative colitis"为关键词检索与UC相关的基因表达谱数据, 选取人类正常样本及UC患者样本均大于10的GEO数据芯片, 下载其对应的结果矩阵(Matrix)与平台注释文件(Platforms), 数据整理分组后导入R软件, 利用Limma包以|lgFC|>1(FC表示差异倍数)、P<0.05为条件筛选出差异表达基因(differentially expressed genes, DEGs), 并分别绘制差异基因火山图和排名前40位差异基因的热图.
1.2.1 HMR中活性成分及靶点筛选: 利用中药系统药理学数据库与分析平台(traditional chinese medicine systems pharmacology database and analysis platform, TCMSP)分别以"肉豆蔻"、"黄连"及"木香"为关键词搜集HMR中各个中药的化学成分, 设定口服生物利用度(oral bioavailability, OB)≥30%和类药性指数(drug-likeness, DL)≥0.18为条件, 筛选出符合条件的活性成分和其所对应的靶点信息. 借助UniProt数据库(http://www.uniprot.org/), 限定物种为"Homo sapiens", 进行基因名匹配及标准化处理.
1.2.2 "中药-活性成分-疾病-靶点"网络的建立: 将筛选得到的药物靶点基因与疾病差异基因相互映射, 得到交集基因, 并查找与之相对应的有效成分, 将搜集到的中药、活性成分、疾病、靶标蛋白中的基因依次输入, 利用Cytoscape 3.9.1软件进行可视化处理, 构建"药物-活性成分-靶点"网络.
1.2.3 蛋白互作网络(protein-protein interaction, PPI)的建立: 将"1.2.2"项得到的交集基因导入STRING(https://string-db.org/)数据库, 物种选择人类, 设置相互作用阈值为"medium confidence(置信度>0.400)", 隐藏没有相互联系的节点, 将蛋白互作关系结果通过Cytoscape3.9.1软件中进行可视化处理, 构建PPI网络, 借助cytoCNA插件进行拓扑结构分析, 计算节点的度值(Degree)、介度中心性(betweenness centrality, BC)和紧密中心性(closeness centrality, CC)值, 并以Degree、BC和CC的中位数值作为节点重要性的量化参考[12,13], 筛选核心靶点.
1.2.4 生物学功能富集分析: 将"1.2.2"项得到的交集基因数据导入Metascape数据库(http://metascape.org/), 设置P<0.01, 限定物种为"Homo sapiens", 进行基因本体论(gene ontology, GO)富集分析和京都基因和基因组百科全书(kyoto encyclopedia of genes and gnomes, KEGG)富集分析.
1.2.5 分子对接验证: 从PDB数据库(http://www.rcsb.org/)中下载核心靶点蛋白质结构, 利用PyMOL 2.2软件除去水分子, 分离原配体, 保存后导入Autodock Tools 1.5.6软件中加氢、计算总电荷、设置原子类型, 保存为"pdbqt"格式. 从TCMSP数据库中下载上述筛选得到的核心成分(配体)的mol2结构, 利用Autodock Tools 1.5.6软件设置可旋转键后保存为"pdbqt"格式文件, 最后利用Autodock-vina 1.1.2软件进行分子对接, 在PyMOL下实现对接结果可视化, 绘制对接相互作用模式图.
统计学处理 采用R4.1.2软件进行数据统计分析, 采用单因素方差分析组间差异, 组间两两比较用最小显著性差异法, P<0.05为差异有统计学意义.
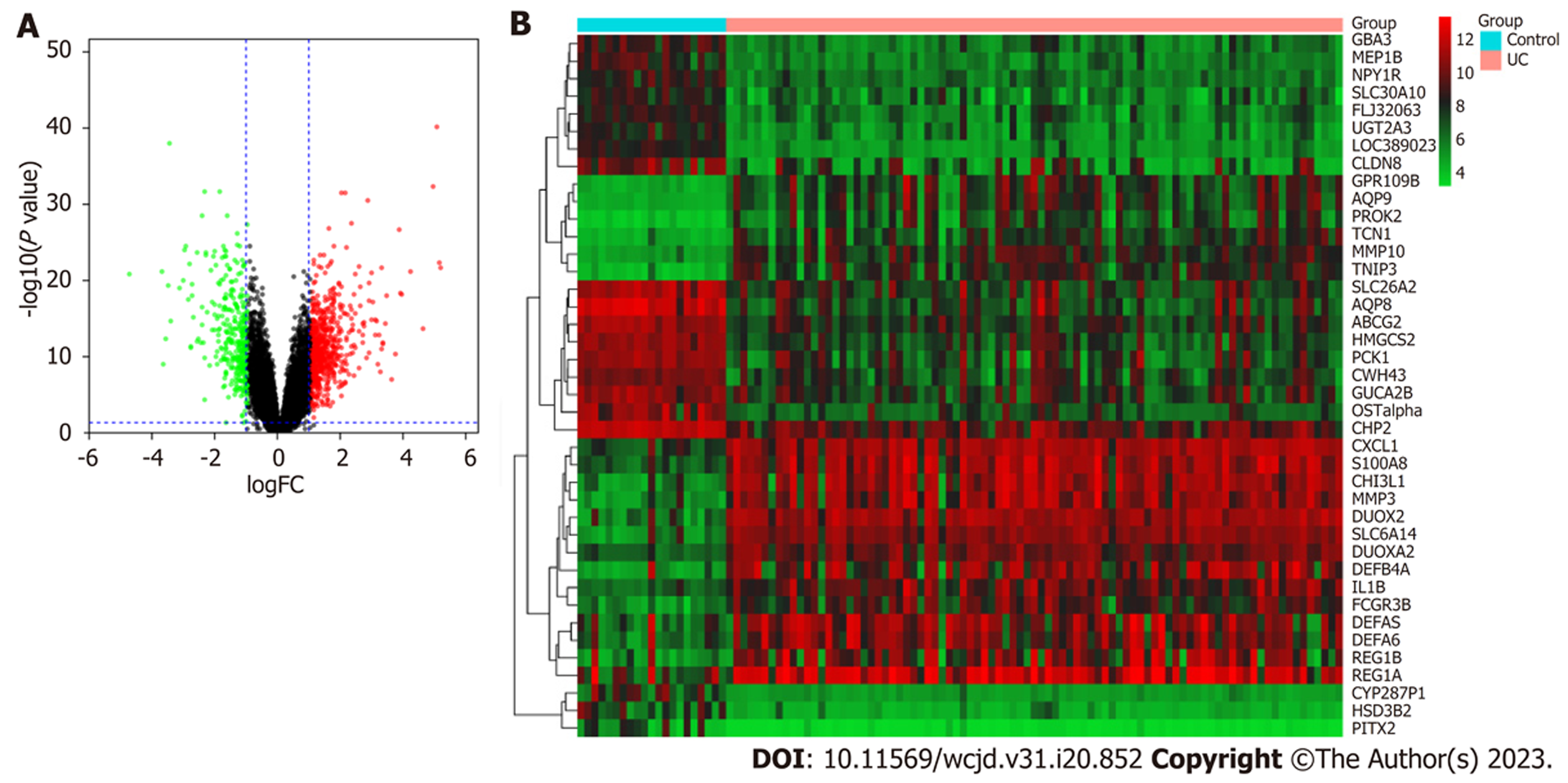
从GEO数据库中选择编号为GSE87473基因表达谱数据. 该芯片数据所采用的平台为GPL13158[HT_HG-U133_Plus_PM] Affymetrix HT HG-U133+PM Array Plate, 包含了21例健康受试者和87例成人UC患者的结肠黏膜组织样本, 以|lgFC|>1、P<0.05为条件共筛选出差异表达基因967个, 其中上调基因619个下调基因348个. 筛选所得差异基因即为UC相关的基因差异基因, UC差异基因的火山图及热图见图1.
根据限定条件, 从TCMSP数据库收集到肉豆蔻主要活性成分9个、木香主要活性成分6个、黄连主要活性成分14个, 共得到HMR的主要活性成分29个, 见表1. 根据筛选所得的活性成分, 获得其所对应的靶点输入UniProt数据库, 删除重复靶点后共得到163个有效靶点基因.
| 编号 | TCMSP编号 | 成分 | OB/% | DL/% | 来源 |
| 1 | MOL009264 | Tetrahydrofuroguaiacin B | 62.86 | 0.32 | 肉豆蔻 |
| 2 | MOL009254 | Galbacin | 61.00 | 0.53 | 肉豆蔻 |
| 3 | MOL009255 | (-)-licarin B | 53.11 | 0.40 | 肉豆蔻 |
| 4 | MOL009265 | Threo-austrobailignan-5 | 49.49 | 0.32 | 肉豆蔻 |
| 5 | MOL009243 | Isoguaiacin | 48.78 | 0.31 | 肉豆蔻 |
| 6 | MOL009259 | Kudos | 45.06 | 0.38 | 肉豆蔻 |
| 7 | MOL009263 | Saucernetindiol | 41.85 | 0.32 | 肉豆蔻 |
| 8 | MOL000358 | Beta-sitosterol | 36.91 | 0.75 | 肉豆蔻 |
| 9 | MOL007920 | Meso-dihydroguaiaretic acid | 31.32 | 0.26 | 肉豆蔻 |
| 10 | MOL010828 | Cynaropicrin | 67.50 | 0.38 | 木香 |
| 11 | MOL000211 | Mairin | 55.38 | 0.78 | 木香 |
| 12 | MOL000449 | Stigmasterol | 43.83 | 0.76 | 木香 |
| 13 | MOL010839 | Lappadilactone | 38.56 | 0.73 | 木香 |
| 14 | MOL000359 | Sitosterol | 36.91 | 0.75 | 木香 |
| 15 | MOL010813 | Benzo[a]carbazole | 35.22 | 0.22 | 木香 |
| 16 | MOL002907 | Corchoroside A_qt | 104.95 | 0.78 | 黄连 |
| 17 | MOL008647 | Moupinamide | 86.71 | 0.26 | 黄连 |
| 18 | MOL000785 | Palmatine | 64.60 | 0.65 | 黄连 |
| 19 | MOL000622 | Magnograndiolide | 63.71 | 0.19 | 黄连 |
| 20 | MOL002903 | (R)-Canadine | 55.37 | 0.77 | 黄连 |
| 21 | MOL000098 | Quercetin | 46.43 | 0.28 | 黄连 |
| 22 | MOL002668 | Worenine | 45.83 | 0.87 | 黄连 |
| 23 | MOL013352 | Obacunone | 43.29 | 0.77 | 黄连 |
| 24 | MOL002897 | Epiberberine | 43.09 | 0.78 | 黄连 |
| 25 | MOL001454 | Berberine | 36.86 | 0.78 | 黄连 |
| 26 | MOL002904 | Berlambine | 36.68 | 0.82 | 黄连 |
| 27 | MOL002894 | Berberrubine | 35.74 | 0.73 | 黄连 |
| 28 | MOL000762 | Palmidin A | 35.36 | 0.65 | 黄连 |
| 29 | MOL001458 | Coptisine | 30.67 | 0.86 | 黄连 |
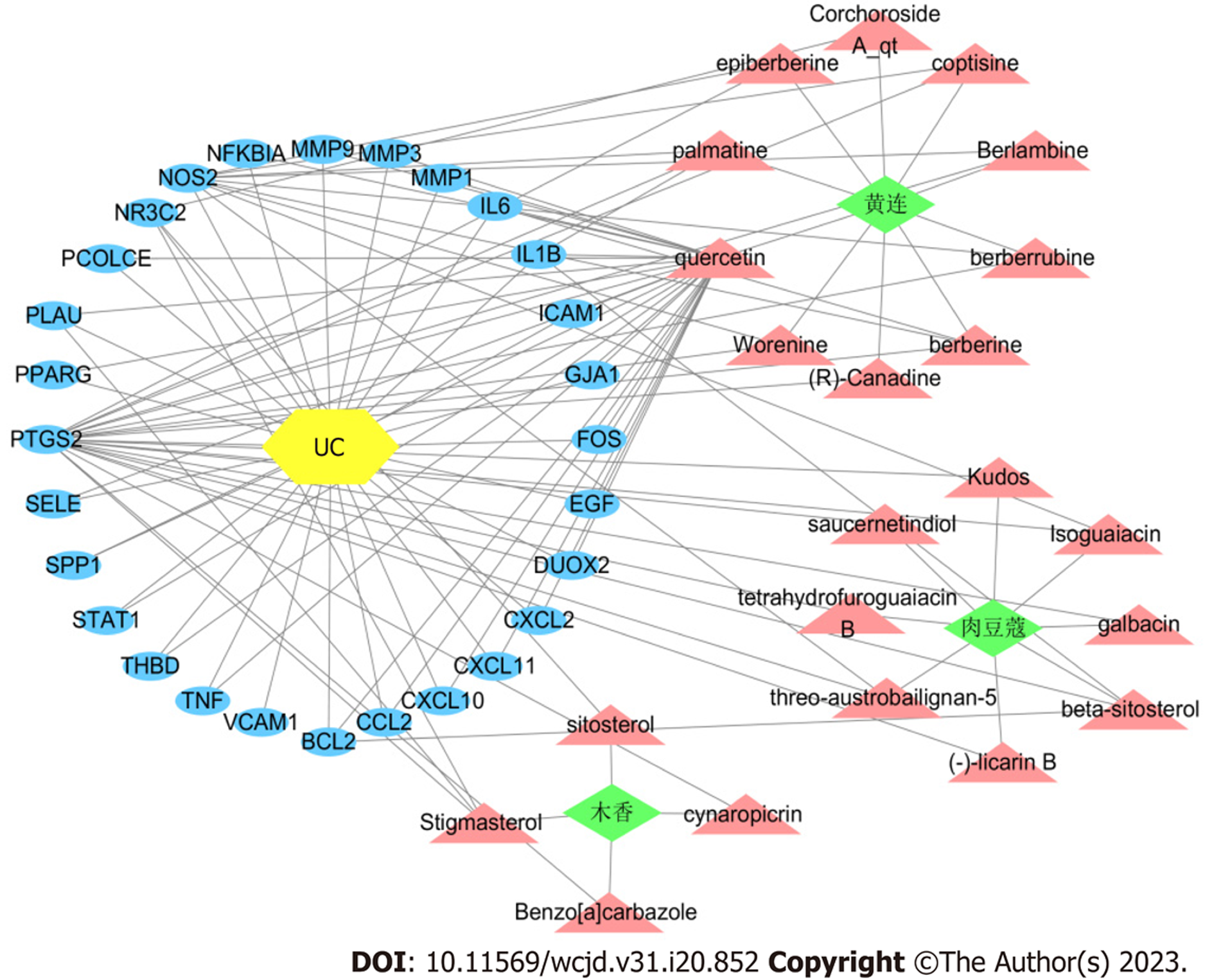
将药物靶点基因与疾病差异基因相互映射, 共得到28个交集基因, 并查找与之对应的有效成分, 共得到24个有效成分, 其中黄连10个、木香6个、肉豆蔻8个. 运用Cytoscape软件构建"中药-活性成分-疾病-靶点"网络, 见图2. 图中共有54个节点和111条边线, 运用网络拓扑结构分析得到各节点Degree值, 其值越大意味着该节点在网络中发挥越重要的作用. 通过计算结果可知: Degree值排名前5位的活性成分为槲皮素(quercetin)、豆甾醇(stigmasterol)、berberine(小檗碱) 、beta-sitosterol(β-谷甾醇)、palmatine(巴马汀).
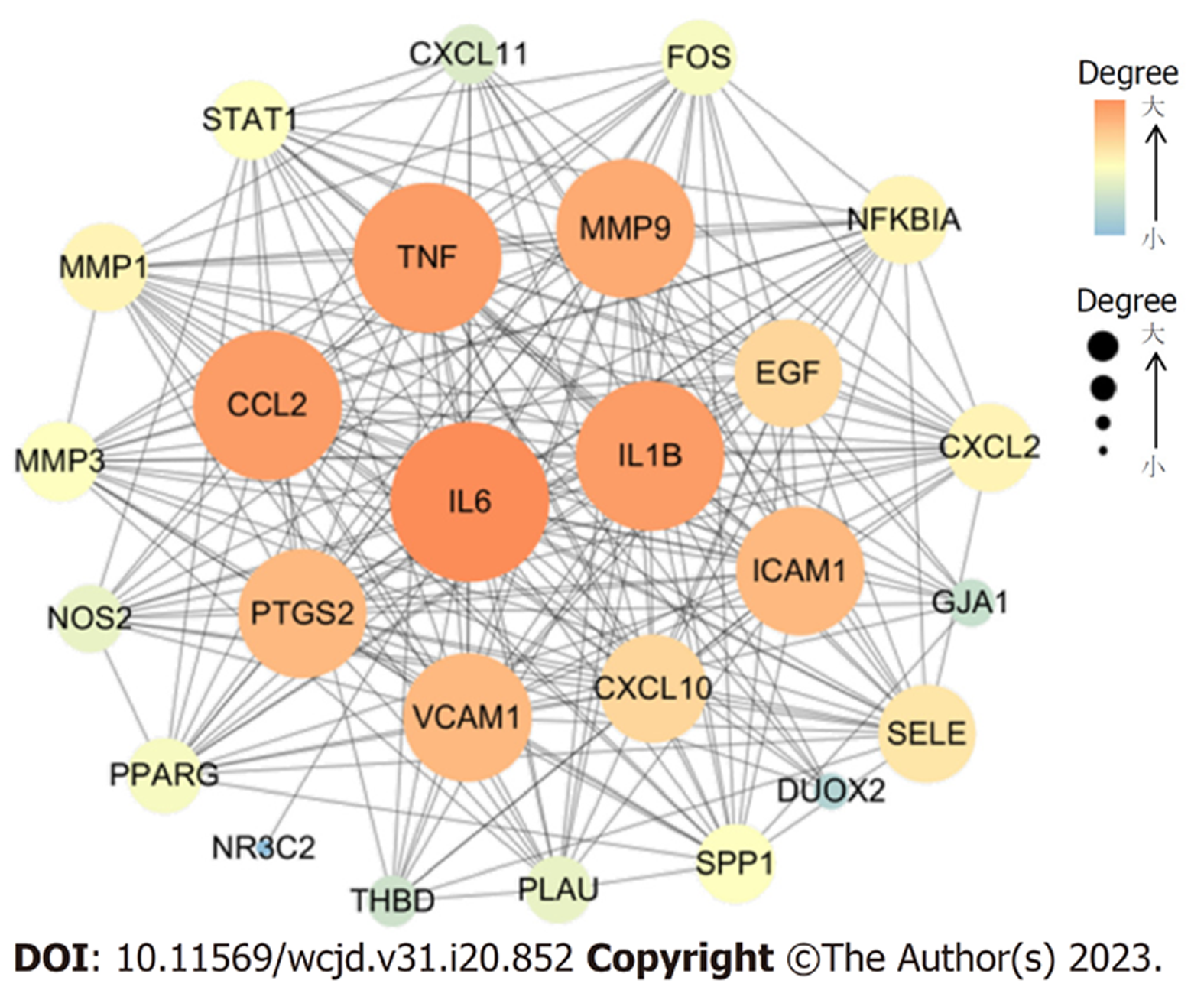
基于STRING数据库(http://www.string-db.org/)分析HMR治疗UC的靶点蛋白之间的相互作用, 得到的PPI网络, 见图3. 通过Cytoscape软件及内置的Cyto NCA模块进行可视化呈现及网络拓扑分析. 图中节点表示靶点蛋白, 边表示蛋白之间的关联, Degree值越大, 则对应的节点越大和颜色越浓. 该PPI网络图中共涉及26个节点、224条边, 经拓扑学分析结果后, 以Degree、BC和CC的均大于其相应的中位数值为条件[12-14], 并按照Degree值由大到小排序, 筛选出白介素1β(interleukin-1β, IL-1β)、白介素6(interleukin-6, IL-6)、CC趋化因子配体2[chemokine (C-C motif) ligand 2, CCL2]、肿瘤坏死因子(tumor necrosis factor, TNF)及基质金属蛋白酶9(matrix metallopeptidase 9, MMP9)共11个核心靶点.
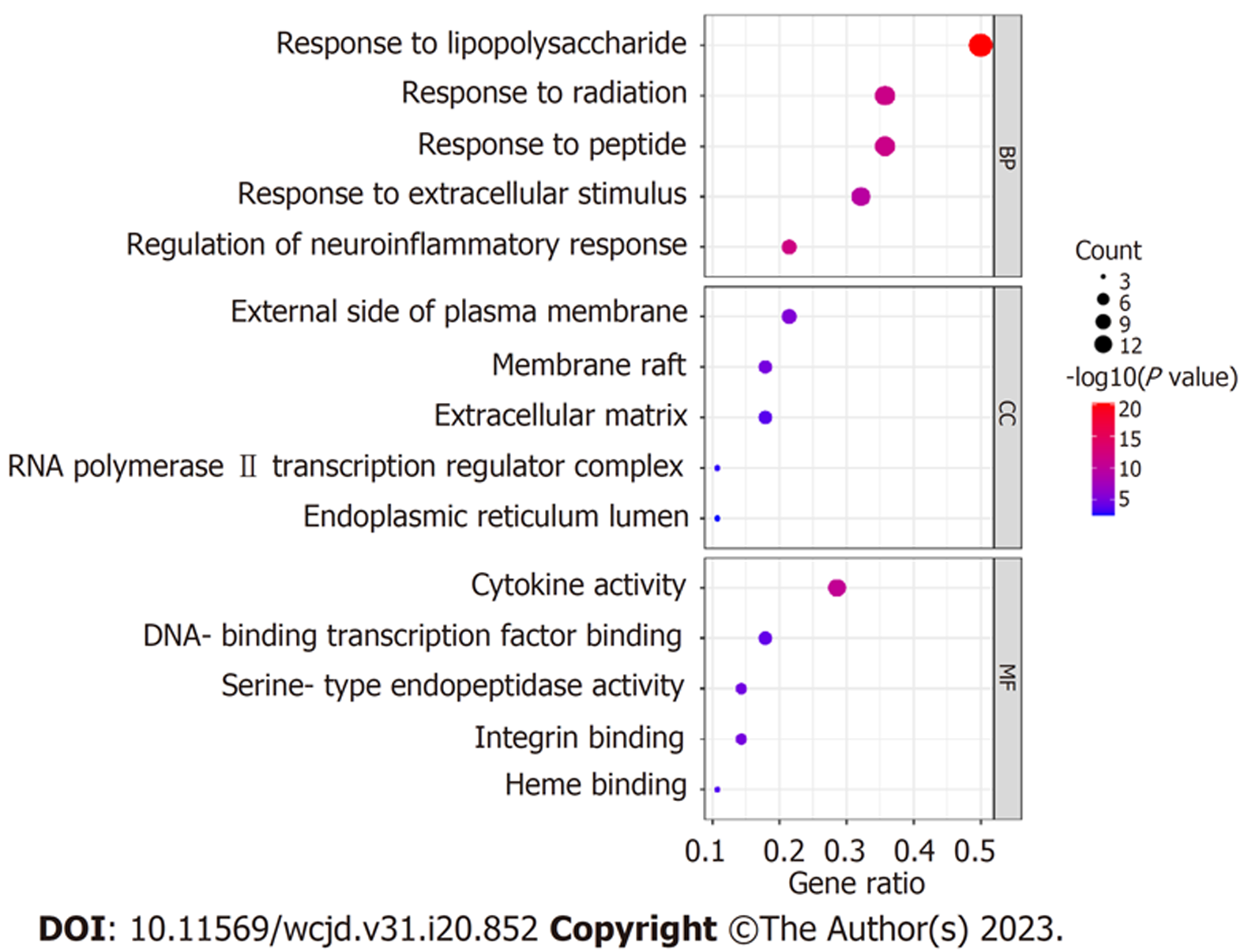
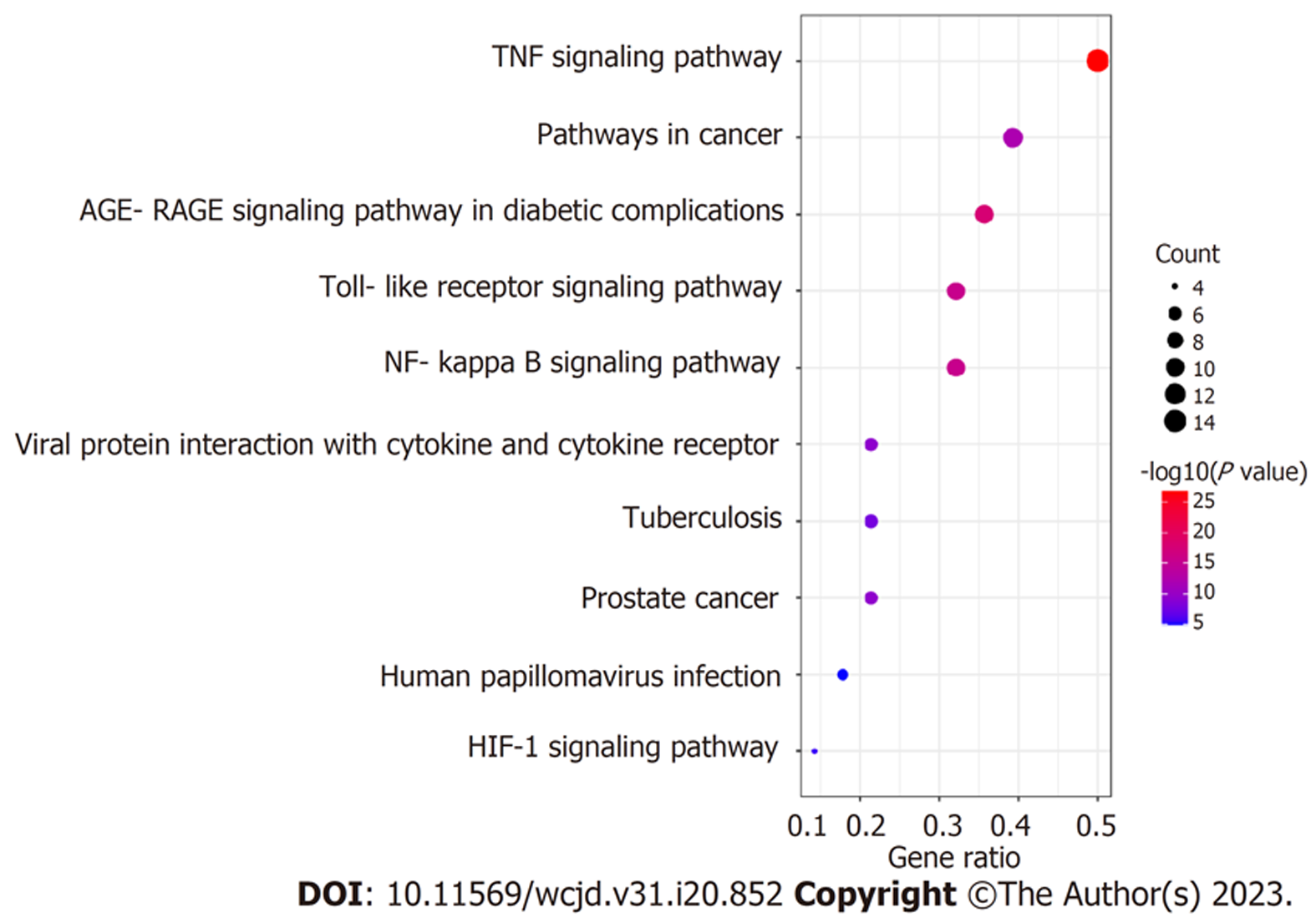
运用Metascape数据库将28个药物靶点基因与UC疾病差异基因的交集基因进行GO功能富集分析, 主要包括生物过程(biological process, BP)、分子功能(molecular function, MF)、细胞组分(cellular component, CC), 筛选各项排列前5的条目所对应靶点具有的功能信息, 绘制气泡图, 见图4. 由图4可知, HMR治疗UC的BP主要涉及脂多糖刺激变化过程、对神经炎症反应调节、对辐射的反应、对肽的反应、对细胞外刺激的反应等; MF主要涉及细胞因子活性、整合素结合、丝氨酸型内肽酶活性、DNA结合转录因子结合、血红素结合等; CC主要涉及质膜外侧面、膜筏、细胞外基质、RNA聚合酶Ⅱ转录调控复合物、内质网管腔等. 运用Metascape数据库进行KEGG功能富集分析, 筛选排列前10的条目所对应靶点具有的功能信息, 绘制气泡图, 见图5. 由图5可知, HMR治疗UC靶点关联的通路主要有TNF信号通路、核转录因子κB(nuclear factor kappa-B, NF-κB)通路、Toll样受体(toll-like receptor, TLR)信号通路等.
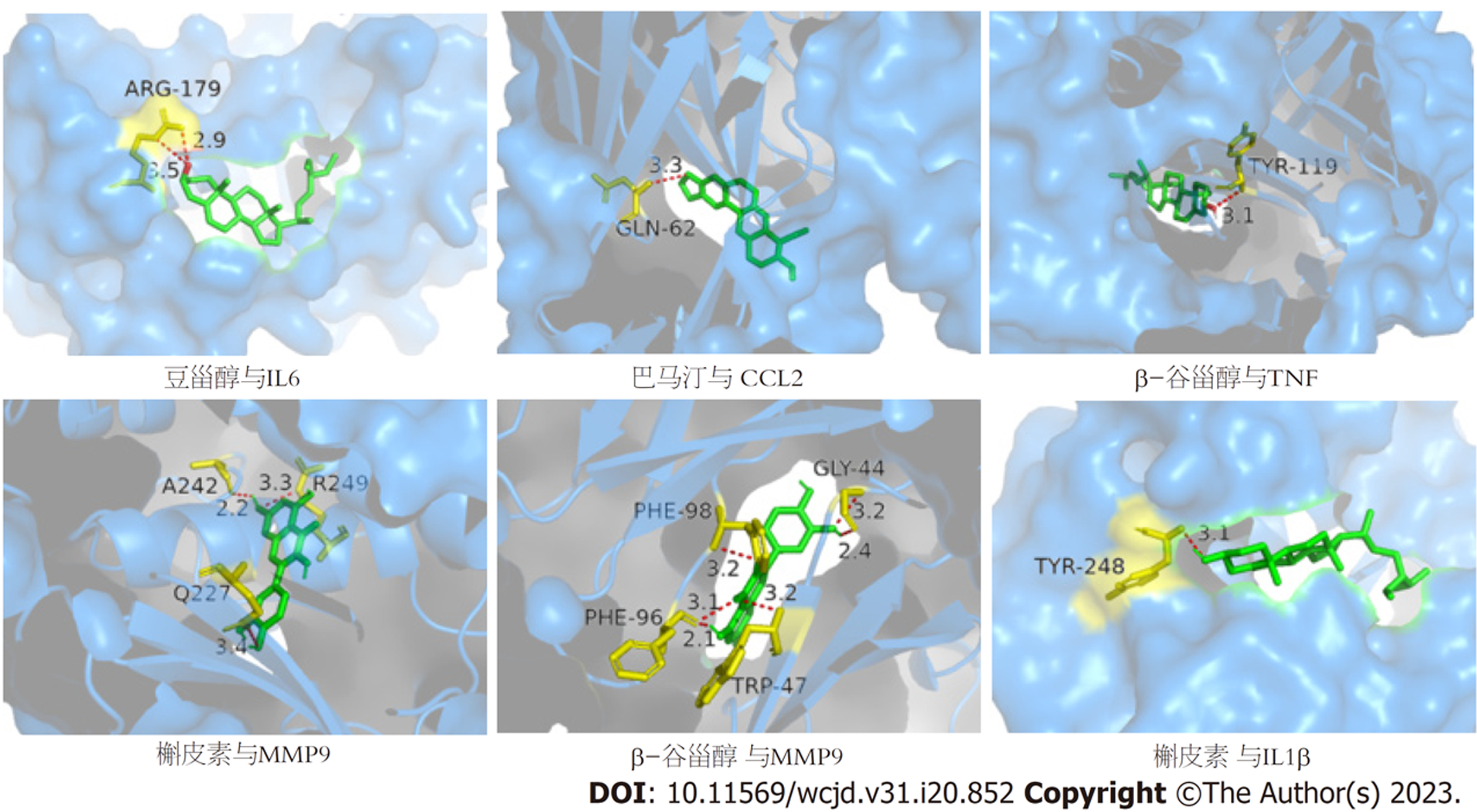
将"2.4"项下"中药-活性成分-疾病-靶点"网络中Degree值排名前5的活性成分, 与"2.5"项下PPI网络中Degree值排名前5的核心靶点进行分子对接, 计算活性成分与核心靶点间的结合能, 结果见表2. 结合能值越小表示结合能越高, 活性成分越容易与蛋白结合, 结合能-5.0 kcal/mol表明两者之间结合活性较好; 小于-7.0 kcal/mol表明两者之间有很强结合活性[15]. 然后再分别选取结合能最低的成分, 并用PyMol软件对其对接结果进行可视化展示, 见图6.
| 靶蛋白 | PDB ID | 最低结合能/(kal•mol-1) | ||||
| 槲皮素 | 豆甾醇 | 小檗碱 | β-谷甾醇 | 巴马汀 | ||
| IL6 | 1ALU | -6.3 | -7.4 | -6.8 | -6.7 | -6.3 |
| CCL2 | 4DN4 | -6.9 | -7.1 | -7.7 | -7.0 | -6.8 |
| TNF | 6OP0 | -8.2 | -6.9 | -8.4 | -9.9 | -8.1 |
| IL-1β | 5R8E | -7.4 | -6.1 | -6.6 | -7.3 | -7.0 |
| MMP9 | 6ESM | -9.8 | -7.4 | -7.8 | -8.3 | -7.6 |
对接结果显示, 槲皮素、豆甾醇、小檗碱、β-谷甾醇、巴马汀与关键靶点IL6、CCL2、TNF、IL-1β、MMP9的结合能均小于-5.0 kcal·mol-1, 说明活性成分与靶点之间具有较好结合活性, 槲皮素与MMP9, β-谷甾醇与TNF的结合能小于9.0 kcal·mol-1, 说明两者之间具有强烈的结合活性. 分子对接可视化分析研究发现, 槲皮素通过氨基酸残基Q227、A242、R249与MMP9形成3条氢键, β-谷甾醇通过氨基酸残基TYR-119与TNF形成1条氢键, β-谷甾醇通过氨基酸残基GLY-44、PHE-96、PHE-98、TRP-47与MMP9形成4条氢键, 并且上述配体化合物均能良好地包埋在受体靶蛋白的活性口袋中.
中药复方具有多成分、多靶点、多通路的作用特点, 传统的药理学方法不能系统阐述其治疗UC的作用机制. 随着生物信息学的迅速发展, 网络药理学因能多系统阐述药理作用机制, 与中医整体观相契合而被广泛应用于中医药治疗疾病作用机制研究[16,17]. 为了更好地挖掘和利用我国丰富的中医药资源, 本文立足于网络药理学方法和分子对接技术系统地探讨HMR治疗UC的物质基础和作用机制.
本研究发现HMR中含有的槲皮素、豆甾醇、小檗碱、β-谷甾醇和巴马汀等为治疗UC的主要活性成分. 研究表明[18], 槲皮素通过诱导紧密连接蛋白修复UC模型小鼠的的肠上皮细胞, 并显著降低肠道炎症损伤; 豆甾醇在结肠炎中通过激活丁酸-过氧化物酶体增殖物激活受体γ轴修复调节性T细胞与辅助性T细胞17平衡, 可抑制模型小鼠血液中炎症细胞增殖, 有效控制结肠组织损伤[19]; β-谷甾醇以浓度依赖的方式降低UC模型小鼠结肠组织中TNF-α、IL-6和IL-1β水平, 并且β-谷甾醇可显著增加肠道上皮细胞抗菌肽的表达, 降低致病菌(含伤寒沙门氏菌等)的存活率[20]; 小檗碱以微生物依赖的方式恢复葡聚糖硫酸钠诱导的UC小鼠炎症, 并且小檗碱通过维持肠黏膜屏障的结构和功能、调节肠黏膜免疫稳态来发挥对结肠的保护作用[21-23]; 巴马汀通过抑制核苷酸结合寡聚化结构域样受体蛋白3炎症小体的活化, 降低UC小鼠结肠中髓过氧化物酶、IL-1β、TNF-α的水平[24]. 以上结果表明从HMR中的筛选得到的多种活性成分在治疗UC方面发挥着重要的作用.
通过PPI网络拓扑分析发现, HMR治疗UC核心靶点有IL-1β、IL-6、CCL2、TNF、MMP9等. 炎症反应是UC病理生理基础, 炎症因子在UC肠道炎症持续过程中发挥着重要作用. 研究发现, UC发病期间IL-1β分泌增加直接介导了UC初期炎症的发生, 且IL-1β分泌过多可激活树突样细胞、促进白细胞介素-2受体过表达, 加重结肠黏膜局部的炎症反应; IL-6分泌增加影响肠上皮细胞电解质分泌紊乱, 介导其他炎症细胞发生炎性反应[26,27]. TNF-α参与细胞免疫炎症反应, 在UC患者受损肠黏膜中呈高水平表达, 诱导结肠上皮细胞大量凋亡, 从而增加肠道上皮细胞通透性[28-30]. CCL2是一种重要的趋化因子[31], 肠道炎症时, 内皮细胞、单核细胞等细胞在TNF-α、IL-1等炎性因子刺激下会大量释放CCL2, 而该趋化因子可高度特异性地激活并趋化淋巴细胞和单核-巨噬细胞等免疫细胞向正常肠黏膜组织聚集, 并促进这些免疫细胞潜入发炎的肠黏膜组织, 进而使肠黏膜发生更严重的免疫炎性损害[32]. 此外, 一项临床发现[33]MMP9在活动性UC患者结肠黏膜中持续高表达, 而活化的MMP9可分解多种蛋白底物, 甚至导致抗TNF药物无效. 近年来有学者提出, 高效且高选择性的MMP抑制剂的研发或将成为UC生物制剂研发的新方向[34]. 上述结果提示PPI网络筛选出的核心靶点在UC的调节炎症反应和免疫应答上有着重要作用, 表明HMR治疗UC主要通过上述多靶点发挥作用.
KEGG富集分析显示, HMR治疗UC主要涉及的通路为炎症反应及肠黏膜免疫相关通路, 如TNF信号通路、NF-κB信号通路、Toll样受体信号通路等. 本研究发现, 在HMR治疗UC中TNF信号通路的基因数富集最多且表达显著. TNF信号通路可通过影响肠黏膜T细胞的活化、增殖, 促进Th1细胞的极化及效应功能, 上调γ干扰素的表达, 从而促进肠黏膜的炎症反应[35]. 同时, 还可作用于辅助性T细胞17使其分泌白介素17(interleukin-17, IL-17)增加, 导致肠黏膜免疫失调引发肠道炎症反应. 此外, TNF信号通路还能激活下游NF-κB通路, 促进IL-lβ、IL-6、IL-17等炎症因子释放[36], 而这些炎症因子又可以反作用于NF-κB信号通路, 调控多种炎症因子相关基因, 进一步加重肠道炎症反应. GO富集分析显示, HMR治疗UC与脂多糖刺激变化等生物过程有关, 且多发生在细胞的质膜外侧面、膜筏、细胞外基质区域, 通过影响细胞因子活性、整合素结合、丝氨酸型内肽酶活性等分子功能发挥作用. 本研究通过GO、KEGG富集分析证明HMR治疗UC是多个分子、多条信号通路对多种细胞生物学行为进行调节的结果.
综上所述, HMR可能是通过槲皮素、豆甾醇及小檗碱等多成分, 作用于IL-1β、IL-6、CCL2等多靶点, 调节TNF信号通路、NF-κB信号通路、TLR信号通路等多种信号通路, 从抗炎和调节肠道免疫等方面发挥对UC的治疗作用. 本次分析结果表明HMR治疗UC的多成分、多靶点、多通路的作用机制, 为今后临床应用和基础研究提供了一定的思路和参考.
溃疡性结肠炎(ulcerative colitis, UC)是一种慢性非特异性炎症性肠病, 常反复发作, 缠绵难愈, 多数需要终身用药维持. 长期使用抗UC药物可引发药物不良反应. 随着中医治疗的发展, 越来越多的中药方剂在治疗UC上展现出了较好的疗效. "黄连-木香-肉豆蔻"(Huanglian-Muxiang-Roudoukou, HMR)是众多名老中医治疗UC的常用组方, 研究其抗UC机制有助于药物开发和推广.
探索HMR治疗UC的作用机制, 以期为该组方的进一步研究与临床应用提供参考.
通过基因表达综合数据库(gene expression omnibus, GEO)中的基因芯片分析结合网络药理学及分子对接方法探究HMR治疗UC的潜在分子机制.
采用GEO数据库获取UC芯片数据, 运用R语言综合分析筛选出疾病差异表达基因, 获得UC的疾病靶标数据库; 利用中药系统药理学数据库与分析平台(traditional Chinese medicine systems pharmacology database and analysis platform, TCMSP)分别检索HMR的活性成分及其作用靶点; 取疾病差异表达基因与药物作用靶点间的交集基因, 通过Cytoscape软件构建"中药-活性成分-疾病-靶点"网络和蛋白互作(protein-protein interaction, PPI)网络并进行拓扑分析, 以此筛选出主要活性成分及核心靶点; 同时利用Metascapes数据库进行进行基因本体(gene ontology, GO)功能分析及京都基因与基因组百科全书(kyoto encyclopedia of genes and genomes, KEGG)通路; 最后使用AutoDock vina软件对主要活性成分和核心靶点进行分子对接.
共筛选得到UC差异表达基因967个, HMR活性成分29种, 对应的靶点163个. "中药-活性成分-疾病-靶点"网络中有活性成分24个, 主要活性成分涉及槲皮素、豆甾醇、小檗碱、β-谷甾醇、巴马汀等; 蛋白互作网络中有蛋白26个, 核心靶点涉及白介素1β(interleukin-1β, IL-1β)、白介素6(interleukin-6, IL-6)、CC趋化因子配体2[chemokine (C-C motif) ligand 2, CCL2]、肿瘤坏死因子(tumor necrosis factor, TNF)、基质金属蛋白酶9(matrix metallopeptidase 9, MMP9)等; GO富集分析主要涉及脂多糖刺激变化等生物过程, 质膜外侧面等细胞成分, 细胞因子活性等分子功能; KEGG通路分析主要涉及TNF信号通路、核转录因子κB(nuclear factor kappa-B, NF-κB)通路、Toll样受体(toll-like receptor, TLR)信号通路等; 运用分子对接模拟证实排名前5的主要活性成分与核心靶点之间均具有较强的结合活性.
通过生物信息学方法筛选及预测, HMR可能是通过槲皮素、豆甾醇及小檗碱等多成分, 作用于IL-1β、IL-6、CCL2等多靶点, 调节TNF信号通路、NF-κB信号通路、TLRs信号通路等多种信号通路, 进而影响UC涉及的炎症、肠道免疫等多种方式, 来发挥改善UC的作用.
基于以上分析, HMR治疗UC是通过多靶点、多通路的, 也提示中药的研究是较为复杂的, 需要从多维度、多靶点进行研究. 基于生物信息学方法, 本研究初步揭示了HMR治疗UC相关靶点之间的复杂关系, 也挖掘了其潜在治疗靶点及可能参与机制. 但对于HMR整体治疗UC的机制仍是初步的, 考虑到具体到临床中的个人更为复杂, 如药物的剂量、煎煮方法、剂型等不同, 会起到不一样的临床疗效. 因此, 基于以上不足, 仍需进一步开展相关的药理学实验, 进一步验证和阐明HMR治疗UC的作用机制.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): D
E级 (差): E
科学编辑: 张砚梁 制作编辑:张砚梁
| 3. | Singh S, Allegretti JR, Siddique SM, Terdiman JP. AGA Technical Review on the Management of Moderate to Severe Ulcerative Colitis. Gastroenterology. 2020;158:1465-1496.e17. [PubMed] [DOI] |
| 6. | 黄 友, 杨 莎莎, 林 夏, 赵 生嘉, 魏 馨怡, 傅 超美, 张 臻. 基于网络药理-分子对接研究附子理中丸治疗溃疡性结肠炎的作用机制. 药学学报. 2020;55:1812-1822. [DOI] |
| 7. | 张 强, 徐 慧慧, 张 润顺, 张 小平, 张 若宣, 吕 文良. 基于方剂计量学与数据挖掘方法探讨姚乃礼教授治疗溃疡性结肠炎临证经验与用药规律分析. 辽宁中医药大学学报. 2020;22:106-110. [DOI] |
| 12. | Huang S, Zhang Z, Li W, Kong F, Yi P, Huang J, Mao D, Peng W, Zhang S. Network Pharmacology-Based Prediction and Verification of the Active Ingredients and Potential Targets of Zuojinwan for Treating Colorectal Cancer. Drug Des Devel Ther. 2020;14:2725-2740. [PubMed] [DOI] |
| 13. | 毛 琳慎, 任 维, 梁 盼, 马 悦, 刘 佳利, 罗 钢, 李 亚琴, 杨 思进. 基于GEO数据库多芯片联合分析与网络药理学探索黄芪治疗心肌缺血再灌注损伤的机制研究. 时珍国医国药. 2021;32:2140-2144. [DOI] |
| 15. | 赖 思佳, 王 达洋, 李 天力, 蒲 凤兰, 王 显. 基于分子对接和网络药理学的五指毛桃-贯叶金丝桃治疗微血管性心绞痛的机制研究. 中国中药杂志. 2021;46:6474-6483. [DOI] |
| 18. | Riemschneider S, Hoffmann M, Slanina U, Weber K, Hauschildt S, Lehmann J. Indol-3-Carbinol and Quercetin Ameliorate Chronic DSS-Induced Colitis in C57BL/6 Mice by AhR-Mediated Anti-Inflammatory Mechanisms. Int J Environ Res Public Health. 2021;18. [PubMed] [DOI] |
| 19. | Wen S, He L, Zhong Z, Zhao R, Weng S, Mi H, Liu F. Stigmasterol Restores the Balance of Treg/Th17 Cells by Activating the Butyrate-PPARγ Axis in Colitis. Front Immunol. 2021;12:741934. [PubMed] [DOI] |
| 20. | Ding K, Tan YY, Ding Y, Fang Y, Yang X, Fang J, Xu DC, Zhang H, Lu W, Li M, Huang SC, Cai ML, Song Y, Ding YJ, Zhang SM. β-Sitosterol improves experimental colitis in mice with a target against pathogenic bacteria. J Cell Biochem. 2019;120:5687-5694. [PubMed] [DOI] |
| 21. | 李 恒, 左 建平, 唐 炜. 小檗碱通过调控溃疡性结肠炎肠道神经免疫炎症保护黏膜屏障损伤. 中国药理学与毒理学杂志. 2019;33:673. |
| 22. | Dong Y, Fan H, Zhang Z, Jiang F, Li M, Zhou H, Guo W, Zhang Z, Kang Z, Gui Y, Shou Z, Li J, Zhu R, Fu Y, Sarapultsev A, Wang H, Luo S, Zhang G, Hu D. Berberine ameliorates DSS-induced intestinal mucosal barrier dysfunction through microbiota-dependence and Wnt/β-catenin pathway. Int J Biol Sci. 2022;18:1381-1397. [PubMed] [DOI] |
| 23. | Fujii A, Okuyama T, Wakame K, Okumura T, Ikeya Y, Nishizawa M. Identification of anti-inflammatory constituents in Phellodendri Cortex and Coptidis Rhizoma by monitoring the suppression of nitric oxide production. J Nat Med. 2017;71:745-756. [PubMed] [DOI] |
| 24. | Mai CT, Wu MM, Wang CL, Su ZR, Cheng YY, Zhang XJ. Palmatine attenuated dextran sulfate sodium (DSS)-induced colitis via promoting mitophagy-mediated NLRP3 inflammasome inactivation. Mol Immunol. 2019;105:76-85. [PubMed] [DOI] |
| 25. | Shimoda M, Horiuchi K, Sasaki A, Tsukamoto T, Okabayashi K, Hasegawa H, Kitagawa Y, Okada Y. Epithelial Cell-Derived a Disintegrin and Metalloproteinase-17 Confers Resistance to Colonic Inflammation Through EGFR Activation. EBioMedicine. 2016;5:114-124. [PubMed] [DOI] |
| 26. | 张 智, 钟 子劭, 余 卫峰, 陈 远方, 黄 穗平. 基于网络药理学探讨葛根芩连汤治疗溃疡性结肠炎的作用机制. 中国中西医结合消化杂志. 2020;28:403-407. [DOI] |
| 27. | Dinallo V, Marafini I, Di Fusco D, Laudisi F, Franzè E, Di Grazia A, Figliuzzi MM, Caprioli F, Stolfi C, Monteleone I, Monteleone G. Neutrophil Extracellular Traps Sustain Inflammatory Signals in Ulcerative Colitis. J Crohns Colitis. 2019;13:772-784. [PubMed] [DOI] |
| 28. | Priem D, Devos M, Druwé S, Martens A, Slowicka K, Ting AT, Pasparakis M, Declercq W, Vandenabeele P, van Loo G, Bertrand MJM. A20 protects cells from TNF-induced apoptosis through linear ubiquitin-dependent and -independent mechanisms. Cell Death Dis. 2019;10:692. [PubMed] [DOI] |
| 29. | 缪 志伟, 徐 艳, 宁 丽琴, 严 晶, 顾 鸣佳, 叶 柏. 白头翁汤治疗溃疡性结肠炎分子机制的网络药理学分析及初步验证. 中国中药杂志. 2020;45:1808-1815. [DOI] |
| 32. | Lopetuso LR, Gasbarrini A. Fighting the Hype for Predictors of Efficacy in Inflammatory Bowel Disease. Inflamm Bowel Dis. 2020;26:764-765. [PubMed] [DOI] |
| 33. | Bai X, Bai G, Tang L, Liu L, Li Y, Jiang W. Changes in MMP-2, MMP-9, inflammation, blood coagulation and intestinal mucosal permeability in patients with active ulcerative colitis. Exp Ther Med. 2020;20:269-274. [PubMed] [DOI] |
| 34. | 唐 舒婷, 廖 桂彬, 龚 嘉倩, 吴 苑, 黄 梦芬, 陈 明榆, 赵 利娜, 陈 斌. 基于网络药理学联合分子对接探析香连丸治疗溃疡性结肠炎的分子机制. 中药新药与临床药理. 2021;32:365-373. [DOI] |
| 35. | 尹 凤荣, 战 蓉蓉, 王 冬, 宋 佳, 李 辉, 张 红, 张 晓岚. TL1A通过调控IL-17和IFN-γ促进慢性实验性结肠炎相关肠纤维化的发生. 中国病理生理杂志. 2020;36:1096-1103. [DOI] |
| 36. | Jarosz-Griffiths HH, Holbrook J, Lara-Reyna S, McDermott MF. TNF receptor signalling in autoinflammatory diseases. Int Immunol. 2019;31:639-648. [PubMed] [DOI] |