修回日期: 2023-08-28
接受日期: 2023-09-01
在线出版日期: 2023-09-08
上消化道出血作为临床常见的消化道疾病之一, 发病率高, 危害性强. 本研究对上消化道出血的再出血、内镜干预和死亡风险预测模型进行综述, 包括研究人群、研究方法、相关风险因素及模型性能等, 以期为临床医护人员尽早开展风险评估, 制订有效预防管理方案, 改善患者生存结局提供参考.
核心提要: 系统阐述了消化道出血的再出血、内镜干预和死亡最新进展的风险预测模型, 包括研究人群、研究方法、相关风险因素及模型性能, 以期为国内急诊及住院护理实践和上消化道出血风险预测模型的构建与验证提供思路.
引文著录: 张诗怡, 朱秀琴, 陈丽红, 何园, 井阿敏. 上消化道出血风险预测模型的研究进展. 世界华人消化杂志 2023; 31(17): 695-704
Revised: August 28, 2023
Accepted: September 1, 2023
Published online: September 8, 2023
Upper gastrointestinal bleeding is a common gastrointes-tinal condition with a high incidence rate and great harm to the body. This paper reviews the rebleeding, endos-copic intervention, and death risk prediction models for upper gastrointestinal bleeding, including the study population, research methods, related risk factors, and model performance, in order to provide reference for clinicians to conduct risk assessment as soon as possible, formulate effective prevention and management plans, and improve patient survival outcomes.
- Citation: Zhang SY, Zhu XQ, Chen LH, He Y, Jing AM. Progress in research of risk prediction models for upper gastrointestinal bleeding. Shijie Huaren Xiaohua Zazhi 2023; 31(17): 695-704
- URL: https://www.wjgnet.com/1009-3079/full/v31/i17/695.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v31.i17.695
上消化道出血(upper gastrointestinal bleeding, UGIB)是指Treitz上方的消化道, 包括食管、胃、十二指肠或胰、胆等病变, 胃空肠吻合术后吻合口附近疾患引起的出血, 根据病因进一步分为非静脉曲张性上消化道出血和静脉曲张性上消化道出血. 上消化道出血作为临床常见的消化道疾病之一, 全球范围内年发病率为48/10万-160/10万, 其病情反复、变化快, 易威胁患者生命安全[1]. 在中国, 急性上消化道出血成年人发病率为100/10万-150/10万, 死亡率为2%-15%[2]. 据报道过去20年, 美国上消化道出血的医疗费用从3.3万亿美元增加到6万亿美元, 占年GDP近20%. 美国胃肠病学会(American College of Gastroenterology, ACG)2021版指南[3]建议, UGIB患者进行早期风险分层以识别高危和低危患者, 指导医务人员采取快速而有效的措施, 合理分配医疗资源, 最终改善患者生存结局. 目前, 国内外使用的上消化道出血风险预测工具繁多, 各种工具有效评估指标各异, 评估内容及适用人群不统一, 造成预测结果与预后存在差距. 鉴于此, 本研究对目前国内外上消化道出血风险预测模型进行总结、分析, 以期为国内急诊及住院护理实践和上消化道出血风险预测模型的构建与验证提供思路.
上消化道出血患者面临各种风险, 如再出血风险、干预需求、死亡风险等. Logsitic回归或Cox比例风险回归是构建模型的常用方法. 近年来, 人工智能也开始应用于预测模型构建.
因其便利性和可操作性, 量表被临床广泛用于预测、评估上消化道出血预后工具. 根据是否需要内镜检查结果可以分为两类, 第一类需要内镜结果: (1)Forrest分级评分(表1), 分为Ⅰa、Ⅰb 、Ⅱa、Ⅱb和Ⅲ, 分别对应再出血率为5%-55%. 指南[4]指出内镜检查时对出血性病变应行Forrest分级, 评估出血风险; (2)Rockall出血和死亡危险性评分(表2), 简称RS, 预测消化道出血病人死亡与再出血的可能性. 评分范围0-11分, 其中高危5-11分, 中危3-4分, 低危0-2分. 第二类不需要内镜结果: (1)The Baylor出血积分量表(表3), 评分范围0-24分, 用于非静脉曲张性上消化道出血(non-variceal upper gastro intestinal bleeding, NVUGIB)再出血风险预测; (2)Blatchford入院危险性积分(表4), 简称GBS. 主要用于评估病人首次就诊时是否需要住院或接受止血干预措施, 如内镜干预或输血等. 2019年国际共识组[5]指南中建议, 对于NVUGIB患者应使用GBS识别再出血率或死亡率风险极低的患者; (3)Cedars-Sinai Medical Center预后指数(表5), 简称CSMCPI. 预测患者住院期间的死亡风险、手术需求程度及再出血风险; (4)AIMS65评分量表(表6), 其临界值较高, 主要用来识别高危患者, 而识别低危患者的特异性较差. 当AIMS65量表评分≥2分时, 可认为患者死亡风险较高.
| Forrest分级 | 溃疡病变的内镜下表现 | 再出血率% |
| Ⅰa | 喷射样出血 | 55 |
| Ⅰb | 活动性出血 | 55 |
| Ⅱa | 血管显露 | 43 |
| Ⅱb | 附着血凝块 | 22 |
| Ⅱc | 黑色基底 | 10 |
| Ⅲ | 基底洁净 | 5 |
| 变量 | 0分 | 1分 | 2分 | 3分 |
| 年龄(岁) | <60 | 60-79 | ≥80 | |
| 休克状况 | 无休克 | 心动过速 | 低血压 | |
| 伴发病 | 无 | 心力衰竭、缺血性心脏病和其他 | 肝功能衰竭、肾衰竭和肿瘤播散 | |
| 重要伴发病 | ||||
| 内镜诊断 | 无病变, Mallory-Weiss综合征 | 溃疡等其他病变 | 上消化道恶性疾病 | |
| 内镜下出血征象 | 无或有黑斑 | 上消化道血液潴留, 黏附血凝块, 血管显露或喷血 |
| 计分 | 胃镜前积分 | 胃镜积分 | |||
| 年龄(岁) | 合并疾病数 | 合并病严重性 | 出血部位 | 出血征象 | |
| 0分 | <30 | 无 | |||
| 1分 | 30-49 | 1种或2种 | 凝血块 | ||
| 2分 | 50-59 | ||||
| 3分 | 60-69 | 血管残端显露 | |||
| 4分 | 3种或4种 | 慢性病 | 球后壁出血 | ||
| ≥70 | ≥5 | 急性病 | 活动性出血 | ||
| 项目 | 分数 |
| BUN, mmol/L | |
| 6.5-7.9 | 2 |
| 8-9.9 | 3 |
| 10-24.5 | 4 |
| ≥25.0 | 6 |
| 血红蛋白, 男(g/L) | |
| 120-129 | 1 |
| 100-119 | 3 |
| <100 | 6 |
| 血红蛋白, 女(g/L) | |
| 100-119 | 1 |
| <100 | 6 |
| 收缩压, mmHg | |
| 100-109 | 1 |
| 90-99 | 2 |
| <90 | 3 |
| 其他 | |
| 脉率≥100 bpm | 1 |
| 黑便 | 1 |
| 晕厥 | 2 |
| 肝脏疾病 | 2 |
| 心力衰竭 | 2 |
| 总分 | 23 |
| 计分 | 胃镜 | 出血到住院时间 | 血循环 | 合并病数目 |
| 0分 | 仅溃疡, 无出血M-W撕裂、糜烂, 无异常 | ≥48 h | 稳定 | 无或1种 |
| 1分 | 有扁平斑点或凝血块溃疡, 有SRH的糜烂、血管畸形 | <48 h | 不稳定 | 2种 |
| 2分 | 血管残端显露或SRH的溃疡 | 住院期间出血 | 休克 | 3种 |
| 3分 | ≥4种 | |||
| 4分 | 持续出血、静脉曲张、癌症 | |||
| 项目 | 分数 |
| 白蛋白 | 1 |
| INR>1.5 | 1 |
| 精神状态改变 | 1 |
| 收缩压≤90 mmHg | 1 |
| 年龄>65岁 | 1 |
Stanley[6]等的一项国际大规模多中心的研究, 对AIMS65、RS、GBS评估量表在评估上消化道出血患者中的预测准确性和临床实用性进行比较, 结果GBS评分在预测内镜治疗(ROC 0.75)方面优于AIMS65(0.62)和RS评分(0.61), AIMS65评分(0.77)在预测死亡率方面最佳, 均优于GBS评分(0.64). AIMS65评分≥2分, RS评分≥5分为预测死亡率最佳截断值, 其敏感性为65.8-78.6%, 特异性为65.0%-65.3%, 三种评分均不能准确预测再出血风险. 而国内学者卢学峰等[7]同样比较三种量表, 报告称AIMS65和RS可以准确预测AUGIB患者院内死亡、再出血、需要非药物止血干预、需要输血四个预后结局的发生风险. GBS仅能有效地预测需要非药物止血干预、需要输血结局的发生风险, 无法对院内死亡及再出血的发生进行准确预估. Benedeto-Stojanov等[8]研究结果则不同, 发现RS、CSMCPI和GBS均能够准确预测院内死亡率(AUC>0.9), 但CSMCPI优于其他两个量表, CSMCPI增加1分, 死亡率高6.3倍. 由此可见, 虽然上述量表均为成熟量表, 但由于不同研究间异质性较高, 因此传统量表针对不同预后结果预测准确性不足, 尚需前瞻性多中心的大型队列研究或者Meta分析进一步探索.
2021年奚黎婷[9]构建SHEA风险评分系统. 研究采用回顾性研究方法, 调查686例急性非静脉曲张性上消化道出血(acute nonvariceal upper gastrointestinal bleeding, ANVUGIB)患者临床相关资料, 构建Logistic回归分析方程: Logit P = 2.499-0.032×SBP-0.035×Hb+1.799×(ASA分级>3级)+1.944×有血凝块+2.039×有血管裸露+2.320×有活动性出血. 在建模组和验证组中, AUC值分别为0.892、0.915; H-L检验卡方值分别为0.934、0.871, 提示具有高区分度和校准度. 为方便计算, 该研究将构建的回归模型转换为风险评分系统, 总分范围为0-52分. 根据截断值将SHEA评分≥20分的患者定义为高危患者, 0-20分为低危. SHEA评分的AUC为0.882, 敏感度为0.862, 特异度为0.765. 该评分的优势在于选择临床上常用的客观变量首次建立ANVUGIB风险评分系统, 并且计算简便, 有利于临床医务人员风险分层并制定个性化干预措施. 但本研究为单中心回顾性研究, 且未对构建的再出血预测模型及SHEA风险评分进行外部验证. 因而, 该研究仍需进行大量多中心、前瞻性研究验证其临床实用性和有效性. 同年, 庄杨萍[10]构建了AUGIB风险预测模型, 模型公式为Logit P = -1.461+0.13乳酸+0.81血浆D-二聚体-0.005 血小板, 其AUC、截断值、灵敏度、特异度分别为0.728、0.152、0.563和0.854, 表明预测能力中等. 与奚黎婷研究相比, 庄杨萍研究适用各种病因引起上消化道出血患者, 涵盖人群更加广泛, 并且评估因素均为实验室指标, 不涉及内镜检查结果, 有利于快速评估. 但该模型灵敏度较低, 存在延误高危患者诊治的可能性. 此外, 模型仅开展横断面调查, 未进行内部和外部验证, 因此其临床使用效果如何尚需要其他研究予以确定.
该模型主要适用人群为老年人. 老年患者是消化道再出血的高危人群, 而急诊胃镜检查因其有创性、侵入性操作的特点, 对于多数老年人存在限制. 金珊珊等[11]于2022年回顾性的分析161例老年ANVUGIB患者, 重点探讨了临床表现和实验室结果与再出血风险的关系. 模型公式为Logit P = 2.411×抗血小板药物+0.917×GBS评分-0.269×白蛋白(ALB)-2.735×纤维蛋白原(FIB)-3.149. 预测模型对应的AUC为0.979, 截断值为0.912, 此时模型特异度为97.7%, 敏感度为93.5%. 使用Bootstrap自举法内部验证, C指数为0.986, 表明模型的预测效果理想. 但该模型还有待改善, 其纳入的样本量相对较少, 均来自同一研究中心, 存在选择偏倚. 其次, 模型直接用回归系数进行计算, 在临床上不易使用. 此外, 模型纳入人群为老年患者, 故其是否适用于其他人群, 值得进一步探讨.
Wong等[12]2019年回顾性分析了22854例患者包括人口统计学、实验室检验、相关诊断、药物等相关临床资料, 以建立消化道溃疡再出血IPU-ML机器学习模型. 在模型构建中, 机器学习可以对结构化数据(诊断代码、人口统计学等)及非结构化数据(主诉、病例中的自由文本数据等)进行观察描述并挖掘他们之间可能的关系, 以此开发出可以辅助临床决策或患者结果的预测模型. 过拟合化是指在建模组中表现出色但在验证组中表现糟糕的情况, 为解决机器学习常见过拟合化的难题, 该研究应用Elastic Net回归, 在连续路径下同时选择变量并优化模型性能. 最终的IPU-ML模型基于六个参数: 年龄, 基线血红蛋白, 胃溃疡, 胃肠道疾病、恶性肿瘤和感染. 当我们将IPU-ML临界值设置为0.20时, 27.5%的患者被归类为再出血的高风险, 敏感度为41.4%, 特异度为74.6%, 阴性预测值为91.1%. 在验证队列中, IPU-ML确定了1年内消化道溃疡再出血患者AUROC为0.775, 总体准确率为84.3%. 与其他研究相比, 该模型应用场景包括急诊、ICU、普通病房, 直至出院的整个治疗阶段, 具有广泛适用性. 然而该队列中研究对象都存在幽门螺杆菌感染, 因此IPU-ML模型在幽门螺杆菌感染率较低的其他国家或地区, 可对"初始模型"进行再校准并进行临床验证.
综上, 国内消化道再出血风险预测模型的研究尚在起步阶段, 对模型结果进行转化和应用较少, 提示今后应更加注重模型内部、外部验证以及在临床上的转化、应用等方面的综合探讨. 另外国外关于再出血的模型构建较少, 仅对再出血的危险因素探究. 土耳其学者Tatlıparmak指出[13]癌症、血小板分布宽度和总蛋白水平是发生再出血的显著危险因素, 还有待更多学者关注此领域进行进一步研究.
2020年, 西班牙学者Redondo-Cerezo[14]等通过前瞻性研究法和logistic回归法构建预测上消化道出血干预需求的评分系统, 称为MAP(ASH)评分系统. 该模型中"干预"是指复合终点包括内镜治疗(介入治疗或手术)以及输注红细胞. 该模型采集547例患者的人口统计学数据、合并症、药物、临床表现、血流动力学参数和入院实验室检查和内镜检查结果, 随访30天时间, 找出了6个显著的影响因素: 精神状态受损(GCS<15分)、脉搏>100次/分、ASA评分>2、收缩压<90 mmHg、白蛋白<2.5 g/dL和血红蛋白<10 g/dL. 根据OR值将预测结果赋值1或2分, 前3个变量分别赋值为1分, 后3个变量分别为2分, 评分范围为0-9分, 将MAP(ASH)评分系统分为低风险(0-1分)、中风险(2-5分)和高风险(≥6分). 模型在内部验证时ROC为0.83. 此外模型在美国、英国、丹麦等多个国家医疗机构的3012例患者中进行了外部验证, ROC曲线下面积为0.82, 提示该模型预测区分度高. 并且其模型预测因素无论医院规模大小都简单易得. 2021年, 日本学者Sasaki等[15]将该模型在日本医疗机构进行了外部验证, 其AUC为0.64, 预测性能有待提高. 因此, 在选用模型时需要进行本土化的验证, 并对模型进一步优化后应用.
在2008年有研究探索人工神经网络在上消化道出血预测模型中的作用. 人工神经网络(artificial neural network, ANN)是机器学习算法中的一种, 它使用非线性统计分析输入变量和输出变量之间难以识别的关系, 可克服传统人工智能方法对于直觉信息处理方面的缺陷[16]. Das等[17]通过前瞻性研究法, 最终构建神经网络模型, 结局指标是内镜治疗. 在神经网络模型中, 使用21个输入变量来预测结果变量: 按重要性降序排列. 排名前5名的分别为: 休克, 低血压, 直立生命体征, 呕血, 便血. 选择在不同医院患者群体中对ANN模型进行外部验证, 预测AVUGIB患者内镜治疗的敏感度和特异度分别为94%和48%, ROC曲线下面积为0.78. 然而该研究纳入的建模数据为1998年的回顾性数据, 病历未进行电子化, 存在偏倚风险. 此外模型特异度低, 说明预测"阴性无病"患者能力有所欠缺, 这会导致过度浪费医疗资源, 造成患者无端的恐慌和焦虑, 因此不推荐在临床单独使用.
2020年, Shung等[18]开发了一个基于机器学习算法的预测模型, 以识别消化道出血需要医院干预(包括输注红细胞、内镜治疗干预)或死亡(30天全因死亡率)的复合终点. 通过专家组确定的9个预测因子使用逻辑回归(ridge、lasso、Elastic Net)、线性支撑向量机、神经网络、决策树模型(随机森林和极度梯度增强)7种机器学习算法, 采集1958例患者临床相关资料构建预测模型, 并基于6项性能指标比较, 选出具有最佳预测性能的模型. 研究结果显示, 极度梯度增强算法在整体表现上为最优算法, 也在验证组中表现出较好的预测性能, 纳入的风险因素为性别、合并症、ASA评分、药物、收缩压等. 美欧患者数据用于构建模型, 共1958例, 并应用十倍交叉验证进行内部验证; 亚太地区399例患者进行外部验证, 模型的AUC为0.90. 该研究结果通过网络应用开发方式转化为基于网络的在线预测风险计算器(https://dshung.shinyapps.io/UGIB_App_USA/; https://dshung.shinyapps.io/UGIB_App_INTL/), ML模型将自动识别UGIB患者, 其性能优于传统的回归模型. 然而, 该模型需要纳入的风险因素多, 全面收集资料困难, 因此目前不适合急诊预检分诊或紧急救治. 美国Kim等[19]发表针对研究的述评, 认为基于机器学习的算法是缺乏可解释性的"黑匣子", 仅能辅助医护人员识别出高风险患者, 而不能解释如何排除混杂因素. 因此, 在未来开发出一个解释性强的机器学习模型具有重要价值.
临床上目前常用Child-Pugh、MELD评分判断肝硬化急性上消化道出血患者死亡风险. Child-Pugh评分1964年由Child及Turcotte提出, 包括肝性脑病、腹水、胆红素、白蛋白、凝血酶原时间五个风险因素[20]. 其优点是计算简单、数据较容易得到. 但是Child-Pugh评分系统仍然存在局限性, 比如肝性脑病及腹水不是客观指标, 且容易受到利尿剂等治疗的影响. MELD是基于终末期肝病的患者提出的评分系统[21], 现在广泛用于评估肝移植患者的优先次序, 后有研究证明[22]其在肝硬化上消化道出血患者预后也较好的预测价值. MELD评分局限性在于算法复杂, 限制了其在临床中的广泛应用. 在此背景下, 针对肝硬化上消化出血死亡风险预测的评分系统被开发. 2015年Johnson等[23]基于日本的1313名肝细胞癌患者建立ALBI模型, 该模型公式为0.66×lg[血清总胆红素]-0.085×[血清白蛋白], 根据公式得分将患者分为低危组(≤-1.39分)和高危组(>-1.39分). Xavier[24]研究结果显示ALBI、Child-Pugh和MELD评分ROC曲线下面积分别为0.71、0.64和0.66, 表明ALBI评分预测性能较好. ALBL所需指标简单, 可以在更短时间内对患者进行评估. 但ALBI模型也存在其局限性, 第一, 由于本研究的回顾性性质, 不应忽视患者选择偏倚和数据缺失. 第二, 无法进行长期随访. 因此, 本研究不能评估ALBI在预测长期进展中的作用.
2019年, Bai等[25]纳入中国八个省市的13个中心肝硬化急性上消化道出血患者, 开展多中心研究. 将患者随机分为训练组和验证组, 通过Logistic回归分析确定院内死亡独立预测因子, 并建立新预后模型CAGIB评分. 该评分系统的计算公式 = 糖尿病×1.040+肝癌×0.974+总胆红素×0.005-白蛋白×0.091+谷丙转氨酶×0.001+肌酐×0.012 -3.964. 结果显示ROC曲线下面积为0.714, 高于Child-Pugh评分(0.693)和MELD评分(0.662). 中国学者赵艳[22]针对GAGIB评分进行了外部验证, 研究结果显示, Child-Pugh评分、CAGIB评分、MELD 评分对于肝硬化上消化道急性出血的预后评估均具有较好的价值, AUC值均大于0.7. CAGIB评分不能与上消化道出血的常规评分系统(如Rockall, GBS和AIMS65评分)进行比较, 这是其主要局限性.
2021年Matsuhashi等[26]应用回归性研究法以日本6所医院的1380例NVUGIB患者作为研究对象, 共纳入7项(即Charlson合并症指数、院内发作、白蛋白、精神状态改变、ECOG-PS评分、类固醇和再出血)危险因素. 统计学方面采用logistic回归, 并应用SPSS及R软件构建模型. 内部与外部验证的C统计量分别为0.91和0.80, 具有出色的预测能力. 每个因素的回归系数做整数化处理, 赋予不同分值, 转换为CHAMPS-R评分, 评分范围是0-7分. 根据住院死亡率, 将患者分为低风险, 中风险和高风险类别, 以3分为截断值, 患者死亡风险较高(24.4%). 此外, 该研究开发了英文和日文版CHAMPS评分的移动应用程序, 在IOS和Android系统均能免费下载. 免费应用程序的开发实现了"互联网+医疗"的有力结合, 能够较精准、快速地预测个体住院的死亡风险, 提高了预测模型的科学性和先进性. 但该应用程序仍有待完善, 如缺乏外部验证结果, 其临床应用价值仍需要进一步研究考证.
北京协和医学院博士刘霜[27]于2021年进行前瞻性多中心大样本的研究, 纳入全国各地20所三级医院的1072例AUGIB患者, 以Logistics回归为基础构建动态模型, 预测进入急诊的AUGIB患者90 d的死亡率. 研究创建了两套模型, 分别为hibag.1(入院时评估)和hibag.2(入院48 h内评估), 并与国际现有评分比较. hibag.1风险因素为血红蛋白、INR、年龄等9项, ROC为0.77、0.78. hibag.2的风险因素为胃肠道肿瘤、未行胃镜、气管插管、入院48 h内出现肺水肿、血管升压药、静脉曲张出血等11项, ROC为0.81、0.77. 两个评分预测性能均优于RS、AIMS65评分. hibag.1评分0-25分, 与评分≥5分(死亡率15.56%)和评分≥10分(死亡率≥44.29%)的患者相比, 4分以下患者住院死亡率为4.10%; hibag.2评分为0-19分, 当评分>10分时, 死亡率为100%. 通过两个时间节点的评估可以对患者的预后做出较为准确且完整的预测, 及早进行有效的医患沟通. 但研究仍存在以下不足. 研究表明[28], 肝素可使上消化道出血患者的死亡风险增加三倍, 而本文中由于患者均从急诊入院, 使用抗凝药物极为罕见, 这可能会影响危险因素的纳入. 另外, 研究对象均为中国患者, 其在世界其他国家和地区预测的有效性有待进一步验证.
列线图是现代医学决策的重要组成部分, 已被证明比预测预后的常规模型更准确. 列线图顶端分值线为0-10分, 各预测因素通过垂直线在列线图顶端分值线上取对应分值.
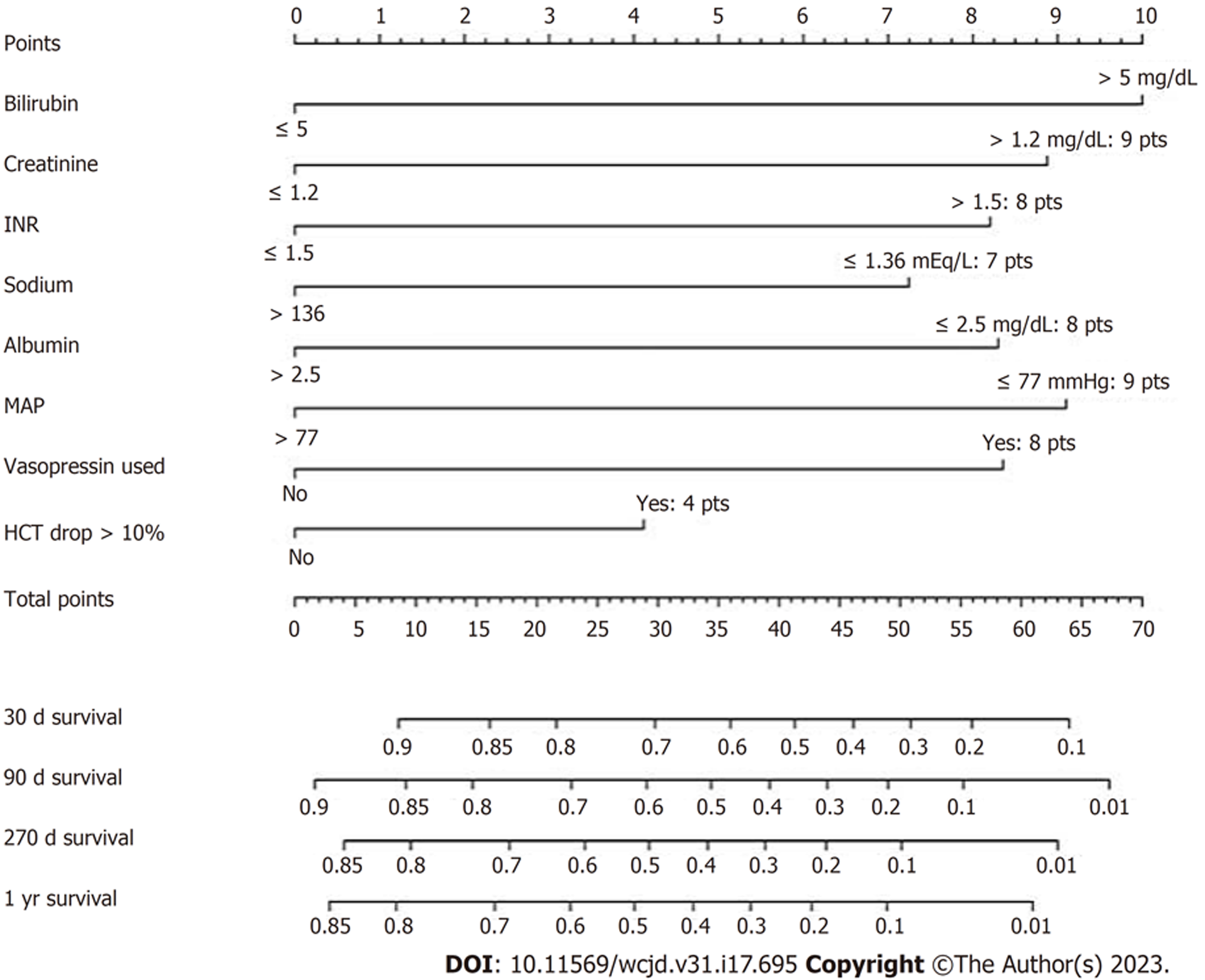
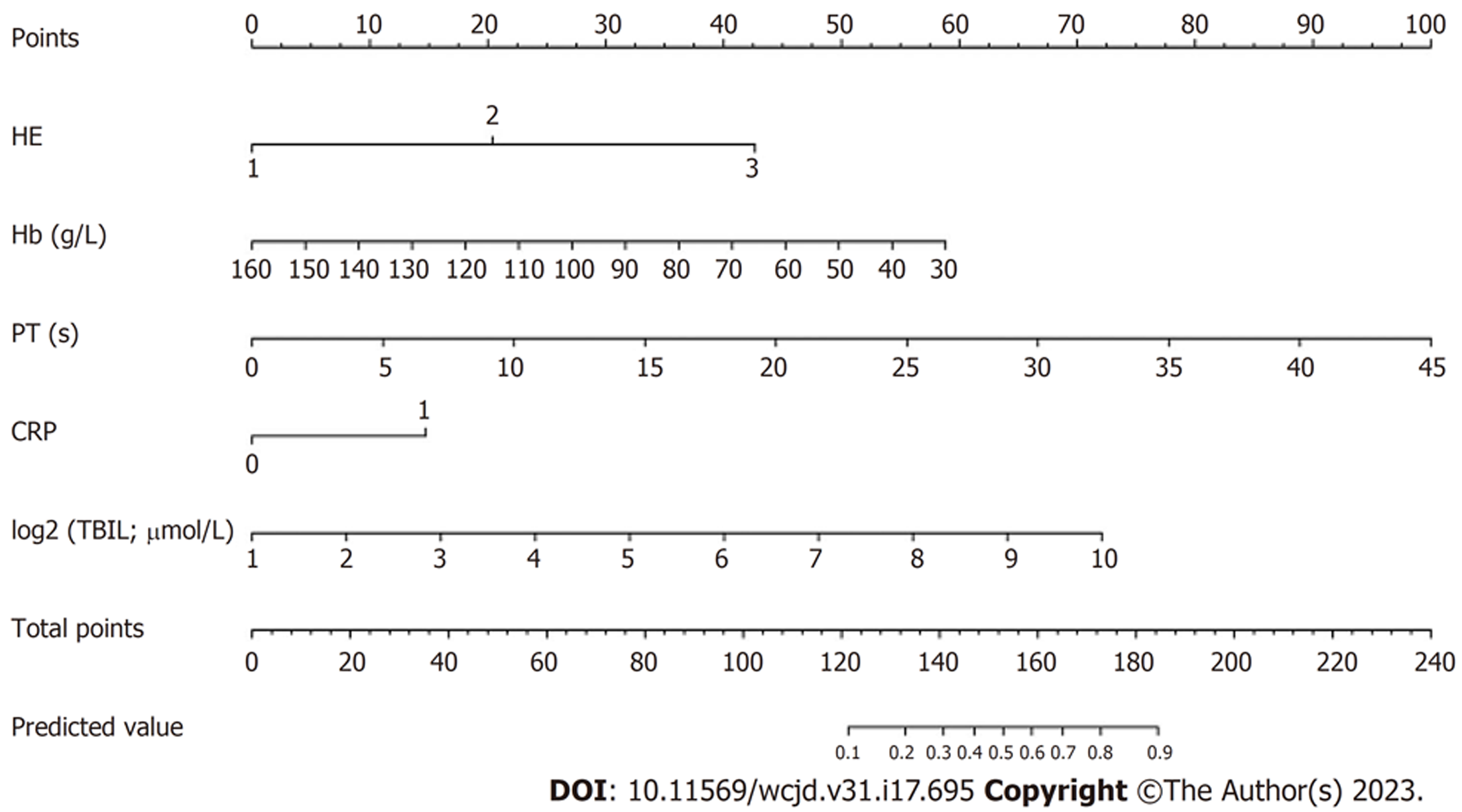
Zhou等[29]于2017年报告了UGIB-CLIF-SOFA评分(图1), 通过回顾性研究方法, 对540例重症肝硬化急性上消化出血(critically ill cirrhotic acute upper gastrointestinal bleeding, CICAUGIB)患者随访至少1年, 其中252例患者死亡. 采用Cox比例风险回归分析筛选风险因素共8项包括: 总胆红素、肌酐、国际标准化比率、钠、白蛋白、平均动脉压、使用加压素和血细胞比容降低. 风险因素总分为64分, 若总分为27分, 其30 d、90 d、270 d和1年的生存概率分别为75%, 65%, 55%和50%. 模型采用自举采样进行内部验证, 模型C指数为0.729, 表明模型的风险预测较准确. 该研究创建了首个基于临床试验研究数据的预测CICAUGIB患者死亡风险的列线图模型. 根据世界卫生组织死亡率数据库, 中国人口中肝硬化的年龄标准化死亡率分别为男女每10万人中14.6人和8.3人. 肝硬化急性UGIB患者的死亡率甚至更高[30]. 模型不仅为临床医护人员及患者自身早期识别、预防不良预后提供了高效、便捷的筛查工具, 还有助于医生根据远期死亡风险预测结果实时调整患者治疗护理方案. 但是该建模数据库不包括再出血, 腹水和内镜检查结果, 而这些因素均被证明是影响静脉曲张性消化道出血死亡的独立危险因素, 故其是否对所有CICAUGIB患者都适用, 值得进一步探究. Zhou等[31]通过分析676例CAUGIB患者建立6 wk死亡率列线图模型, 命名为UGIB-LC评分(图2). 评分包含总胆红素、血红蛋白、C反应蛋白、凝血酶原时间和肝性脑病5个变量, 建模组AUC为0.873, 临界值为3.049, 特异度为0.866, 敏感度为0.76. 该模型进行了内部验证和外部验证, AUC分别为0.837、0.875, BS评分为0.0510、0.054, 提示模型在内部和外部验证中表现均良好. 但该模型仅预测6 wk死亡率, 如需预测长期预后可与Zhou等[29]评分配合使用.
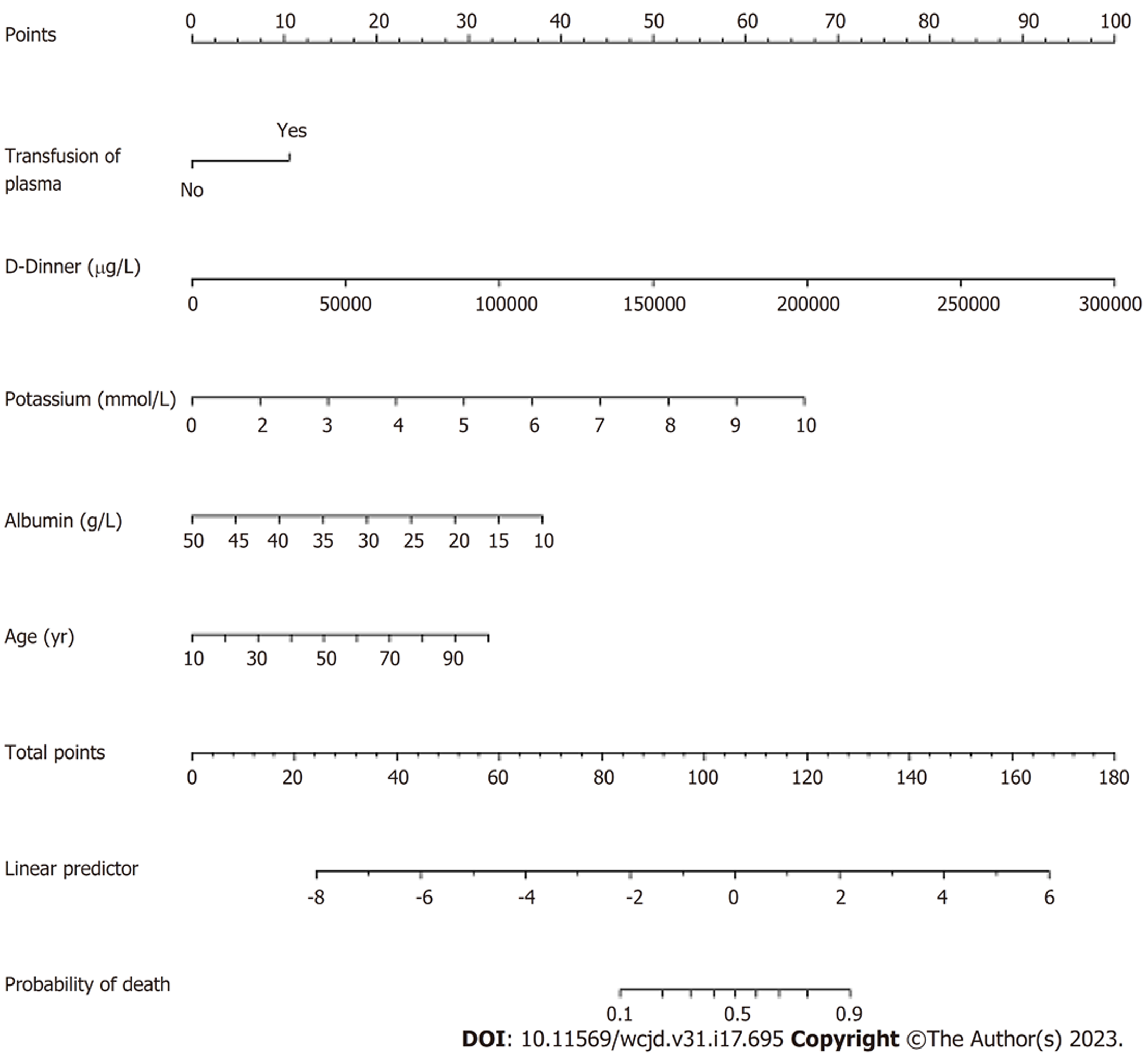
Chen等[32]于2021年建立了AUGIB患者的列线图死亡预测模型(图3), 结局指标为在急诊或离开急诊24 h内死亡率. 模型包含血浆输注、D-二聚体、白蛋白、钾和年龄5个预测因子. 列线图总分>105分, 死亡风险>50%. 该模型内部验证AUC为0.858, 提示模型预测效能高. 血清钾是新出现的预后预测因素. 有研究表明, 血清钾浓度与肝硬化的严重程度相关, 且高钾血症患者的死亡率也显著更高[33]. 因此, 将血清钾作为死亡模型预测因子具有合理性与必要性. 由于肝硬化出血仅占UGIB患者的一部分, 对比Zhou[29]和Zhou[31]研究, 本模型的使用范围更广泛, 其风险因素简单, 方便快速评分, 推荐在急诊室进行推广应用. 但是此研究未收集肌酐和心电图结果, 这与血钾浓度密切相关, 尚无法确定这些因素与死亡率之间的相关性. 此外, 该模型是基于急诊患者即时资料构建, 是否适用于预测住院患者死亡, 需要进一步研究.
综上所述, 国内外对消化道出血风险预测模型的相关研究开展较多, 模型预测性能较好, 但模型的预后结局指标侧重点有所不同. 这是由于多种疾病可引起上消化道出血, 而每种疾病的表现和预后风险不同. 传统的上消化道出血评估量表和新构建的风险模型都存在各自的侧重. 本文4篇研究关注再出血风险, 3篇研究为消化道干预需求, 结局指标为消化道干预的复合终点(内镜治疗、输血和死亡率), 其余研究更关注死亡风险. 因此在选择评估工具时, 研究人员应考虑应用场景不同和预测目的, 选择合适风险预测模型. 此外, 研究者应多开展前瞻性多中心的大样本研究, 探究上消化道出血预后的危险因素. 对不同种族、不同地区进行风险模型的临床验证, 优化预测模型, 并促进新模型与当前评分系统结合使用, 为临床医护人员提供更高效、智能化上消化道出血风险预测工具, 这有利于早期预警和提前预防, 从而改善上消化道出血患者的不良结局, 提高患者生存率和生活质量.
学科分类: 胃肠病学和肝病学
手稿来源地: 湖北省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C, C
D级 (一般): 0
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 3. | Laine L, Barkun AN, Saltzman JR, Martel M, Leontiadis GI. ACG Clinical Guideline: Upper Gastrointestinal and Ulcer Bleeding. Am J Gastroenterol. 2021;116:899-917. [PubMed] [DOI] |
| 6. | Stanley AJ, Laine L, Dalton HR, Ngu JH, Schultz M, Abazi R, Zakko L, Thornton S, Wilkinson K, Khor CJ, Murray IA, Laursen SB; International Gastrointestinal Bleeding Consortium. Comparison of risk scoring systems for patients presenting with upper gastrointestinal bleeding: international multicentre prospective study. BMJ. 2017;356:i6432. [PubMed] [DOI] |
| 8. | Benedeto-Stojanov D, Bjelaković M, Stojanov D, Aleksovski B. Prediction of in-hospital mortality after acute upper gastrointestinal bleeding: cross-validation of several risk scoring systems. J Int Med Res. 2022;50:3000605221086442. [PubMed] [DOI] |
| 9. | 奚 黎婷, 朱 锦舟, 虞 晨燕, 倪 柳菁, 许 春芳, 吴 爱荣. 急性非静脉曲张性上消化道出血患者再出血预测模型和新型评分系统的构建. 上海交通大学学报(医学版). 2021;41:1491-1497. |
| 12. | Wong GL, Ma AJ, Deng H, Ching JY, Wong VW, Tse YK, Yip TC, Lau LH, Liu HH, Leung CM, Tsang SW, Chan CW, Lau JY, Yuen PC, Chan FK. Machine learning model to predict recurrent ulcer bleeding in patients with history of idiopathic gastroduodenal ulcer bleeding. Aliment Pharmacol Ther. 2019;49:912-918. [PubMed] [DOI] |
| 13. | Tatlıparmak AC, Dikme Ö, Dikme Ö, Topaçoğlu H. Cancer, platelet distribution width, and total protein levels as predictors of rebleeding in upper gastrointestinal bleeding. Peer J. 2022;10:e14061. [PubMed] [DOI] |
| 14. | Redondo-Cerezo E, Vadillo-Calles F, Stanley AJ, Laursen S, Laine L, Dalton HR, Ngu JH, Schultz M, Jiménez-Rosales R. MAP(ASH): A new scoring system for the prediction of intervention and mortality in upper gastrointestinal bleeding. J Gastroenterol Hepatol. 2020;35:82-89. [PubMed] [DOI] |
| 15. | Sasaki Y, Abe T, Kawamura N, Keitoku T, Shibata I, Ohno S, Ono K, Makishima M. Prediction of the need for emergency endoscopic treatment for upper gastrointestinal bleeding and new score model: a retrospective study. BMC Gastroenterol. 2022;22:337. [PubMed] [DOI] |
| 16. | Badillo S, Banfai B, Birzele F, Davydov II, Hutchinson L, Kam-Thong T, Siebourg-Polster J, Steiert B, Zhang JD. An Introduction to Machine Learning. Clin Pharmacol Ther. 2020;107:871-885. [PubMed] [DOI] |
| 17. | Das A, Ben-Menachem T, Farooq FT, Cooper GS, Chak A, Sivak MV, Wong RC. Artificial neural network as a predictive instrument in patients with acute nonvariceal upper gastrointestinal hemorrhage. Gastroenterology. 2008;134:65-74. [PubMed] [DOI] |
| 18. | Shung DL, Au B, Taylor RA, Tay JK, Laursen SB, Stanley AJ, Dalton HR, Ngu J, Schultz M, Laine L. Validation of a Machine Learning Model That Outperforms Clinical Risk Scoring Systems for Upper Gastrointestinal Bleeding. Gastroenterology. 2020;158:160-167. [PubMed] [DOI] |
| 19. | Kim HS, Peng FB, Gomez Cifuentes JD. Regarding: Shung et al: Validation of a Machine Learning Model That Outperforms Clinical Risk Scoring Systems for Upper Gastrointestinal Bleeding. Gastroenterology. 2020;158:2308-2309. [PubMed] [DOI] |
| 21. | Ishigami M, Honda T, Okumura A, Ishikawa T, Kobayashi M, Katano Y, Fujimoto Y, Kiuchi T, Goto H. Use of the Model for End-Stage Liver Disease (MELD) score to predict 1-year survival of Japanese patients with cirrhosis and to determine who will benefit from living donor liver transplantation. J Gastroenterol. 2008;43:363-368. [PubMed] [DOI] |
| 23. | Johnson PJ, Berhane S, Kagebayashi C, Satomura S, Teng M, Reeves HL, O'Beirne J, Fox R, Skowronska A, Palmer D, Yeo W, Mo F, Lai P, Iñarrairaegui M, Chan SL, Sangro B, Miksad R, Tada T, Kumada T, Toyoda H. Assessment of liver function in patients with hepatocellular carcinoma: a new evidence-based approach-the ALBI grade. J Clin Oncol. 2015;33:550-558. [PubMed] [DOI] |
| 24. | Xavier SA, Vilas-Boas R, Boal Carvalho P, Magalhães JT, Marinho CM, Cotter JB. Assessment of prognostic performance of Albumin-Bilirubin, Child-Pugh, and Model for End-stage Liver Disease scores in patients with liver cirrhosis complicated with acute upper gastrointestinal bleeding. Eur J Gastroenterol Hepatol. 2018;30:652-658. [PubMed] [DOI] |
| 25. | Bai Z, Li B, Lin S, Liu B, Li Y, Zhu Q, Wu Y, Yang Y, Tang S, Meng F, Chen Y, Yuan S, Shao L, Qi X. Development and Validation of CAGIB Score for Evaluating the Prognosis of Cirrhosis with Acute Gastrointestinal Bleeding: A Retrospective Multicenter Study. Adv Ther. 2019;36:3211-3220. [PubMed] [DOI] |
| 26. | Matsuhashi T, Hatta W, Hikichi T, Fukuda S, Mikami T, Tatsuta T, Nakamura J, Abe Y, Onozato Y, Ogata Y, Masamune A, Ohyauchi M, Ito H, Hanabata N, Araki Y, Yanagita T, Imamura H, Tsuji T, Sugawara K, Horikawa Y, Ohara S, Kondo Y, Dohmen T, Kakuta Y, Nakamura T, Iijima K. A simple prediction score for in-hospital mortality in patients with nonvariceal upper gastrointestinal bleeding. J Gastroenterol. 2021;56:758-768. [PubMed] [DOI] |
| 27. | 刘 霜. 中国急性上消化道出血病情实时评估及预后的临床预测模型构建. 2021. |
| 28. | Marmo R, Koch M, Cipolletta L, Capurso L, Grossi E, Cestari R, Bianco MA, Pandolfo N, Dezi A, Casetti T, Lorenzini I, Germani U, Imperiali G, Stroppa I, Barberani F, Boschetto S, Gigliozzi A, Gatto G, Peri V, Buzzi A, Della Casa D, Di Cicco M, Proietti M, Aragona G, Giangregorio F, Allegretta L, Tronci S, Michetti P, Romagnoli P, Piubello W, Ferri B, Fornari F, Del Piano M, Pagliarulo M, Di Mitri R, Trallori G, Bagnoli S, Frosini G, Macchiarelli R, Sorrentini I, Pietrini L, De Stefano S, Ceglia T, Chiozzini G, Salvagnini M, Di Muzio D, Rotondano G; Italian registry on upper gastrointestinal bleeding (Progetto Nazionale Emorragie Digestive--PNED 2). Predicting mortality in non-variceal upper gastrointestinal bleeders: validation of the Italian PNED Score and Prospective Comparison with the Rockall Score. Am J Gastroenterol. 2010;105:1284-1291. [PubMed] [DOI] |
| 29. | Zhou YJ, Zheng JN, Zhou YF, Han YJ, Zou TT, Liu WY, Braddock M, Shi KQ, Wang XD, Zheng MH. Development of a prognostic nomogram for cirrhotic patients with upper gastrointestinal bleeding. Eur J Gastroenterol Hepatol. 2017;29:1166-1173. [PubMed] [DOI] |
| 30. | World Health Organization. Liver cirrhosis, age-standardized death rates (15+), per 100, 000 population. Available from: https://www.who.int/data/gho/data/indicators/indicator-details/GHO/liver-cirrhosisage-standardized-death-rates-(15-)-per-100-000-population. |
| 31. | Zhou YF, Xu Y, Ding YF, Yu XJ, Wu YL, Chen P, Zou DW. Novel nomogram model for predicting 6-week mortality in liver cirrhosis patients with acute upper gastrointestinal bleeding. J Dig Dis. 2022;23:516-526. [PubMed] [DOI] |
| 32. | Chen L, Zheng H, Wang S. Prediction model of emergency mortality risk in patients with acute upper gastrointestinal bleeding: a retrospective study. Peer J. 2021;9:e11656. [PubMed] [DOI] |
| 33. | Maiwall R, Kumar S, Sharma MK, Wani Z, Ozukum M, Sarin SK. Prevalence and prognostic significance of hyperkalemia in hospitalized patients with cirrhosis. J Gastroenterol Hepatol. 2016;31:988-994. [PubMed] [DOI] |