修回日期: 2023-07-06
接受日期: 2023-07-21
在线出版日期: 2023-07-28
直肠癌发病率逐年升高, 临床常采用根治性手术治疗, 但术后肝转移已成为病死率升高的重要原因, 因而建立模型早期预测异时性肝转移趋势已成为研究重点, Nomogram模型已被广泛用于医学领域, 但直肠癌术后异时性肝转移Nomogram模型尚未统一.
基于直肠癌中青年患者术后异时性肝转移的危险因素构建Nomogram模型, 评价该模型对术后异时性肝转移风险的预测效能, 为临床防治提供一定指导.
选取2019-03/2022-02期间本院收治的120例中青年直肠癌患者作为研究对象, 观察患者术后异时性肝转移发生情况. 单因素、多因素Logistic回归分析术后异时性肝转移的危险因素, 进一步构建Nomogram模型. 利用受试者工作特征(receiver operating characteristic, ROC)曲线、决策曲线、校正曲线验证Nomogram模型对术后异时性肝转移的预测价值及临床效用.
120例中青年直肠癌患者术后1年异时性肝转移发生率为23.33%; 低分化、淋巴结转移、浸润深度T3/T4、原发癌切缘宽度<2 cm、外周血端粒酶逆转录酶(human telomerase reverse transcriptase, hTERT)高表达及血清癌胚抗原(carcinoembryonic antigen, CEA)、血管内皮生长因子(vascular endothelial growth factor, VEGF)、狐猴酪氨酸激酶-3(lemur tyrosine kinase-3, LMTK3)、鳞状细胞癌相关抗原(squamous cell carcinoma associated antigen, SCC-Ag)、神经轴突导向因子-1(neuroaxon guidance factor-1 , Netrin-1)水平升高是术后异时性肝转移的危险因素(P<0.05); Nomogram模型一致性指数(consistency index, C-index)、AUC分别为0.860、0.957, 且净获益值较高(P<0.05).
低分化、淋巴结转移、浸润深度T3/T4、原发癌切缘宽度<2 cm、外周血hTERT高表达及血清CEA、VEGF、LMTK3、SCC-Ag、Netrin-1水平升高是直肠癌中青年患者术后异时性肝转移的危险因素, 基于上述危险因素构建Nomogram模型, 该模型对术后异时性肝转移具有一定预测效能, 可为临床制定干预措施提供参考.
核心提要: 基于单因素、Logistic回归分析直肠癌术后异时性肝转移影响因素, 筛选有统计学意义变量, 并建立直肠癌术后肝转移Nomogram模型, 探究其对术后异时性肝转移的预测价值, 并绘制受试者工作特征曲线、决策曲线、校正曲线验证Nomogram模型.
引文著录: 董伍真, 倪浩亮, 蔡成. 直肠癌中青年患者术后异时性肝转移的Nomogram模型构建和预测能力验证. 世界华人消化杂志 2023; 31(14): 589-597
Revised: July 6, 2023
Accepted: July 21, 2023
Published online: July 28, 2023
The incidence of rectal cancer is increasing year by year. Radical surgery is often used for the treatment of rectal cancer in clinical practice, but postoperative liver metastasis has become an important reason for the increase in mortality. Therefore, establishing a model to predict the trend of metachronous liver metastasis has become a research focus. Nomogram model has been widely used in the medical field, but there has been no widely accepted nomogram model available for prediction of metachronous liver metastasis after rectal cancer surgery.
To constuct a nomogram model based on the risk factors for postoperative metachronous liver metastasis in young and middle-aged patients with rectal cancer, and to evaluate the performance of the model for predicting the risk of postoperative metachronous liver metastasis, so as to provide some guidance for clinical prevention and treatment.
A total of 120 young and middle-aged patients with rectal cancer admitted to our hospital from March 2019 to February 2022 were selected as research subjects to observe the incidence of postoperative heterochronous liver metastasis. Univariate and multivariate Logistic regression analyses were performed to identify the risk factors for postoperative heterochronous liver metastasis and to construct a nomogram model. ROC curve, decision curve, and correction curve analyses were used to verify the value of nomogram model for the prediction of postoperative heterochronous liver metastasis.
The incidence of anomalous liver metastasis 1 year after surgery was 23.33% in 120 young and middle-aged patients with rectal cancer. Low differentiation, lymph node metastasis, depth of invasion (T3/T4), margin width of primary cancer < 2 cm, high expression of peripheral blood telomerase reverse transcriptase (hTERT), and elevated serum levels of carcinoembryonic antigen (CEA), vascular endothelial growth factor (VEGF), lemur tyrosine kinase-3 (LMTK3), squamous cell carcinoma-associated antigen (SCC-Ag), and axon-guided factor-1 (Netrin-1) were identified to be risk factor for postoperative hetero-chronic liver metastasis (P < 0.05). The C-index and area under the curve of the nomogram model were 0.860 and 0.957, respectively, and the net benefit value was high (P < 0.05).
Low differentiation, lymph node metastasis, depth of invasion (T3/T4), margin width of primary cancer < 2 cm, high expression of hTERT in peripheral blood, and elevated levels of serum CEA, VEGF, LMTK3, SC-AG and Netrin-1 are risk factors for postoperative xenotemporal liver metastasis in young and middle-aged patients with rectal cancer. Based on the above risk factors, a nomogram model has been established to predict postoperative heterochronous liver metastasis in such patients.
- Citation: Dong WZ, Ni HL, Cai C. Establishment of a nomogram model for prediction of postoperative heterochronous liver metastasis in young and middle-aged patients with rectal cancer. Shijie Huaren Xiaohua Zazhi 2023; 31(14): 589-597
- URL: https://www.wjgnet.com/1009-3079/full/v31/i14/589.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v31.i14.589
直肠癌发病率、病死率分别位居恶性肿瘤的第3位、第4位, 其主要治疗方式为根治性手术, 但术后肝转移已成为致死的重要原因[1,2]. 异时性肝转移是指切除肿瘤原发病灶6 mo后出现肝脏转移, 直肠癌患者术后异时性肝转移发生率约为20%-25%[3,4]. 因而早期预测异时性肝转移趋势, 有助于采取有效干预、综合治疗. Nomogram模型是由预测模型变量、变量相应得分、预测事件发生概率组成, 并可将数据变为可视化图形, 适用于阐述预测模型中不同变量间的关系[5,6]. 目前直肠癌术后异时性肝转移预测模型尚未统一, 本研究主要探讨直肠癌中青年患者术后异时性肝转移的危险因素, 基于危险因素构建Nomogram模型, 并评价该模型对异时性肝转移的预测效能, 为临床综合治疗提供参考.
选取2019-03/2022-02期间本院收治的120例中青年直肠癌患者作为研究对象, 纳入标准: 符合直肠癌诊断标准[7], 且经病理、影像学检查确诊; 20岁≤年龄<60岁; 术前影像学检查未发现肝转移; 首次诊治; 术前未行新辅助治疗; 术前肝功能Child-Pugh分级为A级; 卡氏评分(KPS)≥60分. 排除标准: 原发性肝癌; 其他肿瘤所致肝转移; 合并其他恶性肿瘤; 原发性癌灶未切除者; 心、肾等器官功能障碍者; 伴有脑、血液系统疾病者. 本研究经本院伦理委员会批准, 患者及其家属知情且签署知情同意书.
1.2.1 治疗方法: 研究对象均行直肠癌根治术, 癌组织下切缘2 cm-3 cm, 环切缘>1 cm, 术后按照直肠癌诊疗规范进行治疗[8]. 术后以门诊、电话方式进行随访, 每3 mo随访1次, 共随访1年, 统计术后1年异时性肝转移发生情况, 异时性肝转移诊断标准[9]: 肝脏超声、腹部CT、MRI检查确诊; 针对超声、腹部CT高度怀疑但未能确诊患者, 需经超声造影等影像学检查, 还需检查血清甲胎蛋白水平.
1.2.2 收集临床资料: 通过调查研究对象电子病历收集临床资料, 包括性别、年龄、婚姻状况、居住地、分化程度、淋巴结转移、肿瘤单发、临床分期、原发癌切缘宽度、浸润深度.
1.2.3 实时荧光定量聚合酶链反应(qRT-PCR)检测外周血端端粒酶逆转录酶(human telomerase reverse transcriptase, hTERT)mRNA表达水平: 抽取术前1 d清晨空腹肘静脉血5 mL, 肝素抗凝后采用淋巴细胞分层液(美国Amersham Biosciences公司)分离外周血单个核细胞, 加入1 mL Trizol试剂(美国Invitrogen公司)提取总RNA. 参照反转录试剂盒(北京天根生化公司)将RNA合成cDNA, 以甘油醛-3-磷酸脱氢酶(GAPDH)为内参, 采用qRT-PCR试剂盒在StepOnePlus实时荧光定量PCR仪(美国Applied Biosystems公司)上检测, 以cDNA为模板扩增hTERT mRNA、GAPDH, 反应体系: 10×PCR Buffer 2.5 μL, MgSO4 2.5 μL, dNTPs 2.5 μL, 正反向引物各0.5 μL, cDNA 2 μL, RNase-Free ddH2O补足体系至25 μL. hTERT正向引物5'-ACGGCGACATGGAGAACAA-3', 反向引物5'-CACTGTCTTCCGCAAGTTCAC-3'; GAPDH正向引物5'-GAAGGTGAAGGTCGGAGTC-3', 反向引物5'-GAAGATGGTGATGGGATTTC-3', 引物由美国ABI公司设计合成. 采用SDS1.4软件分析阈值及目的基因相对表达量(2-ΔΔCt法). 依据hTERT mRNA表达平均值分为高表达、低表达.
1.2.4 检测血清肿瘤转移相关指标水平: 抽取术前1 d清晨空腹肘静脉血5 mL, 常规离心10 min后分离血清, 采用电化学发光法检测血清癌胚抗原(carcinoembryonic antigen, CEA)、鳞状细胞癌相关抗原(squamous cell carcinoma associated antigen, SCC-Ag)水平, 上海科培瑞生物公司提供CEA检测试剂盒, 上海一研生物公司提供SCC-Ag检测试剂盒. 采用ELISA法检测血清血管内皮生长因子(vascular endothelial growth factor, VEGF)、狐猴酪氨酸激酶-3(lemur tyrosine kinase-3, LMTK3)、神经轴突导向因子-1(neuroaxon guidance factor-1, Netrin-1)水平, 美国R&D公司提供VEGF检测试剂盒, 上海康朗生物公司提供LMTK3检测试剂盒, 武汉益普生物公司提供Netrin-1检测试剂盒.
(1)统计术后1年异时性肝转移发生情况; (2)单因素、Logistic回归分析术后异时性肝转移影响因素并构建Nomogram模型; (3)评价预测模型对术后异时性肝转移的预测效能.
统计学处理 采用SPSS 24.0软件、R4.0.2、Stata/SE15.0分析数据, χ2检验分析计数资料[n(%)], 总例数<40或理论频数T<1, 采用确切概率法; Ridit检验(u)分析等级资料; t检验分析计量资料(mean±SD); Logistic回归分析术后异时性肝转移危险因素; 采用rms程序包建立Nomogram模型, 采用Bootstrap自抽样法进行内部验证, 计算一致性指数(C-index), C-index越高表明其预测价值越高; 绘制校正曲线获取预测模型预测的术后异时性肝转移发生情况与实际结果之间的一致性; 绘制受试者工作特征(receiver operating characteristic, ROC)曲线, 计算曲线下面积(area under the curve, AUC), 检验预测模型对术后异时性肝转移的预测价值, AUC>0.9定义为预测效能较高, 0.7≤AUC≤0.9定义为有一定预测效能, 0.5≤AUC<0.7定义为预测效能较低, AUC<0.5定义为无预测效能; 绘制决策曲线分析不同阈值概率下净收益以此确定临床效用性, P<0.05为差异有统计学意义.
120例中青年直肠癌患者, 男71例, 女49例, 分别占59.17%、40.83%; 年龄22-53岁, 平均(41.69±5.12)岁; 低分化30例, 中分化51例, 高分化39例, 分别占25.00%、42.50%、32.50%; 其中术后1年发生异时性肝转移患者有28例, 发生率为23.33%(28/120).
两组中青年直肠癌患者分化程度、淋巴结转移、原发癌切缘宽度、浸润深度、hTERT mRNA表达、CEA水平、VEGF水平、LMTK3水平、SCC-Ag水平、Netrin-1水平相比, 差异有统计学意义(P<0.05); 两组中青年直肠癌患者性别、年龄、婚姻状况、居住地、肿瘤单发、临床分期、术式相比, 无显著差异, 见表1.
| 资料 | 转移组(n = 28) | 未转移组(n = 92) | t/u/χ2 | P | ||
| 例数 | 构成比 | 例数 | 构成比 | |||
| 性别 | 0.036 | 0.849 | ||||
| 男 | 17 | 60.71 | 54 | 58.70 | ||
| 女 | 11 | 39.29 | 38 | 41.30 | ||
| 年龄(岁) | 0.106 | 0.745 | ||||
| <40 | 10 | 35.71 | 36 | 39.13 | ||
| ≥40 | 18 | 64.29 | 56 | 60.87 | ||
| 婚姻状况 | 0.047 | 0.829 | ||||
| 未婚 | 6 | 21.43 | 18 | 19.57 | ||
| 已婚/离异/丧偶 | 22 | 78.57 | 74 | 80.43 | ||
| 居住地 | 0.124 | 0.724 | ||||
| 城镇 | 12 | 42.86 | 36 | 39.13 | ||
| 乡村 | 16 | 57.14 | 56 | 60.87 | ||
| 分化程度 | 9.007 | 0.011 | ||||
| 高分化 | 7 | 25.00 | 32 | 34.78 | ||
| 中分化 | 8 | 28.57 | 43 | 46.74 | ||
| 低分化 | 13 | 46.43 | 17 | 18.48 | ||
| 淋巴结转移 | 4.998 | 0.025 | ||||
| 是 | 15 | 53.57 | 28 | 30.43 | ||
| 否 | 13 | 46.43 | 64 | 69.57 | ||
| 肿瘤单发 | 0.088 | 0.767 | ||||
| 是 | 20 | 71.43 | 63 | 68.48 | ||
| 否 | 8 | 28.57 | 29 | 31.52 | ||
| 临床分期 | 0.188 | 0.980 | ||||
| Ⅰ期 | 5 | 17.86 | 15 | 16.30 | ||
| Ⅱ期 | 6 | 21.43 | 22 | 23.91 | ||
| Ⅲ期 | 7 | 25.00 | 25 | 27.17 | ||
| Ⅳ期 | 10 | 35.71 | 30 | 32.61 | ||
| 原发癌切缘宽度(cm) | 5.901 | 0.015 | ||||
| <2 | 11 | 39.29 | 16 | 17.39 | ||
| ≥2 | 17 | 60.71 | 76 | 82.61 | ||
| 浸润深度 | 8.795 | 0.003 | ||||
| T1、T2 | 10 | 35.71 | 62 | 67.39 | ||
| T3、T4 | 18 | 64.29 | 30 | 32.61 | ||
| hTERT mRNA表达 | 6.455 | 0.011 | ||||
| 低表达 | 18 | 64.29 | 79 | 85.87 | ||
| 高表达 | 10 | 35.71 | 13 | 14.13 | ||
| 术式 | 0.627 | 0.731 | ||||
| 经腹会阴联合切除术 | 12 | 42.86 | 35 | 38.04 | ||
| 直肠癌前侧切除术 | 11 | 39.29 | 34 | 36.96 | ||
| 经腹直肠癌切除近端造口远端封闭术 | 5 | 17.86 | 23 | 25.00 | ||
| CEA水平(μg/L) | 58.96±5.75 | 41.28±3.12 | 21.100 | 0.000 | ||
| VEGF水平(pg/mL) | 457.69±48.32 | 398.24±36.17 | 7.012 | 0.000 | ||
| LMTK3水平(ng/mL) | 18.36±3.19 | 11.57±2.15 | 12.959 | 0.000 | ||
| SCC-Ag水平(ng/mL) | 2.23±0.56 | 1.69±0.47 | 5.085 | 0.000 | ||
| Netrin-1水平(pg/mL) | 498.68±85.27 | 368.47±63.29 | 8.751 | 0.000 | ||
经上述分析P<0.05的因素有: 分化程度、淋巴结转移、原发癌切缘宽度、浸润深度、hTERT mRNA表达、CEA水平、VEGF水平、LMTK3水平、SCC-Ag水平、Netrin-1水平, 采用多因素Logistic回归分析, 探究影响中青年直肠癌患者术后异时性肝转移的有关因素.
将中青年直肠癌患者术后异时性肝转移(未转移 = 0, 转移 = 1)作为研究对象, 利用多因素Logistic回归方程进行分析, 差异有统计学意义的结果如下: 低分化、淋巴结转移、原发癌切缘宽度<2 cm、hTERT mRNA高表达、CEA水平、VEGF水平、LMTK3水平、SCC-Ag水平、Netrin-1水平及浸润深度T3、T4是中青年直肠癌患者术后异时性肝转移的危险因素, 见表2.
| 变量 | 变量说明 | S.E. | β | OR | 95%CI | Wald χ2 | P | |
| 下限 | 上限 | |||||||
| 低分化 | 低分化 = 1, 中分化 = 2, 高分化 = 3 | 0.342 | 1.457 | 4.295 | 1.359 | 13.574 | 18.161 | <0.05 |
| 淋巴结转移 | 否 = 0, 是 = 1 | 0.326 | 1.656 | 5.237 | 2.140 | 12.815 | 25.795 | <0.05 |
| 原发癌切缘宽度<2 cm | <2 cm = 1, ≥2 cm = 2 | 0.503 | 1.562 | 4.770 | 1.342 | 16.952 | 9.647 | <0.05 |
| 浸润深度T3 | T1、T2 = 1, T3、T4 = 2 | 0.273 | 1.221 | 3.391 | 1.017 | 11.308 | 20.010 | <0.05 |
| hTERT mRNA高表达 | 低表达 = 1, 高表达 = 2 | 0.316 | 1.959 | 7.091 | 2.651 | 18.967 | 38.425 | <0.05 |
| CEA水平 | 输入实际值 | 0.286 | 1.694 | 5.438 | 1.719 | 17.206 | 35.062 | <0.05 |
| VEGF水平 | 输入实际值 | 0.431 | 1.216 | 3.375 | 1.169 | 9.742 | 7.964 | <0.05 |
| LMTK3水平 | 输入实际值 | 0.376 | 1.653 | 5.224 | 2.008 | 13.591 | 19.334 | <0.05 |
| SCC-Ag水平 | 输入实际值 | 0.296 | 1.108 | 3.030 | 1.124 | 8.167 | 14.024 | <0.05 |
| Netrin-1水平 | 输入实际值 | 0.500 | 1.382 | 3.982 | 1.035 | 15.321 | 7.638 | <0.05 |
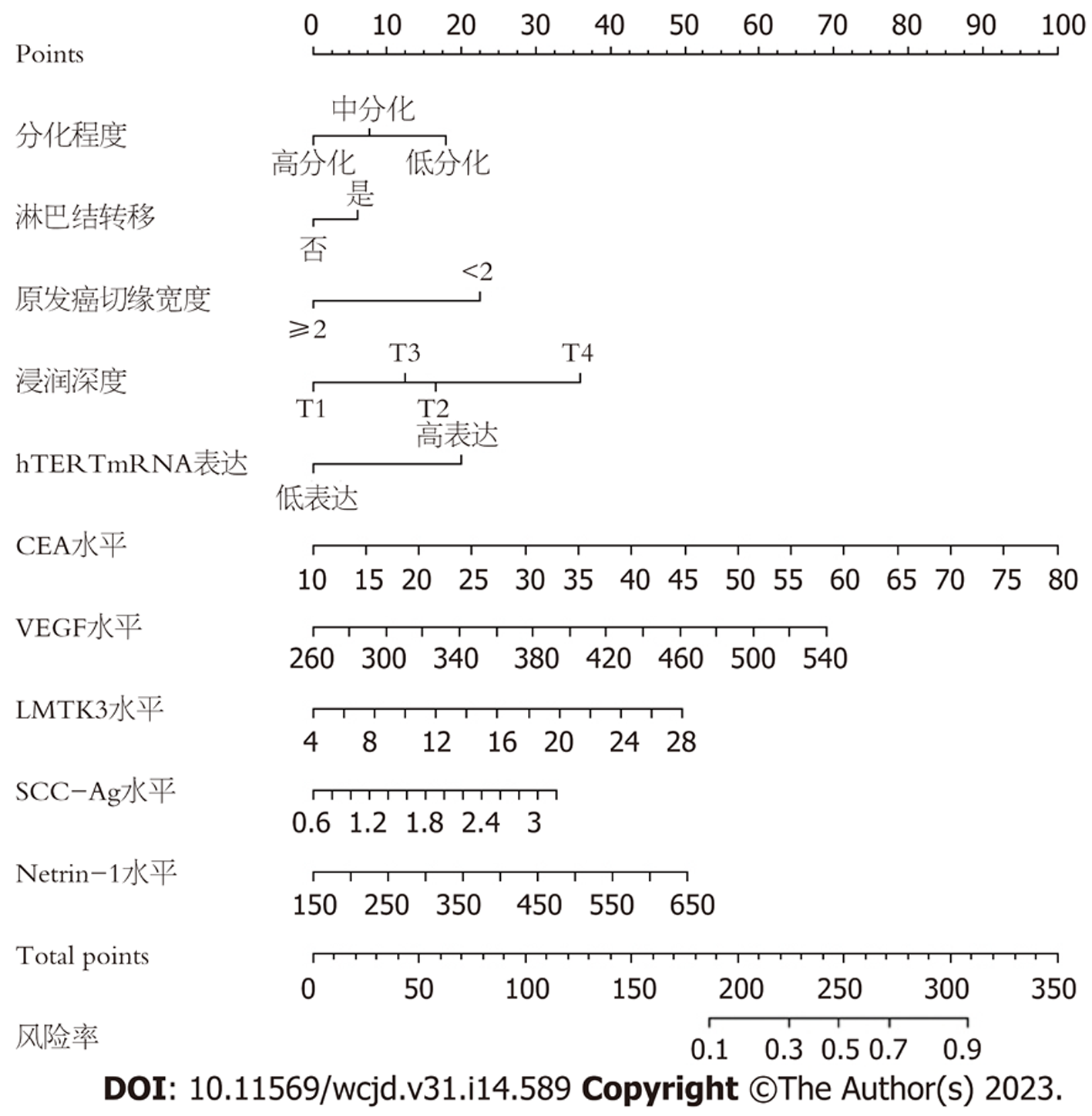
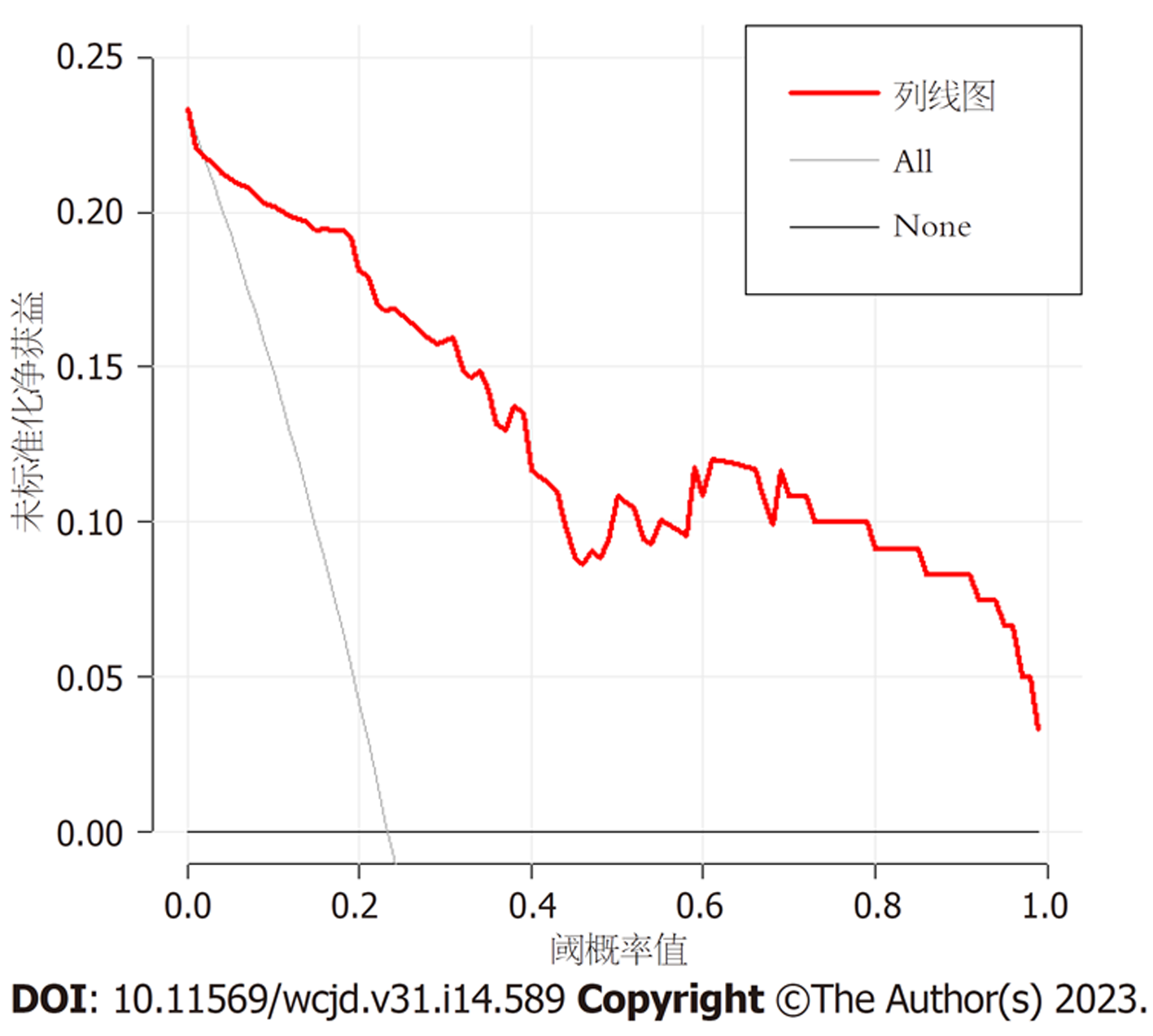
基于10项独立危险因素构建中青年直肠癌患者术后异时性肝转移风险的Nomogram模型, 见图1, 对应中青年直肠癌患者术后异时性肝转移的概率为0.1-0.9. 结果显示: 模型一致性指数(C-index)为0.860(95%CI: 0.827-0.896), 见图2; AUC为0.957(95%CI: 0.907-1.000), 见图3; 决策曲线显示阈值概率在24%-100%范围内时, 净获益值较高, 见图4.
直肠癌肝转移与机体免疫、肝脏微环境、肿瘤细胞生物学特性有关[10]. 同时性肝转移在手术治疗前可通过影像学、病理学检查确诊, 但术后异时性肝转移肿瘤细胞数减少, 常规检查无法进行早期诊断[11,12].
多因素Logistic回归分析可研究分类观察结果、协变量间的关系, 可用于分析诱发疾病的高危因素, 本研究中低分化、淋巴结转移、原发癌切缘宽度<2 cm、hTERT mRNA高表达、血清CEA、VEGF、LMTK3、SCC-Ag、Netrin-1水平升高及浸润深度T3、T4是中青年直肠癌患者术后异时性肝转移的危险因素. 肿瘤低分化可增加侵犯静脉发生风险, 可能是异时性肝转移发生的危险因素[13]. 本研究结果显示低分化者转移率明显高于未转移者, 提示分化程度降低与术后异时性肝转移有关[14]. 原发癌切缘宽度可影响肝转移, 但关于切缘宽度存在一定争议[15]. 本研究显示原发癌切缘宽度<2 cm者术后异时性肝转移发生风险是原发癌切缘宽度≥2 cm者的4.770倍, 提示在避免肿瘤细胞扩散的前提下, 直肠癌根治术中应尽量增加原发癌切缘宽度. 浸润深度越深, 肿瘤细胞易沿着淋巴结、血管发生转移[16]. 本研究发现浸润深度T3、T4者肝转移发生风险升高. 因而临床应在术前评估直肠癌患者浸润深度, 以降低淋巴结转移发生风险.
hTERT与肿瘤分化程度、浸润深度、淋巴结转移呈正相关, 可用于评估直肠癌患者预后[17]. 本研究结果显示hTERT mRNA高表达、低表达者发生术后异时性肝转移风险比为7.091. 临床医师应监测外周血hTERT表达水平, 有助于早期发现术后异时性肝转移者. CEA属于膜糖蛋白, 术前CEA水平升高者肝脏或其他器官可能已存在转移[18]. 本研究通过单因素、多因素Logistic回归分析显示CEA水平升高可增加术后异时性肝转移发生风险, 这与既往研究结果相似[19]. 分析其原因可能为CEA水平升高可上调基质金属蛋白酶1/2表达, 刺激肝转移相关基因, 促进肿瘤细胞生长及转移[20]. 提示临床应关注术前血清CEA水平较高者, 术后增加随访次数. 血管生长可能是术后肝转移的影响因素, VEGF可诱导内皮细胞增殖, 促进肿瘤血管增生, 促进肿瘤细胞侵袭、转移[21,22]. 本研究结果显示, 转移组血清VEGF水平高于未转移组, 且VEGF水平升高可增加术后异时性肝转移发生风险. LMTK3可介导PKC信号通路参与癌细胞转移过程[23,24]. SCC-Ag是一种由鳞状细胞产生的特异性抗原, 其水平升高与癌细胞生长、增殖密切相关[25]. 本研究发现转移组血清LMTK3、SCC-Ag水平高于未转移组, 这与既往研究结果相似[26]. Netrin-1可激活整合蛋白受体调节磷脂酰肌醇-3-激酶(phosphoinositide 3-kinase, PI3K)/蛋白激酶B(protein kinase B, AKT)信号通路, 促进肿瘤细胞增殖、血管生成[27]. 本研究结果显示Netrin-1水平升高是术后异时性肝转移的危险因素, 其原因可能为Netrin-1可能激活PI3K/AKT信号通路, 促进癌细胞增殖、分化, 引起免疫炎性反应紊乱, 促使肝转移发生. 本研究基于术后异时性肝转移的危险因素构建Nomogram模型, 经统计学验证, 该模型校准度、C-index、AUC、预测精准度良好, 提示该模型具有较高预测效能与一致性.
综上所述, 低分化、淋巴结转移、原发癌切缘宽度<2 cm、hTERT mRNA高表达、血清CEA、VEGF、LMTK3、SCC-Ag、Netrin-1水平升高及浸润深度T3、T4是中青年直肠癌患者术后异时性肝转移的危险因素, 基于上述危险因素构建Nomogram模型, 可有效预测术后异时性肝转移发生概率, 可为临床防控工作提供参考.
我国直肠癌发生率逐年上升, 临床常采用手术治疗, 可提高患者生存率, 但患者预后较差, 主要与术后肝转移有关, 病理诊断可用于诊断肝转移, 但具有一定滞后性, 因而需寻找新型预测指标或预测方案, 有助于早期诊断术后肝转移, 改善患者预后.
Nomogram模型具有可视化、可解释性等特点, 可阐述不同变量间关系, 有助于指导临床医师采取针对性措施, 目前直肠癌术后肝转移相关Nomogram模型尚未明确, 因而建立Nomogram模型成为研究重点.
分析并筛选直肠癌术后肝转移相关影响因素, 并构建Nomogram模型, 模型中不同变量对应相应得分, 可依据分值预测事件发生概率, 然后评价并验证该模型对异时性肝转移的预测价值及其临床实用性, 可为临床治疗提供科学依据.
(1)单因素、多因素Logistic回归分析直肠癌术后异时性肝转移影响因素; (2)依据筛选后的影响因素构建Nomogram模型; (3)利用ROC曲线、决策曲线、校正曲线分别验证该模型区分度、校准度及临床效用性.
低分化、淋巴结转移、浸润深度T3/T4、原发癌切缘宽度<2 cm、外周血hTERT高表达及血清CEA、VEGF、LMTK3、SCC-Ag、Netrin-1水平升高为术后异时性肝转移的危险因素, 依据上述危险因素构建Nomogram模型, 该模型预测术后异时性肝转移的AUC为0.957, 且区分度、校准度良好.
基于低分化、淋巴结转移、浸润深度T3/T4、原发癌切缘宽度<2 cm、外周血hTERT高表达及血清CEA、VEGF、LMTK3、SCC-Ag、Netrin-1水平构建Nomogram模型, 其对术后异时性肝转移具有一定预测价值.
本研究建立Nomogram模型还需结合内外部综合验证, 并扩大样本量试图纳入更多因素, 以提高模型预测效能.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): 0
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Quezada-Diaz FF, Smith JJ. Nonoperative Management for Rectal Cancer. Hematol Oncol Clin North Am. 2022;36:539-551. [PubMed] [DOI] |
| 2. | Yang Y, Wang HY, Chen YK, Chen JJ, Song C, Gu J. Current status of surgical treatment of rectal cancer in China. Chin Med J (Engl). 2020;133:2703-2711. [PubMed] [DOI] |
| 3. | Zhang X, Cai X, Deng Y, Wu T, Yang Q, Gao P, Zhang L, Yang X, Wang K, Lian K, Olowokure O, Mazzocca A, Chen EY, Wang W, Li Y, Yu K. Rectal gastrointestinal stromal tumor with metachronous liver metastasis demonstrated no relapse after multidisciplinary team discussion and comprehensive treatment: a case report. J Gastrointest Oncol. 2022;13:2679-2688. [PubMed] [DOI] |
| 4. | Li ZF, Kang LQ, Liu FH, Zhao M, Guo SY, Lu S, Quan S. Radiomics based on preoperative rectal cancer MRI to predict the metachronous liver metastasis. Abdom Radiol (NY). 2023;48:833-843. [PubMed] [DOI] |
| 5. | Zhong X, Wang L, Shao L, Zhang X, Hong L, Chen G, Wu J. Prognostic Nomogram for Rectal Cancer Patients With Tumor Deposits. Front Oncol. 2022;12:808557. [PubMed] [DOI] |
| 6. | Wang Y, Wu J, He H, Ma H, Hu L, Wen J, Lyu J. Nomogram predicting cancer-specific mortality in early-onset rectal cancer: a competing risk analysis. Int J Colorectal Dis. 2020;35:795-804. [PubMed] [DOI] |
| 9. | 中华医学会外科学分会胃肠外科学组; 中华医学会外科学分会结直肠外科学组; 中国抗癌协会大肠癌专业委员会. 中国结直肠癌肝转移诊断和综合治疗指南(2018版). 中华消化外科杂志. 2018;17:527-539. [DOI] |
| 10. | Liang M, Cai Z, Zhang H, Huang C, Meng Y, Zhao L, Li D, Ma X, Zhao X. Machine Learning-based Analysis of Rectal Cancer MRI Radiomics for Prediction of Metachronous Liver Metastasis. Acad Radiol. 2019;26:1495-1504. [PubMed] [DOI] |
| 11. | Besutti G, Damato A, Venturelli F, Bonelli C, Vicentini M, Monelli F, Mancuso P, Ligabue G, Pattacini P, Pinto C, Giorgi Rossi P. Baseline liver steatosis has no impact on liver metastases and overall survival in rectal cancer patients. BMC Cancer. 2021;21:253. [PubMed] [DOI] |
| 12. | Hane Y, Tsuchikawa T, Tanaka K, Nakanishi Y, Asano T, Noji T, Kurashima Y, Ebihara Y, Murakami S, Nakamura T, Okamura K, Takeuchi S, Shichinohe T, Hirano S. Metachronous liver metastases after long-term follow-up of endoscopic resection for rectal neuroendocrine neoplasms: a report of three cases. Surg Case Rep. 2020;6:22. [PubMed] [DOI] |
| 13. | Takasu C, Yamashita S, Morine Y, Yoshikawa K, Tokunaga T, Nishi M, Kashihara H, Yoshimoto T, Shimada M. The role of the immunoescape in colorectal cancer liver metastasis. PLoS One. 2021;16:e0259940. [PubMed] [DOI] |
| 14. | Solís-Fernández G, Montero-Calle A, Martínez-Useros J, López-Janeiro Á, de Los Ríos V, Sanz R, Dziakova J, Milagrosa E, Fernández-Aceñero MJ, Peláez-García A, Casal JI, Hofkens J, Rocha S, Barderas R. Spatial Proteomic Analysis of Isogenic Metastatic Colorectal Cancer Cells Reveals Key Dysregulated Proteins Associated with Lymph Node, Liver, and Lung Metastasis. Cells. 2022;11. [PubMed] [DOI] |
| 15. | Habbous S, Tai X, Gill T, Arias J, Beca J, Raphael MJ, Kennedy E, Biagi JJ, Chan KKW. Outcomes Following Treatment with FOLFOX for Patients with Resectable or Potentially Resectable Metastatic Colorectal Cancer: A Population-based Cohort Study. Clin Oncol (R Coll Radiol). 2023;35:188-198. [PubMed] [DOI] |
| 16. | Tajima T, Mukai M, Uda S, Izumi H, Yokoyama D, Hasegawa S, Makuuchi H. Conversion surgery by hand-assisted laparoscopic surgery following chemotherapy for rectal cancer with H3 liver metastases: a case report. J Gastrointest Oncol. 2022;13:2639-2646. [PubMed] [DOI] |
| 17. | Zhao X, Zheng F, Li Y, Hao J, Tang Z, Tian C, Yang Q, Zhu T, Diao C, Zhang C, Chen M, Hu S, Guo P, Zhang L, Liao Y, Yu W, Chen M, Zou L, Guo W, Deng W. BPTF promotes hepatocellular carcinoma growth by modulating hTERT signaling and cancer stem cell traits. Redox Biol. 2019;20:427-441. [PubMed] [DOI] |
| 18. | Zhu HQ, Wang DY, Xu LS, Chen JL, Chu EW, Zhou CJ. Diagnostic value of an enhanced MRI combined with serum CEA, CA19-9, CA125 and CA72-4 in the liver metastasis of colorectal cancer. World J Surg Oncol. 2022;20:401. [PubMed] [DOI] |
| 20. | Ding Q, Sun Y, Zhang J, Yao Y, Huang D, Jiang Y. Utility and specificity of plasma heat shock protein 90 alpha, CEA, and CA199 as the diagnostic test in colorectal cancer liver metastasis. J Gastrointest Oncol. 2022;13:2497-2504. [PubMed] [DOI] |
| 21. | Guo S, Li J, Huang Z, Yue T, Zhu J, Wang X, Liu Y, Wang P, Chen S. The CBS-H(2)S axis promotes liver metastasis of colon cancer by upregulating VEGF through AP-1 activation. Br J Cancer. 2022;126:1055-1066. [PubMed] [DOI] |
| 22. | Cevik M, Namal E, Dinc-Sener N, Iner-Koksal U, Ciftci C, Susleyici B. Investigation of Vascular Endothelial Growth Factor Polymorphisms on Risk, Metastasis, Laterality, and Prognosis of Colorectal Cancer in Turkish Subjects. Genet Test Mol Biomarkers. 2022;26:298-306. [PubMed] [DOI] |
| 23. | Jiang T, Lu X, Yang F, Wang M, Yang H, Xing N. LMTK3 promotes tumorigenesis in bladder cancer via the ERK/MAPK pathway. FEBS Open Bio. 2020;10:2107-2121. [PubMed] [DOI] |
| 24. | Wang C, Yang M, Gu X, Gu Y. Lemur tyrosine kinase-3 (LMTK3) induces chemoresistance to cetuximab in colorectal cancer via the ERK/MAPK pathway. Bioengineered. 2021;12:6594-6605. [PubMed] [DOI] |
| 25. | Chen W, Xiu S, Xie X, Guo H, Xu Y, Bai P, Xia X. Prognostic value of tumor measurement parameters and SCC-Ag changes in patients with locally-advanced cervical cancer. Radiat Oncol. 2022;17:6. [PubMed] [DOI] |
| 27. | Fang X, Xu Y, Li K, Liu P, Zhang H, Jiang Y, Tang J, Li Y. Exosomal lncRNA PCAT1 Promotes Tumor Circulating Cell-Mediated Colorectal Cancer Liver Metastasis by Regulating the Activity of the miR-329-3p/Netrin-1-CD146 Complex. J Immunol Res. 2022;2022:9916228. [PubMed] [DOI] |