修回日期: 2023-05-23
接受日期: 2023-06-21
在线出版日期: 2023-06-28
难治性溃疡性结肠炎在临床上表现为对多种药物无效或不耐受, 病情反复发作, 治疗存在一定困难.
本例患者因"痔术后反复便血4月"来诊, 诊断为溃疡性结肠炎, 经多种药物治疗无效后, 超适应症使用乌司奴单抗治疗显效, 病情得以控制.
难治性溃疡性结肠炎的诊疗不应拘泥于现有药物的用药适应证, 综合国内外诊治经验及指南建议可拓宽诊疗思路, 为该类患者带来获益.
核心提要: 本文报道广州中医药大学附属中山医院肛肠科收治的1例溃疡性结肠炎患者的诊治过程, 以期为老年难治性溃疡性结肠炎的临床诊治提供经验及参考.
引文著录: 萧绮莉, 徐钰婷. 乌司奴单抗治疗老年难治性溃疡性结肠炎1例. 世界华人消化杂志 2023; 31(12): 515-520
Revised: May 23, 2023
Accepted: June 21, 2023
Published online: June 28, 2023
Refractory ulcerative colitis is clinically irresponsive or intolerant to multiple drugs, with recurrent episodes and difficulties in treatment.
The patient in this case was diagnosed with ulcerative colitis due to repeated bloody stools for 4 mo after hemorrhoid surgery. After multiple drug treatment failures, the off-label treatment with ustekinumab was effective, and the patient's condition was under control.
The diagnosis and treatment of refractory ulcerative colitis should not be limited to the indications of existing drugs. Integrating domestic and foreign medical experiences and guidelines can broaden the diagnosis and treatment approach and bring benefits to such patients.
- Citation: Xiao QL, Xu YT. Ustekinumab for treatment of refractory ulcerative colitis in an elderly patient: A case report. Shijie Huaren Xiaohua Zazhi 2023; 31(12): 515-520
- URL: https://www.wjgnet.com/1009-3079/full/v31/i12/515.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v31.i12.515
溃疡性结肠炎(ulcerative colitis, UC)是一种慢性非特异性肠道炎症性疾病, 容易反复发作. 对糖皮质激素依赖, 或至少对5-氨基水杨酸制剂、糖皮质激素或免疫抑制剂等药物一种无反应或不耐受者, 称为难治性溃疡性结肠炎[1]. 随着生物制剂应用于临床, 溃疡性结肠炎患者的预后也得到了显著的改善[2-4]. 其中, 乌司奴单抗是一种全人源抗白介12/23的IgG1-κ单克隆抗体, 分别于2019及2020在美国、欧洲及日本被批准用于治疗中重度UC. 而在中国, 乌司奴单抗仅于2020-03获批用于中重度克罗恩病, 目前尚未获批UC的适应证. 本文报道1例老年难治性溃疡性结肠炎应用乌司奴单抗治疗的病例, 并对其有效性和安全性展开分析.
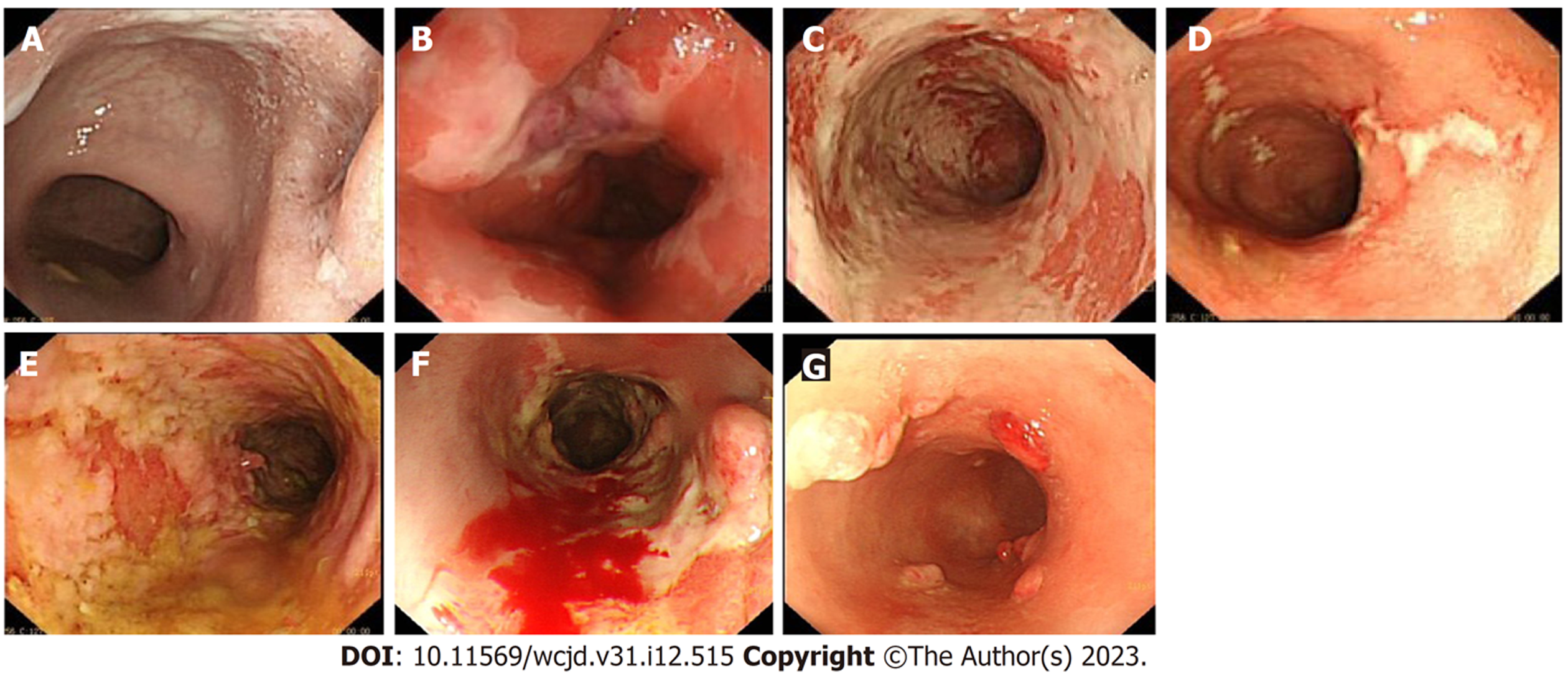
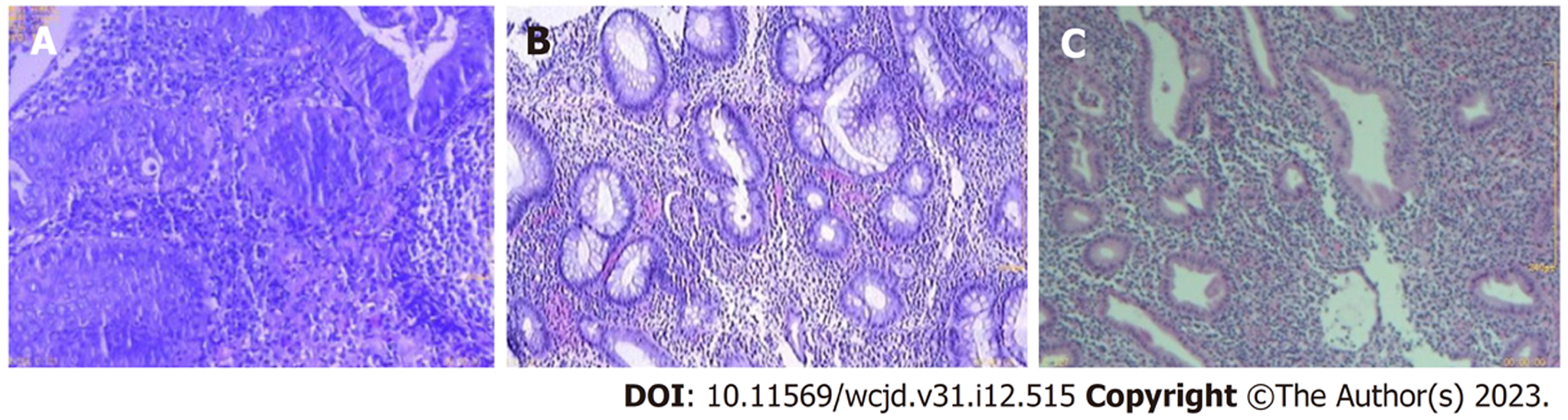
患者, 男, 初诊年龄67岁, 身体质量指数: 24.6 kg/m2. 因"痔术后反复便血4月"于2019-03至我院行肠镜检查, 考虑溃疡性结肠炎(E1 Mayo 1分)(图1A)门诊予美沙拉嗪肠溶片1 g tid治疗后, 患者便血症状仍反复, 于2019-10复查肠镜提示结肠溃疡形成(图1B), 2019-11-04全腹增强CT示: (1)直肠肠壁轻度增厚, 请结合临床; (2)乙状结肠冗长. 予加用美沙拉嗪栓500 mg qn、白及胶囊0.6 g tid治疗后患者症状好转. 2020-02患者出现大便次数增多, 10余次/d, 量少, 伴少量便血, 脐周隐痛, 便后痛减, 于2020-03-12住院治疗, 肛检见指套染暗红色血性粘液, 肛镜下见直肠下段较多血性粘液附着. 实验室检查: 肝功: 白蛋白: 39.0 g/L. CRP: 4.12 mg/L. 抗线粒体抗体-M2: 弱阳性. 大便三项: 潜血: 阳性(+). 血清蛋白电泳: α1 5.28%. 乙肝五项: 乙肝E抗体: 阳性, 乙肝核心抗体: 阳性, 余阴性. 心梗、男性肿瘤十二项、免疫五项、大便培养、大便菌群、大便真菌检查等结果未见异常. 抗髓过氧化物酶抗体、抗蛋白酶3抗体、免疫固定电泳、抗ds-DNA抗体、抗核抗体、大便艰难梭菌抗原GDH及毒素A和B、巨细胞病毒检测、结核菌素试验(PPD)结果均阴性. TPMT+NUDT15: 活性正常. 复查肠镜: 结直肠多发溃疡, 考虑溃疡性结肠炎(图1C). 病理: 诊断: (直肠): 粘膜腺体分化良好, 间质疏松、水肿, 可见大量炎细胞浸润(图2A). 根据上述结果, 诊断溃疡性结肠炎(E2 Mayo 3分), 予美沙拉嗪肠溶片1 g qid、美沙拉嗪栓500 mg纳肛qn, 治疗4 d症状未能改善, 加用甲泼尼龙注射液40 mg静滴 qd, 地塞米松注射液5 mg 保留灌肠qd, 治疗9 d后, 大便次数减少至1-3次/d, 便血症状停止, 甲泼尼龙改为32 mg 口服qd, 随后按每周减4 mg, 减至半量时每2 wk减4 mg. 患者出院后按上述方案治疗2 mo 余, 2020-05-24患者因肛周肿痛再次就诊, 考虑肛周脓肿, 予头孢呋辛酯片0.25 g bid、甲硝唑片0.4 g tid治疗5 d后症状未能改善, 2020-06-01复查肠镜见结直肠多发溃疡(图1D), 较2020-03-31好转. 2020-06-02患者在腰硬联合麻醉下行肛周脓肿切开引流术, 术后根据药敏结果以头孢哌酮/舒巴坦抗感染, 继续美沙拉嗪肠溶片1 g qid、美沙拉嗪栓500 mg qn维持治疗. 术后13 d患者病情稳定出院, 2020-07底伤口完全愈合, 并继续以美沙拉嗪肠溶片1 g tid维持治疗. 2021-01患者再发大便次数增多, 6-9次/d, 间断便血, 色暗红, 加沙利度胺片50 mg bid治疗, 症状不能缓解. 2021-05, 患者便血症状加重, 伴左下腹隐痛, 加予甲泼尼龙片24 mg qd, 症状仍未改善, 2021-07-06患者再次来诊, 肛门指检扪及淡红色血迹. 复查CRP: 24.44 mg/L. 白蛋白: 31.9 g/L. 抗线粒体抗体-M2: 弱阳性. TSPOT阳性. PPD、大便艰难梭菌抗原GDH及毒素A和B、巨细胞病毒检测等结果均阴性. 肠镜考虑溃疡性结肠炎(E2 Mayo 3分)(图1E). 病理: (横结肠、降结肠、乙状结肠、直肠): 结合临床表现及肠镜所见, 不排除溃疡性结肠炎可能; 部分腺体呈腺瘤样改变(图2B). CTE+胸部CT: (1)乙状结肠冗长, 直肠、乙状结肠壁增厚, 符合溃疡性结肠炎: (2)新见双肺下叶后基底段、左肺上叶下舌段散在炎症或节段性不张, 未见结核征象. 2021-07-11予英夫利昔单抗400 mg, 治疗次日便血症状消失, 并按第0, 2, 6周执行治疗方案, 至第3次英夫利昔单抗治疗前1 wk, 患者再发大便次数增多, 10余次/d, 偶有便血, 色淡红, 或便鲜血, 伴肛门不适感, 复查血沉86 mm/H, CRP 24 mg/L, 大便培养阴性. 第3次英夫利昔单抗治疗后, 患者渐渐出现大便次数增多, 10-20次/d, 呈水样, 便血色淡红, 量少, 伴脐周隐痛, 体重无改变, 无发热, 2021-09-15再次就诊, 查CRP 23 mg/L, 血沉74 mm/H. IL-6: 14 ng/L. IFX浓度3.84 ug/mL; IFX抗体14.50 AU/mL. 血常规、降钙素原、CMV定量、EBV定量、艰难梭菌毒素A+B等检测未见明显异常. 肠镜: 溃疡性结肠炎(图1F). 病理: (横结肠): 大肠黏膜呈息肉状增生, 间质炎性细胞浸润. (降结肠): 大肠黏膜呈息肉状增生, 间质炎性细胞浸润. (乙状结肠): 大肠黏膜呈息肉状增生, 间质见急慢性炎性细胞浸润, 局部糜烂, 不排除溃疡性结肠炎可能. (直肠): 炎性肉芽组织及坏死组织, 考虑溃疡. (图2C)CMV免疫组化(-); EBER(-). 临床症状上高度怀疑合并艰难梭菌感染, 09-17予万古霉素0.25 g qid口服, 至2021-09-23复查CRP正常, 血沉43 mm/H, 09-27改用维得利珠单抗300 mg治疗, 患者病情好转出院后, 继续口服万古霉素共2 wk. 2021-10-09患者再发大便次数增多, 10余次/d, 以血性粘液便为主, 伴左下腹隐痛, 2021-10-11查血沉93 mm/H, CRP 53.4 mg/L. 大便涂片、大便真菌检查、大便培养等未见异常, 10-11使用第2程维得利珠单抗治疗, 症状不改善. 患者随后转至其他医院就诊, 复查结果与9月对比无明显改善, 该院先后予美沙拉嗪肠溶片1 g tid、美沙拉嗪灌肠液1支 qd、托法替布5 mg qd治疗, 2021-11-03重新以英夫利昔单抗诱导治疗, 并加予沙利度胺100 mg qd口服, 患者症状未改善, 便血较前增多, 随后以选择性白细胞吸附疗法治疗, 患者症状仍不改善. 2022-02-15患者返回我院就诊, 粪便检查发现艰难梭菌毒素B阳性, 明确为溃疡性结肠炎合并难辨艰难梭状芽胞杆菌性结肠炎, 考虑患者对多种药物失效或不耐受, 予乌司奴单抗390 mg治疗, 联合万古霉素0.125 g qid口服 4 wk, 地塞米松磷酸钠注射液5 mg qd保留灌肠 1 wk. 患者于我院接受乌司奴单抗390 mg q8w治疗共5程, 期间无便血, 2022-10复查肠镜提示: 乙状结肠至直肠黏膜粗糙, 散在分布多处大小不等息肉, 直肠见不规则浅溃疡(图1G). 随访至2023-04, 未见疾病复发.
溃疡性结肠炎(慢性复发型, 左半结肠, 重度活动).
乌司奴单抗390 mg q8w.
患者于我院接受乌司奴单抗390 mg q8w治疗共5程, 期间无便血, 2022-10复查肠镜结果提示病情好转, 随访至2023-04, 未见疾病复发.
一般而言, 溃疡性结肠炎(直肠型)是一种较为温和的溃疡性结肠炎亚型, 预后较好[5]. 本病例患者初诊年龄>65岁, 为老年男性, 初诊明确为溃疡性结肠炎(E1), 对5-氨基水杨酸制剂、糖皮质激素、多种免疫抑制剂及生物制剂无效或不能耐受, 病情反复且持续加重, 病变延伸至左半结肠, 后期合并艰难梭菌感染, 符合难治性溃疡性结肠炎的特点.
对于难治性溃疡性结肠炎患者的治疗尚无统一标准. 有研究证明[6,7], 英夫利昔单抗在难治性溃疡性结肠炎治疗方面可以获得一定疗效.在本例的诊治过程中, 英夫利昔单抗在诱导期获得了一定疗效, 但在3程治疗后, 患者症状复发, 转换维得利珠单抗治疗则未显效, 这可能与维得利珠单抗特异性拮抗α4β7整合素反而进一步加重肠道内细菌感染进而加重病情有关. 一项研究发现[8], 对巯嘌呤、抗肿瘤坏死因子、维得利珠单抗至少一种方案治疗无效或不耐受的中重度溃疡性结肠炎患者, 仍有50%可经乌司奴单抗治疗获得缓解.
目前国内使用乌司奴单抗治疗溃疡性结肠炎的临床经验未见文献报道, 包括剂量、使用间隔、给药途径等用药推荐尚缺乏共识. 用于治疗克罗恩病时, 乌司奴单抗首次给药需根据患者体质量计算, 体重≤55 kg者, 乌司奴单抗剂量为260 mg; 体重介于55 kg至85 kg之间者, 剂量为390 mg; 体重>85 kg者, 剂量为520 mg. 首次给药后第8周乌司奴单抗90 mg皮下注射作为诱导缓解方案, 之后每12 wk 90 mg皮下注射作为维持治疗方案, 如每12 wk给药1次期间失应答, 可缩短间隔为每8 wk注射1次[9]. 而FDA和EMA对于乌司奴单抗治疗溃疡性结肠炎的使用建议则与之相同. 国外的一项临床研究显示, 由于如厕频率高以及既往2种以上生物制剂暴露, 超过40%的溃疡性结肠炎患者在使用乌司奴单抗时需要通过剂量强化来达到临床缓解[10]. 而一项荟萃分析也发现[11], 近30%的难治性溃疡性结肠炎患者在使用乌司奴单抗治疗时需要通过缩短治疗间隔或重复静脉诱导来强化剂量, 这种强化剂量的用药方式也同样见于乌司奴单抗治疗克罗恩病的过程中[12]. 药物安全性方面, 乌司奴单抗无论是在临床注册研究中还是上市后不良反应检测登记均显示患者对其耐受性良好[13,14], 且未显示出剂量相关的毒性[15]. 对于潜伏结核或既往乙肝病毒感染, 目前尚无指南明确指出这类患者使用乌司奴单抗前应预防性抗结核或抗病毒治疗. 而国内一项真实世界研究则显示, 乌司奴单抗治疗伴潜伏结核或非活动性乙肝病毒感染的克罗恩病患者, 随访1年期间无论是否采取预防性抗结核或抗病毒治疗, 均未观察到结核或乙肝病毒激活[16]. 因此, 在参考国外获批适应证及现有的循证医学证据后, 笔者对本例患者采用乌司奴单抗治疗, 经过5次乌司奴单抗390 mg q8w治疗, 患者无论是症状还是内镜复查结果均明显好转, 目前未见明显不良反应发生. 但患者原病变严重的肠段出现了腺瘤改变, 尚未能确定是疾病本身带来的病变, 还是治疗过程中某种或几种药物所致. 一项基于人群研究的荟萃分析显示, 溃疡性结肠炎患者罹患结直肠癌的风险为普通人群的2.4倍[17], 其中病变范围及疾病持续时间是其最重要的风险因素[18,19]. 而药物是否导致溃疡性结肠炎癌变风险的增加, 则是一直颇受关注的话题. 目前已知使用硫唑嘌呤会增加罹患淋巴瘤的风险[20,21], 而抗肿瘤坏死因子会否增加患者患癌风险则有争议[22], 而维得利珠单抗上市后随访4年的数据显示<1%的溃疡性结肠炎患者患癌, 其中最常见的是消化道肿瘤, 但该数据缺乏对照组[23]. 目前数据显示, 乌司奴单抗的使用并未增加炎症性肠病患者患癌的风险[14,24,25], 但该结论尚需更多的长期数据加以支持.
本例老年难治性溃疡性结肠炎患者在经过传统治疗及多种生物制剂治疗无效后, 采用乌司奴单抗治疗后获得较好的效果, 目前未见显著的不良反应, 为老年难治性溃疡性结肠炎提供了另一种治疗的可行性. 但由于病变肠段已出现腺瘤改变, 今后的治疗过程中仍需密切监测结肠癌变风险.
学科分类: 胃肠病学和肝病学
手稿来源地: 广东省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Löwenberg M, de Boer NKh, Hoentjen F. Golimumab for the treatment of ulcerative colitis. Clin Exp Gastroenterol. 2014;7:53-59. [PubMed] [DOI] |
| 2. | Bianchi Porro G, Cassinotti A, Ferrara E, Maconi G, Ardizzone S. Review article: the management of steroid dependency in ulcerative colitis. Aliment Pharmacol Ther. 2007;26:779-794. [PubMed] [DOI] |
| 3. | Danese S, Fiocchi C. Ulcerative colitis. N Engl J Med. 2011;365:1713-1725. [PubMed] [DOI] |
| 4. | Bressler B, Marshall JK, Bernstein CN, Bitton A, Jones J, Leontiadis GI, Panaccione R, Steinhart AH, Tse F, Feagan B; Toronto Ulcerative Colitis Consensus Group. Clinical practice guidelines for the medical management of nonhospitalized ulcerative colitis: the Toronto consensus. Gastroenterology. 2015;148:1035-1058.e3. [PubMed] [DOI] |
| 5. | Meucci G, Vecchi M, Astegiano M, Beretta L, Cesari P, Dizioli P, Ferraris L, Panelli MR, Prada A, Sostegni R, de Franchis R. The natural history of ulcerative proctitis: a multicenter, retrospective study. Gruppo di Studio per le Malattie Infiammatorie Intestinali (GSMII). Am J Gastroenterol. 2000;95:469-473. [PubMed] [DOI] |
| 6. | Bouguen G, Roblin X, Bourreille A, Feier L, Filippi J, Nancey S, Bretagne JF, Flourié B, Hébuterne X, Bigard MA, Siproudhis L, Peyrin-Biroulet L. Infliximab for refractory ulcerative proctitis. Aliment Pharmacol Ther. 2010;31:1178-1185. [PubMed] [DOI] |
| 7. | Pineton de Chambrun G, Amiot A, Bouguen G, Viennot S, Altwegg R, Louis E, Collins M, Fumery M, Poullenot F, Armengol L, Buisson A, Abitbol V, Laharie D, Seksik P, Nancey S, Blanc P, Bouhnik Y, Pariente B, Peyrin-Biroulet L; PROTECT-GETAID study group. Efficacy of Tumor Necrosis Factor Antagonist Treatment in Patients With Refractory Ulcerative Proctitis. Clin Gastroenterol Hepatol. 2020;18:620-627.e1. [PubMed] [DOI] |
| 8. | Ochsenkühn T, Tillack C, Szokodi D, Janelidze S, Schnitzler F. Clinical outcomes with ustekinumab as rescue treatment in therapy-refractory or therapy-intolerant ulcerative colitis. United European Gastroenterol J. 2020;8:91-98. [PubMed] [DOI] |
| 10. | Dalal RS, Esckilsen S, Barnes EL, Pruce JC, Marcus J, Allegretti JR. Predictors and Outcomes of Ustekinumab Dose Intensification in Ulcerative Colitis: A Multicenter Cohort Study. Clin Gastroenterol Hepatol. 2022;20:2399-2401.e4. [PubMed] [DOI] |
| 11. | Taxonera C, Olivares D, López-García ON, Alba C. Meta-analysis: Real-world effectiveness and safety of ustekinumab in patients with ulcerative colitis. Aliment Pharmacol Ther. 2023;57:610-619. [PubMed] [DOI] |
| 12. | Rubín de Célix C, Chaparro M, Gisbert JP. Real-World Evidence of the Effectiveness and Safety of Ustekinumab for the Treatment of Crohn's Disease: Systematic Review and Meta-Analysis of Observational Studies. J Clin Med. 2022;11. [PubMed] [DOI] |
| 13. | Sands BE, Sandborn WJ, Panaccione R, O'Brien CD, Zhang H, Johanns J, Adedokun OJ, Li K, Peyrin-Biroulet L, Van Assche G, Danese S, Targan S, Abreu MT, Hisamatsu T, Szapary P, Marano C; UNIFI Study Group. Ustekinumab as Induction and Maintenance Therapy for Ulcerative Colitis. N Engl J Med. 2019;381:1201-1214. [PubMed] [DOI] |
| 14. | Chaparro M, Garre A, Iborra M, Sierra-Ausín M, Barreiro-de Acosta M, Fernández-Clotet A, de Castro L, Boscá-Watts M, Casanova MJ, López-García A, Lorente R, Rodríguez C, Carbajo AY, Arroyo MT, Gutiérrez A, Hinojosa J, Martínez-Pérez T, Villoria A, Bermejo F, Busquets D, Camps B, Cañete F, Manceñido N, Monfort D, Navarro-Llavat M, Pérez-Calle JL, Ramos L, Rivero M, Angueira T, Camo Monterde P, Carpio D, García-de-la-Filia I, González-Muñoza C, Hernández L, Huguet JM, Morales VJ, Sicilia B, Vega P, Vera I, Zabana Y, Nos P, Suárez Álvarez P, Calviño-Suárez C, Ricart E, Hernández V, Mínguez M, Márquez L, Hervías Cruz D, Rubio Iturria S, Barrio J, Gargallo-Puyuelo C, Francés R, Hinojosa E, Del Moral M, Calvet X, Algaba A, Aldeguer X, Guardiola J, Mañosa M, Pajares R, Piqueras M, García-Bosch O, López Serrano P, Castro B, Lucendo AJ, Montoro M, Castro Ortiz E, Mesonero F, García-Planella E, Fuentes DA, Bort I, Delgado-Guillena P, Arias L, Iglesias A, Calvo M, Esteve M, Domènech E, Gisbert JP. Effectiveness and Safety of Ustekinumab in Ulcerative Colitis: Real-world Evidence from the ENEIDA Registry. J Crohns Colitis. 2021;15:1846-1851. [PubMed] [DOI] |
| 15. | Biancone L, Ardizzone S, Armuzzi A, Castiglione F, D'Incà R, Danese S, Daperno M, Gionchetti P, Rizzello F, Scribano ML, Vecchi M, Orlando A. Ustekinumab for treating ulcerative colitis: an expert opinion. Expert Opin Biol Ther. 2020;20:1321-1329. [PubMed] [DOI] |
| 16. | Liu R, Li Z, Ye L, Hu J, Tang J, Chen B, Chen X, Tan B, Gu Y, Xie C, Ouyang C, Song X, Li F, Fan Y, Ren H, Zhu L, Chen M, Jiang W, Cao Q. Risk of Tuberculosis and Hepatitis B Reactivation in Patients With Crohn's Disease on Ustekinumab: A Nationwide Real-World Study. Inflamm Bowel Dis. 2023;. [PubMed] [DOI] |
| 17. | Jess T, Rungoe C, Peyrin-Biroulet L. Risk of colorectal cancer in patients with ulcerative colitis: a meta-analysis of population-based cohort studies. Clin Gastroenterol Hepatol. 2012;10:639-645. [PubMed] [DOI] |
| 18. | Beaugerie L, Itzkowitz SH. Cancers complicating inflammatory bowel disease. N Engl J Med. 2015;372:1441-1452. [PubMed] [DOI] |
| 19. | Beaugerie L, Svrcek M, Seksik P, Bouvier AM, Simon T, Allez M, Brixi H, Gornet JM, Altwegg R, Beau P, Duclos B, Bourreille A, Faivre J, Peyrin-Biroulet L, Fléjou JF, Carrat F; CESAME Study Group. Risk of colorectal high-grade dysplasia and cancer in a prospective observational cohort of patients with inflammatory bowel disease. Gastroenterology. 2013;145:166-175.e8. [PubMed] [DOI] |
| 20. | Kandiel A, Fraser AG, Korelitz BI, Brensinger C, Lewis JD. Increased risk of lymphoma among inflammatory bowel disease patients treated with azathioprine and 6-mercaptopurine. Gut. 2005;54:1121-1125. [PubMed] [DOI] |
| 21. | Kotlyar DS, Lewis JD, Beaugerie L, Tierney A, Brensinger CM, Gisbert JP, Loftus EV, Peyrin-Biroulet L, Blonski WC, Van Domselaar M, Chaparro M, Sandilya S, Bewtra M, Beigel F, Biancone L, Lichtenstein GR. Risk of lymphoma in patients with inflammatory bowel disease treated with azathioprine and 6-mercaptopurine: a meta-analysis. Clin Gastroenterol Hepatol. 2015;13:847-58.e4; quiz e48-50. [PubMed] [DOI] |
| 22. | Wetwittayakhlang P, Tselekouni P, Al-Jabri R, Bessissow T, Lakatos PL. The Optimal Management of Inflammatory Bowel Disease in Patients with Cancer. J Clin Med. 2023;12. [PubMed] [DOI] |
| 23. | Cohen RD, Bhayat F, Blake A, Travis S. The Safety Profile of Vedolizumab in Ulcerative Colitis and Crohn's Disease: 4 Years of Global Post-marketing Data. J Crohns Colitis. 2020;14:192-204. [PubMed] [DOI] |
| 24. | Abreu MT, Rowbotham DS, Danese S, Sandborn WJ, Miao Y, Zhang H, Tikhonov I, Panaccione R, Hisamatsu T, Scherl EJ, Leong RW, Arasaradnam RP, Afif W, Peyrin-Biroulet L, Sands BE, Marano C. Efficacy and Safety of Maintenance Ustekinumab for Ulcerative Colitis Through 3 Years: UNIFI Long-term Extension. J Crohns Colitis. 2022;16:1222-1234. [PubMed] [DOI] |
| 25. | Kopylov U, Hanzel J, Liefferinckx C, De Marco D, Imperatore N, Plevris N, Baston-Rey I, Harris RJ, Truyens M, Domislovic V, Vavricka S, Biemans V, Myers S, Sebastian S, Ben-Horin S, González Lama Y, Gilletta C, Ariella BS, Zelinkova Z, Weisshof R, Storan D, Zittan E, Farkas K, Molnar T, Franchimont D, Cremer A, Afif W, Castiglione F, Lees C, Barreiro-de Acosta M, Lobaton T, Doherty G, Krznaric Z, Pierik M, Hoentjen F, Drobne D. Effectiveness of ustekinumab dose escalation in Crohn's disease patients with insufficient response to standard-dose subcutaneous maintenance therapy. Aliment Pharmacol Ther. 2020;52:135-142. [PubMed] [DOI] |