修回日期: 2022-01-20
接受日期: 2022-04-06
在线出版日期: 2022-04-28
胃癌是一种常见的消化系统恶性肿瘤, 具有发病率高, 预后差等特点. 由于缺少有效的标志物, 患者常确诊于晚期, 错过最佳治疗时机. miR-720在其他恶性肿瘤中的功能已被广泛报道, 但其在胃癌发展中的具体作用尚不清楚.
通过检测miR-720在胃癌中的表达水平,及其生物学功能, 评估miR-720在胃癌预后及肿瘤进展中的价值.
实时荧光定量PCR(qRT-PCR)分析miR-720的表达水平, 采用Kaplan-Meier和Cox分析miR-720的预后价值, 通过细胞转染过表达或敲低miR-720的表达水平, 并通过CCK-8(Cell counting kit)和Transwell实验分析胃癌细胞的增殖、转移和侵袭能力.
miR-720在胃癌组织和细胞系中表达下调, 且与患者TNM分期和不良预后显著相关(P<0.05). miR-720和患者TNM分期可作为胃癌的独立预后因子, 且miR-720的下调表达促进胃癌细胞的增殖、转移和侵袭能力.
miR-720可能参与胃癌的进展过程并与患者的不良预后密切相关, 为胃癌的治疗提供新的治疗靶点和治疗策略.
核心提要: miR-720在胃癌中的下调表达, 与肿瘤的恶性进展及患者的不良预后密切相关. 此外, miR-720可充当胃癌的肿瘤抑制因子, 一直胃癌的细胞增殖、迁移及侵袭过程. miR-720可作为胃癌有效的生物标志物及潜在的治疗靶点.
引文著录: 陈瑛. 胃癌中miR-720表达的预后价值及其对肿瘤进展的调控作用. 世界华人消化杂志 2022; 30(8): 349-355
Revised: January 20, 2022
Accepted: April 6, 2022
Published online: April 28, 2022
Gastric cancer is a common malignant tumor of the digestive system with a high incidence and poor prognosis. Due to the lack of effective markers, patients are always diagnosed at an advanced stage and miss the best chance for treatment. The function of miR-720 in other malignancies has been widely reported, but its specific role in the development of gastric cancer remains unknown.
To evaluate the value of miR-720 in the prognosis and tumor progression of gastric cancer, by analyzing its expression level and biological effect in gastric cancer.
The expression level of miR-720 was analyzed by real-time quantitative PCR, the prognostic value of miR-720 was evaluated by Kaplan-Meier and Cox regression analysis, and the proliferation, metastasis, and invasion of gastric cancer cells with down-regulated expression of miR-720 were analyzed by CCK-8 and Transwell assays.
The expression of miR-720 was down-regulated in gastric cancer tissues and cell lines, which was significantly associated with TNM stage and poor prognosis of patients (P < 0.05). MiR-720 expression and TNM stage were identified as independent prognostic factors for gastric cancer, and down-regulated expression of miR-720 promoted the proliferation, metastasis, and invasion of gastric cancer cells.
MiR-720 may be involved in the progression of gastric cancer and provide a new therapeutic target for the treatment of this malignancy.
- Citation: Chen Y. Role of miR-720 in prognosis and progression of gastric cancer. Shijie Huaren Xiaohua Zazhi 2022; 30(8): 349-355
- URL: https://www.wjgnet.com/1009-3079/full/v30/i8/349.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v30.i8.349
胃癌是全球范围的常见恶性肿瘤, 近年来, 胃癌发病率有所下降, 但死亡率仍处于较高水平[1,2]. 由于早期症状无特异性, 明显症状多出现于晚期胃癌, 大部分胃癌患者也因此确诊于进展期, 恶性程度更高, 出现病变转移是胃癌患者常见的致死原因[3]. 因此, 探究胃癌进展相关的分子标志物对提高胃癌生存率有重要意义. 胃癌的发生发展是多基因异常引起的渐进性过程, 之前有研究报道了在胃癌发生发展中其作用的分子标志物有很多. 如阿片类结合蛋白/细胞粘附分子样基因(opioid binding protein/cell adhesion molecule-like, OPCML)可以作为胃癌的独立预后因子, 对胃癌细胞活力、凋亡及肿瘤发展过程中有重要作用[4].
近年来, microRNA(miRNA)在肿瘤发生发展及预后中的作用逐渐成为研究热点. miRNA是一系列由20-24个核苷酸组成的内源性非编码RNA, 其通过与蛋白编码基因mRNA结合, 在转录后水平抑制基因表达, 进而调控机体的生长发育和疾病的发生过程[5]. 之前已有关于miRNA在胃癌及其他疾病发展过程中的研究发现, miRNA可以作为多种疾病的分子标志物, 为疾病的治疗提供新的治疗靶点. 例如, miR-129-5p能够通过调控HMGB1的表达抑制胃癌细胞增殖和上皮间质转化[6]. miR-520b能够通过靶向HDAC4抑制肺癌细胞的增殖[7]. 之前关于胃癌miRNA表达谱的研究中发现, miR-720在胃癌组织中显著下调[8], 且在其他肿瘤的研究中, 如乳腺癌、结直肠癌、宫颈癌及肾细胞癌等, miR-720的上调或下调表达在肿瘤的进展或患者预后中有重要作用[9-12]. 但是, miR-720在胃癌中的下调表达是否会影响胃癌的发展过程, 以及miR-720在胃癌中的生物学功能还需要进一步探究.
因此, 本文通过实时荧光定量PCR(qRT-PCR)在胃癌组织及正常癌旁组织中的表达, 通过CCK-8及Transwell实验研究了miR-720在胃癌细胞增殖、转移及侵袭中的作用, 旨在为胃癌提供新的治疗策略和潜在的治疗靶点.
本研究于2012-2014选取在诸暨市中心医院接受胃癌手术治疗的124名患者, 纳入标准如下: (1)患者确诊为胃癌且具有明显的手术指征; (2)患者未确诊其他恶性肿瘤或合并其他慢性疾病; (3)患者术前未接受任何形式抗癌治疗; (4)患者临床数据完整.
采集患者的胃癌组织及相应的正常癌旁组织(距离病灶区至少5 cm). 采集到的组织经至少两名病理学家确认, 并保存于液氮中, 用于后续实验. 通过5年电话随访或门诊复查获得患者在术后的生存信息. 所有患者均签署知情同意书, 伦理符合"赫尔辛基宣言"和"诸暨市中心医院伦理委员会宣言"准则(伦理学批件号: KZC20110531).
1.2.1 细胞培养与转染: 选择胃癌细胞系(HGC27、NCI-N87、MKN45及SNU-1)和正常胃粘膜细胞系(GES-1)探究miR-720在胃癌细胞中的表达及其生物学功能. 所选细胞系购自中国上海细胞研究所, 在含有10%胎牛血清的RPMI1640培养基中, 于37 ℃, 5% CO2人工培养箱中培养至对数生长期.
取两等份RPMI1640培养基分别与Lipofectamine 2000(Invitrogen, 美国)及实验载体包括miR-720类似物(miR-720 mimic, 5'-CGTCTCGCTGGGGC CTCCATTCAAGAGA-3')、miR-720抑制物(miR-720 inhibitor, 5'-TCTCTTGAATGGAGGCCCCAGC GAGAGCG-3')及相应的阴性对照(mimic NC、inhibitor NC)在室温下混合, 静置10 min. 而后将两份培养基等体积混匀, 室温下静置10 min. 弃去培养液, PBS清洗两次, 得到转染细胞.
1.2.2 总RNA提取及qRT-PCR: 使用TRIzol试剂(Invitrogen, 美国)分离胃癌组织及细胞中的总RNA, 并通过OD260/OD280测定其纯度. 之后将提取的RNA反转录为cDNA(TaKaRa反转录试剂盒, 美国). 通过qRT-PCR(Applied Biosystems 7500 Sequence检测系统)对miR-720的相对表达量进行分析(SYBR Premix Ex TaqTM试剂盒). PCR反应条件为5 ℃孵育2min后, 于95 ℃下变性5 s. 60 ℃退火反应10 s, 而后6延伸 10 s, 共40个循环. 分析过程以U6作为内参, 通过2-ΔΔCt方法计算得到miR-720的相对表达量.
1.2.3 CCK-8实验检测细胞增殖能力: 将培养至对数生长期的细胞接种至96孔细胞培养板上, 接种密度为5×103个/孔. 将培养板放置在37 ℃, 5% CO2培养箱中培养, 在培养0、24、48、72 h后, 向每孔中加入CCK-8溶液, 之后继续培养4 h. 培养结束后, 以酶标仪(Thermo Fisher Scientific)测定每孔在450 nm处的吸光值(OD450).
1.2.4 Transwell实验检测细胞转移、侵袭能力: 将转染后的细胞接种于Transwell上室, 接种的细胞密度为2×105个/孔, 侵袭实验需提前包被基质胶. Transwell上室以无血清的血清培养基填充, 下室使用含有10%血清的培养基填充. 之后, 将培养板置于37 ℃, 5% CO2培养箱中孵育48 h. 培养结束后, 将下室细胞固定, 结晶紫染色, 之后显微镜计数转移和侵袭的细胞数量, 评估细胞的转移和侵袭能力.
统计学处理 所有数据以mean±SD的形式表示, 使用SPSS 19.0和GraphPad Prism 5.0软件进行数据处理. 对组间差异分析采用Student's t test及ANOVA, 通过χ2检验分析miR-720表达量与患者临床特征之间的相关性. 另外, 通过Kaplan-Meier法和log-rank检验对患者的生存率进行分析, 通过Cox多元回归分析对miR-720的预后价值进行了评估. 当P<0.05时认为具有统计学意义.
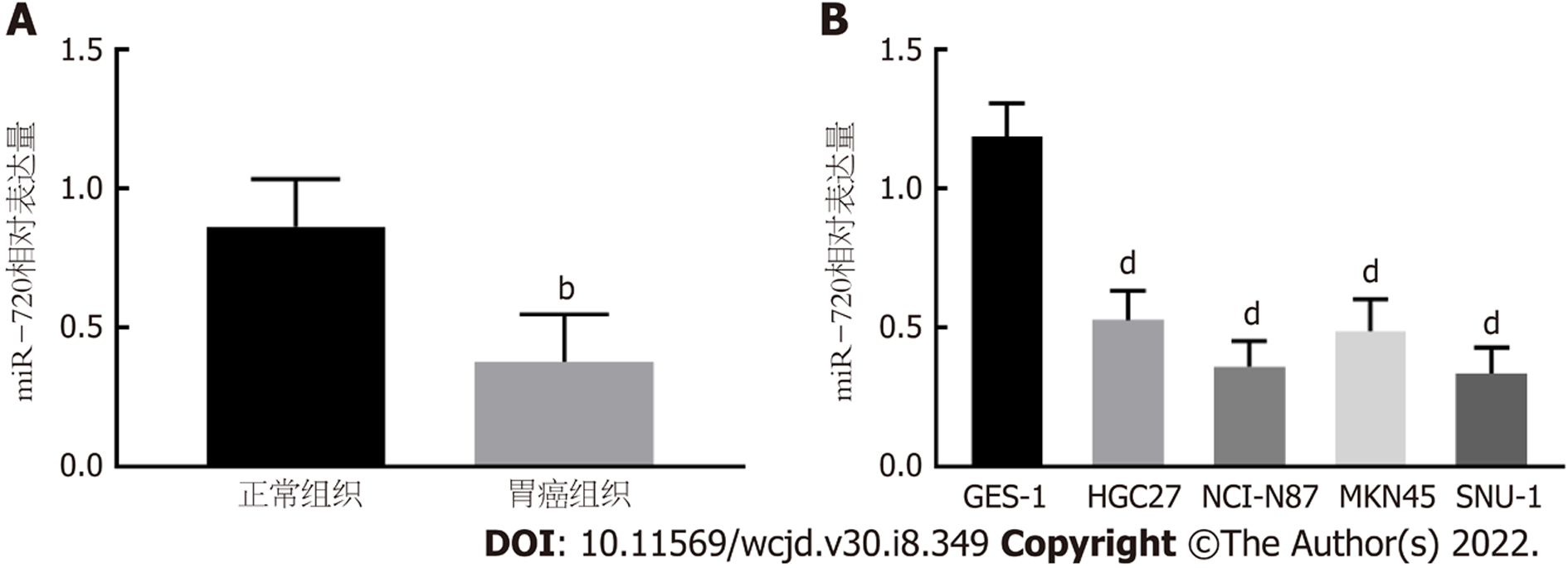
由qRT-PCR检测miR-720在胃癌组织和细胞系中的相对表达量发现, 与正常癌旁组织及正常胃粘膜细胞系(GES-1)相比, miR-720在胃癌组织和细胞系(HGC27、NCI-N87、MKN45、SNU-1)中的表达显著下调(P<0.001, 图1). 选择NCI-N87和SNU-1作为细胞实验所用的细胞系.
以miR-720在胃癌组织中表达量的平均值(0.377)为分界点, 将124名胃癌患者分为两组, 其中miR-720低表达组包含68名患者, miR-720高表达组包含56名患者, 患者的临床特征如表1所示. 通过卡方分析发现, miR-720表达量与患者的TNM分期密切相关(P = 0.006), 与其他临床特征没有显著的相关性.
| 患者人数(n = 124) | miR-720低表达(n = 68) | miR-720高表达(n = 56) | P值 | |
| 年龄 | ||||
| ≤50 | 65 | 36 | 29 | 0.624 |
| >50 | 59 | 32 | 27 | |
| 性别 | ||||
| 男 | 67 | 33 | 34 | 0.788 |
| 女 | 57 | 35 | 22 | |
| 组织分化程度 | ||||
| 中高程度分化 | 71 | 39 | 32 | 0.284 |
| 低度分化 | 53 | 29 | 24 | |
| TNM分期 | ||||
| Ⅰ-Ⅱ | 70 | 29 | 41 | 0.006 |
| Ⅲ-Ⅳ | 54 | 39 | 15 | |
| 淋巴结转移 | ||||
| 阴性 | 66 | 37 | 29 | 0.169 |
| 阳性 | 58 | 31 | 27 |
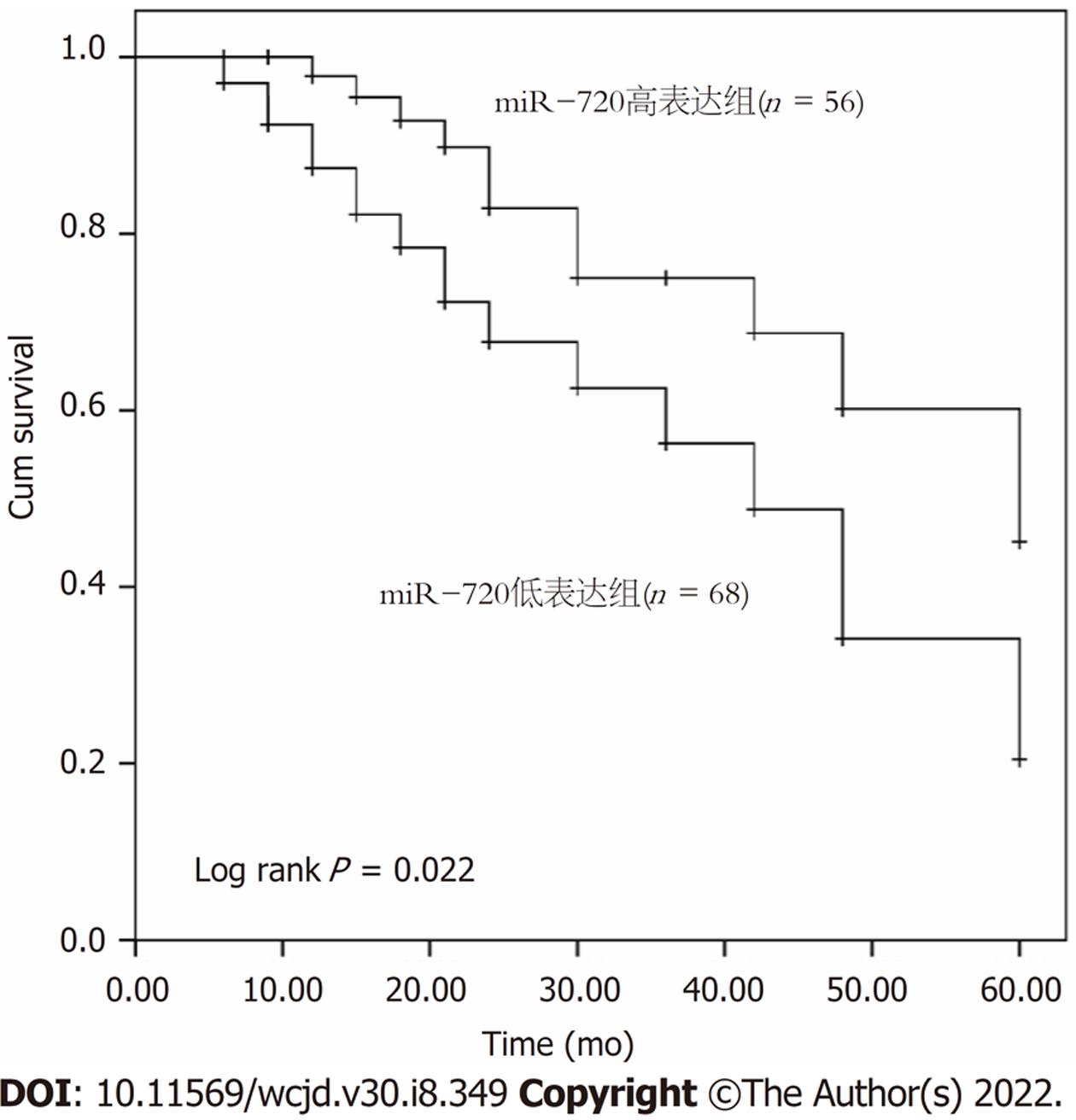
通过5年电话随访获得患者的生存信息, 并绘制得到Kaplan-Meier生存曲线如图2所示. miR-720低表达的患者五年生存率显著低于miR-720高表达患者的生存率(Log rank P = 0.022).
Cox多元回归分析结果证明, miR-720(HR = 2.452, 95%CI= 1.192-5.044, P = 0.015)和TNM分期(HR = 2.106, 95%CI = 1.003-4.423, P = 0.049)可以作为胃癌的独立预后因子(表2).
| HR | 95%CI | P值 | |
| miR-720 | 2.452 | 1.192-5.044 | 0.015 |
| 年龄 | 1.122 | 0.583-2.159 | 0.73 |
| 性别 | 1.228 | 0.633-2.380 | 0.543 |
| 组织分化程度 | 1.412 | 0.678-2.944 | 0.357 |
| TNM分期 | 2.106 | 1.003-4.423 | 0.049 |
| 淋巴结转移 | 1.673 | 0.759-3.686 | 0.202 |
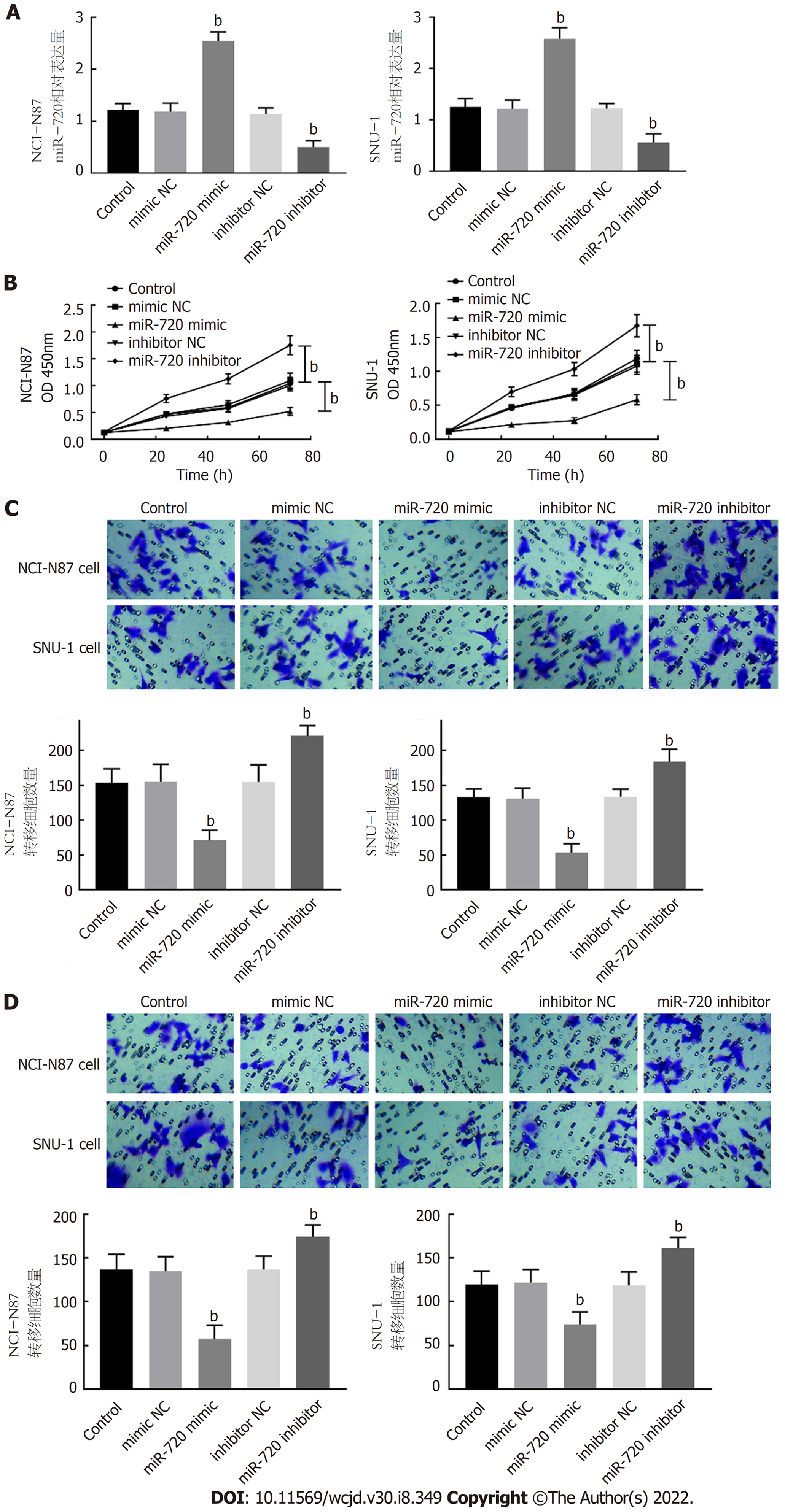
通过转染miR-720 mimic、miR-720 inhibitor及相应的阴性对照, 调控miR-720在胃癌细胞中的表达. 在NCI-N87和SNU-1转染miR-720 mimic后, miR-720的表达量显著升高, 而miR-720 inhibitor的转染显著抑制了miR-720的表达量(P<0.001, 图3A). 在miR-720上调的细胞中, 细胞的增殖能力受到抑制, 而miR-720的下调表达显著促进了胃癌细胞的增殖(P<0.05, 图3B). 在Transwell检测细胞转移与侵袭的实验中发现, miR-720的上调表达对NCI-N87和SNU-1的转移和侵袭都有显著的抑制作用, 而miR-720的下调表达对二者的转移和侵袭有显著的促进作用(P<0.001, 图3C和D).
胃癌作为常见的恶性肿瘤之一, 其较高的发病率和死亡率威胁者人类的健康. 手术虽是胃癌治疗最常见最有效的手段, 但术后的复发和转移是胃癌不良预后的主要原因. 随着分子生物学的发展, 分子标志物的发现对理解肿瘤的发生发展过程, 寻找新的治疗策略有重要意义. 恶性肿瘤的发生与发展与维持机体细胞正常生长、分化过程基因的异常调控有关[13]. 之前已有报道多种miRNAs, 尤其是异常表达的miRNA, 在不同的肿瘤发生发展过程中具有重要作用[14-16]. 例如, 在胃癌中也有大量异常表达的miRNAs被证实可以作为胃癌的生物标志物, 如miR-539, miR-1179, miR-129-5p等, 这些miRNAs都参与了胃癌的进展, 且对胃癌细胞的增殖、转移和侵袭等过程具有重要影响[6,17,18]. 之前对miR-720的研究中发现, miR-720在多种肿瘤的进展中起重要作用, 如, miR-720通过靶向TWIST1抑制乳腺癌细胞的转移和侵袭[19]. miR-720还可以通过调控Rab35的表达促进宫颈癌细胞的转移[11]. 此外, miR-720对肿瘤患者的预后也具有重要的预测价值. 例如, 在结直肠癌中, miR-720的高表达可作为结直肠癌患者的不利预后因素, 并与肿瘤的恶化密切相关[10]. 胃癌miRNA表达谱中发现, miR-720在胃癌组织中表达与正常组织相比, 显著下调, 而对其在胃癌中的生物学功能及预后价值探讨不够[8].
本文对124名胃癌患者胃癌组织及正常癌旁组织中miR-720的表达进行分析发现, miR-720在胃癌组织中表达下调, 且miR-720的下调表达与患者的TNM分期密切相关, 这与之前报道结果一致[8]. miR-720下调表达的患者5年生存率较miR-720上调表达患者低, 且miR-720与TNM分期可作为胃癌的独立预后因子. 此外, 在胃癌细胞中, miR-720的下调表达对胃癌细胞的增殖、转移和侵袭有明显的促进作用, 反之, miR-720的上调表达能显著抑制胃癌细胞的增殖、转移和侵袭能力. 之前的研究中, 对miR-720的下游靶基因进行了广泛的报道, 揭示了miR-720调控不同肿瘤发生发展的潜在分子机制. 例如, 乳腺癌中, miR-720作为肿瘤抑制因子通过靶向TWIST1, 抑制乳腺癌细胞的侵袭与迁移过程, 进而阻碍肿瘤的进展过程[19]. miR-720在胶质瘤中的表达对TARSL2的表达具有显著的抑制作用, 且通过调控TARSL2促进胶质瘤细胞的增殖及迁移侵袭过程[20]. 因此, 对于miR-720在胃癌中发挥作用的分子机制的研究, 可视为本研究的进一步研究目标.
综上所述, miR-720在胃癌中下调表达且与胃癌患者的不良预后密切相关. miR-720抑制胃癌细胞的增殖、转移和侵袭, 说明miR-720可能参与了胃癌的发展, 这为胃癌的治疗提供了新的潜在的治疗靶点. 但具体的分子机制还尚不清楚, 需要深入的研究实验.
miRNAs被认为是肿瘤有效的生物标志物, 调控肿瘤的进展, 预测患者的预后状态. 已有研究发现, miR-720在胃癌中异常表达, 且在多种人体恶性肿瘤华中具有调控作用. 但其对胃癌进展及预后的影响尚不清楚.
探讨miR-720在胃癌中的具体表达、临床价值及生物学功能, 为胃癌靶向治疗的研究提供潜在靶点及理论支持.
研究miR-720在胃癌组织及细胞系中的表达, 评估其在患者病情进展及生存状态中的价值. 并探讨其在肿瘤进展相关的细胞过程中的作用.
研究纳入124例胃癌患者, 比较患者正常组织与肿瘤组织中miR-720的表达水平, 并患者临床病理特征及生存状况与miR-720表达的相关性评估miR-720在胃癌进展中的临床价值. 通过细胞转染调控miR-720的表达, 通过细胞增殖及迁移侵袭实验, 评估miR-720在细胞过程中的调控作用.
miR-720在胃癌组织及细胞系中显著下调, 且与患者的TNM分期密切相关. miR-720可作为胃癌的不良预后因子及肿瘤抑制因子, 预测患者的不良生存状况, 抑制胃癌细胞的增殖、迁移及侵袭过程.
miR-720充当胃癌的预后生物标志物及肿瘤抑制因子, 并有望成为胃癌治疗的潜在治疗靶点.
miR-720预测患者不良预后及恶性进展, 抑制肿瘤进展过程, 为胃癌靶向治疗的研究提供了潜在靶点.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): 0
D级 (一般): D, D, D
E级 (差): E
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Ferlay J, Soerjomataram I, Dikshit R, Eser S, Mathers C, Rebelo M, Parkin DM, Forman D, Bray F. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. Int J Cancer. 2015;136:E359-E386. [PubMed] [DOI] |
| 3. | Meng FS, Zhang ZH, Wang YM, Lu L, Zhu JZ, Ji F. Comparison of endoscopic resection and gastrectomy for the treatment of early gastric cancer: a meta-analysis. Surg Endosc. 2016;30:3673-3683. [PubMed] [DOI] |
| 4. | Xing X, Cai W, Ma S, Wang Y, Shi H, Li M, Jiao J, Yang Y, Liu L, Zhang X, Chen M. Down-regulated expression of OPCML predicts an unfavorable prognosis and promotes disease progression in human gastric cancer. BMC Cancer. 2017;17:268. [PubMed] [DOI] |
| 5. | Zhang Y, Wang Z, Gemeinhart RA. Progress in microRNA delivery. J Control Release. 2013;172:962-974. [PubMed] [DOI] |
| 6. | Wang S, Chen Y, Yu X, Lu Y, Wang H, Wu F, Teng L. miR-129-5p attenuates cell proliferation and epithelial mesenchymal transition via HMGB1 in gastric cancer. Pathol Res Pract. 2019;215:676-682. [PubMed] [DOI] |
| 7. | Jin K, Zhao W, Xie X, Pan Y, Wang K, Zhang H. MiR-520b restrains cell growth by targeting HDAC4 in lung cancer. Thorac Cancer. 2018;9:1249-1254. [PubMed] [DOI] |
| 8. | Hwang J, Min BH, Jang J, Kang SY, Bae H, Jang SS, Kim JI, Kim KM. MicroRNA Expression Profiles in Gastric Carcinogenesis. Sci Rep. 2018;8:14393. [PubMed] [DOI] |
| 9. | Das SG, Romagnoli M, Mineva ND, Barillé-Nion S, Jézéquel P, Campone M, Sonenshein GE. miR-720 is a downstream target of an ADAM8-induced ERK signaling cascade that promotes the migratory and invasive phenotype of triple-negative breast cancer cells. Breast Cancer Res. 2016;18:40. [PubMed] [DOI] |
| 10. | Wang X, Kuang Y, Shen X, Zhou H, Chen Y, Han Y, Yuan B, Zhou J, Zhao H, Zhi Q, Xue X. Evaluation of miR-720 prognostic significance in patients with colorectal cancer. Tumour Biol. 2015;36:719-727. [PubMed] [DOI] |
| 11. | Tang Y, Lin Y, Li C, Hu X, Liu Y, He M, Luo J, Sun G, Wang T, Li W, Guo M. MicroRNA-720 promotes in vitro cell migration by targeting Rab35 expression in cervical cancer cells. Cell Biosci. 2015;5:56. [PubMed] [DOI] |
| 12. | Bhat NS, Colden M, Dar AA, Saini S, Arora P, Shahryari V, Yamamura S, Tanaka Y, Kato T, Majid S, Dahiya R. MicroRNA-720 Regulates E-cadherin-αE-catenin Complex and Promotes Renal Cell Carcinoma. Mol Cancer Ther. 2017;16:2840-2848. [PubMed] [DOI] |
| 14. | Li D, Song H, Wu T, Xie D, Hu J, Zhao J, Shen Q, Fang L. MiR-519d-3p suppresses breast cancer cell growth and motility via targeting LIM domain kinase 1. Mol Cell Biochem. 2018;444:169-178. [PubMed] [DOI] |
| 15. | Luo L, Xia L, Zha B, Zuo C, Deng D, Chen M, Hu L, He Y, Dai F, Wu J, Wang C, Wang Y, Zhang Q. miR-335-5p targeting ICAM-1 inhibits invasion and metastasis of thyroid cancer cells. Biomed Pharmacother. 2018;106:983-990. [PubMed] [DOI] |
| 16. | Zhu L, Tu H, Liang Y, Tang D. MiR-218 produces anti-tumor effects on cervical cancer cells in vitro. World J Surg Oncol. 2018;16:204. [PubMed] [DOI] |
| 17. | Jin W, Han H, Liu D. Downregulation miR-539 is associated with poor prognosis of gastric cancer patients and aggressive progression of gastric cancer cells. Cancer Biomark. 2019;26:183-191. [PubMed] [DOI] |
| 18. | Li Y, Qin C. MiR-1179 inhibits the proliferation of gastric cancer cells by targeting HMGB1. Hum Cell. 2019;32:352-359. [PubMed] [DOI] |
| 19. | Li LZ, Zhang CZ, Liu LL, Yi C, Lu SX, Zhou X, Zhang ZJ, Peng YH, Yang YZ, Yun JP. miR-720 inhibits tumor invasion and migration in breast cancer by targeting TWIST1. Carcinogenesis. 2014;35:469-478. [PubMed] [DOI] |