修回日期: 2021-11-30
接受日期: 2022-02-22
在线出版日期: 2022-02-28
连翘苷是中药连翘的主要活性成分之一, 具有抗肝癌、肺癌和肾癌的作用, 但其能否影响胃癌细胞的恶性行为还未知. 长基因间非编码RNA 00342(LINC00342)是一种非小细胞肺癌和结直肠癌中表达增加的长链非编码RNA(lncRNA), 其作为促癌基因促进这些肿瘤细胞的恶性行为, 进而促进肿瘤的发展进程. 本研究假设连翘苷可通过抑制LINC00342发挥抗胃癌作用.
探讨连翘苷对胃癌细胞增殖、迁移、侵袭和炎症因子表达的影响及可能机制.
体外培养胃癌HGC-27细胞, 用不同剂量(5、10、20 μmol/L)连翘苷干预24 h后, CCK-8和克隆形成实验检测检测细胞增殖, Transwell检测细胞迁移和侵袭, 蛋白质印迹法检测细胞中E-cadherin和N-cadherin蛋白表达, 试剂盒检测细胞培养上清液中炎症因子TNF-α和IL-6表达, qRT-PCR法检测细胞中LINC00342表达. 收集51例胃癌组织和癌旁组织, qRT-PCR法检测组织中LINC00342表达. 转染LINC00342小干扰RNA或过表达载体至HGC-27细胞, 上述相同方法观察LINC00342对HGC-27细胞增殖、迁移、侵袭及炎症因子表达的影响.
与对照组比较, HGC-27细胞经不同剂量连翘苷干预后, 细胞增殖抑制率、E-cadherin蛋白表达量均升高(P<0.05), 细胞克隆数、迁移数、侵袭数及细胞中N-cadherin蛋白和LINC00342的表达量、细胞培养上清液中TNF-α和IL-6表达均降低(P<0.05). 胃癌组织中LINC00342的表达量为显著高于癌旁组织(P<0.05). 敲减LINC00342后, HGC-27细胞增殖抑制率、E-cadherin蛋白表达量均升高(P<0.05), 细胞克隆数、迁移数、侵袭数、细胞中N-cadherin蛋白表达、细胞培养上清液中TNF-α和IL-6表达均降低(P<0.05). 过表达LINC00342逆转了连翘苷对HGC-27细胞增殖、迁移、侵袭和炎症因子表达的影响.
连翘苷可抑制胃癌HGC-27细胞增殖、迁移和侵袭及炎症因子TNF-α和IL-6表达, 其作用机制可能与下调细胞中LINC00342表达有关.
核心提要: 连翘苷可抑制胃癌HGC-27细胞增殖、迁移和侵袭, 同时抑制细胞中炎症因子TNF-α和IL-6的表达, 这可与其下调了细胞中长基因间非编码RNA 00342的表达有关.
引文著录: 李绍智, 练维生. 连翘苷调控LINC00342影响胃癌细胞增殖、迁移和侵袭及炎症因子表达的实验研究. 世界华人消化杂志 2022; 30(4): 182-190
Revised: November 30, 2021
Accepted: February 22, 2022
Published online: February 28, 2022
Forsythin is one of the main active components of the traditional Chinese medicine forsythia. It has anti-liver cancer, lung cancer, and kidney cancer effects, but whether it affects the malignant behavior of gastric cancer cells is still unknown. Long intergenic non-coding RNA 00342 (LINC00342) is a long non-coding RNA with increased expression in small cell lung cancer and colorectal cancer, which acts as an oncogene to promote the malignant behavior of these tumor cells, thereby promoting the development of tumors. We hypothesized that forsythin has an anti-gastric cancer effect by inhibiting LINC00342.
To investigate the effect of forsythin on the cell proliferation, migration, and invasion and the expression of inflammatory factors in gastric cancer cells and the possible mechanism involved.
Gastric cancer cells (HGC-27) were cultured in vitro and treated with different doses (5, 10, and 20 μmol/L) of forsythin for 24 h. Cell proliferation was detected by CCK-8 and colony formation assays, and cell migration and invasion were detected by Transwell assay. The protein expression of E-cadherin and N-cadherin in cells was detected by Western blot, and the expression of inflammatory factors TNF-α and IL-6 in cell culture supernatant was detected with commercial kits. qRT-PCR was used to detect the expression of LINC00342 in cells. Fifty-one cases of gastric cancer tissues and adjacent tissues were collected, and qRT-PCR was used to detect the expression of LINC00342 in the tissues. LINC00342 small interfering RNA or overexpression vector was transfected into HGC-27 cells, and the effects of LINC00342 on HGC-27 cell proliferation, migration, and invasion and the expression of inflammatory factors were explored.
Compared with the control group, the proliferation inhibition rate and the protein expression of E-cadherin in HGC-27 cells treated with different doses of forsythin were increased (P < 0.05), but the number of cell clones, migration and invasion, the expression of N-cadherin protein and LINC00342 in the cells, and the expression of TNF-α and IL-6 in the cell culture supernatant were all decreased (P < 0.05). The expression of LINC00342 in gastric cancer tissue was significantly higher than that in adjacent tissues (P < 0.05). After knocking down LINC00342, the proliferation inhibition rate and the protein expression of E-cadherin in HGC-27 cells treated with different doses of forsythin were increased (P < 0.05), but the number of cell clones, migration and invasion, the protein expression of N-cadherin in the cells, and the expression of TNF-α and IL-6 in the cell culture supernatant were decreased (P < 0.05). Overexpression of LINC00342 reversed the effects of forsythin on the cell proliferation, migration, and invasion and the expression of inflammatory factors in HGC-27 cells.
Forsythin may inhibit the proliferation, migration, and invasion of gastric cancer HGC-27 cells and the expression of inflammatory factors TNF-α and IL-6 via mechanisms that may be related to the down-regulation of the expression of LINC00342.
- Citation: Li SZ, Lian WS. Forsythin regulates cell proliferation, migration, and invasion and expression of inflammatory factors in gastric cancer cells by regulating LINC00342. Shijie Huaren Xiaohua Zazhi 2022; 30(4): 182-190
- URL: https://www.wjgnet.com/1009-3079/full/v30/i4/182.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v30.i4.182
胃癌是常见的消化系统恶性肿瘤, 其进展速度快, 严重威胁患者生命健康. 胃癌发病隐匿, 早期诊断率较低, 多数患者确诊时已处于中晚期[1]. 放化疗是中晚期患者治疗的常用手段, 但胃癌对化疗药物耐药性的产生常导致化疗疗效不佳[2]. 因此, 需要寻找用于治疗胃癌的新药物. 天然中草药或其活性成分具有毒副作用小、作用靶点多、价格便宜等优点, 是抗肿瘤药物研究的热点内容. 连翘苷是中药连翘的主要活性成分之一, 具有抗炎、抗氧化、抗衰老等功效[3]. 近年来研究显示, 连翘苷还具有一定的抗肿瘤作用. 连翘苷可通过调控circ_0054537/miR-409-3p表达抑制肝癌细胞的恶性生物学行为[4]; 连翘苷可通过下调VEGF和上调endostatin的表达抑制肺癌肿瘤发展[5]; 连翘苷可通过抑制PI3K/Akt信号通路降低肾癌细胞的生长、迁移和侵袭能力[6]. 但是, 连翘苷对胃癌发生发展的影响和机制还未知. 长基因间非编码RNA 00342(LINC00342)是一种长链非编码RNA(lncRNA), 其在非小细胞肺癌和结直肠癌等肿瘤中表达增加, 促进肿瘤细胞的恶性行为[7,8]. 然而, LINC00342对胃癌发生发展的影响还未知. 本研究主要探究了连翘苷和LINC00342对胃癌HGC-27细胞增殖、迁移、侵袭和炎症因子表达的影响及连翘苷能否调控LINC00342发挥作用, 报道如下.
1.1.1 临床资料: 51例胃癌组织及癌旁组织取自2018-10/2020-10于浙江省肿瘤医院行手术治疗的胃癌患者, 液氮保存. 男24例, 女性18例, 患者平均年龄(45.26±7.39)岁. 纳入标准: 首次确诊. 排除标准: 合并其他恶性肿瘤患者; 心脏、肾等重要脏器功能障碍患者. 研究符合《赫尔辛基宣言》原则.
1.1.2 细胞和试剂: HGC-27细胞系, 中国科学院上海细胞库; 连翘苷, 纯度≥98%, 上海科醚化学科技有限公司; RPMI 1640培养液、BCA蛋白检测试剂盒和CCK-8试剂盒, 北京索莱宝; 胎牛血清(fetal bovine serum, FBS), 浙江天杭生物科技有限公司; LipofectamineTM 2000试剂盒, 美国Invitrogen公司; RNA提取试剂盒、逆转录试剂盒和PCR试剂盒, 大连宝生物; LINC00342小干扰RNA(si-LINC00342)和过表达载体(pcDNA-LINC00342)、小干扰RNA阴性对照(si-NC)、空载体(pcDNA)及PCR引物, 上海生工; E-cadherin和N-cadherin抗体, 中国Abcam公司.
1.2.1 细胞培养: HGC-27细胞, 用含10% FBS的RPMI 1640培养液置于CO2培养箱中培养HGC-27细胞. 当细胞融合至90%时, 用0.25%胰蛋白酶消化, 传代培养.
1.2.2 CCK-8法检测细胞增殖抑制率: 将200 μL对数期HGC-27细胞(5.0×104个/mL)接种至96孔板中, 培养4 h后, 弃培养液, 分别用含0、5、10、20 μmol/L[4]连翘苷的培养液培养, 分别记为对照组、连翘苷低剂量组、连翘苷中剂量组、连翘苷高剂量组. 培养24 h后, 加10 μL CCK-8, 孵育2 h, 用酶标仪(波长450 nm)测光密度(optical density, OD)值. 增殖抑制率(%) = (OD对照组-OD实验组)/OD对照组×100 %. 实验重复3次.
1.2.3 克隆形成实验: 取2.5 mL对数期HGC-27细胞(5.0×104个/mL)接种至6孔板中, 按上述1.2.2分组处理. 每2 d更换一次, 培养14 d. 弃培养液, 经多聚甲醛固定、结晶紫染色后, 显微镜观察, 统计克隆形成数. 实验重复3次.
1.2.4 Transwell实验检测细胞迁移和侵袭: 取2.5 mL对数期HGC-27细胞(5.0×104个/mL)接种至6孔板中, 按上述1.2.2分组处理. 培养24 h后, 收集细胞, 并调整各组细胞浓度为2.5×105个/mL. 侵袭实验: 将Transwell小室置于24孔板中, 铺Matrigel基质胶, 自然晾干. 取100 μL各组细胞悬液加至上室, 500 μL完全培养液加至下室. 培养24 h后, 弃培养液, 用多聚甲醛固定、结晶紫染色会后, 显微镜观察, 记数. 迁移实验: 除不铺Matrigel基质胶外, 操作过程与侵袭实验相同.
1.2.5 蛋白质印迹(Western blotting)法检测E-cadherin和N-cadherin蛋白表达: 取2.5 mL对数期HGC-27细胞(5.0×104个/mL)接种至6孔板中, 按上述1.2.2分组处理. 培养24 h后, 用RIPA试剂提取细胞中总蛋白, BCA法检测蛋白浓度. 行10% SDS-PAGE电泳, 将分离蛋白转至PVDF膜, 用5%脱脂奶粉封闭1 h. 于4 ℃冰箱中分别用E-cadherin(1:500)、N-cadherin(1:500)、GAPDH(1:1000)一抗孵育过夜, 洗膜后, 再于山羊抗兔二抗(1:2000)中37 ℃孵育1 h. 加显影液, 避光显影, 曝光拍照.
1.2.6 试剂盒检测细胞培养上清液中TNF-α和IL-6表达: 取2.5 mL对数期HGC-27细胞(5.0×104个/mL)接种至6孔板中, 按上述1.2.2分组处理. 培养24 h后, 收集各组细胞培养上清液. 3500 r/min离心10 min后, 分别利用TNF-α和IL-6试剂盒检测上清液中其表达水平.
1.2.7 qRT-PCR检测LINC00342表达: (1)细胞接种和处理同1.2.5, 培养24 h后, 收集细胞, 检测细胞中LINC00342表达; (2)在液氮保护下, 研磨组织样本, 检测组织样本中LINC00342蛋白表达. 用RNA提取试剂盒提取细胞或组织中总RNA, 逆转录后, 行PCR扩增. 引物序列: LINC00342上游5'-CGTTCCAATGTGTTGGGT-3', 下游5'-TGGGAGGAGGTTGAGATG-3'; GAPDH上游5'-ACGGATTTGGTCGTATTGGGCG-3', 下游5'-CTCCTGGAAGATGGTGATGG-3'. 2-△△Ct法计算LINC00342相对GAPDH的表达量.
1.2.8 细胞转染和处理: 取2.5 mL对数期HGC-27细胞(5.0×104个/mL)接种至6孔板中, 培养24 h后, 用LipofectamineTM 2000脂质体法分别转染si-LINC00342、si-NC、pcDNA-LINC00342、pcDNA至HGC-27细胞, 转染12 h后, 更换为完全培养液. 再培养24 h, qRT-PCR检测细胞中LINC00342表达验证转染效果, 方法同1.2.8. 将转染后的HGC-27细胞均接种至培养板中, 培养4 h后, 弃培养液, 分组处理. 其中转染si-LINC00342、si-NC的HGC-27细胞均用不含连翘苷的培养液培养, 分别记为si-LINC00342组、si-NC组. 转染pcDNA-LINC00342、pcDNA的HGC-27细胞均用含20 μmol/L连翘苷的培养液培养分别记为连翘苷+pcDNA-LINC00342组、连翘苷+pcDNA组. 培养24 h后, 分别参照1.2.2-1.2.6检测细胞细胞抑制率、克隆形成数、迁移和侵袭数、细胞中E-cadherin和N-cadherin蛋白表达及细胞培养上清液中TNF-α和IL-6表达.
统计学处理 SPSS 22.0软件分析实验数据. 计量资料以均数±标准差(mean±SD)表示, 经正态性检验和方差齐性检验后, 两组间比较行独立样本t检验; 多组间比较用单因素方差分析, 组间两两比较用LSD-t检验. 以P<0.05表示差异有统计学意义.
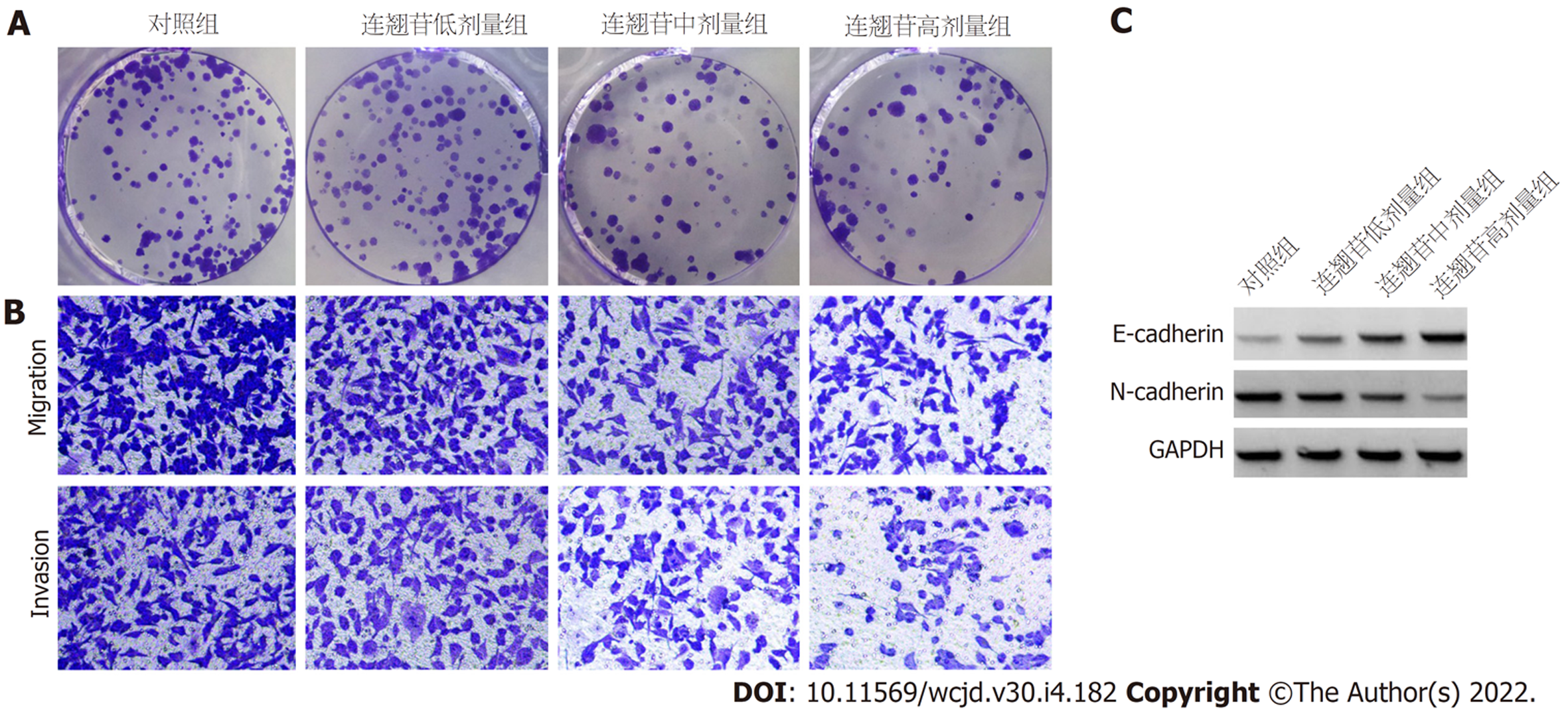
与对照组比较, 胃癌HGC-27细胞经不同剂量连翘苷作用后, 细胞增殖抑制率升高(P<0.05), 细胞克隆数、迁移数和侵袭数及细胞中N-cadherin蛋白表达均降低(P<0.05), E-cadherin蛋白表达升高(P<0.05), 细胞培养上清液中TNF-α和IL-6表达降低(P<0.05), 且呈剂量依赖性. 见图1、表1及补充材料表1.
| 分组 | 抑制率/% | 细胞数/个 | pg/mL | E-cadherin (97kDa) | N-cadherin (125kDa) | |||
| 克隆 | 迁移 | 侵袭 | TNF-α | IL-6 | ||||
| 对照组 | 0.00±0.00 | 113.00±8.83 | 174.33±9.98 | 143.00±6.68 | 269.57±16.67 | 352.17±29.15 | 0.22±0.02 | 0.57±0.06 |
| 连翘苷低剂量组 | 18.39±1.67a | 88.67±4.50a | 148.33±7.59a | 115.67±4.11a | 211.12±10.37a | 280.73±17.75a | 0.37±0.04a | 0.43±0.03a |
| 连翘苷中剂量组 | 36.29±4.39ab | 59.67±1.70ab | 106.33±6.94ab | 86.33±2.62ab | 146.95±10.01ab | 214.76±18.47ab | 0.57±0.06ab | 0.27±0.04ab |
| 连翘苷高剂量组 | 61.62±4.00abc | 41.00±2.45abc | 73.00±3.74abc | 54.00±2.94abc | 95.15±7.04abc | 124.96±11.62abc | 0.82±0.07abc | 0.15±0.01abc |
| F | 217.625 | 71.444 | 109.944 | 228.358 | 129.159 | 68.43 | 77.143 | 65.226 |
| P | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
与对照组比较, 胃癌HGC-27细胞经不同剂量连翘苷作用后, 细胞中LINC00342表达降低(P<0.05), 且呈剂量依赖性. 见表2.
胃癌组织中LINC00342的表达量为2.39±0.40, 显著高于癌旁组织中LINC00342的表达量0.95±0.28 (t = 21.062, P<0.05).
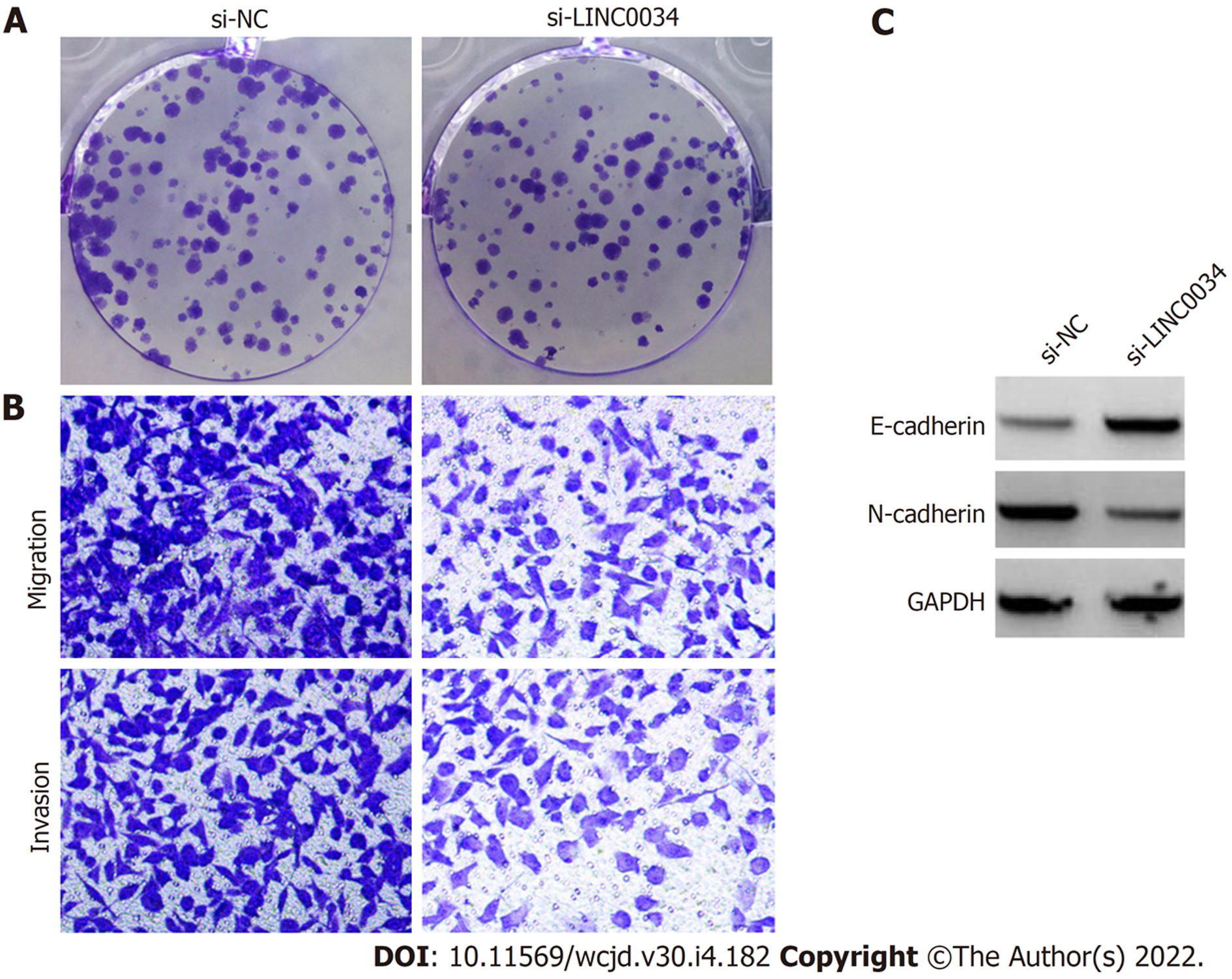
转染si-LINC0034的胃癌HGC-27细胞中LINC00342表达量为0.35±0.05, 显著低于转染si-NC的HGC-27细胞中LINC00342表达量1.00±0.00 (t = 22.517, P<0.05), 说明敲减LINC00342的HGC-27细胞构建成功. 转染pcDNA-LINC0034的胃癌HGC-27细胞中LINC00342表达量为3.00±0.11, 显著高于转染pcDNA的HGC-27细胞中LINC00342表达量1.00±0.00 (t = 31.492, P<0.05), 说明过表达LINC00342的HGC-27细胞构建成功.
si-LINC0034组胃癌HGC-27细胞增殖抑制率、E-cadherin蛋白表达均高于si-NC组(P<0.05), 细胞克隆数、迁移数和侵袭数、细胞中N-cadherin蛋白表达及细胞培养上清液中TNF-α和IL-6表达均低于si-NC组(P<0.05). 见图2、表3.
| 分组 | 抑制率/% | 细胞数/个 | pg/mL | E-cadherin | N-cadherin | |||
| 克隆 | 迁移 | 侵袭 | TNF-α | IL-6 | ||||
| si-NC组 | 0.00±0.00 | 112.33±5.79 | 174.00±7.87 | 142.33±6.94 | 264.51±18.17 | 342.49±29.26 | 0.23±0.02 | 0.58±0.04 |
| si-LINC0034组 | 54.49±3.09a | 52.00±2.83a | 75.00±3.56a | 63.00±2.45a | 119.54±11.23a | 143.82±9.05a | 0.71±0.05a | 0.12±0.02a |
| t | 30.544 | 16.214 | 19.852 | 18.670 | 11.755 | 11.235 | 15.438 | 17.816 |
| P | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 |
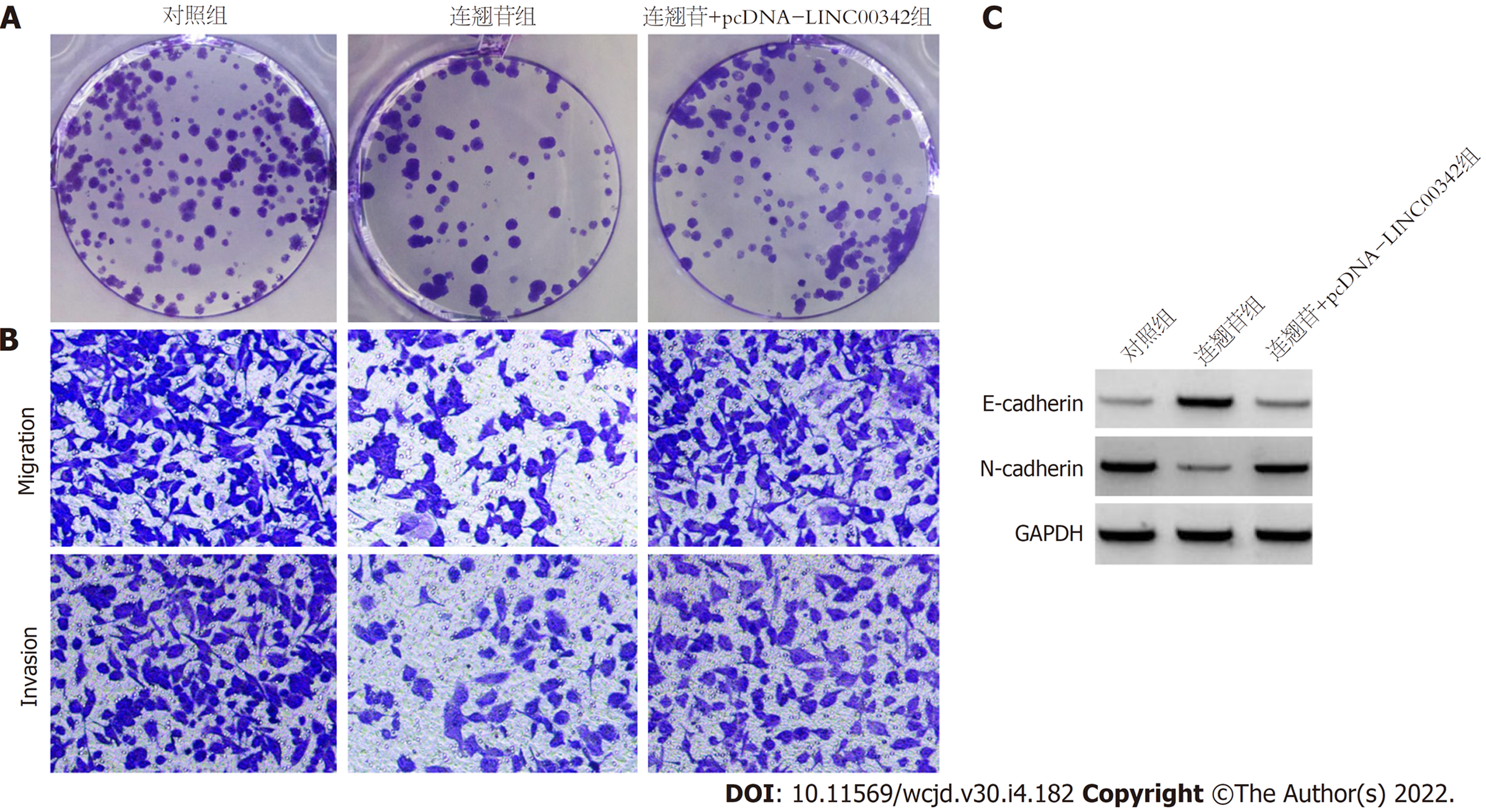
连翘苷+pcDNA-LINC00342组胃癌HGC-27细胞增殖抑制率、E-cadherin蛋白表达均高于连翘苷组(P<0.05), 细胞克隆数、迁移数和侵袭数、细胞中N-cadherin蛋白表达及细胞培养上清液中TNF-α和IL-6表达均低于连翘苷组(P<0.05). 见图3、表4.
| 分组 | 抑制率/% | 细胞数/个 | pg/mL | E-cadherin | N-cadherin | |||
| 克隆 | 迁移 | 侵袭 | TNF-α | IL-6 | ||||
| 对照组 | 0.00±0.00 | 112.67±9.53 | 173.33±10.62 | 143.00±5.10 | 271.23±24.63 | 354.88±29.22 | 0.22±0.02 | 0.58±0.07 |
| 连翘苷组 | 60.68±5.54a | 40.67±3.30a | 72.67±5.44a | 53.67±2.62a | 97.50±7.71a | 124.16±7.24a | 0.81±0.06a | 0.15±0.02a |
| 连翘苷+pcDNA -LINC00342组 | 15.06±1.21b | 97.00±4.55b | 156.67±10.66b | 128.67±4.50b | 230.23±13.56b | 314.21±20.50b | 0.28±0.04b | 0.50±0.04b |
| F | 279.424 | 105.413 | 102.334 | 389.939 | 87.399 | 102.910 | 169.446 | 68.217 |
| P | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 |
近年来, 天然中草药或其活性成分在肿瘤治疗中表现出良好优势, 是抗肿瘤药物研究的热点对象. 研究已表明, 多种草药或其活性成分具有抗胃癌作用. 例如, 白江江等[9]研究显示, 冬凌草甲素抑制胃癌细胞增殖并增强胃癌细胞对化疗药物西妥昔单的敏感性, 其作用机制与抑制细胞中EGFR/STAT3通路有关. 杨振方等[10]研究显示, 牛蒡子苷元可通过下调SETDB1的表达抑制胃癌细胞的恶性生物学行为. 洪星辉等[11]研究显示, 重楼总皂苷可通过调控Wnt/β-catenin信号通路抑制胃癌细胞迁移和侵袭.
连翘是我国传统常用中草药, 有清热解毒、消肿散结等功效. 作为连翘的主要活性成分, 连翘苷对胃癌发生发展的影响还未见相关报道. 胃癌细胞过度增殖促进胃癌发生发展, 而胃癌细胞迁移和侵袭则是胃癌复发和转移的主要原因. 本研究结果显示, 胃癌HGC-27细胞经不同剂量连翘苷作用后, 细胞增殖抑制率明显升高, 克隆数、迁移数、侵袭数均明显降低, 说明连翘苷抑制了胃癌HGC-27细胞增殖、迁移和侵袭, 提示其可能通过抑制胃癌细胞的恶性行为来发挥抗胃癌作用. 上皮间质转化在肿瘤的发生发生中起重要作用, 肿瘤细胞在经历此过程后, 细胞间粘附作用降低, 迁移和侵袭性增强[12]. EMT过程中伴随多种分子标志物的改变, 如上皮标志物E-cadherin表达降低, 而间质标志物N-cadherin表达升高[13]. 本研究结果显示, 连翘苷促进了胃癌HGC-27细胞中E-cadherin蛋白表达, 而抑制了N-cadherin蛋白表达, 且呈剂量依赖性, 提示其可能通过抑制EMT过程降低胃癌细胞的迁移和侵袭能力.
胃癌的发生发展与慢性炎症密切相关. TNF-α和IL-6是促炎细胞因子, 对胃癌发展具有促进作用. TNF-α可通过与其受体结合激活多种信号通路, 调控细胞凋亡、炎症反应及免疫. IL-6是一种多功能细胞因子, 参与调控细胞增殖、凋亡和免疫防御等过程. 研究显示, 胃癌患者血清中TNF-α和IL-6的表达明显上调, 联合检测血清TNF-α和IL-6有助于胃癌预后判断[14]; IL-6可通过活化STAT3促进胃癌细胞增殖活性及顺铂抗性[15]. 本研究结果显示, 连翘苷降低了胃癌HGC-27细胞培养上清液中TNF-α和IL-6表达, 提示连翘苷发挥抗胃癌作用也可能与其抑制炎症环境有关.
中药作用途径及作用靶点较为广泛, 这也是其具有较好抗肿瘤作用的原因之一. lncRNA是一类长链非编码RNA, 在真核生物中广泛存在. 研究显示, 肿瘤中存在大量异常表达的lncRNA, 这些lncRNA参与调控肿瘤细胞恶性生物学行为, 可作为肿瘤治疗的分子靶点. 研究已表明, LINC00511[16]、LINC00265[17]和LINC00649[18]等多种lncRNA在胃癌中表达增加, 促进胃癌的发展进程; LINC00982[19]和HAND2-AS1[20]等lncRNA在胃癌中表达降低, 作为抑癌基因影响胃癌发生发展. 此外, lncRNA还参与调控肿瘤炎症微环境. 例如, Liu等[21]研究显示, lncRNA MSC-AS1在胃癌中表达上调, 其可促进胃癌细胞生长、细胞周期进程及分泌炎症介质IL-1β、IL-6和TNF-α, 促进胃癌的发展进程. 本研究结果显示, LINC00342在胃癌肿瘤组织中的表达明显高于癌旁组织, 提示其可能也促进胃癌的发展进程; 通过敲减胃癌细胞中LINC00342的表达发现, 敲减LINC00342可有效阻碍胃癌细胞增殖、迁移和侵袭, 并抑制胃癌细胞分泌TNF-α和IL-6, 提示LINC00342有可能成为胃癌治疗的分子靶点. 此外, 本研究还显示, 连翘苷可呈剂量依赖性抑制胃癌细胞中LINC00342的表达, 而过表达LINC00342逆转了连翘苷对胃癌细胞增殖、迁移和侵袭及炎症因子TNF-α和IL-6表达的影响, 提示连翘苷发挥抗胃癌作用也可能通过与其下调细胞中LINC00342的表达有关.
综上, 一定剂量的连翘苷对胃癌细胞增殖、迁移和侵袭及炎症因子表达具有明显的抑制作用, 其作用机制可能与下调细胞中LINC00342的表达有关, 具有治疗胃癌的潜在价值. LINC00342可发挥微小RNA(miRNA)分子海绵作用调控miRNA靶基因的表达, 进而发挥生物学作用, 本研究中尚未对LINC00342结合的miRNA及下游靶基因进行探究, 这将是加下来要进行的研究工作; 同时, 尚需进一步通过裸鼠移植瘤实验在体内验证连翘苷的抗胃癌作用.
胃癌发病机制尚未阐明, 且缺乏有效的治疗方法. 作为重要连翘的主要活成成分, 连翘苷对肝癌、肺癌和肾癌等肿瘤细胞的恶性行为具有显著抑制作用, 表现出一定的抗肿瘤作用, 但其能否抑制胃癌细胞的恶性行为还未知. 长基因间非编码RNA 00342(LINC00342)是促进非小细胞肺癌和结直肠癌发展的lncRNA, 可作为非小细胞肺癌和结直肠癌治疗的分子靶点. 但连翘苷能否通过调控LINC00342来影响胃癌的发生发展也还未知.
本研究旨在探究连翘苷对胃癌细胞增殖、迁移、侵袭及炎症因子表达的影响及其能否通过调控LINC00342发挥作用, 以期为其用于胃癌的治疗提供一定的实验依据.
本研究的主要目标是观察连翘苷能否影响胃癌细胞的增殖、迁移和侵袭及炎症因子TNF-α和IL-6的表达, 同时观察其能否通过调控LINC00342发挥作用, 初步了解连翘苷对胃癌发生发展的影响和机制.
将不同剂量(5、10、20 μmol/L)的连翘苷作用于胃癌HGC-27细胞, CCK-8法和克隆形成实验检测细胞增殖, Transwell实验检测细胞迁移和侵袭, 蛋白质印迹法检测E-cadherin和N-cadherin蛋白表达, 试剂盒检测细胞培养上清液中TNF-α和IL-6表达, qRT-PCR检测LINC00342表达. 同时敲减HGC-27细胞中LINC00342的表达, 观察敲减LINC00342对HGC-27细胞增殖、迁移、侵袭及炎症因子TNF-α和IL-6表达的影响. 此外, 通过恢复实验观察过表达LINC00342能否逆转连翘苷对HGC-27细胞增殖、迁移、侵袭及炎症因子TNF-α和IL-6表达的影响.
本研究达到实验目标, 结果表明连翘苷对胃癌HGC-27细胞增殖、迁移、侵袭及炎症因子TNF-α和IL-6的表达具有抑制作用; 敲减LINC00342对胃癌HGC-27细胞增殖、迁移、侵袭及炎症因子TNF-α和IL-6的表达也具有抑制作用. 同时, 连翘苷抑制了HGC-27细胞中LINC00342的表达, 过表达LINC00342逆转了连翘苷对HGC-27细胞增殖、迁移、侵袭及炎症因子TNF-α和IL-6表达的影响.
本研究发现连翘苷可抑制胃癌HGC-27细胞增殖、迁移、侵袭及炎症因子TNF-α和IL-6的表达, 其作用机制可能与下调细胞中LINC00342的表达有关.
本研究初步发现连翘苷具有抗胃癌的潜在价值, 但尚需进一步在体内验证. 同时, LINC00342下游调控的基因或通路也有待探究. 接下来, 将通过建立裸鼠移植瘤实验, 在体内观察连翘苷对胃癌发生发展的影响, 并对LINC00342下游调控的基因或通路进行预测和验证, 更加全面了解连翘苷的抗胃癌作用和机制, 为胃癌治疗药物的研发提供新途径.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C, C
D级 (一般): 0
E级 (差): 0
科学编辑: 刘继红 制作编辑:张砚梁
| 1. | Wang J, Yu Z, Wang J, Shen Y, Qiu J, Zhuang Z. LncRNA NUTM2A-AS1 positively modulates TET1 and HIF-1A to enhance gastric cancer tumorigenesis and drug resistance by sponging miR-376a. Cancer Med. 2020;9:9499-9510. [PubMed] [DOI] |
| 2. | Tong KH, Qian J. Long non-coding RNA FGD5-AS1 is an inducer of cisplatin chemoresistance in gastric cancer cells by sponging miR-195. J Biol Regul Homeost Agents. 2021;35:819-826. [PubMed] [DOI] |
| 4. | 高 志强, 陈 君, 李 丁洋, 刘 兆臣, 葛 鹏磊, 张 弓, 党 晓卫. 环状RNA_0054537联合连翘苷调控肝癌细胞生物学特性的分子机制. 中华实验外科杂志. 2020;37:1464-1468. [DOI] |
| 7. | Chen QF, Kong JL, Zou SC, Gao H, Wang F, Qin SM, Wang W. LncRNA LINC00342 regulated cell growth and metastasis in non-small cell lung cancer via targeting miR-203a-3p. Eur Rev Med Pharmacol Sci. 2019;23:7408-7418. [PubMed] [DOI] |
| 8. | Shen P, Qu L, Wang J, Ding Q, Zhou C, Xie R, Wang H, Ji G. LncRNA LINC00342 contributes to the growth and metastasis of colorectal cancer via targeting miR-19a-3p/NPEPL1 axis. Cancer Cell Int. 2021;21:105. [PubMed] [DOI] |
| 9. | 白 江江, 宗 新玲, 高 维东, 曹 光材, 霍 爱鑫. 冬凌草甲素抑制胃癌细胞增殖及增强西妥昔单抗化疗敏感性的机制研究. 实用临床医药杂志. 2019;23:43-46, 50. [DOI] |
| 10. | 杨 振方, 王 保卫, 刘 大勇, 廖 新伟, 陈 小兵. 牛蒡子苷元通过调控SETDB1表达对胃癌细胞增殖,迁移和侵袭的影响及其机制研究. 中国药学杂志. 2020;55:41-47. [DOI] |
| 12. | Wang J, Liu Y, Cai H, Jiang H, Li W, Shi Y. Long coding RNA CCAT2 enhances the proliferation and epithelial-mesenchymal transition of cervical carcinoma cells via the microRNA-493-5p/CREB1 axis. Bioengineered. 2021;12:6264-6274. [PubMed] [DOI] |
| 13. | Jin G, Mi H, Ye Y, Yao Q, Yuan L, Wu X. LINC00671 inhibits renal cell cancer progression via regulating miR-221-5p/SOCS1 axis. Am J Transl Res. 2021;13:7524-7537. [PubMed] |
| 15. | Fan H, Ou Q, Su Q, Li G, Deng Z, Huang X, Bi J. ZIPK activates the IL-6/STAT3 signaling pathway and promotes cisplatin resistance in gastric cancer cells. FEBS Open Bio. 2021;11:2655-2667. [PubMed] [DOI] |
| 16. | Cui N, Sun Q, Liu H, Li L, Guo X, Shi Y, Jing C, Qin C, Zhao Y. Long non-coding RNA LINC00511 regulates the expression of microRNA-625-5p and activates signal transducers and activators of transcription 3 (STAT3) to accelerate the progression of gastric cancer. Bioengineered. 2021;12:2915-2927. [PubMed] [DOI] |
| 17. | Yang Z, OuYang X, Zheng L, Dai L, Luo W. Long intergenic noncoding RNA00265 promotes proliferation of gastric cancer via the microRNA-144-3p/Chromobox 4 axis. Bioengineered. 2021;12:1012-1025. [PubMed] [DOI] |
| 18. | Wang H, Di X, Bi Y, Sun S, Wang T. Long non-coding RNA LINC00649 regulates YES-associated protein 1 (YAP1)/Hippo pathway to accelerate gastric cancer (GC) progression via sequestering miR-16-5p. Bioengineered. 2021;12:1791-1802. [PubMed] [DOI] |
| 19. | Zheng L, Cao J, Liu L, Xu H, Chen L, Kang L, Gao L. Long noncoding RNA LINC00982 upregulates CTSF expression to inhibit gastric cancer progression via the transcription factor HEY1. Am J Physiol Gastrointest Liver Physiol. 2021;320:G816-G828. [PubMed] [DOI] |
| 20. | Yu L, Luan W, Feng Z, Jia J, Wu Z, Wang M, Li F, Li Z. Long non-coding RNA HAND2-AS1 inhibits gastric cancer progression by suppressing TCEAL7 expression via targeting miR-769-5p. Dig Liver Dis. 2021;53:238-244. [PubMed] [DOI] |
| 21. | Liu Y, Li L, Wu X, Qi H, Gao Y, Li Y, Chen D. MSC-AS1 induced cell growth and inflammatory mediators secretion through sponging miR-142-5p/DDX5 in gastric carcinoma. Aging (Albany NY). 2021;13:10387-10395. [PubMed] [DOI] |