修回日期: 2022-06-16
接受日期: 2022-11-24
在线出版日期: 2022-12-08
circRNA在结直肠癌中表达异常, 并可通过充当miRNA海绵分子调节其靶基因表达, 进而调节结直肠癌细胞生物学行为, 但circEIF4G2/miR-144-3p在结直肠癌发生发展过程中的作用机制尚未明确.
考察环状RNA(circRNA)circEIF4G2/miR-144-3p对结直肠癌LoVo细胞增殖、迁移、侵袭的影响.
逆转录-定量聚合酶链反应检测结直肠癌组织中circEIF4G2、miR-144-3p的表达. 结直肠癌LoVo细胞中转染si-NC、si-circEIF4G2、si-circEIF4G2+anti-miR-NC、si-circEIF4G2+anti-miR-144-3p, 分别记为si-NC组、si-circEIF4G2组、si-circEIF4G2+anti-miR-NC组、si-circEIF4G2+anti-miR-144-3p组. 利用双荧光素酶报告实验分析circEIF4G2与miR-144-3p之间的靶向结合. 采用CCK-8法和克隆形成实验进行四组结直肠癌LoVo细胞的增殖抑制率、克隆形成情况测定, Transwell法检测细胞迁移、侵袭, 并利用Western blotting检测上皮钙黏蛋白(E-cadherin)、神经钙黏蛋白(N-cadherin)蛋白表达.
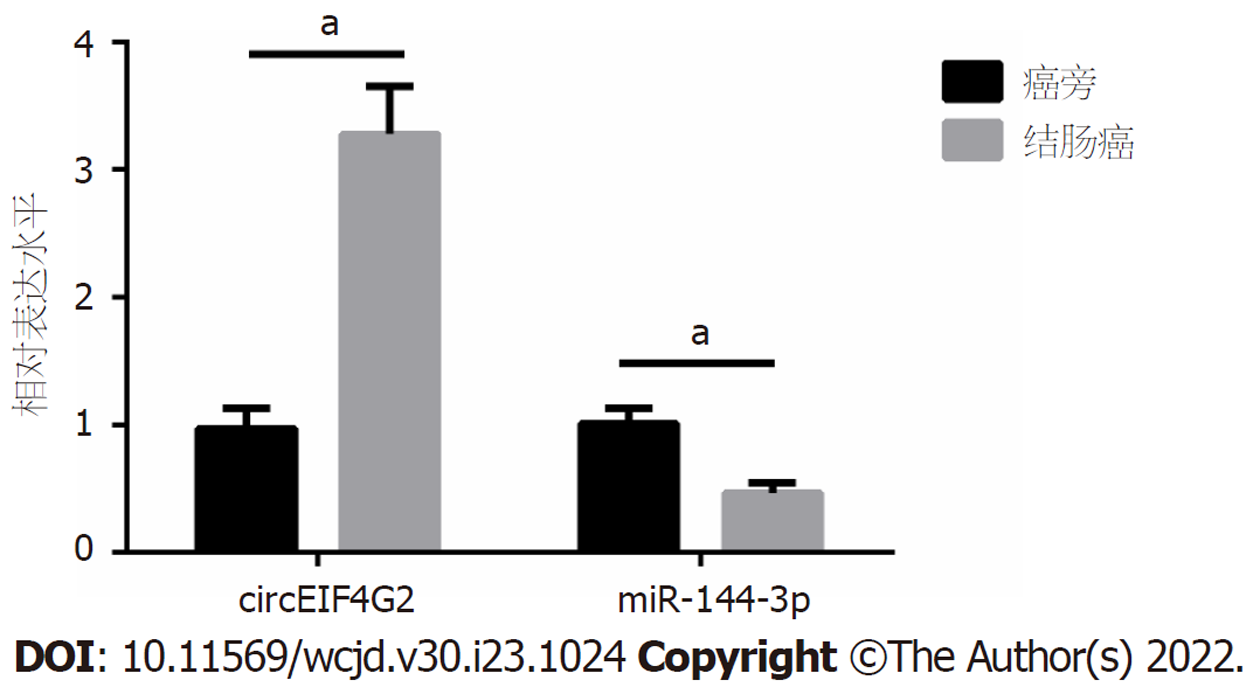
51例结直肠癌组织中circEIF4G2表达量比癌旁组织增加约2.38倍, miR-144-3p表达量比癌旁组织减少约0.54倍(均P<0.05). circEIF4G2靶向、调控miR-144-3p的表达. 结直肠癌LoVo细胞中成功转染后, si-circEIF4G2组结直肠癌LoVo细胞的增殖抑制率、E-cadherin蛋白表达量比si-NC组增加, 克隆数、迁移、侵袭数和N-cadherin蛋白表达量却比si-NC组减少(均P<0.05). si-circEIF4G2+anti-miR-144-3p组结直肠癌LoVo细胞的增殖抑制率、E-cadherin蛋白表达量低于si-circEIF4G2+anti-miR-NC组, 而克隆数、迁移、侵袭数和N-cadherin蛋白表达量高于si-circEIF4G2+anti-miR-NC组(均P<0.05).
敲减circEIF4G2通过靶向结直肠癌LoVo细胞中miR-144-3p, 抑制细胞增殖、迁移和侵袭.
核心提要: circEIF4G2在结直肠癌中表达上调, 可充当miR-144-3p的海绵分子从而调节miR-144-3p表达进而调节LoVo细胞增殖、迁移和侵袭.
引文著录: 潘建柱, 孙萍萍, 刘丽苹. circEIF4G2靶向miR-144-3p促进结肠癌LoVo细胞的增殖、迁移、侵袭. 世界华人消化杂志 2022; 30(23): 1024-1031
Revised: June 16, 2022
Accepted: November 24, 2022
Published online: December 8, 2022
Many circular RNAs (circRNAs) are abnormally expressed in colorectal cancer, and they can regulate the expression of their target genes by acting as a miRNA sponge molecule, thereby regulating the biological behavior of colorectal cancer cells; however, the role of circEIF4G2/miR-144-3p in the occurrence and development of colorectal cancer and the underlying mechanism are not yet clear.
To investigate the effect of circEIF4G2/miR-144-3p on the proliferation, migration, and invasion of colorectal cancer LoVo cells.
Reverse transcription-quantitative polymerase chain reaction was used to detect the expression of circEIF4G2 and miR-144-3p in colorectal cancer tissues. LoVo cells were divided into four groups and transfected with si-NC, si-circEIF4G2, si-circEIF4G2 + anti-miR-NC, and si-circEIF4G2 + anti-miR-144-3p, respectively. Dual luciferase reporter assay was performed to analyze the targeting relationship between circEIF4G2 and miR-144-3p. CCK-8 assay and clone formation assay were utilized to monitor the proliferation inhibition rate and clone formation in the four groups, respectively. Transwell assay was used to detect cell migration and invasion, and Western blot analysis was performed to determine E-cadherin and N-cadherin protein expression.
The expression of circEIF4G2 in 51 cases of colorectal cancer tissues increased by ~2.38 times compared with tumor adjacent tissues, and the expression of miR-144-3p decreased by about 0.54 times compared with tumor adjacent tissues (P < 0.05 for both). CircEIF4G2 targets and regulates the expression of miR-144-3p. The proliferation inhibition rate and E-cadherin protein expression in the si-circEIF4G2 group increased compared with those in the si-NC group, while the number of clones, migration, invasion, and the expression level of N-cadherin protein were lower than those of the si-NC group (P < 0.05 for all). The proliferation inhibition rate and E-cadherin protein expression in the si-circEIF4G2 + anti-miR-144-3p group were lower than those of the si-circEIF4G2 + anti-miR-NC group, while the number of clones, migration, invasion, and the expression of N-cadherin protein were higher than those of the si-circEIF4G2+anti-miR-NC group (P < 0.05 for all).
Knockdown of circEIF4G2 inhibits cell proliferation, migration, and invasion by targeting miR-144-3p in colorectal cancer LoVo cells.
- Citation: Pan JZ, Sun PP, Liu LP. CircEIF4G2 promotes proliferation, migration, and invasion of colon cancer LoVo cells by targeting miR-144-3p. Shijie Huaren Xiaohua Zazhi 2022; 30(23): 1024-1031
- URL: https://www.wjgnet.com/1009-3079/full/v30/i23/1024.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v30.i23.1024
结直肠癌是全球第三大致命恶性肿瘤[1]. 每年大约三分之一的结直肠癌死亡率是由于此类癌症处于晚期发现所致[2]. 因此, 迫切需要更强大的诊断和预后工具来识别和治疗结直肠癌的发生. 在过去的几十年里, 发现多种基因与结直肠癌相关, 包括环状RNA(circular RNA, circRNA)、微小RNA(microRNA, miRNA/miR)[3]. circRNA是一类特殊的非编码RNA, 在调节包括结直肠癌在内的一系列癌症类型中的细胞生长、周期、凋亡、迁移和代谢中起着至关重要的作用[4]. circRNA被证实通过与miRNA结合来调节基因表达[5]. circRNA EIF4G2(circEIF4G2; hsa_circ_0021254)是一种新发现的circRNA, circEIF4G2在宫颈癌组织中表达增加, 并且circEIF4G2的上调与宫颈癌患者的不良预后相关[6]. circEIF4G2通过海绵miR-218促进骨肉瘤的肿瘤发生和进展[7]. miR-144-3p的异常表达在各种癌症中起到抑癌[8]或致癌[9]基因的作用. 在结直肠癌中, miR-144-3p表达下调[10], 通过靶向BCL6抑制Wnt/β-catenin信号传导来抑制结直肠癌细胞增殖[11]. Starbase预测显示circEIF4G2和miR-144-3p存在互补序列, 然而circEIF4G2在结直肠癌中的表达情况、详细作用及与miR-144-3p的关系尚未见报道. 本研究的重点是探索circEIF4G2在结直肠癌LoVo细胞增殖、迁移、侵袭中的作用, 旨在确定circEIF4G2的潜在机制.
从医院进行手术的结直肠癌患者中共获得51对结直肠癌组织和相应的邻近正常组织(癌旁组织). 癌旁组织距原发病灶3 cm以上. 排除接受放射或化学治疗的结直肠癌患者. 所有患者均签署知情同意书. 研究得到医院伦理委员会的批准. 组织分离后, 使用液氮速冻并储存在-80 ℃备用.
结直肠癌细胞LoVo(美国典藏培养物保存中心), 靶向circEIF4G2的小干扰RNA(small interfering RNA, siRNA)si-circEIF4G2、siRNA阴性对照(si-NC)、miR-144-3p inhibitor(anti-miR-144-3p)、阴性对照anti-miR-NC、miR-144-3p mimic、阴性对照miR-NC(广州RiboBio), Lipofectamine 3000(美国Invitrogen), High Capacity cDNA RT试剂盒、SYBR Select Master Mix(美国Applied Biosystems), CCK-8溶液(日本Dojindo), 二辛可宁酸蛋白质测定试剂盒(大连Takara), 抗上皮钙黏蛋白(E-cadherin)、抗神经钙黏蛋白(N-cadherin)抗体(美国Proteintech), 抗增殖标记蛋白细胞增殖核抗原-67(Ki-67)、增殖细胞核抗原(PCNA)抗体(美国Abcam), 增强型化学发光检测试剂盒(美国EMD Millipore), pmirGLO荧光素酶载体(美国Promega).
达尔伯克改良伊格尔培养基(dulbecco's modified eagle medium, DMEM)中添加10%胎牛血清、青霉素(100 U/mL)和链霉素(100 mg/mL), 用于在37 ℃和5% CO2条件下培养结直肠癌细胞LoVo. 转染时, 根据Lipofectamine 3000操作手册指示, 在接种于6孔板的结直肠癌细胞LoVo(2×105个细胞/孔)中, 分别转染si-NC、si-circEIF4G2、si-circEIF4G2+anti-miR-NC、si-circEIF4G2+anti-miR-144-3p, 记为si-NC组、si-circEIF4G2组、si-circEIF4G2+anti-miR-NC组、si-circEIF4G2+anti-miR-144-3p组. 孵育48 h后, 通过检测circEIF4G2或miR-144-3p表达进行转染效率评估. 收获细胞用于进一步实验.
使用TRIzol试剂从结直肠癌组织或LoVo细胞中分离总RNA. 使用NanoDrop 2000c分光光度计定量后, 使用High Capacity cDNA RT试剂盒对RNA进行cDNA合成. qPCR在ABI 7900系统上使用SYBR Select Master Mix进行, GAPDH或U6作为内部对照. PCR条件如下: 95 ℃ 3 min, 然后95 ℃ 10 s、60 ℃ 30 s和72 ℃ 30 s的40个循环. 引物序列(5′-3′): circEIF4G2 TTTTTCAACAAAGCAAGGTCAA(F)和TCTAGGTCCCACTGTCCTCA(R). GAPDHCTCTGCTCCTCCTGTTCGAC (F)和CGACCAAATCCGTTGACTCC (R). miR-144-3p TGCGGTACAGTATAGATGAT(F)和CCAGTGCAGGGTCCGAGGT(R). U6 CGCTTCGGCAGCACATATACTA (F)和CGCTTCACGAATTTGCGTGTCA (R). 2-ΔΔCt方法用于确定circEIF4G2、miR-144-3p相对基因表达水平.
使用预测软件starbase预测与circEIF4G2相互作用的潜在miRNA. 为了构建重组荧光素酶载体, 野生型(wild type, WT)和突变型(mutant, MUT)-circEIF4G2序列由上海GenePharma公司合成并克隆到pmirGLO荧光素酶载体, 生成WT-circEIF4G2、MUT-circEIF4G2. 使用Lipofectamine 3000, 将结直肠癌细胞LoVo用50 nM miR-144-3p mimic或miR-NC与重组荧光素酶载体WT-circEIF4G2或MUT-circEIF4G2共转染, 孵育48 h后, 在双荧光素酶报告基因检测系统检测荧光素酶活性.
CCK-8检测: 接种对数生长期的结直肠癌细胞LoVo在96孔板(1×104个细胞/孔)中培养过夜. 细胞达到60%汇合时, 根据1.2中分组进行转染, 然后培养48 h. 加入10 μL CCK-8溶液4 h. 使用酶标仪基于450 nm处检测到的吸光度OD值来测量细胞增殖抑制率. 抑制率(%) = 100%-实验组OD值/对照组OD值×100%.
克隆形成实验: 将转染后的结直肠癌细胞LoVo(5×102个细胞)与DMEM混合, 并接种到培养皿, 在37 ℃和5% CO2下孵育2 wk. 然后, 克隆细胞用4%多聚甲醛固定15 min, 室温下用0.05%结晶紫染色30 min. 使用光学显微镜(放大倍数, ×200)评估大于50的克隆数.
转染48 h后, 在结直肠癌细胞LoVo中利用20 μL的枪头在细胞层均匀的划一条直线. 用PBS洗细胞3次, 加入无血清培养基, 随后对细胞进行拍照. 继续培养24 h后, 再一次对细胞进行拍照, 计算划痕愈合率.
将转染后结直肠癌细胞LoVo重悬于无血清DMEM中, 并接种在具有8 μm孔(2.5×103个细胞/孔)的Transwell上室中(侵袭实验时, 该上室预涂有Matrigel, 迁移实验则未涂Matrigel). 将含有10%胎牛血清的DMEM添加到下室. 孵育24 h后, 迁移或侵袭性细胞在37 ℃下用甲醇固定30 min, 并在37 ℃下用0.1%结晶紫染色30 min. 随后, 捕获3个视野细胞的图像并使用IX71显微镜(放大倍数, ×200)对细胞进行计数.
使用Pierce细胞裂解缓冲液从转染后的结直肠癌细胞LoVo中提取总蛋白. 二辛可宁酸蛋白质测定试剂盒用于定量蛋白浓度. 通过10% SDS-PAGE分离等量的蛋白(30 μg), 随后转移到聚偏二氟乙烯膜上. 将膜在5%脱脂牛奶中37 ℃封闭2 h, 然后与一抗在4 ℃下孵育过夜. 使用的一抗是抗E-cadherin(1:1000)、抗N-cadherin(1:1000)、抗Ki-67(1:1000)、PCNA(1:1000)和抗GAPDH(1:2000). 随后, 将膜与辣根过氧化物酶标记二抗在室温下孵育2 h. 使用增强型化学发光检测试剂盒使条带可视化.
统计学处理 每个独立实验均重复3次, 实验数据表示为平均值±标准偏差(mean±SD). 用SPSS 22.0软件来评估统计显著性. 通过独立样本t检验进行两组间差异分析, 单因素方差分析进行多组间分析, SNK-q检验进行组间多重分析; Pearson法进行相关性分析. P<0.05为差异有统计学意义.
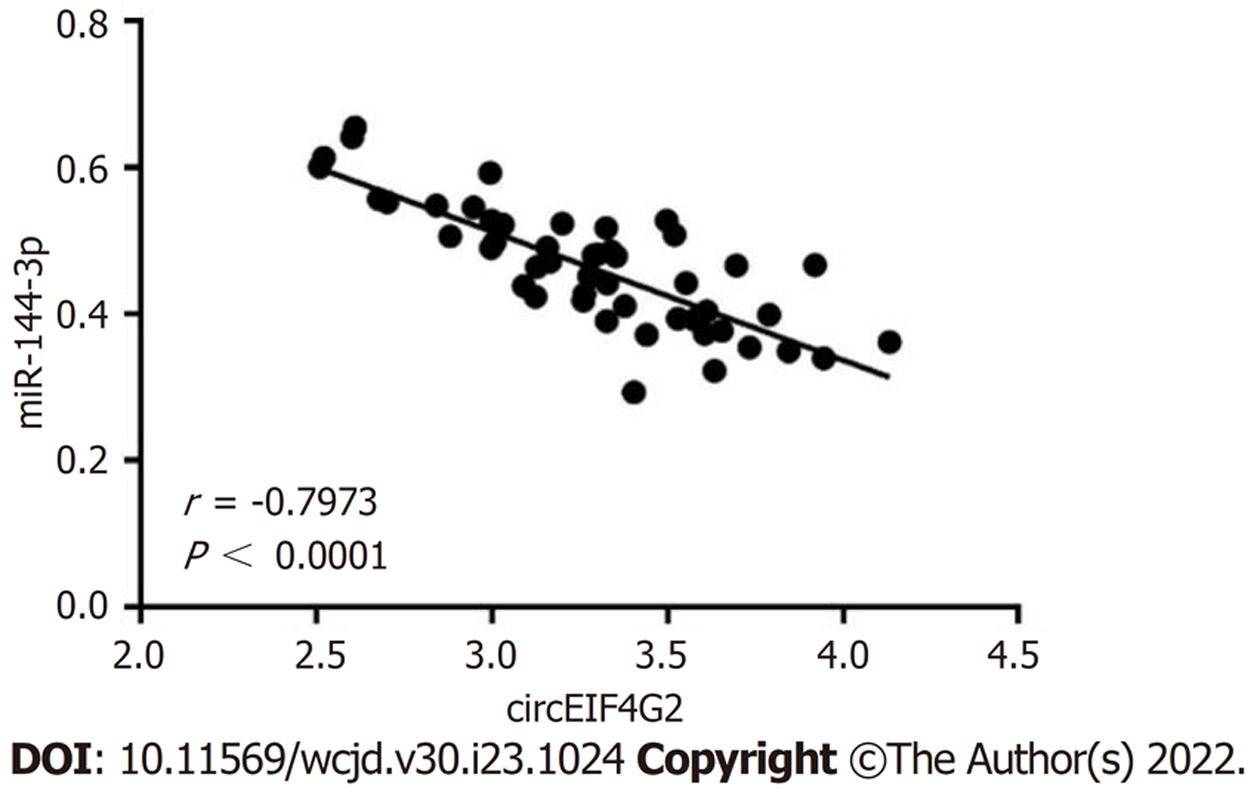
51例结肠癌组织中circEIF4G2表达量比癌旁组织增加约2.38倍, miR-144-3p表达量比癌旁组织减少约0.54倍(均P<0.05), 见图1. Pearson法分析结肠癌组织中circEIF4G2、miR-144-3p表达量的相关性, 结果显示, circEIF4G2与miR-144-3p呈负相关(r = -0.7973, P<0.0001), 见图2.
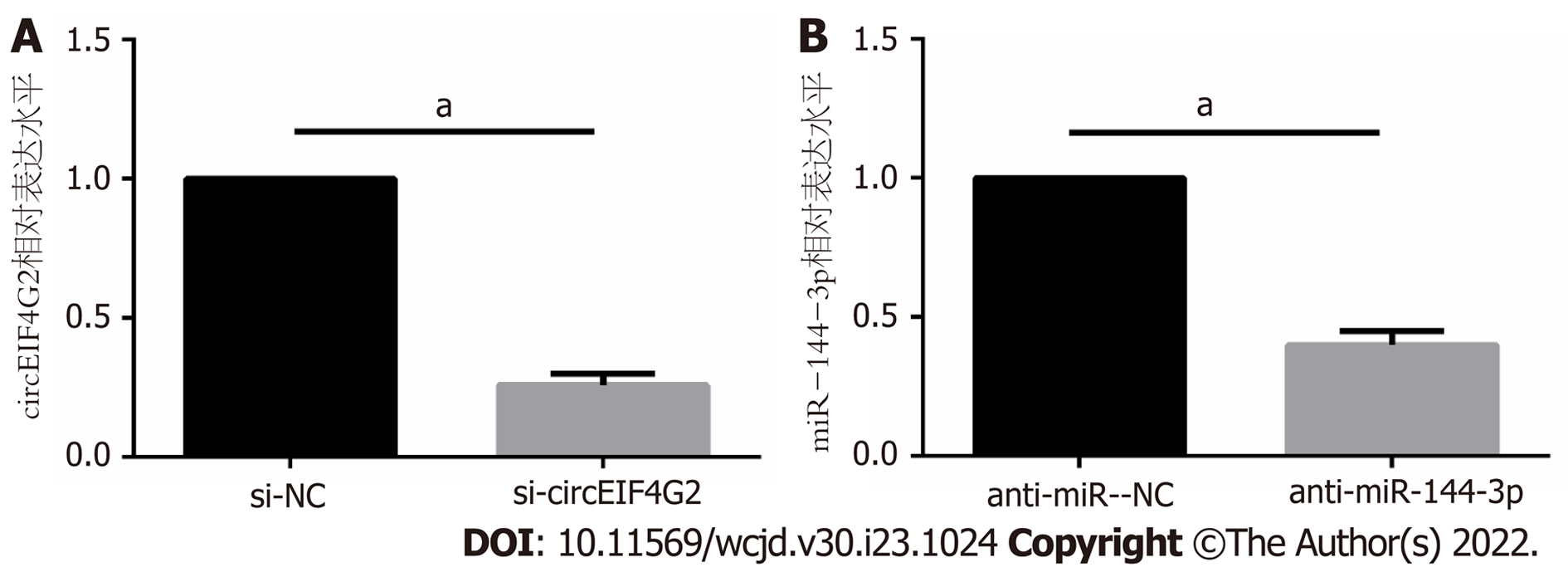
在结肠癌LoVo细胞中分别转染si-circEIF4G2或anti-miR-144-3p后, si-circEIF4G2组circEIF4G2表达量比si-NC组减少约0.74倍, anti-miR-144-3p组miR-144-3p表达量比anti-miR-NC组减少约0.60倍(均P<0.05), 见图3.
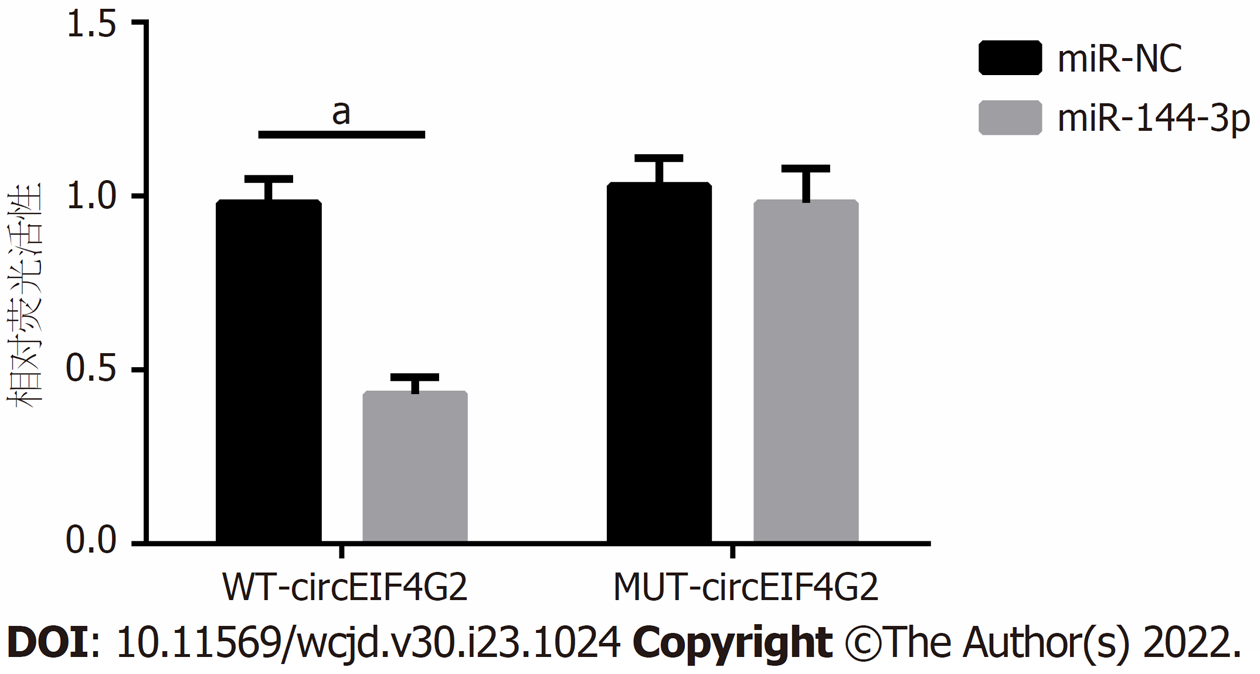
预测软件starbase预测的circEIF4G2和miR-144-3p的互补序列见图4. 与miR-NC组相比, miR-144-3p组共转染WT-circEIF4G2的结直肠癌LoVo细胞的荧光素酶活性减少(P<0.05), 而共转染MUT-circEIF4G2的结直肠癌LoVo细胞的荧光素酶活性无明显波动(P = 0.259), 见图5. si-circEIF4G2组结肠癌LoVo细胞内miR-144-3p表达量为3.44±0.09, 显著高于si-NC组的1.00±0.00(t = 81.333, P<0.05).
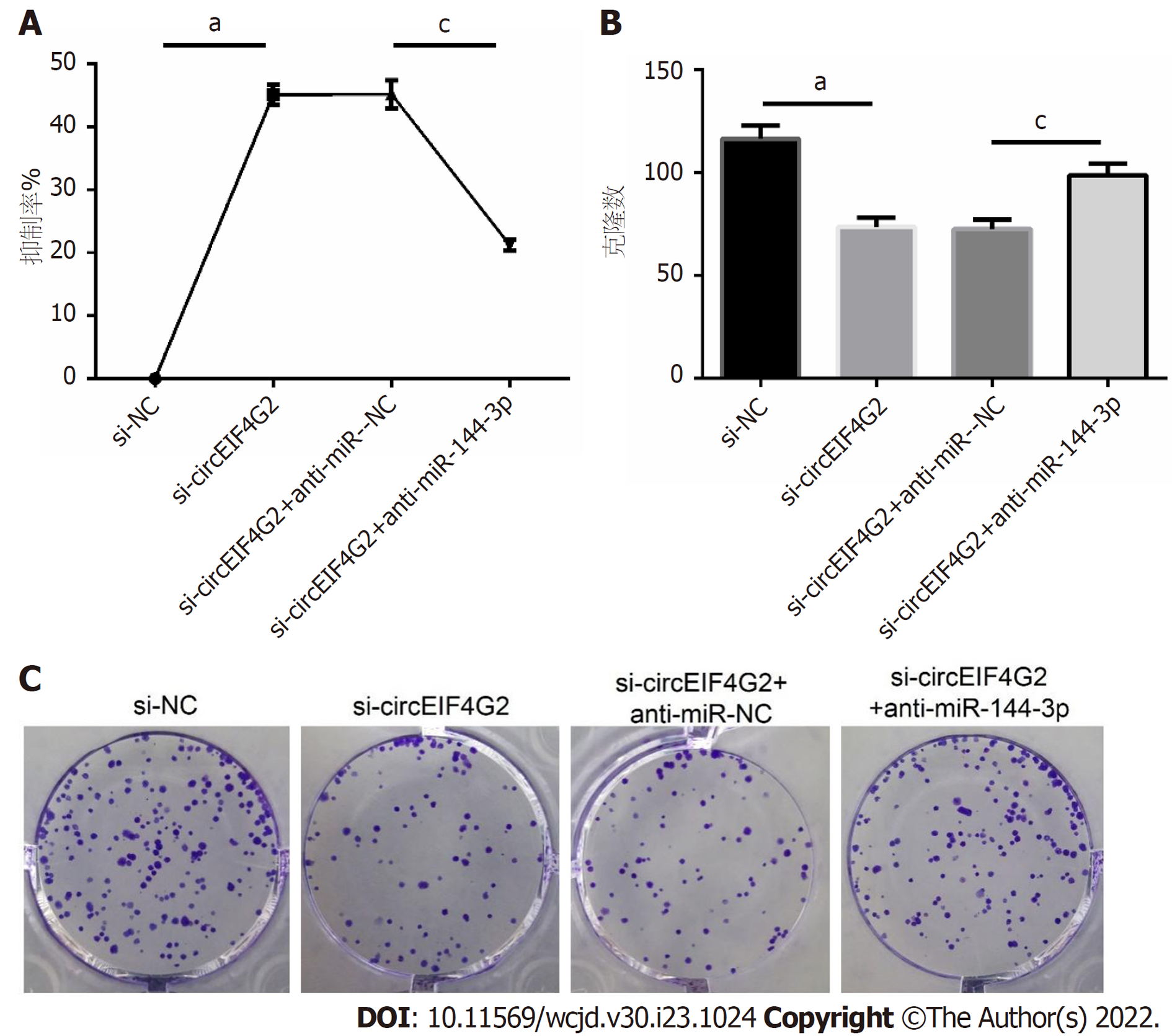
si-circEIF4G2组结肠癌LoVo细胞的增殖抑制率比si-NC组增加, 克隆数却比si-NC组减少; si-circEIF4G2+anti-miR-144-3p组结肠癌LoVo细胞的增殖抑制率比si-circEIF4G2+anti-miR-NC组减少, 克隆数却比si-circEIF4G2+anti-miR-NC组增加(均P<0.05), 见图6.
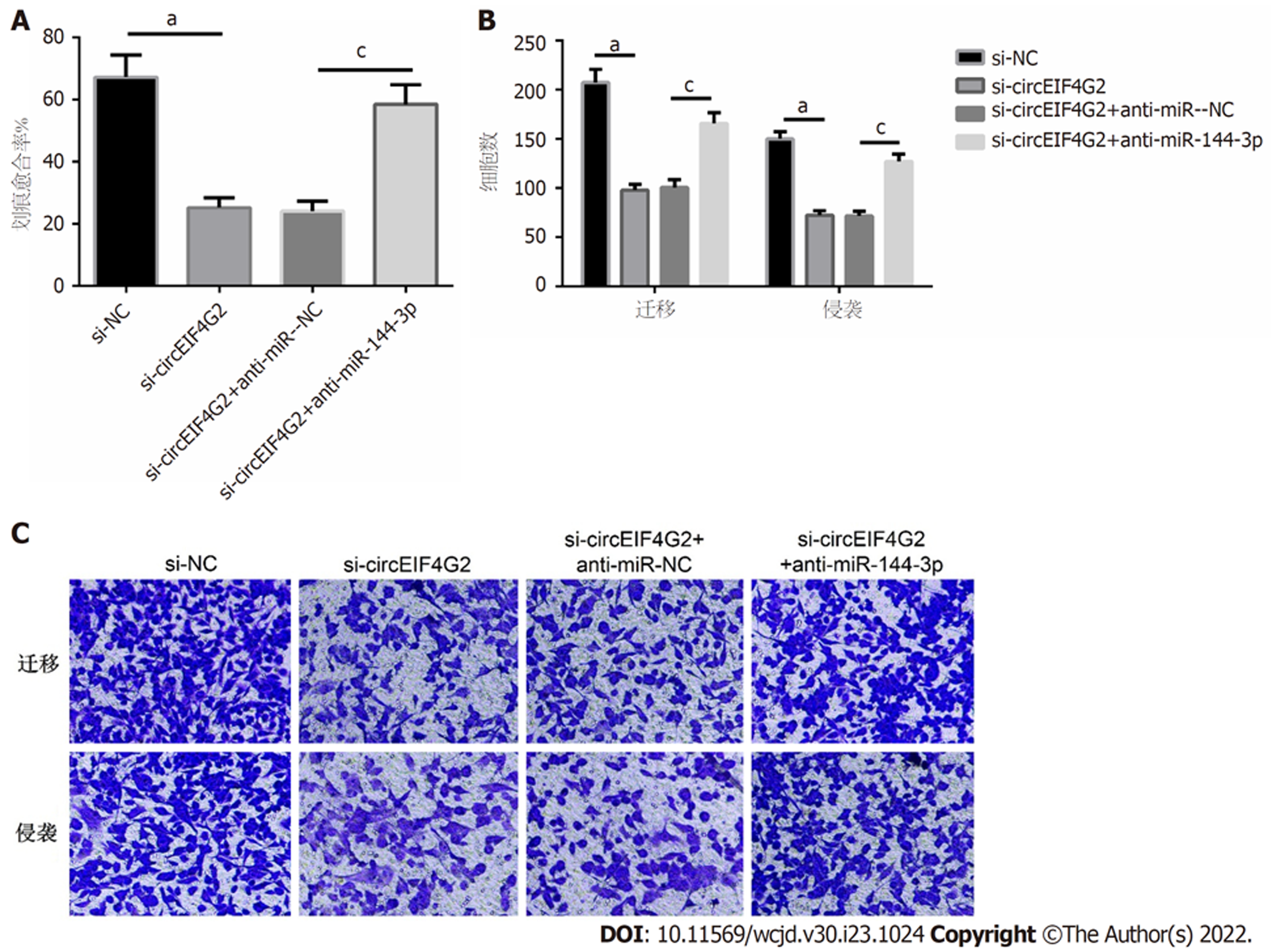
si-circEIF4G2组结肠癌LoVo细胞的迁移和侵袭数均比si-NC组减少; si-circEIF4G2+anti-miR-144-3p组结肠癌LoVo细胞的迁移和侵袭数均比si-circEIF4G2+anti-miR-NC组增加(均P<0.05), 见图7.
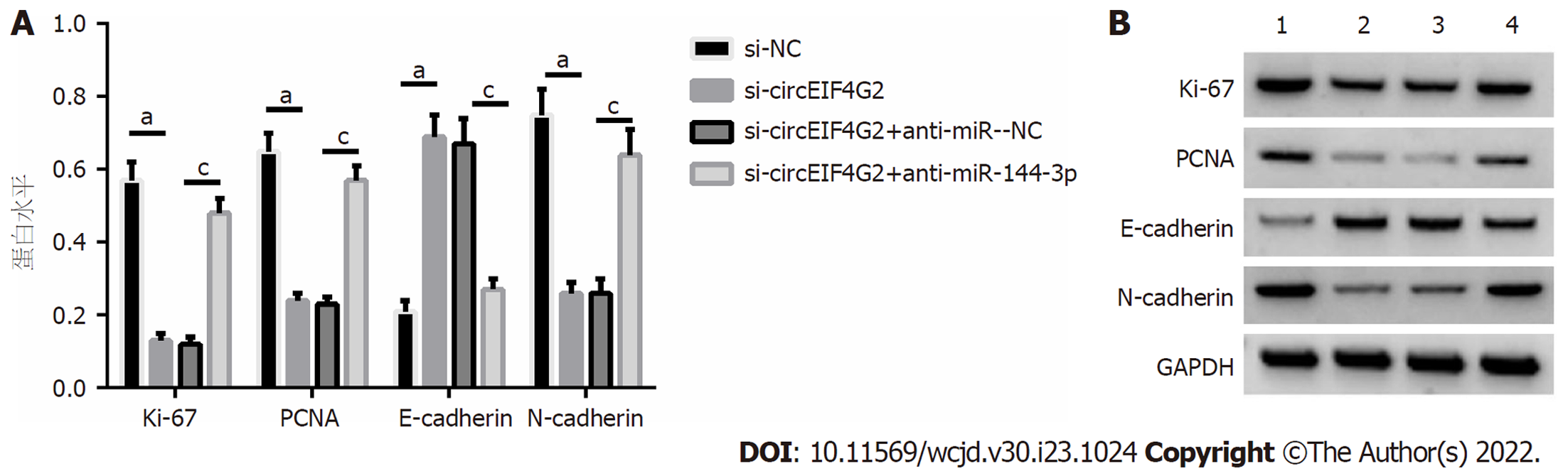
si-circEIF4G2组结肠癌LoVo细胞的E-cadherin蛋白表达量高于si-NC组, N-cadherin、Ki-67、PCNA蛋白表达量低于si-NC组; si-circEIF4G2+anti-miR-144-3p组结肠癌LoVo细胞的E-cadherin蛋白表达量低于si-circEIF4G2+anti-miR-NC组, N-cadherin、Ki-67、PCNA蛋白表达量高于si-circEIF4G2+anti-miR-NC组(均P<0.05), 见图8.
文献报道[12], circEIF4G2在正常组宫颈组织和血清中的表达显著低于宫颈癌组, 其在宫颈病变组织和血清中表达升高可作为宫颈病变诊断的标志物. 在宫颈癌中, circEIF4G2通过促进细胞增殖、集落形成、迁移和侵袭起致癌基因的作用[6]. 在骨肉瘤中, circEIF4G2敲低显著抑制细胞增殖、迁移和侵袭, 从机制上讲, circEIF4G2可以直接结合miR-218[7]. 这些研究表明, circEIF4G2在宫颈癌、骨肉瘤癌症中作为肿瘤促进的circRNA加速肿瘤进展. 但circEIF4G2在结直肠癌中的表达和功能尚未可知. 本研究首先检测了结直肠癌组织样本中circEIF4G2的表达. 结果表明, 与癌旁组织相比, circEIF4G2在结直肠癌组织中上调, 这提示circEIF4G2可能在结直肠癌的发展中起关键作用. 随后, 本研究在体外进行的细胞功能测定. 在结直肠癌LoVo细胞中通过siRNA敲减circEIF4G2, 结果显示, 成功敲减circEIF4G2后, 结直肠癌LoVo细胞的增殖抑制率增加, 克隆数、迁移、侵袭数减少, 并且增殖相关蛋白Ki-67、PCNA下调, 迁移侵袭相关蛋白E-cadherin上调、N-cadherin下调, 说明敲减circEIF4G2可以有效抑制结直肠癌LoVo细胞的增殖、迁移和侵袭的恶性特征, 这些结果表明circEIF4G2在结直肠癌的肿瘤发生中发挥致癌作用, 与先前的研究一致.
已有文献记载, circRNA可以通过充当miRNA海绵来发挥其调节能力[12]. 例如circEIF4G2通过海绵miR-218加重糖尿病肾病的肾纤维化[13]. 本研究还评估了circEIF4G2影响结直肠癌进展的潜在机制. 使用生物信息学预测方法, 本研究发现circEIF4G2可以靶向miR-144-3p. 几项研究指出, miR-144-3p是一种促癌基因, 例如在透明细胞肾细胞[9]、甲状腺[14]中高表达, 促进甲状腺肿瘤的发展. 但据多项研究报道, miR-144-3p是多种人类癌症的抑癌基因, 包括结直肠癌[10]、口腔鳞状细胞癌[15]、非小细胞肺癌[16]、肝癌[17]和胃癌[18]. 例如miR-144-3p通过靶向EZH2癌基因抑制口腔鳞状细胞癌的肿瘤细胞生长和侵袭[19]. 结直肠腺癌组织中miR-144-3p的表达下调, miR-144-3p显著抑制结直肠腺癌细胞的增殖、迁移和侵袭[20]. 可见miR-144-3p是结直肠癌中的肿瘤抑制因子. 本研究同样检测到结直肠癌组织中miR-144-3p表达下调. 双荧光素酶报告实验数据显示, circEIF4G2直接与miR-144-3p结合, 且敲减circEIF4G2提升了miR-144-3p的水平. 此外, miR-144-3p抑制剂逆转了敲减circEIF4G2对结直肠癌LoVo细胞增殖、迁移和侵袭的抑制效果. 这些结果表明, circEIF4G2促进结直肠癌LoVo细胞恶性增殖、迁移和侵袭的作用是通过靶向miR-144-3p来实现的.
总之, 本研究结果首次表明circEIF4G2可能是结直肠癌中的一种新型致癌基因. 此外, circEIF4G2通过靶向miR-144-3p, 促进结直肠癌LoVo细胞的生长和转移. 本研究提供了结直肠癌发病机制的新见解.
结直肠癌发病机制较为复杂, 已知circRNA在结直肠癌组织/细胞中表达异常, 并可作为结直肠癌诊断的潜在生物学标志物及治疗的潜在靶点, 目前circEIF4G2在结直肠癌发病过程中的作用机制尚未明确.
circEIF4G2在其他肿瘤中表达上调, 并可发挥癌基因作用, 但其在结直肠癌中的表达尚未可知, 本研究分析circEIF4G2在结直肠癌组织/细胞中表达, 探究其对结直肠癌细胞生物学行为的影响, 为结直肠癌靶向治疗寻找新型靶点.
探究circEIF4G2/miR-144-3p在结直肠癌细胞生长、转移中的作用机制.
逆转录-定量聚合酶链反应检测结直肠癌组织中circEIF4G2、miR-144-3p的表达. 实验分组: si-NC组、si-circEIF4G2组、si-circEIF4G2+anti-miR-NC组、si-circEIF4G2+anti-miR-144-3p组. 利用双荧光素酶报告实验分析circEIF4G2与miR-144-3p之间的靶向结合. 采用CCK-8法和克隆形成实验进行四组结直肠癌LoVo细胞的增殖抑制率、克隆形成情况测定, Transwell法检测细胞迁移、侵袭, 并利用Western blotting检测E-cadherin、N-cadherin蛋白表达.
circEIF4G2在结直肠癌组织中高表达, miR-144-3p表达量降低; circEIF4G2可靶向结合miR-144-3p, 并充当miR-144-3p海绵分子; 抑制circEIF4G2表达可抑制结直肠癌LoVo细胞增殖、克隆形成、迁移及侵袭, 下调miR-144-3p表达可减弱抑制circEIF4G2表达对LoVo细胞生物学行为的作用.
circEIF4G2通过充当miR-144-3p的海绵分子而促进LoVo细胞的生长和转移.
下一步将进行体内移植瘤实验, 验证circEIF4G2/miR-144-3p分子轴对裸鼠移植瘤生长、体积的影响.
学科分类: 胃肠病学和肝病学
手稿来源地: 天津市
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B, B
C级 (良好): C
D级 (一般): 0
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Artemaki PI, Scorilas A, Kontos CK. Circular RNAs: A New Piece in the Colorectal Cancer Puzzle. Cancers (Basel). 2020;12. [PubMed] [DOI] |
| 2. | Esmaeili M, Keshani M, Vakilian M, Esmaeili M, Peymani M, Seyed Forootan F, Chau TL, Göktuna SI, Zaker SR, Nasr Esfahani MH, Ghaedi K. Role of non-coding RNAs as novel biomarkers for detection of colorectal cancer progression through interaction with the cell signaling pathways. Gene. 2020;753:144796. [PubMed] [DOI] |
| 3. | Sarraf JS, Puty TC, da Silva EM, Allen TSR, Sarraf YS, de Carvalho LEW, Adami F, de Oliveira EHC. Noncoding RNAs and Colorectal Cancer: A General Overview. Microrna. 2020;9:336-345. [PubMed] [DOI] |
| 4. | Lei B, Tian Z, Fan W, Ni B. Circular RNA: a novel biomarker and therapeutic target for human cancers. Int J Med Sci. 2019;16:292-301. [PubMed] [DOI] |
| 5. | Yin Y, Long J, He Q, Li Y, Liao Y, He P, Zhu W. Emerging roles of circRNA in formation and progression of cancer. J Cancer. 2019;10:5015-5021. [PubMed] [DOI] |
| 6. | Mao Y, Zhang L, Li Y. circEIF4G2 modulates the malignant features of cervical cancer via the miR218/HOXA1 pathway. Mol Med Rep. 2019;19:3714-3722. [PubMed] [DOI] |
| 7. | Lin E, Liu S, Xiang W, Zhang H, Xie C. CircEIF4G2 Promotes Tumorigenesis and Progression of Osteosarcoma by Sponging miR-218. Biomed Res Int. 2020;2020:8386936. [PubMed] [DOI] |
| 8. | Wu J, Zhao Y, Li F, Qiao B. MiR-144-3p: a novel tumor suppressor targeting MAPK6 in cervical cancer. J Physiol Biochem. 2019;75:143-152. [PubMed] [DOI] |
| 9. | Xiao W, Lou N, Ruan H, Bao L, Xiong Z, Yuan C, Tong J, Xu G, Zhou Y, Qu Y, Hu W, Gao Y, Ru Z, Liu L, Xiao H, Chen K, Yang H, Zhang X. Mir-144-3p Promotes Cell Proliferation, Metastasis, Sunitinib Resistance in Clear Cell Renal Cell Carcinoma by Downregulating ARID1A. Cell Physiol Biochem. 2017;43:2420-2433. [PubMed] [DOI] |
| 10. | Zhou N, Chen Y, Yang L, Xu T, Wang F, Chen L, Liu J, Liu G. LncRNA SNHG4 promotes malignant biological behaviors and immune escape of colorectal cancer cells by regulating the miR-144-3p/MET axis. Am J Transl Res. 2021;13:11144-11161. [PubMed] |
| 11. | Sun N, Zhang L, Zhang C, Yuan Y. miR-144-3p inhibits cell proliferation of colorectal cancer cells by targeting BCL6 via inhibition of Wnt/β-catenin signaling. Cell Mol Biol Lett. 2020;25:19. [PubMed] [DOI] |
| 12. | Zeng K, Wang S. Circular RNAs: The crucial regulatory molecules in colorectal cancer. Pathol Res Pract. 2020;216:152861. [PubMed] [DOI] |
| 13. | Xu B, Wang Q, Li W, Xia L, Ge X, Shen L, Cang Z, Peng W, Shao K, Huang S. Circular RNA circEIF4G2 aggravates renal fibrosis in diabetic nephropathy by sponging miR-218. J Cell Mol Med. 2022;26:1799-1805. [PubMed] [DOI] |
| 14. | Cao HL, Gu MQ, Sun Z, Chen ZJ. miR-144-3p Contributes to the Development of Thyroid Tumors Through the PTEN/PI3K/AKT Pathway. Cancer Manag Res. 2020;12:9845-9855. [PubMed] [DOI] |
| 15. | Li X, Li Y, Jiang C, Chen L, Gan N. MicroRNA-144-3p Inhibits Tumorigenesis of Oral Squamous Cell Carcinoma by downregulating ERO1L. J Cancer. 2020;11:759-768. [PubMed] [DOI] |
| 16. | Li M, Liu Y, Jiang X, Hang Y, Wang H, Liu H, Chen Z, Xiao Y. Inhibition of miR-144-3p exacerbates non-small cell lung cancer progression by targeting CEP55. Acta Biochim Biophys Sin (Shanghai). 2021;53:1398-1407. [PubMed] [DOI] |
| 17. | Li H, Wang M, Zhou H, Lu S, Zhang B. Long Noncoding RNA EBLN3P Promotes the Progression of Liver Cancer via Alteration of microRNA-144-3p/DOCK4 Signal. Cancer Manag Res. 2020;12:9339-9349. [PubMed] [DOI] |
| 18. | Gao ZY, Liu H, Zhang Z. miR-144-3p increases radiosensibility of gastric cancer cells by targeting inhibition of ZEB1. Clin Transl Oncol. 2021;23:491-500. [PubMed] [DOI] |
| 19. | He L, Liao L, Du L. miR1443p inhibits tumor cell growth and invasion in oral squamous cell carcinoma through the downregulation of the oncogenic gene, EZH2. Int J Mol Med. 2020;46:828-838. [PubMed] [DOI] |
| 20. | Li T, Tang C, Huang Z, Yang L, Dai H, Tang B, Xiao B, Li J, Lei X. miR-144-3p inhibited the growth, metastasis and epithelial-mesenchymal transition of colorectal adenocarcinoma by targeting ZEB1/2. Aging (Albany NY). 2021;13:17349-17369. [PubMed] [DOI] |