修回日期: 2021-10-23
接受日期: 2022-01-12
在线出版日期: 2022-01-28
大量实验证明丹酚酸B(salvianolic acid B, Sal B)对非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)有治疗作用, 细胞焦亡在NAFLD发病及其向非酒精性脂肪性肝炎(nonalcoholic steatohepatitis, NASH)进展的过程中起了重要作用, 通过研究Sal B对NASH细胞焦亡主要相关蛋白的调节, 发觉Sal B在NAFLD中多途径、多靶点的治疗作用及优势.
建立NASH体外细胞模型, 并用Sal B及焦亡抑制剂(VX-765)干预, 探讨Sal B对细胞焦亡的影响及对焦亡通路GSDMD/NLRP3/Caspase-1的调节机制.
取对数生长期HepG2细胞, MTT法检测筛选棕榈酸(palmitic acid, PA)最佳的药物干预浓度及干预时间; 将细胞随机分为对照组、模型组(PA), 治疗组(Sal B+PA)及抑制剂组(VX-765+PA). 取各组细胞分别经油红O染色在光学显微镜观察细胞内脂质蓄积情况, 收集细胞上清液酶标仪下测定光密度(optical density, OD)值; 免疫荧光H2DCFH探针测定细胞内活性氧含量; 酶联免疫吸附试验(enzyme-linked immunosorbent assays, ELISA)检测各组细胞上清液白细胞介素-18(interleukin 18, IL-18)、白细胞介素1β(interleukin 1β, IL-1β) 表达量; Western Blot检测炎性小体核苷酸寡聚化结构域样受体蛋白3(nucleotide-binding oligomerization domain-like receptor protein 3, NLRP3)及焦亡相关蛋白半胱氨酸蛋白酶-1(Caspase-1)、消皮素(gasdermin D, GSDMD)、GSDMD的N端结构域(GSDMD-N)的表达, 并检测各种蛋白的相对表达量变化.
模型组细胞内脂质小体及活性氧(reactive oxygen species, ROS)蓄积明显, IL-1β、IL-18等促炎因子分泌增多(P值<0.05), 炎症小体NLRP3、焦亡相关蛋白Caspase-1、GSDMD、GSDMD-N表达均升高(P值均<0.05). 使用Sal B干预治疗或VX-765抑制剂处理后可逆转PA造成的脂质及ROS蓄积, IL-1β及IL-18炎症因子的分泌, 同时可下调NLRP3、Caspase-1、GSDMD、GSDMD-N等焦亡相关蛋白表达(P值均<0.05).
PA可诱导肝脏细胞焦亡发生, 丹酚酸B通过对焦亡通路NLRP3/Caspase-1/GSDMD的抑制作用减轻炎症反应, 缓解NASH进展.
核心提要: 丹酚酸B通过抑制焦亡效应分子消皮素(gasdermin D, GSDMD)蛋白、焦亡启动分子NLRP3蛋白及焦亡相关的半胱氨酸蛋白酶-1(Caspase-1)蛋白的表达, 进一步减轻促炎因子IL-1β和TNF-α的释放, 进而减轻细胞内炎症反应, 缓解非酒精性脂肪性肝炎(non-alcoholic steatohepatitis, NASH)发展.
引文著录: 陈小青, 彭波, 姜红梅, 张昌欨, 李海燕, 李子银. 丹酚酸B对NASH细胞焦亡通路NLRP3/Caspase-1/GSDMD的影响. 世界华人消化杂志 2022; 30(2): 69-76
Revised: October 23, 2021
Accepted: January 12, 2022
Published online: January 28, 2022
Numerous studies have proved that salvianolic acid B (Sal B) has a therapeutic effect on non-alcoholic fatty liver disease (NAFLD). Cell pyrolysis plays an important role in the onset of NAFLD and its progression to NASH. By studying the regulatory effect of Sal B on the main proteins related to cell pyrolysis in NASH, it was found that Sal B has the advantages of multiple approaches and multiple targets in the treatment of NAFLD.
To establish a non-alcoholic steatohepatitis (NASH) cell model by treating HepG2 cells with palmitic acid (PA), and explore the effect of Sal B on cell pyrolysis and the pyrolysis-related GSDMD/NLRP3/caspase-1 pathway.
HepG2 cells in logarithmic growth phase were collected, and the optimal drug intervention concentration and intervention time for PA were assessed by MTT assay. The cells were randomly divided into a control group, a model group (PA), a treatment group (Sal B + PA), and a pyrolysis inhibitor group (VX-765 + PA). The cells of each group were stained with oil red O to observe the lipid accumulation in the cells under an inverted phase-contrast microscope. The cell supernatant was collected to measure the OD value with a microplate reader. The immunofluorescence probe DCFH-DA was used to determine the intracellular ROS content. The expression of interleukin 18 (IL-18) and interleukin 1β (IL-1β) in cell supernatant was determined by ELISA. The expression of NLRP3 and pyrolysis-related proteins caspase-1, GSDMD, and GSDMD-N was detected by Western blot.
Compared with the control group, the model group had obvious accumulation of lipids and ROS, increased secretion of inflammatory factors IL-1β and IL-18 (P < 0.05), and increased protein expression of NLRP3, caspase-1, GSDMD, and GSDMD-N (P < 0.05). Sal B or VX-765 inhibitor treatment can reverse the accumulation of lipids and ROS caused by PA, decreased the secretion of IL-1β and IL-18, and down-regulated the protein expression of NLRP3, caspase-1, GSDMD, and GSDMD-N (P < 0.05).
PA can induce pyrolysis of liver cells. Sal B can reduce inflammation and alleviate the progression of NASH by inhibiting the NLRP3/caspase-1/GSDMD pathway.
- Citation: Chen XQ, Peng B, Jiang HM, Zhang CX, Li HY, Li ZY. Effect of salvianolic acid B on NLRP3/caspase-1/GSDMD pyrolysis pathway in NASH cells. Shijie Huaren Xiaohua Zazhi 2022; 30(2): 69-76
- URL: https://www.wjgnet.com/1009-3079/full/v30/i2/69.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v30.i2.69
流行病学显示亚太地区非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)患病率为2%-35%[1]. 单纯性脂肪肝向非酒精性脂肪性肝炎(non-alcoholic steatohepatitis, NASH)发展是NAFLD病理发展最为关键的一步, 若不进行及时的干预和治疗, 最终均有很大概率发展为肝硬化及肝癌[2,3]. 然而对该病的病理机制和临床治疗管理仍存在局限性. 因此, 如果能在分子层面探索和筛选新的药物靶点, 将能够为NASH治疗提供新的策略.
焦亡是程序性细胞死亡的新形式, 细胞内炎症小体引起下游半胱氨酸蛋白酶-1(Caspase-1)激活, 后者通过切割消皮素(gasdermin D, GSDMD)的N端结构阈介导膜孔形成, 胞质内容物泄露并引起强烈的炎症反应[4]. 有相关文献研究证明非酒精性肝病中GSDMD能诱导炎症因子外泄、激活NF-κB信号通路、促进脂质生成,推动肝脂肪变性向肝炎的转化[5].
Sal B是活血化瘀要药丹参主要水溶性活性成分, 可以通过调节肝癌细胞AKT/mTOR信号通路, 诱导细胞自噬, 促进细胞凋亡[6]. Sal B通过减少肝脏氧化应激反应改善肥胖症小鼠的胰岛素抵抗[7]. 大量研究显示Sal B具有抗炎、抗氧化、抗凋亡及清除氧自由基的作用[8-10], 可能是对NASH一个潜在治疗药物.
本实验通过应用Caspase抑制剂(VX-765)与Sal B共同干预NASH模型细胞, 观察Sal B对NASH治疗效果及对细胞焦亡的影响, 并进一步研究其分子机制, 为NASH在中医药治疗方法中扩展新研究领域和理论依据.
细胞与试剂: HepG2细胞(武汉大学细胞库); Sal B溶液(美仑生物); 棕榈酸(palmitic acid, PA)(美国Sigma-Aldrich); VX-765抑制剂(APExBIO); 牛血清白蛋白(Bovine serum albumin, BSA)、油红O染色剂、活性氧ROS荧光探针及MTT试剂盒(南京凯基生物); 酶联免疫吸附试验(enzyme-linked immunosorbent assays, ELISA)试剂盒(上海碧云天); NLRP3抗体、caspase-1抗体、GSDMD抗体、GSDMD-N抗体、Actin抗体(Cell Signaling Technology); BCA蛋白定量试剂盒(南京凯基生物); Prestained Protein Ladder、HRP标记山羊抗兔IgG、ECL显影液(ThermoFisher Scientific).
1.2.1 MTT法筛选PA最佳干预浓度: 将细胞悬液接种于96孔培养板, 每组细胞设置5个副孔, 在细胞培养箱下培养24 h, 分别加入终浓度为0.25、0.5、1.0及2.0 mmol/L的PA溶液培养24 h, 干预完成后弃上清液, 加入20 μL无血清MTT试剂(5 mg/mL)避光孵育4 h, 加入150 μL/孔二甲基亚砜溶液, 充分震荡混匀使结晶溶解后于酶标仪光密度(optical density, OD)值570 nm处测定其吸光度值, 根据标准公式计算细胞存活率.
1.2.2 细胞分组: 将细胞随机分为4组: 对照组细胞使用完全培养基培养; 模型组细胞使用终浓度为1.0 mmol/L PA溶液培养24 h; 治疗组细胞给与5 μmol/L Sal B预处理24 h, 再使用1.0 mmol/L PA溶液继续培养24 h; 抑制剂组细胞给与50 μmol/L VX-765预处理4 h后再加入1 mmol/L PA继续培养24 h.
1.2.3 油红O染色: 将细胞接种于24孔培养板, 磷酸缓冲盐溶液(phosphate buffered saline solution, PBS)漂洗后弃上清液, 4%多聚甲醛避光固定; PBS 漂洗去除多聚甲醛, 用油红O试剂(500 μL/孔) 室温避光染色30 min; 60%异丙醇洗10 s, 于倒置显微镜下观察. 60%异丙醇溶解细胞10 min, 于酶标仪510 nm波长处测定各组OD值.
1.2.4 免疫荧光: 以1×106/孔将细胞接种于6孔培养板, 药物干预后PBS漂洗3次, 加入终浓度 10 μmol/L的2', 7'-二氯荧光素二乙酸酯(H2DCFH)探针, 于恒温培养箱中避光静置1 h, PBS漂洗3次除去多余未进入细胞的探针, 荧光显微镜拍摄观察.
1.2.5 ELISA: 收集各组细胞上清液, 4 ℃低速离心, 将收集上清液于-80 ℃储存. 按照试剂盒说明进行实验操作, 测定吸光度值, 计算白细胞介素1β(interleukin 1β, IL-1β)和白细胞介素-18(interleukin 18, IL-18)浓度.
1.2.6 Western blot: 提取各组细胞内全部蛋白后检测蛋白含量; 待蛋白质样品变性后, 加样至泳道, 恒压120 V电泳60 min;将PVDF膜置于电转槽中进行转膜; 移膜至封闭液中1 h; 加配制好的一抗溶液覆盖PVDF膜, 4 ℃冰箱内放置12 h; 洗涤多余一抗上清液后加配置好的二抗溶液, 室温孵育1 h; 洗膜后加入显色试剂, 于成像系统中拍摄成像.
统计学处理 SPSS 25.0软件进行数据分析. 各组实验结果用mean±SD表示, 采用单因素方差分析进行多组间比较, 进一步两两比较采用LSD-t检验. P<0.05为差异有统计学意义.
实验结果显示0.25-1.0 mmol/L浓度的PA溶液对HepG2细胞的生长具有促进作用, 差异有统计学意义(P值<0. 01), 2.0 mmol/L PA对HepG2细胞的生长具有明显抑制作用. 因此选择1.0 mmol/L浓度的PA溶液进行造模实验(表1).
| PA浓度组别 | OD值 |
| 0.25 mmol/L组 | 1.179±0.099 |
| 0.5 mmol/L组 | 1.218±0.118 |
| 1.0 mmol/L组 | 1.396±0.181 |
| 2.0 mmol/L组 | 0.427±0.149 |
| F值 | 46.99 |
| P值 | <0.01 |
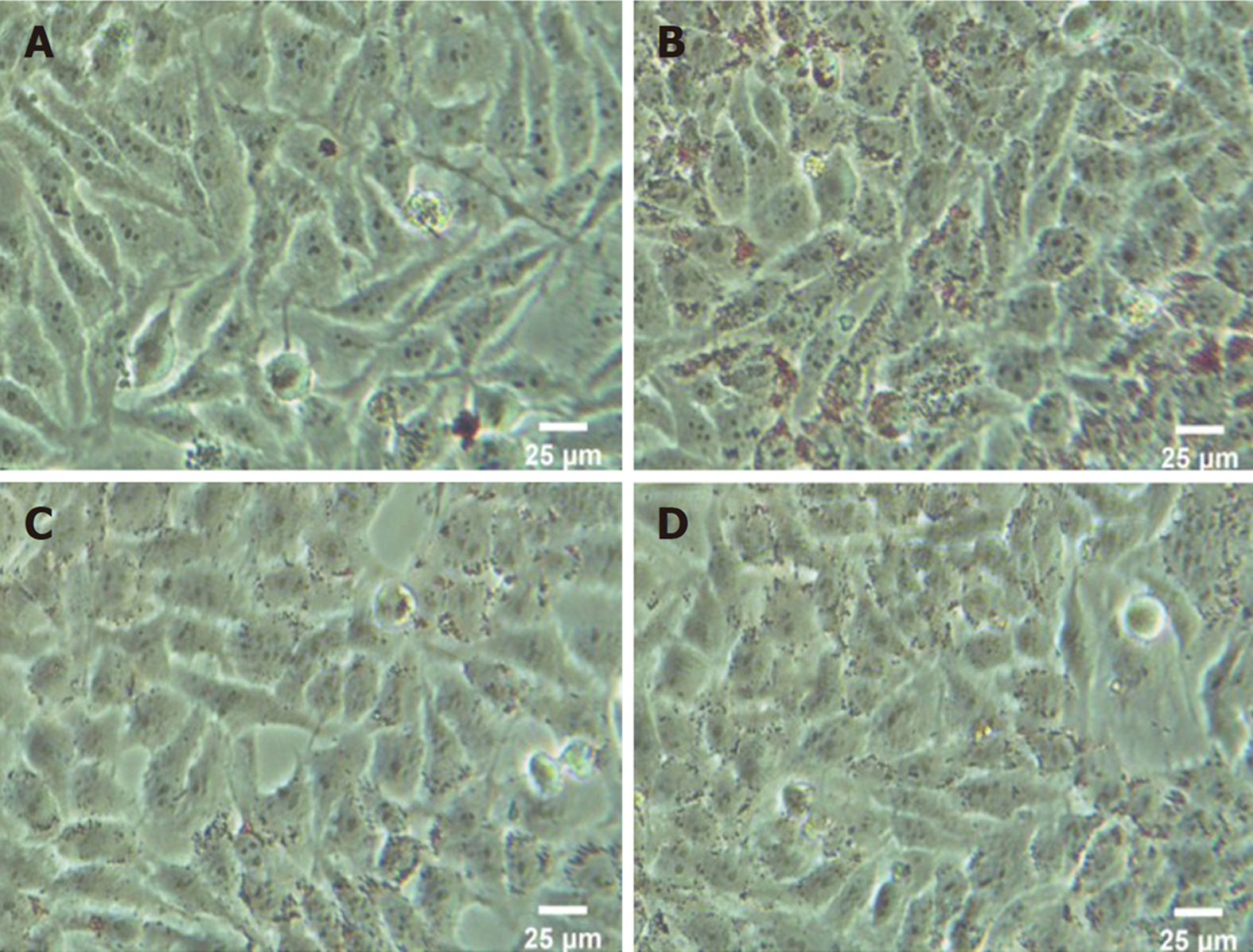
结果显示对照组细胞内无明显红染, 模型组细胞可见胞质内有大量脂滴蓄积, 与油红O试剂反应后显示明显红染, 治疗组及抑制剂组较模型组内脂滴明显减少(图1). 三组细胞脂滴表达量均不同, 差异有统计学意义(F = 114.94, P<0.05), 模型组OD值(0.81±0.04)较对照组(0.39±0.02)升高, 治疗组 (0.53±0.05)较模型组降低. 而抑制剂组OD值(0.51±0.03)较模型组降低(P<0.05), 抑制剂组与治疗组OD值无明显差异. 结果显示1.0 mmol/L PA给药24 h后可成功诱导HepG2细胞内脂质蓄积, Sal B治疗及抑制剂干预后均可明显缓解由PA引起的细胞内脂质蓄积现象.
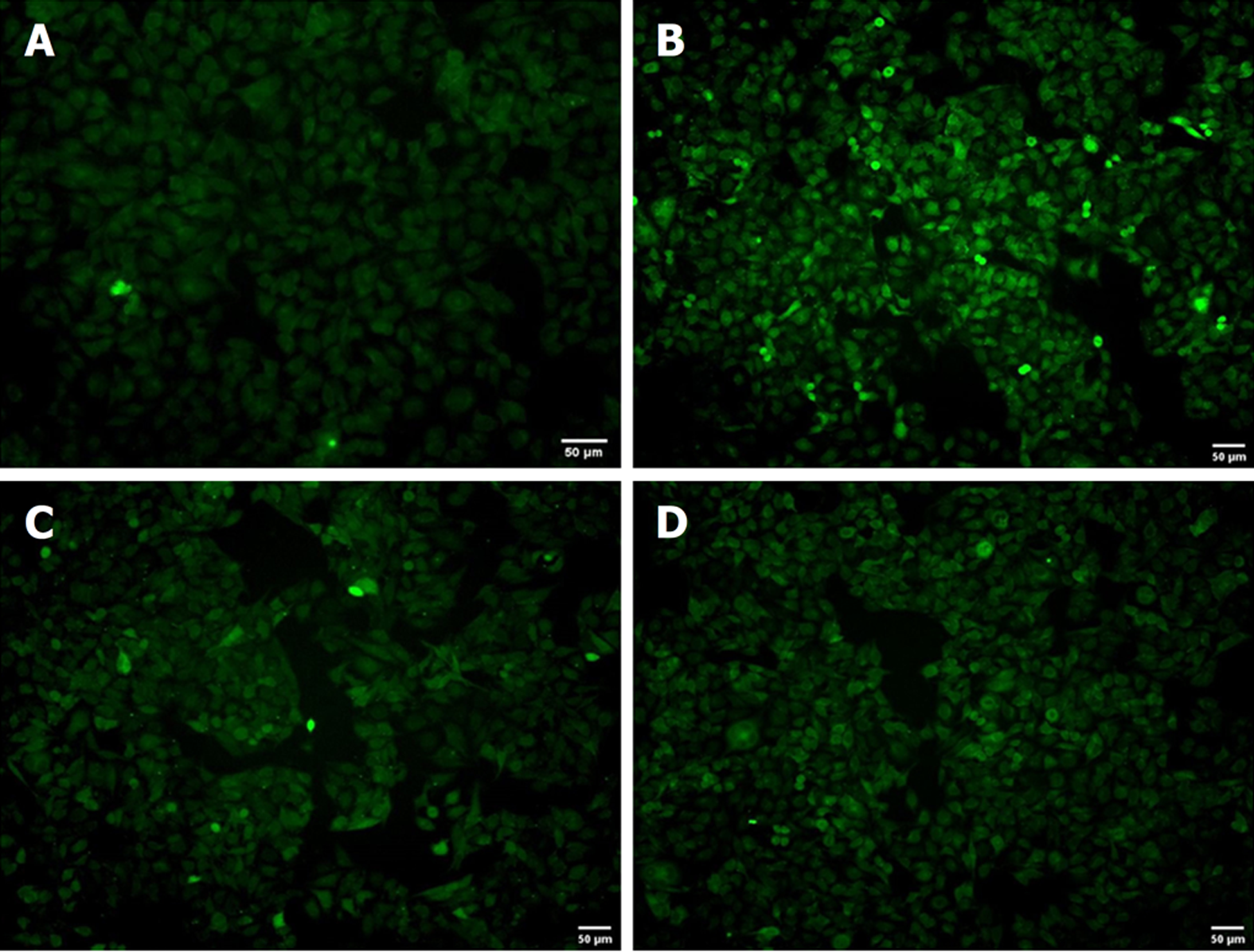
荧光显微镜下观察H2DCFH探针孵育各组细胞后的活性氧(reactive oxygen species, ROS)的荧光强度, 荧光图显示模型组荧光强度较正常对照组明显增多, 治疗组及抑制剂组较模型组荧光强度明显降低(图2). 结果显示NASH细胞内存在明显的过氧化物蓄积, Sal B治疗后可明显减轻细胞内氧化应激, 对NASH具有治疗作用.
实验结果显示, 各组细胞上清液中IL-1β蛋白表达量不同, 差异有统计学意义(F = 522.35, P<0.01), 模型组IL-1β相对表达量(18.46±0.48)较对照组(7.24±0.48)升高(P<0.01), 治疗组(10.38±0.41)较模型组降低(P<0.01), 抑制剂组(11.81±0.62)较模型组降低(P<0.01). 各组细胞上清液IL-18表达量不同, 差异有统计学意义(F = 182.7, P<0.05), 模型组IL-18(15.56±0.44)较对照组(7.38±0.69)升高(P<0.01), 治疗组(10.31±0.68)较模型组降低(P<0.01), 抑制剂组(11.25±0.59)较模型组升高(P<0.01)(表2).
| 组别 | IL-1β含量(ng/L) | IL-18含量(ng/L) |
| 对照组 | 7.24±0.48 | 7.38±0.69 |
| 模型组 | 18.46±0.48 | 15.56±0.44 |
| 治疗组 | 10.38±0.41 | 10.31±0.68 |
| 抑制剂组 | 11.81±0.62 | 11.25±0.59 |
| F值 | 522.35 | 182.7 |
| P值 | <0.01 | <0.05 |
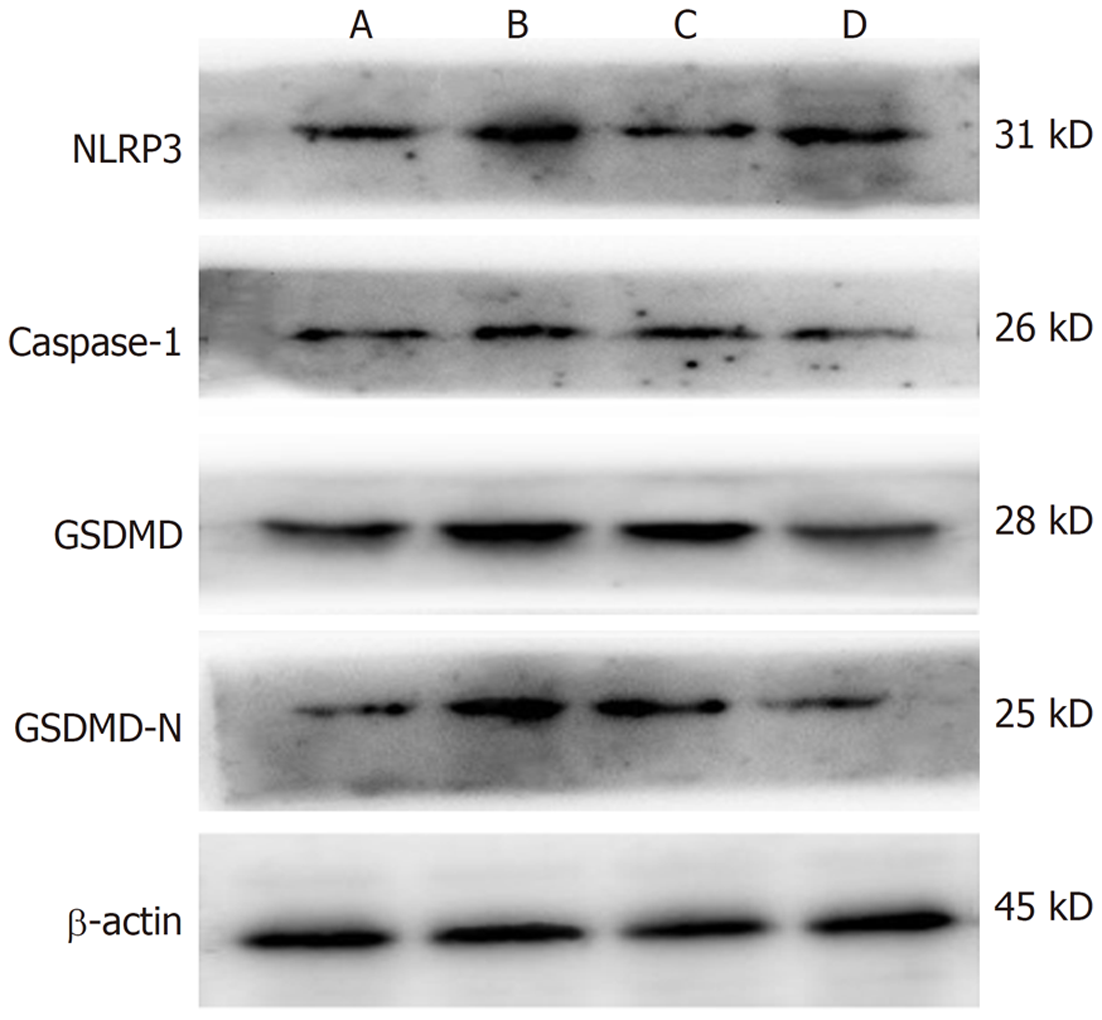
实验结果显示, 模型组较对照组细胞内焦亡相关蛋白NLRP3、Caspase-1、GSDMD和GSDMD-N的表达上调(P<0.01); 使用丹酚酸B治疗后, PA引起的炎性小体NLRP3及焦亡相关蛋白表达上调均被抑制(P<0.01); 使用VX-765抑制剂处理后, 焦亡相关蛋白表达抑制较治疗组更明显(P<0.01), 但对炎性小体NLRP3上调无明显抑制作用(图3, 表3).
| 组别 | NLRP3 | Caspase-1 | GSDMD | GSDMD-N |
| 对照组 | 0.89±0.02 | 0.44±0.03 | 1.67±0.03 | 0.35±0.08 |
| 模型组 | 1.36±0.04 | 1.91±0.18 | 2.93±0.41 | 2.05±0.08 |
| 治疗组 | 0.71±0.02 | 0.69±0.04 | 1.88±0.03 | 1.03±0.08 |
| 抑制剂组 | 1.21±0.04 | 0.28±0.04 | 1.38±0.04 | 0.60±0.05 |
| F值 | 260.08 | 178.34 | 31.55 | 245.09 |
| P值 | <0.01 | <0.01 | <0.01 | <0.01 |
近年来非酒精性脂肪性肝炎的发生机制及治疗方法一直是研究热点, HepG2细胞经PA诱导形成非酒精性脂肪性肝炎的细胞模型也已被广泛应用[11]. 丹参是我国传统中医药中应用最早和最广的药物之一, 前期大量研究发现丹参酚酸类水溶性提取物Sal B具有明显抗炎、抗氧化、抗凋亡的活性, 且含有多种药理活性,如抗肝纤维化、减少肾脏损伤、降低心肌耗氧量、保护神经系统等[12-15]. 本研究主要通过建立体外模型细胞, 在细胞及分子层面上探究Sal B对NASH细胞焦亡的影响, 并对其机制进行进一步研究.
目前关于细胞程序性死亡方式主要有凋亡、自噬及焦亡3种, 在细胞生命各项活动中发挥重要的作用. 焦亡是由Cookson和Brennan在2001年首次提出[16], 即在胱天蛋白酶切割消皮素GSDMD介导下, 引起细胞膜发生破裂, 细胞内容物、促炎因子及大量炎症介质泄露释放, 进而导致细胞严重的炎症反应及死亡. 大量研究结果证实细胞焦亡发生在肝炎、肝硬化、肝癌、胰腺炎、结肠癌及炎症性肠病等各种消化道系统疾病中[17,18]. 细胞焦亡可由两种途径触发即由Caspase-1介导的经典途径和Caspase-4/5/11介导的非经典途径[19]. 刺激因素不同途径激活AIM2、NLRP1b、NLRP3等炎性小体, 炎症小体与ASC相连从而活化Caspase-1, 进一步促使前细胞因子IL-1β和IL-18的活化, 促进GSDMD的裂解, 释放的GSDMD-N端结构域破坏细胞膜完整性, 使细胞内炎性物质大量释放导致细胞焦亡[20]. Caspase-1是焦亡最主要的信号分子之一, VX-765是其选择性抑制剂, 可抑制其表达和活性[21]. 本研究通过检测NLRP3为代表的炎症小体、IL-1β和IL-18为代表的炎性因子、Caspase-1为代表的Caspase家族、以及GSDMD蛋白、GSDMD-N蛋白等作为焦亡发生的指标.
NASH的组织病理学特征在于脂质蓄积及脂毒性损伤和炎症小体激活诱导线粒体损伤[22,23]. 研究结果提示, 当前实验环境下1 mmol PA可诱导HepG2形成NASH模型细胞, 生化检测、油红O染色及免疫荧光染色结果均提示NASH细胞内有明显的脂质、过氧化物及脂氧化物蓄积, ELISA结果提示NASH细胞内炎症因子显著激活, 对NLRP3、Caspase-1、GSDMD蛋白及GSDMD-N蛋白检测证实NASH细胞内焦亡相关蛋白明显升高, 这些结果提示PA可诱导的NASH模型细胞内发生了焦亡.
实验结果提示Sal B可逆转NASH细胞内焦亡的发生, 减轻细胞内炎症反应, 从而减轻NASH细胞的损伤及病变的进一步进展. Sal B对HepG2预处理24 h后, 可显著减少细胞内脂滴及过氧化物的蓄积, 抑制炎性因子释放, 有效降低NLRP3、Caspase-1、GSDMD蛋白及GSDMD-N蛋白的表达, 从而抑制细胞焦亡. 通VX-765抑制剂预处理HepG2细胞, 阻断Caspase-1的活化, 细胞焦亡的进展过程可有效被抑制, NASH细胞病理进展得到有效缓解, 但与治疗组相比, 抑制剂组对NASH细胞炎症因子的抑制作用较差. 结果进一步证实Sal B对肝脏细胞的保护作用与抑制细胞焦亡有关, 但不仅限于此.
综上所述, 本研究深入细胞水平证实Sal B抑制NASH细胞发生细胞焦亡的作用机制, 改善减轻NASH细胞脂质蓄积和炎性病变, 缓解NASH病变进展, 其机制与对NLRP3/Caspase-1/GSDMD信号途径抑制作用有关. 目前细胞焦亡在肝脏疾病中的影响及具体机制还存在很多关键科学问题尚未阐明, 焦亡在消化道相关疾病的调节机制仍需不断地完善和补充. 本研究为确定Sal B预对NASH治疗及保护作用方面的应用提供更加有利的理论依据, 也为中药在NASH细胞病变机制中寻求更多可能的治疗靶点提供新思路.
大量实验证实丹酚酸B(salvianolic acid B, Sal B)在人体、动物的多个系统及细胞中具有抗炎、抗氧化、清除氧自由基的作用, 前期我们已经初步证实其可通过多种机制对非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)起治疗作用. 已有研究证实细胞焦亡在NAFLD发病及其向非酒精性脂肪性肝炎(non-alcoholic steatohepatitis, NASH)进展的过程中起了重要的作用, 细胞焦亡通过调控打孔蛋白GSDMD(gasdermin D)的表达, 抑制NAFLD模型中的细胞焦亡过程可以保肝抗炎, 延缓病情的进展.
通过观察Sal B对NASH大鼠肝脏氧化物蓄积及脂质过氧化程度的影响, 证实其对NASH的治疗效果. 检测炎症因子及焦亡相关蛋白表达水平, 证实Sal B可减轻NASH细胞内的焦亡反应.
验证Sal B可否有效减轻NASH细胞内过氧化物活性氧(reactive oxygen species, ROS)、脂氧化物含量, 以及油红O染色验证治疗组细胞内脂滴变化来证实抑制剂组和治疗组都可有效减少焦亡相关蛋白表达, 减轻炎症反应, 缓解NASH发展.
通过棕榈酸(palmitic acid, PA)干预HepG2细胞建立NASH模型, 使用Sal B溶液、Caspase抑制剂干预, 建立对照组、NASH模型组、Sal B治疗组及抑制组. 通过生化指标、油红O染色观察细胞病理变化及脂滴聚集. 免疫荧光探针测定细胞内POS含量; 酶联免疫吸附试验检测各组细胞上清液白细胞介素-18(interleukin 18, IL-18)、白细胞介素1β(interleukin 1β, IL-1β)表达量; Western Blot检测消皮素(gasdermin D, GSDMD)、GSDMD的N端结构域(GSDMD-N)、核苷酸寡聚化结构域样受体蛋白3(nucleotide-binding oligomerization domain-like receptor protein 3, NLRP3)和半胱氨酸蛋白酶-1(Caspase-1)焦亡相关蛋白.
模型组细胞内脂质小体及活性氧(reactive oxygen species, ROS)蓄积明显, IL-1β、IL-18等促炎因子分泌增多, 炎症小体NLRP3、焦亡相关蛋白Caspase-1、GSDMD、GSDMD-N表达均升高. 使用Sal B干预治疗或VX-765抑制剂处理后可逆转PA造成的脂质及ROS蓄积, IL-1β及IL-18炎症因子的分泌, 同时可下调NLRP3、Caspase-1、GSDMD、GSDMD-N等焦亡相关蛋白表达.
PA可诱导肝脏细胞焦亡发生, 丹酚酸B通过对焦亡通路NLRP3/Caspase-1/GSDMD的抑制作用减轻炎症反应, 缓解NASH进展.
通过研究Sal B对NASH细胞焦亡主要相关蛋白的调节, 发觉Sal B在NAFLD中多途径、多靶点的治疗优势, 为探索NAFLD新型治疗药物提供新的研究领域.
学科分类: 胃肠病学和肝病学
手稿来源地: 湖北省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B, B
C级 (良好): C
D级 (一般): 0
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Lee SB, Kim KM, An J, Lee D, Shim JH, Lim YS, Lee HC, Chung YH, Lee YS. Clinical characteristics and potential aetiologies of non-B non-C hepatocellular carcinoma in hepatitis B virus endemic area. Liver Int. 2016;36:1351-1361. [PubMed] [DOI] |
| 2. | Athyros VG, Boutari C, Stavropoulos K, Anagnostis P, Imprialos KP, Doumas M, Karagiannis A. Statins: An Under-Appreciated Asset for the Prevention and the Treatment of NAFLD or NASH and the Related Cardiovascular Risk. Curr Vasc Pharmacol. 2018;16:246-253. [PubMed] [DOI] |
| 3. | Younossi ZM, Koenig AB, Abdelatif D, Fazel Y, Henry L, Wymer M. Global epidemiology of nonalcoholic fatty liver disease-Meta-analytic assessment of prevalence, incidence, and outcomes. Hepatology. 2016;64:73-84. [PubMed] [DOI] |
| 4. | Amarante-Mendes GP, Adjemian S, Branco LM, Zanetti LC, Weinlich R, Bortoluci KR. Pattern Recognition Receptors and the Host Cell Death Molecular Machinery. Front Immunol. 2018;9:2379. [PubMed] [DOI] |
| 5. | Wree A, McGeough MD, Peña CA, Schlattjan M, Li H, Inzaugarat ME, Messer K, Canbay A, Hoffman HM, Feldstein AE. NLRP3 inflammasome activation is required for fibrosis development in NAFLD. J Mol Med (Berl). 2014;92:1069-1082. [PubMed] [DOI] |
| 6. | Gong L, Di C, Xia X, Wang J, Chen G, Shi J, Chen P, Xu H, Zhang W. AKT/mTOR signaling pathway is involved in salvianolic acid B-induced autophagy and apoptosis in hepatocellular carcinoma cells. Int J Oncol. 2016;49:2538-2548. [PubMed] [DOI] |
| 7. | Shi Y, Pan D, Yan L, Chen H, Zhang X, Yuan J, Mu B. Salvianolic acid B improved insulin resistance through suppression of hepatic ER stress in ob/ob mice. Biochem Biophys Res Commun. 2020;526:733-737. [PubMed] [DOI] |
| 8. | Jiang P, Guo Y, Dang R, Yang M, Liao D, Li H, Sun Z, Feng Q, Xu P. Salvianolic acid B protects against lipopolysaccharide-induced behavioral deficits and neuroinflammatory response: involvement of autophagy and NLRP3 inflammasome. J Neuroinflammation. 2017;14:239. [PubMed] [DOI] |
| 9. | Wang W, Hu W. Salvianolic acid B recovers cognitive deficits and angiogenesis in a cerebral small vessel disease rat model via the STAT3/VEGF signaling pathway. Mol Med Rep. 2018;17:3146-3151. [PubMed] [DOI] |
| 10. | Zeng Z, Zhang H, Wang X, Liu K, Li T, Sun S, Li H. Salvianolic acid B suppresses cell proliferation and induces apoptosis in osteosarcoma through p38-mediated reactive oxygen species generation. Oncol Lett. 2018;15:2679-2685. [PubMed] [DOI] |
| 11. | Xiao Q, Zhang S, Yang C, Du R, Zhao J, Li J, Xu Y, Qin Y, Gao Y, Huang W. Ginsenoside Rg1 Ameliorates Palmitic Acid-Induced Hepatic Steatosis and Inflammation in HepG2 Cells via the AMPK/NF-κB Pathway. Int J Endocrinol. 2019;2019:7514802. [PubMed] [DOI] |
| 12. | Zeng W, Shan W, Gao L, Gao D, Hu Y, Wang G, Zhang N, Li Z, Tian X, Xu W, Peng J, Ma X, Yao J. Inhibition of HMGB1 release via salvianolic acid B-mediated SIRT1 up-regulation protects rats against non-alcoholic fatty liver disease. Sci Rep. 2015;5:16013. [PubMed] [DOI] |
| 13. | Hu Y, Wang M, Pan Y, Li Q, Xu L. Salvianolic acid B attenuates renal interstitial fibrosis by regulating the HPSE/SDC1 axis. Mol Med Rep. 2020;22:1325-1334. [PubMed] [DOI] |
| 14. | Deng Y, Zhang T, Teng F, Li D, Xu F, Cho K, Xu J, Yin J, Zhang L, Liu Q, Yang M, Wu W, Liu X, Guo DA, Jiang B. Ginsenoside Rg1 and Rb1, in combination with salvianolic acid B, play different roles in myocardial infarction in rats. J Chin Med Assoc. 2015;78:114-120. [PubMed] [DOI] |
| 15. | Chen T, Liu W, Chao X, Zhang L, Qu Y, Huo J, Fei Z. Salvianolic acid B attenuates brain damage and inflammation after traumatic brain injury in mice. Brain Res Bull. 2011;84:163-168. [PubMed] [DOI] |
| 16. | Cookson BT, Brennan MA. Pro-inflammatory programmed cell death. Trends Microbiol. 2001;9:113-114. [PubMed] [DOI] |
| 17. | Zheng T, Yang X, Li W, Wang Q, Chen L, Wu D, Bian F, Xing S, Jin S. Salidroside Attenuates High-Fat Diet-Induced Nonalcoholic Fatty Liver Disease via AMPK-Dependent TXNIP/NLRP3 Pathway. Oxid Med Cell Longev. 2018;2018:8597897. [PubMed] [DOI] |
| 19. | Huang X, Feng Y, Xiong G, Whyte S, Duan J, Yang Y, Wang K, Yang S, Geng Y, Ou Y, Chen D. Caspase-11, a specific sensor for intracellular lipopolysaccharide recognition, mediates the non-canonical inflammatory pathway of pyroptosis. Cell Biosci. 2019;9:31. [PubMed] [DOI] |
| 20. | Xia X, Wang X, Zheng Y, Jiang J, Hu J. What role does pyroptosis play in microbial infection? J Cell Physiol. 2019;234:7885-7892. [PubMed] [DOI] |
| 21. | Flores J, Noël A, Foveau B, Beauchet O, LeBlanc AC. Pre-symptomatic Caspase-1 inhibitor delays cognitive decline in a mouse model of Alzheimer disease and aging. Nat Commun. 2020;11:4571. [PubMed] [DOI] |
| 22. | Mota M, Banini BA, Cazanave SC, Sanyal AJ. Molecular mechanisms of lipotoxicity and glucotoxicity in nonalcoholic fatty liver disease. Metabolism. 2016;65:1049-1061. [PubMed] [DOI] |
| 23. | Yu J, Nagasu H, Murakami T, Hoang H, Broderick L, Hoffman HM, Horng T. Inflammasome activation leads to Caspase-1-dependent mitochondrial damage and block of mitophagy. Proc Natl Acad Sci USA. 2014;111:15514-15519. [PubMed] [DOI] |