修回日期: 2022-03-22
接受日期: 2022-06-21
在线出版日期: 2022-07-28
超声内镜兼具内镜检查和超声扫描功能, 由于肠道解剖结构较为复杂, 在结直肠病变中对超声内镜的研究较少, 通过探讨超声内镜检查在结直肠病变中的作用, 可为临床工作提供一定的诊断价值.
探讨超声内镜检查在结直肠及周围病变诊断中的临床应用价值.
回顾性分析2018-09/2021-07, 95例结直肠及周围病变患者的小探头和大探头超声内镜检查结果, 并与术后病理对照. 统计学方法采用kappa检验.
与术后病理相比: (1)大探头超声内镜检查判断直肠癌浸润深度T分期的准确率为73.9%(17/23): T1期2/4, T2期4/6, T3期6/7, T4期5/5; 判断评估区域淋巴结转移N分期的准确率为91.3%(21/23): N0 14/15, N1 7/8; 一致性较好(kappa值为0.782, P<0.01); (2)小探头超声内镜在结直肠腺瘤或早癌内镜黏膜下剥离术(endoscopic submucosal dissection, ESD)术前评估中判断肿瘤浸润深度的准确率为87.1%(27/31), 一致性一般(kappa值为0.665, P<0.01); (3)小探头超声内镜判断结直肠黏膜下隆起性病变起源和类型的准确率为95.5%(21/22), 一致性高(kappa值为0.919, P<0.01). (4)超声内镜引导细针穿刺诊断直肠及其周围病变的准确率为70.0%(7/10), 一致性一般(kappa值为0.565, P<0.01).
根据结直肠及其周围病变具体部位、大小, 选择性应用小探头或大探头超声内镜检查,对直肠癌TN分期、ESD术前评估、判断结直肠黏膜下隆起性病变特点及获取直肠及其周围病变组织标本具有重要价值.
核心提要: 本研究通过回顾性分析我院超声内镜检查结直肠及周围病变病例的结果, 并与术后病理结果进行比较, 为临床诊断及治疗提供一定的理论基础.
引文著录: 唐曦平, 陈金凤, 刘爱群, 沈妍华, 黄月丽. 超声内镜在结直肠及周围病变评估中的临床应用分析. 世界华人消化杂志 2022; 30(14): 647-654
Revised: March 22, 2022
Accepted: June 21, 2022
Published online: July 28, 2022
Endoscopic ultrasonography (EUS) has the functions of both endoscopy and ultrasound. Due to the complex anatomical structure of the intestine, there are few studies on EUS in colorectal lesions.
To explore the clinical application value of EUS in the diagnosis of colorectal and peri-colorectal lesions.
We retrospectively analyzed the examination results of 95 patients detected by endoscopic miniprobe sonography (MPS) and linear EUS from September 2018 to July 2021, which were then compared to postoperative pathology. The kappa test was used in statistical analysis.
Using postoperative pathology as the golden standard, the accuracy of linear EUS in diagnosing the depth of rectal cancer invasion (T stage) was 73.9% (17/23 cases), including T1 (2/4 cases), T2 (4/6 cases), T3 (6/7 cases) , and T4 (5/ 5 cases) stages. The accuracy of linear EUS in diagnosing regional lymph node metastasis (N stage) was 91.3% (21/23 cases), including N0 (14/15 cases) and N1 (7/8 cases) stages. The consistency was high (kappa value = 0.782, P < 0.01). During preoperative evaluation of colorectal adenoma or early cancer before endoscopic submucosal dissection (ESD), the accuracy of MPS in diagnosing the depth of tumor invasion was 87.1% (27/31 cases), and the consistency was moderate (kappa value = 0.665, P < 0.01). The accuracy of MPS in diagnosing the origin and type of colorectal submucosal lesions was 95.5% (21/22 cases), and the consistency was high (kappa value = 0.919, P < 0.01). The accuracy of endoscopic ultrasonography-guided fine-needle aspiration in determining rectal and peri-rectal lesions was 70.0% (7/10 cases), and the consistency was moderate (kappa value = 0.565, P < 0.01).
According to the specific location and size of colorectal and peri-colorectal lesions, selective use of the MPS and linear EUS is of great value with regard to T/N staging of rectal cancer, preoperative evaluation of ESD, determination of the characteristics of colorectal-submucosal bulging lesions, and acquisition of lesion tissue of rectal and peri-rectal lesions.
- Citation: Tang XP, Chen JF, Liu AQ, Shen YH, Huang YL. Clinical application of endoscopic ultrasonography in evaluation of colorectal and peri-colorectal lesions. Shijie Huaren Xiaohua Zazhi 2022; 30(14): 647-654
- URL: https://www.wjgnet.com/1009-3079/full/v30/i14/647.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v30.i14.647
超声内镜检查是将超声和内镜相结合的检查技术, 在内镜直视下可以将超声探头接近病灶进行实时扫查, 避免了皮下脂肪及消化道管腔内气体的干扰. 当消化道管壁各层有实质性病灶生长、浸润, 或管壁外病变对消化道有压迫时, 超声内镜可以通过扫描, 清晰地将这些影像信息显示出来, 并且对病变累及管壁层次做出初步判断. 因此超声内镜检查适用于很多胃肠道及食管局部病变的治疗前诊断. 但由于肠道解剖结构对超声内镜操作的挑战性, 有关超声内镜在结直肠病变检查中的报道较少. 本文旨在回顾性分析我院超声内镜检查结直肠及周围病变病例的结果, 首次较全面的探讨其临床应用价值.
回顾性分析2018-09/2021-07在我院进行肠道超声内镜检查的95例患者. 接受小探头超声内镜检查者62例, 接受大探头超声内镜检查者23例, 接受超声内镜引导细针穿刺者10例. 其中男性61例, 女性34例, 年龄(25-81)岁, 平均(56.2±12.6)岁.
结肠镜为Olympus PCF-Q260JF; 内镜用超声小探头为Olympus UM-BS20-26R, 扫描频率为20 MHz; 大探头超声内镜为Olympus UC-UCT260, 扫描频率为7.5 MHz; 穿刺针为COOKECHO 3-22.
术前常规予口服肠道清洁剂或灌肠清洁行肠道准备, 检查时取左侧卧位, 体位同肠镜检查体位. 行小探头超声检查时, 在肠镜显示病变后, 注入蒸馏水, 使病变浸入水中, 将超声小探头经内镜活检钳道插入, 采用直接接触法或脱气充水法进行实时超声扫描, 扫查过程中应尽量使探头与病灶平行, 从而获得清晰的声像图. 行大探头超声检查前, 行肠镜检查确定病变位置, 大探头超声内镜常规插镜、观察, 到达与肠镜所见一致病变的部位并观察到病变后, 调整超声内镜位置, 清楚呈现病变目标的超声图像, 选取肿瘤周围正常结直肠壁层次作为判断侵犯深度的基线标准, 观察并采集病变部位、大小、浸润深度、回声特点、局部淋巴结、周围组织及器官的转移情况等信息.
根据《中国内镜超声引导下细针穿刺抽吸/活体组织检查术应用指南(2021年, 上海)》[1],不同粗细的穿刺针对实性病变或淋巴结穿刺的诊断准确率无统计学差异, 并且由于22G穿刺针灵活性和超声下可视性均较好, 可获得足量的细胞学或组织学样本, 同时不增加操作并发症风险, 因此目前在临床应用最广泛. 本院行超声内镜引导下细针穿刺时, 经内镜活检钳道插入22G穿刺针, 主要使用5或10 mL负压及慢提拉技术来施加最小负压, 每次穿刺进针后, 反复提拉30次, 每个病灶穿刺2-3针, 获取的标本送组织病理学及细胞学检查. 操作医师均为具有5年以上超声内镜诊断经验的高年资内镜医师.
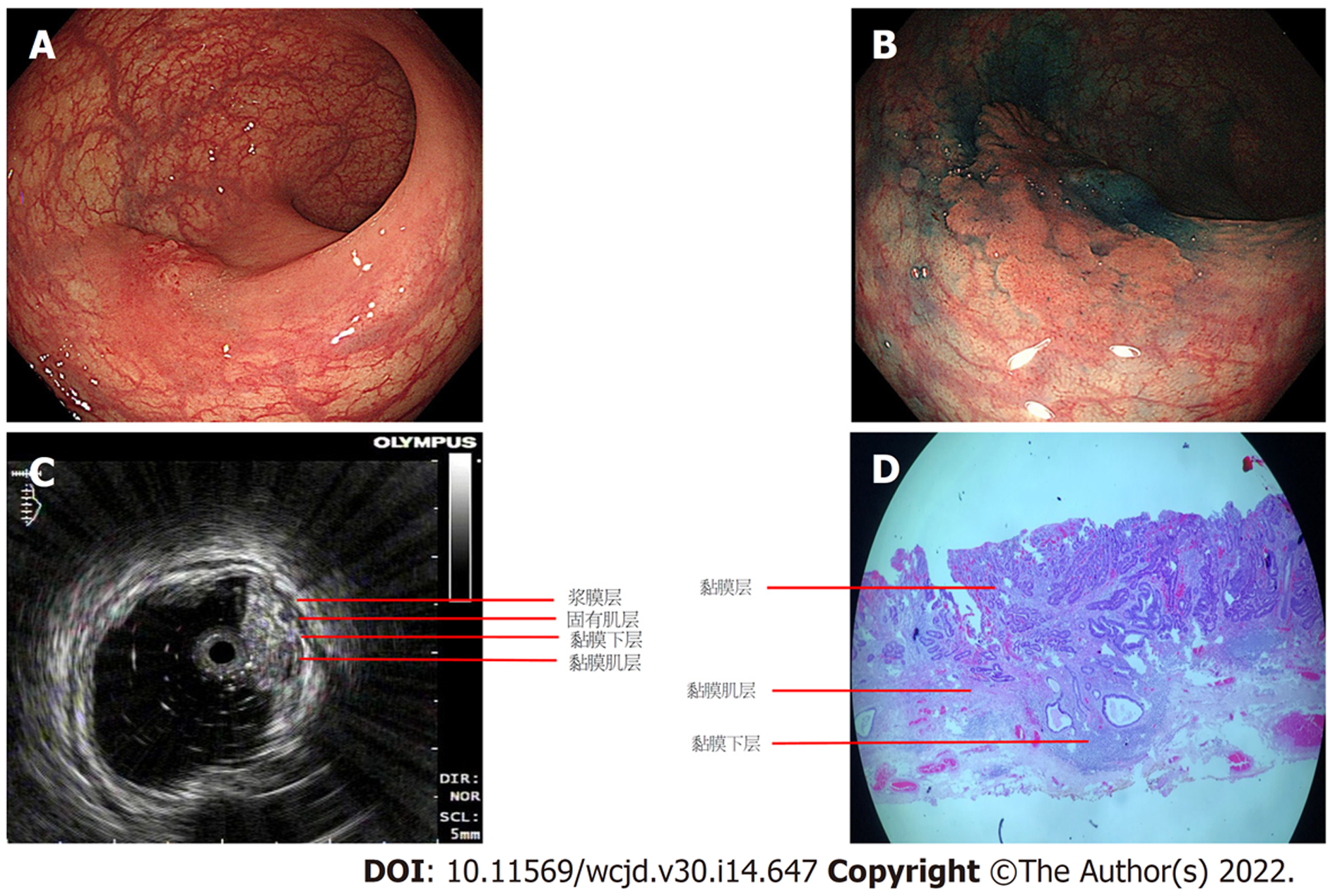
1.3.1 正常肠壁超声内镜图像判断标准: 正常肠壁在超声内镜下分为5层结构(自靠近探头开始); 第一层呈高回声, 为黏膜层; 第二层呈低回声, 为黏膜肌层; 第三层呈高回声, 为黏膜下层; 第四层呈低回声, 为固有肌层; 第五层呈高回声, 为浆膜层.
1.3.2 直肠癌TN分期: 直肠癌超声内镜影像主要表现为不规则、边界破坏、内部回声不均匀的低回声区域, 可累及一层或多层肠壁结构, 按照直肠癌超声分期方法[2], 根据肿瘤侵犯肠壁的层次确定T分期: T1: 低回声影局限于黏膜下层以内, 未达到固有肌层; T2: 低回声影侵犯固有肌层但未突破浆膜层; T3: 低回声影累及全层并突破浆膜层, 浸润到直肠周围组织; T4: 低回声影穿透浆膜并侵犯邻近器官. 在直肠肿物周围或狭窄近端扫查盆腔淋巴结, 根据淋巴结良恶性确定区域淋巴结转移N分期: (1)良性: 边界不清楚、椭圆形、回声较均匀的强回声, 直径<0.5 cm; (2)恶性: 边界清楚、圆形、内为不均匀的低回声. 对于任何区域的淋巴结转移都被定为N1, 无淋巴结转移定为N0.
统计学处理 数据采用SPSS 26.0统计软件分析处理. 呈正态分布的计量资料采用mean±SD表示; 计数资料采用百分率及构成比描述; 采用kappa检验对多分类变量做一致性评价, kappa值越接近1表示一致性越高, >0.9为一致性高, >0.7为一致性较好, 0.4-0.7为一致性一般, <0.4为一致性较差. P<0.05为有统计学意义.
18例经肠镜活检病理组织学确诊直肠癌(其中肿块型14例, 溃疡型4例)患者及5例怀疑直肠癌性狭窄患者进行治疗前超声内镜分期评估, 与术后病理相比, 超声内镜检查判断直肠癌浸润深度T分期的准确率为73.9%(17/23): T1期2/4, T2期4/6, T3期6/7, T4期5/5; 判断评估区域淋巴结转移N分期的准确率为91.3%(21/23): N0 14/15, N1 7/8; 一致性较好(kappa值为0.782, P<0.01).我们同时分析CT判断直肠癌TN分期的结果, T分期的准确率为65.2%(15/23), N分期的准确率为73.9%(17/23), 一致性一般(kappa值为0.619, P<0.01, 表1, 表2).
| 病理分期 | 例数 | 超声内镜 | 准确率(%) | CT | 准确率(%) | ||||||
| T1 | T2 | T3 | T4 | T1 | T2 | T3 | T4 | ||||
| T1 | 4 | 2 | 2 | 50.0 | 2 | 2 | 50.0 | ||||
| T2 | 7 | 1 | 4 | 2 | 57.1 | 1 | 3 | 3 | 42.9 | ||
| T3 | 7 | 0 | 1 | 6 | 85.7 | 1 | 1 | 5 | 71.4 | ||
| T4 | 5 | 5 | 100.0 | 5 | 100.0 | ||||||
| 总计 | 23 | 4 | 6 | 8 | 5 | 73.9 | 4 | 6 | 8 | 5 | 65.2 |
| 病理分期 | 例数 | 超声内镜 | 准确率(%) | CT | 准确率(%) | ||
| N0 | N1 | N0 | N1 | ||||
| N0 | 15 | 14 | 1 | 93.3 | 12 | 2 | 85.7 |
| N1 | 8 | 1 | 7 | 87.5 | 4 | 5 | 55.6 |
| 总计 | 23 | 15 | 8 | 91.3 | 16 | 7 | 73.9 |
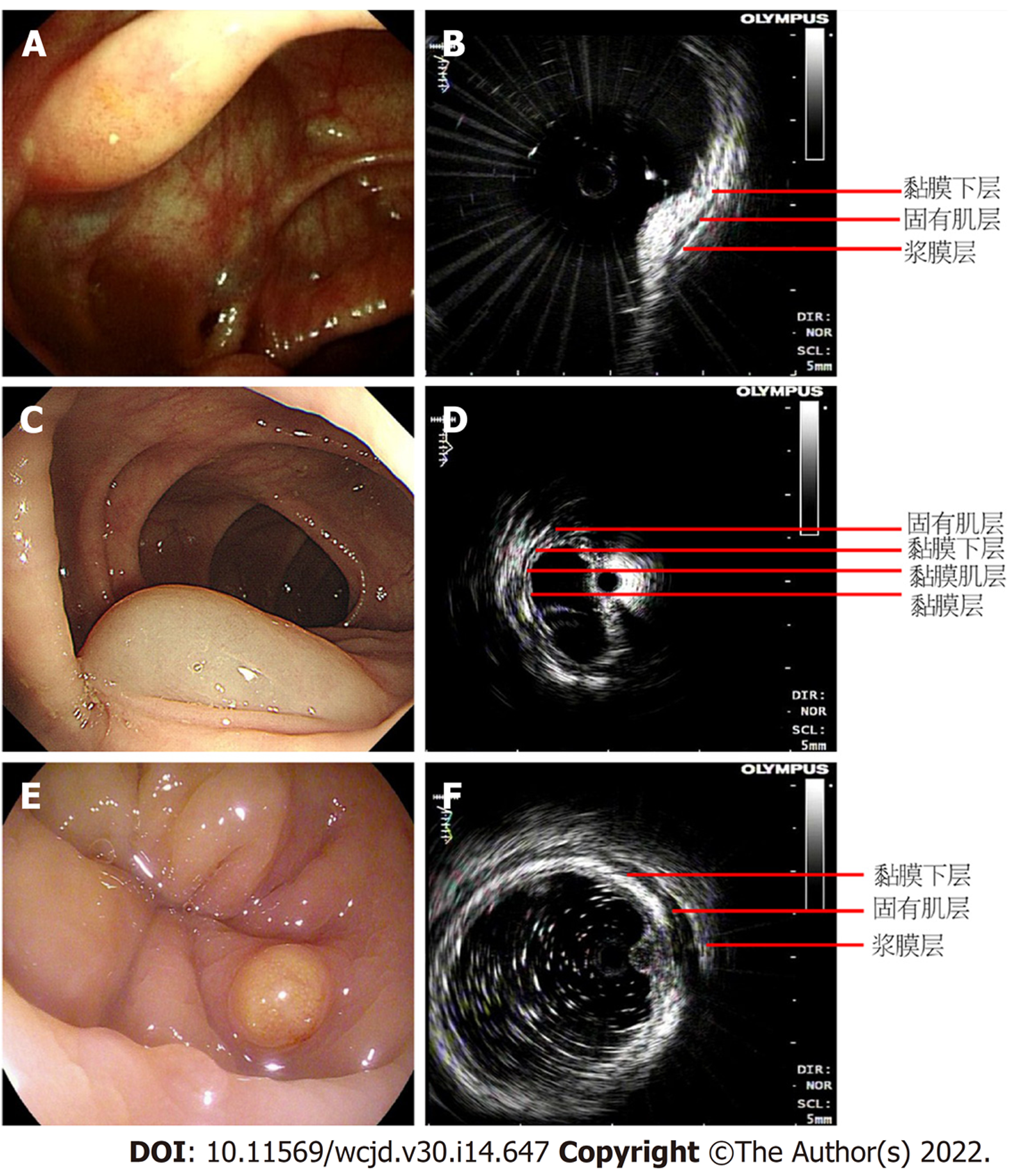
本研究中共有62例患者接受小探头超声内镜检查. 其中对术前活检病理或放大染色内镜评估怀疑腺瘤或局部伴高级别上皮内瘤变、大小≥2 cm的结直肠肿物(其中根据山田分型, Ⅰ型10例, Ⅱ型4例, Ⅲ型4例, Ⅳ型0例, 侧向发育型13例), 进行小探头超声内镜检查共31例. 经超声内镜评估肿瘤浸润黏膜肌层19例, 浸润黏膜下层5例, 浸润固有肌层7例; 行内镜黏膜下剥离术(endoscopic submucosal dissection, ESD)完整切除21例, 行外科手术切术7例, ESD术后追加外科手术3例; 与术后病理相比, 超声内镜判断肿瘤浸润深度的准确率为87.1%(27/31), 一致性一般(kappa值为0.665, P<0.01, 表3, 图1).
| 术后病理 | 例数 | 超声内镜 | 准确率(%) | |
| 黏膜下层内 | 固有肌层 | |||
| 黏膜下层内 | 22 | 21 | 1 | 95.5 |
| 固有肌层 | 9 | 3 | 6 | 66.7 |
| 总计 | 31 | 24 | 7 | 87.1 |
对31例经肠镜诊断的结直肠黏膜下隆起性病变进行小探头超声内镜检查, 包括以下类型: (1)脂肪瘤8例, 超声内镜表现为起源于黏膜下层的高回声; (2)神经内分泌肿瘤13例, 超声内镜表现为起源于黏膜肌层或黏或黏膜下层的低回声, 与黏膜层境界不清晰; (3)囊肿6例, 超声内镜表现为起源于黏膜肌层或黏膜下层的囊性无回声; (4)混合痔与脓肿各2例, 超声内镜表现为主要局限于黏膜层或黏膜下层以内的无回声或混有不均匀回声的高回声影像. 31例患者中, 除2例混合痔、2例脓肿病变、3例囊肿和2例脂肪瘤外, 其余22例病变进行了手术或内镜下切除. 其中9例病变(6例脂肪瘤、3例囊肿)行内镜下黏膜切除术(endoscopic mucosal resection, EMR), 13例神经内分泌瘤分别行ESD切除(7例)、腹腔镜手术切除(4例)、ESD后追加手术根治切除(2例). 与术后病理相比, 超声内镜判断结直肠黏膜下隆起性病变起源和类型的准确率为95.5%(21/22), 一致性高(kappa值为0.919, P<0.01, 表4, 图2).
| 术后病理 | 例数 | 超声内镜 | ||
| 脂肪瘤 | 神经内分泌肿瘤 | 囊肿 | ||
| 脂肪瘤 | 6 | 6 | 0 | 0 |
| 神经内分泌肿瘤 | 13 | 0 | 13 | 0 |
| 囊肿 | 2 | 0 | 0 | 2 |
| 黏液性肿瘤 | 1 | 0 | 0 | 1 |
| 总计 | 22 | 6 | 13 | 3 |
| 准确率(%) | 95.5 | |||
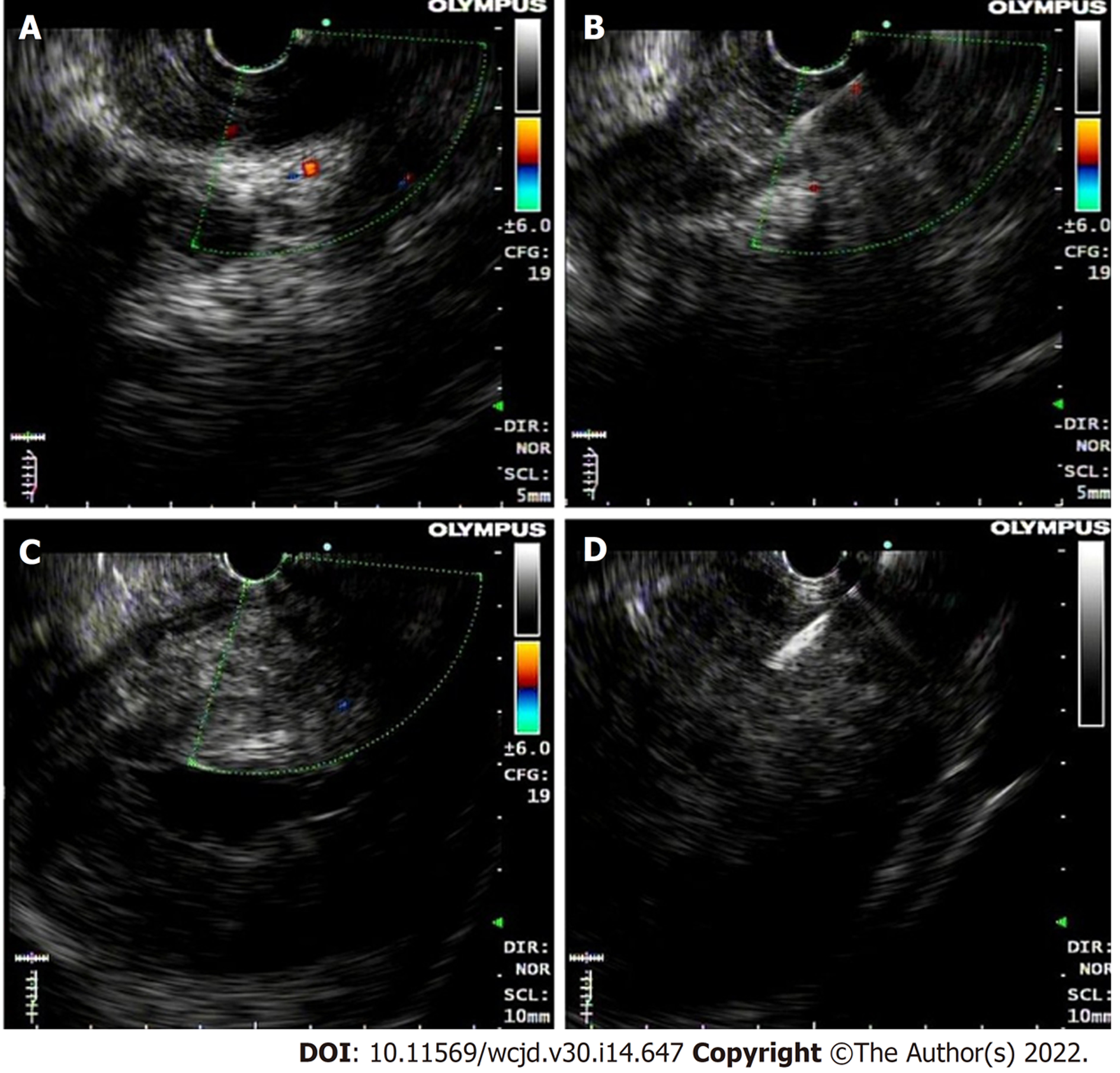
10例直肠及其周围病变由于肠腔狭窄或内镜下黏膜活检未获得阳性病理, 予行超声内镜引导下细针穿刺, 穿刺后病理提示直肠癌4例, 神经内分泌瘤1例, 间质瘤2例, 无阳性表现3例. 与术后病理相比, 超声内镜引导细针穿刺明确病理类型的准确率为70.0%(7/10), 一致性一般(kappa值为0.565, P<0.01, 图3).
目前临床采用的超声内镜分为两种: 一种是将超声探头直接固定于内镜前端, 称为大探头超声内镜; 另一种是将超声探头经内镜活检孔道导入, 称为小探头(或微探头)超声内镜. 根据扫描方式分为两类: 一类是与内镜轴相垂直的扇形扫描, 能作360°旋转环形扫描, 其扫描范围广, 能清楚显示消化管壁各层次结构; 另一类是与内镜轴相平行的线阵扫描, 能定向作90°-120°线性扫描, 主要用于超声内镜引导下细针穿刺/活检术(endoscopic ultrasonography-guided fine needle aspiration/ biopsy, EUS-FNA/FNB). 我院目前所采用的超声内镜是小探头超声内镜和大探头线阵超声内镜两种.
结直肠癌治疗前的准确分期, 特别是对肿瘤的浸润深度和区域淋巴结的转移情况进行准确判断将直接关系到治疗方法的正确选择, 目前的评估方法主要依靠超声内镜、计算机断层扫描(computed tomography, CT)和磁共振成像(nuclear magnetic resonance imaging, MRI)等影像检查. 尽管CT可显示直肠肿瘤厚度和外侵情况, 但反映肿瘤浸润深度的准确率较低, 仅为65%-75%[3]. 而超声内镜进行直肠癌T分期的准确率可达83%以上, 敏感度达92.5%; N分期方面准确率和敏感度分别为76.67%、79.31%[4]. 大探头超声内镜功率较高, 对肠壁及邻近组织的穿透性较强, 适合于较大病变或肠壁周围组织的扫查; 然而由于大探头线阵超声内镜为斜视镜、直径粗且质硬, 操作上的局限性使其不易进入近端结肠, 故大探头线阵超声内镜在肠道病变检查中主要应用于直肠及周围病变的扫查. 此外, 我们注意到越早期的病变, 超声内镜诊断T分期的准确率越低, 可能与我们在直肠癌分期中采用大探头超声内镜进行评估有关, 由于小探头超声内镜有利于发现适合内镜切除的T1期病变[5,6], 因此我们推测对于较早的T1、T2期病变应用小探头超声内镜进行评估将有可能进一步提高结直肠癌分期的准确率.
近年来, 随着内镜下微创治疗技术的迅速发展, 尤其是对于范围较小、浸润较浅的病灶, CT、MRI等影像学检查很难获得清晰信息, 而超声内镜从腔内扫查的优势则使其成为此类手术前评估最重要的检查方法. 尽管小探头超声由于功率较低, 对结直肠周围组织穿透性不够, 扫查较大肿物时远场回声减弱, 但其优点在于当肠镜检查发现病变时, 可立即经活检管道插入超声微探头, 从而获得实时声像图信息, 因此, 小探头超声内镜适用于较小结直肠肿物浸润深度的判断. 尤其当结直肠腺瘤或侧向发育型息肉可能存在局部癌变者, 而内镜下观察或活检不能做出全面评估时, 小探头超声内镜则能够明确病变范围与浸润深度, 从而确定手术方式的选择并提高操作的安全性. 文献报道超声内镜对术前早期胃癌侵犯深度的诊断准确率为70%-85%[7], 但尚无对术前早期结直肠癌评估统计的相关报道. 根据日本癌症协会[8]定义的ESD指征, 本组研究中应用小探头超声内镜对31例大小≥2 cm的结直肠腺瘤及早癌病变进行术前评估, 其中侵犯黏膜肌层19例、侵犯黏膜下层5例、侵犯固有肌层7例. 根据小探头超声内镜评估病变浸润深度的结果, 21例黏膜下层内病变进行了ESD完整切除, 另有3例ESD切除病变因病变组织残留追加外科手术, 其余7例直接行外科手术切除. 与术后病理对比, 小探头超声内镜对病变浸润深度判断的准确率达87.1%. 提示小探头超声内镜对结直肠早期癌浸润深度的判断及ESD术前评估具有重要价值. 此外, 小探头超声内镜对直径<3 cm的肠壁黏膜下隆起性病变可获得非常清晰的肠壁结构层次信息, 从而判断病变的起源. 本研究采用20 Mhz高频微型探头超声对较小的结直肠黏膜下隆起性病变进行探查, 诊断神经内分泌瘤13例、囊肿6例、脂肪瘤8例, 混合痔或脓肿各2例. 与术后病理对比, 小探头超声内镜判断结直肠黏膜下隆起性病变起源和类型的准确率高达95.5%.
超声内镜除扫查病变外, 还可以在其引导下进行细针穿刺, 获取细胞或组织以确定病变的病理性质, 因此EUS-FNA已成为上消化道及邻近器官病变诊治的重要手段[9-18]. 然而, 由于肠道解剖结构对超声内镜进镜的挑战及超声内镜移动装置在直肠乙状结肠周围扫查的技术挑战, 使得EUS-FNA在下消化道中使用受限, 因此有关的研究报道相对较少[19]. 本组研究中, 经直肠EUS-FNA病例共10例, 与术后病理对比, 超声内镜引导细针穿刺活检的准确率达70.0%, 表明超声内镜引导下的直肠或盆腔肿块穿刺活检可以为鉴别直肠局部的良恶性狭窄和明确盆腔肿块性质提供了一种可获取组织标本的、准确的补充诊断技术.
同时本研究也存在一定的不足之处: (1)本组研究应用大探头线阵超声内镜评估23例治疗前直肠癌分期, 结果提示, 与术后病理相比, 超声内镜对T分期和N分期诊断的准确率分别为73.9%、91.3%, T分期诊断的准确率低于之前的文献报道, 可能与我们评估的病例数较少及应用线阵超声探头进行检查有关, 但其准确率仍高于CT对直肠癌TN分期的准确率(65.2%、73.9%), 说明大探头超声内镜可以作为直肠癌治疗前分期的重要检查方法; (2)准确的超声内镜诊断还与内镜医师的操作技术、探头频率及超声内镜种类的选择应用等因素有关, 比如在用小探头超声内镜判断结直肠黏膜下隆起性病变起源和类型时, 与术后病理诊断不一致的1例在小探头超声内镜诊断中考虑为回盲部脂肪瘤, 其术后病理为阑尾低级别黏液性肿瘤. 可能由于阑尾低级别黏液性肿瘤较少见, 诊断医生经验不足, 加上病变继发感染后表现为高回声, 从而引起小探头超声内镜误诊.
综上所述, 本研究结合两种超声探头各自优缺点, 应用小探头超声内镜评估全结肠和直肠3 cm以下黏膜或黏膜下隆起性病变起源层次、浸润深度及回声特点, 其操作方便、准确性高, 为内镜下治疗提供了指导性意见, 同时为减少并发症、提高患者安全性起到了积极作用. 对于进展期直肠癌、直肠狭窄或盆腔肿块, 应用大探头超声内镜不仅可以精准反映组织浸润深度和周围淋巴结转移情况, 有助于直肠乙状结肠癌TN分期, 还可以通过超声内镜引导下细针穿刺活检获得组织标本进一步行病理组织学诊断, 为制定治疗方案提供一定的应用价值.
肠道解剖结构复杂, 超声内镜检查能够清楚显示结直肠病变的起源及浸润深度等情况, 探讨大小超声探头在结直肠病变中的应用能为临床诊断和治疗提供一定的参考价值.
探讨大小超声探头在结直肠病变中的应用, 对于内镜治疗具有重要意义.
研究超声内镜检查在结直肠及其周围病变中的应用价值.
回顾性分析我院95例结直肠及周围病变患者的小探头和大探头超声内镜检查结果, 并与术后病理结果进行比较, 进行统计分析.
与术后病理结果相比: 大探头超声内镜检查判断直肠癌浸润深度T分期的准确率为73.9%(17/23), 判断评估区域淋巴结转移N分期的准确率为91.3%(21/23); 小探头超声内镜在结直肠腺瘤或早癌ESD术前评估中判断肿瘤浸润深度的准确率为87.1%(27/31), 判断结直肠黏膜下隆起性病变起源和类型的准确率为95.5%(21/22); 超声内镜引导细针穿刺诊断直肠及其周围病变的准确率为70.0%(7/10).
可根据结直肠及其周围病变的部位、大小、起源等, 选择性应用不同探头超声内镜检查,从而提高诊断的准确性, 制定合适的治疗策略.
随着超声内镜在结直肠病变中的临床研究不断积累, 相信对于结直肠病变的内镜诊断和内镜下治疗技术会得到极大的提高.
学科分类: 胃肠病学和肝病学
手稿来源地: 广西壮族自治区
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): D, D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 3. | Marone P, de Bellis M, D'Angelo V, Delrio P, Passananti V, Di Girolamo E, Rossi GB, Rega D, Tracey MC, Tempesta AM. Role of endoscopic ultrasonography in the loco-regional staging of patients with rectal cancer. World J Gastrointest Endosc. 2015;7:688-701. [PubMed] [DOI] |
| 4. | Patel S, Soni R, Gupta KC, Sharma J, Meena K. Role of Transrectal Ultrasound in Preoperative Local Staging of Carcinoma Rectum and It's Histopathological Correlation. Indian J Surg. 2014;76:21-25. [PubMed] [DOI] |
| 5. | Gall TM, Markar SR, Jackson D, Haji A, Faiz O. Mini-probe ultrasonography for the staging of colon cancer: a systematic review and meta-analysis. Colorectal Dis. 2014;16:O1-O8. [PubMed] [DOI] |
| 6. | Puli SR, Bechtold ML, Reddy JB, Choudhary A, Antillon MR. Can endoscopic ultrasound predict early rectal cancers that can be resected endoscopically? A meta-analysis and systematic review. Dig Dis Sci. 2010;55:1221-1229. [PubMed] [DOI] |
| 7. | Takamaru H, Yoshinaga S, Takisawa H, Oda I, Katai H, Sekine S, Taniguchi K, Saito Y. Endoscopic Ultrasonography Miniature Probe Performance for Depth Diagnosis of Early Gastric Cancer with Suspected Submucosal Invasion. Gut Liver. 2020;14:581-588. [PubMed] [DOI] |
| 8. | Tanaka S, Kashida H, Saito Y, Yahagi N, Yamano H, Saito S, Hisabe T, Yao T, Watanabe M, Yoshida M, Saitoh Y, Tsuruta O, Sugihara KI, Igarashi M, Toyonaga T, Ajioka Y, Kusunoki M, Koike K, Fujimoto K, Tajiri H. Japan Gastroenterological Endoscopy Society guidelines for colorectal endoscopic submucosal dissection/endoscopic mucosal resection. Dig Endosc. 2020;32:219-239. [PubMed] [DOI] |
| 9. | Cazacu IM, Luzuriaga Chavez AA, Saftoiu A, Vilmann P, Bhutani MS. A quarter century of EUS-FNA: Progress, milestones, and future directions. Endosc Ultrasound. 2018;7:141-160. [PubMed] [DOI] |
| 10. | Yoshinaga S, Itoi T, Yamao K, Yasuda I, Irisawa A, Imaoka H, Tsuchiya T, Doi S, Yamabe A, Murakami Y, Ishikawa H, Saito Y. Safety and efficacy of endoscopic ultrasound-guided fine needle aspiration for pancreatic masses: A prospective multicenter study. Dig Endosc. 2020;32:114-126. [PubMed] [DOI] |
| 11. | Yoon SB, Moon SH, Song TJ, Kim JH, Kim MH. Endoscopic ultrasound-guided fine needle aspiration versus biopsy for diagnosis of autoimmune pancreatitis: Systematic review and comparative meta-analysis. Dig Endosc. 2021;33:1024-1033. [PubMed] [DOI] |
| 12. | Chen L, Li Y, Gao X, Lin S, He L, Luo G, Li J, Huang C, Wang G, Yang Q, Shan H. High Diagnostic Accuracy and Safety of Endoscopic Ultrasound-Guided Fine-Needle Aspiration in Malignant Lymph Nodes: A Systematic Review and Meta-Analysis. Dig Dis Sci. 2021;66:2763-2775. [PubMed] [DOI] |
| 13. | Vazquez-Sequeiros E, Levy MJ, Van Domselaar M, González-Panizo F, Foruny-Olcina JR, Boixeda-Miquel D, Juzgado-Lucas D, Albillos A. Diagnostic yield and safety of endoscopic ultrasound guided fine needle aspiration of central mediastinal lung masses. Diagn Ther Endosc. 2013;2013:150492. [PubMed] [DOI] |
| 14. | Oki M, Saka H, Ando M, Kitagawa C, Kogure Y, Seki Y. Endoscopic ultrasound-guided fine needle aspiration and endobronchial ultrasound-guided transbronchial needle aspiration: Are two better than one in mediastinal staging of non-small cell lung cancer? J Thorac Cardiovasc Surg. 2014;148:1169-1177. [PubMed] [DOI] |
| 15. | Mehmood S, Jahan A, Loya A, Yusuf MA. Onsite cytopathology evaluation and ancillary studies beneficial in EUS-FNA of pancreatic, mediastinal, intra-abdominal, and submucosal lesions. Diagn Cytopathol. 2015;43:278-286. [PubMed] [DOI] |
| 16. | Nieuwoudt M, Lameris R, Corcoran C, Rossouw TM, Slavik T, Du Plessis J, Omoshoro-Jones JA, Stivaktas P, Potgieter F, Van der Merwe SW. Polymerase chain reaction amplifying mycobacterial DNA from aspirates obtained by endoscopic ultrasound allows accurate diagnosis of mycobacterial disease in HIV-positive patients with abdominal lymphadenopathy. Ultrasound Med Biol. 2014;40:2031-2038. [PubMed] [DOI] |
| 17. | Lopes CV, Zereu M, Furian RD, Furian BC, Remonti TA. Retroperitoneal schwannoma diagnosed by endoscopic ultrasound-guided fine-needle aspiration. Endoscopy. 2014;46 Suppl 1 UCTN:E287-E288. [PubMed] [DOI] |
| 18. | Sengupta S, Pal S, Biswas BK, Chakrabarti S, Bose K, Jana S. Fine-needle aspiration cytology of retroperitoneal lesions: a 5-year experience with an emphasis on cytohistological discrepancy. Acta Cytol. 2014;58:138-144. [PubMed] [DOI] |
| 19. | Pinto-Pais T, Sousa-Fermandes S, Pontes JM, Proença L, Fernandes C, Ribeiro I, Costa AP, Rodrigues H, Carvalho J, Fraga J. Atypical pelvic recurrence of anal squamous cell carcinoma: successful endoscopic ultrasound-guided fine-needle aspiration through the sigmoid colon. Int J Colorectal Dis. 2015;30:139-140. [PubMed] [DOI] |