修回日期: 2022-05-31
接受日期: 2022-06-21
在线出版日期: 2022-07-28
松果菊苷(echinacoside, ECH)具有抗炎和抗氧化的药理作用, 且能改善多种器官损伤,而其对重症急性胰腺炎(severe acute pancreatitis, SAP)的作用及潜在机制尚不清楚.
探究ECH对SAP模型大鼠的胰腺的保护作用及其潜在机制.
将大鼠随机分为假手术组(Sham)、ECH对照组(Sham+ECH)、SAP模型组(SAP)和ECH治疗组(SAP+ECH), 每组10只. 测定各组大鼠的腹水量以及血清淀粉酶和脂肪酶活性; HE染色分析各组大鼠胰腺组织学表现; TUNEL染色观察胰腺腺泡细胞死亡情况; 组织生化法检测胰腺组织中肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、白细胞介素-6(interleukin-6, IL-6)和丙二醛(malondialdehyde, MDA)水平以及谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)、超氧化物歧化酶(superoxide dismutase, SOD)和髓过氧化物酶(myeloperoxidase, MPO)活性; Western blot分析胰腺组织中B细胞淋巴瘤-2(B cell lymphoma-2, Bcl-2)、Bcl-2相关X蛋白(Bcl2-associated X protein, Bax)、裂解的天冬氨酸特异性半胱氨酸蛋白酶蛋白酶-3(Cleaved cysteinyl aspartate-specific proteinase-3, Cleaved caspase-3)、核因子E2相关因子2(nuclear factor erythroid-2 related factor 2, Nrf-2)、Toll样受体4(toll-like receptor 4, TLR-4)和核因子κB(nuclear factor κB, NF-κB)p65蛋白的表达情况.
相对于SAP组, SAP+ECH组大鼠腹水量、血清淀粉酶和脂肪酶活性均降低(P<0.05), 胰腺组织水肿、炎性细胞浸润、坏死和总组织学的积分均降低(P<0.05), TUNEL染色阳性细胞减少, 胰腺组织匀浆液中TNF-α、IL-6和MDA水平和MPO活性降低(P<0.05)以及SOD、GSH-Px活性增加(P<0.05), 胰腺组织中Bax、Cleaved caspase-3、TLR-4和NF-κB p65表达降低(P<0.05)而Bcl-2和Nrf-2表达增高(P<0.05).
ECH可在SAP模型大鼠胰腺组织中发挥抗炎、抗氧化和抗损伤的作用, 这些作用可能与其降低病变组织中TLR-4、NF-κB p65和Bax表达并升高Nrf-2和Bcl-2表达有关.
核心提要: 松果菊苷能减轻重症急性胰腺炎模型大鼠的胰腺损伤和炎症反应, 且此作用与其降低胰腺组织中氧化应激与炎症反应以及抑制腺泡细胞死亡有关.
引文著录: 宁易平, 牟莉, 李柯. 松果菊苷通过抗炎和抗氧化作用改善急性胰腺炎模型大鼠的胰腺损伤. 世界华人消化杂志 2022; 30(14): 631-638
Revised: May 31, 2022
Accepted: June 21, 2022
Published online: July 28, 2022
Echinacoside (ECH) has anti-inflammatory and antioxidant effects, and can improve multiple organ injuries. However, the effect and potential mechanism of action of ECH on severe acute pancreatitis (SAP) are still unclear.
To investigate the protective effect of ECH on the pancreas of SAP model rats and the potential mechanism involved.
Rats were randomly divided into sham group (Sham), ECH control group (Sham + ECH), SAP model group (SAP), and ECH treatment group (SAP + ECH), with 10 rats each. Ascites volume and the activities of amylase and lipase in serum were determined. HE staining was used to analyze the histological changes in each group, and TUNEL assay was used to observe the apoptosis of pancreatic acinar cells. The levels of tumor necrosis factor-α (TNF-α), interleukin-6 (IL-6), and malondialdehyde (MDA) and the activities of glutathione peroxidase (GSH-PX), superoxide dismutase (SOD), and myeloperoxidase (MPO) in pancreatic tissues were measured by tissue biochemistry. The expression levels of B cell lymphoma-2 (Bcl-2), Bcl2-associated X protein (Bax), cleaved caspase-3, nuclear factor E2-related factor 2 (NRF-2), Toll-like receptor 4 (TLR-4), and nuclear factor κB (NF-κB) p65 proteins in pancreatic tissue were detected by Western blot.
Compared with the SAP group, ascites volume and serum amylase and lipase activities in the SAP + ECH group were decreased (P < 0.05); pancreatic tissue edema, inflammatory cell infiltration, and necrosis scores and total histological score were decreased (P < 0.05); the number of TUNEL positive cells was reduced; the levels of TNF-α, IL-6, MDA, and MPO activity in pancreatic tissue homogenate were decreased (P < 0.05), and the activities of SOD and GSH-Px were increased (P < 0.05); the expression levels of Bax, cleaved caspase-3, TLR-4, and NF-κB p65 were decreased (P < 0.05), and the expression levels of Bcl-2 and NRF-2 were increased (P < 0.05).
ECH has anti-inflammatory, anti-oxidant, and anti-injury effects in pancreatic tissues of SAP model rats, which may be related to the downregulation of TLR-4, NF-κB p65, and Bax expression and the upregulation of NRF-2 and Bcl-2 expression.
-
Citation: Ning YP, Mou L, Li K. Echinacoside alleviates pancreatic injury
via exerting anti-inflammatory and anti-oxidant activities in a rat model of acute pancreatitis. Shijie Huaren Xiaohua Zazhi 2022; 30(14): 631-638 - URL: https://www.wjgnet.com/1009-3079/full/v30/i14/631.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v30.i14.631
急性胰腺炎(acute pancreatitis, AP)是一种常见的急腹症, 分为轻症AP(约占80%以上)和重症急性胰腺炎(severe acute pancreatitis, SAP)(约占20%). 其中, SAP发作时引起的炎性风暴可造成胰腺坏死和多器官衰竭[1]. 目前, 尽管对SAP的治疗取得了很大改善, 但据报道与此疾病相关的死亡率仍高达20%[2]. SAP的发病机制一直是许多研究的重点. 目前, 氧化应激、促炎细胞因子的过度释放、钙过载和自噬失调被认为是导致SAP病理的主要机制[3-6]. 特别是, 炎性反应和氧化应激在SAP的进展中起着关键作用[7,8], 因此, 用抗炎和抗氧化剂治疗可能提供一种很好的替代疗法.
松果菊苷(echinacoside, ECH)是一种从传统中草药肉苁蓉中分离出的苯乙醇苷类化合物. 最近的研究表明[9-12], ECH具有很强的抗炎和抗氧化活性, 其在动物模型中能改善如肠、肝和肾等多种器官损伤. 而ECH对SAP的作用及潜在机制尚不清晰. 因此, 本研究通过胆胰管逆行注射5%牛磺胆酸钠溶液构建大鼠SAP模型, 采用生化、病理和Western blot分析法探究ECH对SAP大鼠模型所致的胰腺损伤的作用及潜在机制.
ECH(纯度98%)和牛磺胆酸钠(纯度98%)试剂购自上海源叶生物科技有限公司; 肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、白细胞介素-6(interleukin-6, IL-6)、脂肪酶和髓过氧化物酶(myeloperoxidase, MPO)大鼠ELISA试剂盒购自江苏酶免实业有限公司; 谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)、超氧化物歧化酶(superoxide dismutase, SOD)、淀粉酶大鼠ELISA试剂盒购自江苏晶美生物科技有限公司; 丙二醛试剂盒(malondialdehyde, MDA)、β-actin抗体、天冬氨酸特异性半胱氨酸蛋白酶蛋白酶-3(cysteinyl aspartate-specific proteinase-3, Caspase-3)抗体和原位末端转移酶标记技术(terminal deoxynucleotidyl transferase-mediated dUTP-biotin nick end labeling assay, TUNEL)染色试剂盒(FITC标记)均购自上海碧云天生物科技有限公司; B细胞淋巴瘤-2(B cell lymphoma-2, Bcl-2)抗体、Bcl-2相关X蛋白(Bcl2-associated X protein, Bax)抗体、核因子E2相关因子2(nuclear factor erythroid-2 related factor 2, Nrf-2)抗体、Toll样受体4(Toll-like receptor 4, TLR-4)抗体、核因子κB(nuclear factor κB, NF-κB)p65抗体和羊抗兔IgG-HRP二抗均购自南京巴傲得生物科技有限公司.
1.2.1 SAP模型建立和实验方案: 成年雄性Sprague-Dawley大鼠(清洁级, 230 -250) g购于浙江维通利华实验动物技术有限公司(许可证号: SCXK(浙)2019-0001), 饲养在12 h光照-黑暗周期循环、稳定湿度(50%-65%)和恒温(23±2) ℃的屏障环境中, 大鼠可自由进食和饮水. 实验前, 让大鼠适应环境一周. 大鼠在造模前12 h禁食不禁水, 按照文献[13,14]方法诱导SAP大鼠模型: 用3%戊巴比妥钠(60 mg/kg)腹腔注射麻醉大鼠, 开腹, 将5%牛磺胆酸钠溶液(1 mL/kg)以3 mL/h的恒定速率逆行输注到胆胰管中, 输注完成后, 将进入十二指肠的部分导管夹闭5 min以保证牛磺胆酸钠进入胰腺小叶, 接着取下血管夹并缝合伤口; 手术过程在2%异氟醚维持麻醉下进行.
将大鼠随机分为四组(每组n = 10): A组: 假手术组(Sham); B组: ECH对照组(Sham+ECH); C组: SAP模型组(SAP); D组: ECH治疗组(SAP+ECH). Sham组除不进行输注牛磺胆酸钠外, 进行了同模型组所有的手术程序. Sham+ECH和SAP+ECH组大鼠在术后0.5 h用ECH(20 mg/kg)灌胃, 间隔12 h灌胃一次; ECH的剂量和给药方案是根据文献11, 12及本实验室预实验决定. Sham和SAP组大鼠给予灌胃等体积生理盐水.
1.2.2 标本准备: 治疗后24 h后, 大鼠给予过量戊巴比妥钠麻醉处死, 开腹, 收集腹水并用量筒测体积, 右心室取血, 并用左心室注射生理盐水将血液排空, 收集胰腺. 取部分胰腺组织在4%多聚甲醛中固定24 h, 在含有30%蔗糖的PBS中于4 ℃脱水24 h, 然后石蜡包埋, 切5 μm厚组织附于载玻片上, 用于组织学分析. 同部位胰腺组织迅速放入液氮中, 然后转移至-80 ℃冰箱, 用于后续生化和Western blot实验.
1.2.3 胰腺组织学分析: 取石蜡包埋的胰腺组织, 切成5 μm厚组织附于载玻片上, 脱蜡至水化后进行苏木精和曙红(hematoxylin-eosin, HE)染色. 在光学显微镜下观察HE染色情况, 在400×视野下对每个切片的6个视野下根据Van Laethem等[15]方法进行胰腺组织病理学评分. 评分包括: 水肿: 从0到3级(0: 不存在; 1: 小叶之间局灶性增加; 2: 小叶之间弥漫性增加; 3: 腺泡破裂和分开); 炎性细胞浸润: 从0到3分级[0: 不存在; 1: 在导管中(导管边缘周围); 2: 在实质, <50%的小叶; 3: 在实质中, >50%的小叶]; 腺泡坏死: 从0到3分级(0: 不存在; 1: 导管周围坏死, <5%; 2: 局灶性坏死, 5%-20%; 3: 弥漫性实质坏死, 20-50%).
1.2.4 TUNEL法: 取石蜡包埋的胰腺组织, 切成5 μm厚组织附于载玻片上, 脱蜡至水化后, 按照试剂盒说明步骤进行, 室温孵育20 μg/mL蛋白酶K溶液10 min, 洗涤后, 室温孵育FITC标记的TUNEL检测液45 min, 含DAPI封片剂封片, 荧光显微镜下观察TUNEL阳性细胞情况.
1.2.5 血生化检测: 按试剂盒说明, 分离各组大鼠血清, 并用ELISA法检查血清淀粉酶和脂肪酶活性.
1.2.6 组织生化检测: 大鼠胰腺组织用生理盐水按1:9比例匀浆后, 3000×g离心10 min收集上清匀浆液. BCA法测定胰腺组织的匀浆液中蛋白浓度. 分别根据相应的试剂盒, 用ELISA法测定TNF-α和IL-6含量以及MPO、GSH-Px和SOD活性, 用TBA法测定MDA含量. 然后根据匀浆液中蛋白浓度, 对上述指标进行标准量化.
1.2.7 Western blot分析: 用RIPA裂解缓冲液提取胰腺组织中蛋白质, 并用BCA法测定量蛋白浓度. 按常规Western blot转印方法, 通过10%SDS-PAGE凝胶分离等量(20 μg/样本)蛋白, 然后转移到聚偏二氟乙烯膜上. 封闭后, 将膜分别与一抗(Bax、Bcl-2、Caspase-3、Nrf-2、TLR-4、NF-κB p65, 均1:1000; β-actin, 1:5000)在4 ℃过夜: 洗涤后, 加入羊抗兔IgG第二抗体孵育1 h后, 通过电化学发光检测试剂使用ChemiDoc XRS成像系统扫描和分析条带. β-actin用作内部对照.
统计学处理 所有统计分析均使用SPSS 19.0软件进行. 定量数据表示为平均值±标准差(mean±SD). 多组之间使用单因素方差分析, 均数两两比较用SNK-q事后检验. 对于所有统计分析, 以P<0.05为界限判断有无统计学意义.
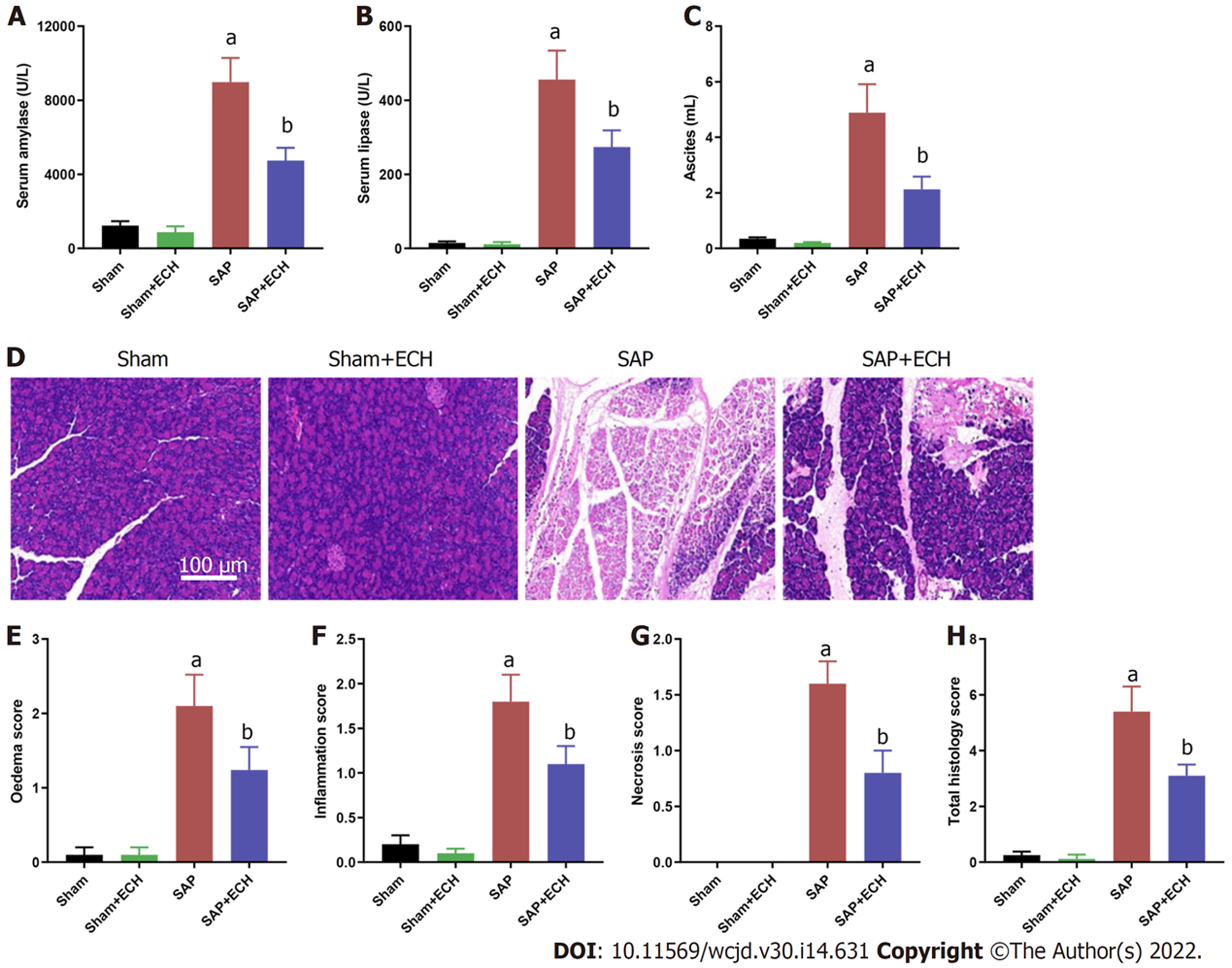
如图1A-C所示, 相对于Sham组, Sham+ECH组血清淀粉酶和脂肪酶活性以及腹水量均无明显变化, 而SAP组血清淀粉酶和脂肪酶活性以及腹水量均明显升高(均P<0.05); 相对于SAP组, SAP+ECH组血清淀粉酶和脂肪酶活性以及腹水量均明显降低(均P<0.05). HE染色组织学(图1D)显示, Sham组和Sham+ECH组胰腺组织正常, SAP组胰腺组织水肿、有炎性细胞浸润和部分胰腺坏死情况, SAP+ECH组相对于SAP组的胰腺病理学有明显改善; 与之一致, 评分结果(图1E-H)显示, 相对于Sham组, Sham+ECH组胰腺的水肿、炎症、坏死以及总组织学评分均无明显变化, 而SAP组胰腺的水肿、炎症、坏死以及总组织学评分均明显升高(均P<0.05); 相对于SAP组, SAP+ECH组大鼠上述指标评分均明显降低(均P<0.05).
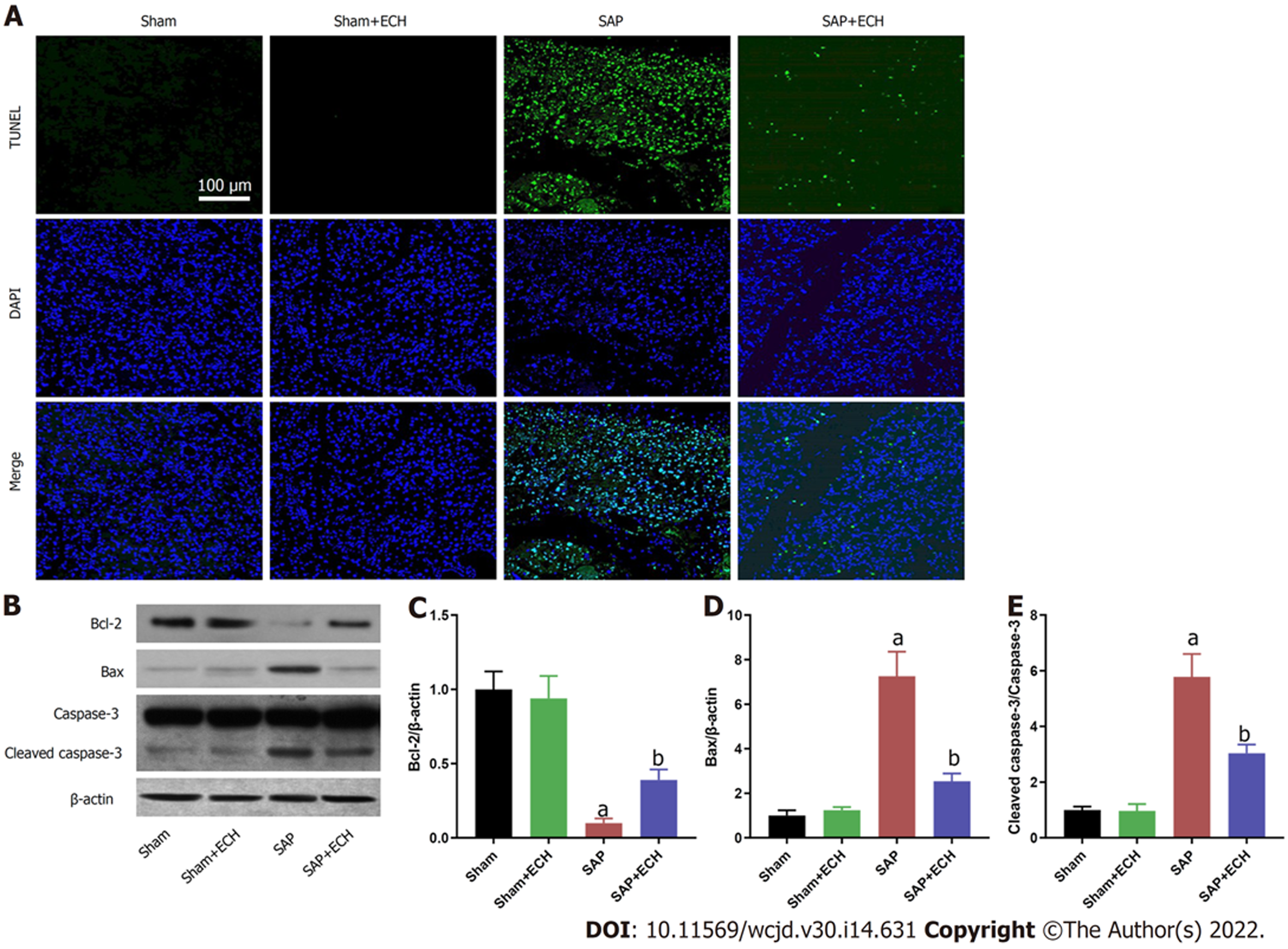
TUNEL染色(图2A)显示, Sham组和Sham+ECH组胰腺组织几乎未见TUNEL阳性细胞; SAP组胰腺组织可见大面积TUNEL阳性细胞; SAP+ECH组相对于SAP组的胰腺组织中TUNEL阳性细胞范围和数量均减少. Western blot结果(图2B-E)显示, 相对于Sham组, Sham+ECH组胰腺组织中Bcl-2、Bax和裂解的caspase-3(Cleaved caspase-3)的表达水平均无明显变化, 而SAP组胰腺组织中Bax和Cleaved caspase-3的表达水平均明显升高(均P<0.05)和Bcl-2表达水平明显降低(P<0.05); 相对于SAP组, SAP+ECH组胰腺组织中Bax和Cleaved caspase-3的表达水平均降低(均P<0.05)和Bcl-2表达水平明显升高.
炎症指标生化检测结果显示, 相对于Sham组, Sham+ECH组胰腺组织的炎症指标(促炎性因子TNF-α和IL-6水平、MPO活性)均无明显变化, 而SAP组上述炎症指标均明显升高(均P<0.05); 相对于SAP组, SAP+ECH组炎症指标均明显降低(均P<0.05). 氧化应激指标生化检测结果显示, 相对于Sham组, Sham+ECH组胰腺组织中MDA水平和抗氧化酶SOD和GSH-Px活性均无明显变化(均P>0.05), 而SAP组胰腺组织中MDA水平明显升高(P<0.05)和SOD和GSH-Px活性明显降低(P<0.05); 相对于SAP组, SAP+ECH组MDA水平明显降低和SOD和GSH-Px活性明显升高(P<0.05)(表1).
| 组别 | TNF-α (pg/mg) | IL-6 (pg/mg) | MPO (U/g) | MDA (nmol/mg) | SOD (U/mg) | GSH-Px (U/mg) |
| Sham组 | 83.15±12.78 | 35.02±5.23 | 0.05±0.02 | 0.25±0.07 | 23.42±2.32 | 162.74±15.86 |
| Sham+ECH组 | 94.36±21.07 | 42.18±9.31 | 0.03±0.01 | 0.31±0.09 | 21.53±1.84 | 173.47±21.02 |
| SAP组 | 512.75±69.83a | 213.56±34.71c | 0.75±0.10e | 2.34±0.31g | 4.42±0.53i | 35.03±7.07k |
| SAP+ECH组 | 278.06±35.24b | 124.33±18.56d | 0.34±0.05f | 0.83±0.11h | 14.71±2.29j | 104.15±18.25l |
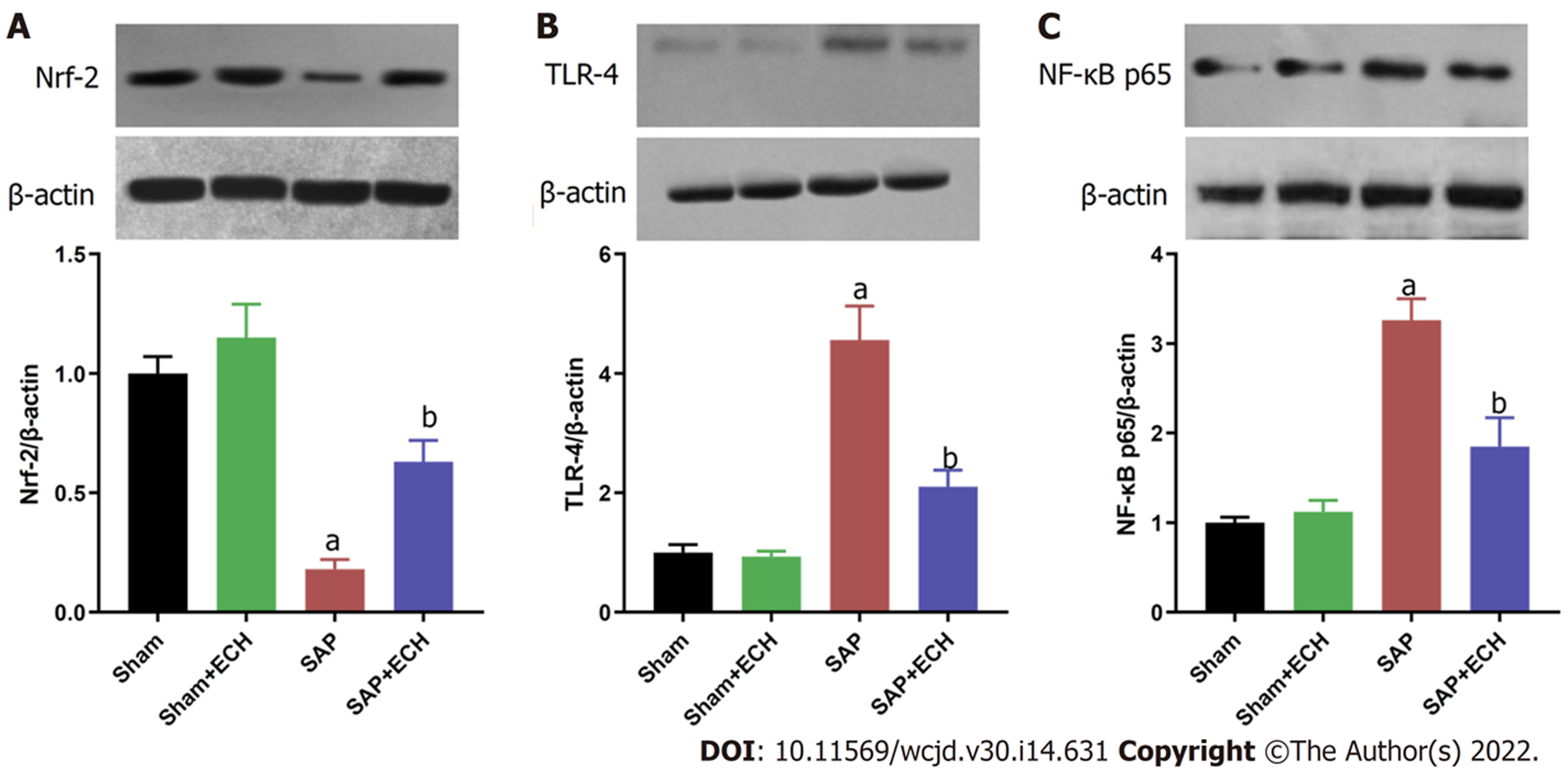
Western blot结果(图3)显示, 相对于Sham组, Sham+ECH组胰腺组织中Nrf-2、TLR-4和NF-κB p65蛋白表达水平无明显变化, 而SAP组Nrf-2表达水平明显降低(P<0.05)和TLR-4和NF-κB p65表达水平明显升高(均P<0.05); 相对于SAP组, SAP+ECH组Nrf-2表达水平明显升高(P<0.05)和TLR-4和NF-κB p65表达水平明显降低(P<0.05).
目前, SAP的总体治疗效果差强人意[2], 因此研究潜在的SAP的治疗措施具有现实意义. 本研究在SAP模型大鼠中发现ECH能降低AP标记物胰蛋白酶和脂肪酶活性, 减轻胰腺组织水肿、炎性细胞浸润和坏死病理改变, 说明ECH可能是SAP的潜在治疗剂.
SAP的病理机制复杂, 但其病理特征主要为胰腺腺泡细胞死亡以及局灶或全身炎症反应[16]. 已有研究证实[17], 胰腺腺泡细胞死亡能增加胰酶活化进而加重胰腺损伤, 减少胰腺腺泡细胞死亡能减轻AP的严重程度. 而胰腺腺泡细胞死亡程序可受到Bcl-2、Bax以及Cleaved caspase-3表达控制. Bcl-2水平升高和Bax水平降低说明细胞对死亡的抵抗性增强, 反之则相反[18]. Cleaved caspase-3是细胞死亡的执行蛋白, Cleaved caspase-3表达增加说明能增加细胞死亡. 本研究证实了, ECH能减少SAP模型大鼠胰腺腺泡细胞的TUNEL阳性细胞数、增加Bcl-2表达并降低Bax和Cleaved caspase-3表达, 说明ECH能降低SAP模型大鼠胰腺腺泡细胞的死亡. 另外, 胰腺腺泡细胞坏死还能引起炎症, 而如TNF-α和白细胞介素-1β(interleukin-1β, IL-1β)等促炎因子也可通过细胞凋亡或坏死发生可导致腺泡细胞死亡, 并且级联式放大促炎介质也加重胰腺组织损伤并可触发全身炎症反应综合征[19]. 氧化应激在AP中发挥关键作用. 在AP进展中, 氧自由基的产生和积累以及抗氧化防御系统的下降, 引起不饱和脂肪酸脂质过氧化, 加重胰腺损伤[20]. Li等[20]研究表明ECH在缺血再灌注大鼠视网膜中可阻止脂质过氧化(降低MDA水平)并诱导抗氧化酶(SOD、CAT和GSH-Px)的活化, 同时抑制炎症因子TNF-α、IL-1β和IL-6产生. 同时, ECH已被证明在实验性结肠炎、肝缺血再灌注以及脓毒症等模型大鼠中可发挥抗炎和抗氧化作用[9-12]. 本研究检测了胰腺组织匀浆中炎症相关指标TNF-α、IL-6和MPO(反映白细胞浸润的炎症生物标志物)以及氧化应激相关指标MDA、GSH-Px和SOD, 结果显示, ECH能降低SAP模型大鼠胰腺组织中促炎介质TNF-α和IL-6水平以及MPO活性, 降低脂质过氧化损伤(抑制MDA水平)并提高抗氧化酶SOD和GSH-Px活性, 说明ECH在SAP中也发挥抗炎和抗氧化作用.
本研究进一步对ECH在SAP模型大鼠中的抗炎和抗氧化作用的机制进行了探索. TLR-4/NF-κB通路是机体参与免疫和炎症调节的主要通路. 有研究[21]显示, SAP模型胰腺组织中TLR-4和NF-κB p65表达增加, 反之抑制TLR-4/NF-κB活性可减轻SAP模型的胰腺损伤和胰腺炎. 在动物和细胞模型中研究显示, ECH可能通过抑制TLR-4/NF-κB活性来减轻急性结肠炎和肺泡炎[9,11]. 本研究结果同样显示, ECH在SAP模型的胰腺组织中可抑制TLR-4/NF-κB信号关键蛋白TLR-4和NF-κB p65表达, 提示ECH至少能通过减弱TLR-4/NF-κB活性降低SAP大鼠胰腺组织中炎性反应. Nrf-2信号是机体参与抗氧化的主要信号通路. 当SAP发生后, 通过药物干预增强Nrf-2信号活性能进而增加抗氧化酶SOD和GSH-Px合成, 并可抑制氧化酶合成, 加快自由基清除, 从而恢复氧化/抗氧化平衡, 降低胰腺氧化损伤[22,23]. 本研究结果显示, ECH能上调SAP大鼠胰腺组织中Nrf-2表达, 体现ECH可能激活Nrf-2活性进而激活下游抗氧化酶GSH-Px和SOD生成, 发挥抗氧化作用.
总之, 本研究提示ECH能通过抗氧化、抗炎以及抑制腺泡细胞死亡来改善SAP导致的胰腺损伤. 另外, ECH可能是潜在的抗AP药物.
从抗炎和抗氧化活性的化合物中可能筛选到具有治疗重症急性胰腺炎(severe acute pancreatitis, SAP)的潜在药剂.
松果菊苷(echinacoside, ECH)具有较强的抗炎和抗氧化的活性, 且已在动物模型中被发现具有改善多种器官损伤的作用, 提示其可能在SAP中也能发挥有益作用.
检测ECH在SAP中的作用并进一步分析其机制.
构建SAP模型大鼠, 并给予ECH治疗. 收集血清和胰腺组织, 通过生化、组织学以及Western blot检测评估ECH是否在SAP中能发挥有益作用.
ECH治疗能减轻SAP大鼠胰腺炎的严重程度, 改善胰腺组织形态表现, 抑制炎症反应以及氧化应激并减少腺泡细胞死亡; 此外, ECH能减弱SAP大鼠胰腺组织中TLR-4/NF-κB活性和增强Nrf-2信号活性.
ECH在SAP中具有有益作用, 且此作用可能与其抗炎、抗氧化以及抑制腺泡细胞死亡有关.
ECH可能是潜在的抗SAP的药物.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): D, D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Hines OJ, Pandol SJ. Management of severe acute pancreatitis. BMJ. 2019;367:l6227. [PubMed] [DOI] |
| 2. | Trikudanathan G, Wolbrink DRJ, van Santvoort HC, Mallery S, Freeman M, Besselink MG. Current Concepts in Severe Acute and Necrotizing Pancreatitis: An Evidence-Based Approach. Gastroenterology. 2019;156:1994-2007.e3. [PubMed] [DOI] |
| 3. | Ge P, Luo Y, Okoye CS, Chen H, Liu J, Zhang G, Xu C, Chen H. Intestinal barrier damage, systemic inflammatory response syndrome, and acute lung injury: A troublesome trio for acute pancreatitis. Biomed Pharmacother. 2020;132:110770. [PubMed] [DOI] |
| 4. | Hu F, Lou N, Jiao J, Guo F, Xiang H, Shang D. Macrophages in pancreatitis: Mechanisms and therapeutic potential. Biomed Pharmacother. 2020;131:110693. [PubMed] [DOI] |
| 5. | Gryshchenko O, Gerasimenko JV, Gerasimenko OV, Petersen OH. Ca(2+) signals mediated by bradykinin type 2 receptors in normal pancreatic stellate cells can be inhibited by specific Ca(2+) channel blockade. J Physiol. 2016;594:281-293. [PubMed] [DOI] |
| 6. | Gukovskaya AS, Gukovsky I, Algül H, Habtezion A. Autophagy, Inflammation, and Immune Dysfunction in the Pathogenesis of Pancreatitis. Gastroenterology. 2017;153:1212-1226. [PubMed] [DOI] |
| 7. | Jung KH, Hong SW, Zheng HM, Lee HS, Lee H, Lee DH, Lee SY, Hong SS. Melatonin ameliorates cerulein-induced pancreatitis by the modulation of nuclear erythroid 2-related factor 2 and nuclear factor-kappaB in rats. J Pineal Res. 2010;48:239-250. [PubMed] [DOI] |
| 8. | Tsai K, Wang SS, Chen TS, Kong CW, Chang FY, Lee SD, Lu FJ. Oxidative stress: an important phenomenon with pathogenetic significance in the progression of acute pancreatitis. Gut. 1998;42:850-855. [PubMed] [DOI] |
| 9. | 贺 璐璐, 韩 佳瑞, 计 树灵, 左 振魁, 段 晓宇, 范 飒, 祝 康杰. 松果菊苷对葡聚糖硫酸钠诱导的实验性结肠炎模型大鼠的保护作用. 中国病理生理杂志. 2021;37:2050-2056. [DOI] |
| 10. | 周 海银, 隆 彩霞, 罗 兰, 陈 艳瑛, 刘 萍萍, 肖 政辉, 张 树菊. 松果菊苷调控SIRT1/STAT3信号通路改善CLP大鼠肝损伤及糖代谢紊乱的研究. 中国医师杂志. 2021;23:1379-1385. [DOI] |
| 11. | 崔 艳红, 李 克芳, 金 博, 彭 飞, 刘 培培, 曲 伟伟, 门 翔, 赵 江. 松果菊苷抑制博来霉素诱导的肺上皮细胞损伤及炎症反应. 中国病理生理杂志. 2021;37:2024-2030. [DOI] |
| 13. | 肖 懿, 冯 志乔, 张 桂贤, 沈 洪昇, 李 文畅, 李 霞, 高 瑞芳, 刘 洪斌. 血必净注射液调节线粒体N-甲酰肽/NLRP3炎症通路对重症急性胰腺炎大鼠模型的治疗机制. 中国实验方剂学杂志. 2022;28:88-94. [DOI] |
| 14. | 宋 冰, 汪 永锋, 余 四九, 张 延英, 康 万荣. 基于TLR4/MYD88信号通路探讨大黄牡丹汤对急性胰腺炎大鼠模型的保护作用. 中国实验动物学报. 2021;29:17-26. [DOI] |
| 15. | Van Laethem JL, Marchant A, Delvaux A, Goldman M, Robberecht P, Velu T, Devière J. Interleukin 10 prevents necrosis in murine experimental acute pancreatitis. Gastroenterology. 1995;108:1917-1922. [PubMed] [DOI] |
| 16. | Garg PK, Singh VP. Organ Failure Due to Systemic Injury in Acute Pancreatitis. Gastroenterology. 2019;156:2008-2023. [PubMed] [DOI] |
| 17. | Shen Y, Wen L, Zhang R, Wei Z, Shi N, Xiong Q, Xia Q, Xing Z, Zeng Z, Niu H, Huang W. Dihydrodiosgenin protects against experimental acute pancreatitis and associated lung injury through mitochondrial protection and PI3Kγ/Akt inhibition. Br J Pharmacol. 2018;175:1621-1636. [PubMed] [DOI] |
| 18. | Wang Q, Liu S, Han Z. miR-339-3p regulated acute pancreatitis induced by caerulein through targeting TNF receptor-associated factor 3 in AR42J cells. Open Life Sci. 2020;15:912-922. [PubMed] [DOI] |
| 19. | Portelli M, Jones CD. Severe acute pancreatitis: pathogenesis, diagnosis and surgical management. Hepatobiliary Pancreat Dis Int. 2017;16:155-159. [PubMed] [DOI] |
| 20. | Song YD, Liu YY, Li DJ, Yang SJ, Wang QF, Liu YN, Li MK, Mei CP, Cui HN, Chen SY, Zhu CJ. Galangin ameliorates severe acute pancreatitis in mice by activating the nuclear factor E2-related factor 2/heme oxygenase 1 pathway. Biomed Pharmacother. 2021;144:112293. [PubMed] [DOI] |
| 21. | Zhong K. Curcumin Mediates a Protective Effect Via TLR-4/NF-κB Signaling Pathway in Rat Model of Severe Acute Pancreatitis. Cell Biochem Biophys. 2015;73:175-180. [PubMed] [DOI] |
| 22. | Liu X, Zhu Q, Zhang M, Yin T, Xu R, Xiao W, Wu J, Deng B, Gao X, Gong W, Lu G, Ding Y. Isoliquiritigenin Ameliorates Acute Pancreatitis in Mice via Inhibition of Oxidative Stress and Modulation of the Nrf2/HO-1 Pathway. Oxid Med Cell Longev. 2018;2018:7161592. [PubMed] [DOI] |