修回日期: 2022-04-29
接受日期: 2022-06-21
在线出版日期: 2022-07-08
白细胞介素17(interleukin 17, IL-17)是多细胞分泌因子, 与肿瘤细胞发展有关, lncRNA NNT-AS1胃癌组织中lncRNA NNT-AS1表达上调, lncRNA NNT-AS1可能通过降低miR-363的表达抑制胃癌细胞增殖和侵袭, 并阻滞细胞周期的发展.关于lncRNA NNT-AS1与IL-17调控作用对胃癌细胞研究尚不明确.
探究长链非编码RNA烟酰胺核苷酸转氢酶反义RNA1(lncRNA NNT-AS1)调控miR-518a-3p抑制IL-17诱导胃癌细胞增殖、迁移和侵袭的分子机制.
使用IL-17处理胃癌细胞AGS, 将细胞分为对照(Con)组、IL-17组、IL-17+si-NC组、IL-17+si-lncRNA NNT-AS1组、IL-17+si-lncRNA NNT-AS1+anti-miR-NC组、IL-17+si-lncRNA NNT-AS1+anti-miR-518a-3p组. 实时荧光定量PCR(RT-qPCR)检测miR-518a-3p和lncRNA NNT-AS1表达水平; 克隆实验、Transwell检测AGS细胞增殖、迁移、侵袭; 蛋白印迹法(Western blot)检测增殖、转移蛋白表达; 双荧光素酶实验检测miR-518a-3p和lncRNA NNT-AS1关系.
与Con组相比, IL-17组克隆细胞数、迁移细胞数、侵袭细胞数增多, lncRNA NNT-AS1表达水平、细胞核增殖抗原标记物(Ki-67)、基质金属蛋白酶2(matrix metalloproteinase 2, MMP2)、神经钙黏蛋白(N-cadherin)蛋白表达升高, miR-518a-3p表达水平、上皮钙黏蛋白(E-cadherin)蛋白表达降低. 下调lncRNA NNT-AS1降低IL-17处理胃癌细胞克隆细胞数、迁移细胞数、侵袭细胞数, 下调Ki-67、N-cadherin、MMP2蛋白表达, 上调E-cadherin蛋白表达增加. lncRNA NNT-AS1靶向调控miR-518a-3p的表达, 抑制miR-518a-3p可以逆转下调NNT-AS1对IL-17诱导胃癌细胞增殖、迁移和侵袭的影响.
lncRNA NNT-AS1靶向调控miR-518a-3p抑制IL-17诱导胃癌细胞增殖、迁移和侵袭.
核心提要: lncRNA NNT-AS1通过调控miR-363抑制胃癌细胞增殖和侵袭, 并阻滞细胞周期. 关于lncRNA NNT-AS1与白细胞介素17(interleukin 17, IL-17)调控作用对胃癌细胞研究尚不明确. 在线生物信息学软件预测miR-518a-3p是NNT-AS1靶基因, 在三阴性乳腺癌、结直肠癌中miR-518a-3p表达下调, 但是在胃癌中未知.
引文著录: 张晶, 王博, 王红霞, 孔凡铭, 李小江, 贾英杰. lncRNA NNT-AS1调控miR-518a-3p抑制IL-17诱导胃癌细胞增殖、迁移和侵袭的分子机制. 世界华人消化杂志 2022; 30(13): 571-578
Revised: April 29, 2022
Accepted: June 21, 2022
Published online: July 8, 2022
Interleukin 17 (IL-17) is a cytokine secreted in many cell types, which is related to the development of tumor cells. The expression of the long noncoding RNA (lncRNA) nicotinamide nucleotide transhydrogenase antisense RNA1 (NNT-AS1) is up-regulated in gastric cancer tissues. NNT-AS1 may inhibit the proliferation and invasion of gastric cancer cells and arrest cell cycle progression by reducing the expression of miR-363. The regulatory mechanism of NNT-AS1 and IL-17 on gastric cancer cells is still not completely clear.
To explore the molecular mechanism by which NNT-AS1 inhibits IL-17-induced proliferation, migration, and invasion of gastric cancer cells.
IL-17 was used to treat gastric cancer AGS cells, and the cells were divided into Con group, IL-17 group, IL-17 + si-NC group, IL-17 + si-lncRNA NNT-AS1 group, IL-17 + si-lncRNA NNT-AS1 + anti-miR-NC group, and IL-17 + si-lncRNA NNT-AS1 + anti-miR-518a-3p group. Real-time fluorescence quantitative PCR (RT-qPCR) was used to detect miR-518a-3p and NNT-AS1 expression. Colony forming assay and Transwell assay were performed to detect AGS cell proliferation, migration, and invasion. Western blot was used to detect relevant protein expression. Dual luciferase assay was used to detect the relationship of miR-518a-3p and NNT-AS1.
Compared with the Con group, the number of cell colonies, the number of migrating cells, and the number of invasive cells in the IL-17 group increased, the expression of Ki-67, N-cadherin, and MMP2 proteins increased, the expression of E-cadherin protein decreased, the expression of NNT-AS1 increased, and the expression of miR-518a-3p decreased. Down-regulation of NNT-AS1 decreased the number of cell colonies formed, the number of migrating cells, and the number of invasive cells in gastric cancer cells treated with IL-17, decreased the expression of Ki-67, matrix metalloproteinase 2 (MMP2), and N-cadherin proteins, and increased the expression of E-cadherin protein. NNT-AS1 targets and regulates the expression of miR-518a-3p. Inhibition of miR-518a-3p can reverse the effect of down-regulation of NNT-AS1 on IL-17-induced proliferation, migration, and invasion of gastric cancer cells.
NNT-AS1 inhibits IL-17-induced gastric cancer cell proliferation, migration, and invasion possibly by regulating the expression of miR-518a-3p.
- Citation: Zhang J, Wang B, Wang HX, Kong FM, Li XJ, Jia YJ. Long noncoding RNA NNT-AS1 inhibits IL-17-induced proliferation, migration, and invasion of gastric cancer cells by regulating miR-518a-3p. Shijie Huaren Xiaohua Zazhi 2022; 30(13): 571-578
- URL: https://www.wjgnet.com/1009-3079/full/v30/i13/571.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v30.i13.571
胃癌是常见的恶性消化系统肿瘤, 据统计资料显示, 2020年全球范围内病死率高达7.7%, 而中国高达2.1%, 虽然外科手术、放疗或化疗在治疗胃癌中已经取得了改善, 但是胃癌发病机制十分复杂, 致使患者5年预后生存期限未超过30%[1,2]. 白细胞介素17(interleukin 17, IL-17)是多细胞分泌因子, 与肿瘤细胞发展有关[3], 研究显示, 胃癌血清中高表达, 与患者分化程度、淋巴结转移有关[4]. lncRNA是一种定义为长度超过200核苷酸的非编码RNA分子的转录本, 因为没有完整的开放阅读框, 不具备编码蛋白的能力[5]. lncRNA烟酰胺核苷酸转氢酶-反义RNA1 (NNT-AS1)在癌症中发挥着重要作用, 胃癌组织中lncRNA NNT-AS1表达增加, lncRNA NNT-AS1可能通过降低miR-363的表达抑制胃癌细胞增殖和侵袭, 并阻滞细胞周期的发展[6]. 然而关于lncRNA NNT-AS1与IL-17调控作用对胃癌细胞研究尚不明确. 通过在线生物信息学软件预测显示, miR-518a-3p是NNT-AS1靶基因之一, 在三阴性乳腺癌、结直肠癌中miR-518a-3p表达下调, 与患者较短生存期有关, miR-518a-3p过表达可抑制肿瘤细胞增殖、迁移和侵袭[7,8], 但是对胃癌的研究尚不清楚. 本研究使用IL-17处理胃癌细胞, 观察lncRNA NNT-AS1靶向调控miR-518a-3p对IL-17诱导的胃癌细胞增殖、迁移、侵袭的影响.
胃癌AGS细胞购于中科院细胞中心; IL-17购于碧云天生物; si-lncRNA NNT-AS1、anti-miR-NC、si-NC、anti-miR-518a-3p、引物购于上海吉玛公司; 胎牛血清、DMEM培养基购于美国Hyclone公司; ECL试剂、双荧光素酶活性试剂盒、BCA试剂盒购于北京索莱宝公司; Trizol试剂盒、荧光定量试剂盒、逆转录试剂盒购于大连宝生生物公司; Matrigel基质胶、Transwell小室购于上海泽迈生物公司; 神经钙黏蛋白(N-cadherin)抗体、上皮钙黏蛋白(E-cadherin)抗体、细胞核增殖抗原标记物(Ki-67抗体、基质金属蛋白酶2(matrix metalloproteinase 2, MMP2)抗体、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)抗体、二抗购于上海赛信通公司; Lipofectamin 2000试剂盒购于美国invitrogen公司.
胃癌细胞AGS用10%胎牛血清的DMEM培养基内, 培养箱内进行孵育. 取对数期胃癌细胞AGS, 细胞分为Con组、IL-17组、IL-17+si-NC组、IL-17+si-lncRNA NNT-AS1组、IL-17+si-lncRNA NNT-AS1+anti-miR-NC组、IL-17+si-lncRNA NNT-AS1+anti-miR-518a-3p组. 其中Con组未经进行IL-17处理细胞, IL-17组: 使用100 μg/L的IL-17处理细胞; IL-17+si-NC组、IL-17+si-lncRNA NNT-AS1组、IL-17+si-lncRNA NNT-AS1+anti-miR-NC组、IL-17+si-lncRNA NNT-AS1+anti-miR-518a-3p组: 将si-NC、si-lncRNA NNT-AS1、si-lncRNA NNT-AS1和anti-miR-NC、si-lncRNA NNT-A和S1+anti-miR-518a-3p转染细胞, 使用100 μg/L的IL-17处理细胞. 按照Lipofectamin 2000试剂盒进行.
取各组AGS细胞培养24 h, Trizol试剂加细胞中提取总RNA, 逆转录合成cDNA, 配置反应体系: 1 μL cDNA、0.5 μL上下游引物、10 μL 2×miRcute miRNA premix, 使用RNase-Free ddH2O补充至20 μL. 用GAPDH、U6作内参, 采用2-△△CT法计lncRNA算NNT-AS1和miR-518a-3p表达水平.
取对数期胃癌细胞AGS按照1.2法处理细胞, 将细胞按照500个/孔接种6孔板中, 细胞放到恒温培养箱内培养14 d, 有克隆形成时停止培养. 使用4%多聚甲醇固定细胞, 结晶紫染色, 漂洗细胞, 待自然晾干后, 使用显微镜观察细胞克隆数.
迁移实验: 各组AGS细胞培养48 h, 用不含血清培养基重悬细胞(2×104个/mL), Transwell上室添加细胞悬液200 μL, 下室加500 μL含血清培养基, 培养24 h, 取出小室使用棉签擦掉未穿膜的细胞, 用多聚甲醛固定细胞, 再用结晶紫染色, 显微镜观察细胞迁移数. 侵袭实验: 将50 μL的Matrigel基质胶稀释液铺至Transwell上室内, 凝固5 h, 后续实验同迁移实验一致.
收集培养24 h各组AGS细胞, 加放射免疫沉淀法(RIPA)试剂提取细胞总蛋白, BCA法检测蛋白浓度, 经过聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白样品, 结束后转膜, 脱脂奶粉封闭1 h, 将聚偏二氟乙烯(PVDF)膜放在稀释好的一抗溶液中(Ki-67、E-cadherin、N-cadherin、MMP2, 稀释1:600), 4 ℃孵育过夜, 加稀释浓度为1:3000的二抗溶液, 室温孵育1 h, 加电化学发光(ECL)试剂显色, 曝光. 使用Image J软件分析蛋白条带灰度值.
构建miR-518a-3p相互结合位点lncRNA NNT-AS1的荧光素酶载体, 将突变型、野生型报告载体(lncRNA NNT-AS1 MUT、lncRNA NNT-AS1 WT)分别与miR-NC或miR-518a-3p转染至胃癌细胞AGS中, 转染按照脂质体法, 转染48 h, 根据双荧光素酶活性检测试剂盒操作进行, SpectraMax Mini多功能酶标仪(美谷分子仪器有限公司)检测各组荧光素酶活性. 其中萤火虫荧光素酶活性值为内参, 计算各组荧光素酶活性.
统计学处理 实验采用SPSS 19.0软件分析处理数据, 结果以(mean±SD)表示, 多组间比较用单因素方差分析, 两组间比较用t检验. P<0.05为差异有统计学意义.
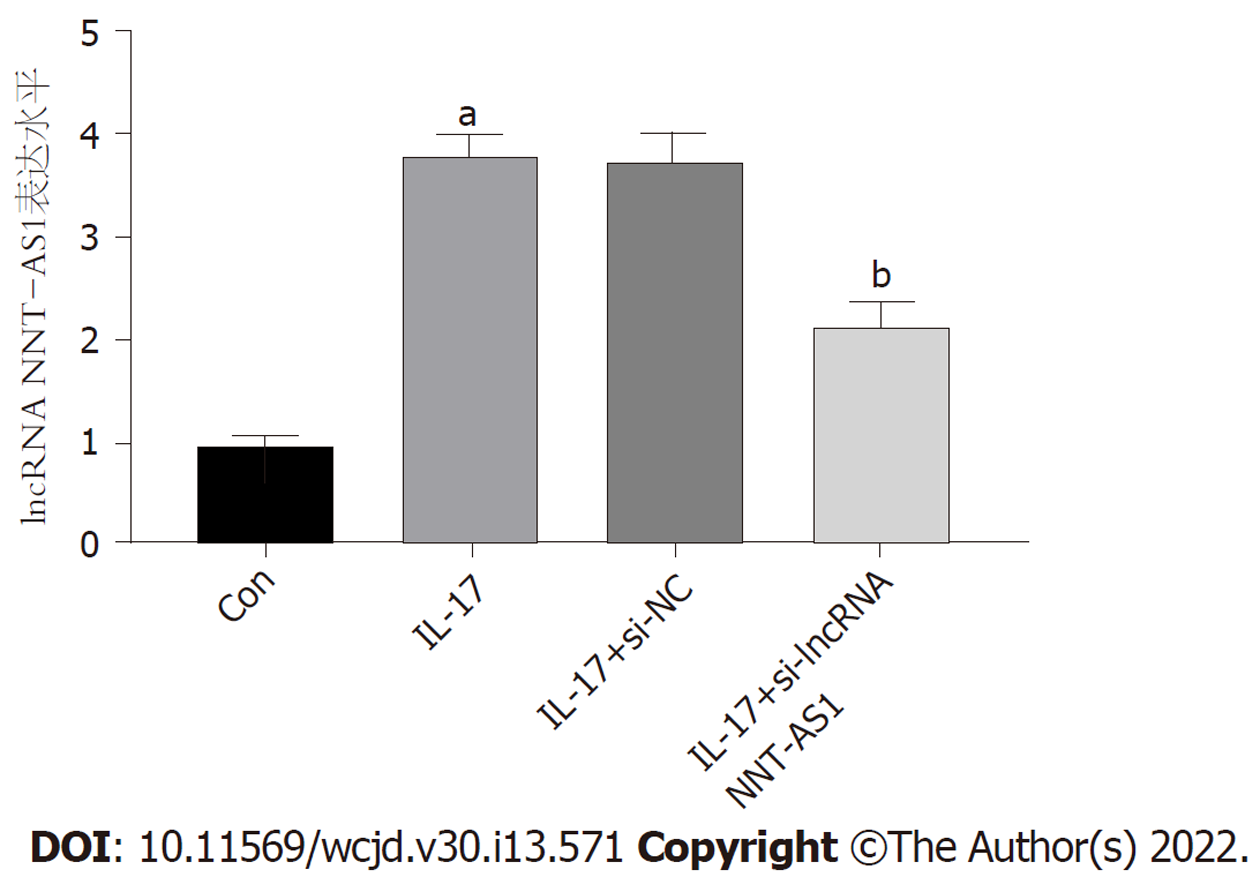
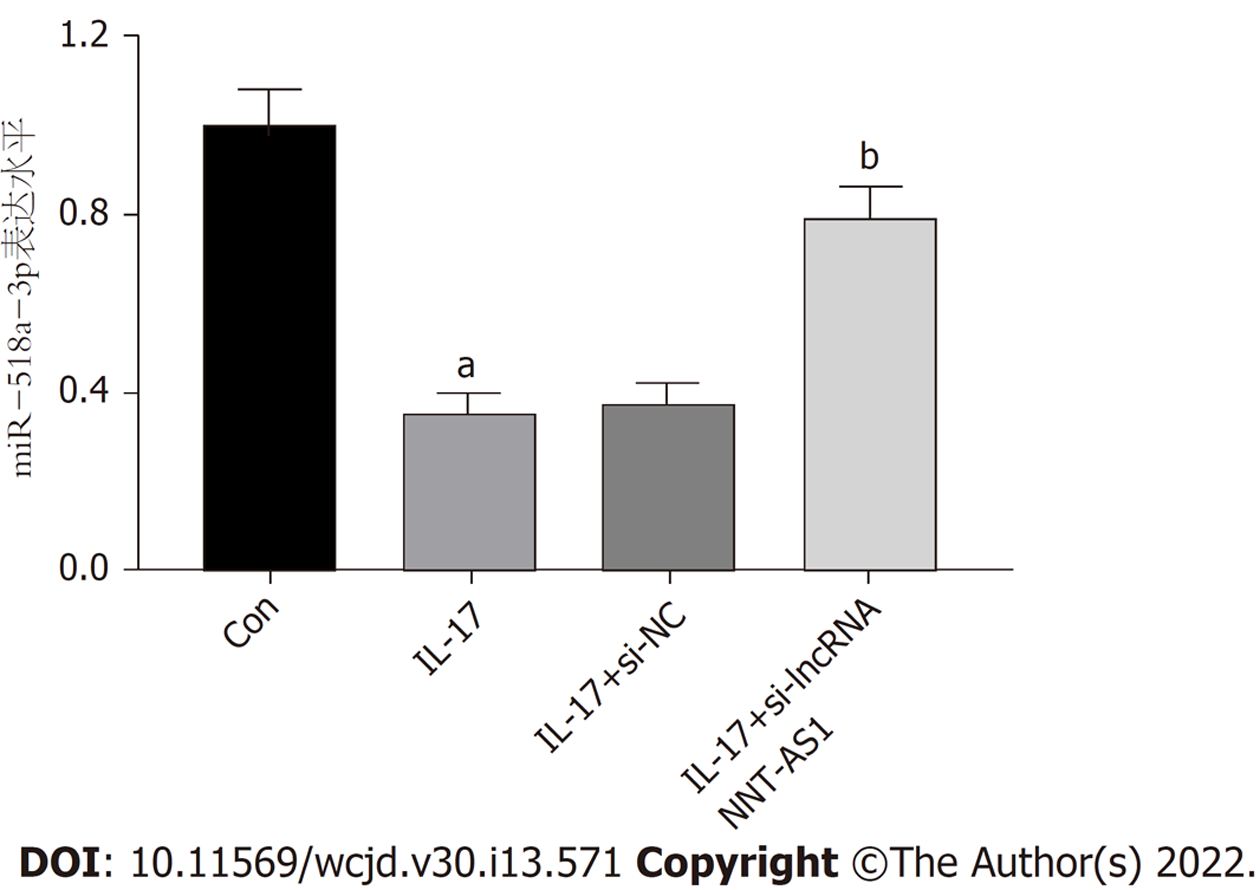
与Con组比较, IL-17组lncRNA NNT-S1表达水平显著升高(P<0.05); 与IL-17+si-NC组相比, IL-17+si-lncRNA NNT-AS1组lncRNA NNT-S1表达水平显著降低(P<0.05). 图1.
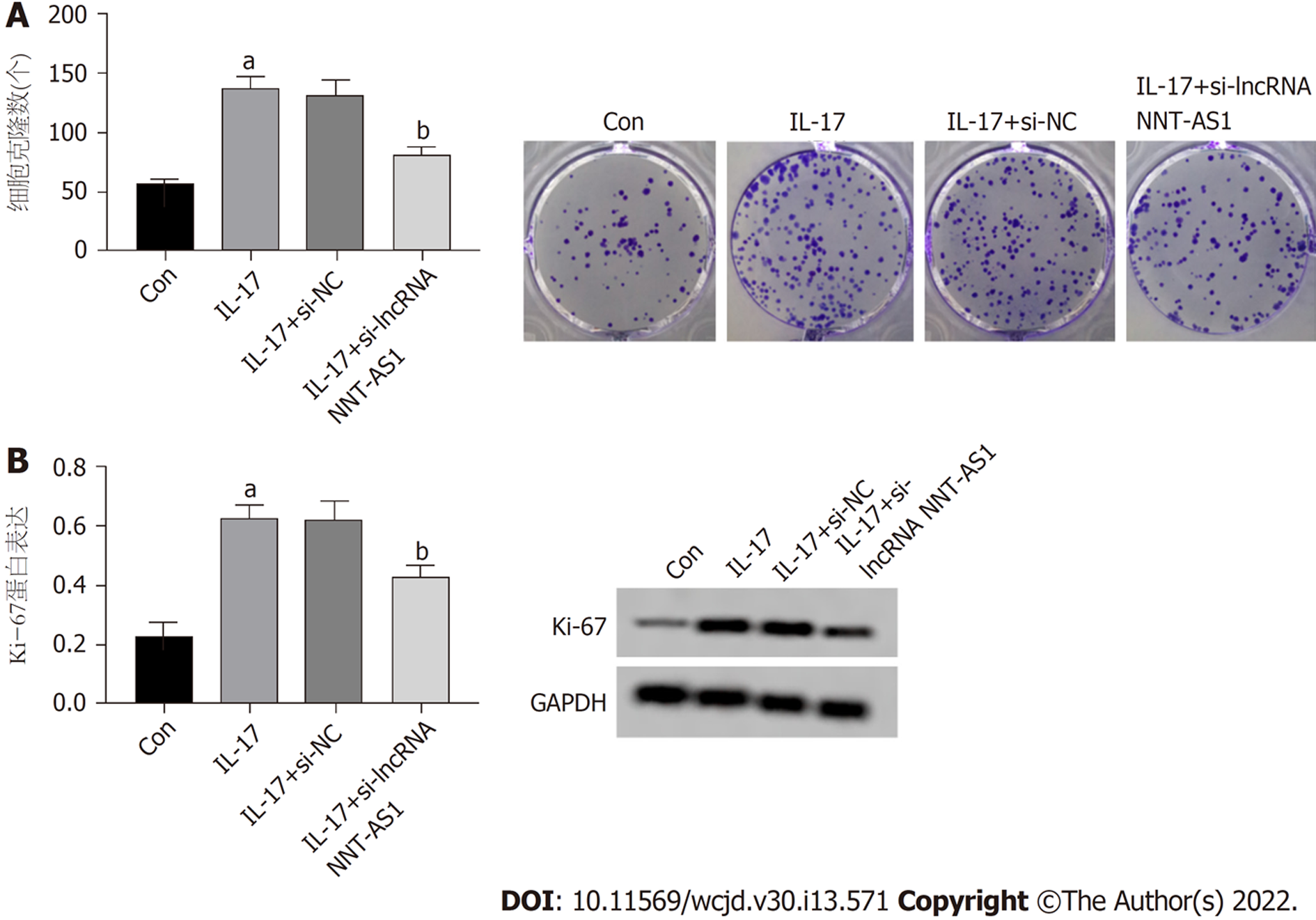
与Con组比较, IL-17组Ki-67蛋白表达、克隆细胞数显著升高(P<0.05); 与IL-17+si-NC组相比, IL-17+si-lncRNA NNT-AS1组、克隆细胞数Ki-67蛋白表达显著降低(P<0.05). 图2.
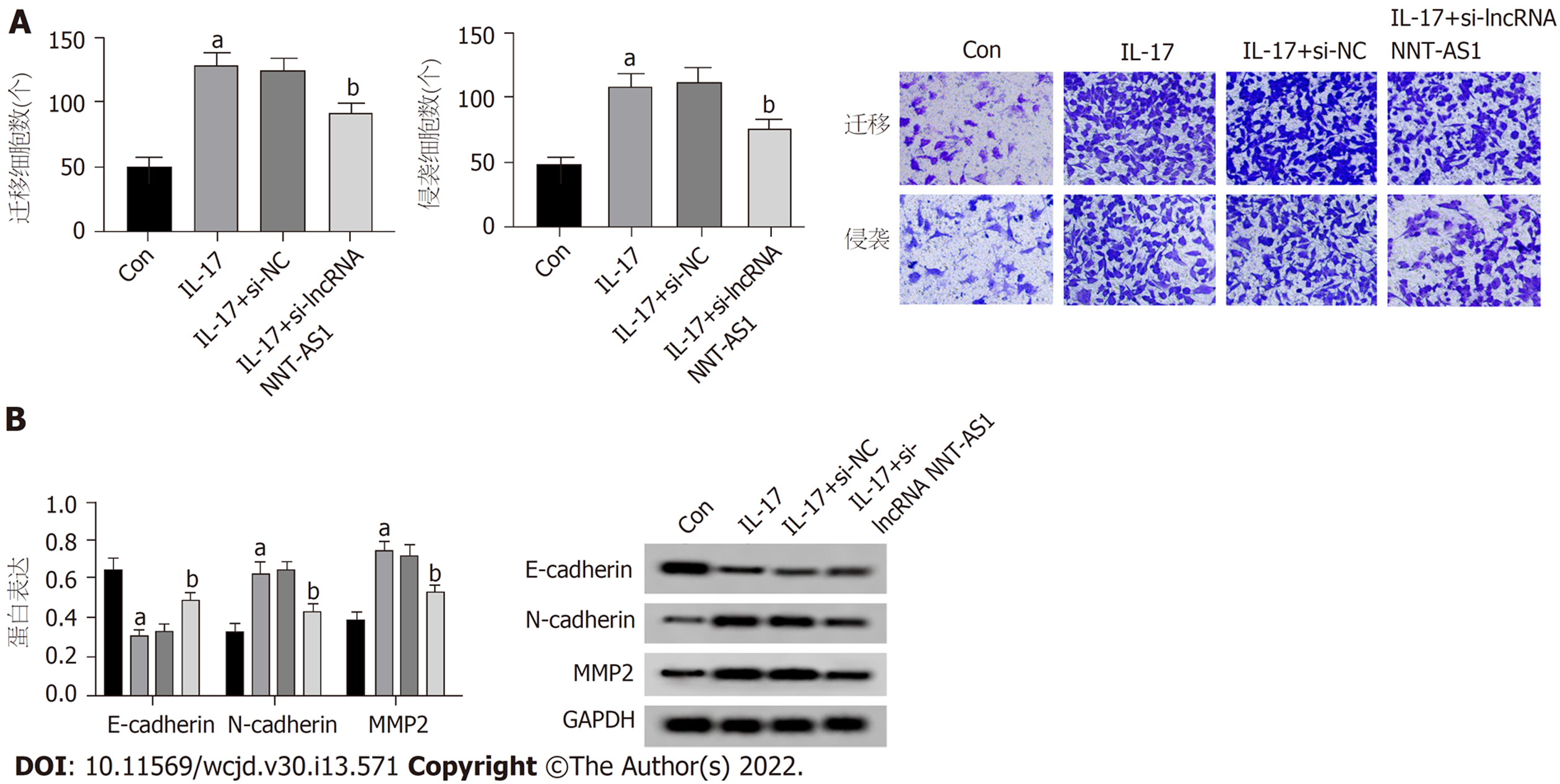
与Con组比较, IL-17组迁移细胞数、侵袭细胞数增多(P<0.05), E-cadherin蛋白表达降低(P<0.05), N-cadherin、MMP2蛋白表达升高(P<0.05); 与IL-17+si-NC组相比, IL-17+si-lncRNA NNT-AS1组迁移细胞数、侵袭细胞数减少(P<0.05), N-cadherin、MMP2蛋白表达降低(P<0.05), E-cadherin蛋白表达升高(P<0.05). 图3.
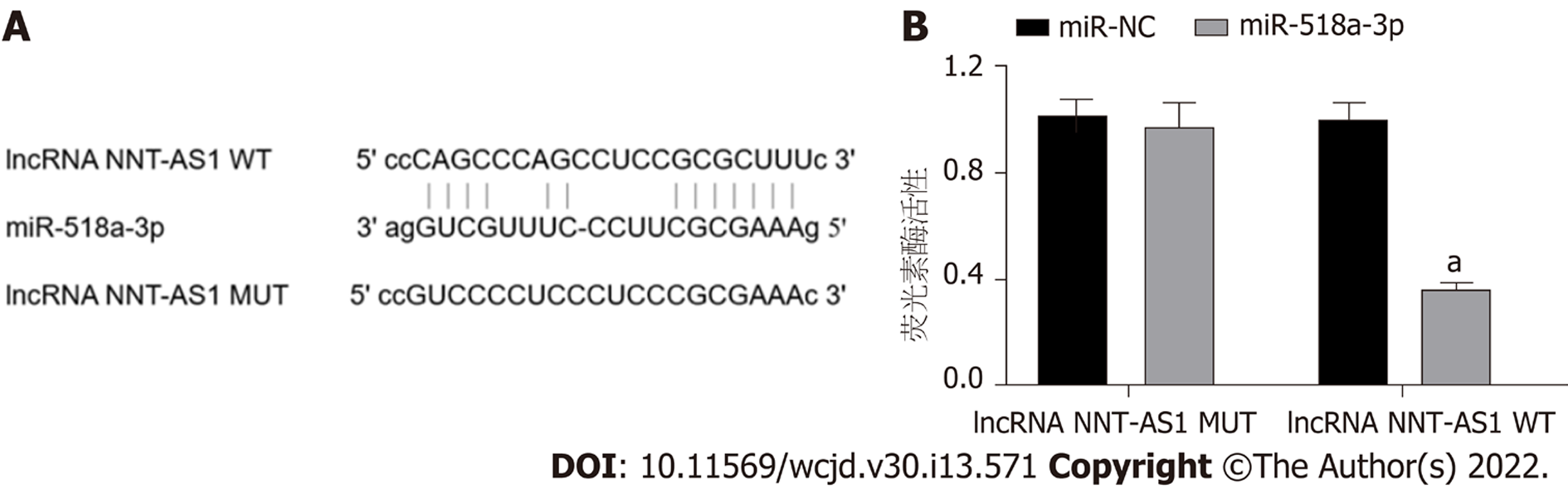
在线生物信息学网站预测显示, lncRNA NNT-AS1和miR-518a-3p存在相互结合位点, 见图3. 与miR-NC组相比, miR-518a-3p组lncRNA NNT-AS1 MUT荧光素酶活性差异不显著, lncRNA NNT-AS1 WT荧光素酶活性显著降低(P<0.05). 图4.
与Con组比较, IL-17组miR-518a-3p表达水平显著降低(P<0.05); 与IL-17+si-NC组相比, IL-17+si-lncRNA NNT-AS1组miR-518a-3p表达水平显著增加(P<0.05). 图5.
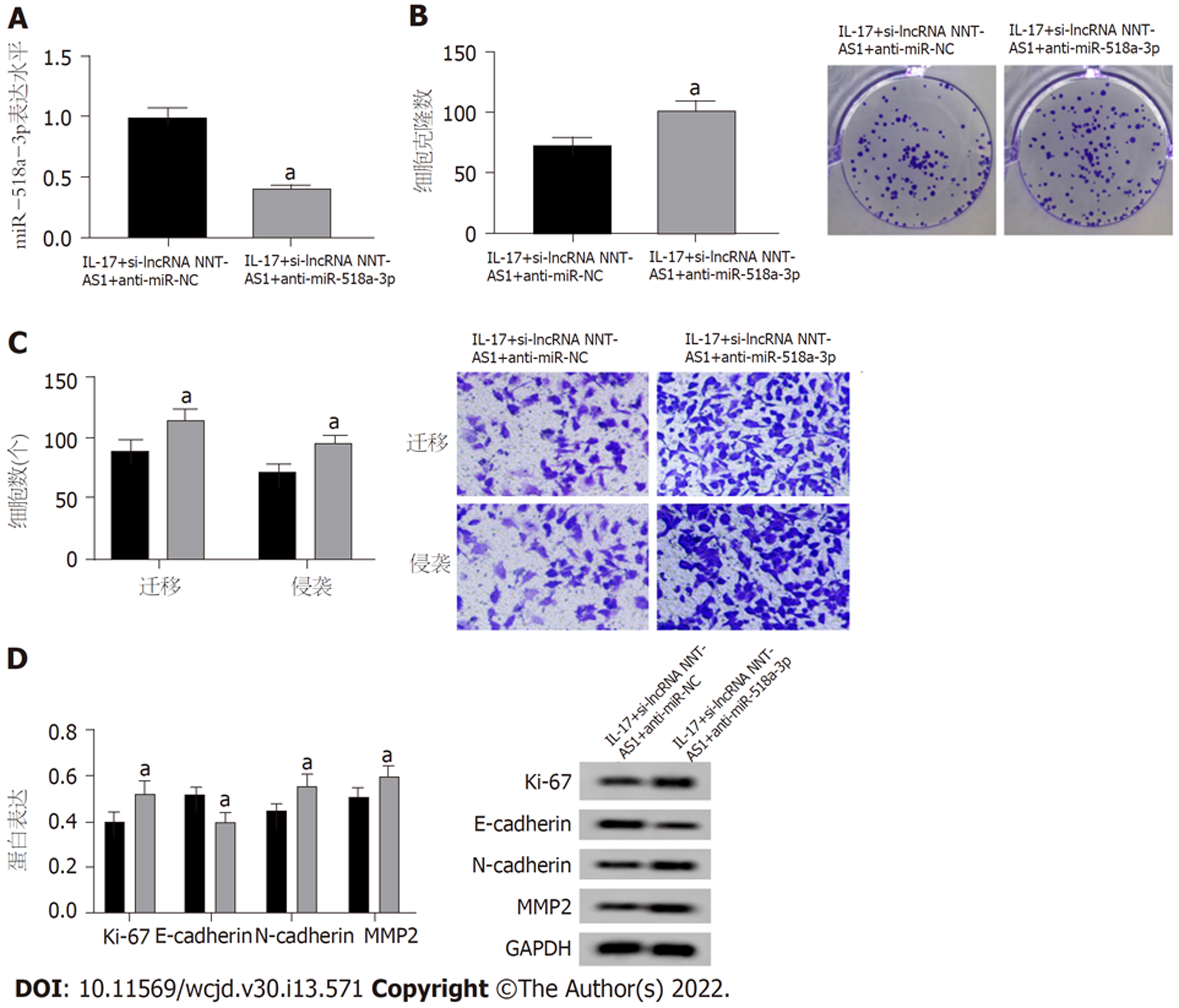
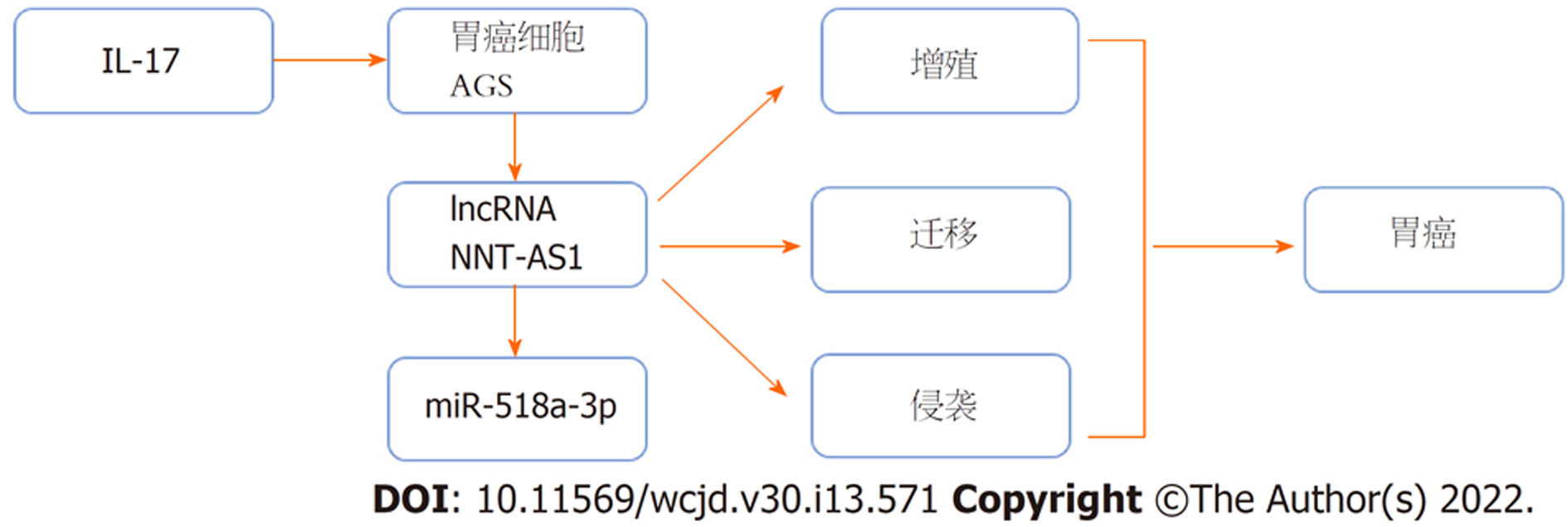
与IL-17+si-lncRNA NNT-AS1+anti-miR-NC组相比, IL-17+si-lncRNA NNT-AS1+anti-miR-518a-3p组克隆细胞数、迁移细胞数、侵袭细胞数增多(P<0.05), Ki-67、N-cadherin、MMP2蛋白表达升高, E-cadherin蛋白表达降低(P<0.05). 图6. 并根据以上结果, 绘制了lncRNA NNT-AS1在胃癌细胞中分子机制图, 图7.
IL-17是Th17细胞分泌的炎性因子, 在肿瘤组织中表达上调, 与肿瘤微环境中血管形成有关系[9]. 研究结果证明[10], IL-17与胃癌发展密切相关, 研究显示, IL-17对胃癌细胞增殖、迁移、侵袭的抑制作用. 本研究结果显示, IL-17处理胃癌细胞AGS, 克隆细胞数、迁移细胞数、侵袭细胞数增多, 下调E-cadherin蛋白表达, 上调Ki-67、N-cadherin、MMP2蛋白表达, 提示IL-17能诱导胃癌细胞增殖、侵袭和侵袭, 这与之前的研究结果[10]一致.
lncRNA是多功能非编码调控转录本, lncRNA NNT-AS1是一种新发现的促癌非编码RNA分子, 既往的研究结果显示, 在乳腺癌、卵巢癌、胶质瘤等癌症中异常表达, 与患者总生存期、TNM分期等有关[11-13]. 前列腺癌研究结果显示, lncRNA NNT-AS1表达水平在前列腺癌细胞中表达增加, 沉默lncRNA NNT-AS1能够抑制前列腺癌细胞增殖、迁移和侵袭, 并诱导细胞凋亡[14]. 在胃癌组织和细胞中lncRNA NNT-AS1表达增加, 与患者较差的预后有关, lncRNA NNT-AS1通过降低miR-424抑制胃癌细胞增殖和侵袭, 阻滞细胞周期发展[15]. 胃癌细胞中, lncRNA NNT-AS1还能够通过调控miR-142-5p/性别决定基因-区域转录因子4(SOX4)轴抑制胃癌细胞增殖、迁移和侵袭, 并促进细胞凋亡[16]. 以上说明lncRNA NNT-AS1与肿瘤发展相关, 且在胃癌中起促癌作用, 但是关于lncRNA NNT-AS1与IL-17的调控作用不清楚. 本研究结果显示, IL-17处理胃癌细胞后lncRNA NNT-AS1表达增加, 下调lncRNA NNT-AS1降低了IL-17诱导胃癌细胞中lncRNA NNT-AS1表达水平, 提示lncRNA NNT-AS1可能与IL-17诱导胃癌细胞有关. 下调lncRNA NNT-AS1减少IL-17诱导胃癌细胞克隆细胞数、迁移细胞数、侵袭细胞数, 增加E-cadherin蛋白表达, 降低Ki-67、N-cadherin、MMP2相关蛋白表达, 提示下调lncRNA NNT-AS1抑制IL-17诱导的胃癌细胞增殖、迁移和侵袭.
lncRNA还能够作为竞争性内源RNA调控miRNA表达参与肿瘤的发展[17], 在本研究中, 通过双荧光素酶报告实验和RT-qPCR实验验证lncRNA NNT-AS1靶向调控miR-518a-3p的表达. miR-518a-3p在癌症中低表达, 如在非小细胞肺癌细胞中表达降低, LINC00461可充当miR-518a-3p海绵抑制非小细胞肺癌细胞增殖和转移[18]. 在口腔鳞癌细胞中miR-518a-3p表达降低, 功能实验显示, lncRNA HOXA11-AS可能通过降低miR-518a-3p抑制口腔鳞癌细胞增殖、侵袭, 并阻碍细胞周期发展[19]. 本研究发现, IL-17处理胃癌细胞后降低miR-518a-3p表达, 下调lncRNA NNT-AS1增加IL-17处理胃癌细胞后miR-518a-3p, 说明lncRNA NNT-AS1靶向负调控miR-518a-3p. 进一步实验结果显示, 抑制miR-518a-3p可以逆转下调lncRNA NNT-AS1对IL-17诱导胃癌细胞增殖、迁移和侵袭的作用, 提示lncRNA NNT-AS1靶向负调控miR-518a-3p影响IL-17诱导的胃癌细胞增殖、迁移、侵袭.
综上所述, 下调lncRNA NNT-AS1能抑制IL-17诱导的胃癌细胞增殖、迁移和侵袭, 可能与上调miR-518a-3p有关, 旨在为胃癌诊断提供新的作用靶点. 本研究也存在不足之处, 关于lncRNA NNT-AS1体内实验需要我们进行后续实验研究.
胃癌是常见的恶性消化系统肿瘤, 虽然外科手术、放疗或化疗在治疗胃癌中已经取得了改善, 但是胃癌发病机制十分复杂, 致使患者5年预后生存期限未超过30%.白细胞介素17(interleukin 17, IL-17)是多细胞分泌因子, 与肿瘤细胞发展有关,其在胃癌血清中高表达, 与患者分化程度、淋巴结转移有关. lncRNA是一种定义为长度超过200核苷酸的非编码RNA分子的转录本, 可靶向miRNA影响IL-17诱导的胃癌细胞发展.
IL-17是多细胞分泌因子,在胃癌血清中高表达, 而lncRNA NNT-AS1在胃癌组织中表达增加, lncRNA NNT-AS1可能通过降低miR-363的表达抑制胃癌细胞增殖和侵袭, 并阻滞细胞周期的发展. lncRNA NNT-AS1与IL-17调控作用对胃癌细胞研究尚不明确. 通过在线生物信息学软件预测显示, miR-518a-3p是NNT-AS1靶基因之一, miR-518a-3p在三阴性乳腺癌、结直肠癌中表达下调, 本研究观察lncRNA NNT-AS1靶向调控miR-518a-3p对IL-17诱导的胃癌细胞增殖、迁移、侵袭的影响.
验证lncRNA NNT-AS1靶向调控miR-518a-3p对IL-17处理胃癌细胞增殖、迁移、侵袭的作用.
RT-qPCR检测miR-518a-3p和lncRNA NNT-AS1表达水平; 克隆实验、Transwell检测AGS细胞增殖、迁移、侵袭; Western Blot检测增殖、转移蛋白表达; 双荧光素酶实验检测miR-518a-3p和lncRNA NNT-AS1关系.
IL-17能诱导胃癌细胞增殖、侵袭和侵袭; 下调lncRNA NNT-AS1抑制IL-17诱导的胃癌细胞增殖、迁移和侵袭; lncRNA NNT-AS1靶向负调控miR-518a-3p. 进一步实验结果显示, 抑制miR-518a-3p可以逆转下调lncRNA NNT-AS1对IL-17诱导胃癌细胞增殖、迁移和侵袭的作用.
lncRNA NNT-AS1靶向调控miR-518a-3p抑制IL-17诱导胃癌细胞增殖、迁移和侵袭.
旨在为胃癌诊断提供新的作用靶点.
学科分类: 胃肠病学和肝病学
手稿来源地: 天津市
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C, C, C
D级 (一般): D
E级 (差): E
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Sung H, Ferlay J, Siegel RL, Laversanne M, Soerjomataram I, Jemal A, Bray F. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021;71:209-249. [PubMed] [DOI] |
| 2. | Xia C, Dong X, Li H, Cao M, Sun D, He S, Yang F, Yan X, Zhang S, Li N, Chen W. Cancer statistics in China and United States, 2022: profiles, trends, and determinants. Chin Med J (Engl). 2022;135:584-590. [PubMed] [DOI] |
| 3. | Li X, Bechara R, Zhao J, McGeachy MJ, Gaffen SL. IL-17 receptor-based signaling and implications for disease. Nat Immunol. 2019;20:1594-1602. [PubMed] [DOI] |
| 6. | Wang X, Ren M, Li Y, Hu J, Lu G, Ma W, Guo D, Lu X, He S. Long noncoding RNA NNT-AS1 promotes gastric cancer proliferation and invasion by regulating microRNA-363 expression. J Cell Biochem. 2019;120:5704-5712. [PubMed] [DOI] |
| 7. | Gan L, Yang H, Xiong Z, Yang Z, Wang T, Lyu G. miR-518a-3p Suppresses Triple-Negative Breast Cancer Invasion and Migration Through Regulation of TMEM2. Technol Cancer Res Treat. 2020;19:1533033820977523. [PubMed] [DOI] |
| 8. | Qu LL, He L, Zhao X, Xu W. Downregulation of miR-518a-3p activates the NIK-dependent NF-κB pathway in colorectal cancer. Int J Mol Med. 2015;35:1266-1272. [PubMed] [DOI] |
| 9. | Wang X, Yang L, Huang F, Zhang Q, Liu S, Ma L, You Z. Inflammatory cytokines IL-17 and TNF-α up-regulate PD-L1 expression in human prostate and colon cancer cells. Immunol Lett. 2017;184:7-14. [PubMed] [DOI] |
| 10. | 母 润红, 艾 一玖, 李 雨澎, 林 睿, 叶 思萍, 马 方, 郭 笑. 重组人IL-17A在胃癌组织中的表达及其对胃癌BGC-823细胞增殖、侵袭、迁移和凋亡的影响. 吉林大学学报(医学版). 2021;47:1510-1517. [DOI] |
| 11. | Zhou C, Duan S. The Role of Long Non-Coding RNA NNT-AS1 in Neoplastic Disease. Cancers (Basel). 2020;12. [PubMed] [DOI] |
| 13. | Zheng D, Chen D, Lin F, Wang X, Lu L, Luo S, Chen J, Xu X. LncRNA NNT-AS1 promote glioma cell proliferation and metastases through miR-494-3p/PRMT1 axis. Cell Cycle. 2020;19:1621-1631. [PubMed] [DOI] |
| 14. | Yao C, Cheng X, Guo X, Lu X, Bu F, Xu Y. NNT-AS1 modulates prostate cancer cell proliferation, apoptosis and migration through miR-496/DDIT4 axis. Cancer Cell Int. 2020;20:463. [PubMed] [DOI] |
| 15. | Chen B, Zhao Q, Guan L, Lv H, Bie L, Huang J, Chen XB. Long non-coding RNA NNT-AS1 sponges miR-424/E2F1 to promote the tumorigenesis and cell cycle progression of gastric cancer. J Cell Mol Med. 2018;22:4751-4759. [PubMed] [DOI] |
| 16. | Zhang J, Zhang K, Hou Y. Long noncoding RNA NNTAS1 knockdown represses the progression of gastric cancer via modulating the miR1425p/SOX4/Wnt/βcatenin signaling pathway. Mol Med Rep. 2020;22:687-696. [PubMed] [DOI] |
| 17. | Paraskevopoulou MD, Hatzigeorgiou AG. Analyzing MiRNA-LncRNA Interactions. Methods Mol Biol. 2016;1402:271-286. [PubMed] [DOI] |
| 18. | Wang Z, Lu Y, Sheng B, Ding Y, Cheng X. Long-noncoding RNA LINC00461 promotes proliferation and invasion of nonsmall cell lung cancer cells via targeting miR-518a-3p/WDR1 pathway. J Recept Signal Transduct Res. 2022;42:80-87. [PubMed] [DOI] |
| 19. | Li B, Wang W, Miao S, Li G, Lv Y, Xiang C, Pei R. HOXA11-AS promotes the progression of oral squamous cell carcinoma by targeting the miR-518a-3p/PDK1 axis. Cancer Cell Int. 2019;19:140. [PubMed] [DOI] |