修回日期: 2022-04-27
接受日期: 2022-05-25
在线出版日期: 2022-07-08
苷水解酶是水解苷类化合物的一类酶, 对苷类化合物在肠道中的代谢转化具有重要作用, 但机体自身基因编码表达的苷水解酶的数量有限, 绝大部分苷水解酶由肠道菌群基因编码产生. 肠道菌群及其分泌的苷水解酶参与了苷类化合物的脱糖转化并提高其生物利用度, 大多数苷类化合物经脱糖转化后生成药效更强的次级苷或苷元从而提高生物利用度, 也有少数产生毒性. 本文综述了苷水解酶的定义、种类、肠道微生物来源和其对苷类化合物的转化, 并探讨了肠道菌群、苷水解酶及苷脱糖转化产物之间的关系, 为实现苷水解酶及苷转化产物的高效生产、挖掘新药资源提供参考.
核心提要: 由肠道菌群分泌的苷水解酶能将苷类化合物脱糖转化成生物利用度更高的次级苷和苷元, 但肠道菌群、苷水解酶及苷脱糖转化产物之间的关系还有待进一步明确.
引文著录: 黄莉莉, 唐圆, 谢果珍, 谭周进. 肠道菌群中苷水解酶的研究进展. 世界华人消化杂志 2022; 30(13): 555-561
Revised: April 27, 2022
Accepted: May 25, 2022
Published online: July 8, 2022
Glycoside hydrolases are a class of enzymes that hydrolyze glycosides and play an important role in the metabolic transformation of glycosides in the intestine, but the number of glycoside hydrolases encoded and expressed in the body is limited, and most glycoside hydrolases are produced from intestinal bacteria genes. Gut microbiota and the secreted glycoside hydrolases participate in the deglycosylation of glycosides and improve their bioavailability. In this paper, we review the definition and types of glucoside hydrolases, their sources from the gut microbiota, and transformation of glycosides by the gut microbiota. We also discuss the relationship between the gut microbiota, glucoside hydrolases, and glucoside deglycosylation transformation products, with an aim to provide a reference for efficient production of enzymes and glycoside conversion products, and mining of new drug resources.
- Citation: Huang LL, Tang Y, Xie GZ, Tan ZJ. Progress in research of glycoside hydrolases in the intestine. Shijie Huaren Xiaohua Zazhi 2022; 30(13): 555-561
- URL: https://www.wjgnet.com/1009-3079/full/v30/i13/555.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v30.i13.555
苷类化合物广泛存在于天然药物中, 并作为一类重要的活性成分广受关注. 研究证实苷类成分具有抗炎、抗肿瘤、提高机体免疫力等重要的药理活性. 苷类化合物由苷元及糖基或糖衍生物构成, 极性较大, 生物利用度低. 苷类成分通常被视为"前药", 而真正起作用的是极性较小的次级苷或苷元. 因此, 苷类化合物在体内的转化研究成为探明药物的作用机理及挖掘新药的重要基础. 因此, 本综述主要关注肠道菌群中苷水解酶的种类、来源及作用, 以期为苷类药物的研究提供参考.
凡是能改变苷类化合物的结构及生物利用度的一类酶均可称为苷转化酶. 由于其对中药苷类成分药效的发挥产生重要的作用而被广泛关注. 苷转化酶对黄酮苷(黄芩苷、槲皮素、橙皮苷、柚皮苷、芦丁、葛根素等)的转化主要包括糖苷键水解、甲基化反应及羟基化反应, 对萜苷(人参皂苷、栀子苷等)转化涉及糖苷键水解、羟基化、酯化反应和氧化反应[1]. 可见苷转化酶对苷类化合物的代谢转化过程涉及了甲基化、羟基化、水解反应和氧化还原反应, 并以水解反应为主, 氧化还原反应为辅[2]. 羟化酶、酯酶和甲基化酶、氮还原酶、硝基还原酶和P450同工酶参与了苷类化合物在肠道中的代谢和转化, 因其几乎不由肠道菌群分泌, 所以本综述不作重点讨论.
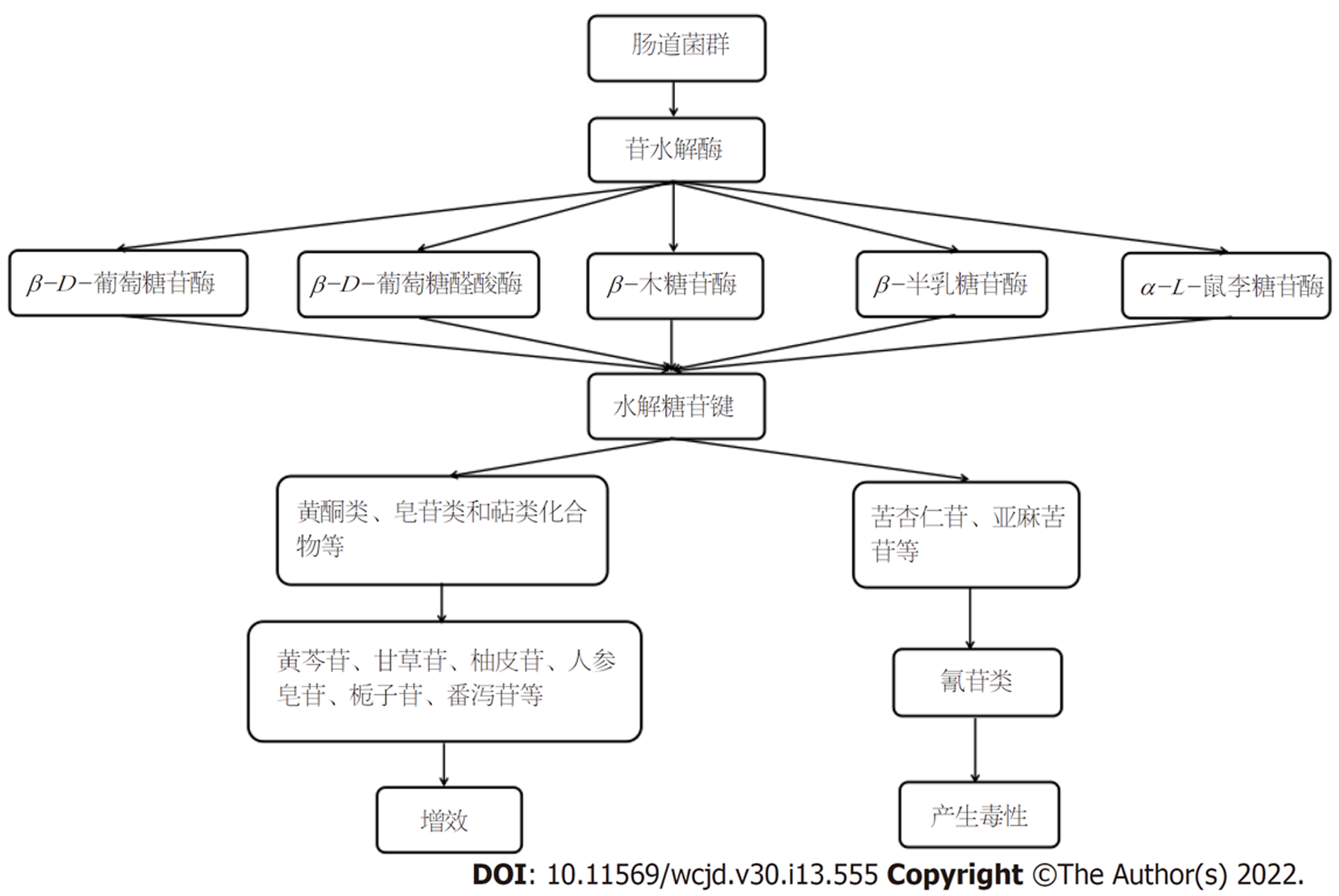
苷水解酶是指参与苷类化合物水解反应的一类酶, 主要作用于不同位点的糖苷键, 其在功能上属于苷转化酶的一类, 在结构上属于碳水化合物活性酶(carbohydrate active enzymes, CAZYmes). CAZYmes目前涵盖的酶类包括糖苷水解酶(glycoside hydrolases, GHs)、糖基转移酶(glycosyl transferases, GTs)、多糖裂解酶(polysaccharide lyases, PLs)、碳水化合物酯酶(carbohydrate esterases, CEs)和辅酶(auxiliary activities, AAs). 其中酯酶主要用于天然多羟基化合物(如人参皂苷、薯蓣皂苷等)的选择性酯化, 而糖苷水解酶和多糖裂解酶主要作用于糖苷键[3]. 多糖裂解酶通过β排除机制降解含糖醛酸的多糖长链参与碳水化合物主链的降解, 在裂解点生成不饱和烯醛酸残基和新的还原端,其对底物的转化过程不需要水分子的参与, 多糖裂解酶通常作用于海洋多糖等复杂碳水化合物的裂解. 糖苷水解酶是一类特异性水解糖苷键的酶,通过插入水分子水解糖苷类化合物中糖基之间或糖基与非糖基之间的糖苷键, 产生糖半缩醛或半缩酮以及相应的游离糖苷配基[4]. 目前研究较多的苷水解酶有: β-D-葡萄糖苷酶(β-D-glucosidase, EC3.2.1.21)、β-D-葡萄糖醛酸酶(β-D-glucuronidase, EC 3.2.1.31)、β-木糖苷酶(β-xylosidase, EC 3.2.1.37)、β-半乳糖苷酶(β-galactosidase, EC3.2.1.23)、α-L-鼠李糖苷酶(α-L-rhamnosidase, EC 3.2.1.40).
苷水解酶主要由肠道菌群或机体自身的基因编码, 如β-D-葡萄糖醛酸酶既可来源于肝脏, 又可来源于肠道菌群; β-半乳糖苷酶既可由小肠黏膜上皮细胞分泌, 也可由肠道菌群分泌. 然而动物和人类基因组编码的苷水解酶数量有限, 据统计, 人类基因组编码的糖苷水解酶约97种. 肠道菌群作为人体重要的"微生态器官", 是苷水解酶的主要来源.
肠道菌群是以互惠共生的方式生活在人体肠道中的复杂微生物群落, 其结构受到宿主遗传、饮食、环境、药物等因素的影响. 已报道的肠道菌群超过50个菌门, 人体肠道菌群的优势菌门为厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes), 占肠道微生物的90%. 研究表明[5], 肠道菌群中双歧杆菌属(Bifidobacterium)、肠球菌属(Enterococcus)、大肠杆菌属(Escherichia coli)等细菌和曲霉属(Aspergillus)、青霉属(Penicillium)等真菌均可表达苷水解酶. 有些肠菌能分泌多种苷水解酶, 如乳酸菌(Lactobacillus)能分泌β-D-葡萄糖苷酶和β-半乳糖苷酶, 而拟杆菌能分泌超过260种糖苷水解酶.
β-D-葡萄糖苷酶主要分布在糖苷水解酶第1、2、3、5、9、30和116家族中, 其中GH1家族多为细菌、植物来源, GH3家族多为真菌来源, 来源不同的β-D-葡萄糖苷酶结构及组成差异很大. β-D-葡萄糖苷酶的微生物来源主要有霉菌、酵母菌(Saccharomyces)和乳酸菌等. 人肠道细菌中厚壁菌门、拟杆菌门和放线菌门(Actinobacteria)均可表达β-D-葡萄糖苷酶, 其中双歧杆菌和多形拟杆菌(Bacteroides thetaiotaomicron)对其有较高的表达. Yang等人[6]发现芽孢杆菌(Bacillus sp. 52)、拟杆菌(Bacteroides sp. 45、42)和韦荣氏菌(Veillonella sp. 32)均能分泌β-D-葡萄糖苷酶, 且Veillonella sp. 32和Bacteroides sp. 42的产酶活性高于Bacteroides sp. 45和Bacillus sp. 52. Shin和Siddiqi等人[7,8]还报道了Gordonia terrae、Arachidicoccus ginsenosidimutans、Paenibacillus mucilaginosus和Caldicellulosiruptor bescii均能分泌β-D-葡萄糖苷酶, 且能转化人参皂苷.
β-D-葡萄糖醛酸酶主要分布在糖苷水解酶第2和79家族中. 30多年前首次在大肠杆菌中被发现. 大肠杆菌对β-D-葡萄糖醛酸酶具有高度的特异性, 因此β-D-葡萄糖醛酸酶阳性可作为判断大肠杆菌存在的重要指标. 后来陆续发现葡萄球菌(Staphylococcus)、乳酸菌和瘤胃球菌(Ruminococcus)等细菌和青霉菌、曲霉菌和酵母菌等真菌均可表达β-D-葡萄糖醛酸酶. Wang等人[9]总结报道了厚壁菌门的产气荚膜梭菌(Perfringens)、无乳链球菌(Streptococcus agalactiae)和拟杆菌门的脆弱类杆菌(Bacterooides fragilis)来源的β-D-葡萄糖醛酸酶. Xu等人[10]还报道了丝状真菌Talaromyces pinophilus Li-93来源的β-D-葡萄糖醛酸酶, 且能精准的将甘草酸(glycyrrhizic acid, GL)转化为单葡萄糖醛酸甘草次酸(glycyrrhetinic acid monoglucuronide, GAMG).
β-木糖苷酶主要分布在糖苷水解酶第1、3、5、28、30、39、43、51、52、54、116和120家族中, 其中来自GH3和GH39家族中的多种β-木糖苷酶不仅具有催化活性, 还具有转糖基活性, 采用保留型催化机制将木糖基转移到糖苷类受体的基团上, 形成带有木糖基的生物活性物质. β-木糖苷酶的微生物来源主要是细菌和真菌, 真菌中以丝状真菌(Mycelial fungus)为主, 能产生多种β-木糖苷酶, 双歧杆菌(Bifidobacterium)和酵母菌中比较少见[11]. 肠道中芽孢杆菌(Bacillus halodurans)、嗜热脂肪芽孢杆菌(Stearothermophilus)、解糖热纤维菌(Caldocellum saccharolyticum)、新月柄杆菌(Caulobacter crescentus)、粪球梭菌(Clostridium stercorarium)、厌氧嗜热杆菌(Thermoanaerobacterium saccharolyticum)均可表达β-木糖苷酶[12].
β-半乳糖苷酶主要分布在糖苷水解酶第1、2、3、35、42、50和59家族中. β-半乳糖苷酶的微生物来源主要有曲霉属、克鲁维酵母属(Kluyveromyces)、乳杆菌属(Lactobacillus)、双歧杆菌属以及大肠杆菌属等[13]. 其中来自霉菌和克鲁维酵母菌的β-半乳糖苷酶因其具备食品安全性已被广泛应用于工业生产[29]. β-半乳糖苷酶在肠道中主要由双歧杆菌、乳酸菌和嗜热链球菌等肠道益生菌产生, 如罗伊氏乳杆菌(Lactobacillus reuteri)、长双歧杆菌(Bifidobacterium longum)、两歧双歧杆菌(B. bifidum)和乳酸菌(L. plantarum70810). Li等人[14]发现, 嗜热链球菌分泌的β-半乳糖苷酶可抑制体外培养的结直肠癌细胞增殖, 促进癌细胞凋亡. 同时, 嗜热链球菌通过分泌的β-半乳糖苷酶增加了肠道益生菌(双歧杆菌和乳酸菌)的丰度.
α-L-鼠李糖苷酶主要分布在糖苷水解酶第28、78和106家族, 广泛分布于机体的细菌(如芽孢杆菌属、拟杆菌属、乳杆菌属等)和自然界的真菌(如曲霉属、青霉属、木霉属(Trichoderma sp)中, 研究表明多种益生菌, 如嗜酸乳杆菌(Lactobacillus acidophilus)、副干酪乳杆菌(Lactobacillus paracasei)、乳球菌(Lactococcus Schleifer)、双歧杆菌等均可表达α-L-鼠李糖苷酶, 细菌中以乳酸菌来源数量最多[15]. 短双歧杆菌(Bifidobacterium breve)来源的α-L-鼠李糖苷酶具有广泛的底物特异性, 可用于多种天然苷类化合物的去鼠李糖基化, Amaretti等人[16]筛选了33株双歧杆菌菌株, 通过研究其对橙皮苷的水解过程证明只有链状双歧杆菌(Bifidobacterium catenulatum)和伪链状双歧杆菌(Bifidobacterium pseudoatenultum)含有表达α-L-鼠李糖苷酶的基因. 目前已报道的肠菌来源的α-L-鼠李糖苷酶最适pH大多呈中性或偏酸性, 但梭菌(Clostridium stercorarium)和嗜热细菌(Thermomicrobia bacterium PRI-1686)来源的α-L-鼠李糖苷酶最适pH偏碱性. 也有研究表明多形拟杆菌来源的α-L-鼠李糖苷酶的1个基因座包含2个α-L-鼠李糖苷酶基因(BtRha78D和BtRha78E)[17], 这两个基因的酶学性质有利于黄酮类化合物脱糖基转化. 苷水解酶的具体来源及其性质见表1.
| 苷水解酶 | 来源 | 底物 | 产物 | 参考文献 |
| Bifidobacterium sp. strain SEN | 番泻苷 | 番泻苷元 | [18] | |
| Bacillus sp.strain AU3b4(MF612187.1) | 人参皂苷Rb1 | 稀有人参皂苷CK | [19] | |
| Paenibacillus sp. MBT213; Bacillus safensis | 人参皂苷Rb1 | 人参皂苷 Rd | [20] | |
| β-D-glucosidase | Lactobacillus plantarum KFY02 | 虎杖苷 | 白藜芦醇 | [21] |
| Eubacterium sp. A-44 | 京尼平苷 | 京尼平 | [22] | |
| Cohnella thermotolerans | 人参皂苷Rb1 | 稀有人参皂苷CK | [23] | |
| Bifidobacterium lactis Bi-07 | 人参皂苷Rb1 | 人参皂苷F2 | [24] | |
| penicillium decumbens | 人参皂苷Rb1 | 人参皂苷Rh2 | [25] | |
| Extracellular A. usamii | 桔梗苷E和桔梗素D3 | 桔梗素D | [26] | |
| Bacillus subtilis JY24 | 黄芩苷 | 黄芩素 | [27] | |
| E. coli K12 | 黄芩苷 | 黄芩素 | [28] | |
| β-D-glucuronidase | Talaromyces pinophilus Li-93 | 甘草酸 | 单葡萄糖醛酸甘草次酸 | [10] |
| Eubacterium L-8 | 甘草酸 | 甘草次酸 | [29] | |
| Bifidobacterium breve K-110 | 人参皂苷Ra1 | 人参皂苷Rb2 | [30] | |
| β-xylosidase | Thermoanaerobacterium thermosaccharolyticum | 三七皂苷R1、R2 | 人参皂苷Rg1和Rh1 | [31] |
| Dictyoglomus thermophilum | 黄芪甲苷 | 环黄芪醇 | [32] | |
| Lactobacillus ginsenosidimutans EMML 3041 | 人参皂苷Rb1 | 人参皂苷Rg3 | [33] | |
| β-galactosidase | Aspergillus sp. | 人参皂苷Rg3 | 人参皂苷Rh2 | [34] |
| Enterobacter cloacae | 红景天苷 | 酪醇半乳糖苷 | [35] | |
| Aspergillus nidulans | 橙皮苷 | 橙皮素单葡萄糖苷 | [36] | |
| α-L-rhamnosidase | Bifidobacterium breve ATCC 15700 | 芦丁 | 异槲皮苷 | [37] |
| Bacteroides sp. 22 | 芦丁 | 槲皮素-3-o-葡萄糖苷 | [8] | |
| Absidia sp.G3 | 人参皂苷Re | 人参皂苷Rg1 | [38] |
中药苷类化合物在肠道中的转化需要多种酶共同参与. 如京尼平苷在肠道的转化过程需要苷水解酶和酯酶的共同参与: 京尼平苷的环烯烃醚萜首先被β-D-葡糖苷酶水解为京尼平, 然后再被酯酶转化成京尼平苷酸. 苷水解酶根据其结构和底物特异性的不同能转化不同的苷类化合物. 许多中药中的糖苷类成分必须去除糖基形成相应的次级苷或苷元才能真正发挥药效, 但并非所有的苷类化合物经水解后都能增强药性, 有的苷类化合物经苷水解酶水解后会产生毒性, 如β-D-葡萄糖苷酶能将本身没有毒性的氰苷水解生成糖和对应的羟基腈, α-羟基腈裂解酶再将羟基腈化合物转化成氢氰酸和醛酮化合物从而产生毒性(图1)[39].
β-D-葡萄糖苷酶属于纤维素酶类, 能水解芳香基或烃基与糖基原子团之间的糖苷键, 同时释放出β-D-葡萄糖和相应的配基. β-D-葡萄糖苷酶主要作用于β-1, 4-葡萄糖苷键, 也能作用于β-(1, 1)、(1, 2)、(1, 3)、(1, 6)糖苷键, 其底物专一性较差, 对多种蒽醌苷、黄酮苷和萜苷都有高效的水解作用, 可有效水解人参皂苷、柴胡皂苷、甘草苷、番泻苷、虎杖苷、京尼平苷、龙胆苦苷等. 栀子的主要药效成分京尼平具有消炎、利胆、退黄等药理作用, 但其在栀子中的含量很低(0.005%-0.01%), 而栀子的另一种苷类成分京尼平苷的含量则达到 (3.0%-8.0%), β-D-葡萄糖苷酶能在肠道中将京尼平苷水解为京尼平, 从而发挥药理作用[22]. β-D-葡萄糖苷酶能水解虎杖苷的β-1, 4-葡萄糖苷键将其转化为具有保护心血管和抗氧化等药理作用的白藜芦醇; β-D-葡萄糖苷酶能高效地水解大豆异黄酮, 得到具有提高人体免疫力的异黄酮苷元; β-D-葡萄糖苷酶通过去除人参皂苷C3/C6和C20位点上的单糖, 将天然人参皂苷脱糖基转化为次级苷, 同时也将普通皂苷转化为稀有皂苷, 是参与多种稀有人参皂苷制备的重要酶. β-D-葡萄糖苷酶还能将番泻苷转化为具有泻下作用的大黄酸蒽酮. 其中β-D-葡萄糖苷酶对番泻苷的转化途径有两条: 一是β-D-葡萄糖苷酶先将番泻苷水解为番泻苷8-O-单葡萄糖苷, 后者再脱去一个葡萄糖并通过还原反应生成大黄酸蒽酮;二是番泻苷先被还原成大黄酸蒽酮葡萄糖苷, 再由β-D-葡萄糖苷酶水解生成大黄酸蒽酮[40]. 大黄酸蒽酮能激活结肠巨噬细胞增加前列腺素E2(PGE2)释放,从而降低水通道蛋白3(aquaporin 3, AQP3)的表达, 促进结肠中水分解滞留从而导致腹泻.
β-D-葡萄糖醛酸酶可催化各种类型葡萄糖醛酸结合物发生水解反应并释放出β-葡萄糖醛酸和相应配基. 对含β-1,4-葡萄糖醛酸键的黄芩苷、汉黄芩苷和GL具有较好的水解作用. 研究表明[41], β-D-葡萄糖醛酸酶在黄芩素和黄芩苷的"肠肝循环"代谢中起重要作用, 黄芩素极性较小, 易经小肠吸收, 经Ⅱ相代谢酶作用生成黄芩苷, 后者又可经胆汁和肠黏膜转运至肠腔, 被肠道菌群水解成黄芩素. 甘草的主要药性成分GL的C3位连接两个葡萄糖醛酸基, GL的水解途径包括两种: 去掉两个葡萄糖醛酸基和外端一个葡萄糖醛酸基, 分别生成甘草次酸(glycyrrhetinic acid, GA)和GAMG, GAMG的抗炎、抗过敏等药理活性均高于GL. β-D-葡萄糖醛酸酶能定向水解GL中的β-1,2-糖苷键生成GAMG,是酶法制备GAMG的主要途径[42].
β-木糖苷酶是一种外切酶, 能切除某些天然物质上的木糖基团, 从而生成具有生物活性的物质, 近年来的研究发现微生物来源的β-木糖苷酶可以水解萜类、甾体等苷元与木糖形成的糖苷键, 释放出苷元. 三七皂苷R1和R2都含有一个木糖基, 其木糖基由一个β-1,2-糖苷键和一个糖基相连, β-木糖苷酶能切除三七皂苷R1和R2木糖基中的β-1,2-糖苷键, 生成具有抗过敏、抗氧化、抗炎等功效的人参皂苷Rg1和Rh1, Shin等人[31]首次报道了酶法生产人参皂苷Rg1和Rh1, Thermophilum thermosaccharolyticum表达的β-木糖苷酶在4 h和18 h内分别将2 g三七皂苷R1和R2完全转化为1.69 g人参皂苷Rg1和1.63 g人参皂苷Rh1, 摩尔转化率为100%. β-木糖苷酶能与β-D-葡萄糖苷酶分别切除黄芪甲苷IV(ASI)上C3位的木糖基和C6位的葡萄糖基生成抗衰老等药理作用更强的环黄芪醇(CA), 但目前关于β-木糖苷酶转化黄芪甲苷Ⅳ的报道很少, 且转化黄芪甲苷Ⅳ的β-木糖苷酶的尚未发现有肠道微生物来源.
β-半乳糖苷酶能水解β-1, 4-糖苷键, 具有高度底物专一性, 要求底物的半乳糖基必须以β-糖苷键与多糖部分相连. 具有水解乳糖和转糖苷两种功能. 人参皂苷Rh2能诱导癌细胞凋亡, 具备较高的抗癌活性. β-半乳糖苷酶能水解Rg3的3位外侧葡萄糖而不水解内侧葡萄糖从而将Rg3转化为Rh2. 研究表明[33,34], Aspergillus sp.和Aspergillus oryzae来源的β-半乳糖苷酶均可用于Rh2的制备, 且来源于Aspergillus oryzae的β-半乳糖苷酶活性更高,当以25 g/L和6.27 g/L的Rg3为底物, 转化率分别为90.6%和100%. 红景天苷的类似物半乳糖型红景天苷的抗氧化、抗炎、抗疲劳、心脏和神经保护等药理作用优于红景天苷, 但目前酶法制备半乳糖型红景天苷的产率较低, 不适于大批量生产, β-半乳糖苷酶能通过转糖苷功能将红景天苷的苷元-酪醇糖基化生成神经保护和心血管保护作用更强的半乳糖型红景天苷[35], 为半乳糖型红景天苷的规模化生产奠定了基础.
α-L-鼠李糖苷酶是一类催化水解非还原性末端α-L-鼠李糖残基的糖苷水解酶, 主要作用于α-(1, 2)和α-(1,6)葡萄糖苷键, 也能作用于α-(1, 3)和α-(1, 4)糖苷键. α-L-鼠李糖苷酶可水解切割黄酮苷化合物芦丁、橘皮苷、柚皮苷, 人参皂苷化合物Rg2和Re, 柴胡皂苷C等末端的α-L-鼠李糖基. α-L-鼠李糖苷酶可水解芦丁生成抗氧化、抗增殖和抗衰老作用更强的异槲皮素. α-L-鼠李糖苷酶参与芦丁的脱糖基反应有两种途径: 其一为α-L-鼠李糖苷酶先将芦丁水解成异槲皮苷, 异槲皮苷再被β-D-葡萄糖苷酶进一步水解成苷元槲皮素, 其二为α-L-鼠李糖苷酶和β-D-葡萄糖苷酶直接将芦丁转化为无色花青素. α-L-鼠李糖苷酶能将柚皮苷水解为普鲁宁, 普鲁宁在β-D-葡萄糖苷酶作用下进一步转化为具有抗细胞凋亡等作用的柚皮素[37,43], α-L-鼠李糖苷酶能水解人参皂苷Re的C6位末端上的一个α-鼠李糖基, 生成能发挥抗中枢神经系统和抗心脑血管系统疾病的人参皂苷Rg1. 还能水解人参皂苷Rg2的C6位末端上的一个α-鼠李糖基生成具有抗炎、抗氧化、免疫调节作用的人参皂苷Rh1.
酶解法具有条件温和, 操作简单, 价格低廉等优点, 可在体外用酶解法富集生物利用度和药理活性更好的苷元, 并开发为新药. 然而目前自然界现有的苷水解酶大多存在产量低、稳定性差、底物专一性不强、易产生副产物等问题, 不适合定向催化, 也难以实现工业大批量生产. 因此实现苷水解酶的高效生产成了近年来研究的热点. 基因工程和酶工程等现代生物技术的发展成为苷水解酶工业化生产的有力工具. 利用基因重组从微生物中分离出能表达苷水解酶的基因, 将该编码基因导入到"工程菌"中实现同源或异源表达, 从而获得高酶活、耐热或耐酸碱的苷水解酶. 还可通过基因定点突变、体外分子定向进化等方式对苷水解酶分子进行定向改造, 让其更高效的用于工业生产和食品药品开发中. 如Thermotoga petrophila来源的耐热β-D-葡萄糖苷酶基因tp bgl l3(Gen Bank:ABQ46916.1)已经在大肠杆菌中实现了异源表达, 并应用于人参皂苷与黄芩苷的生物制备[44]. Xu等人[45]从丝状真菌(Talaromyces pinophilus Li-93)中分离得到一种表达β-D-葡萄糖醛酸酶的基因: tpgus79a, 其能特异、精确地将GL转化为GAMG, 无中间产物生成, 将其克隆并在Pichia酵母中实现了异源表达, 克服了β-D-葡萄糖醛酸酶底物特异性低的问题, 也为后续GAMG分离纯化降低了难度.
司磊等人[46]在体外利用肠道菌群分泌的β-D-葡萄糖醛酸酶将黄芩苷转化为黄芩素, 黄芩素比黄芩苷口服给药后更易吸收, 且黄芩素的抗炎、解热、镇痛等药理作用优于黄芩苷. 刘沛等人[47]用三黄颗粒中的黄芩素代替黄芩苷制备的素代三黄颗粒其药理作用优于三黄颗粒, 为黄芩素代替黄芩苷制备中药复方制剂提供了参考. 人参皂苷Rg3能够诱导癌细胞凋亡和抑制癌细胞转移, 在体内外均有较强的抗肿瘤的活性, 但其在人参中含量极少, 目前制备Rg3的主要途径是利用微生物分泌的β-D-葡萄糖苷酶水解人参皂苷Rb1生成Rg3. 苏敏等人[48]从kefir粒中分离出一株产β-D-葡萄糖苷酶的马克斯克鲁维酵母菌, 能将人参皂苷Rb1转化为Rg3, 并对酶解工艺进行优化, 使人参皂苷Rg3的含量比未发酵时提高了3.48倍, 为人参皂苷Rg3的高效生产提供了途径.
研究肠道菌群中的苷水解酶及其对苷类化合物的转化过程, 将有利于筛选高表达苷转化酶的菌株, 明确编码苷水解酶的基因, 选择合适的"工程菌"实现苷水解酶的工业化生产, 进一步用于苷的体外转化, 为新药开发提供支持.
学科分类: 胃肠病学和肝病学
手稿来源地: 湖南省
同行评议报告学术质量分类
A级 (优秀): A
B级 (非常好): B, B
C级 (良好): 0
D级 (一般): D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 2. | Gong X, Li X, Bo A, Shi RY, Li QY, Lei LJ, Zhang L, Li MH. The interactions between gut microbiota and bioactive ingredients of traditional Chinese medicines: A review. Pharmacol Res. 2020;157:104824. [PubMed] [DOI] |
| 3. | Luis AS, Martens EC. Interrogating gut bacterial genomes for discovery of novel carbohydrate degrading enzymes. Curr Opin Chem Biol. 2018;47:126-133. [PubMed] [DOI] |
| 6. | Yang J, Qian D, Jiang S, Shang EX, Guo J, Duan JA. Identification of rutin deglycosylated metabolites produced by human intestinal bacteria using UPLC-Q-TOF/MS. J Chromatogr B Analyt Technol Biomed Life Sci. 2012;898:95-100. [PubMed] [DOI] |
| 8. | Siddiqi MZ, Ximenes HA, Song BK, Park HY, Lee WH, Han H, Im WT. Enhanced production of ginsenoside Rh2(S) from PPD-type major ginsenosides using BglSk cloned from Saccharibacillus kuerlensis together with two glycosidase in series. Saudi J Biol Sci. 2021;28:4668-4676. [PubMed] [DOI] |
| 9. | Wang P, Jia Y, Wu R, Chen Z, Yan R. Human gut bacterial β-glucuronidase inhibition: An emerging approach to manage medication therapy. Biochem Pharmacol. 2021;190:114566. [PubMed] [DOI] |
| 10. | Xu Y, Feng X, Jia J, Chen X, Jiang T, Rasool A, Lv B, Qu L, Li C. A Novel β-Glucuronidase from Talaromyces pinophilus Li-93 Precisely Hydrolyzes Glycyrrhizin into Glycyrrhetinic Acid 3-O-Mono-β-d-Glucuronide. Appl Environ Microbiol. 2018;84. [PubMed] [DOI] |
| 12. | Shin KC, Seo MJ, Oh DK. Characterization of β-xylosidase from Thermoanaerobacterium thermosaccharolyticum and its application to the production of ginsenosides Rg1 and Rh 1 from notoginsenosides R 1 and R 2. Biotechnol Lett. 2014;36:2275-2281. [PubMed] [DOI] |
| 13. | Hyun YJ, Kim B, Kim DH. Cloning and characterization of ginsenoside Ra1-hydrolyzing beta-D-xylosidase from Bifidobacterium breve K-110. J Microbiol Biotechnol. 2012;22:535-540. [PubMed] [DOI] |
| 14. | Li Q, Hu W, Liu WX, Zhao LY, Huang D, Liu XD, Chan H, Zhang Y, Zeng JD, Coker OO, Kang W, Ng SSM, Zhang L, Wong SH, Gin T, Chan MTV, Wu JL, Yu J, Wu WKK. Streptococcus thermophilus Inhibits Colorectal Tumorigenesis Through Secreting β-Galactosidase. Gastroenterology. 2021;160:1179-1193.e14. [PubMed] [DOI] |
| 15. | Mueller M, Zartl B, Schleritzko A, Stenzl M, Viernstein H, Unger FM. Rhamnosidase activity of selected probiotics and their ability to hydrolyse flavonoid rhamnoglucosides. Bioprocess Biosyst Eng. 2018;41:221-228. [PubMed] [DOI] |
| 16. | Amaretti A, Raimondi S, Leonardi A, Quartieri A, Rossi M. Hydrolysis of the rutinose-conjugates flavonoids rutin and hesperidin by the gut microbiota and bifidobacteria. Nutrients. 2015;7:2788-2800. [PubMed] [DOI] |
| 17. | 李 彬春, 吉 亚茹, 李 艳琴, 丁 国斌. 多形拟杆菌α-L-鼠李糖苷酶序列分析与酶学性质. 中国生物化学与分子生物学报. 2017;33:391-399. [DOI] |
| 18. | Akao T, Che QM, Kobashi K, Yang L, Hattori M, Namba T. Isolation of a human intestinal anaerobe, Bifidobacterium sp. strain SEN, capable of hydrolyzing sennosides to sennidins. Appl Environ Microbiol. 1994;60:1041-1043. [PubMed] [DOI] |
| 20. | Renchinkhand G, Cho SH, Urgamal M, Park YW, Nam JH, Bae HC, Song GY, Nam MS. Characterization of Paenibacillus sp. MBT213 Isolated from Raw Milk and Its Ability to Convert Ginsenoside Rb1 into Ginsenoside Rd from Panax ginseng. Korean J Food Sci Anim Resour. 2017;37:735-742. [PubMed] [DOI] |
| 22. | Long X, Zeng X, Tan F, Yi R, Pan Y, Zhou X, Mu J, Zhao X. Lactobacillus plantarum KFY04 prevents obesity in mice through the PPAR pathway and alleviates oxidative damage and inflammation. Food Funct. 2020;11:5460-5472. [PubMed] [DOI] |
| 23. | 张 庆锋, 吕 世鑫, 江 雨欣, 王 丹丹, 王 洪涛. 产β-葡萄糖苷酶微生物的筛选鉴定及其在人参皂苷Compound K转化中的应用. 山东农业科学. 2021;53:63-69. [DOI] |
| 24. | Tan JS, Yeo CR, Popovich DG. Fermentation of protopanaxadiol type ginsenosides (PD) with probiotic Bifidobacterium lactis and Lactobacillus rhamnosus. Appl Microbiol Biotechnol. 2017;101:5427-5437. [PubMed] [DOI] |
| 25. | Kim SY, Lee HN, Hong SJ, Kang HJ, Cho JY, Kim D, Ameer K, Kim YM. Enhanced biotransformation of the minor ginsenosides in red ginseng extract by Penicillium decumbens β-glucosidase. Enzyme Microb Technol. 2022;153:109941. [PubMed] [DOI] |
| 26. | Ahn HJ, You HJ, Park MS, Johnston TV, Ku S, Ji GE. Biocatalysis of Platycoside E and Platycodin D3 Using Fungal Extracellular β-Glucosidase Responsible for Rapid Platycodin D Production. Int J Mol Sci. 2018;19. [PubMed] [DOI] |
| 27. | 孔 利华, 高 书锋, 雷 平, 王 升平, 周 映华, 龚 平, 曾 发姣, 缪 东, 周 小玲, 曾 奥, 舒 燕, 邬 理洋, 刘 惠知. 产β-葡萄糖醛酸苷酶菌株胃肠道耐受性与酶学特性研究. 家畜生态学报. 2020;41:59-64. |
| 29. | Kim DH, Hong SW, Kim BT, Bae EA, Park HY, Han MJ. Biotransformation of glycyrrhizin by human intestinal bacteria and its relation to biological activities. Arch Pharm Res. 2000;23:172-177. [PubMed] [DOI] |
| 30. | Hyun YJ, Kim B, Kim DH. Cloning and characterization of ginsenoside Ra1-hydrolyzing beta-D-xylosidase from Bifidobacterium breve K-110. J Microbiol Biotechnol. 2012;22:535-540. [PubMed] [DOI] |
| 31. | Shin KC, Seo MJ, Oh DK. Characterization of β-xylosidase from Thermoanaerobacterium thermosaccharolyticum and its application to the production of ginsenosides Rg1 and Rh 1 from notoginsenosides R 1 and R 2. Biotechnol Lett. 2014;36:2275-2281. [PubMed] [DOI] |
| 32. | Li Q, Wu T, Qi Z, Zhao L, Pei J, Tang F. Characterization of a novel thermostable and xylose-tolerant GH 39 β-xylosidase from Dictyoglomus thermophilum. BMC Biotechnol. 2018;18:29. [PubMed] [DOI] |
| 33. | Siddiqi MZ, Srinivasan S, Park HY, Im WT. Exploration and Characterization of Novel Glycoside Hydrolases from the Whole Genome of Lactobacillus ginsenosidimutans and Enriched Production of Minor Ginsenoside Rg3(S) by a Recombinant Enzymatic Process. Biomolecules. 2020;10. [PubMed] [DOI] |
| 34. | Shin KC, Oh DK. Classification of glycosidases that hydrolyze the specific positions and types of sugar moieties in ginsenosides. Crit Rev Biotechnol. 2016;36:1036-1049. [PubMed] [DOI] |
| 36. | 叶 德晓, 黄 佳俊, 卢 宇靖, 林 育成, 李 慧灵, 谭 景航, 周 金林. α-L-鼠李糖苷酶AnRhaE在毕赤酵母中的表达及应用. 食品与发酵工业. 2021;47:25-30. [DOI] |
| 37. | Zhang R, Zhang BL, Xie T, Li GC, Tuo Y, Xiang YT. Biotransformation of rutin to isoquercitrin using recombinant α-L-rhamnosidase from Bifidobacterium breve. Biotechnol Lett. 2015;37:1257-1264. [PubMed] [DOI] |
| 39. | 刘 易. 中成药中氰苷类有毒成分的筛查、定量测定和体外转化研究. 中国人民解放军军事医学科学院. 2016. |
| 40. | Hasegawa H, Sung JH, Matsumiya S, Uchiyama M. Main ginseng saponin metabolites formed by intestinal bacteria. Planta Med. 1996;62:453-457. [PubMed] [DOI] |
| 41. | Noh K, Kang Y, Nepal MR, Jeong KS, Oh DG, Kang MJ, Lee S, Kang W, Jeong HG, Jeong TC. Role of Intestinal Microbiota in Baicalin-Induced Drug Interaction and Its Pharmacokinetics. Molecules. 2016;21:337. [PubMed] [DOI] |
| 44. | 裴 雯雯, 曾 艳, 刘 娟娟, 张 建刚, 王 敏, 孙 媛霞. β-葡萄糖苷酶的枯草芽孢杆菌表达、酶学性质分析及其在宝藿苷Ⅰ制备中的应用. 食品工业科技. 2022;43:133-140. [DOI] |
| 45. | Xu Y, Feng X, Jia J, Chen X, Jiang T, Rasool A, Lv B, Qu L, Li C. A Novel β-Glucuronidase from Talaromyces pinophilus Li-93 Precisely Hydrolyzes Glycyrrhizin into Glycyrrhetinic Acid 3-O-Mono-β-d-Glucuronide. Appl Environ Microbiol. 2018;84. [PubMed] [DOI] |