修回日期: 2021-09-29
接受日期: 2021-12-20
在线出版日期: 2022-01-08
Hippo信号转导通路首先在果蝇体内被发现, 是一条高度保守、抑制细胞生长的信号通路. 其核心分子包括Hpo、Sav、Wts、Mats及下游效应因子YAP/TAZ, 在人类中有对应的同源类似物, 分别为哺乳动物STE20蛋白样激酶家族1/2(mammalian STE20 protein-like kinase 1/2, MST1/2)、萨尔瓦多家族1(salvatore family 1, SAVl)、大肿瘤抑制基因1/2激酶(large tumor suppressor gene 1/2 kinase, LATS1/2)和MOB激酶激活物1A/1B(mob kinase activator 1A/1B, MOB1A/1B). 当该通路失活时, 可促进癌细胞存活、增殖、侵袭性迁移和转移, 该过程可见于肝癌、肺癌、结直肠癌、乳腺癌、胰腺癌、以及黑素瘤和胶质瘤等多种癌症中, 可导致化疗、放疗或免疫治疗耐药的发生. 因此, 本文旨在综述Hippo信号通路对肝癌发生发展及治疗的影响, 以期为肝癌新的靶向疗法提供参考.
核心提要: Hippo信号通路是抑制细胞增殖的信号通路, 该通路失活与细胞增殖及肿瘤进展密切相关, 本文综述了Hippo信号通路对肝癌细胞增殖、自噬、转移、代谢重编程和肿瘤微环境的影响以及治疗的进展, 为肝癌的诊治提供新的思路.
引文著录: 唐惠仙, 易富珍, 黄赞松, 黄桂柳. Hippo信号通路与原发性肝癌发生发展及治疗研究进展. 世界华人消化杂志 2022; 30(1): 34-42
Revised: September 29, 2021
Accepted: December 20, 2021
Published online: January 8, 2022
The Hippo signal transduction pathway, first discovered in drosophila, is a highly conserved signaling pathway that inhibits cell growth. Its core molecules include Hpo, Sav, Wts, Mats, and downstream effector factor YAP/TAZ. Corresponding homologous analogs in humans are STE20 protein-like kinase 1/2, Salvatore family 1, large tumor suppressor gene 1/2 kinase, and MOB kinase activator 1A/1B. Inactivation of this pathway promotes the survival, proliferation, invasive migration, and metastasis of cancer cells. This process can be seen in liver cancer, lung cancer, colorectal cancer, breast cancer, pancreatic cancer, melanoma, glioma, and other cancers, which can lead to the occurrence of resistance to chemotherapy, radiotherapy, or immunotherapy. This paper aims to review the role of the Hippo signaling pathway in the occurrence, development, and treatment of liver cancer, in order to provide reference for new targeted therapies for liver cancer.
- Citation: Tang HX, Yi FZ, Huang ZS, Huang GL. Role of Hippo signaling pathway in occurrence, development, and treatment of primary hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2022; 30(1): 34-42
- URL: https://www.wjgnet.com/1009-3079/full/v30/i1/34.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v30.i1.34
原发性肝癌(primary carcinoma of the liver, PLC), 简称肝癌, 是指由肝细胞或肝内胆管细胞发生的癌肿, 其中超过90%的肝癌为肝细胞癌(hepatocellular carcinoma, HCC), 发病率呈明显上升趋势, 全球负担增加. 2020年全球肝癌新发病例905677例, 死亡病例830180例, 分别占癌症发病和死亡总数的4.7%和8.3%[1]. 尽管新的治疗方法不断出现, HCC患者的预后仍然非常差, 5年生存率低于15%[2], 目前国内外认为HCC发生发展是遗传、环境双重因素交互作用的结果, 但其确切致病机制仍未完全阐明, 因此, 对HCC发病机制和治疗的研究一直是肿瘤学者基础与临床研究的难点和热点. 迄今已有研究发现[3-6]: HCC的发生发展与多种信号通路的异常激活或抑制相关, 如 JAK/STAT信号通路、Wnt/β-catenin信号通路、Hedgehog信号通路、Hippo信号通路等, 其中Hippo信号通路的重要性逐渐被揭示. Hippo信号通路1994年在黑腹果蝇体内被发现, 故以果蝇STE20样激酶Hippo命名[7], 在进化上高度保守. Hippo信号通路除了参与早期胚胎发育、组织再生、器官大小调节等生长发育过程之外, 还参与调控包括HCC在内的多种肿瘤的发生发展[8,9]. 多项研究表明Hippo信号通路通过调节细胞增殖和凋亡来实现对器官的调控, 在哺乳动物器官大小的调控中至关重要. 在HCC发展过程中, 该通路可能在肿瘤起始细胞中失活, 使其逃脱周围正常组织的抑制, 从而允许克隆扩增和肿瘤发展. 在包括肝癌在内的几种人类癌症中已经发现Yes相关蛋白(yes-associated protein, YAP)或含PDZ结合基序的转录共激活因子(transcriptional coactivator with PDZ-binding motif, TAZ), 也称WWTR1的异常激活. Hippo信号通路的抑制或激活, 可使得YAP/TAZ的活性增强或减弱. 在小鼠模型中, YAP/TAZ在肝细胞中的激活导致肝癌发生表明YAP/TAZ是治疗人肝癌的潜在靶点. 本文就Hippo信号通路在肝癌发生发展中的多种调控机制及治疗进行综述, 介绍Hippo/YAP/TAZ在控制肝细胞增殖、自噬、转移和代谢中的作用.
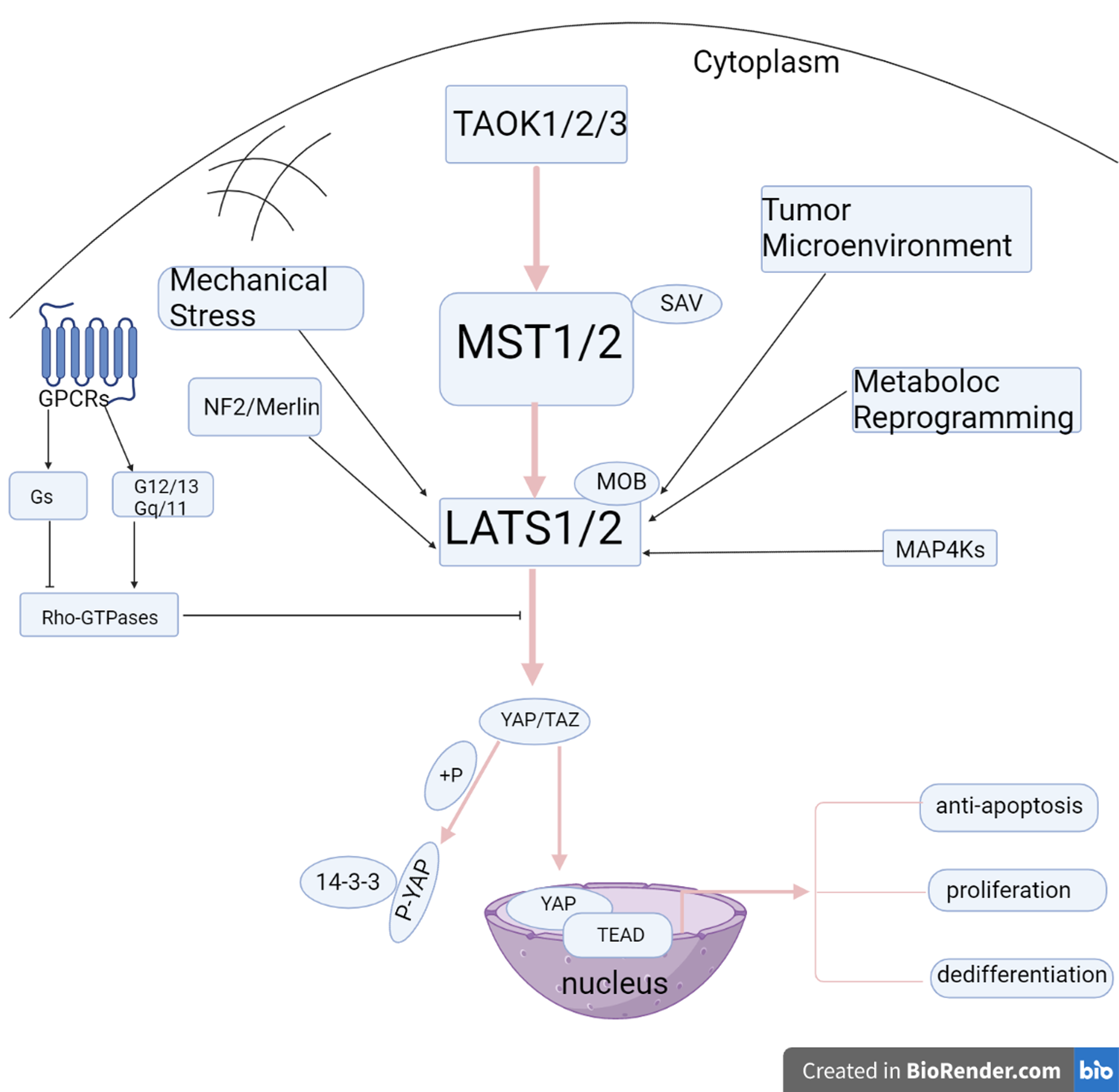
Hippo通路作为抑制果蝇组织生长的关键信号通路, 在20世纪末首次被发现, 在进化上高度保守, 调控细胞增殖、存活、分化及器官大小. 在果蝇中, 该通路核心成分包括Hpo和Wts的激酶级联, Hpo与支架蛋白Sav结合并激活Wts, Wts随后与其调节蛋白Mats形成复合物, 磷酸化转录共激活因子Yki, 促进Yki与14-3-3的相互作用并将其隔离在细胞质中. 相反, 当Hippo通路失活时, 未磷酸化的Yki易位到细胞核中, 与TEAD/TEF家族转录因子结合, 启动基因表达, 促进细胞存活和增殖. 在哺乳动物中, Hippo通路的核心成分为哺乳动物STE20蛋白样激酶家族1/2(mammalian STE20 protein-like kinase 1/2, MST1/2)、大肿瘤抑制基因1/2激酶(large tumor suppressor gene 1/2 kinase, LATS1/2)、萨尔瓦多家族1(salvatore family 1, SAVl)和MOB激酶激活物1A/1B(mob kinase activator 1A/1B, MOB1A/1B), SAV1能使MST1/2与LATS1/2在空间上彼此靠近, 以便MST1/2磷酸化LATS1/2, 而MOB1A/B能够使LATS1/2激酶活性增强, 下游效应因子包括YAP和TAZ.各核心激酶分子之间构成蛋白激酶级联反应转导通路[10]. Hippo通路激活后, LATS1/2介导YAP Ser127磷酸化, 磷酸化的YAP与14-3-3蛋白结合被隔离在细胞质中, 以依赖泛素-蛋白酶体的方式降解, 而未磷酸化的YAP与TEAD家族转录因子促进细胞增殖和器官生长. 除TEAD家族转录因子外, YAP/TAZ还与Smad、Runx1/2、p73、ErbB4、Pax3、T-box转录因子5等其他转录因子相互作用, 介导多种基因的转录. 但这些转录因子在介导Hippo信号转导中的生物学功能尚需进一步研究.
在HCC和胆管癌(cholangiocarcinoma, CCA)中, 已经观察到Hippo通路的YAP和TAZ的异常激活, 并与高进展和低分化的肿瘤类型相关, 导致HCC预后不良[11,12]. 在临床研究中, HCC患者中YAP的过表达与肿瘤分化(P = 0.02)和血清甲胎蛋白水平(alpha fetal protein, AFP)(P<0.001)呈正相关, 更重要的是, YAP是HCC患者无病生存期和总生存期的独立预测因子[13].
Hippo信号通路主要通过影响细胞增殖、转移、自噬、代谢重编程和免疫微环境参与HCC发生和发展(图1), 其抑癌作用主要是通过灭活YAP/TAZ实现的. Hippo信号通路核心激酶盒的分子活性受到抑制, 或各种因素导致YAP/TAZ入核增加均可促进肿瘤的发生. 目前以YAP/TAZ在HCC中作用的研究最为丰富, 对其他核心分子的研究也在逐渐展开.
从认识到Hippo通路可调控器官大小及增殖相关事件以来, 肝脏Hippo信号成分在肝脏大小和肿瘤形成中的作用已被广泛研究. 该通路上游调控因子如NF2、TAOK或者通路中主要的抑癌基因如Mst1/2或Lats1/2的失活、肝脏特异性过表达YAP均可导致肝脏肿大和肿瘤形成, 而降低YAP/TAZ水平可以挽救Hippo通路失活所致的肝肿瘤, 表明YAP/TAZ激活介导了HCC的发生[14].
过去多项研究证明Hippo信号受物理因素的调控, 如细胞外基质(extracellular matrix, ECM)刚度、液体剪切力、细胞密度、细胞骨架等[15]. ECM沉积增加导致基质刚度增加, 促进肝纤维化和肝硬化, 基质刚度增加也是HCC发生的一个强有力的预测指标[16]. 慢性肝纤维化的高硬度环境通过促进细胞增殖、间充质表型和化疗耐药促进HCC进展. 相反, 柔软的生理环境会诱导干细胞休眠和减弱克隆能力[17]. 液体剪切力是流体粘度和剪切速率的乘积, 是流动液体中细胞应力的一个重要参数, HCC部分切除后由于门静脉压力增加, 剪切应力发生显著变化, 激活YAP/TAZ[18], 促进再生增殖[19]. 此外, 在Song等[20]的研究中, 通过构建条件性工具小鼠与Alb-Cre小鼠杂交, 在Cre酶作用下, 子代小鼠肝细胞特异性缺失Mst1和Mst2, 导致HCC和CCA形成. 而Nf2或Lats1/2缺失所致的肝脏肿瘤使肝脏出现同时具有HCC和肝内胆管细胞癌特征, 提示Hippo通路中不同成分的缺失与肝细胞的命运相关, 决定肝脏肿瘤类型[21].
胆汁酸(bile acid, BAs)作为信号分子在肝脏再生和肿瘤促进中发挥重要作用, 在HCC中水平升高. Moore的研究小组发现[22], 由于调节BAs稳态的胆汁酸受体和小异质二聚体伴侣缺失导致YAP激活, 肝祖细胞增殖, 发生自发性HCC.
乙型肝炎病毒(hepatitis B virus, HBV)在HCC的发生发展中起着重要作用, 研究表明, YAP在HBV感染肝癌HepG2.2.15细胞株和肝癌组织乙肝病毒X蛋白(hepatitis B virus X protein, HBx)中的表达显著升高, YAP启动子的232/+115区域包含环磷酸腺苷反应元件结合蛋白(cyclic adenosine phosphate response element binding protein, CREB)元件, HBx与该区域结合后以CREB依赖的方式激活YAP启动子, 进而影响HCC细胞的增殖[23].
细胞分化蛋白SEPT6是GTP结合蛋白家族的成员, 在真核生物中高度保守, 调控多种生物学功能, 包括细胞分裂和细胞迁移等, 在包括肝癌在内的多种肿瘤中表达上调. Fan等[24]的研究首次证实SEPT6过表达可促进cyclin D1、MMP2的表达, 促进HCC细胞增殖和G1/S过渡. 其上调可能通过抑制LATS1的磷酸化使Hippo信号失活, 从而抑制YAP磷酸化, YAP蛋白被转位到细胞核, 导致基因转录增强, 促进HCC的增殖.
微小RNA(micro RNAs, miRNAs)是一种小型非编码RNA, 主要通过促进mRNA降解来沉默靶基因的表达. miRNA-375通过抑制内源性YAP蛋白水平, 从而抑制HCC细胞的增殖和侵袭[25]. Xin等[26]通过miR-135b模拟剂和抑制剂处理肝癌SMMC7721细胞, 结果显示miR-135b模拟剂通过靶向MST1的30-UTR沉默MST1的表达, 而miR-135b抑制剂增加了MST1蛋白的表达. miR-135b下调磷酸化的LATS1和YAP, miR-135b抑制剂则发挥相反的作用. 在Lu等[27]的研究中发现, miR-1254的上调通过降低PAX5使Hippo-YAP信号通路失活, 从而促进HCC细胞增殖、侵袭和迁移.
自噬与肝脏代谢相关, 在慢性肝损伤中自噬受损, 导致细胞成分清除减少, 线粒体和细胞完整性失调[28]. 自噬在癌症中有双重作用, 在肿瘤启动过程中, 自噬去除受损的细胞器和活性氧, 以维持基因组的稳定, 促进癌基因诱导的衰老, 从而抑制恶性转化. 在晚期肿瘤和转移瘤中, 自噬可能促进肿瘤细胞在低营养条件和化疗诱导应激下生存. 已有研究证实[29]YAP通过增强自噬通量促进癌细胞存活, 自噬受损是YAP稳定和活性的潜在驱动因素, 慢性肝病中自噬受损为YAP活性增强与HCC发生提供了潜在基础. 在既往的研究中, 自噬缺乏的小鼠模型发生良性腺瘤和肝肿大, 这归因于p62/Sqstm1-Nrf2轴的激活[30]. 而在Lee[31] 的实验中, 通过对YAP进行免疫染色, 发现L-Atg7 KO的小鼠肝脏和从该小鼠分离的原代培养肝细胞中细胞质和细胞核YAP均增加. 该研究证实了YAP在L-Atg7 KO小鼠肝脏中积累并被激活, YAP可以通过自噬降解, 自噬受损的肝脏会导致YAP的核积累. YAP是自噬缺陷肝脏中组织重塑、祖细胞激活和HCC发生的重要下游介质.
转化生长因子β激活的LncRNA(lncRNA activated by transforming growth factor beta, lncRNA-ATB)是一种由转化生长因子β信号调控的lncRNA转录体, 通过竞争性结合MiR-200家族成员介导转化生长因子信号下游的上皮-间质转化(epithelial-mesenchymal transition, EMT). 最近, 有报道称[32]lncRNA-ATB在多种人类癌症中上调, 并发现在癌细胞中影响多种细胞功能, 包括自噬调节[33]. Wang等[34]的研究发现, 在肝癌细胞SMMC-7721和HepG2细胞中磷酸化的YAP(p-YAP)表达降低, lncRNA-ATB过表达诱导YAP从细胞质转位到细胞核, 表明lncRNA-ATB诱导YAP的核转位. 此外为了证实lncRNA-ATB是否通过激活YAP来促进自噬, 使用siRNA抑制YAP的表达, YAP敲低后可部分减弱lncRNA-ATB诱导的HCC细胞自噬, 表明lncRNA-ATB通过调节YAP激活来促进HCC细胞的自噬.
2.3.1 葡萄糖代谢: YAP/TAZ促进细胞生长和增殖需要高营养物质, 葡萄糖是能量的重要来源, 也是细胞代谢的基础. 研究表明[35], YAP通过将底物的糖异生能量消耗过程转向生长的合成代谢过程来重新编程细胞代谢. YAP可增强葡萄糖摄取和利用. 高迁移率组盒1(high mobility group box 1, HMGB1)是一种高度保守的非组蛋白染色体蛋白, 通过YAP/缺氧诱导因子1(hypoxia inducible factor, HIF1α)依赖的有氧糖酵解在HCC启动过程中发挥重要作用. YAP/TAZ通过抑制肝脏中G6PC和PEPCK的表达来调控胰高血糖素抑制糖异生的作用, 并为HCC细胞的生长和增殖提供能源[36]. YAP可以被去乙酰化酶(sirtuin1, SIRT1)去乙酰化, 增强YAP/TEAD4在HCC细胞中的关联和转录活性, 导致细胞生长和肿瘤形成[37]. YAP的靶基因胰岛素受体底物2(insulin receptor substrate 2, IRS2)是胰岛素信号通路的重要组成部分, YAP/TAZ复合物正向调节人HCC中IRS2的表达, 导致非酒精性脂肪肝(non-alcoholic fatty liver disease, NAFLD)和HCC[38]. O-GlcNAc糖基化是由O-GlcNAc转移酶催化的蛋白质翻译后修饰, 一项研究表明, 在高糖条件下, YAP在丝氨酸(S109)位点被O-GlcNAc糖基化, 阻止YAP-LATS相互作用, 从而激活YAP, 这对高糖诱导的HCC的发生至关重要[39,40].
2.3.2 脂肪酸代谢: 癌细胞需要高水平的脂质来维持它们的生长和增殖, 越来越多的证据表明, YAP/TAZ不仅被脂质代谢途径失调激活, 而且在癌症脂质代谢适应中发挥作用. 脂噬是脂滴的自噬降解过程, 最近的一项研究表明氧化低密度脂蛋白(oxidized low-density lipoprotein, oxLDL)脂噬与YAP激活和HCC进展有关[41]. 在肝脏中, 过量的营养供应会导致NAFLD, 异常脂质积累导致肝细胞炎症和死亡, 促进纤维化、肝硬化, 最终导致HCC. 在小鼠NAFLD模型和人类脂肪性肝炎样本中, 已经观察到YAP/TAZ水平的增加可以促进炎症、NAFLD和肿瘤的形成[42]. 此外, 游离脂肪酸超载诱导与冠状动脉疾病相关的连接蛋白(junction coronary artery disease, JCAD)显著高表达, JCAD过表达通过去磷酸化和促进YAP核转位来激活YAP转录, JCAD与LATS2激酶结构域结合, 抑制LATS2磷酸化YAP的能力, 进而激活YAP促进HCC细胞增殖[43]. 棕榈酸是常见的饱和脂肪酸, 可通过上调MST1抑制YAP, 从而抑制内皮细胞增殖、迁移和血管生成. 其机制为棕榈酸诱导线粒体损伤, 导致线粒体DNA(mitochondrial DNA, MTDNA)释放到细胞质, 进而诱导MST1转录[44].
2.3.3 氨基酸代谢: 在肿瘤中, Hippo通路与氨基酸代谢相互调节. 谷氨酰胺(glutamine, Gln)参与三羧酸循环(tricarboxylic acid cycle, TCA)的能量产生、分子的生物合成、氧化还原稳态的控制和细胞信号传导的调节, 增强Gln摄取和分解是癌细胞增殖和存活所必需的, YAP/TAZ通过上调参与Gln代谢的各种基因参与Gln代谢[45]. 有报道称, YAP/TAZ直接调控谷氨酰胺转运蛋白SLC38A1和SLC7A5在HCC中的表达, 而这些转运蛋白是YAP/TAZ介导HCC细胞增殖所必需的[46]. 同时, YAP/TAZ还与其他氨基酸的调控相关, 氨基酸的上调导致哺乳动物雷帕霉素靶点(mTOR)信号通路激活, mTOR通路通过抑制自噬、MST1和AMOTL2等多种机制控制YAP/TAZ活性[47].
肿瘤微环境主要由炎症细胞协调, 是肿瘤发生发展过程中不可或缺的参与者, 促进增殖、生存和迁移. 在大多数情况下, HCC是由慢性病毒性肝炎、代谢性肝病和酒精滥用引起的多种炎症反应发展而来. 来自循环单核细胞前体的巨噬细胞是参与炎症、纤维化和癌症进展的起始和维持的关键成分[48], 肿瘤相关巨噬细胞(tumor-associated macrophages, TAMs)分泌的因子被认为有助于肿瘤的起始和生长. Kim等[14]通过建立删除Mst1和Mst2基因肝癌模型, 发现肝细胞中Mst1和Mst2的基因缺失导致了HCC的发生, 在该模型中单核细胞趋化因子1(monocyte chemoattractant protein 1, Mcp1)的表达高水平上调, M1和M2混合表型巨噬细胞大量浸润, 巨噬细胞通过减少Mst1和Mst2的基因缺失显著降低了小鼠的肝炎和HCC的发展. 巨噬细胞在响应微环境信号时, 可获得两种不同的M1(经典)和M2(交替)表型, 表现出抑制或促进肿瘤的活性. M1型经典活化的特点是抗原呈递活性增高和产生IL-12及其他促炎细胞因子, 导致的Th1型免疫应答的启动, 对被吞噬的微生物和癌细胞表现出高的细胞毒性. M2型极化是在IL-4、IL-13、IL-10、糖皮质激素及toll样受体的激活下发生的, 可减少抗原呈递活性和一些细胞因子和趋化因子的表达(如IL-10和TGFβ). M2巨噬细胞激活Th2型免疫反应, 诱导血管生成和组织再生[49].
转移是HCC高复发和高死亡率的主要因素. 转移的发生通过多个步骤级联反应, 癌细胞首先获得迁移和侵袭的能力并从原发肿瘤中分离出来, 进入血液和淋巴管, 到达远处的组织和器官, 形成继发性肿瘤. 在包括肝癌在内的多种癌症类型的异种移植小鼠模型中, YAP/TAZ的过表达或激活可促进癌细胞转移的能力, 相反, YAP/TAZ的失活抑制了小鼠(肝癌)模型的转移[50]. 有研究表明[51]PDZ和LIM结构域蛋白1(PDLIM1)在HCC组织中显著下调时预示预后不良, 在机制上, PDLIM1竞争性地与细胞骨架交联蛋白ACTN4结合, 导致ACTN4与F-肌动蛋白(F-actin)分离, 防止F-actin过度生长, 相反, PDLIM1缺失诱导F-actin过度形成, 导致LATS1去磷酸化和YAP激活, 从而促进肝癌转移. 肝激酶B1(liver kinase B1, LKB1)是HCC中一个经常突变的抑癌因子, 在HCC细胞株中较正常肝细胞株相比降低, 提示其过表达降低了细胞的活力和侵袭性. Qiu等[52]的研究证实LKB1的缺失诱导了多种EMT标记蛋白的表达, 包括锌指E(E-box binding homeobox 1, ZEB1), ZEB1通过激活YAP促进HCC进展. 视网膜脱氢酶5(retinal dehydrogenase 5, RDH5)是一种重要的酶, 可抑制HCC细胞增殖, 在HCC组织中其表达明显下调, 其低表达与转移和预后差相关, 而过表达RDH5可通过逆转EMT过程来抑制转移, 抑制RDH5可以激活Hippo/YAP信号通路, 促进YAP入核, RDH5通过调节Hippo/YAP信号通路影响转移[53]. 卷曲蛋白2(frizzled2, FZD2)诱导的EMT可能是HCC转移和早期复发的关键步骤, 在Ou等[54]的研究中, 证实了HepG2细胞中FZD2过表达会抑制LATS1、MST1/2的表达水平, 激活YAP, 而FZD2敲低导致核YAP显著缺失. TAZ是Hippo信号通路中的关键效应因子, 在HCC组织和细胞系中过表达, 过表达与肝癌患者肝切除术后总生存率降低相关. TAZ敲低使E-cadherin表达的增加, N-钙粘蛋白、波形蛋白、Snail和Slug表达减少, 抑制基质金属蛋白酶-2、基质金属蛋白酶-9, 从而逆转EMT, 减少HCC细胞的迁移和侵袭[55]. miR-103通过直接抑制LATS2促进HCC转移和EMT, 并与增强的转移和不良结果相关[56]. 目前尚未发现Hippo信号通路对HCC转移影响的临床研究的报道.
Hippo信号通路的功能主要是由YAP/TAZ和相关转录因子TEAD1-4介导的, 可以在多个水平上被调节, 鉴于Hippo是一条抑制细胞增殖的信号通路, 抑制抑癌基因Lats、Mst可能会引起细胞增殖, 导致不良后果. 因此阻断Hippo信号主要通过干扰YAP/TAZ- TEAD的相互作用来实现. 迄今, 在临床已发现有一些药物也能影响Hippo信号通路, 从而起到抑癌作用. Liu和同事[57]发现卟啉家族化合物, 如维替泊芬(verteporfin, VP), 是一种用于消除与年龄相关的黄斑变性等疾病的眼内异常血管的光动力疗法的光敏剂, 新近发现能有效阻断YAP-TEAD相互作用, 但由于其蛋白毒性及较差的药代动力学, 临床上用于治疗HCC仍有限制. VP能够与YAP结合并改变其构象, 从而破坏YAP和TEAD之间的相互作用, 抑制下游靶基因转录. VP能够减轻由YAP过表达引起的小鼠肝过度生长, 提示维替泊芬作为YAP-TEAD抑制剂具有治疗HCC的潜力. Vgll4模拟肽可以与TEAD结合, 已被开发出来取代TEAD中的YAP[58]. 甲羟戊酸途径抑制剂, 包括他汀类药物、香叶酰香叶酰转移酶抑制剂(geranyl geranyl transferase inhibitor, GGTI)和唑来膦酸(zoledronic acid, ZA), 通过作用于Rho GTPase下游的激酶阻断YAP1/TAZ核定位[42], 端锚聚合酶抑制剂XAV939可阻断AMOT降解, 使YAP1定位于细胞质[59], 有资料显示[58]他汀类药物可抑制HCC细胞增殖, 以辛伐他汀和氟伐他汀的作用最强, 而普伐他汀无抑制作用. Higashi等[60]对29例的HCC切除术后患者进行了服用他汀类药物的随访观察, 结果除了普伐他汀以外的他汀类药物, 都能延长无瘤生存期. 蛋白激酶C抑制剂(protein kinase C inhibitor, PKCi)通过磷酸化AMOTs, 阻断其与YAP1的相互作用, 金诺芬是一种PKCi, 可以降低YAP的核定位[61]. 此外, 磷酸二酯酶抑制剂罗利普兰和异丁司特, 通过激活cAMP-PKA信号抑制YAP[62], 二甲双胍通过激活AMPK活化Lats、磷酸化YAP从而起到抑制YAP的作用[63].
靶向Hippo信号通路的药物也正在积极研发. Zhou等[64]设计了一种环状YAP样肽, 可直接靶向TEAD来阻断YAP-TEAD复合物的形成. 他们还构建了TEAD1点突变细胞系, 该突变可阻断YAP和TEAD1的结合, 然后使用TEAD1突变HCC细胞系在小鼠体内构建移植瘤模型, 结果发现突变组小鼠肿瘤明显较对照组小, 证明YAP与TEAD的结合对于YAP发挥致癌作用至关重要, 提示开发YAP与TEAD结合的抑制剂是一种有前途的抗肿瘤策略. CT-707是中国已批准进入Ⅱ期临床试验的一种多激酶抑制剂, 用于ALK阳性非小细胞肺癌患者. Zhu等[65]研究发现: CT-707能够促进YAP磷酸化、抑制YAP核易位, 从而抑制小鼠体内HCC的生长.
目前HCC的治疗方法主要有手术切除、局部消融、肝动脉化疗栓塞、肝移植及酪氨酸激酶抑制剂. 然而经过现有方法治疗后, 患者生存率仍不理想. 导致治疗效果不佳的重要原因之一是肿瘤细胞产生耐药性, 如索拉菲尼、瑞格菲尼能抑制细胞增殖, 诱导凋亡和抑制血管生成, 但因为HCC细胞易对其产生耐药性, 效果并不持久. Suemura等[66]研究发现: 敲减LATS2后, 瑞格菲尼处理过的HCC细胞凋亡减少, 抑制LATS2表达使YAP活性增加, 导致YAP下游凋亡抑制基因Bcl-xL和多耐药相关基因ABCB1表达增强, 促使HCC细胞对瑞格菲尼耐药.
YAP的表达水平与肝癌细胞对索拉非尼的敏感性有关, YAP表达下调提高了SK-Hep-1细胞对索拉非尼的敏感性, 而表达上调可以降低Hun7细胞对索拉非尼的敏感性, 索拉非尼一方面可通过抑制MAPK通路抑制肿瘤生长, 另一方面抑制肿瘤新生血管的形成, 使肿瘤细胞处于缺氧微环境中, 缺氧环境可刺激YAP表达升高, 活性增强, 导致肿瘤细胞增殖能力提高, 耐药形成[67]. Zhou等[68]发现: 在人肝癌5-氟尿嘧啶(5-fluorouracil, 5-FU)耐药细胞系 BEL/FU中, YAP表达上调, 并通过抑制活性氧(reactive oxygen species, ROS)产生, 维持mTOR的活化, 阻断自噬相关细胞死亡, 促进HCC细胞对5-FU和多柔比星产生耐药性. Chen等[69]的研究也发现: YAP能促进多柔比星耐药, 并且YAP靶基因ABCB1的表达增强. 这与YAP促进瑞格菲尼耐药的机制相似, 有可能是YAP诱导耐药过程中普遍存在的一种机制. 以上研究均提示Hippo信号通路与HCC细胞产生耐药性有关, 激活Hippo信号通路可能会促进耐药逆转, 提高对药物的敏感性.
Hippo信号通路及其效应蛋白YAP/TAZ对肝脏稳态和HCC的发生发展至关重要. 通过对文献的梳理发现, 在肝再生过程中, Hippo信号关闭, 不仅允许细胞增殖, 还允许细胞存活、去分化, 干细胞和祖细胞的扩张; Hippo通路和/或YAP/TAZ的异常调控导致HCC发生, 细胞增殖和肿瘤不受控制; Hippo信号通路有望成为HCC治疗靶点, 但目前针对该通路的治疗药物并不多; 总的来说, 虽然我们对其分子调控机制、Hippo信号组成有了更深入的了解, 但仍有许多未知因素; 随着研究的深入将继续扩大我们对Hippo信号成分的理解, 并可能为HCC的治疗提供新的治疗选择, 改善HCC患者预后.
学科分类: 胃肠病学和肝病学
手稿来源地: 广西壮族自治区
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C, C
D级 (一般): D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Sung H, Ferlay J, Siegel RL, Laversanne M, Soerjomataram I, Jemal A, Bray F. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021;71:209-249. [PubMed] [DOI] |
| 3. | Dimri M, Satyanarayana A. Molecular Signaling Pathways and Therapeutic Targets in Hepatocellular Carcinoma. Cancers (Basel). 2020;12. [PubMed] [DOI] |
| 7. | Justice RW, Zilian O, Woods DF, Noll M, Bryant PJ. The Drosophila tumor suppressor gene warts encodes a homolog of human myotonic dystrophy kinase and is required for the control of cell shape and proliferation. Genes Dev. 1995;9:534-546. [PubMed] [DOI] |
| 8. | Yu FX, Zhao B, Guan KL. Hippo Pathway in Organ Size Control, Tissue Homeostasis, and Cancer. Cell. 2015;163:811-828. [PubMed] [DOI] |
| 9. | Lu L, Finegold MJ, Johnson RL. Hippo pathway coactivators Yap and Taz are required to coordinate mammalian liver regeneration. Exp Mol Med. 2018;50:e423. [PubMed] [DOI] |
| 10. | Harvey KF, Zhang X, Thomas DM. The Hippo pathway and human cancer. Nat Rev Cancer. 2013;13:246-257. [PubMed] [DOI] |
| 11. | Guo Y, Pan Q, Zhang J, Xu X, Liu X, Wang Q, Yi R, Xie X, Yao L, Liu W, Shen L. Functional and clinical evidence that TAZ is a candidate oncogene in hepatocellular carcinoma. J Cell Biochem. 2015;116:2465-2475. [PubMed] [DOI] |
| 12. | Weiler SME, Pinna F, Wolf T, Lutz T, Geldiyev A, Sticht C, Knaub M, Thomann S, Bissinger M, Wan S, Rössler S, Becker D, Gretz N, Lang H, Bergmann F, Ustiyan V, Kalin TV, Singer S, Lee JS, Marquardt JU, Schirmacher P, Kalinichenko VV, Breuhahn K. Induction of Chromosome Instability by Activation of Yes-Associated Protein and Forkhead Box M1 in Liver Cancer. Gastroenterology. 2017;152:2037-2051.e22. [PubMed] [DOI] |
| 13. | Xu MZ, Yao TJ, Lee NP, Ng IO, Chan YT, Zender L, Lowe SW, Poon RT, Luk JM. Yes-associated protein is an independent prognostic marker in hepatocellular carcinoma. Cancer. 2009;115:4576-4585. [PubMed] [DOI] |
| 14. | Kim W, Khan SK, Liu Y, Xu R, Park O, He Y, Cha B, Gao B, Yang Y. Hepatic Hippo signaling inhibits protumoural microenvironment to suppress hepatocellular carcinoma. Gut. 2018;67:1692-1703. [PubMed] [DOI] |
| 15. | Liu S, Martin JF. The regulation and function of the Hippo pathway in heart regeneration. Wiley Interdiscip Rev Dev Biol. 2019;8:e335. [PubMed] [DOI] |
| 16. | Suh B, Park S, Shin DW, Yun JM, Yang HK, Yu SJ, Shin CI, Kim JS, Ahn E, Lee H, Park JH, Cho B. High liver fibrosis index FIB-4 is highly predictive of hepatocellular carcinoma in chronic hepatitis B carriers. Hepatology. 2015;61:1261-1268. [PubMed] [DOI] |
| 17. | Schrader J, Gordon-Walker TT, Aucott RL, van Deemter M, Quaas A, Walsh S, Benten D, Forbes SJ, Wells RG, Iredale JP. Matrix stiffness modulates proliferation, chemotherapeutic response, and dormancy in hepatocellular carcinoma cells. Hepatology. 2011;53:1192-1205. [PubMed] [DOI] |
| 18. | Sabine A, Bovay E, Demir CS, Kimura W, Jaquet M, Agalarov Y, Zangger N, Scallan JP, Graber W, Gulpinar E, Kwak BR, Mäkinen T, Martinez-Corral I, Ortega S, Delorenzi M, Kiefer F, Davis MJ, Djonov V, Miura N, Petrova TV. FOXC2 and fluid shear stress stabilize postnatal lymphatic vasculature. J Clin Invest. 2015;125:3861-3877. [PubMed] [DOI] |
| 19. | Michalopoulos GK. Liver regeneration after partial hepatectomy: critical analysis of mechanistic dilemmas. Am J Pathol. 2010;176:2-13. [PubMed] [DOI] |
| 20. | Song H, Mak KK, Topol L, Yun K, Hu J, Garrett L, Chen Y, Park O, Chang J, Simpson RM, Wang CY, Gao B, Jiang J, Yang Y. Mammalian Mst1 and Mst2 kinases play essential roles in organ size control and tumor suppression. Proc Natl Acad Sci USA. 2010;107:1431-1436. [PubMed] [DOI] |
| 21. | Lee DH, Park JO, Kim TS, Kim SK, Kim TH, Kim MC, Park GS, Kim JH, Kuninaka S, Olson EN, Saya H, Kim SY, Lee H, Lim DS. LATS-YAP/TAZ controls lineage specification by regulating TGFβ signaling and Hnf4α expression during liver development. Nat Commun. 2016;7:11961. [PubMed] [DOI] |
| 22. | Anakk S, Bhosale M, Schmidt VA, Johnson RL, Finegold MJ, Moore DD. Bile acids activate YAP to promote liver carcinogenesis. Cell Rep. 2013;5:1060-1069. [PubMed] [DOI] |
| 23. | Zhang T, Zhang J, You X, Liu Q, Du Y, Gao Y, Shan C, Kong G, Wang Y, Yang X, Ye L, Zhang X. Hepatitis B virus X protein modulates oncogene Yes-associated protein by CREB to promote growth of hepatoma cells. Hepatology. 2012;56:2051-2059. [PubMed] [DOI] |
| 24. | Fan Y, Du Z, Ding Q, Zhang J, Op Den Winkel M, Gerbes AL, Liu M, Steib CJ. SEPT6 drives hepatocellular carcinoma cell proliferation, migration and invasion via the Hippo/YAP signaling pathway. Int J Oncol. 2021;58. [PubMed] [DOI] |
| 25. | Liu AM, Poon RT, Luk JM. MicroRNA-375 targets Hippo-signaling effector YAP in liver cancer and inhibits tumor properties. Biochem Biophys Res Commun. 2010;394:623-627. [PubMed] [DOI] |
| 26. | Xin Y, Yang X, Xiao J, Zhao W, Li Y, Lu L, He X, Zhan M. MiR-135b promotes HCC tumorigenesis through a positive-feedback loop. Biochem Biophys Res Commun. 2020;530:259-265. [PubMed] [DOI] |
| 27. | Lu X, Yang C, Hu Y, Xu J, Shi C, Rao J, Yu W, Cheng F. Upregulation of miR-1254 promotes Hepatocellular Carcinoma Cell Proliferation, Migration, and Invasion via Inactivation of the Hippo-YAP signaling pathway by decreasing PAX5. J Cancer. 2021;12:771-789. [PubMed] [DOI] |
| 28. | Ueno T, Komatsu M. Autophagy in the liver: functions in health and disease. Nat Rev Gastroenterol Hepatol. 2017;14:170-184. [PubMed] [DOI] |
| 29. | Song Q, Mao B, Cheng J, Gao Y, Jiang K, Chen J, Yuan Z, Meng S. YAP enhances autophagic flux to promote breast cancer cell survival in response to nutrient deprivation. PLoS One. 2015;10:e0120790. [PubMed] [DOI] |
| 30. | Haga S, Yimin, Ozaki M. Relevance of FXR-p62/SQSTM1 pathway for survival and protection of mouse hepatocytes and liver, especially with steatosis. BMC Gastroenterol. 2017;17:9. [PubMed] [DOI] |
| 31. | Lee YA, Noon LA, Akat KM, Ybanez MD, Lee TF, Berres ML, Fujiwara N, Goossens N, Chou HI, Parvin-Nejad FP, Khambu B, Kramer EGM, Gordon R, Pfleger C, Germain D, John GR, Campbell KN, Yue Z, Yin XM, Cuervo AM, Czaja MJ, Fiel MI, Hoshida Y, Friedman SL. Autophagy is a gatekeeper of hepatic differentiation and carcinogenesis by controlling the degradation of Yap. Nat Commun. 2018;9:4962. [PubMed] [DOI] |
| 32. | Xiao H, Zhang F, Zou Y, Li J, Liu Y, Huang W. The Function and Mechanism of Long Non-coding RNA-ATB in Cancers. Front Physiol. 2018;9:321. [PubMed] [DOI] |
| 33. | Sun T. Long noncoding RNAs act as regulators of autophagy in cancer. Pharmacol Res. 2018;129:151-155. [PubMed] [DOI] |
| 34. | Wang CZ, Yan GX, Dong DS, Xin H, Liu ZY. LncRNA-ATB promotes autophagy by activating Yes-associated protein and inducing autophagy-related protein 5 expression in hepatocellular carcinoma. World J Gastroenterol. 2019;25:5310-5322. [PubMed] [DOI] |
| 35. | Plouffe SW, Meng Z, Lin KC, Lin B, Hong AW, Chun JV, Guan KL. Characterization of Hippo Pathway Components by Gene Inactivation. Mol Cell. 2016;64:993-1008. [PubMed] [DOI] |
| 36. | Hu Y, Shin DJ, Pan H, Lin Z, Dreyfuss JM, Camargo FD, Miao J, Biddinger SB. YAP suppresses gluconeogenic gene expression through PGC1α. Hepatology. 2017;66:2029-2041. [PubMed] [DOI] |
| 37. | Mao B, Hu F, Cheng J, Wang P, Xu M, Yuan F, Meng S, Wang Y, Yuan Z, Bi W. SIRT1 regulates YAP2-mediated cell proliferation and chemoresistance in hepatocellular carcinoma. Oncogene. 2014;33:1468-1474. [PubMed] [DOI] |
| 38. | Straßburger K, Tiebe M, Pinna F, Breuhahn K, Teleman AA. Insulin/IGF signaling drives cell proliferation in part via Yorkie/YAP. Dev Biol. 2012;367:187-196. [PubMed] [DOI] |
| 39. | Peng C, Zhu Y, Zhang W, Liao Q, Chen Y, Zhao X, Guo Q, Shen P, Zhen B, Qian X, Yang D, Zhang JS, Xiao D, Qin W, Pei H. Regulation of the Hippo-YAP Pathway by Glucose Sensor O-GlcNAcylation. Mol Cell. 2017;68:591-604.e5. [PubMed] [DOI] |
| 40. | Zhang X, Qiao Y, Wu Q, Chen Y, Zou S, Liu X, Zhu G, Zhao Y, Chen Y, Yu Y, Pan Q, Wang J, Sun F. The essential role of YAP O-GlcNAcylation in high-glucose-stimulated liver tumorigenesis. Nat Commun. 2017;8:15280. [PubMed] [DOI] |
| 41. | Bhat KP, Salazar KL, Balasubramaniyan V, Wani K, Heathcock L, Hollingsworth F, James JD, Gumin J, Diefes KL, Kim SH, Turski A, Azodi Y, Yang Y, Doucette T, Colman H, Sulman EP, Lang FF, Rao G, Copray S, Vaillant BD, Aldape KD. The transcriptional coactivator TAZ regulates mesenchymal differentiation in malignant glioma. Genes Dev. 2011;25:2594-2609. [PubMed] [DOI] |
| 42. | Sorrentino G, Ruggeri N, Specchia V, Cordenonsi M, Mano M, Dupont S, Manfrin A, Ingallina E, Sommaggio R, Piazza S, Rosato A, Piccolo S, Del Sal G. Metabolic control of YAP and TAZ by the mevalonate pathway. Nat Cell Biol. 2014;16:357-366. [PubMed] [DOI] |
| 43. | Shu Z, Gao Y, Zhang G, Zhou Y, Cao J, Wan D, Zhu X, Xiong W. A functional interaction between Hippo-YAP signalling and SREBPs mediates hepatic steatosis in diabetic mice. J Cell Mol Med. 2019;23:3616-3628. [PubMed] [DOI] |
| 44. | Matés JM, Di Paola FJ, Campos-Sandoval JA, Mazurek S, Márquez J. Therapeutic targeting of glutaminolysis as an essential strategy to combat cancer. Semin Cell Dev Biol. 2020;98:34-43. [PubMed] [DOI] |
| 45. | Xie SC, Zhang JQ, Jiang XL, Hua YY, Xie SW, Qin YA, Yang YJ. LncRNA CRNDE facilitates epigenetic suppression of CELF2 and LATS2 to promote proliferation, migration and chemoresistance in hepatocellular carcinoma. Cell Death Dis. 2020;11:676. [PubMed] [DOI] |
| 46. | Janse van Rensburg HJ, Azad T, Ling M, Hao Y, Snetsinger B, Khanal P, Minassian LM, Graham CH, Rauh MJ, Yang X. The Hippo Pathway Component TAZ Promotes Immune Evasion in Human Cancer through PD-L1. Cancer Res. 2018;78:1457-1470. [PubMed] [DOI] |
| 47. | Dasari VR, Mazack V, Feng W, Nash J, Carey DJ, Gogoi R. Verteporfin exhibits YAP-independent anti-proliferative and cytotoxic effects in endometrial cancer cells. Oncotarget. 2017;8:28628-28640. [PubMed] [DOI] |
| 48. | Noy R, Pollard JW. Tumor-associated macrophages: from mechanisms to therapy. Immunity. 2014;41:49-61. [PubMed] [DOI] |
| 49. | Novikova MV, Khromova NV, Kopnin PB. Components of the Hepatocellular Carcinoma Microenvironment and Their Role in Tumor Progression. Biochemistry (Mosc). 2017;82:861-873. [PubMed] [DOI] |
| 50. | Wang J, Rouse C, Jasper JS, Pendergast AM. ABL kinases promote breast cancer osteolytic metastasis by modulating tumor-bone interactions through TAZ and STAT5 signaling. Sci Signal. 2016;9:ra12. [PubMed] [DOI] |
| 51. | Huang Z, Zhou JK, Wang K, Chen H, Qin S, Liu J, Luo M, Chen Y, Jiang J, Zhou L, Zhu L, He J, Li J, Pu W, Gong Y, Li J, Ye Q, Dong D, Hu H, Zhou Z, Dai L, Huang C, Wei X, Peng Y. PDLIM1 Inhibits Tumor Metastasis Through Activating Hippo Signaling in Hepatocellular Carcinoma. Hepatology. 2020;71:1643-1659. [PubMed] [DOI] |
| 52. | Qiu B, Wei W, Zhu J, Fu G, Lu D. EMT induced by loss of LKB1 promotes migration and invasion of liver cancer cells through ZEB1-induced YAP signaling. Oncol Lett. 2018;16:6465-6471. [PubMed] [DOI] |
| 53. | Hu H, Xu L, Luo SJ, Xiang T, Chen Y, Cao ZR, Zhang YJ, Mo Z, Wang Y, Meng DF, Yu L, Lin LZ, Zhang SJ. Retinal dehydrogenase 5 (RHD5) attenuates metastasis via regulating HIPPO/YAP signaling pathway in Hepatocellular Carcinoma. Int J Med Sci. 2020;17:1897-1908. [PubMed] [DOI] |
| 54. | Ou H, Chen Z, Xiang L, Fang Y, Xu Y, Liu Q, Hu Z, Li X, Huang Y, Yang D. Frizzled 2-induced epithelial-mesenchymal transition correlates with vasculogenic mimicry, stemness, and Hippo signaling in hepatocellular carcinoma. Cancer Sci. 2019;110:1169-1182. [PubMed] [DOI] |
| 55. | Xiao H, Jiang N, Zhou B, Liu Q, Du C. TAZ regulates cell proliferation and epithelial-mesenchymal transition of human hepatocellular carcinoma. Cancer Sci. 2015;106:151-159. [PubMed] [DOI] |
| 56. | Han LL, Yin XR, Zhang SQ. miR-103 promotes the metastasis and EMT of hepatocellular carcinoma by directly inhibiting LATS2. Int J Oncol. 2018;53:2433-2444. [PubMed] [DOI] |
| 57. | Liu-Chittenden Y, Huang B, Shim JS, Chen Q, Lee SJ, Anders RA, Liu JO, Pan D. Genetic and pharmacological disruption of the TEAD-YAP complex suppresses the oncogenic activity of YAP. Genes Dev. 2012;26:1300-1305. [PubMed] [DOI] |
| 58. | Jiao S, Wang H, Shi Z, Dong A, Zhang W, Song X, He F, Wang Y, Zhang Z, Wang W, Wang X, Guo T, Li P, Zhao Y, Ji H, Zhang L, Zhou Z. A peptide mimicking VGLL4 function acts as a YAP antagonist therapy against gastric cancer. Cancer Cell. 2014;25:166-180. [PubMed] [DOI] |
| 59. | Troilo A, Benson EK, Esposito D, Garibsingh RA, Reddy EP, Mungamuri SK, Aaronson SA. Angiomotin stabilization by tankyrase inhibitors antagonizes constitutive TEAD-dependent transcription and proliferation of human tumor cells with Hippo pathway core component mutations. Oncotarget. 2016;7:28765-28782. [PubMed] [DOI] |
| 60. | Higashi T, Hayashi H, Kitano Y, Yamamura K, Kaida T, Arima K, Taki K, Nakagawa S, Okabe H, Nitta H, Imai K, Hashimoto D, Chikamoto A, Beppu T, Baba H. Statin attenuates cell proliferative ability via TAZ (WWTR1) in hepatocellular carcinoma. Med Oncol. 2016;33:123. [PubMed] [DOI] |
| 61. | Wang Y, Justilien V, Brennan KI, Jamieson L, Murray NR, Fields AP. PKCι regulates nuclear YAP1 localization and ovarian cancer tumorigenesis. Oncogene. 2017;36:534-545. [PubMed] [DOI] |
| 62. | Yu FX, Zhang Y, Park HW, Jewell JL, Chen Q, Deng Y, Pan D, Taylor SS, Lai ZC, Guan KL. Protein kinase A activates the Hippo pathway to modulate cell proliferation and differentiation. Genes Dev. 2013;27:1223-1232. [PubMed] [DOI] |
| 63. | Zhao Y, Yang X. The Hippo pathway in chemotherapeutic drug resistance. Int J Cancer. 2015;137:2767-2773. [PubMed] [DOI] |
| 64. | Zhou Z, Hu T, Xu Z, Lin Z, Zhang Z, Feng T, Zhu L, Rong Y, Shen H, Luk JM, Zhang X, Qin N. Targeting Hippo pathway by specific interruption of YAP-TEAD interaction using cyclic YAP-like peptides. FASEB J. 2015;29:724-732. [PubMed] [DOI] |
| 65. | Zhu H, Wang DD, Yuan T, Yan FJ, Zeng CM, Dai XY, Chen ZB, Chen Y, Zhou T, Fan GH, Ying M, Cao J, Luo P, Liu XJ, Hu Y, Peng Y, He Q, Yang B. Multikinase Inhibitor CT-707 Targets Liver Cancer by Interrupting the Hypoxia-Activated IGF-1R-YAP Axis. Cancer Res. 2018;78:3995-4006. [PubMed] [DOI] |
| 66. | Suemura S, Kodama T, Myojin Y, Yamada R, Shigekawa M, Hikita H, Sakamori R, Tatsumi T, Takehara T. CRISPR Loss-of-Function Screen Identifies the Hippo Signaling Pathway as the Mediator of Regorafenib Efficacy in Hepatocellular Carcinoma. Cancers (Basel). 2019;11. [PubMed] [DOI] |
| 68. | Zhou Y, Wang Y, Zhou W, Chen T, Wu Q, Chutturghoon VK, Lin B, Geng L, Yang Z, Zhou L, Zheng S. YAP promotes multi-drug resistance and inhibits autophagy-related cell death in hepatocellular carcinoma via the RAC1-ROS-mTOR pathway. Cancer Cell Int. 2019;19:179. [PubMed] [DOI] |
| 69. | Chen M, Wu L, Tu J, Zhao Z, Fan X, Mao J, Weng Q, Wu X, Huang L, Xu M, Ji J. miR-590-5p suppresses hepatocellular carcinoma chemoresistance by targeting YAP1 expression. EBioMedicine. 2018;35:142-154. [PubMed] |