修回日期: 2021-02-16
接受日期: 2021-03-15
在线出版日期: 2021-05-08
原发性腹膜后肿瘤多为恶性肿瘤, 其病因多种多样. 分级、切除范围和肿瘤完整性等参数已被证明影响预后.
探索影响原发性腹膜后肿瘤手术患者术后生存的危险因素.
73例腹膜后肿瘤根治性手术的患者分为无瘤生存组(47例)、复发死亡组(26例). 收集并分析影响患者术后无瘤生存的因素, 包括年龄、肿瘤长径、淋巴结转移、首发症状、肿瘤类型、肿瘤分化程度以及是否合并其他系统疾病等.
原发性腹膜后肿瘤术后5年无瘤生存率为64.4% (47/73). 对影响原发性腹膜后肿瘤术后无瘤生存率的因素进行单因素分析结果显示: 年龄(P<0.05), 肿瘤长径(P<0.05), 淋巴结转移(P<0.05), 首发症状(P<0.05), 肿瘤类型(P<0.05), 肿瘤分化程度(P<0.05)共6项因素与腹膜后肿瘤术后无瘤生存率相关. 多因素Cox回归分析结果提示首发症状(P<0.05)以及肿瘤类型(P<0.05)影响腹膜后肿瘤患者术后无瘤生存率的独立危险因素.
首发症状以及肿瘤类型是影响腹膜后肿瘤患者术后无瘤生存率的关键.
核心提要: 由于腹膜后肿瘤发病率低, 临床症状不典型, 术后5年存活率低, 在疾病诊断及治疗上均有一定的困难. 为此, 本研究总结了影响PRT手术患者生存率的危险因素以期为临床治疗提供指导意义.
引文著录: 郭丽娜, 李云超, 孙占峰, 闫海洋, 李辉, 王月明. 影响原发性腹膜后肿瘤手术患者预后的危险因素分析. 世界华人消化杂志 2021; 29(9): 461-466
Revised: February 16, 2021
Accepted: March 15, 2021
Published online: May 8, 2021
Primary retroperitoneal tumors are mostly malignancies with a variety of etiologies. Parameters such as tumor grade, range of resection, and tumor integrity have been shown to influence prognosis.
To identify the risk factors for postoperative survival in patients undergoing primary retroperitoneal tumor surgery.
Seventy-three patients undergoing radical retroperitoneal tumor surgery were divided into a tumor-free survival group (47 cases) and a recurrence-caused death group (26 cases). Factors affecting patients' tumor-free survival after surgery were collected and analyzed, including age, tumor long diameter, lymph node metastasis, first symptom, tumor type, tumor differentiation degree, and complication with other systemic diseases.
The 5-year tumor-free survival rate for primary retroperitoneal tumors was 64.4% (47/73). Single factor analysis showed that age (P < 0.05), tumor long diameter (P < 0.05), lymph node metastasis (P < 0.05), first symptom (P < 0.05), tumor type (P < 0.05), and tumor differentiation degree (P < 0.05) were significantly associated with retroperitoneal tumor surgery disease-free survival rate. Multivariate Cox regression analysis indicated that first symptom (P < 0.05) and tumor type (P < 0.05) were independent risk factors affecting postoperative tumor-free survival in retroperitoneal tumor patients.
First symptom and tumor type are the key factors affecting the postoperative tumor-free survival of retroperitoneal tumor patients.
- Citation: Guo LN, Li YC, Sun ZF, Yan HY, Li H, Wang YM. Risk factors influencing prognosis of patients undergoing primary retroperitoneal tumor surgery. Shijie Huaren Xiaohua Zazhi 2021; 29(9): 461-466
- URL: https://www.wjgnet.com/1009-3079/full/v29/i9/461.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v29.i9.461
原发性腹膜后肿瘤(primary retroperitoneal tumor, PRT)主要来源于腹膜后间隙的脂肪、疏松结缔组织、筋膜、肌肉、血管、神经、淋巴组织以及胚胎残留组织. PRT组织学类型繁多, 按组织学来源可分为: (1)间叶组织肿瘤; (2)神经原性肿瘤; (3)泌尿生殖脊残余囊癌; (4)胚胎残余组织; (5)来源不明或不能分类. PRT以恶性肿瘤为主, 约占80%. PRT中儿童以畸胎瘤和神经母细胞癌多见, 成人以神经源性良性肿瘤、平滑肌肉瘤多见[1]. 由于腹膜后解剖位置的特殊性, 腹膜后肿瘤患者的临床表现多不典型, 不易早期明确诊断. 手术完全切除肿瘤是PRT的唯一有可能根治的治疗方法, 包括开腹手术和腹腔镜手术. 由于PRT发病率低, 临床症状不典型, 术后5年存活率低, 在疾病诊断及治疗上均有一定的困难. 为此, 本研究总结了影响PRT手术患者生存率的危险因素以期为临床治疗提供指导意义.
2010-10/2015-10期间, 根据纳入和排除标准筛选出本院PRT住院行根治性手术的患者73例. 纳入标准: 入院时明确腹膜后肿瘤诊断, 手术根治性切除, 术后病理明确为原发性腹膜后肿瘤, 非腹膜后器官来源或转移至腹膜后的肿瘤, 全部病例无手术禁忌症行开腹或腹腔镜手术治疗, 全部病例住院病历资料完整, 全部术后73例完成随访并取得知情同意. 排除标准: 术后病理为腹膜后器官来源, 术后病理为转移至腹膜后的肿瘤, 既往长期心肺慢性疾病, 不能耐受手术, 在随访过程中失访、退出或更改治疗方案的患者. 根据随访将5年内没有肿瘤复发和死亡的患者分为无瘤生存组(47例), 将5年内出现复发、二次手术和死亡的患者分为复发死亡组(26例).
73例PRT根治手术患者术前诊断通过影像学检查明确, 并由术中所见和术后病理证实. 所有两组病例资料经详细统计并行标准化后录入电子计算机数据库. 以PRT术后结局(生存或复发死亡)为因变量. 以对结局可能影响因素包括性别, 年龄, BMI, 手术方式, 肿瘤部位, 肿瘤分化程度, 肿瘤病理类型, 肿瘤分期, 手术时间, 肿瘤长径, CEA, CA19-9, 吸烟史, 饮酒史, 是否合并其他系统疾病, 是否淋巴结转移, 是否远处转移, 手术类型(开放手术或者腹腔镜手术)等18项为自变量. 其中包括术前影响因素及术后影响因素. 术前影响因素主要根据病例病史, 体格检查及辅助检查等统计得到, 包括年龄, BMI指数, 吸烟史, 饮酒史及合并其他系统疾病等因素. 术后影响因素主要依据患者术中所见, 手术记录和肿瘤病理等资料统计得到等因素.
统计学处理 采用SPSS 17.0软件进行统计学分析. 患者生存分析采用Kaplan-Meier法及Log Rank检验, 计量数据用均数±标准差(mean±SD)表示, 采用单因素分析方法, 计数资料用百分比表示, 行χ2检验, 将单因素分析有统计学意义(P<0.05)的因素进行多因素Cox回归分析, 分析得出影响腹膜后肿瘤术后无瘤生存率的独立危险因素.
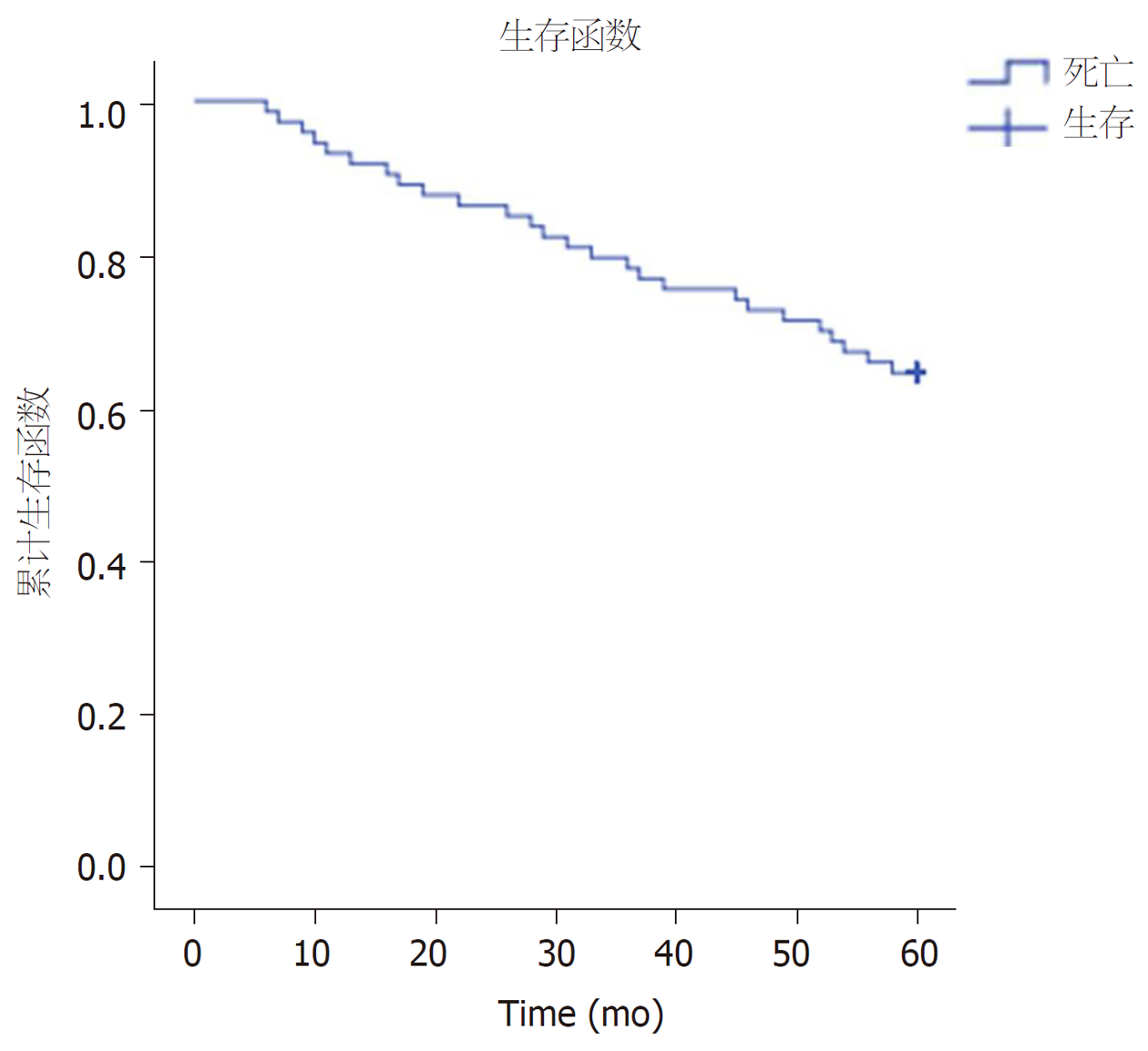
通过5年的术后随访, 73例PRT患者术后平均生存(50±17)个月, 其中1年生存率为93.2% (68/73), 3年生存率为78.1% (57/73), 5年生存率为64.4% (47/73) (图1).
根据PRT患者术后5年随访一般资料(表2, 表3), 无瘤生存组中男性22例, 女性28例; 年龄21-79岁, 平均年龄(55.9±10.5)岁; 术后病理诊断结果显示良性肿瘤患者26例, 恶性肿瘤患者21例. 复发死亡组PTH正常组中男性15例, 女性16例; 年龄 20-78岁, 平均年龄(50.6±11.9)岁; 术后病理诊断结果显示良性肿瘤患者2例, 恶性肿瘤患者24例. 全组资料中良性肿瘤(神经鞘瘤8/28、浆液性囊腺瘤3/28、囊肿3/28等)28例, 恶性肿瘤(脂肪肉瘤17/45、平滑肌肉瘤4/45、粘液肉瘤4/45等)45例. 具体病理类型见表1. 通过组间比较, 两组患者在性别、体重指数、吸烟史、饮酒史、CEA、CA19-9、是否远处转移、手术类型、合并其他疾病之间比较有差异(P>0.05) (见表2). 而两组患者在年龄、肿瘤长径、淋巴结转移、首发症状、肿瘤分化程度和肿瘤类型之间存在差异(P<0.05) (表3).
| 良性肿瘤 | 例数 | 恶性肿瘤 | 例数 |
| 神经鞘瘤 | 8 | 脂肪肉瘤 | 17 |
| 节细胞神经瘤 | 2 | 平滑肌肉瘤 | 5 |
| 副神经节瘤 | 1 | 血管肉瘤 | 1 |
| 神经纤维瘤 | 2 | 纤维肉瘤 | 2 |
| 脂肪瘤 | 2 | 粘液肉瘤 | 4 |
| Castleman病 | 2 | 滑膜肉瘤 | 1 |
| 特发性纤维化 | 1 | 横纹肌肉瘤 | 1 |
| 浆液性囊腺瘤 | 3 | 混合脂肪肉瘤 | 3 |
| 腺肌病 | 1 | 多形性肉瘤 | 2 |
| 孤立性纤维性肿瘤 | 1 | 淋巴瘤 | 2 |
| 梭形细胞肿瘤 | 2 | 恶性纤维母细胞瘤 | 4 |
| 囊肿 | 3 | 粘液囊腺癌 | 3 |
| 因素 | 无瘤生存组(47) | 复发死亡组(26) | t/χ2值 | P值 |
| 性别(n) | χ2 = 0.15 | 0.7 | ||
| 男 | 22 | 15 | ||
| 女 | 28 | 16 | ||
| BMI (n) | χ2 = 2.477 | 0.29 | ||
| ≥24 | 15 | 7 | ||
| 18.5≤BMI<24 | 15 | 13 | ||
| <18.5 | 17 | 6 | ||
| 吸烟史(n) | χ2 = 0.003 | 0.956 | ||
| 有 | 25 | 14 | ||
| 无 | 22 | 12 | ||
| 饮酒史(n) | χ2 = 1.537 | 0.215 | ||
| 有 | 27 | 11 | ||
| 无 | 20 | 15 | ||
| CEA (ng/mL) | 10.17±2.16 | 11.19±2.78 | t = 1.741 | 0.086 |
| CA19-9 (U/mL) | 80.33±17.57 | 88.07±16.15 | t = 1.854 | 0.068 |
| 远处转移(n) | χ2 = 2.024 | 0.155 | ||
| 是 | 5 | 6 | ||
| 否 | 42 | 20 | ||
| 手术类型(n) | χ2 = 1.217 | 0.27 | ||
| 开放手术 | 19 | 14 | ||
| 腹腔镜手术 | 28 | 12 | ||
| 合并其他疾病(n) | 无瘤生存组 | 复发死亡组 | χ2 = 2.321 | 0.128 |
| 有 | 22 | 17 | ||
| 无 | 25 | 9 |
| 组别 | 无瘤生存组47 | 复发死亡组26 | t/χ2值 | P |
| 年龄(岁) | 55.9±10.5 | 50.6±11.9 | 2.148 | 0.032 |
| 肿瘤长径(cm) | 11.123 | 0.001 | ||
| ≥5 cm | 17 | 20 | ||
| <5 cm | 30 | 6 | ||
| 淋巴转移(n) | 9.842 | 0.002 | ||
| 是 | 13 | 17 | ||
| 否 | 34 | 9 | ||
| 首发症状(n) | 11.414 | 0.003 | ||
| 腹部肿块 | 16 | 13 | ||
| 腹痛腹胀 | 12 | 12 | ||
| 体检发现 | 19 | 1 | ||
| 肿瘤分化程度(n) | 13.277 | <0.05 | ||
| 高-中分化 | 28 | 4 | ||
| 低-差分化 | 19 | 22 | ||
| 肿瘤类型(n) | 16.059 | <0.05 | ||
| 良性肿瘤 | 26 | 2 | ||
| 恶性肿瘤 | 21 | 24 |
将上述单因素分析得到的年龄、肿瘤长径、淋巴结转移、首发症状、肿瘤类型、肿瘤分化共6项有统计学意义的因素作为自变量进行多因素Cox回归分析结果首发症状及肿瘤类型为影响PRT术后无瘤生存率的独立危险因素(表4).
| 变量 | 偏回归系数 | 标准误 | 相对危险度 | P值 |
| 年龄 | 0.005 | 0.021 | 0.067 | 0.796 |
| 肿瘤直径 | -1.518 | 1.136 | 1.787 | 0.181 |
| 淋巴结转移 | -0.710 | 0.980 | 0.526 | 0.000 |
| 首发症状 | -2.565 | 0.689 | 13.867 | 0.000 |
| 肿瘤类型 | 6.424 | 1.486 | 18.867 | 0.000 |
| 肿瘤分化 | 0.995 | 0.905 | 1.210 | 0.271 |
在本研究中, 通过随访原发性腹膜后肿瘤术后患者的生存情况, 无瘤生存组与复发死亡组相比, 首发症状, 淋巴结转移以及肿瘤类型是影响腹膜后肿瘤患者术后无瘤生存率的关键. 由于腹膜后间隙位置较深, 缺乏骨性结构及实质性的边缘, 空间的可扩张性使得腹膜后肿瘤患者临床表现多不典型. 腹膜后肿瘤多生长缓慢, 发生远处转移者极少, 这种特性决定了腹膜后肿瘤在长大到一定程度时方出现临床症状[2]. 辅助检查对腹膜后肿瘤的患者诊断有很大帮助, 随着人们健康意识的上升以及体格检查的普遍性, 往往能及早发现肿瘤, 这对腹膜后肿瘤的初步诊断以及决定手术方式具有重要意义[3]. 本研究体检发现患者19例(26%), 且体检发现肿瘤的患者比出现疾病症状就诊的患者表现出更高的生存率(95% vs 53%).
由于腹膜后组织的组成繁杂, 导致腹膜后肿瘤病理类型的多样性, 大体上可分为来源于间叶组织、神经组织、生殖胚胎源性组织以及来源不明的肿瘤四类[4]. 按照生物学行为分为良性肿瘤、恶性肿瘤和交界性肿瘤, 以恶性肿瘤居多, 82%的原发性腹膜后肿瘤为恶性, 18%为良性; 大多数腹膜后肿瘤为恶性, 本组恶性肿瘤占62%, 低于国外文献报道水平[5]. 原发性腹膜后肿瘤种类繁多, 文献报道以脂肪组织肿瘤、恶性纤维组织细胞瘤及神经源性肿瘤最常见[6]. 本研究统计结果依次是脂肪源性肿瘤、神经源性肿瘤、平滑肌肉瘤, 与文献报道基本相同. 腹膜后肉瘤的患者大部分都会复发, 因肿瘤死亡患者中, 75%都与复发有关[7]. 有研究表明, 局部复发灶的大小、病灶生长速度以及原发灶的病理类型、病理学级别是影响腹膜后肉瘤局部复发患者预后的独立因素[8].
原发性腹膜后肿瘤诊治专家共识中指出, 目前尚无证据证实辅助化疗对完整切除的腹膜后肉瘤患者有益. 但在晚期或转移性软组织肉瘤的姑息性治疗方法中, 化疗的作用也越来越受临床医师重视. 随着对脂肪肉瘤分子学突变机制的不断研究, 新型的靶向药物逐渐走入人们的视野. 与传统非特异性细胞毒性化疗相反, 这些新疗法大部分是针对特定的、异常遗传和分子途径的靶向药物. 如与DNA小沟结合, 针对FUS-CHOP基因融合型黏液性脂肪肉瘤的曲贝替定, 微管抑制剂甲磺酸艾瑞布林, p53-MDM2抑制剂RG7112、RG7388等靶向药物的出现为RPLPS患者摆脱反复外科手术的疾苦带来希望[9-11].
综上所述, 原发性腹膜后肿瘤因其腹膜后间隙位置特殊、临床表现不典型, 体检及早发现腹膜后肿瘤对患者预后有重要意义. 治疗以外科手术切除治疗为主, 肿瘤的病理类型是指导手术方案的关键.
Cox回归分析了73例原发性腹膜后肿瘤(primary retroperitoneal tumor, PRT)患者的各项因素, 结果得出首发症状及肿瘤类型为影响PRT术后无瘤生存率的独立危险因素. 首发症状的出现意味着更低的生存率, 因此, 本研究体现了体检对PRT患者预后的重要意义. 由于腹膜后肿瘤发病率低, 临床症状不典型, 术后5年存活率低, 在疾病诊断及治疗上均有一定的困难.
本研究总结了影响PRT手术患者生存率的危险因素以期为临床治疗提供指导意义.
探索影响PRT手术患者术后生存的危险因素.
对在本院接受治疗并诊断为PRT并接受肿瘤切除的的73例患者进行回顾性研究,来评估患者术后无瘤生存的独立危险因素.
PRT术后5年无瘤生存率为64.4% (47/73). 年龄、肿瘤长径、淋巴结转移、首发症状、肿瘤类型和肿瘤分化程度与PRT术后无瘤生存率相关, 并且, 首发症状和肿瘤类型是影响PRT术后无瘤生存率的独立危险因素.
首发症状以及肿瘤类型是影响PRT患者术后无瘤生存率的关键.
随着对PRT分子学突变机制的不断研究, 新型的靶向药物逐渐走入人们的视野.这些针对特定的、异常遗传和分子途径靶向药物的新疗法, 有望为PRT患者摆脱反复外科手术的疾苦带来希望.
学科分类: 胃肠病学和肝病学
手稿来源地: 天津市
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): D
E级 (差): 0
科学编辑: 刘继红 制作编辑:张砚梁
| 1. | 陈 锐, 吴 涵潇, 余永伟 吕晨, 孙 颖浩, 冯 翔. 腹膜后占位的病理诊断-单中心大样本腹膜后占位分析. 临床与实验病理学杂志. 2020;36:842-844. [DOI] |
| 2. | Lou J, Moten AS, Reddy SS, Howell KJ, Movva S, von Mehren M, Farma JM. Retroperitoneal Sarcomas: Does Laterality Matter? J Surg Res. 2019;244:34-41. [PubMed] [DOI] |
| 4. | Kim MK, Im CM, Oh SH, Kwon DD, Park K, Ryu SB. Unusual presentation of right-side accessory spleen mimicking a retroperitoneal tumor. Int J Urol. 2008;15:739-740. [PubMed] [DOI] |
| 5. | Garcia-Ortega DY, Villa-Zepeda O, Martinez-Said H, Cuellar-Hübbe M, Luna-Ortiz K. Oncology outcomes in Retroperitoneal sarcomas: Prognostic factors in a Retrospective Cohort study. Int J Surg. 2016;32:45-49. [PubMed] [DOI] |
| 6. | Leão P, Vilaça S, Oliveira M, Falcão J. Giant recurrent retroperitoneal liposarcoma initially presenting as inguinal hernia: Review of literature. Int J Surg Case Rep. 2012;3:103-106. [PubMed] [DOI] |
| 7. | Strauss DC, Hayes AJ, Thomas JM. Retroperitoneal tumours: review of management. Ann R Coll Surg Engl. 2011;93:275-280. [PubMed] [DOI] |
| 8. | Park JO, Qin LX, Prete FP, Antonescu C, Brennan MF, Singer S. Predicting outcome by growth rate of locally recurrent retroperitoneal liposarcoma: the one centimeter per month rule. Ann Surg. 2009;250:977-982. [PubMed] [DOI] |
| 9. | Lewis JJ, Leung D, Woodruff JM, Brennan MF. Retroperitoneal soft-tissue sarcoma: analysis of 500 patients treated and followed at a single institution. Ann Surg. 1998;228:355-365. [PubMed] [DOI] |
| 10. | Blay JY, Casali P, Nieto A, Tanović A, Le Cesne A. Efficacy and safety of trabectedin as an early treatment for advanced or metastatic liposarcoma and leiomyosarcoma. Future Oncol. 2014;10:59-68. [PubMed] [DOI] |
| 11. | Ding Q, Zhang Z, Liu JJ, Jiang N, Zhang J, Ross TM, Chu XJ, Bartkovitz D, Podlaski F, Janson C, Tovar C, Filipovic ZM, Higgins B, Glenn K, Packman K, Vassilev LT, Graves B. Discovery of RG7388, a potent and selective p53-MDM2 inhibitor in clinical development. J Med Chem. 2013;56:5979-5983. [PubMed] [DOI] |