修回日期: 2020-11-25
接受日期: 2020-12-25
在线出版日期: 2021-02-08
由于缺乏食管早期诊断、转移复发检测和预后判断的高效生物标志物, 导致食管鳞癌晚期确诊,生存率低. lncRNA HOTAIR在癌组织中一致高表达,并且与肿瘤的发生发展有关, 但其在血清中的研究较少.
探讨lncRNA HOTAIR在健康志愿者和食管鳞癌血清中的表达差异及其临床意义.
采用RT-qPCR分别检测48例健康志愿者血清、48例食管鳞癌初治患者血清及其配对癌组织中lncRNA HOTAIR表达水平. 秩和检验分析健康志愿者和食管鳞癌患者血清中HOTAIR表达水平及其差异性; 受试者工作曲线(receiver operating characteristic, ROC)对血清lncRNA HOTAIR诊断效能进行评价; 食管鳞癌患者血清与其配对癌组织中表达水平相关性采用Spearman分析.
lncRNA HOTAIR在食管鳞癌患者血清中表达水平显著高于健康志愿者, P = 0.0099, ROC曲线下面积为0.8618, 敏感度为0.7612, 特异度为0.9091, 截断值为14.4670, 提示血清中lncRNA HOTAIR表达水平对食管鳞癌的诊断敏感度和特异度均较满意; 食管鳞癌患者血清与其配对癌组织中lncRNA HOTAIR的表达水平呈正相关(rs = 0.3920, P = 0.0124); 其与食管鳞癌患者临床病理因素相关性的研究发现, 伴远处转移食管癌患者血清HOTAIR表达水平显著高于无转移者P = 0.003; 伴随TNM分期渐晚, lncRNA HOTAIR表达水平逐渐升高, 具有等级相关性, P = 0.011.
血清lncRNA HOTAIR及其动态变化有望成为食管鳞癌患者早期诊断、判断病情严重程度, 预测治疗效果及预后生物学指标.
核心提要: lncRNA HOTAIR在食管鳞癌患者血清中高表达, 与健康志愿者相比具有显著差异; 同时, 患者血清与其配对组织中lncRNA HOTAIR表达和不同病理分期具有显著相关性, 推断lncRNA HOTAIR可作为食管鳞癌患者诊断生物学标志物.
引文著录: 达春丽, 刘凯, 孙伟. lncRNA HOTAIR在食管鳞癌患者血清中的表达及其意义. 世界华人消化杂志 2021; 29(3): 125-130
Revised: November 25, 2020
Accepted: December 25, 2020
Published online: February 8, 2021
Due to the lack of effective biomarkers for early diagnosis, detection of metastasis, recurrence, and prognosis of esophageal squamous cell carcinoma (ESCC), the survival rate of this malignancy is low. The long non-coding RNA (lncRNA) HOTAIR is highly expressed in cancer tissues and is related to tumor occurrence and development, however, it has been rarely studied in serum.
To investigate the clinical significance of serum lncRNA HOTAIR in patients with ESCC.
Serum samples from 48 healthy volunteers and 48 patients with ESCC and cancer tissues from the patients were collected to detect the expression of HOTAIR by RT-qPCR. Differences in lncRNA HOTAIR expression levels in serum of both healthy volunteers and patients with ESCC were analyzed by the rank-sum test. Spearman correlation analysis was used to analyze the correlation between serum HOTAIR expression levels and clinicopathological factors in ESCC patients.
The expression level of lncRNA HOTAIR in the serum of patients with ESCC was significantly higher than that of healthy volunteers (P = 0.0099). Using a cutoff value of 14.4670, the sensitivity and specificity of serum HOTAIR for diagnosis of ESCC were 0.7612 and 0.9091, respectively; the area under the ROC curve was 0.8618. Serum levels of HOTAIR in patients with ESCC were positively correlated with its expression levels in matched carcinoma tissues (rS = 0.3920, P = 0.0124). Serum lncRNA HOTAIR expression level was significantly higher in patients with distant metastasis than in those without (P = 0.003). With the increase in TNM stage, the expression level of HOTAIR increased gradually, showing a hierarchical correlation (P = 0.011).
The serum lncRNA HOTAIR and its dynamic changes are expected to be used for early diagnosis, severity rassessment, and therapeutic effect and prognosis prediction in patients with ESCC.
- Citation: Da CL, Liu K, Sun W. Significance of expression of lncRNA HOTAIR in serum of patients with esophageal squamous cell carcinoma. Shijie Huaren Xiaohua Zazhi 2021; 29(3): 125-130
- URL: https://www.wjgnet.com/1009-3079/full/v29/i3/125.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v29.i3.125
食管癌是中国常见的高发恶性肿瘤之一, 其病理类型主要是食管鳞状细胞癌(esophageal squamous cell carcinoma, ESCC)和食管腺癌(esophagus adenous cancer, EAC), 其中ESCC占90%以上, 大多数食管鳞癌患者早期临床症状不明显, 在确诊时往往已是局部晚期, 或伴有淋巴结及远处转移, 缺乏有效的早期诊断和治疗手段, 五年生存率不超过30%[1]. 因此对食管鳞癌的早期或预后预测的研究尤为重要.
长链非编码RNA(long non-coding RNA, lncRNAs)是一类长度约为200个核苷酸[2], 且不表现任何蛋白编码潜能, 以RNA的形式在多种层面(表观遗传学、转录水平、转录后水平)上调控基因表达, 在个体发育及肿瘤发生、侵袭、转移及化疗抵抗过程中起着重要作用[3,4]. HOX转录反义RNA(HOX transcript antisense intergenic RNA, HOTAIR)因其在几乎所有癌症中均有显著且一致的上调表达, 成为引起研究者们广泛关注的长链非编码RNA之一[5,6]. 在生理条件下, lncRNA HOTAIR是人体内重要的反式转录调控基因表达的lncRNA, 可作用于靶mRNA, 抑制HOX的转录或翻译[7], 近年来, 多项研究指出, lncRNA HOTAIR在口腔癌[8]、结直肠癌[9]、肺癌[10]等多种肿瘤组织中高表达, 并与肿瘤的发展过程密切相关, 推测其可作为肿瘤诊断、预后评估的生物标志物和肿瘤治疗的靶点. 近年来有研究发现, lncRNA HOTAIR不止存在于肿瘤组织, 其在乳腺癌[11]和宫颈癌[12]患者血清中表达水平显著高于健康志愿者, 并且发现伴随术后体内肿瘤负荷下降, 其血清中lncRNA HOTAIR表达水平对癌症的预测及病情动态检测可能具有指导意义. 本课题组已有对lncRNA HOTAIR在食管鳞癌组织表达显著高于其配对癌旁组织的研究结果, 其可能在食管鳞癌发生过程中可能起到重要作用[13], 但未对HOTAIR在食管鳞癌血清中表达水平进行研究, 本文在前期研究基础上, 对食管鳞癌患者、健康志愿者外周血及食管鳞癌患者组织中lncRNA HOTAIR的表达差异进行研究对比分析, 以期更好地了解lncRNA HOTAIR在食管鳞癌患者诊断中潜在的应用价值, 为其作为食管鳞癌临床诊断分子生物学标志物提供可参考的临床数据.
1.1.1 研究对象: 收集我院胸外科及我科2018-05/2020-03间收治的首诊食管鳞癌患者; 所有患者无合并其它部位原发恶性肿瘤或其它严重疾病; 治疗前均完成影像学检查; 提取血液学标本前均未行任何抗肿瘤治疗; 均经手术或内窥镜取得病理组织, 并经两位以上高年资病理教授阅片病理确诊为食管鳞癌.
1.1.2 排除标准: 排除伴严重其它疾病以及合并其他肿瘤者. 收集到48例食管鳞癌患者中, 男性37例, 女性11例; 年龄为30-73岁, 中位年龄60岁; 收集患者临床病理资料、临床分期根据第8版TNM分期, 原发肿瘤分期(T1+T2)10例, (T3+T4)38例, 伴区域淋巴结转移28例, 无淋巴结转移20例; 伴远处转移(M)分期8例, 无远处转移40例; 肿瘤发生部位上段10例, 中下段38例; Ⅰ+Ⅱ期10例, Ⅲ期30例, Ⅳ期8例. 另外, 同时收集来我院见刊体检的健康志愿者血清标本48例, 所有健康志愿者既往体检, 取血前或取血时没有任何肿瘤病史, 也没有其它已知的严重疾病病史. 所有参与者外周血标本收集离心后用 1.5 mL离心管收集上清并做好标记, 后立即储存在-80 ℃冰箱备用. 组织学标本收集后立即暂存液氮罐后转入-80 ℃冰箱保存待测. 所有参与者(包括所有患者及健康志愿者), 均于提取标本前获知并签署知情同意书, 本研究经医院伦理委员会审核通过.
1.1.3 试剂与设备: 血清RNA提取试剂盒(Qiagen217184), Trizol(美国 Invitrogen), 反转录试剂盒PrimeScriptTM RT Master Mix和TB GreenTM Premix Ex TaqTM Ⅱ 均购自Takara公司, 引物由上海生工合成, ABI7500 Fast实时荧光定量PCR仪(美国 Applied Biosystems).
1.2 方法 实时荧光定量PCR(RT-qPCR)检测血清及组织中lncRNA HOTAIR表达水平. 提取血清及组织中总RNA并采用反转录试剂盒将RNA反转录为cDNA, 按照TB Green Ⅱ试剂说明配制反应体系并进行PCR扩增, 25 μL反应体系: TB Green Ⅱ (2×) 12.5 μL, cDNA 2.0 μL, 正反向引物各1.0 μL, ddH2O 7.0 μL. HOTAIR引物 F: 5'-GCCTTTCCCTGCTACTTGTG-3', R: 5'-GGCTGGACCTTTGCTTCTATG-3'; GAPDH引物 F: 5'-GCACCGTCAAGGCTGAGAAC-3', R: 5'- TGGTGAAGACGCCAGTGGA-3'. PCR反应程序为: 预变性95 ℃ 1 min; 95 ℃ 15 s, 60 ℃ 15 s, 72 ℃ 15 s, 共40个循环. lncRNA HOTAIR以GAPDH为内参基因, 所得数据Ct值采用2-ΔΔCt算法计算HOTAIR的相对表达量.
统计学处理 文中所有数据采用SPSS 17.0对数据进行统计分析, 因研究数不符合正态分布, 因此采用M(P25, P75)进行统计学描述, 两样本间比较采用Mann-Whiteney U秩和检验. 两组间比较也采用Mann-Whiteney U秩和检验; 三组间比较采用Kruskal-Wallis秩和检验. 血清lncRNA HOTAIR在食管癌患者中的诊断效能以受试者工作特征(receiver operating characteristics, ROC)曲线描述, 相关性采用Spearman相关分析. P<0.05为差异有统计学意义.
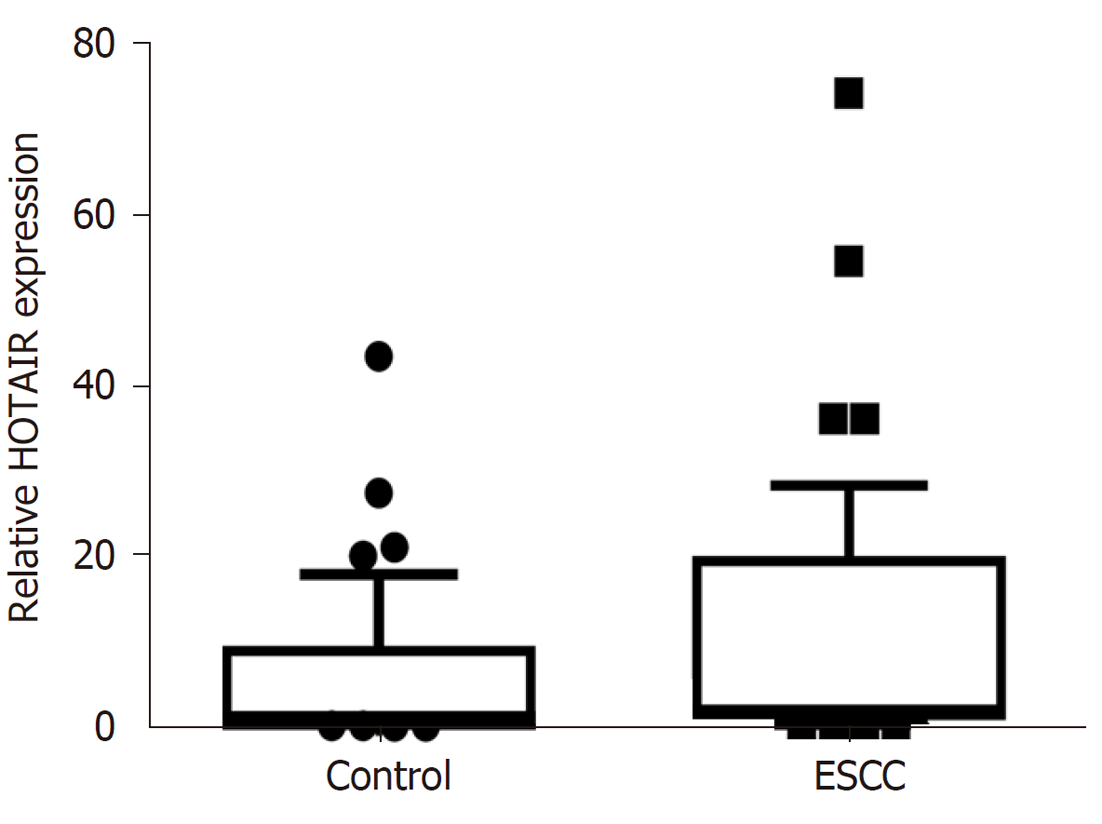
在食管鳞癌及健康志愿者血清中表达差异比较: lncRNA HOTAIR食管鳞癌患者血清中相对表达为1.947(0.738-19.892), 健康志愿者中为1.15(0.095-9.428), 其在食管鳞癌患者中的表达显著高于健康志愿者, 具有统计学意义P = 0.0099, 图1. 提示血清中lncRNA HOTAIR表达水平升高可能与食管鳞癌的发生发展有关.
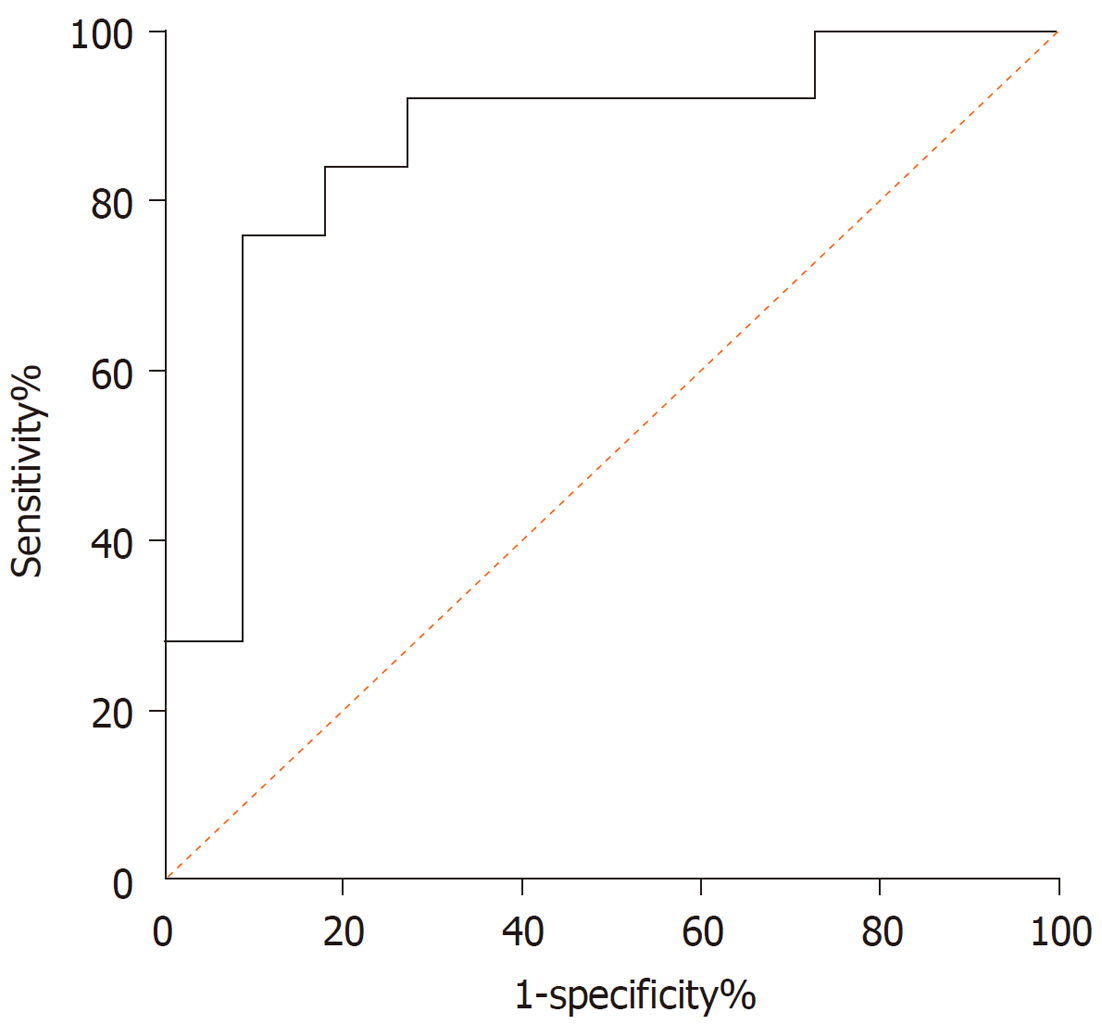
健康志愿者和食管鳞癌患者血清中lncRNA HOTAIR表达水平受试者工作曲线分析结果: ROC曲线下面积(area under the curves, AUC)为0.8618 (95%CI: 0.7831-0.9405, P<0.01), 敏感度为0.7612, 特异度为0.9091, 其截断值: 14.4670. 提示血清lncRNA HOTAIR表达水平对食管鳞癌的诊断敏感度和特异度均较满意, 见图2.
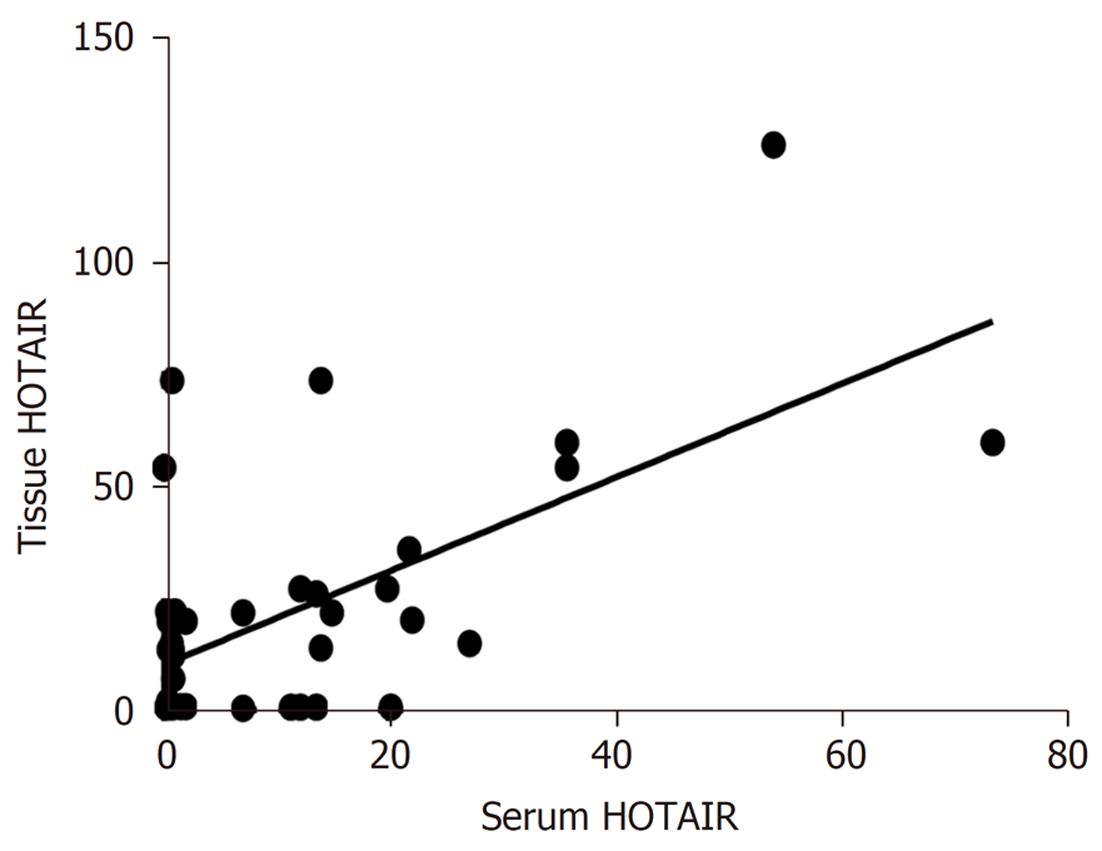
48例食管鳞癌组织lncRNA HOTAIR表达水平[14.94(0.8080, 27.22)]与其配对血清中lncRNA HOTAIR表达水平[1.447(0.7328, 14.70)]呈正相关, 相关系数rs = 0.3920, P = 0.0124, 见图3.
伴远处转移食管癌患者血清lncRNA HOTAIR表达水平显著高于无转移组 [20.86(4.44, 25.94) vs 0.85(0.72, 14.00)], 差异有统计学意义, P = 0.0003; 随TNM分期逐渐变晚, 血清lncRNA HOTAIR表达水平[0.83(0.73, 12.84) vs 1.40(0.68, 15.47) vs 20.86(4.44, 25.94)]逐渐升高, lncRNA HOTAIR表达水平与患者TNM分期显著正相关, P = 0.011. 另外发现, HOTAIR表达水平与肿瘤浸润深度(P = 0.0797)、淋巴结转移(P = 0.0671)之间有正相关的趋势, 但尚未见统计学意义. 食管鳞癌患者血清中lncRNA HOTAIR的表达水平与患者性别、年龄、族别、肿瘤生长部位无显著相关性, 差异无统计学意义, 见表1.
| 组别 | 例数 | 2-△△CtM(P25, P75) | T/H | P值 | |
| 性别 | 250.5 | 0.6856 | |||
| 男性 | 37 | 1.95(0.75, 19.97) | |||
| 女性 | 11 | 3.93(0.68, 20.38) | |||
| 年龄 | 247 | 0.8524 | |||
| >60岁 | 32 | 4.49(0.74, 18.65) | |||
| ≤60岁 | 16 | 1.40(0.72, 20.13) | |||
| 组别 | 0.069 | 0.966 | |||
| 维族 | 16 | 3.93(0.63, 18.65) | |||
| 汉族 | 22 | 4.49(0.73, 20.38) | |||
| 哈族 | 10 | 1.40(0.73, 24.13) | |||
| T分期 | 120.5 | 0.0797 | |||
| T1+T2 | 10 | 0.77(0.60, 4.10) | |||
| T3+T4 | 38 | 9.59(0.75, 20.61) | |||
| N分期 | 192 | 0.0671 | |||
| 有 | 28 | 12.86(0.76, 22.05) | |||
| 无 | 20 | 0.83(0.62,13.21) | |||
| M分期 | 81 | 0.003 | |||
| 有 | 8 | 20.86(4.44, 25.94) | |||
| 无 | 40 | 0.85(0.72, 14.00) | |||
| 肿瘤部位 | 179.5 | 0.7995 | |||
| 上段 | 10 | 4.49(0.73, 19.97) | |||
| 中下段 | 38 | 1.45(0.74, 20.38) | |||
| TNM分期 | 9.03 | 0.011 | |||
| Ⅰ+Ⅱ | 10 | 0.83(0.73, 12.84) | |||
| Ⅲ | 30 | 1.40(0.68, 15.47) | |||
| Ⅳ | 8 | 20.86(4.44, 25.94) |
在恶性肿瘤细胞中, 某些特定的lncRNA的表达水平会发生明显改变, 在肿瘤发生、发展中可能通过参与细胞增生、分化、改变细胞侵袭性、转移性而参与肿瘤发生、发展过程, 进而影响肿瘤患者的病情及后期放化疗效果[14,15].
越来越多的证据表明, lncRNA HOTAIR在多种肿瘤中表达升高, 其可能是癌症发生、发展中的一种致癌的驱动因素, 并可能成为预测患者对治疗反应性及预后的重要生物学指标[13,16,17]. 刘艳华等[18]通过qRT-PCR对乳腺癌与乳腺良性结节患者血清lncRNA HOTAIR的对比研究发现, 其在癌组织与其外周血中表达水平均显著高于良性结节患者, 认为lncRNA HOTAIR水平可作为乳腺癌早期诊断的潜在标记物. Wang等人[19]也通过qRT-PCR研究食管鳞癌患者与健康志愿者血清中HOTAIR表达水平, 发现食管鳞癌患者血清中lncRNA HOTAIR表达水平显著高于健康组, 且术后1 mo较术前患者血清中lncRNA HOTAIR显著降低, 认为血清lncRNA HOTAIR不但可作为癌症早期诊断的标记物, 而且可能成为动态监测病情变化的生物学标志. 但是, lncRNA作为循环肿瘤标志物在食管鳞癌的研究尚处于初级阶段. 鉴于本课题组前期的研究中已发现食管鳞癌患者癌组织中lncRNA HOTAIR表达显著高于配对癌旁组织[13], 本研究在以上研究结论基础上进一步通过qRT-PCR检测lncRNA HOTAIR在48例健康志愿者与48例食管鳞癌患者血清中表达水平的差异性, 分析其作为食管鳞癌诊断早期生物学指标的可能性, 研究结果发现, lncRNA HOTAIR在食管鳞癌患者血清中表达水平显著高于健康志愿者, 进一步行ROC曲线下面积分析, 结果提示血清lncRNA HOTAIR对食管鳞癌的诊断敏感性和特异性均较满意, 结合既往的文献我们推测, 血清lncRNA HOTAIR有望成为食管鳞癌诊断的早期分子生物学指标.
基于本课题组前期研究结果发现, 食管鳞癌组织中lncRNA HOTAIR不仅有望成为食管鳞癌早期诊断的分子生物学指标, 其可能也参与食管鳞癌发生转移过程并影响患者不良分期, 对102例接受放疗食管鳞癌患者组织lncRNA HOTAIR表达情况研究发现, 放疗有效组食管鳞癌组织中lncRNA HOTAIR表达水平显著低于放疗无效组[13], 体外实验进一步研究了不同细胞中lncRNA HOTAIR表达水平及其与食管鳞癌细胞放射敏感性关系, 结果发现, lncRNA HOTAIR表达水平与细胞放射抵抗性呈显著正相关[20], 然后以其中Eca109细胞为研究对象, 比较放射抵抗细胞Eca109R60/2与亲本细胞Eca109中HOTAIR表达情况, 结果显示, 高表达的HOTAIR可能以时间和剂量依赖的方式参与食管鳞癌细胞的放疗抵抗, 并可能是食管鳞癌细胞放疗敏感性的预测因子[21]. 本课题在既往研究基础上, 进一步研究lncRNA HOTAIR在患者血清中与其对应癌组织中表达水平的相关性, 结果发现, 血清中lncRNA HOTAIR表达水平与其对应癌组织表达水平呈显著正相关, 血清中lncRNA HOTAIR表达水平与患者脏器转移状态及TNM分期也呈显著正相关, 结合本课题组既往的研究成果, 我们推测, 动态监测血清中lncRNA HOTAIR水平可能反映肿瘤负荷的变化, 有望可以替代组织活检, 成为一种有效的, 微创的生物学指标来动态判断患者病情严重程度、预测治疗效果及预后.
综上所述及本研究结果我们推测, 血清lncRNA HOTAIR有望成为未来食管鳞癌早期诊断、判断疾病严重程度、预测治疗效果及预后的有效生物学指标, 外周血肿瘤标记物因其操作方便和微创, 而表现出明显优势, 且一直是人们致力研究的方向, 因而具有良好的研究价值. 限于样本量有限及研究周期较短, 加之患者依从性、医疗开销等其他不可控因素未能结合临床预后的关系进行研究, 后续我们将继续加强随访人群及随访时间管理, 扩大样本量, 深入分析血清lnc RNA HOTAIR在食管鳞癌诊断及治疗中的应用价值.
食管鳞状细胞癌(esophageal squamous cell carcinoma, ESCC)的5年生存率较低, 且患者确诊时大多已为晚期, 寻找有效的生物标志物是早发现早治疗ESCC的有效方法. 与肿瘤的发生发展有关的LncRNA HOTAIR也与肿瘤的预后有关, lncRNA HOTAIR在ESCC中高表达和可检测性, 可能作为ESCC诊断和预后的潜在分子标志物.
本研究旨在观察lncRNA HOTAIR 在ESCC患者及健康志愿者血清中的变化差异, 分析其在ESCC患者血清及其配对组织和病理分期的相关性, 初步探讨血清lncRNA HOTAIR作为肿瘤生物标志物在ESCC诊断中的价值.
ESCC患者血清检测中显著高于健康志愿者, 患者血清lncRNA HOTAIR表达与其配对组织和病理分期具有相关性.
采用RT-qPCR法检测健康志愿者血清和ESCC患者血清组织中的表达量; 采用pearson法分析血清和组织中lncRNA HOTAIR 表达的相关性, 观察血清lncRNA HOTAIR 表达与病理分期的相关性.
LncRNA HOTAIR在ESCC患者血清中呈高表达, 显著高于健康志愿者; 与其配对组织中的表达具有相关性, 同时与病理分期具有相关性.
lncRNA HOTAIR有望成为ESCC早期诊断、判断疾病严重程度、预测治疗效果及预后的有效生物学指标.
LncRNA HOTAIR作为ESCC患者诊断预后标志物仍需要扩大研究样本量给出截断值、特异性和灵敏性清晰的定义.
学科分类: 胃肠病学和肝病学
手稿来源地: 新疆维吾尔自治区
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C, C
D级 (一般): D, D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Alsop BR, Sharma P. Esophageal Cancer. Gastroenterol Clin North Am. 2016;45:399-412. [PubMed] [DOI] |
| 2. | Li JH, Liu S, Zhou H, Qu LH, Yang JH. starBase v2.0: decoding miRNA-ceRNA, miRNA-ncRNA and protein-RNA interaction networks from large-scale CLIP-Seq data. Nucleic Acids Res. 2014;42:92-97. [PubMed] [DOI] |
| 3. | Caley DP, Pink RC, Trujillano D, Carter DR. Long noncoding RNAs, chromatin, and development. S. cientific World Journal. 2010;10:90-102. [PubMed] [DOI] |
| 4. | Saxena A, Carninci P. Long non-coding RNA modifies chromatin: epigenetic silencing by long non-coding RNAs. Bioessays. 2011;33:830-839. [PubMed] [DOI] |
| 5. | Chandra Gupta S, Nandan Tripathi Y. Potential of long non-coding RNAs in cancer patients: From biomarkers to therapeutic targets. Int J Cancer. 2017;140:1955-1967. [PubMed] [DOI] |
| 6. | Li J, Wang J, Zhong Y, Guo R, Chu D, Qiu H, Yuan Z. HOTAIR: a key regulator in gynecologic cancers. Cancer Cell Int. 2017;17:65. [PubMed] [DOI] |
| 7. | Cai H, Yao J, An Y, Chen X, Chen W, Wu D, Luo B, Yang Y, Jiang Y, Sun D, He X. LncRNA HOTAIR acts a competing endogenous RNA to control the expression of notch3 via sponging miR-613 in pancreatic cancer. Oncotarget. 2017;8:32905-32917. [PubMed] [DOI] |
| 9. | 刘 振兴, 高 翔, 张 震, 魏 建昌. 研究长链非编码RNA HOTAIR在结直肠癌中的表达、临床意义和预后效果. 临床医药文献电子杂志. 2020;7:161-162. |
| 10. | Li L, Wang Y, Song G, Zhang X, Gao S, Liu H. HOX cluster-embedded antisense long non-coding RNAs in lung cancer. Cancer Lett. 2019;450:14-21. [PubMed] [DOI] |
| 11. | Zhang KJ, Zhang Y, Luo ZL, Liu L, Yang J, Wu LC, Yu SS, Liu JB. [Long non-coding RNA HOTAIR in plasma as a potential biomarker for breast cancer diagnosis]. Nan Fang Yi Ke Da Xue Xue Bao. 2016;36:488-492. [PubMed] |
| 13. | Da C, Zhan Y, Li Y, Tan Y, Li R, Wang R. The expression and significance of HOX transcript antisense RNA and epithelial-mesenchymal transition-related factors in esophageal squamous cell carcinoma. Mol Med Rep. 2017;15:1853-1862. [PubMed] [DOI] |
| 14. | Yarmishyn AA, Kurochkin IV. Long noncoding RNAs: a potential novel class of cancer biomarkers. Front Genet. 2015;6:145. [PubMed] [DOI] |
| 15. | 徐 小雯, 袁 捷, 左 志贵, 于 志奇, 刘 永明, 傅 传刚. 与放疗抵抗相关的长链非编码RNA在不同放疗敏感性结直肠癌细胞株中的表达. 中华胃肠外科杂志. 2014;17:1096-1100. |
| 17. | Singh D, Khan MA, Siddique HR. Emerging role of long non-coding RNAs in cancer chemoresistance: unravelling the multifaceted role and prospective therapeutic targeting. Mol Biol Rep. 2020;47:5569-5585. [PubMed] [DOI] |
| 19. | Wang W, He X, Zheng Z, Ma X, Hu X, Wu D, Wang M. Serum HOTAIR as a novel diagnostic biomarker for esophageal squamous cell carcinoma. Mol Cancer. 2017;16:75. [PubMed] [DOI] |