修回日期: 2020-11-30
接受日期: 2020-12-21
在线出版日期: 2021-02-08
胃癌(gastric cancer, GC)是消化系统常见的恶性肿瘤之一, 预后较差. 晚期患者5年生存率低, 同时大部分患者发现时已发展为远处转移的晚期或局部晚期, 丧失了手术机会. 然而, GC发生发展及侵袭转移的确切分子机制仍不完全明晰.
在本研究中, 我们采用生物信息分析结合细胞实验方法探讨CMTM3基因在GC中的表达、生物学功能及其潜在的分子调控机制.
首先在GEO和TCGA数据库中分析CMTM3基因的差异表达情况, 并比较CMTM3基因高低表达与GC患者预后的关系. 在正常胃上皮细胞(GES-1)和多个GC细胞系(HGC-27, BGC-823和MKN45)中比较CMTM3基因的表达情况. 在MKN45细胞中转染外源性小干扰RNA(sh-CMTM3-1)下调细胞中CMTM3基因表达后, 采用MTT实验和划痕实验, 评价下调前后细胞增殖和迁移能力有无改变. GEO数据库中筛选GC组织 vs 胃正常组织中差异表达的microRNA谱, 并根据microRNA在线预测软件Targetscan预测CMCT3上游靶基因miR-125b-5P. 选取我院收治的15例GC患者, 采用q-PCR方法检测癌组织和癌旁组织中CMTM3和miR-125b-5P表达水平. 双荧光素酶报告实验验证miR-125b-5P与CMTM3靶向调控关系. 转染外源性miR-125b-5P-mimic, 评价MKN45细胞增殖和迁移能力的变化.
在GC患者, 癌组织中的CMTM3基因mRNA表达水平明显高于癌旁正常胃组织(P<0.05). CMTM3基因高表达GC患者总生存(overall survival, OS)和无疾病进展生存(disease free survival, DFS)均低于低表达患者. 外源性小干扰RNA(sh-CMTM3-1)可显著下调MKN45 GC细胞中CMTM3基因表达(P<0.05). sh-CMTM3-1下调MKN45 GC细胞中CMTM3基因表达后, 细胞的迁移能力明显减低(P<0.05). MTT实验显示, sh-CMTM3-1下调CMTM3表达后, MKN45 GC细胞增殖能力明显下降(P<0.05). 筛选出CMTM3上游靶基因miR-125b-5P. miR-125b-5P在正常胃黏膜细胞系中表达水平明显高于GC细胞系(P<0.05), GC患者癌组织中miR-125b-5P表达水平明显低于癌旁正常组织(P<0.05). CMTM3基因在GC组织中的表达水平明显高于癌旁组织(P<0.05). GC组织中CMTM3与miR-125b-5P表达呈负相关(rPearson = -0.58, P<0.05). MKN45细胞中, miR-125b-5P可显著下调CMTM3基因表达(P<0.05). 双荧光素酶报告实验显示miR-125b-5P基因与CMTM3基因3'UTR靶向结合. 转染miR-125b-5P-mimic下调CMTM3表达后GC MKN45细胞增殖能力和迁移能力明显减低(P<0.05).
miR-125b-5P靶向调控CMTM3基因表达影响GC增殖和迁移能力, 并有望成为GC预后的分子标志物和潜在治疗靶点.
核心提要:CMTM3基因在胃癌(gastric cancer, GC)中高表达, 并与GC患者的预后有关. miR-125b-5P可靶向抑制CMTM3的表达, 并影响MKN45 GC细胞的增殖和迁移. miR-125b-5P和CMTM3相关信号通路在GC增殖和迁移中发挥重要作用, 并有望成为GC预后的分子标志物和潜在治疗靶点.
引文著录: 李爱云, 吴玉秀, 郜娜, 张建光, 孟薇. CMTM3在胃癌中的表达及其生物学功能研究. 世界华人消化杂志 2021; 29(3): 116-124
Revised: November 30, 2020
Accepted: December 21, 2020
Published online: February 8, 2021
Gastric cancer (GC) is one of the most common malignant tumors in the digestive system with a poor prognosis. The 5-year survival rate of patients with advanced stage GC is low, and most patients have locally advanced or metastatic disease when initially diagnosed, and have therefore lost the opportunity of surgery. The exact molecular mechanism of GC is still unclear.
To investigate the expression, biological function, and potential molecular regulatory mechanism of CMTM3 gene in GC by bioinformatics analysis and cellular experiments.
The differential expression of CMTM3 gene was analyzed in GEO and TCGA databases, and the relationship between CMTM3 gene expression and the prognosis of GC patients was compared. The expression of CMTM3 gene was compared between normal gastric epithelial cells (GES-1) and several GC cell lines (HGC-27, BGC-823, and MKN45). After transfection of exogenous small interfering RNA (sh-CMTM3-1) into MKN45 cells, cell proliferation and migration were evaluated by MTT assay and scratch test. The differentially expressed microRNA profiles in GC tissues and normal gastric tissues were screened from the GEO database, and the upstream target gene miR-125b-5p of CMCT3 was predicted according to the microRNA online prediction software TargetScan. The expression levels of CMTM3 and miR-125b-5p were detected by qPCR in 15 patients with GC at our hospital. Double luciferase reporter assay was performed to verify the relationship between miR-125b-5p and CMTM3 targeted regulation. The proliferation and migration of MKN45 cells were evaluated by transfection of exogenous miR-125b-5p-mimic.
The expression of CMTM3 mRNA in GC tissues was significantly higher than that in adjacent normal gastric tissues (P < 0.05). The overall survival (OS) and disease free survival (DFS) of GC patients with high expression of CMTM3 gene were lower than those of patients with low expression of CMTM3. Exogenous small interfering RNA (sh-CMTM3-1) significantly down-regulated the expression of CMTM3 gene in MKN45 GC cells (P < 0.05). After sh-CMTM3-1-mediated down-regulation of the expression of CMTM3 gene in MKN45 GC cells, cell migration and proliferation were significantly reduced (P < 0.05). The upstream target gene miR-125b-5p of CMTM3 was screened. The expression level of miR-125b-5p in normal gastric mucosa cell line GES-1 was significantly higher than that in GC cell lines (P < 0.05). The expression level of miR-125b-5p in GC tissues was significantly lower than that in adjacent normal tissues (P < 0.05). The expression level of CMTM3 gene in GC tissues was significantly higher than that in adjacent tissues (P < 0.05). There was a negative correlation between the expression of CMTM3 and miR-125b-5p in GC (rpearson = -0.58, P < 0.05). In MKN45 cells, miR-125b-5p significantly down-regulated the expression of CMTM3 gene (P < 0.05). Double luciferase reporter assay showed that miR-125b-5p gene can bind the 3'-untranslated region of CMTM3 gene. After transfection of miR-125b-5p-mimic to down-regulate the expression of CMTM3, the proliferation and migration of GC MKN45 cells were significantly decreased (P < 0.05).
MiR-125b-5p regulates the expression of CMTM3 gene and affects the proliferation and migration of GC. CMTM3 is expected to become a molecular marker and potential therapeutic target for GC.
- Citation: Li AY, Wu YX, Gao N, Zhang JG, Meng W. Expression and biological function of CMTM3 in gastric cancer. Shijie Huaren Xiaohua Zazhi 2021; 29(3): 116-124
- URL: https://www.wjgnet.com/1009-3079/full/v29/i3/116.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v29.i3.116
在全球范围内, 胃癌(gastric cancer, GC)在男性是第3大常见恶性肿瘤, 发病率仅次于肺癌、结直肠癌占所有肿瘤患者病例数的7%和死亡人数的9%[1]. 2018年, GC新发103万人, 造成78.3万人死亡. 20世纪30年代以前, 在世界大部分地区, 包括大多数西方发达国家, GC是最常见的死亡原因[2]. 然而, 近1个世纪以来, 世界上许多地区的GC发病率和死亡率都在下降. 其原因可能与食品保鲜方法的改进以及食用较少的腌制食品有关. 然而目前, GC在东亚尤其是我国和日本等国家仍为常见的恶性肿瘤[3-5].
GC整体预后较差, 晚期患者5年生存率低. 大部分患者发现时已发展远处转移的晚期或局部晚期, 丧失了手术机会[6]. 然而, GC发生发展及侵袭转移的确切分子机制仍不完全明晰. 近年来随着分子生物学技术的不断进步及大数据分析的不断发展, GC研究尤其是相关信号通路在其表型中的相关性取得了长足的进步.
CMTM为趋化素样因子家族(CKLFS), 是一个新基因家族[7]. CMTM3是趋化素样因子家族主要成员, 在多种人体恶性肿瘤中呈现差异表达, 并与细胞的恶性表型有关. 但其上游靶基因及其相关分子调控机制并不十分清楚. 在本研究中, 我们采用生物信息分析结合细胞实验方法探讨CMTM3基因在GC中的表达、生物学功能及其潜在的分子调控机制.
1.1.1 细胞系和组织标本: 正常胃上皮细胞(GES-1)和多个GC细胞系(HGC-27, BGC-823和MKN45)购自中国科学院上海生科院细胞资源中心. 选取我院手术治疗的15例GC患者, 术中留取患者癌组织和癌旁正常组织标本后立即置入液氮中迅速冷冻, 然后转移到-80 ℃冰箱中保存. 组织标本获取经我院医学伦理委员会及家属知情同意.
1.1.2 仪器与设备: 台式低速离心机(B160A型); 荧光定量PCR仪7500HT; 超低温冰箱; 无菌操作台 Steril CARD Ⅲ Advance; 台式微型离心机(Mierofuge18).
1.2.1 生物信息分析: 在GEOhttp://www.ncbi.nlm.nih.gov/geo/)[8,9]和TCGA(https://portal.gdc.cancer.gov/)[10]数据库中分析CMTM3基因的差异表达情况. CMTM3差异表达选取GEO数据库中2个芯片数据集GSE93415和GSE99415, 差异筛选条件为表达CMTM3表达上调或下调2倍及以上(Log2FC>1), 同时P<0.05. 采用microRNA靶基因在线预测软件Targetscan (http://www.targetscan.org/vert_72/)[11], 预测CMTM3上游靶基因.
1.2.2 实时荧光定量PCR: 根据说明书使用Trizol试剂(Invitrogen)从细胞中提取总RNA. 分别用PrimeScriPt RT试剂盒和SYBR Prime-ScriPt-RT-PCR试剂盒进行逆转录(RT)和qRT-PCR. miR125b-5P和CMTM3使GAPDH作为内参照物. 结果采用2-△△Ct法进行计算. CMTM3引物序列为: F:5'-TCTTGCGTGTGAATCTCTTACC-3'; R: 5'-CAGGATCCACATTGGTGTTACC-3'.
1.2.3 MTT实验: 培养分别于转染0、24、48、72 h后, 弃去各孔培养基, PBS清洗3次, 加入200 μL新鲜完全培养基, 并加入5 mg/mL MTT溶液20 μL, 继续将培养板置于37 ℃ 5%CO2培养箱中培养4 h, 4 h后弃去上清, 每孔加入150 μL DMSO, 置摇床上低速振荡10 min, 使结晶物充分溶解后, 在酶联免疫检测仪OD490 nm处测量各孔的吸光值, 上机时设置调零孔. 以时间梯度为横坐标(X轴), 吸光值为纵坐标(Y轴)绘制曲线图.
1.2.4 划痕实验: 取对数生长期的细胞, 用0.25%胰蛋白酶消化并吹打成单个细胞, 取六孔板, 将事先处理好的细胞以50%的细胞密度均匀铺与六孔板内, 置于37 ℃ 5%CO2孵箱中培养. 24 h后将小干扰至细胞, 并置于37 ℃ 5%CO2孵箱中培养. 细胞转染24 h后, 采用1000 μL枪头在贴壁细胞做垂直的划痕, 然后弃掉培养基并用1×PBS清洗2遍后加入培养基后置于37 ℃ 5%CO2孵箱中培养. 分别在上述细胞划痕后0、24、48 h后采用倒置显微镜观察细胞迁移情况, 并随机记录3个视野下的细胞迁移距离.
1.2.5 双荧光素酶报告实验: 培养GC MKN45细胞, 将构建的miR-125b-5P mimics与PmiR-GLO-CMTM3-3'UTR共转染至MKN45细胞中, CMTM3基因的3'UTR区克隆至载体肾荧光素酶基因下游位点. 构建结合miR-125b-5P mimics与对照的野生型(WT)报告质粒及突变型(MUT)报告质粒. 采用LiPofectamine 3000试剂盒说明, 转染构建好的质粒至MKN45细胞. 转染48 h后, 通过双荧光素酶报告检测系统进行检测.
统计学处理 相关统计分析采用R软件完成, 计量资料用mean±SD表示, 组间比较采用t检验, 计数资料采用相对数表示, 行χ2检验, 双侧P<0.05为差别有统计学意义.
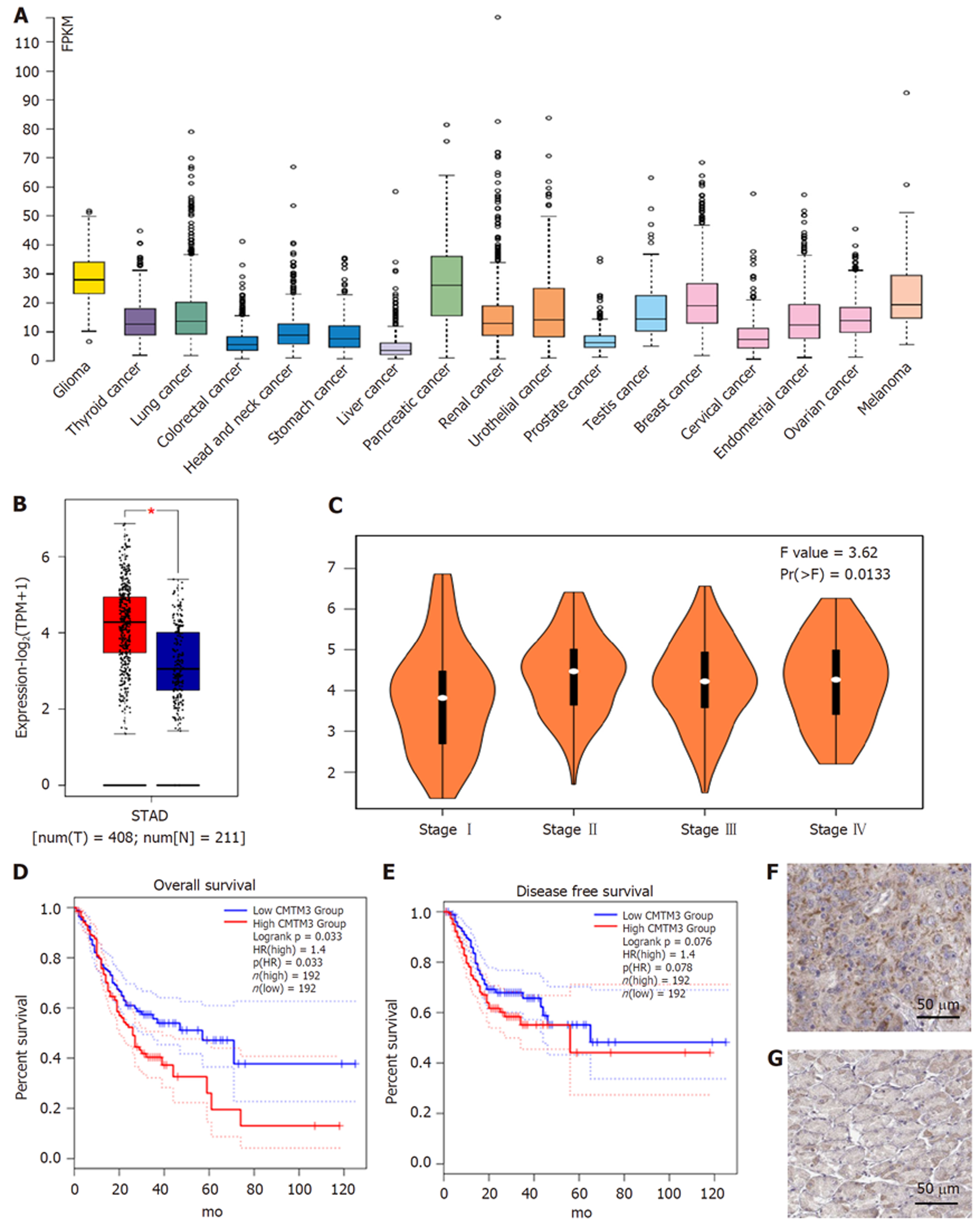
TCGA数据库中, CMTM3基因mRNA在多种肿瘤及GC中的表达明显上调(图1A); 在GC患者, 癌组织中的CMTM3基因mRNA表达水平明显高于癌旁正常胃组织(图1B). 同时, 随着GC患者分期的升高, CMTM3基因表达水平也增加(图1C). 预后分析数据来源于TCGA数据库, 高低表达组患者各192例, 随访时间130 mo, 根据CMTM3基因mRNA表达水平分为高和低表达组(CMTM3表达水平≥中位数为高表达, 反之为低表达), CMTM3基因高表达GC患者OS和DFS均低于低表达患者(图1D, E). 免疫组化显示, CMTM3基因编码蛋白主要表达于细胞浆和细胞膜, 在癌组织中高表达而在正常胃组织中低表达(图1F, G)
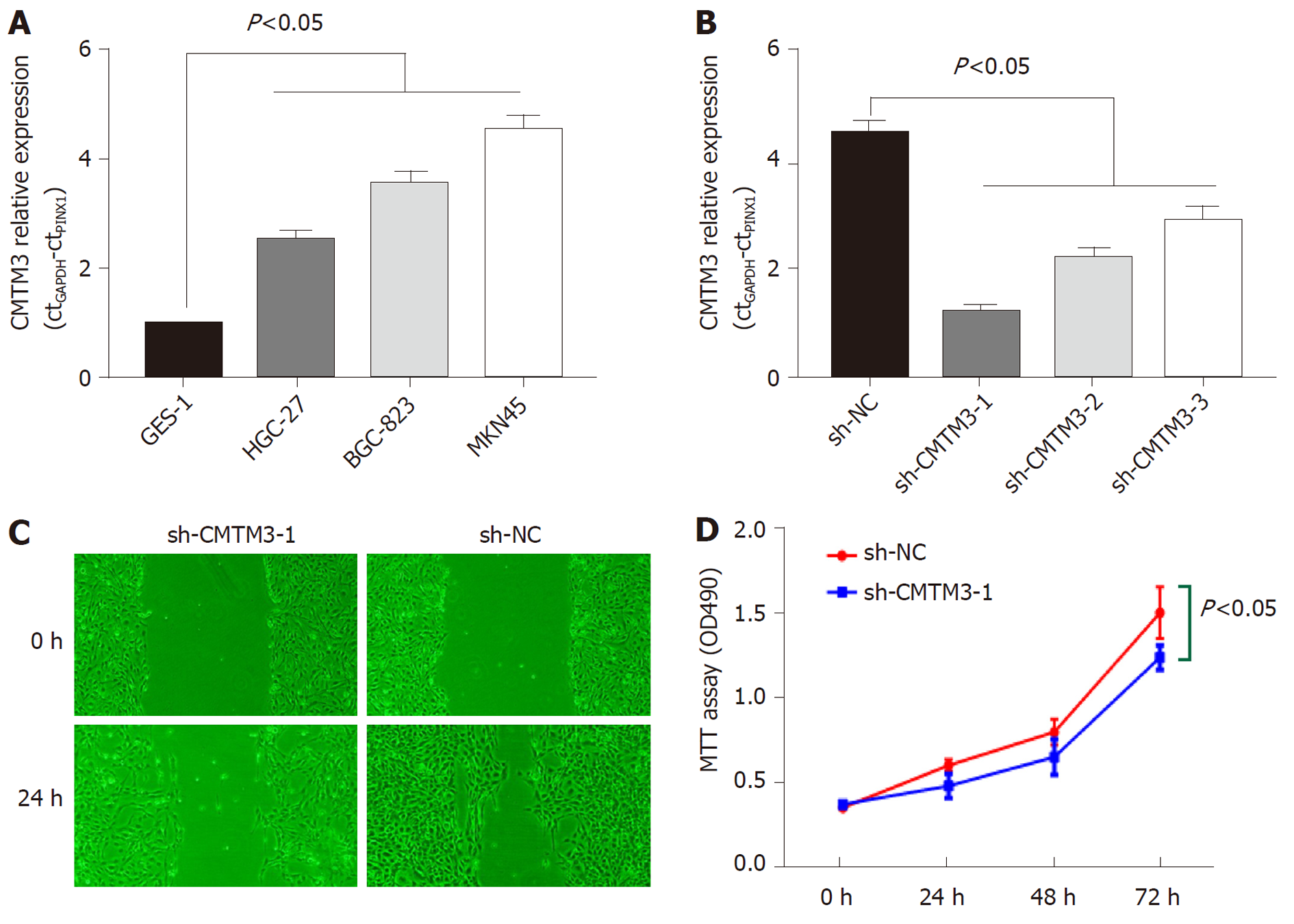
CMTM3基因mRNA在不同GC细胞系中的表达水平明显高于正常胃上皮细胞(GES-1), 且有统计学差异(P<0.05), MKN45GC细胞中CMTM3基因标的水平最高, 图2A. 外源性小干扰RNA(sh-CMTM3-1)可显著下调MKN45GC细胞中CMTM3基因表达(P<0.05), 图2B. sh-CMTM3-1下调MKN45GC细胞中CMTM3基因表达后, 细胞的迁移能力明显减低(P<0.05), 图2C. MTT实验显示, sh-CMTM3-1下调CMTM3表达后, MKN45GC细胞增殖能力明显下降(P<0.05), 图2D.
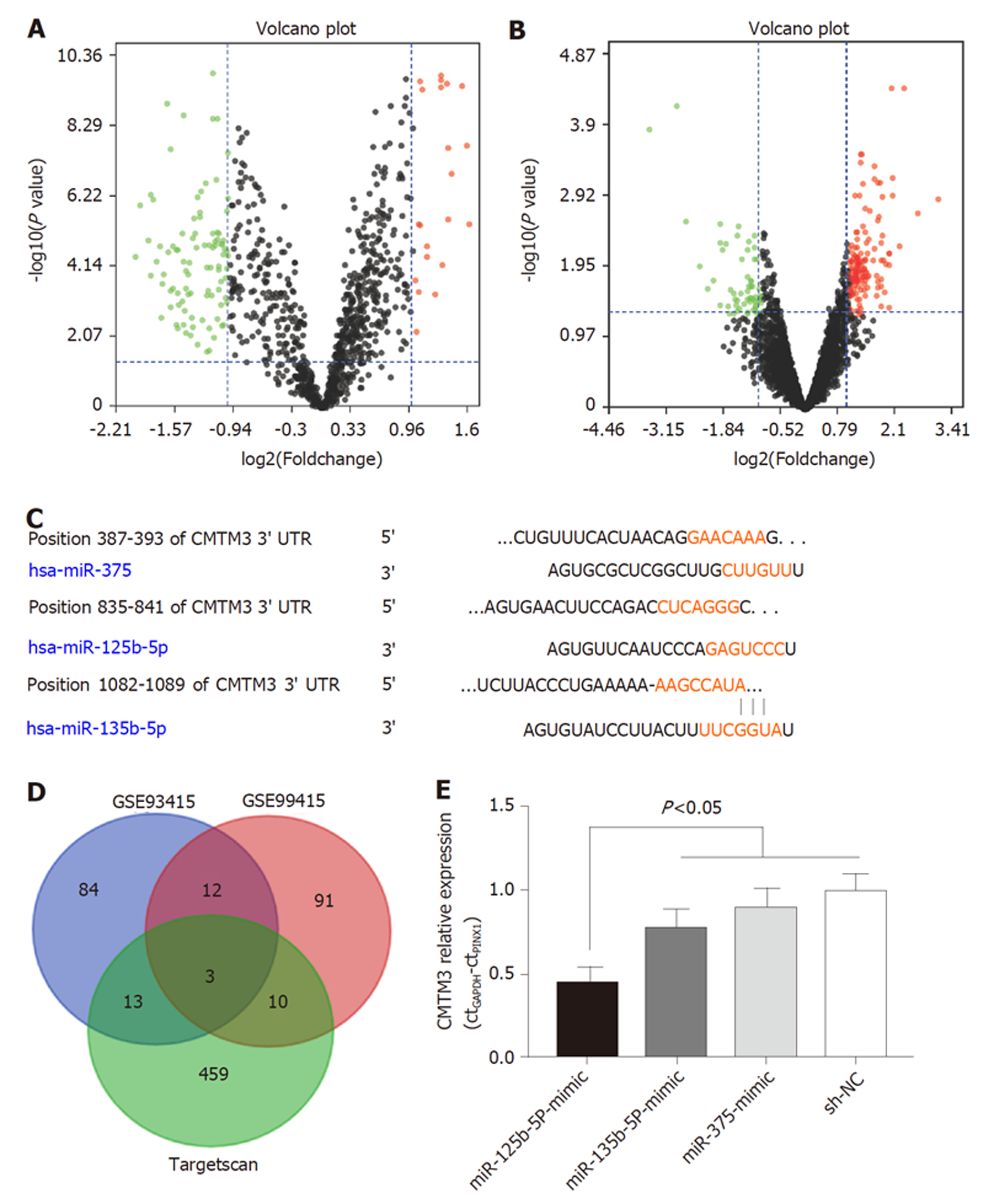
GEO数据库中下载GC vs 正常胃黏膜差异表达芯片GSE93415和GSE99415, 筛选出差异表达micro12个(图3A, B). 同时采用miRNA靶基因下线预测软件, 筛选出与上述12个差异表达基因重合的microRNA 3个, 分别为miR-375, miR-125b-5P和miR-135b-5P(图3C, D). 其中miR-125b-5P下调CMTM3基因在GC细胞中的表达最为明显(P<0.05)(图3E).
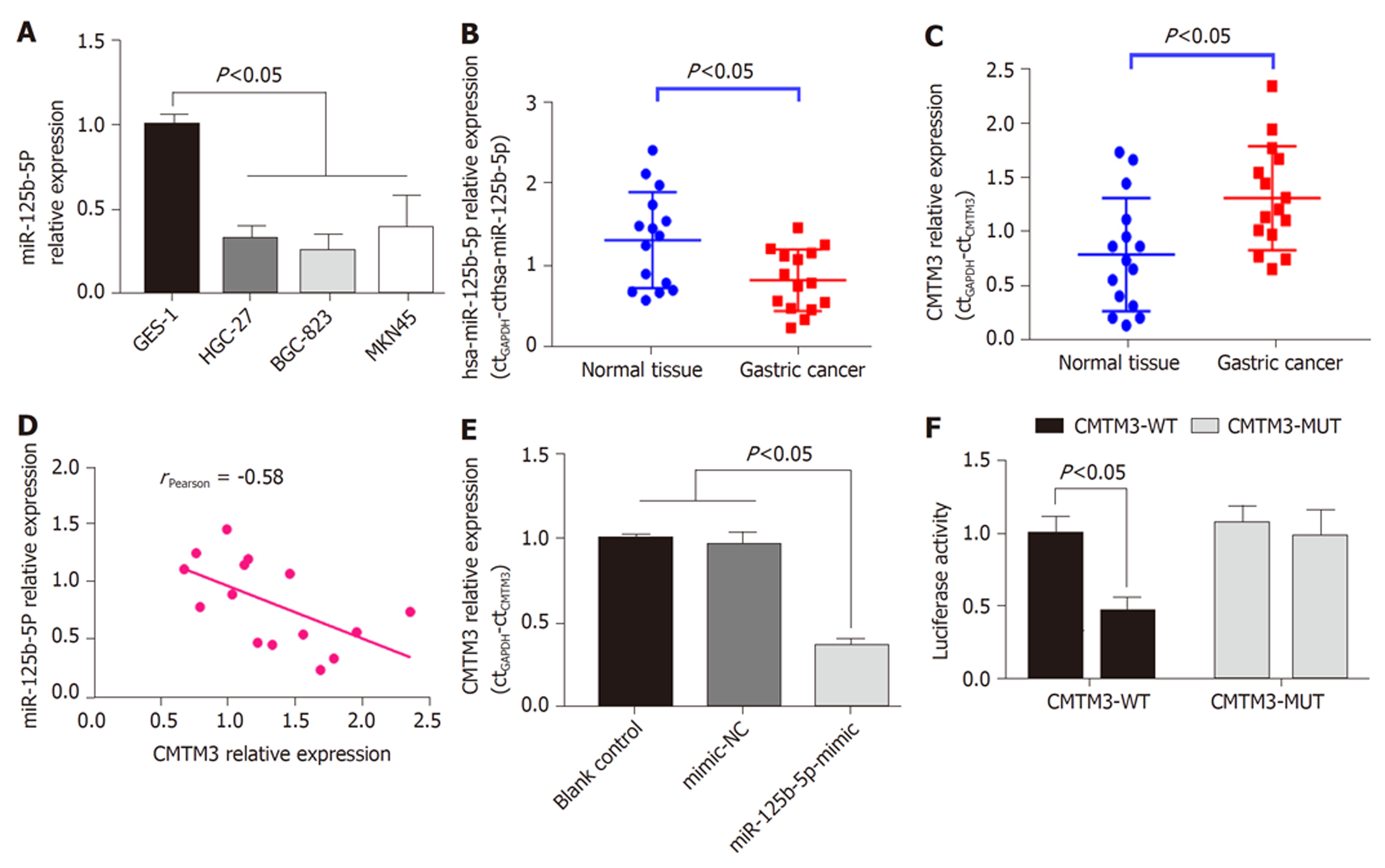
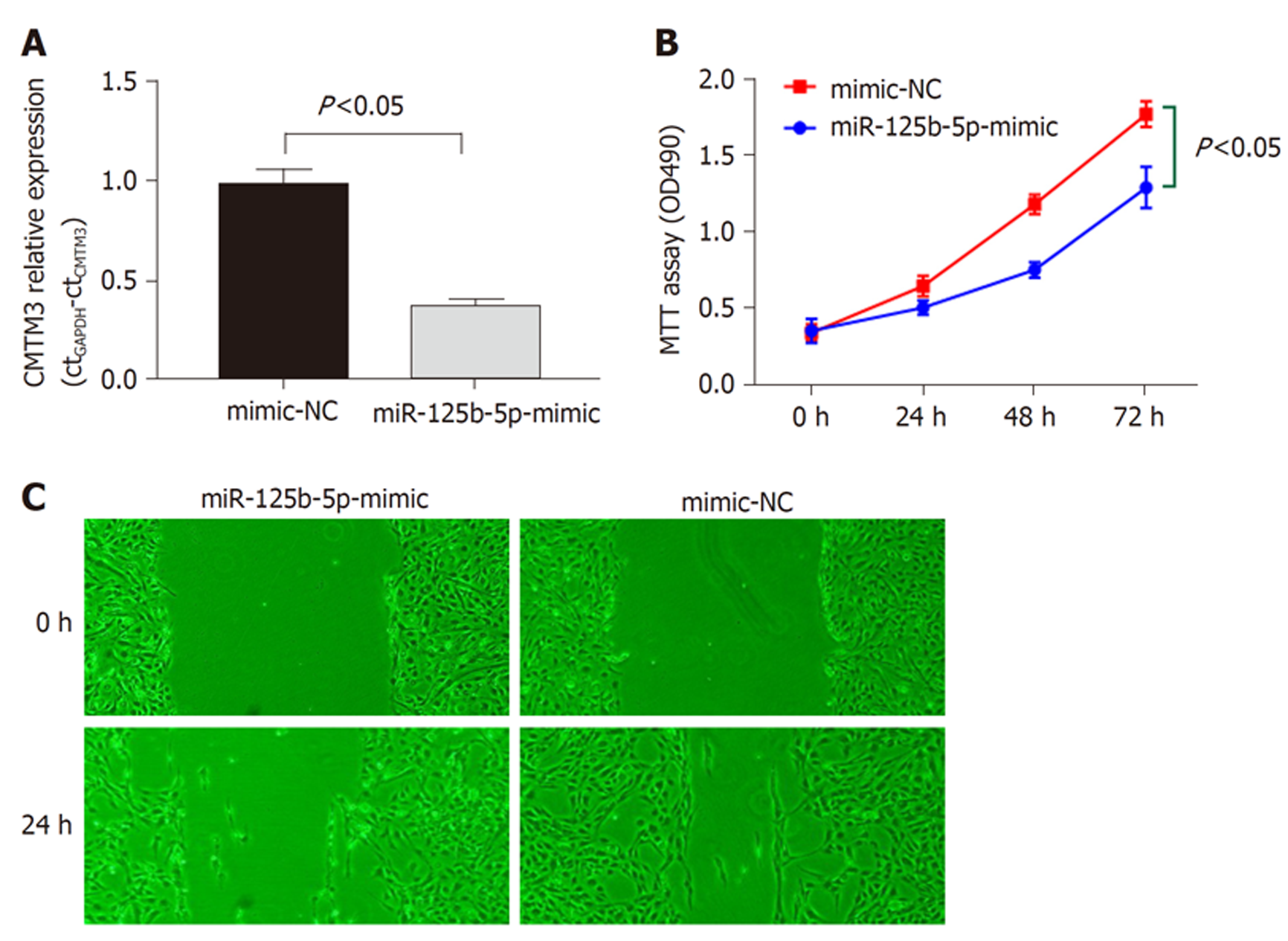
miR-125b-5P在正常胃粘膜细胞系中表达水平明显高于GC细胞系(P<0.05), 图4A. GC患者癌组织中miR-125b-5P表达水平明显低于癌旁正常组织(P<0.05), 图4B. CMTM3基因在GC组织中的表达水平明显高于癌旁组织(P<0.05), 图4C. GC组织中CMTM3与miR-125b-5P表达呈负相关(rPearson = -0.58, P<0.05). MKN45细胞中, miR-125b-5P可显著下调CMTM3基因表达(P<0.05), 图4E. 荧光素报告酶实验显示miR-125b-5P基因与CMTM3基因3'UTR靶向结合, 图4F.
在GCMKN45细胞中, miR-125b-5P可显著下调CMTM3表达(P<0.05), 图5A. MTT实验, 下调CMTM3表达后GCMKN45细胞增殖能力明显减低(P<0.05), 图5B. 划痕实验显示, miR-125b-5P下调CMTM3表达后GCMKN45细胞迁移能力也明显下降(P<0.05), 图5C.
GC是临床上最常见的消化系统恶性肿瘤之一, 也是癌症相关死亡的重要原因, 在所有癌症死亡原因中排第三位置[12]. 尽管患者接受了外科手术或放化疗, GC患者的预后仍不理想, 晚期患者远期生存率极低. 晚期GC患者化疗及放疗效果十分有限, 大多数患者仅能从放化疗中获益很少, 其主要原因为其肿瘤细胞增殖、侵袭的分子机制未能完全明晰[4,13,14]. 因此, 这里迫切需要更好地了解GC发生发展及增殖等生物学功能的分子机制及其相关信号通路.
CMTM3是趋化素样因子家族主要成员, 在多种人体恶性肿瘤中呈现差异表达, 并与细胞的恶性表型有关[15,16]. 已有研究显示CMTM家族蛋白在肿瘤生长、转移和抗肿瘤免疫中发挥重要作用[17,18]. 依据既往文献报道, CMTM不同家族成员在不同的肿瘤中的生物学功能并不完全相同, 甚至在不同的肿瘤中呈现出相反的生物学功能[19]. 有文献报道, CMTM3在前列腺癌中表达水平较低, 进一步下调细胞CMTM3表达水平后, 其增长和侵袭能力增强, 提示CMTM3在前列腺癌中可能发挥了抑癌基因的作用[20]. 然而在本研究中, 我们通过生物信息学研究发现, CMTM3基因mRNA在大多数人体肿瘤组织中表达水平是上调的, 提示其在人实体肿瘤的发生与发展中可能发挥重要作用. 我们设计并合成了针对CMTM3的外源性小干扰RNA, 转让GC细胞MKN45后, 细胞的增殖和迁移能力减低, 提示CMTM3在GC的增殖和迁移生物学功能方面具有重要作用. 进一步我们对相关GC差异表达micorRNA基因芯片数据进行了分析, 并结合microRNA靶基因在线预测软件证实了miR-125b-5P为CMTM3上游重要的靶基因, 并能够下调CMTM3在GC细胞中的表达, 并抑制细胞的增殖和迁移能力.
CMTM3基因在GC组织及GC细胞株中高表达, 并与GC患者的预后有关. 时miR-125b-5P可靶向抑制CMTM3的表达, 并影响MKN45 GC细胞的增殖和迁移. miR-125b-5P和CMTM3相关信号通路望成为GC预后的分子标志物和潜在治疗靶点. 然而, CMTM3在不同肿瘤中的高低表达有差异, 其大多数情况下作为抑癌基因发挥作用并在肿瘤组织中低表达. 但CMTM3在不同肿瘤中也呈现高表达, 可能作为癌基因发挥. 因此, 其确切分子机制并不完全清楚, 在不同的肿瘤中可能发挥不同的作用. 我们分析了TCGA数据库中的数据, 显示期在GC中均为高表达. 但由于CMTM3不同肿瘤组织中的表达水平存在差异, 该基因在其他肿瘤中的作用及生物学功能有待进一步研究.
miR-125b-5P靶向调控CMTM3基因表达影响GC增殖和迁移能力, 并有望成为GC预后的分子标志物和潜在治疗靶点.
胃癌(gastric cancer, GC)是临床常见消化系统恶性肿瘤, 然而其发生发展及侵袭转移的确切分子机制仍不完全明晰. CMTM3是趋化素样因子家族主要成员, 在多种人体恶性肿瘤中呈现差异表达, 并与细胞的恶性表型有关. 但其上游靶基因及其相关分子调控机制并不十分清楚.
本研究目的在于采用生物信息分析结合细胞实验方法探讨CMTM3基因在GC中的表达、生物学功能及其潜在的分子调控机制, 为后续靶向药物的研发提供新的潜在靶点.
探寻CMTM3基因在GC细胞系及组织中的表达、及其对GC细胞增殖、迁移和穿膜能力的影响, 同时探讨其潜在的分子调控机制.
生物信息法分析CMTM3基因的差异表达情况, 并比较CMTM3基因在上皮细胞和多个GC细胞系中表达情况. 在GC细胞中转染外源性小干扰下调细胞中CMTM3基因表达后评价细胞增殖和迁移能力. 预测CMTM3上游靶基因, 双荧光素酶报告实验验证miR-125b-5P与CMTM3靶向调控关系. 转染外源性miR-125b-5P-mimic, 评价GC细胞增殖和迁移能力的变化.
GC组织中的CMTM3基因mRNA表达水平明显高于癌旁正常胃组织(P<0.05), 并于预后有关. miR-125b-5p可显著下调GC细胞CMTM3表达, 并影响细胞的增殖和迁移能力(P<0.05).
miR-125b-5p靶向调控CMTM3基因表达影响GC增殖和迁移能力, 并有望成为GC预后的分子标志物和潜在治疗靶点.
miR-125b-5p靶向抑制CMTM3基因的表达, 并影响GC患者的预后, 有望成为GC靶向药物开发的新靶点及信号通路.
学科分类: 胃肠病学和肝病学
手稿来源地: 天津市
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C
D级 (一般): D, D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Siegel RL, Miller KD, Jemal A. Cancer statistics, 2019. CA Cancer J Clin. 2019;69:7-34. [PubMed] [DOI] |
| 2. | Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018;68:394-424. [PubMed] [DOI] |
| 3. | Ramazani Y, Mardani E, Najafi F, Moradinazar M, Amini M. Epidemiology of Gastric Cancer in North Africa and the Middle East from 1990 to 2017. J Gastrointest Cancer. 2020;. [PubMed] [DOI] |
| 4. | Machlowska J, Baj J, Sitarz M, Maciejewski R, Sitarz R. Gastric Cancer: Epidemiology, Risk Factors, Classification, Genomic Characteristics and Treatment Strategies. Int J Mol Sci. 2020;21. [PubMed] [DOI] |
| 5. | Cavatorta O, Scida S, Miraglia C, Barchi A, Nouvenne A, Leandro G, Meschi T, De' Angelis GL, Di Mario F. Epidemiology of gastric cancer and risk factors. Acta Biomed. 2018;89:82-87. [PubMed] [DOI] |
| 6. | Venerito M, Vasapolli R, Rokkas T, Malfertheiner P. Gastric cancer: epidemiology, prevention, and therapy. Helicobacter. 2018;23 Suppl 1:e12518. [PubMed] [DOI] |
| 7. | Wu J, Li L, Wu S, Xu B. CMTM family proteins 1-8: roles in cancer biological processes and potential clinical value. Cancer Biol Med. 2020;17:528-542. [PubMed] [DOI] |
| 8. | Toro-Domínguez D, Martorell-Marugán J, López-Domínguez R, García-Moreno A, González-Rumayor V, Alarcón-Riquelme ME, Carmona-Sáez P. ImaGEO: integrative gene expression meta-analysis from GEO database. Bioinformatics. 2019;35:880-882. [PubMed] [DOI] |
| 9. | Yao S, Liu T. Analysis of differential gene expression caused by cervical intraepithelial neoplasia based on GEO database. Oncol Lett. 2018;15:8319-8324. [PubMed] [DOI] |
| 10. | Lan Q, Wang P, Tian S, Dong W. Mining TCGA database for genes of prognostic value in gastric cancer microenvironment. J Cell Mol Med. 2020;24:11120-11132. [PubMed] [DOI] |
| 11. | Agarwal V, Bell GW, Nam JW, Bartel DP. Predicting effective microRNA target sites in mammalian mRNAs. Elife. 2015;4. [PubMed] [DOI] |
| 12. | Siegel RL, Miller KD, Jemal A. Cancer statistics, 2020. CA Cancer J Clin. 2020;70:7-30. [PubMed] [DOI] |
| 13. | Eloranta S, Smedby KE, Dickman PW, Andersson TM. Cancer survival statistics for patients and healthcare professionals - a tutorial of real-world data analysis. J Intern Med. 2020;. [PubMed] [DOI] |
| 14. | Henley SJ, Ward EM, Scott S, Ma J, Anderson RN, Firth AU, Thomas CC, Islami F, Weir HK, Lewis DR, Sherman RL, Wu M, Benard VB, Richardson LC, Jemal A, Cronin K, Kohler BA. Annual report to the nation on the status of cancer, part I: National cancer statistics. Cancer. 2020;126:2225-2249. [PubMed] [DOI] |
| 15. | Chrifi I, Louzao-Martinez L, Brandt M, van Dijk CGM, Burgisser P, Zhu C, Kros JM, Duncker DJ, Cheng C. CMTM3 (CKLF-Like Marvel Transmembrane Domain 3) Mediates Angiogenesis by Regulating Cell Surface Availability of VE-Cadherin in Endothelial Adherens Junctions. Arterioscler Thromb Vasc Biol. 2017;37:1098-1114. [PubMed] [DOI] |
| 16. | Yuan W, Liu B, Wang X, Li T, Xue H, Mo X, Yang S, Ding S, Han W. CMTM3 decreases EGFR expression and EGF-mediated tumorigenicity by promoting Rab5 activity in gastric cancer. Cancer Lett. 2017;386:77-86. [PubMed] [DOI] |
| 17. | Hu FZ, Yuan WQ, Wang XL, Qin CP, Sheng ZZ, DU YQ, Yin HQ, Xu T. [Knockdown of CMTM3 promotes migration and invasion of PC3 cell in vitro]. Beijing Da Xue Xue Bao Yi Xue Ban. 2016;48:594-597. [PubMed] [DOI] |
| 18. | Zhang H, Zhang J, Nan X, Li X, Qu J, Hong Y, Sun L, Chen Y, Li T. CMTM3 inhibits cell growth and migration and predicts favorable survival in oral squamous cell carcinoma. Tumour Biol. 2015;36:7849-7858. [PubMed] [DOI] |
| 19. | Delic S, Thuy A, Schulze M, Proescholdt MA, Dietrich P, Bosserhoff AK, Riemenschneider MJ. Systematic investigation of CMTM family genes suggests relevance to glioblastoma pathogenesis and CMTM1 and CMTM3 as priority targets. Genes Chromosomes Cancer. 2015;54:433-443. [PubMed] [DOI] |
| 20. | Hu F, Yuan W, Wang X, Sheng Z, Yuan Y, Qin C, He C, Xu T. CMTM3 is reduced in prostate cancer and inhibits migration, invasion and growth of LNCaP cells. Clin Transl Oncol. 2015;17:632-639. [PubMed] [DOI] |