修回日期: 2020-11-18
接受日期: 2020-12-07
在线出版日期: 2021-01-28
食管胃结合部癌由于其肿瘤部位的特殊性, 外科手术需要同时满足淋巴结清扫范围、切缘及重建安全性, 因此在分型方式、手术径路等方面存在争议.传统的Siewert及Nishi分型以肿瘤中心作为分型的主要依据, 这种分型没有考虑到肿瘤的上下切缘, 尤其是对食管下端的浸润距离缺乏直观的精准的术前术中评估, 因此这种分型对食管胃结合部癌手术方式、淋巴结清扫范围及重建方式的指导作用受到了一定的限制. 本文系统分析了传统的Siewert及Nishi分型优缺点, 阐述了不同分型的规范化淋巴结清扫范围及重建方式, 并提出了一种以食管浸润长度为核心的食管胃结合部肿瘤分型的设想.
核心提要: Siewert及Nishi分型以肿瘤中心作为分型的主要依据, 这种分型没有考虑到肿瘤的上下切缘, 尤其是对食管下端的浸润距离缺乏直观的精准的术前术中评估, 因此这种分型对食管胃结合部癌手术方式、淋巴结清扫范围及重建方式的指导作用受到了一定的限制, 作者借此提出了一种以食管浸润长度为核心的食管胃结合部肿瘤分型的设想.
引文著录: 马欣俐, 顾佳毅, 邱江锋. 食管胃结合部癌的分型思考与手术径路探讨. 世界华人消化杂志 2021; 29(2): 53-57
Revised: November 18, 2020
Accepted: December 7, 2020
Published online: January 28, 2021
Due to the specific tumor site, the surgical resection and reconstruction of esophagogastric junction carcinoma needs radical lymphadenectomy and the safety of anastomotic stoma. The classification and surgical approaches for esophagogastric junction carcinoma are still under debate. The Siewert classification and Nishi classification focus on the center of the tumor, and do not take the proximal or distal margin into account. The lack of accurate preoperative or intraoperative assessment of the infiltration distance of the distal esophagus may limit the decision on the surgical approach, lymphadenectomy, and reconstruction. The purpose of this paper is to put forward a new classification for esophagogastric junction carcinoma, which includes the proximal and distal margins within 5 cm from the dentate line, with the proximal margin used as the main classification basis. Tumors with a distance from the proximal margin to the dentate line more than 3 cm are classified as type Ⅰ, those less than 3 cm are classified as type Ⅱ, and those with the proximal margin below the dentate line are classified as type Ⅲ.
- Citation: Ma XL, Gu JY, Qiu JF. Controversy over classifications and surgical approaches for esophagogastric junction carcinomas. Shijie Huaren Xiaohua Zazhi 2021; 29(2): 53-57
- URL: https://www.wjgnet.com/1009-3079/full/v29/i2/53.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v29.i2.53
食管胃结合部(esophagogastric junction, EGJ)癌通常是指肿瘤中心位于食管胃交界线上下5 cm范围内的癌, 其中以食管胃结合部腺癌(adenocarcinoma of esophagogastric junction, AEG)为主. 肥胖症、胃食管反流性疾病、Barrett食管等是AEG发病的主要危险因素[1]. 目前对于食管胃结合部癌的分型方式、手术径路与术式选择存在一定争议, 本文针对这两个方面进行文献复习并进行探讨.
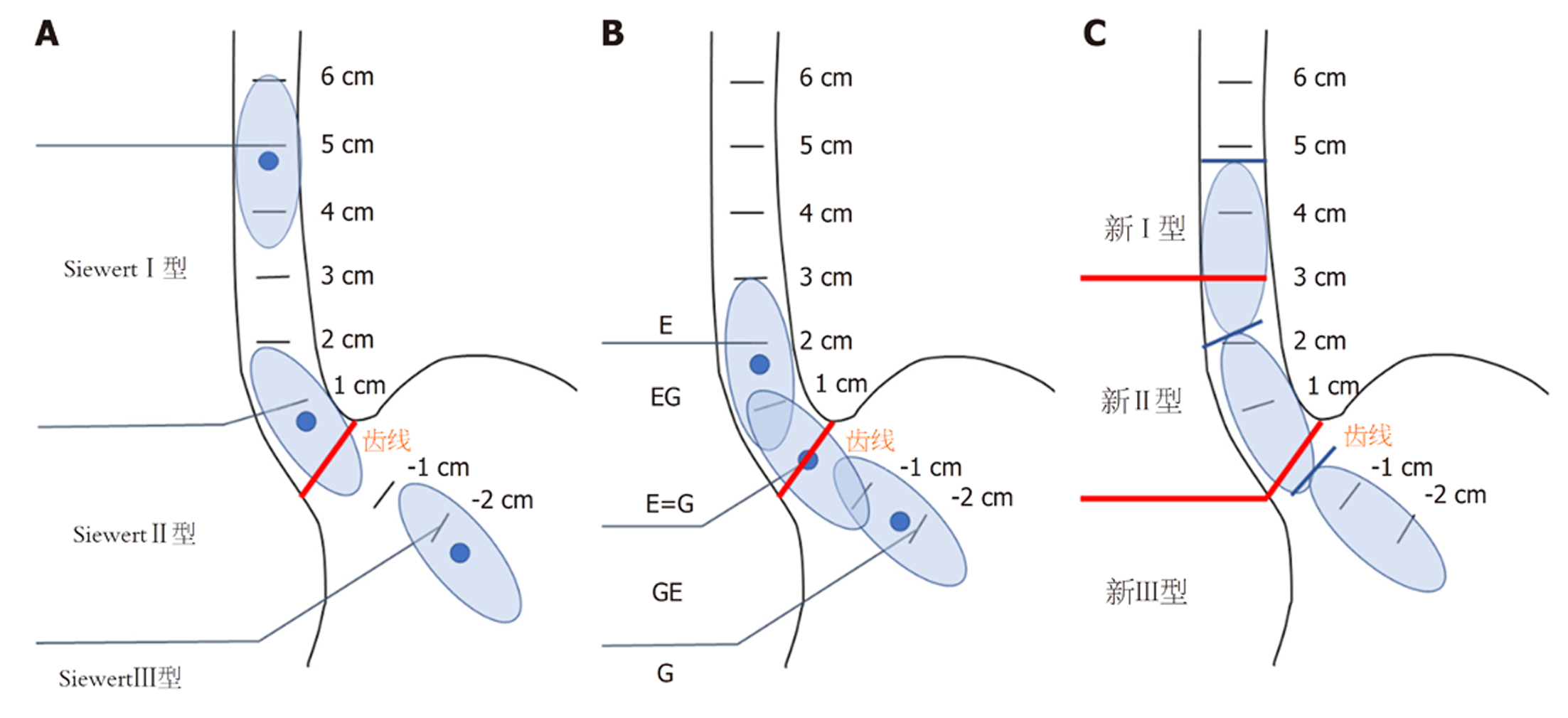
目前, 食管胃结合部癌的分型方法主要有2种: Siewert分型[2,3]和Nishi分型[4]. Siewert分型最早由德国慕尼黑大学的Siewert等人在1987年[3]提出, 并于1998年[2]以英文发表; 同年, 国际胃癌协会及国际食道疾病学会通过一系列会议, 一致决定将AEG通过肿瘤形态及肿瘤中心解剖位置, 定义为肿瘤中心在贲门近端及远端5 cm内的腺癌, 并将其称为Siewert分型, 包括: Siewert Ⅰ型肿瘤为食管下段腺癌, 其肿瘤中心位于齿状线上1-5 cm, 主要病因为食管特殊的肠上皮化生(如Barrett食管), 可向下浸润EGJ部位; Siewert Ⅱ型肿瘤为真正意义上的"贲门癌", 其肿瘤中心位于齿状线上1 cm到齿状线下2 cm, 通常由于EGJ部位上皮化生引起, 也曾称为交界部癌; Siewert Ⅲ型肿瘤为贲门下型胃癌, 肿瘤中心位于齿状线下2-5 cm, 由贲门下方向EGJ部位和食管远端浸润[2]. 实际上Siewert Ⅰ型其肿瘤发病机制、生物学行为以及淋巴转移途径与Ⅱ型及Ⅲ型略有不同, 放射性同位素淋巴造影术显示Siewert Ⅰ型淋巴转移主要包括纵膈转移及腹腔转移, 而Siewert Ⅱ、Ⅲ型主要为腹腔、脾门、腹主动脉旁淋巴结转移[5]. 因此这三型肿瘤的手术径路选择也存在差异.
Nishi分型是由日本学者Mitsumasa Nishi于1973年提出[4], 定义为肿瘤直径≤4 cm, 且肿瘤中心位于EGJ上下2 cm范围内的恶性肿瘤, 而根据肿瘤中心与食管胃交界线的相对关系包括偏食管侧及偏胃侧两类, 具体可分为5型: E, EG, E=G, GE, G. 由于日本鳞癌发病率较高, 因此Nishi分型包含腺癌及鳞癌, 而在2018年发表的第5版日本胃癌诊疗指南[6]中, 不同部位、不同病理类型以及不同病理分期所需清扫的淋巴结范围各不相同. 目前日本Nishi方法仅在日本广泛应用, 国际上仍多参考Siewert分型.
AEG手术的原则是在确保手术安全的前提下, 完整切除原发灶、合理且彻底清扫区域淋巴结及简单安全的消化道重建, 其手术入路包括单一左胸径路(Sweet)、左侧胸腹联合切口(left thoracoabdominal approach, LTA)、经右侧胸腹联合切口(Ivo-Leiws)、经腹食管裂孔入路(abdominal-transhiatal approach, TH)等.
在Siewert分型中, 不同分型的纵隔淋巴结转移率具有显著差别, Siewert在2006年发表的一项纳入1602例AEG患者的研究[7]中提示, 纵隔淋巴结在Siewert Ⅰ、Ⅱ、Ⅲ型中的转移率分别为65%、12%、6%. 由此可见肿瘤位置越高, 纵隔淋巴结转移率也随之升高, 因此这三型患者的手术径路、手术切除重建、淋巴结清扫范围各有不同. Siewert Ⅰ型的胃癌纵隔淋巴结转移率高, 其手术切除范围及手术径路可参考食管下端癌. 一项2002年发表的荷兰RCT研究[8,9]比较了106例TH径路及114例经胸径路治疗累及食管下端的贲门癌患者的预后, 结果提示围术期TH径路的患者发生肺部并发症、ICU及住院时间较短, 存在淋巴结转移的患者接受经胸径路预后更佳, 因此该项研究认为, 经胸径路对于存在纵隔淋巴结转移的Siewert Ⅰ型患者具有一定优势. 另一项有关食管鳞癌的随机对照研究[10]结果提示, 对于存在纵隔淋巴结转移的患者, Ivo-Leiws径路在淋巴结清扫方面具有一定优势, 接受此类手术的患者相较于LTA具有更好的3年无病生存率及总生存率. 因此, 2018版中国专家共识[11]中已明确提出对于Siewert Ⅰ型AEG患者推荐右胸径路, 包括Ivor-Leiws或McKeown术式. Siewert Ⅲ型肿瘤中心位于齿状线下2-5 cm, 其解剖部位相当于胃底胃体部肿瘤, 因此有文献[2]建议Siewert Ⅲ型患者切除范围可按胃底胃体癌要求, 其重建通常通过TH径路完成. 2018版中国专家共识[11]也一致推荐经腹膈肌食管裂孔径路适用于Siewert Ⅲ型AEG.
Siewert Ⅱ型AEG被称为真正的"贲门癌", 定义为肿瘤中心位于EGJ上方1 cm至下方2 cm之间的腺癌; 在日本Nishi分型中则主要包括EG, E=G或GE型[12], 这类肿瘤患者手术径路及切除重建方式目前尚存争议, 其主要原因在于Siewert和Nishi分类都是以肿瘤中心作为分型依据, 均没有考虑肿瘤的上下缘, 对于手术切除范围的选择存在一定局限性.
日本JCOG9502临床研究[13]是2006年发表的一项RCT研究, 旨在比较Siewert Ⅱ型、Ⅲ型AEG患者接受创伤较大的LTA是否延长其生存时间, 结果提示相较于TH径路, LTA并未提高这两类胃癌患者的预后, 而接受LTA的患者肺炎发生率较高, 且有3例于围术期死亡, 因此该项研究提前终止, 并得出了对于Siewert Ⅱ型、Ⅲ型AEG胃癌患者应选择TH径路, 避免LTA, 减小手术创伤, 降低术后并发症发生率的结论; 该项研究术后10年的随访数据[14]同样证实了类似的结论, 但该研究由于两组因素存在一定的不平衡, 下纵隔淋巴结受累的发现低于试验计划时的最初预测, 以及研究的过早结束, 使得这项试验在一定程度上受到了限制.
季加孚教授提及2019年的第13届世界胃癌大会上, 日本学者Kitagawa曾报告食管胃结合部癌各组淋巴结转移率及治疗效果的临床研究结果, 结果提示随着肿瘤累及食管的距离越来越高, 第110组淋巴结转移率从0.9%到28.6%不等, 因此肿瘤累及食管2 cm以上的患者需常规清扫第110组淋巴结[15]. 2018年第5版日本胃癌诊疗指南[6]中, 依据日本国内一项包含273个中心、3177名患者的回顾性研究[16]结果提示, 偏食管侧(E、EG、E=G)这三类分型的淋巴结清扫需根据肿瘤病理类型、疾病临床分期进行综合判断, 其中鳞癌cT1期需清扫第1、2、3、7、19、20组淋巴结及中、下纵隔淋巴结, cT2期及以上则在cT1期的基础上增加了第8a、9、11p组淋巴结及上纵隔、颈部淋巴结的清扫; 如病理结果为腺癌, 与鳞癌cT1期相比增加了第9组淋巴结的清扫, 而无需进行中纵隔淋巴结的清扫, cT2期增加了8a、11p、11d组淋巴结的清扫; 而偏胃侧(GE、G)这两类分型则仅需根据临床分期决定, 其中cT1期应清扫第1、2、3、7、9、19、20组淋巴结及下纵隔淋巴结, 而cT2期及以上在此基础上增加了第8a、11p、11d组淋巴结的清扫. 值得一提的是, 临床操作中第19、20、110、111、112组淋巴结术中通常难以区分, 因此在清扫膈肌裂孔及下纵隔淋巴结的过程中应尽可能做到整块清扫.
Siewert Ⅱ型AEG病人的手术切除范围应结合分期考虑, 对于早期AEG病人(cT1-2), 只要临床上没有怀疑胃远端淋巴结转移, 一般行包括远端食管的近端胃部分切除(限制性切除)就已足够, 4种常见重建方式包括食管胃吻合, 间置空肠单通道, 间置空肠双通道, 含抗返流的食管胃吻合(如Kamikawa)术等. 食管胃吻合术是最简单的方法, 但反流性食管炎发生率高, 在改进行管胃食管吻合后严重的反流性食管炎发生率有明显下降. 双通道重建术的反流性食管炎发生率最低, 但操作相对复杂, 重建的耗材费用也明显增加. 对于中晚期Siewert Ⅱ型病人或早期病人不符合限制性切除的条件, 切除范围及3种常见重建方式包括经胸食管部分切除和近端胃切除, 胸内食管胃吻合术; 经腹全胃切除伴远端食管切除的Roux-en-Y食管空肠吻合术, 如果经TH入路吻合困难, 可以加做经胸切口重建; 食管次全切除和全胃切除, 结肠间置重建术, 适用于肿瘤较大或以前行胃分切除的病人.
在实际临床操作中, 食管胃结合部癌的手术径路不仅需参考肿瘤分期、Siewert或Nishi分型, 还应考虑患者的其他情况, 包括: 肿瘤上下缘与齿状线的距离、食管组织质地是否健康、是否存在水肿、小肠系膜的肥厚程度及游离度、肠系膜血管的长度、是否存在胃或结肠手术史、是否有肺切除史等各项重要指标[17]; 其中肿瘤上缘与齿状线的距离尤为重要, 食管浸润长度既和纵隔淋巴结转移率相关, 也是决定切除重建方式的重要因素. 在新鲜手术标本上, 食道的头侧安全切缘应至少为2 cm, 否则根据Mine等的分析, 预后明显较差[18]. 另外, 食管浸润的程度评估比胃受累更重要, 因为经腹显露食管的入路和长度有限, 而胃则容易显露. 食管远端的暴露对于获得合适的食管切缘和通过经TH入路在下纵隔建立一个安全的吻合口至关重要, 只要其中有一项不能保证, 则需要考虑经胸途径, 不宜以减小手术创伤的名义过度提倡TH径路.
基于上述研究及临床实践, 我们认为, 食管下端浸润长度直接与AEG的手术径路、淋巴结清扫范围和吻合方式相关, 而传统的Siewert分型是以肿瘤中心与齿状线的距离作为分型的主要依据, 在临床实践中存在一定不足: (1)术前往往难以通过CT、钡餐造影、胃镜等检查手段获得准确的肿瘤中心位置, 更无法准确判断肿瘤中心与齿状线之间的距离, 因此术前Siewert分型对手术方式的选择的重要性有限; (2)术中外科医生的关注点主要为肿瘤的上下切缘, 多篇研究[19-22]分析Siewert Ⅱ型食管胃结合部癌的不同手术方式时将食管切除长度、近端及远端切缘距离作为重要评估标准, 而并未纳入肿瘤中心位置, 2019年Siewert Ⅱ型食管胃结合部癌腔镜手术治疗中国专家共识[23]同样要求食管上切缘距离>2 cm, 且建议将上切缘的术中快速冰冻结果纳入手术常规步骤, 由此可见食管上切缘对Siewert Ⅱ型肿瘤具有重要临床评估价值; (3)对于肿瘤直径仅只2-4 cm, 肿瘤中心接近齿线上5 cm的Siewert Ⅰ型肿瘤而言, 其肿瘤上缘接近齿线上6-7 cm, 作为普外科医生在临床实践中很难遇到, 而同样肿瘤中心接近齿线下5 cm的Siewert Ⅲ型肿瘤也更接近胃体癌, 这一部分肿瘤尽管从定义上符合食管胃结合部癌, 但临床上多以食管癌或胃癌的常规诊疗流程进行胸外科或胃外科手术操作. 上述三点表明, 在实际临床操作中外科医生甚少会在术中对肿瘤中心予以准确的测量, 而术后对肿瘤标本进行肿瘤中心与齿状线的距离测量往往因为组织的回缩而影响结果, 有时候只要1 cm的测量误差就可以导致分型上的不同, 使得不同地区不同医院在报道以Siewert分型为标准的AEG时存在较大的差异, 结果缺乏可比性; 且Siewert分型纳入范围过大, 往往将部分食管下端癌及胃体癌纳入一并分析, 可能导致统计结果不准确. 因此, Siewert分型主要通过肿瘤中心作为分型依据, 存在着概念模糊、临床实际操作不便等问题.
日本的Nishi分型虽然同样通过肿瘤中心位置进行分型, 但相较于Siewert分型则更为细致、精准. 肿瘤直径≤4 cm是Nishi分型的纳入标准, 由于日本食道癌及胃癌早期筛查相对普及, 绝大部分患者在体检中即确诊食管胃结合部癌并接受相应手术, 因此以早期病例居多. 而食管胃结合部癌在西方国家发病率较低、我国人口众多导致早期筛查难以普及等因素, 患者多在出现进食哽噎感等临床症状后就诊, 此时病程已进入进展期甚至晚期, 肿瘤直径也往往>4 cm, 因此Nishi分型不符合我国国情, 也是在国际上应用较少的原因之一.
鉴于Siewert分型及Nishi分型各自的一定局限性, 以及食管下端浸润长度评估在手术选择中的重要性, 我们设想, 是否可以沿用Siewert分型的核心理念, 将肿瘤上缘、下缘与齿状线的距离作为分型的主要依据, 结合我国专家共识中推荐的食管受累距离齿状线<3 cm首选经腹膈肌食管裂孔径路, 而≥3 cm者推荐经上腹右胸径路的建议, 将肿瘤上缘、下缘距离齿状线5 cm内纳入食管胃结合部肿瘤, 肿瘤上缘距离齿状线≥3 cm者为Ⅰ型, 齿状线上<3 cm的为Ⅱ型, 齿状线下的为Ⅲ型(见图1), 既简单实用, 易于分型比较, 又有临床实际指导意义.
传统的Siewert及Nishi分型以肿瘤中心作为分型的主要依据, 在临床实践中有一定的局限性, 而肿瘤的食管下端浸润长度在手术方式及路径选择中具有重要意义, 因此我们提出了以食管下端浸润长度为依据的分型设想, 将肿瘤上缘、下缘距离齿状线5 cm内纳入食管胃结合部肿瘤, 肿瘤上缘距离齿状线≥3 cm者为Ⅰ型, 齿状线上<3 cm的为 Ⅱ型, 齿状线下的为Ⅲ型, 简单实用, 又有临床实际指导意义.
学科分类: 胃肠病学和肝病学
手稿来源地: 上海市
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): 0
D级 (一般): D, D
E级 (差): E
科学编辑: 刘继红 制作编辑:张砚梁
| 1. | Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018;68:394-424. [PubMed] [DOI] |
| 2. | Siewert JR, Stein HJ. Classification of adenocarcinoma of the oesophagogastric junction. Br J Surg. 1998;85:1457-1459. [PubMed] [DOI] |
| 3. | Siewert JR, Holscher AH, Becker K, Gossner W. [Cardia cancer: attempt at a therapeutically relevant classification]. Chirurg. 1987;58:25-32. [PubMed] |
| 5. | Aikou T, Shimazu H. Difference in main lymphatic pathways from the lower esophagus and gastric cardia. Jpn J Surg. 1989;19:290-295. [PubMed] [DOI] |
| 6. | Japanese Gastric Cancer Association. Japanese gastric cancer treatment guidelines 2018 (5th edition). Gastric Cancer. 2021;24:1-21. [PubMed] [DOI] |
| 7. | Siewert JR, Stein HJ, Feith M. Adenocarcinoma of the esophago-gastric junction. Scand J Surg. 2006;95:260-269. [PubMed] [DOI] |
| 8. | Hulscher JB, van Sandick JW, de Boer AG, Wijnhoven BP, Tijssen JG, Fockens P, Stalmeier PF, ten Kate FJ, van Dekken H, Obertop H, Tilanus HW, van Lanschot JJ. Extended transthoracic resection compared with limited transhiatal resection for adenocarcinoma of the esophagus. N Engl J Med. 2002;347:1662-1669. [PubMed] [DOI] |
| 9. | Omloo JM, Lagarde SM, Hulscher JB, Reitsma JB, Fockens P, van Dekken H, Ten Kate FJ, Obertop H, Tilanus HW, van Lanschot JJ. Extended transthoracic resection compared with limited transhiatal resection for adenocarcinoma of the mid/distal esophagus: five-year survival of a randomized clinical trial. Ann Surg. 2007;246:992-1000; discussion 1000-1. [PubMed] [DOI] |
| 10. | Li B, Hu H, Zhang Y, Zhang J, Miao L, Ma L, Luo X, Zhang Y, Ye T, Li H, Zhou J, Li Y, Shen L, Zhao K, Fan M, Zhu Z, Wang J, Xu J, Deng Y, Lu Q, Jia H, Cheng X, Li H, Zhang Y, Li C, Pan Y, Liu S, Hu H, Shao L, Sun Y, Xiang J, Chen H. Extended Right Thoracic Approach Compared With Limited Left Thoracic Approach for Patients With Middle and Lower Esophageal Squamous Cell Carcinoma: Three-year Survival of a Prospective, Randomized, Open-label Trial. Ann Surg. 2018;267:826-832. [PubMed] [DOI] |
| 11. | 国际食管疾病学会中国分会(cSDE)食管胃结合部疾病跨界联盟; 中国医师协会内镜医师分会腹腔镜外科专业委员会; 中国医师协会外科医师分会上消化道外科医师专业委员会; 中华医学会肿瘤分会胃肠肿瘤学组. 中华胃肠外科杂志. 2018;21:961-975. |
| 12. | Kitagawa Y, Uno T, Oyama T, Kato K, Kato H, Kawakubo H, Kawamura O, Kusano M, Kuwano H, Takeuchi H, Toh Y, Doki Y, Naomoto Y, Nemoto K, Booka E, Matsubara H, Miyazaki T, Muto M, Yanagisawa A, Yoshida M. Esophageal cancer practice guidelines 2017 edited by the Japan Esophageal Society: part 1. Esophagus. 2019;16:1-24. [PubMed] [DOI] |
| 13. | Sasako M, Sano T, Yamamoto S, Sairenji M, Arai K, Kinoshita T, Nashimoto A, Hiratsuka M; Japan Clinical Oncology Group (JCOG9502). Left thoracoabdominal approach versus abdominal-transhiatal approach for gastric cancer of the cardia or subcardia: a randomised controlled trial. Lancet Oncol. 2006;7:644-651. [PubMed] [DOI] |
| 14. | Kurokawa Y, Sasako M, Sano T, Yoshikawa T, Iwasaki Y, Nashimoto A, Ito S, Kurita A, Mizusawa J, Nakamura K; Japan Clinical Oncology Group (JCOG9502). Ten-year follow-up results of a randomized clinical trial comparing left thoracoabdominal and abdominal transhiatal approaches to total gastrectomy for adenocarcinoma of the oesophagogastric junction or gastric cardia. Br J Surg. 2015;102:341-348. [PubMed] [DOI] |
| 15. | 季 加孚, 季 科. 食管胃结合部腺癌外科治疗进展. 中国普外基础与临床杂志. 2019;26:1021-1024. [DOI] |
| 16. | Yamashita H, Seto Y, Sano T, Makuuchi H, Ando N, Sasako M; Japanese Gastric Cancer Association and the Japan Esophageal Society. Results of a nation-wide retrospective study of lymphadenectomy for esophagogastric junction carcinoma. Gastric Cancer. 2017;20:69-83. [PubMed] [DOI] |
| 17. | Holscher AH, Law S. Esophagogastric junction adenocarcinomas: individualization of resection with special considerations for Siewert type II, and Nishi types EG, E=G and GE cancers. Gastric Cancer. 2020;23:3-9. [PubMed] [DOI] |
| 18. | Mine S, Sano T, Hiki N, Yamada K, Kosuga T, Nunobe S, Yamaguchi T. Proximal margin length with transhiatal gastrectomy for Siewert type II and III adenocarcinomas of the oesophagogastric junction. Br J Surg. 2013;100:1050-1054. [PubMed] [DOI] |
| 19. | 王 道胜, 曹 守根, 谭 晓杰, 刘 尚龙, 刘 晓东, 牛 兆建, 陈 栋, 王 东升, 张 坚, 吕 亮, 李 宇, 江 海涛, 郭 栋, 李 毅, 李 泽群, 周 岩冰. 机器人与腹腔镜辅助手术对SiewertⅡ型食管胃结合部腺癌淋巴结清扫及近期结局的影响. 中华胃肠外科杂志. 2019;22:156-163. [DOI] |
| 20. | 杨 世界, 袁 勇, 胡 皓源, 李 睿哲, 刘 凯, 张 维汉, 杨 昆, 杨 玉赏, 白 丹, 陈 心足, 周 总光, 陈 龙奇. SiewertⅡ型食管胃结合部腺癌经胸与经腹入路手术的预后比较-胸外科与胃肠外科联合数据分析. 中华胃肠外科杂志. 2019;22:132-142. |
| 21. | 余 盼攀, 张 健, 孔 文成, 朱 阿考, 尹 光, 袁 美娟, 章 静, 应 荣超. 完全腹腔镜经腹经膈肌裂孔入路在Siewert Ⅱ型食管胃结合部腺癌根治术中的应用价值. 中华消化外科杂志. 2019;18:587-593. [DOI] |