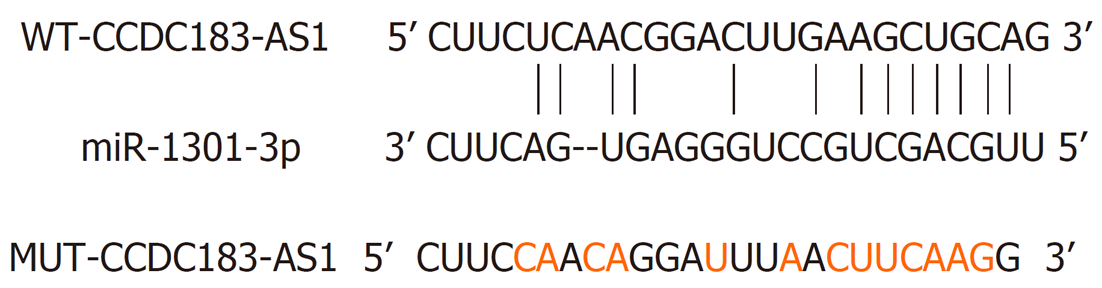修回日期: 2021-05-20
接受日期: 2021-06-28
在线出版日期: 2021-09-08
长链非编码RNA(long non-coding RNA, lncRNA) CCDC183-AS1在肝细胞癌中表达上调, 促进肝细胞癌进展. 但lncRNA CCDC183-AS1对胃癌的影响及其分子机制还未知. StarBase预测显示, lncRNA CCDC183-AS1可能靶向结合miR-1301-3p. 本研究假设lncRNA CCDC183-AS1可靶向调控miR-1301-3p影响胃癌细胞的增殖、迁移和侵袭, 进而影响胃癌发展进程.
探讨lncRNA CCDC183-AS1对胃癌AGS细胞增殖、迁移和侵袭的影响以及其分子机制.
选取本院30例胃癌组织及匹配的癌旁组织;实时荧光定量PCR(real-time fluorescence quantitative PCR, RT-qPCR)检测lncRNA CCDC183-AS1和miR-1301-3p表达及变化; 四甲基偶氮唑盐比色法(methyl thiazolye telrazlium, MTT)检测细胞增殖, Transwell检测细胞迁移侵袭, 蛋白质印迹(Western blot)检测细胞周期素D1(CyclinD1)、基质金属蛋白酶2(matrix metalloproteinase 2, MMP-2)、基质金属蛋白酶9(matrix metalloproteinase 9, MMP-9)和p21蛋白的表达; AGS细胞中分别转染si-CCDC183-AS1、miR-1301-3p, 并利用上述检测细胞增殖、迁移侵袭能力的变化; StarBase预测显示lncRNA CCDC183-AS1的序列中含有与miR-1301-3p互补的核苷酸序列, 双荧光素酶报告实验鉴定其靶向关系.
与癌旁组织比较, 胃癌组织中lncRNA CCDC183-AS1和miR-1301-3p的表达水平分别显著升高和降低(P<0.05). 抑制lncRNA CCDC183-AS1表达或过表达miR-1301-3p后, AGS细胞的增殖和迁移侵袭能力下降, CyclinD1、MMP-2和MMP-9表达水平降低, p21表达水平升高(P<0.05). lncRNA CCDC183-AS1靶向调控miR-1301-3p表达(P<0.05). 下调miR-1301-3p表达逆转了抑制lncRNA CCDC183-AS1表达对胃癌AGS细胞增殖、迁移和侵袭的影响.
抑制lncRNA CCDC183-AS1通过靶向上调miR-1301-3p表达调控胃癌AGS细胞的增殖、迁移和侵袭.
核心提要: 长链非编码RNA(long non-coding RNA, lncRNA) CCDC183-AS1在胃癌中高表达,而miR-1301-3p低表达, 双荧光素酶报告实验证实lncRNA CCDC183-AS1可靶向miR-1301-3p, 下调lncRNA CCDC183-AS1可靶向负调控miR-1301-3p表达抑制胃癌细胞增殖、迁移和侵袭.
引文著录: 张红英, 何陈聪, 钟定福. lncRNA CCDC183-AS1通过靶向miR-1301-3p调控胃癌AGS细胞的增殖、迁移和侵袭. 世界华人消化杂志 2021; 29(17): 990-998
Revised: May 20, 2021
Accepted: June 28, 2021
Published online: September 8, 2021
The long noncoding RNA (lncRNA) CCDC183-AS1 is up-regulated in hepatocellular carcinoma and promotes the progression of hepatocellular carcinoma. However, the effect of CCDC183-AS1 on gastric cancer and its molecular mechanism are unknown. Starbase prediction shows that CCDC183-AS1 may target miR-1301-3p. We hypothesized that CCDC183-AS1 can target and regulate miR-1301-3p to affect the proliferation, migration, and invasion of gastric cancer cells, thereby affecting the development of gastric cancer.
To investigate the effect of CCDC183-AS1 on the proliferation, migration, and invasion of gastric cancer AGS cells and the underlying molecular mechanism.
Thirty gastric cancer tissues and matched adjacent normal tissues were collected at our hospital. RT-qPCR was used to detect the expression of CCDC183-AS1 and miR-1301-3p in the collected tissues. MTT assay was used to detect cell proliferation in AGS cells, and transwell assay was used to detect cell migration and invasion. Western blot was used to detect the protein expression of CyclinD1, MMP-2, MMP-9, and p21. Small interfering RNA targeting CCDC183-AS1 (si-CCDC183-AS1) and miR-1301-3p were transfected into AGS cells, respectively, and the changes in cell proliferation, migration, and invasion were detected using the above methods. StarBase prediction showed that the sequence of lncRNA CCDC183-AS1 contains nucleotide sequences complementary to miR-1301-3p, and the targeting relationship was confirmed by dual luciferase report assay.
Compared with adjacent normal tissues, the expression levels of CCDC183-AS1 and miR-1301-3p in gastric cancer tissues were significantly increased and decreased, respectively (P < 0.05). Inhibition of CCDC183-AS1 or overexpression of miR-1301-3p reduced the proliferation, migration, and invasion of AGS cells, decreased the expression levels of CyclinD1, MMP-2, and MMP-9, and increased the expression level of p21 (P < 0.05). CCDC183-AS1 targeted the expression of miR-1301-3p. Down-regulation of miR-1301-3p reversed the effect of inhibition of CCDC183-AS1 expression on the proliferation, migration, and invasion of AGS cells.
Inhibition of CCDC183-AS1 regulates the proliferation, migration, and invasion of gastric cancer AGS cells via targeted up-regulation of miR-1301-3p expression.
- Citation: Zhang HY, He CC, Zhong DF. Long non-coding RNA CCDC183-AS1 regulates gastric cancer AGS cell proliferation, migration, and invasion by targeting miR-1301-3p. Shijie Huaren Xiaohua Zazhi 2021; 29(17): 990-998
- URL: https://www.wjgnet.com/1009-3079/full/v29/i17/990.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v29.i17.990
胃癌是全球最常见恶性肿瘤之一. 饮食、感染、吸烟、肥胖和幽门螺杆菌等都与胃癌的发生发展有关[1]. 据报道, 2018年全球新增胃癌数量超1000万, 死亡人数783万[2]. 目前治疗方法主要有手术、化疗、放疗、靶向治疗和免疫基因治疗等, 但由于晚期、耐药和高复发率, 患者5年生存率低于30%[3]. 因此, 亟待寻找有效的治疗手段. 长链非编码RNA(long non-coding RNA, lncRNA)是指长度超过200个核苷酸且不具有编码蛋白功能的转录本, 众多研究表明, lncRNAs参与人类多种癌症的发生、发展及预后[4]. lncRNA CCDC183-AS1位于人类Chr 9q34.3区域, 研究发现, 在肝细胞癌中, lncRNA CCDC183-AS1高表达与患者低总生存率有关, 并促进肝细胞癌细胞的增殖、迁移和侵袭以及体内肿瘤的生长和转移[5]. 然而lncRNA CCDC183-AS1在胃癌中的表达和作用尚不明确, StarBase预测显示, lncRNA CCDC183-AS1与miR-1301-3p具有互补核苷酸序列. 研究报道[6], 沉默miR-1301-3p可消除下调LINC01207对胃癌细胞生长和迁移的抑制作用. 尽管已有研究确定miR-1301-3p在胃癌中的作用, 但lncRNA CCDC183-AS1在胃癌中的作用以及其分子机制是否与miR-1301-3p有关还尚未可知. 因此, 本实验以胃癌AGS细胞为体外研究对象, 探讨lncRNA CCDC183-AS1是否通过靶向调控miR-1301-3p表达来影响胃癌细胞的增殖、迁移和侵袭.
选取本院2017-01/2019-01期间经病理检测为胃癌的患者30例, 获得原发性胃癌组织及相应癌旁组织, 每位患者均知情且同意, 手术切除后立即将样本保存在-80 ℃. 本研究经本院伦理委员会批准. 胃癌AGS细胞系购自中国科学院上海细胞库; 胎牛血清、DMEM培养基购自美国Hyclone公司; Trziol、反转录、实时荧光定量PCR(real-time fluorescence quantitative PCR , RT-qPCR)试剂盒购自日本Takara公司; 四甲基偶氮唑盐比色法(methye thiazolye telrazlium, MTT)试剂购自上海晶抗生物工程有限公司; Transwell小室购于美国密理博公司; RIPA蛋白裂解液、二辛可宁酸试剂盒购自上海研谨生物科技有限公司; 双荧光素酶报告基因检测试剂盒购自北京百奥莱博科技有限公司; Lipofectamine2000购自美国Invitrogen公司.
1.2.1 细胞转染与分组: 取对数生长期AGS细胞, 将si-NC、si-CCDC183-AS1、miR-NC、miR-1301-3p分别转染至其中, 记为si-NC组、si-CCDC183-AS1组、miR-NC组、miR-1301-3p组; 将si-CCDC183-AS1分别与anti-miR-NC、anti-miR-1301-3p共转染至AGS细胞中, 记为si-CCDC183-AS1+anti-miR-NC组、si-CCDC183-AS1+anti-miR-1301-3p组.
1.2.2 RT-qPCR: 提取细胞总RNA, 反转录成cDNA, lncRNA CCDC183-AS1和miR-1301-3p分别以GAPDH和U6为内参, 相对表达量采用2-△△Ct法计算. lncRNA CCDC183-AS1上游引物序列: 5'-GACTTGATCCGTTGGCCTGA-3', 下游引物序列: 5'-CTTGGACTTCCCCTCGAACC-3'; miR-1301-3p上游引物序列: 5'-TTACAGCTGCCTGAGAGTGACTTA-3', 下游引物序列: 5'-CTCTACAGCTATATTGCCAGCCA-3'; GAPDH上游引物序列: 5'-ACAACTTTGGTATCGTGGAAGG-3', 下游引物序列: 5'-GCCATCACGCCACAGTTTC-3'; U6上游引物序列: 5'-CGCTTCGGCAGGCATTATATAC-3', 下游引物序列: 5'-AAGGGGCCATGCTAATCTT-3'; 引物由上海生工生物工程公司合成.
1.2.3 MTT检测细胞活性: 取各组AGS细胞(2.5×104个/mL), 接种于96孔板(100 μL/L), 培养48 h后, 加入MTT溶液20 μL/孔, 培养4 h, 弃上清, 加入DMSO 150 μL/孔, 室温震荡孵育5 min, 酶标仪检测450 nm处的OD值.
1.2.4 Transwell检测细胞迁移与侵袭: Transwell小室上室接种AGS细胞(5×104个/孔), 下室加入600 μL(含10%胎牛血清)培养液, 37 ℃下孵育24 h后, 棉签擦去未穿膜细胞. 多聚甲醛固定, 0.1%结晶紫染色. 置于显微镜下计数.
1.2.5 Western blot检测蛋白表达: 提取各组细胞总蛋白, BCA试剂盒进行定量. 各组蛋白上样量60 μg, 进行聚丙烯酰胺凝胶电泳后, 转至聚偏二氟乙烯膜上, 5%脱脂牛奶室温封闭1 h, 一抗4 ℃孵育过夜, 二抗室温孵育2 h, 暗室中曝光显影, 定影, Image J软件分析目的蛋白的相对表达量.
1.2.6 双荧光素酶报告实验: StarBase预测显示lncRNA CCDC183-AS1与miR-1301-3p存在结合位点, 构建CCDC183-AS1野生型和突变型荧光素酶表达载体WT-CCDC183-AS1和MUT-CCDC183-AS1, 将其分别与miR-NC和miR-1301-3p共转染至AGS细胞中, 按照说明书检测荧光素酶活性.
统计学处理 采用SPSS 21.0统计学软件分析数据, 每组实验重复9次, 计量资料以(mean±SD)表示且均符合正态分布, 两组间比较采用独立样本t检验, 多组间比较采用单因素方差分析, 以P<0.05为差异具有统计学意义.
与癌旁组织比较, 胃癌组织中CCDC183-AS1和miR-1301-3p的表达水平分别显著升高和降低(P<0.05); 与人正常胃粘膜细胞GES-1比较, 胃癌细胞AGS、N87、HGC-27、SNU-484中CCDC183-AS1和miR-1301-3p的表达水平分别显著升高和降低(P<0.05)(表1, 表2). 后续实验选用AGS细胞.
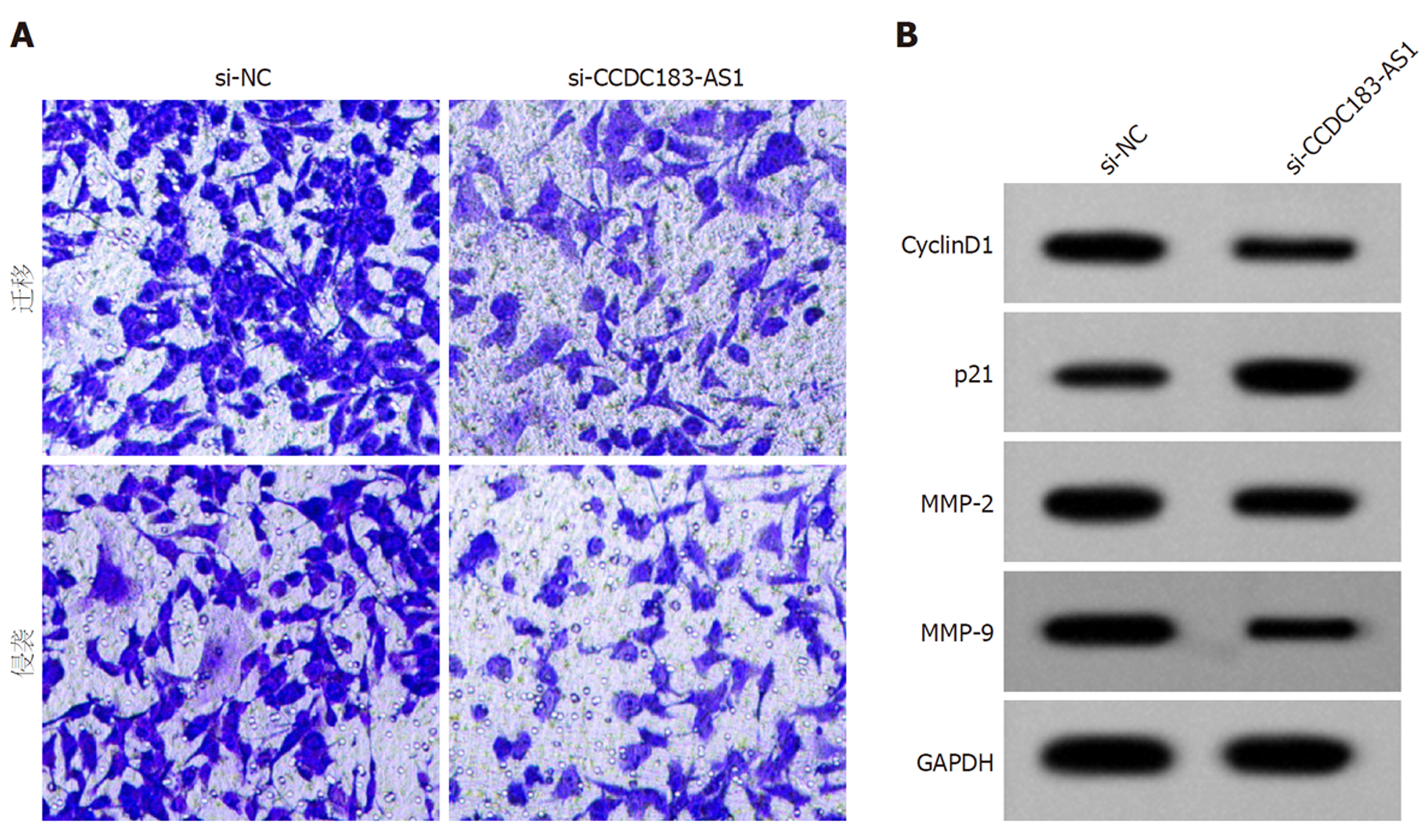
转染si-CCDC183-AS1后, AGS细胞中CCDC183-AS1的表达水平降低, OD值、迁移细胞数、侵袭细胞数、细胞周期素D1(CyclinD1)、基质金属蛋白酶2(matrix metalloproteinase 2, MMP-2)和基质金属蛋白酶9(matrix metalloproteinase 9, MMP-9)表达水平降低, p21表达水平升高(P<0.05)(图1, 表3, 表4).
StarBase预测的lncRNA CCDC183-AS1与miR-1301-3p的互补核苷酸序列(图2). 转染miR-1301-3p的WT-CCDC183-AS1荧光素酶活性降低(P<0.05)(表5). lncRNA CCDC183-AS1靶向调控miR-1301-3p表达(P<0.05)(表6).
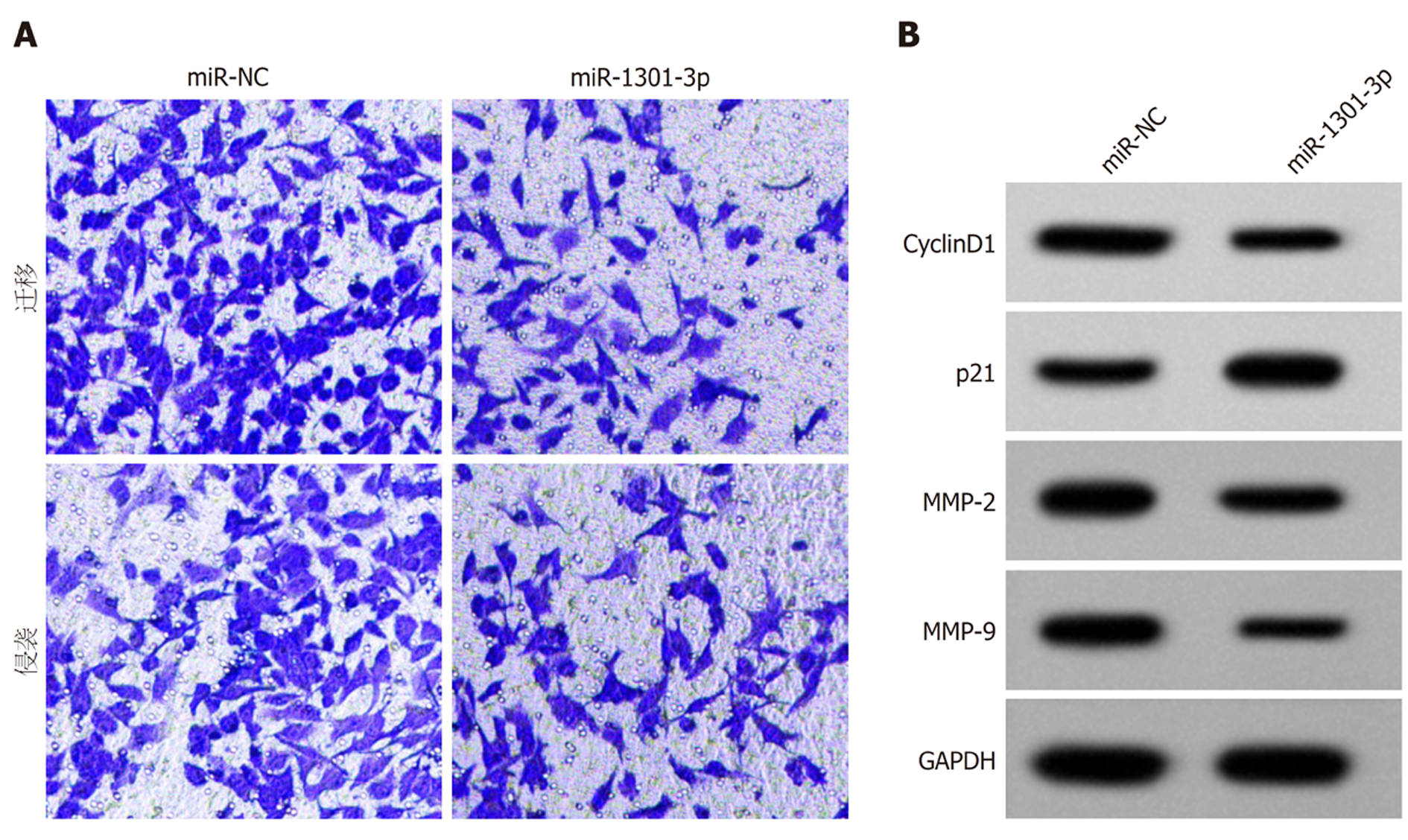
转染miR-1301-3p后, AGS细胞中miR-1301-3p的表达水平升高, OD值、迁移细胞数、侵袭细胞数、CyclinD1、MMP-2和MMP-9表达水平降低, p21表达水平升高(P<0.05)(图3, 表7, 表8).
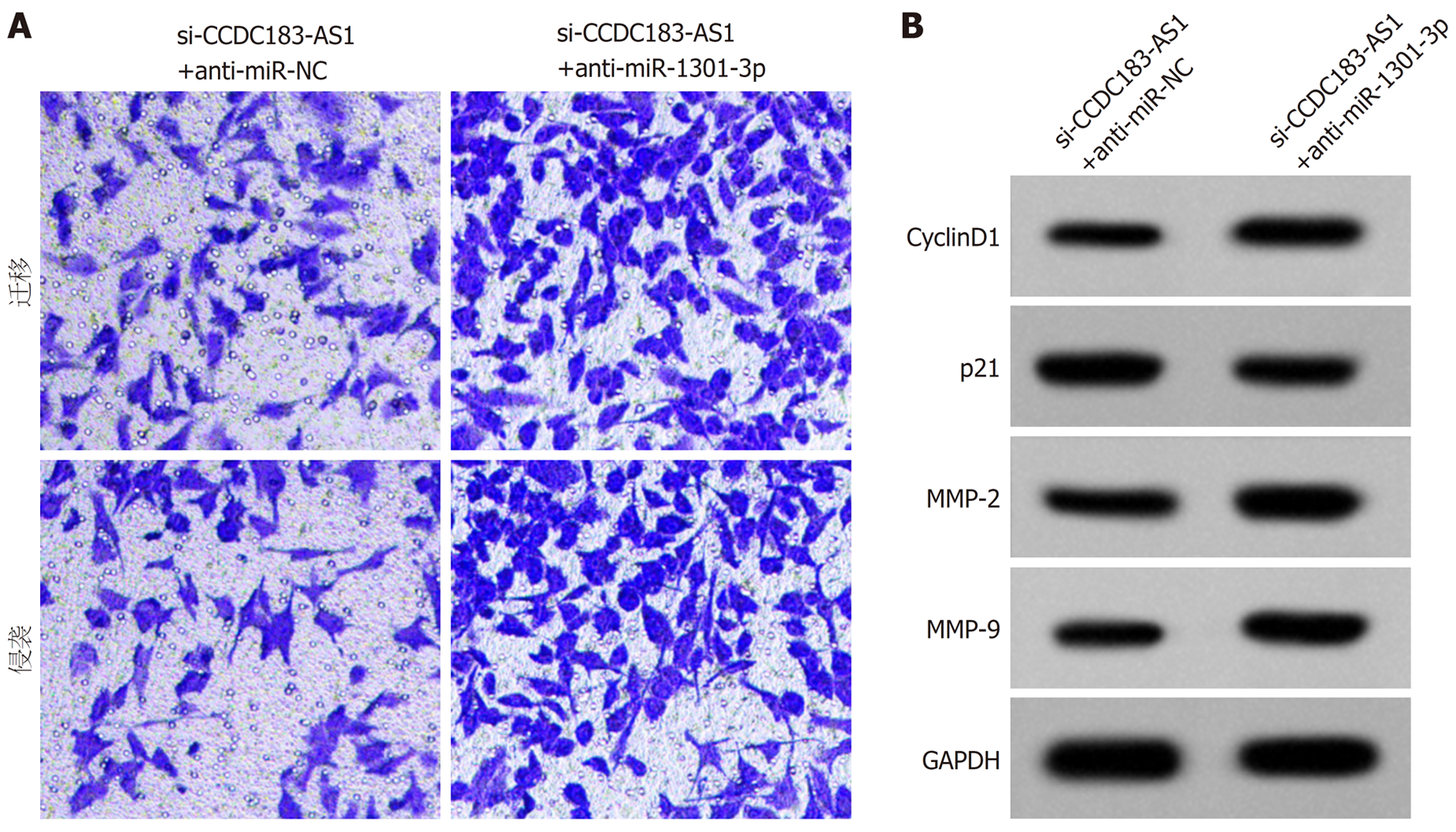
共转染si-CCDC183-AS1、anti-miR-1301-3p后, AGS细胞中miR-1301-3p的表达水平降低, OD值、迁移细胞数、侵袭细胞数、CyclinD1、MMP-2和MMP-9表达水平升高, p21表达水平降低(P<0.05)(图4, 表9, 表10).
越来越多证据表明, lncRNAs在胃癌发生发展中的作用, 如lncRNA KCNQ1OT1在胃癌组织和细胞中高表达, 敲减lncRNA KCNQ1OT1可抑制肿瘤生长、细胞活力和集落形成, 促进细胞凋亡, lncRNA KCNQ1OT1通过miR-145-5p/ARF6轴促进胃癌进展[7]. 在胃癌中, LINC01224和CDK8表达上调, miR-193a-5p表达下调, LINC01224促进细胞增殖、迁移和侵袭, 抑制细胞凋亡, 下调miR-193a-5p部分消除了沉默LINC01224对胃癌细胞恶性行为的抑制作用[8]. lncRNA HOXA-AS3的高表达与胃癌肿瘤大小、淋巴结状态、浸润深度和幽门螺杆菌感染状态相关, 敲除lncRNA HOXA-AS3可抑制细胞增殖、迁移、侵袭和肿瘤转移[9]. 与正常胃粘膜上皮细胞相比, 胃癌细胞中lncRNA SNHG4表达水平升高, 下调其表达通过靶向上调miR-204-5p抑制细胞的增殖、迁移和侵袭, 并阻断细胞周期的进程[10]. lncRNA HIF1A-AS2在胃癌组织和细胞中表达升高, 下调miR-429消除了敲减lncRNA HIF1A-AS2对细胞增殖、迁移和侵袭的抑制作用[11]. lncRNA HCP5通过miR-519d/HMGA1轴增强胃癌细胞的增殖和顺铂耐药性[12]. 与上述结果一致, 本实验结果显示, 与癌旁组织相比, 胃癌组织中lncRNA CCDC183-AS1表达水平显著升高, 抑制lncRNA CCDC183-AS1表达显著降低了胃癌AGS细胞的增殖、迁移和侵袭能力. CyclinD1促进细胞周期由G1期到S期的转变, 其过表达可促进细胞增殖, 导致细胞增殖异常[13], 而p21发挥肿瘤抑制作用, 促进多种刺激下的细胞周期阻滞[14,15]. MMPs在癌细胞的侵袭、转移和血管生成中发挥重要作用, MMP-2、MMP-9是MMPs家族的两个重要成员, 是癌细胞转移的关键调控因子[16,17]. 本实验结果显示, 抑制lncRNA CCDC183-AS1表达后, CyclinD1、MMP-2和MMP-9表达水平降低, p21表达水平升高, 进一步说明lncRNA CCDC183-AS1对胃癌AGS细胞增殖、迁移和侵袭的调控作用.
研究表明lncRNAs可作为ceRNA或"分子海绵"负调控肿瘤相关miRNA表达来促进胃癌进展[7-12]. 本实验的StarBase预测显示, lncRNA CCDC183-AS1与miR-1301-3p含有互补核苷酸序列, 双荧光素酶报告实验显示, 在WT-CCDC183-AS1中, 转染miR-1301-3p的荧光素酶活性显著降低, lncRNA CCDC183-AS1靶向负调控miR-1301-3p表达. 研究表明, miR-1301-3p参与了多种癌症细胞的增殖、迁移、侵袭和凋亡, 下调miR-1301-3p可逆转敲减circ_0004370对食管癌细胞恶性行为的抑制作用[18]. miR-1301-3p的低表达与甲状腺乳头状癌的T、N分级升高显著相关, 上调miR-1301-3p通过下调PCNA表达抑制TPC-1细胞的增殖[19]. 在膀胱癌细胞中, lncRNA NNT-AS1和PODXL表达升高, miR-1301-3p表达降低, lncRNA NNT-AS1通过靶向miR-1301-3p/PODXL轴和激活Wnt通路促进细胞生长[20]. miR-1301在骨肉瘤细胞中低表达, 表阿霉素通过调控miR-1301/TRIAP1轴抑制骨肉瘤细胞的增殖, 并促进细胞凋亡[21]. miR-1301-3p的低表达与乳腺癌肿瘤大小及临床分期密切相关, 上调miR-1301-3p通过靶向下调ICT1表达抑制乳腺癌细胞的增殖, 促进细胞凋亡[22]. 与前人研究结果一致, 与癌旁组织相比, 胃癌组织中miR-1301-3p表达显著降低, 过表达miR-1301-3p显著降低了胃癌AGS细胞的增殖、迁移和侵袭能力. 且下调miR-1301-3p表达逆转了抑制lncRNA CCDC183-AS1表达对胃癌AGS细胞增殖、迁移和侵袭的影响. 提示lncRNA CCDC183-AS1可能通过调控miR-1301-3p表达影响AGS细胞的增殖、迁移和侵袭.
综上所述, lncRNA CCDC183-AS1在胃癌组织中表达上调, 抑制lncRNA CCDC183-AS1通过靶向上调miR-1301-3p表达降低胃癌AGS细胞的增殖、迁移和侵袭能力. 这意味着lncRNA CCDC183-AS1可能是治疗胃癌的新靶点, 但仅限于体外实验, 其在体内的作用及调控机制还有待进一步研究.
胃癌的致病机理尚不明确, 已有研究发现长链非编码RNA(long non-coding RNA, lncRNA)的异常表达与胃癌细胞的恶性生物学行为有关, 但lncRNA CCDC183-AS1对胃癌细胞恶性生物学行为的影响尚未可知.
lncRNA CCDC183-AS1在肝细胞癌中表达上调, 促进肝细胞癌细胞的增殖、迁移和侵袭以及体内肿瘤的生长和转移, 但其对胃癌细胞的影响及分子机制还尚未可知. StarBase预测显示, lncRNA CCDC183-AS1可能靶向结合miR-1301-3p. 已有研究称, 沉默miR-1301-3p可消除下LINC01207对胃癌细胞生长和迁移的抑制作用. 但lncRNA CCDC183-AS1能否靶向调控miR-1301-3p影响胃癌细胞 的增殖、迁移和侵袭尚不清楚. 因此, 探究lncRNA CCDC183-AS1对胃癌细胞增殖、迁移和侵袭的影响及其能否靶向miR-1301-3p发挥作用, 以期为胃癌治疗提供新思路.
探究lncRNA CCDC183-AS1对胃癌细胞增殖、迁移和侵袭的影响及其能否靶向miR-1301-3p发挥作用, 为胃癌治疗提供新思路.
RT-qPCR检测胃癌组织和细胞中lncRNA CCDC183-AS1和miR-1301-3p的表达. 分别转染lncRNA CCDC183-AS1小干扰RNA、miR-1301-3p模拟物至胃癌细胞AGS中, RT-qPCR检测其转染效果, MTT检测细胞增殖, Transwell检测细胞迁移和侵袭, Western blot检测CyclinD1、p21、基质金属蛋白酶2(matrix metalloproteinase 2, MMP-2)和基质金属蛋白酶9(matrix metalloproteinase 9, MMP-9)蛋白表达. 双荧光素酶报告实验验证lncRNA CCDC183-AS1与miR-1301-3p的靶向调控关系.
胃癌组织中lncRNA CCDC183-AS1高表达, miR-1301-3p低表达. 抑制lncRNA CCDC183-AS1表达或高表达miR-1301-3p可降低AGS细胞OD值、迁移细胞数、侵袭细胞数以及CyclinD1、MMP-2、MMP-9表达水平, 提高p21表达水平. lncRNA CCDC183-AS1可靶向负调控miR-1301-3p表达,下调miR-1301-3p表达逆转了抑制lncRNA CCDC183-AS1表达对AGS细胞增殖、迁移和侵袭的抑制作用.
胃癌组织中lncRNA CCDC183-AS1表达升高, 抑制lncRNA CCDC183-AS1表达可降低AGS细胞的增殖、迁移和侵袭能力, 其分子机制可能与靶向上调miR-1301-3p有关, 为胃癌的靶向分子治疗提供了新靶点.
miR-1301-3p下游靶基因以及信号通路在胃癌进展中的作用还未知, 且本研究仅仅限于体外实验, 还需进一步验证lncRNA CCDC183-AS1/miR-1301-3p轴在裸鼠移植瘤实验中对胃癌进展的作用.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C, C
D级 (一般): 0
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D. Global cancer statistics. CA Cancer J Clin. 2011;61:69-90. [PubMed] [DOI] |
| 2. | Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018;68:394-424. [PubMed] [DOI] |
| 3. | Zhang H, Fu T, Zhang C. MicroRNA-1249 Targets G Protein Subunit Alpha 11 and Facilitates Gastric Cancer Cell Proliferation, Motility and Represses Cell Apoptosis. Onco Targets Ther. 2021;14:1249-1259. [PubMed] [DOI] |
| 4. | Gao J, Wang F, Wu P, Chen Y, Jia Y. Aberrant LncRNA Expression in Leukemia. J Cancer. 2020;11:4284-4296. [PubMed] [DOI] |
| 5. | Zhu H, Zhang H, Pei Y, Liao Z, Liu F, Su C, Liu Y, Dong R, Song J, Zhang X, Fan Y, Liang H, Zhang B, Chen X. Long non-coding RNA CCDC183-AS1 acts AS a miR-589-5p sponge to promote the progression of hepatocellular carcinoma through regulating SKP1 expression. J Exp Clin Cancer Res. 2021;40:57. [PubMed] [DOI] |
| 6. | Yu L, Gao Y, Ji B, Feng Z, Li T, Luan W. CTCF-induced upregulation of LINC01207 promotes gastric cancer progression via miR-1301-3p/PODXL axis. Dig Liver Dis. 2021;53:486-495. [PubMed] [DOI] |
| 7. | Zhong X, Wen X, Chen L, Gu N, Yu X, Sui K. Long non-coding RNA KCNQ1OT1 promotes the progression of gastric cancer via the miR-145-5p/ARF6 axis. J Gene Med. 2021;23:e3330. [PubMed] [DOI] |
| 8. | Sun H, Yan J, Tian G, Chen X, Song W. LINC01224 accelerates malignant transformation via MiR-193a-5p/CDK8 axis in gastric cancer. Cancer Med. 2021;10:1377-1393. [PubMed] [DOI] |
| 9. | Qu F, Zhu B, Hu YL, Mao QS, Feng Y. LncRNA HOXA-AS3 promotes gastric cancer progression by regulating miR-29a-3p/LTβR and activating NF-κB signaling. Cancer Cell Int. 2021;21:118. [PubMed] [DOI] |
| 10. | Cheng XB, Zhang T, Zhu HJ, Ma N, Sun XD, Wang SH, Jiang Y. Knockdown of lncRNA SNHG4 suppresses gastric cancer cell proliferation and metastasis by targeting miR-204-5p. Neoplasma. 2021;68:546-556. [PubMed] [DOI] |
| 11. | Mu L, Wang Y, Su H, Lin Y, Sui W, Yu X, Lv Z. HIF1A-AS2 Promotes the Proliferation and Metastasis of Gastric Cancer Cells Through miR-429/PD-L1 Axis. Dig Dis Sci. 2021;. [PubMed] [DOI] |
| 12. | Zhang Z, Wang H. HCP5 Promotes Proliferation and Contributes to Cisplatin Resistance in Gastric Cancer Through miR-519d/HMGA1 Axis. Cancer Manag Res. 2021;13:787-794. [PubMed] [DOI] |
| 13. | Lee JY, Lee NK. Up-regulation of cyclinD1 and Bcl2A1 by insulin is involved in osteoclast proliferation. Life Sci. 2014;114:57-61. [PubMed] [DOI] |
| 14. | Kim J, Bae S, An S, Park JK, Kim EM, Hwang SG, Kim WJ, Um HD. Cooperative actions of p21WAF1 and p53 induce Slug protein degradation and suppress cell invasion. EMBO Rep. 2014;15:1062-1068. [PubMed] [DOI] |
| 15. | Karimian A, Ahmadi Y, Yousefi B. Multiple functions of p21 in cell cycle, apoptosis and transcriptional regulation after DNA damage. DNA Repair (Amst). 2016;42:63-71. [PubMed] [DOI] |
| 16. | Lin HJ, Su CC, Lu HF, Yang JS, Hsu SC, Ip SW, Wu JJ, Li YC, Ho CC, Wu CC, Chung JG. Curcumin blocks migration and invasion of mouse-rat hybrid retina ganglion cells (N18) through the inhibition of MMP-2, -9, FAK, Rho A and Rock-1 gene expression. Oncol Rep. 2010;23:665-670. [PubMed] [DOI] |
| 17. | Stetler-Stevenson WG. The role of matrix metalloproteinases in tumor invasion, metastasis, and angiogenesis. Surg Oncol Clin N Am. 2001;10:383-392, x. [PubMed] [DOI] |
| 18. | Chen X, Sun H, Zhao Y, Zhang J, Xiong G, Cui Y, Lei C. CircRNA circ_0004370 promotes cell proliferation, migration, and invasion and inhibits cell apoptosis of esophageal cancer via miR-1301-3p/COL1A1 axis. Open Med (Wars). 2021;16:104-116. [PubMed] [DOI] |
| 19. | Qiao DH, He XM, Yang H, Zhou Y, Deng X, Cheng L, Zhou XY. miR-1301-3p suppresses tumor growth by downregulating PCNA in thyroid papillary cancer. Am J Otolaryngol. 2021;42:102920. [PubMed] [DOI] |
| 20. | Liu Y, Wu G. NNT-AS1 enhances bladder cancer cell growth by targeting miR-1301-3p/PODXL axis and activating Wnt pathway. Neurourol Urodyn. 2020;39:547-557. [PubMed] [DOI] |
| 21. | Yu L, Meng M, Bao Y, Zhang C, Gao B, Sa R, Luo W. miR-1301/TRIAP1 Axis Participates in Epirubicin-Mediated Anti-Proliferation and Pro-Apoptosis in Osteosarcoma. Yonsei Med J. 2019;60:832-841. [PubMed] [DOI] |
| 22. | Peng X, Yan B, Shen Y. MiR-1301-3p inhibits human breast cancer cell proliferation by regulating cell cycle progression and apoptosis through directly targeting ICT1. Breast Cancer. 2018;25:742-752. [PubMed] [DOI] |