修回日期: 2021-04-09
接受日期: 2021-05-25
在线出版日期: 2021-08-08
幽门螺杆菌(Helicobacter pylori, H. pylori)感染公认的Ⅰ类致癌因素, 但其与结直肠癌(colorectal cancer, CRC)上皮-间质转化(epithelial-mesenchymal transition, EMT)的关系报道较少. 故本研究推测H. pylori感染与EMT存在一定相关性, 在CRC发生、发展中可能起着重要作用.
探讨H. pylori感染与CRC患者EMT的相关性.
选取2016-01/2017-10我院经手术组织病理检查证实为CRC患者97例, 另选取同期因其他原因接受肠切除术患者118例作为对照组. 比较两组基线资料、H. pylori感染、EMT相关蛋白[E-钙黏蛋白(E-cadherin, E-cad)、波形蛋白(vimentin, VIM)、β-连环素(β-catenin, β-CAT)]阳性率, 探讨不同H. pylori感染状态下EMT相关蛋白表达及临床病理参数, 分析H. pylori感染与EMT相关蛋白表达相关性, 评价H. pylori感染与生存的关系.
H. pylori感染、VIM、β-CAT蛋白阳性率: 观察组>对照组, E-cad蛋白阳性率: 观察组<对照组(P<0.05); 观察组H. pylori阳性者分化程度低分化、临床分期Ⅲ+Ⅳ期、浸润深度全层/浆膜外比例、区域淋巴结转移比例、VIM、β-CAT蛋白阳性率高于H. pylori阴性者, E-cad蛋白阳性率低于H. pylori阴性者(P<0.05); H. pylori感染与E-cad蛋白呈负相关, 与VIM、β-CAT蛋白呈正相关(P<0.05); H. pylori阳性表达患者3年生存率低于阴性表达患者(P<0.05).
H. pylori感染与CRC患者EMT存在一定相关性, 推测H. pylori感染可能通过促进EMT发生导致CRC侵袭、转移及不良预后.
核心提要: 幽门螺杆菌(Helicobacter pylori, H. pylori)感染与结直肠癌(colorectal cancer, CRC)患者上皮-间质转化(epithelial-mesenchymal transition, EMT)相关, 可为临床评估CRC发生、侵袭、转移及不良预后提供科学指导.
引文著录: 楼何飞, 马春梅, 傅英芝, 张术. 幽门螺杆菌感染与结直肠癌EMT的相关性研究. 世界华人消化杂志 2021; 29(15): 858-865
Revised: April 9, 2021
Accepted: May 25, 2021
Published online: August 8, 2021
Helicobacter pylori (H. pylori) has been recognized as a class I carcinogen, but its relationship with epithelial-mesenchymal transition (EMT) in colorectal cancer (CRC) T) is rarely reported. We hypothesized that H. pylori infection is related to EMT and may play an important role in the occurrence and development of CRC.
To investigate the relationship between H. pylori infection and EMT in CRC patients.
From January 2016 to October 2017, 97 patients with CRC confirmed by surgical histopathological examination at our hospital were selected, and 118 patients who underwent bowel resection for other reasons during the same period were selected as a control group. Baseline data, H. pylori infection, and the positive rates of EMT-related proteins [E-cadherin (E-cad), vimentin (VIM), and β-catenin (β-CAT)] were compared between the two groups. The expression of EMT-related proteins and clinicopathological parameters in different H. pylori infection states were analyzed to assess the association of H. pylori infection with EMT-related protein expressionn and survival.
The positive rates of H. pylori infection and VIM and β-CAT protein expression were significantly higher in the observation group than in the control group, while the positive rate of E-cad protein expression was significantly lower in the observation group than in the control group (P < 0.05). In the observation group, significantly more H. pylori positive patients had poor differentiation, clinical stage Ⅲ/Ⅳ, deep infiltration (full thickness/extraserous ratio), regional lymph node metastasis, and positive VIM and β-CAT protein erexpression than H. pylori negative ones, while E-cad protein positive rate was significantly lower than that of H. pylori negative patients (P < 0.05). H. pylori infection was negatively correlated with E-cad protein expression, and positively correlated with VIM and β-CAT protein expression (P < 0.05). The 3-year survival rate of H. pylori positive patients was lower than that of H. pylori negative patients (P < 0.05).
There is a correlation between H. pylori infection and EMT in patients with CRC. H. pylori infection may cause CRC invasion, metastasis, and poor prognosis by promoting the occurrence of EMT.
- Citation: Lou HF, Ma CM, Fu YZ, Zhang S. Relationship between Helicobacter pylori infection and epithelial-mesenchymal transition in colorectal cancer. Shijie Huaren Xiaohua Zazhi 2021; 29(15): 858-865
- URL: https://www.wjgnet.com/1009-3079/full/v29/i15/858.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v29.i15.858
流行病学调查显示[1,2], 结直肠癌(colorectal cancer, CRC)发病率居全球恶性肿瘤的第3位, 并随我国人口老龄化趋势加剧、生活方式与饮食习惯改变等出现显著增长趋势. 近年来, CRC患者5年生存率虽出现明显改善, 但肿瘤细胞去分化、侵袭、转移仍是目前临床治疗亟需克服难点与热点问题. 多项研究证实[3-5], 上皮-间质转化(epithelial-mesenchymal transition, EMT)是调控恶性肿瘤细胞侵袭、转移的主要机制. 同时, 幽门螺杆菌(Helicobacter pylori, H. pylori)感染已被世界卫生组织列为Ⅰ类致癌因素, 国内外研究均已证实其与胃癌EMT具有显著相关性[6,7], 关于其是否会诱导CRC患者EMT发生临床研究较少. 基于此, 本研究尝试分析H. pylori感染与CRC患者EMT相关蛋白的相关性, 旨在为临床抑制CRC病程进展、促进预后改善提供科学指导. 详情如下.
选取2016-01/2017-10我院经手术组织病理检查证实为CRC患者97例, 其中肿瘤部位: 结肠63例, 直肠34例; 病理类型: 乳头状管状腺癌34例, 管状腺癌54例, 黏液腺癌7例, 其他2例; 肿瘤大小: ≤4 cm 63例, >4 cm 34例; 分化程度: 高、中分化53例, 低分化44例; 临床分期: Ⅰ+Ⅱ期42例, Ⅲ+Ⅳ期55例; 区域淋巴结转移24例; 浸润深度: 黏膜层/肌层46例, 全层/浆膜外51例. 另选取同期接受肠切除术患者118例作为对照组. 设计调查问卷收集两组年龄、性别、体质量指数、饮酒史、吸烟史、既往史等内容. 本院伦理委员会经审核评议同意本研究.
纳入标准: 观察组均符合《中国结直肠癌诊疗规范(2015版)》[8]中诊断标准, 并经手术组织病理学检查证实为CRC, 预计生存期>6 mo; 对照组经结肠镜检查、手术组织病理检查均未发现肿瘤病灶; 两组所有研究对象均知情并签订同意书.
排除标准: 胃癌及其他部位恶性肿瘤者; 既往有胃部手术史者; 近1个月内有抗菌药物、质子泵抑制剂、糖皮质激素等影响H. pylori药物服用史者; 消化性溃疡、急性消化道出血或凝血功能障碍者; 精神行为异常者.
H. pylori检测: 采用14C尿氮呼气试验检测, 严格按照深圳市中核海得威生物科技有限公司提供的说明书操作, 其中H. pylori感染数值<100 dpm/mmoL为阴性, ≥100 dpm/mmoL为阳性.
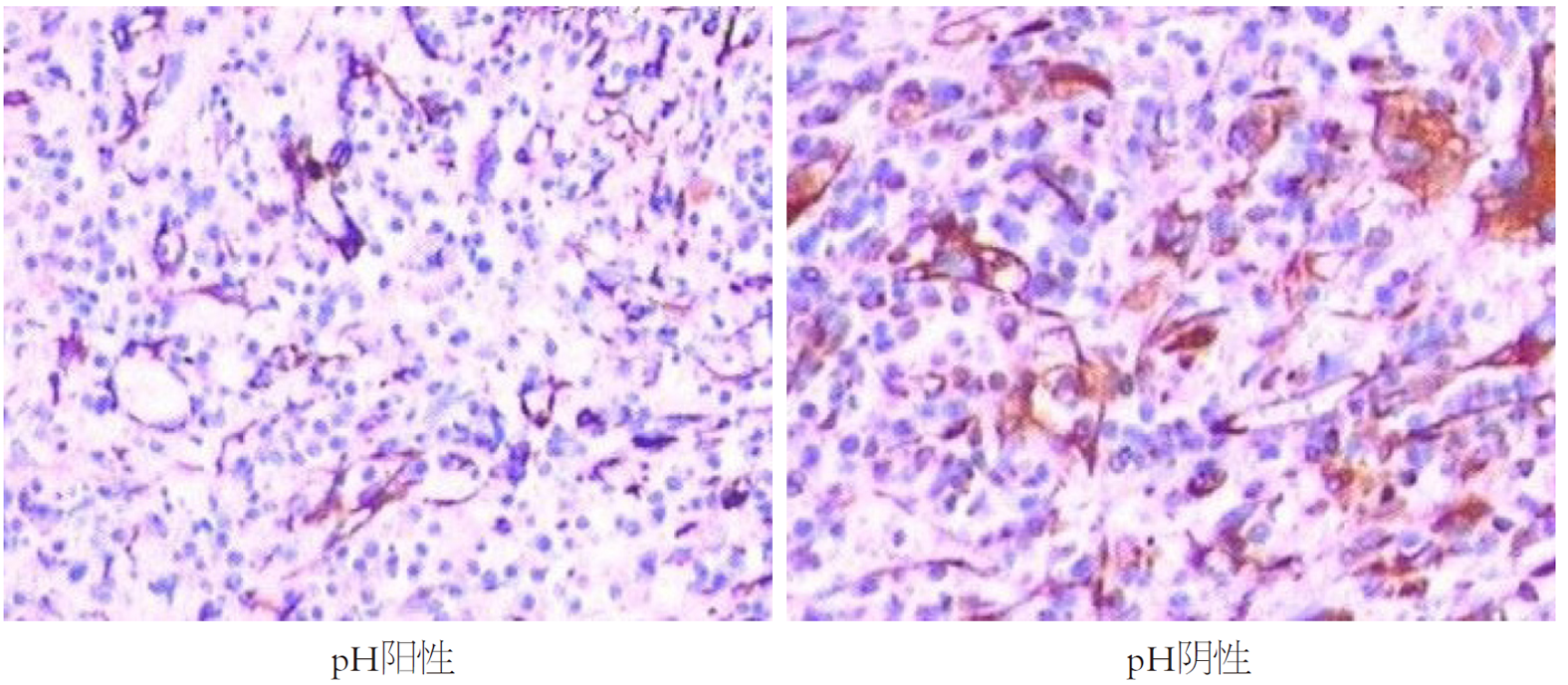
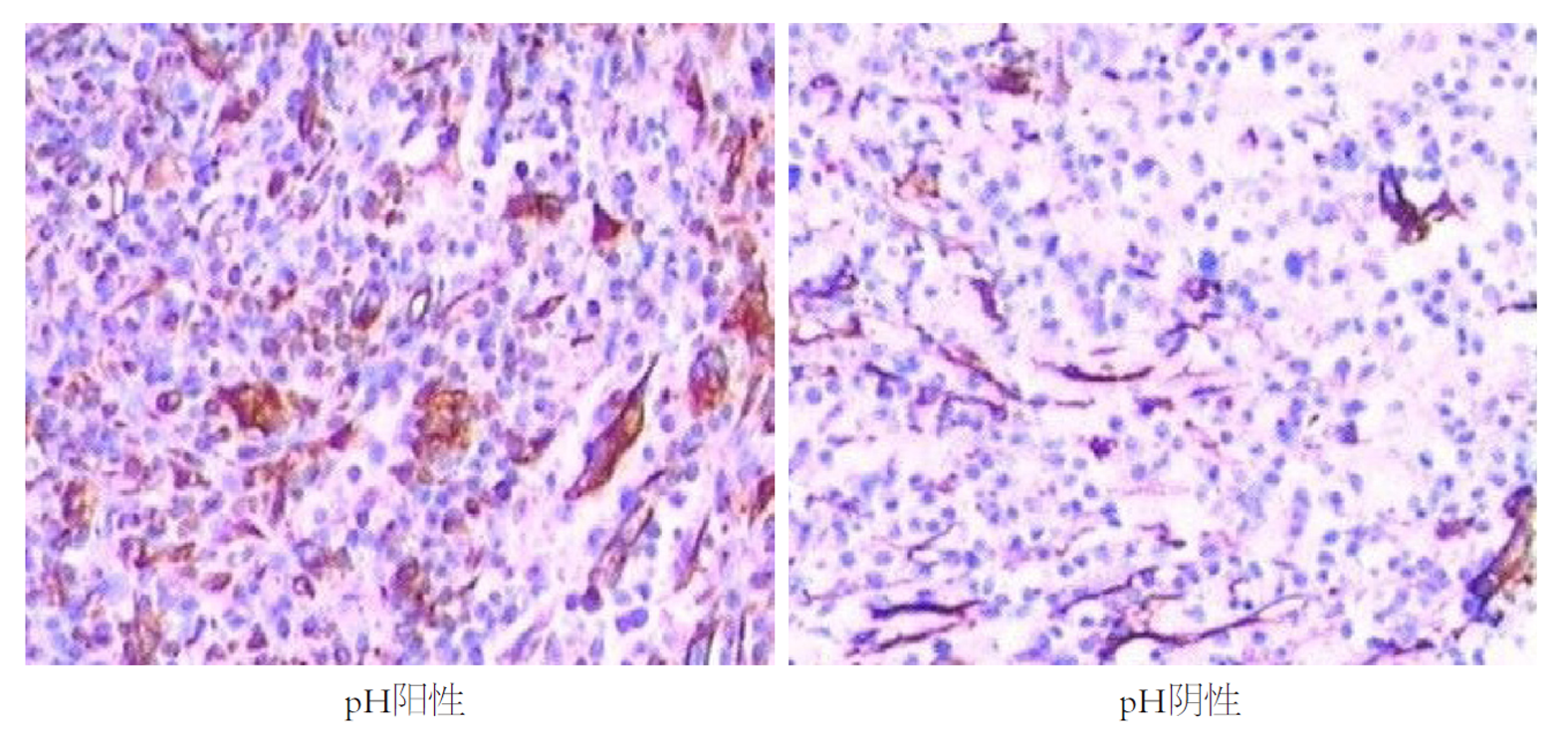
EMT相关蛋白检测: 取观察组癌组织、对照组正常结直肠组织标本, 应用免疫组化SP法检测EMT相关蛋白[E-钙黏蛋白(E-cadherin, E-cad)、波形蛋白(vimentin, VIM)、β-连环素(β-catenin, β-CAT)]表达, 严格按照上海信裕生物科技有限公司提供的试剂盒说明书操作. 具体操作: 中性甲醛(10.0%)固定, 石蜡包埋, 切片(厚度为4 μm), 烤箱(65 ℃)过夜, 酒精梯度洗脱, 抗原修复. 结果判定[9]: 每张切片均由具备丰富经验的2名病理医师根据染色范围与染色强度的评分进行判断, VIM、β-CAT、E-cad蛋白阳性以胞膜出现棕黄色颗粒为准, 其中染色范围: 每张切片随机选取5个高倍镜视野, 视野中阳性细胞数≤25.0%为1分, 26.0%-50.0%为2分, 51.0%-75.0%为3分, >75.0%为4分; 染色强度: 与背景相似为0分, 稍微高于背景色为1分, 明显超出背景色为2分, 呈深棕黄色为3分. 染色范围、染色强度评分结果相乘, 0-3分提示EMT相关蛋白表达阴性, >3分提示EMT相关蛋白表达阳性.
统计学处理 采用统计学软件SPSS 22.0处理数据, 计量资料采取Bartlett方差齐性检验与夏皮罗-威尔克正态性检验, 均确认具备方差齐性且近似服从正态分布, 以mean±SD描述, 组间比较采用独立样本t检验; 计数资料用n(%)表示、χ2检验; 等级资料用u表示、Ridit检验; 采用Spearman相关系数模型分析H. pylori感染与EMT相关蛋白的相关性; 采用Kaplan-Meier法绘制生存曲线分析H. pylori感染与CRC生存的关系, 组间比较采用Log-rank检验. 均采用双侧检验, α = 0.05.
两组性别、年龄、吸烟史、高血压及冠心病比例比较, 差异无统计学意义; 两组饮酒史比例、体质量指数、糖尿病比例、癌症遗传史比例、慢性胃炎病史、比较, 差异有统计学意义(P<0.05), 见表1.
| 基线资料 | 观察组(n = 97) | 对照组(n = 118) | u/t/χ2 | P值 |
| 性别 | ||||
| 男 | 63(64.95) | 72(61.02) | 0.352 | 0.553 |
| 女 | 34(35.05) | 46(38.88) | ||
| 年龄(岁) | 58.64±10.28 | 56.59±12.45 | 1.299 | 0.196 |
| 吸烟史 | 41(42.27) | 45(38.14) | 0.379 | 0.538 |
| 饮酒史 | 35(36.08) | 16(13.56) | 14.926 | <0.001 |
| 慢性胃炎病史 | 72(74.23) | 58(49.15) | 14.002 | <0.001 |
| 体质量指数(kg/m2) | ||||
| 偏瘦 | 16(16.49) | 29(24.58) | 3.258 | 0.001 |
| 正常 | 23(23.71) | 48(40.68) | ||
| 肥胖 | 38(39.18) | 30(25.42) | ||
| 超重 | 20(20.62) | 11(9.32) | ||
| 既往史 | ||||
| 糖尿病 | 28(28.87) | 13(11.02) | 10.990 | 0.001 |
| 高血压 | 32(32.99) | 33(27.97) | 0.637 | 0.425 |
| 冠心病 | 12(12.37) | 11(9.32) | 0.518 | 0.472 |
| 癌症遗传史 | 15(15.46) | 6(5.08) | 6.507 | 0.011 |
观察组H. pylori感染、VIM、β-CAT蛋白阳性率均高于对照组, E-cad蛋白阳性率低于对照组P<0.05), 见表2.
| 组别 | 例数 | H. pylori阳性 | EMT相关蛋白阳性 | ||
| E-cad | VIM | β-CAT | |||
| 观察组 | 97 | 69(71.13) | 21(21.65) | 49(50.52) | 64(65.98) |
| 对照组 | 118 | 55(46.61) | 98(83.05) | 15(12.71) | 11(9.32) |
| χ2 | 13.116 | 81.214 | 36.392 | 75.234 | |
| P | <0.001 | <0.001 | <0.001 | <0.001 | |
观察组不同H. pylori感染状态患者性别、年龄、肿瘤部位、病理类型、肿瘤大小比较, 差异无统计学意义; 观察组H. pylori阳性者分化程度低分化、临床分期Ⅲ+Ⅳ期、区域淋巴结转移比例、浸润深度全层/浆膜外比例、VIM、β-CAT蛋白阳性率高于H. pylori阴性者, E-cad蛋白阳性率低于H. pylori阴性者(P<0.05), 见表3、图1-3.
| 项目 | H. pylori阳性者(n = 69) | H. pylori阴性者(n = 28) | χ2 | P |
| 性别 | ||||
| 男 | 45(65.22) | 18(64.29) | 0.008 | 0.931 |
| 女 | 24(34.78) | 10(35.71) | ||
| 年龄(岁) | ||||
| ≤60 | 36(52.17) | 12(42.86) | 0.692 | 0.406 |
| >60 | 33(47.83) | 16(57.14) | ||
| 肿瘤部位 | ||||
| 结肠 | 42(60.87) | 21(75.00) | 1.747 | 0.186 |
| 直肠 | 27(39.13) | 7(25.00) | ||
| 病理类型 | ||||
| 乳头状管状腺癌 | 24(34.78) | 10(35.71) | 1.721 | 0.632 |
| 管状腺癌 | 37(53.62) | 17(60.71) | ||
| 黏液腺癌 | 6(8.70) | 1(3.57) | ||
| 其他 | 2(2.90) | 0(0) | ||
| 肿瘤大小(cm) | ||||
| ≤4 | 48(69.57) | 15(53.57) | 2.238 | 0.135 |
| >4 | 21(30.43) | 13(46.43) | ||
| 分化程度 | ||||
| 高、中分化 | 30(43.49) | 23(82.14) | 12.014 | 0.001 |
| 低分化 | 39(56.31) | 5(17.86) | ||
| 临床分期 | ||||
| Ⅰ+Ⅱ期 | 23(33.33) | 19(67.86) | 9.670 | 0.002 |
| Ⅲ+Ⅳ期 | 46(66.67) | 9(32.14) | ||
| 区域淋巴结转移 | ||||
| 有 | 21(30.43) | 3(10.71) | 4.160 | 0.041 |
| 无 | 48(69.57) | 25(89.29) | ||
| 浸润深度 | ||||
| 黏膜层/肌层 | 26(37.68) | 20(80.00) | 13.152 | <0.001 |
| 全层/浆膜外 | 43(62.32) | 8(20.00) | ||
| E-cad | ||||
| 阳性 | 6(8.70) | 15(53.57) | 23.647 | <0.001 |
| 阴性 | 63(91.30) | 13(46.43) | ||
| VIM | ||||
| 阳性 | 44(63.77) | 5(17.86) | 16.795 | <0.001 |
| 阴性 | 25(36.23) | 23(82.14) | ||
| β-CAT | ||||
| 阳性 | 56(81.16) | 8(28.57) | 24.539 | <0.001 |
| 阴性 | 13(18.84) | 20(71.43) |
将观察组不同H. pylori感染状态患者EMT相关蛋白阳性率作为源数据, 采用Spearman进行相关性分析, 结果显示, H. pylori感染与E-cad蛋白呈负相关, 与VIM、β-CAT蛋白呈正相关(P<0.05), 见表4.
| 项目 | EMT相关蛋白 | |||
| E-cad | VIM | β-CAT | ||
| H. pylori感染 | r | -0.494 | 0.416 | 0.503 |
| P | <0.001 | <0.001 | <0.001 | |
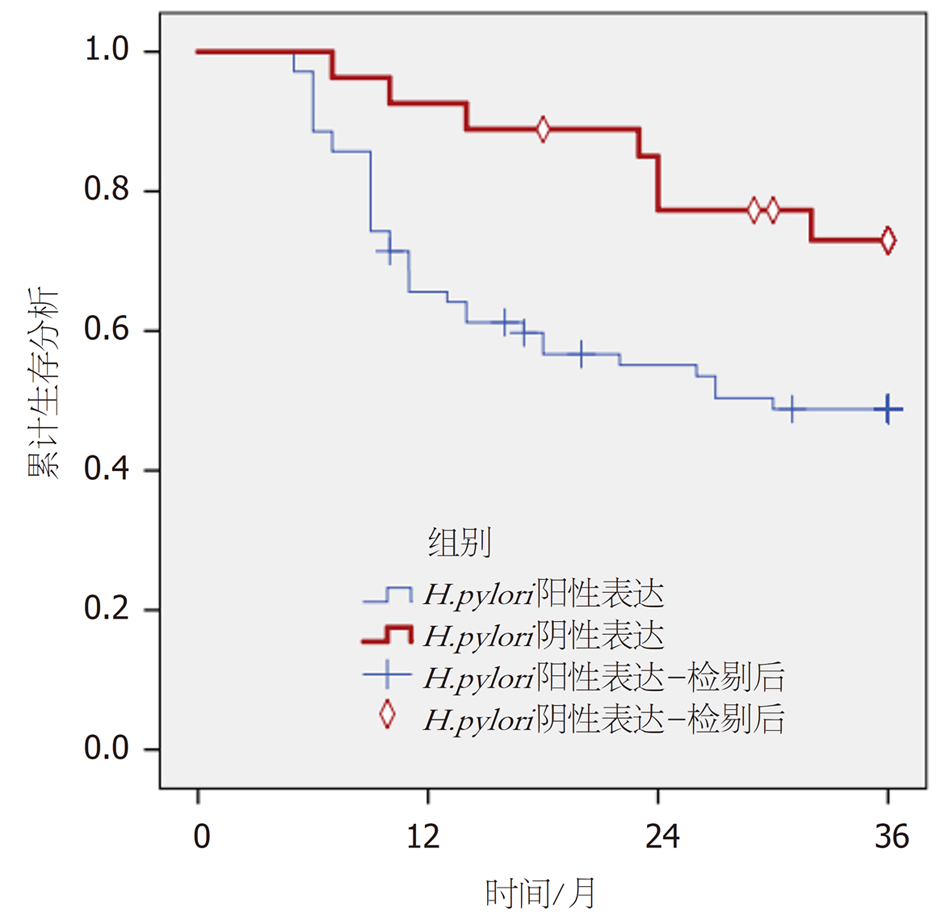
随访3年, 脱落8例. 89例CRC患者3年生存率为52.81%(47/89). K-M曲线分析, H. pylori阳性表达患者3年生存率低于阴性表达患者(χ2 = 5.375, P = 0.02), 见图4.
H. pylori是一类, 微需氧型革兰阴性菌, 黏附于胃幽门, 可分泌尿素酶、细胞毒素相关蛋白等多种毒力因子, 金怀亮等[10]研究表明, 其可损伤胃黏膜上皮, 诱发机体胃黏膜炎性反应, 甚至恶性转化. 同时, 国外学者Butt等[11]经前瞻性多中心研究显示, HcpC和VacA等H. pylori蛋白抗体反应与罹患大肠癌的风险增加相关. 资料还发现[12], H. pylori感染可能将CRC发生风险提高20%-49%. 本研究通过14C尿氮呼气试验可知, H. pylori阳性率在CRC患者中呈高表达, 并与分化程度、临床分期、区域淋巴结转移、浸润深度存在一定相关性. 董一凡等研究[13]也证实了H. pylori感染与CRC发生、发展的关系. 考虑上述结果可能与以下机制有关: (1)H. pylori感染可能刺激胃泌素分泌, 引发高胃泌素血症, 活化生长因子依赖信号转导通路, 促进自分泌环调控形成, 引发癌变, 从而诱发CRC[14]; (2)H. pylori感染可能诱发长期炎症刺激, 释放大量环氧化酶、白细胞介素-1、肿瘤坏死因子-α等炎症因子, 激活环境及食物中多种前致癌物, 抑制抑癌基因表达, 诱导肿瘤细胞增殖; (3)H. pylori感染可抑制胃酸分泌, 促使腺体萎缩, 打破肠道菌群平衡, 诱导菌属侵袭结直肠黏膜上皮细胞, 引起宿主炎性反应, 提高DNA高度甲基化等DNA突变风险[15], 从而导致细胞恶变, 上调CRC发生风险. 提示H. pylori感染在CRC发生、发展中可能扮演着重要角色, 推测以H. pylori感染为靶点的临床干预可能是抑制CRC发生的潜在途径.
大量研究显示[16,17], EMT在肿瘤细胞发生转移的某一环节中起着关键作用, 亦是肿瘤细胞对化疗药物耐药性的机制之一. 同时, 有学者还指出[18], EMT发生不仅可刺激肿瘤细胞运动、侵袭与凋亡, 还能驱动肿瘤细胞, 提高其干性潜能, 从而实现自我更新、肿瘤起始与降低化疗敏感性等. E-cad表达丢失、VIM、β-CAT表达增加是EMT的重要上皮细胞标记物[19,20]. 本研究数据表明, 与因其他原因接受肠切除术患者比较, CRC患者E-cad蛋白阳性率更低、VIM、β-CAT蛋白阳性率更高, 与吴建龙等[21]、孟媛等[22]研究结果相似, 说明EMT可能通过增加间质相关分子与抑制上皮相关分子表达, 进而在CRC发生、侵袭及转移中发挥重要作用. 进一步经Spearman相关性分析显示, H. pylori感染与CRC患者E-cad蛋白存在负相关关系, 与VIM、β-CAT蛋白存在正相关关系, 结合李年双等[23]研究认为这可能归因于细胞毒素相关蛋白Cag作为H. pylori最重要致病因子, 通过与肿瘤坏死因子受体相关因子6与转化生长因子-β活化激酶1(TAK1)相互作用, 可促使TAK1磷酸化, 刺激p-IKKβ形成, 引起磷脂酰肌醇3-激酶、蛋白激酶的持续激活, 进而活化核转录因子kappaB信号通路, 诱导Slug、Twist家族bHLH转录因子1、锌指转录因子转录, 调控肿瘤细胞增殖、凋亡、永生化等多种生物学效应, 促使CRC患者EMT发生, 从而参与CRC恶性生物学行为. 推测H. pylori感染调控CRC发生、发展可能是通过激活NF-κB信号通路, 诱导EMT发生实现的. 最后, 为明确H. pylori感染与CRC患者生存的关系, 本研究通过绘制K-M曲线显示, H. pylori阳性表达可能降低CRC患者3年生存率, 这可能与H. pylori感染通过诱发EMT增强CRC侵袭转移能力有关. 由此可见, H. pylori感染在CRC预后预判方面具有一定临床应用价值.
综上可知, H. pylori感染与CRC患者EMT存在一定相关性, 推测H. pylori感染可能通过促进EMT发生导致CRC侵袭、转移及不良预后. 但受时间限制本研究纳入样本量小, 仅为单中心研究, 未结合H. pylori分型分组以及在CRC标本中进行H. pylori定殖研究, 有待后续进一步扩大样本量, 多中心深入研究H. pylori相关机制.
结直肠癌病情的恶化受较多因素影响. 其中上皮-间质转化(epithelial-mesenchymal transition, EMT)是促使结直肠癌发生转移和侵袭的重要机制之一, 防止EMT是控制直肠癌患者病情的关键. 发现与EMT发生的相关高危因素是预防的前提.
幽门螺杆菌(Helicobacter pylori, H. pylori)与胃癌的EMT有很大的相关性, 近来有研究显示H. pylori感染与结直肠癌的发生存在较大的关系, 但是否与结直肠癌的EMT相关鲜有报道, 以便为结直肠癌患者找到导致EMT的因素, 为结直肠癌患者的治疗康复提供依据.
探讨H. pylori与结直肠癌EMT发生的相关性, 为结直肠癌患者的治疗以及预防提供借鉴.
本研究通过收集病例信息、检测和统计学相关性分析的方法, 将患者的相关指标与H. pylori相结合, 探讨结直肠癌患者EMT与H. pylori的相关性.
两组饮酒史比例、体质量指数、糖尿病比例、癌症遗传史比例、慢性胃炎病史、比较, 差异有统计学意义. 观察组H. pylori感染、波形蛋白(vimentin, VIM)、β-连环素(β-catenin, β-CAT)蛋白阳性率均高于对照组, E-钙黏蛋白(E-cadherin, E-cad)蛋白阳性率低于对照组. H. pylori阳性者分化程度低分化、临床分期Ⅲ+Ⅳ期、区域淋巴结转移比例、浸润深度全层/浆膜外比例、VIM、β-CAT蛋白阳性率高于H. pylori阴性者, E-cad蛋白阳性率低于H. pylori阴性者. H. pylori感染与E-cad蛋白呈负相关, 与VIM、β-CAT蛋白呈正相关. H. pylori阳性表达患者3年生存率低于阴性表达患者.
H. pylori感染与结直肠癌EMT有一定的相关性. 感染H. pylori的结直肠癌患者发生EMT的风险更高, 要更加重视病情, 加强检测的频次.
本研究通过统计学分析证明了H. pylori感染与结直肠癌EMT有一定的相关性, 为临床治疗提供借鉴. 但样本量仍然较小, 仅为单中心研究, 有待后续进一步扩大样本量, 多中心深入研究相关机制.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C, C
D级 (一般): 0
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 2. | 国家消化系统疾病临床医学研究中心(上海, 国家消化道早癌防治中心联盟, 中华医学会消化内镜学分会, 中华医学会健康管理学分会, 中国医师协会内镜医师分会消化内镜专业委员会, 中国医师协会内镜医师分会内镜健康管理与体检专业委员会, 中国医师协会内镜医师分会内镜诊疗质量管理与控制专业委员会, 中国健康促进基金会, 国家消化内镜质控中心, 中国抗癌协会肿瘤内镜学专业委员会. 中国早期结直肠癌筛查流程专家共识意见(2019, 上海). 中华内科杂志. 2019;58:736-744. [DOI] |
| 3. | Dongre A, Weinberg RA. New insights into the mechanisms of epithelial-mesenchymal transition and implications for cancer. Nat Rev Mol Cell Biol. 2019;20:69-84. [PubMed] [DOI] |
| 4. | Bozhkova DM, Poryazova-Markova EG. The Epithelial-Mesenchymal Transition, E-cadherin and Tumor Progression in Ovarian Serous Tumors. Folia Med (Plovdiv). 2019;61:296-302. [PubMed] [DOI] |
| 5. | Zhang Y, Wang LF, Gao JH, Li L, Jiang P, Lv X, Yu LX, Yang J, Li RT, Liu BR. Clinical significance of epithelial-mesenchymal transition-related molecules in lung adenocarcinoma. Curr Oncol. 2019;26:e121-e127. [PubMed] [DOI] |
| 6. | 韩 亮, 陈 国栋, 曾 莎莎, 肖 玲巧, 张 洁雅, 赵 兰华, 蔡 恒玲, 张 艳. 幽门螺杆菌Tipα通过激活IL-6/STAT3信号通路诱导胃癌细胞EMT的形成. 免疫学杂志. 2019;35:105-111. [DOI] |
| 7. | Baj J, Korona-Głowniak I, Forma A, Maani A, Sitarz E, Rahnama-Hezavah M, Radzikowska E, Portincasa P. Mechanisms of the Epithelial-Mesenchymal Transition and Tumor Microenvironment in Helicobacter pylori-Induced Gastric Cancer. Cells. 2020;9. [PubMed] [DOI] |
| 9. | 宋 学民, 罗 东明, 汤 阳阳, 尚 小文, 韦 轲, 李 学河. 结直肠癌患者癌组织CTEN、E-cadherin及Vimentin蛋白的表达水平及意义. 现代消化及介入诊疗. 2020;25:598-602. [DOI] |
| 11. | Butt J, Jenab M, Pawlita M, Tjønneland A, Kyrø C, Boutron-Ruault MC, Carbonnel F, Dong C, Kaaks R, Kühn T, Boeing H, Schulze MB, Trichopoulou A, Karakatsani A, La Vecchia C, Palli D, Agnoli C, Tumino R, Sacerdote C, Panico S, Bueno-de-Mesquita B, Vermeulen R, Gram IT, Weiderpass E, Borch KB, Quirós JR, Agudo A, Rodríguez-Barranco M, Santiuste C, Ardanaz E, Van Guelpen B, Harlid S, Imaz L, Perez-Cornago A, Gunter MJ, Zouiouich S, Park JY, Riboli E, Cross AJ, Heath AK, Waterboer T, Hughes DJ. Antibody Responses to Helicobacter pylori and Risk of Developing Colorectal Cancer in a European Cohort. Cancer Epidemiol Biomarkers Prev. 2020;29:1475-1481. [PubMed] [DOI] |
| 14. | Liu IL, Tsai CH, Hsu CH, Hu JM, Chen YC, Tian YF, You SL, Chen CY, Hsiao CW, Lin CY, Chou YC, Sun CA. Helicobacter pylori infection and the risk of colorectal cancer: a nationwide population-based cohort study. QJM. 2019;112:787-792. [PubMed] [DOI] |
| 17. | Pudova EA, Kudryavtseva AV, Fedorova MS, Zaretsky AR, Shcherbo DS, Lukyanova EN, Popov AY, Sadritdinova AF, Abramov IS, Kharitonov SL, Krasnov GS, Klimina KM, Koroban NV, Volchenko NN, Nyushko KM, Melnikova NV, Chernichenko MA, Sidorov DV, Alekseev BY, Kiseleva MV, Kaprin AD, Dmitriev AA, Snezhkina AV. HK3 overexpression associated with epithelial-mesenchymal transition in colorectal cancer. BMC Genomics. 2018;19:113. [PubMed] [DOI] |
| 18. | Liu W, Wang S, Sun Q, Yang Z, Liu M, Tang H. DCLK1 promotes epithelial-mesenchymal transition via the PI3K/Akt/NF-κB pathway in colorectal cancer. Int J Cancer. 2018;142:2068-2079. [PubMed] [DOI] |
| 20. | 宋 子正, 杨 华, 臧 爱民, 张 磊, 张 红岩. 过表达P185可抑制EMT并促进胃癌细胞侵袭和迁移. 基因组学与应用生物学. 2019;38:3771-3776. [DOI] |