修回日期: 2021-04-30
接受日期: 2021-05-25
在线出版日期: 2021-07-08
长期服用非甾体抗炎药可导致胃溃疡. 但目前常用的胃溃疡的治疗剂存在诸多副作用.
探讨木犀草素(luteolin, Lut)对吲哚美辛(indomethacin, IND)所致大鼠胃溃疡的防护作用及其相关机制.
40只雄性Wistar大鼠按照随机数字法分为对照组、模型组、低、中和高剂量Lut组, 每组纳入8只大鼠. 通过IND(40 mg/kg)的灌胃给药14天构建大鼠胃溃疡模型; 低、中和高剂量Lut组采用IND(40 mg/kg)的给药, 同时用1 mg/kg、10 mg/kg和100 mg/kg的Lut灌胃给药14 d; 对照组给予同等体积的羧甲纤维素. 肉眼观察胃粘膜组织的大体形态; HE染色检查胃粘膜组织的病理学改变; ApopTag过氧化物酶原位细胞凋亡染色检测胃粘膜组织中的细胞凋亡; 试剂盒法检测胃粘膜组织中超氧化物歧化酶(superoxide dismutase, SOD)、还原型谷胱甘肽(reduced glutathione, GSH)和丙二醛(malondialdehyde, MDA)水平.
Lut给药可以剂量依赖的方式减轻IND诱导的胃溃疡, 改善胃粘膜组织的病理学形态, 降低胃粘膜上皮细胞凋亡水平, 增加胃粘膜组织中SOD和GSH的水平并降低MDA水平.
Lut能减轻IND诱导的大鼠胃溃疡, 且其机制可能与其抑制胃粘膜上皮细胞凋亡以及抗氧化应激作用相关.
核心提要: 木犀草素(luteolin, Lut)对吲哚美辛(indomethacin, IND)诱导的大鼠胃溃疡具有防护作用, 且这一作用可能与其抗氧化和抗胃粘膜上皮细胞凋亡有关.
引文著录: 王煦, 张娜, 王婷. 木犀草素对吲哚美辛所致大鼠胃溃疡的防护作用. 世界华人消化杂志 2021; 29(13): 701-706
Revised: April 30, 2021
Accepted: May 25, 2021
Published online: July 8, 2021
Long-term use of nonsteroidal anti-inflammatory drugs can lead to gastric ulcer. However, there are many side effects associated with the commonly used therapeutic agents for gastric ulcer.
To investigate the protective effect of luteolin (Lut) on indomethacin (IND)-induced gastric ulcer in rats and the underlying mechanisms.
Forty male Wistar rats were randomly divided into a control group, a model group, and low-, medium-, and high-dose Lut groups, with eight rats in each group. A rat gastric ulcer model was established by intragastric administration of IND (40 mg/kg) for 14 d. The low-, medium-, and high-dose Lut groups were given 1 mg/kg, 10 mg/kg, and 100 mg/kg Lut by gavage for 14 d. The control group was given the same volume of carboxymethylcellulose. The macroscopic morphology of the gastric mucosa was observed visually. The pathological changes of the gastric mucosa were examined by HE staining. Apoptosis in the gastric mucosa was detected with the ApopTag Peroxidase In Situ Apoptosis Detection Kit. The levels of superoxide dismutase (SOD), reduced glutathione (GSH), and malondialdehyde (MDA) in the gastric mucosa were determined with commercial kits.
Lut administration could reduce IND-induced gastric ulcer in a dose-dependent manner, improve the pathological morphology of gastric mucosal tissues, reduce the apoptosis of gastric mucosal epithelial cells, increase the levels of SOD and GSH in gastric mucosal tissues, and decrease the level of MDA.
Lut can alleviate IND-induced gastric ulcer in rats, and the mechanism may be related to the inhibition of gastric epithelial cell apoptosis and antioxidant stress.
- Citation: Wang X, Zhang N, Wang T. Protective effect of luteolin on indomethacin-induced gastric ulcer in rats. Shijie Huaren Xiaohua Zazhi 2021; 29(13): 701-706
- URL: https://www.wjgnet.com/1009-3079/full/v29/i13/701.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v29.i13.701
胃溃疡主要是由于胃中的保护性因子和破坏性因子失衡引起的胃黏膜受损而造成的胃内壁的溃疡, 是常见的上消化道疾病[1,2]. 长期使用非甾体抗炎药(nonsteroidal anti-inflammatory drugs, NSAIDs)是导致胃溃疡的主要原因之一[3,4]. 吲哚美辛(indomethacin, IND)是一种广泛使用的NSAIDs, 但长期服用该类药物能导致胃粘膜完整性丧失相关的胃损伤, 其机制包含产生氧化应激、抑制粘液产生和诱导胃黏膜细胞凋亡等[5]. 虽然, 质子泵抑制剂(proton-pump inhibitors, PPI)和2型组胺(type 2 histamine, H2)受体拮抗剂已被用于防治NSAIDs诱导的胃溃疡, 但是长期使用PPI或H2受体拮抗剂依然具有诸多不良反应[6]. 天然药物因具有靶点多和毒副作用低的特点, 尤其是从中筛选具有抗氧化和修复胃黏膜的天然药物分子可能会为发现新的有效的抗NSAIDs诱导的胃溃疡的药物.
木犀草素(luteolin, Lut)是一种广泛存在于水果、蔬菜和草药中具有抗肿瘤、抗肝毒性、抗过敏、抗炎、抗氧化和加快伤口愈合等多种药理活性的生物类黄酮[7]. 根据Lut的药理活性推测其可能具有抗胃溃疡的作用, 而其对IND诱导的胃溃疡的具体作用尚不清晰. 因此, 本研究采用IND所致胃溃疡大鼠模型来探讨Lut对IND诱导的胃溃疡的作用并分析其机制, 以期为Lut是否可作为治疗IND诱导的胃溃疡的替代药物提供实验依据.
40只6-7周龄无特定病原体(specific pathogen free, SPF)级雄性维斯塔尔(Wistar)大鼠(体重190-220 g)购自浙江维通利华实验动物技术有限公司(生产许可证号: SCXK(浙)2019-0001). IND片(批准文号: 国药准字H14020549; 产品编号: 014202046946)购于临汾奇林药业有限公司; Lut(纯度>98%; 货号: 49968)购自美国Sigma公司; 羧甲纤维素(carboxymethylcellulose, CMC; 货号: A50147)购自生工生物工程(上海)股份有限公司; ApopTag过氧化物酶原位细胞凋亡检测试剂盒(S7100)购自美国Millipore Chemicon公司; 铜锌/锰-超氧化物歧化酶(copper zinc/manganese-superoxide dismutase, CuZn/Mn-SOD)活性检测试剂盒(货号: S0103)、还原型谷胱甘肽(reduced glutathione, GSH)和氧化型谷胱甘肽(oxidized glutathione disulfide, GSSG)检测试剂盒(货号: S0053)、丙二醛(malondialdehyde, MDA)检测试剂盒(货号: S0131S)和二辛可宁酸(bicinchoninic acid, BCA)蛋白浓度测定试剂盒(货号: P0012S)购自上海碧云天生物科技有限公司.
将所有大鼠饲养在SPF级动物房的动物饲养笼里, 给予普通颗粒饲料饲养, 所有大鼠自由饮水饮食. 经过适应饲养3 d后, 将所有大鼠分为5组, 即对照组、模型组、低中高剂量Lut组, 每组纳入8只大鼠. 实验前, 将IND片磨成粉末, 然后用CMC制成20 mg/mL糊状物. 按照文献方法[8], 模型组大鼠采用IND(40 mg/kg)的连续14天灌胃给药诱发胃溃疡; 低中高剂量Lut组大鼠均在IND灌胃2 h后, 分别用1 mg/kg、10 mg/kg和100 mg/kg的Lut灌胃给药14 d(Lut的剂量参考文献[9]); 对照组和模型组给予灌胃等体积CMC.
给药方案结束后, 用10%水合氯醛(0.4 mL/100g)腹腔麻醉大鼠, 打开腹腔, 收集胃. 用解剖剪沿胃大弯将胃剪开, 并用PBS冲洗干净, 并拍照. 按照Guth法[10]统计各组大鼠的胃溃疡指数.
用RIPA对胃粘膜组织匀浆后, 用BCA蛋白浓度测定试剂盒检测匀浆液中蛋白浓度. 取匀浆液分别按照试剂盒说明书步骤测定大鼠匀浆液中SOD、GSH和MDA水平, 然后用测定的匀浆液中蛋白浓度将匀浆液中SOD、GSH和MDA水平标准化为mg蛋白中SOD、GSH和MDA水平.
将每只大鼠胃粘膜组织固定在10%福尔马林中, 并按常规法包埋在石蜡中. 切下5 μM厚的切片, 经常规脱蜡至水后, 并用苏木精-伊红染色法 (hematoxylin-eosin, HE)染色. 随后用光学显微镜对胃粘膜的HE染色的连续切片进行胃粘膜病变评分. 评分标准: 按照充血、出血和上皮细胞变性坏死的面积(0<S≤20%, 20%<S≤40%, 40%<S≤60%, 60%<S≤80%, 80%<S≤100%)分别计为1、2、3、4、5分. 胃粘膜病变总积分 = 充血积分+出血积分×2+上皮细胞变性坏死积分×3.
取石蜡包埋的胃粘膜切片(5 μM厚), 经常规脱蜡至水后, 根据制造商的说明书步骤, 使用ApopTag过氧化物酶原位细胞凋亡检测试剂盒对样品切片进行染色. 在光学显微镜下观察凋亡阳性染色百分比. 每只大鼠任选10张胃粘膜切片, 每张切片至少任选5个视野, 取平均值作为每只大鼠胃粘膜凋亡指数.
统计学处理 数据表示为均数±标准差(mean±SD), 各组数据比较采用单因素方差分析, 各组均数两两比较采用Bonferroni法. 以P值<0.05时, 认为差异具备统计学意义.
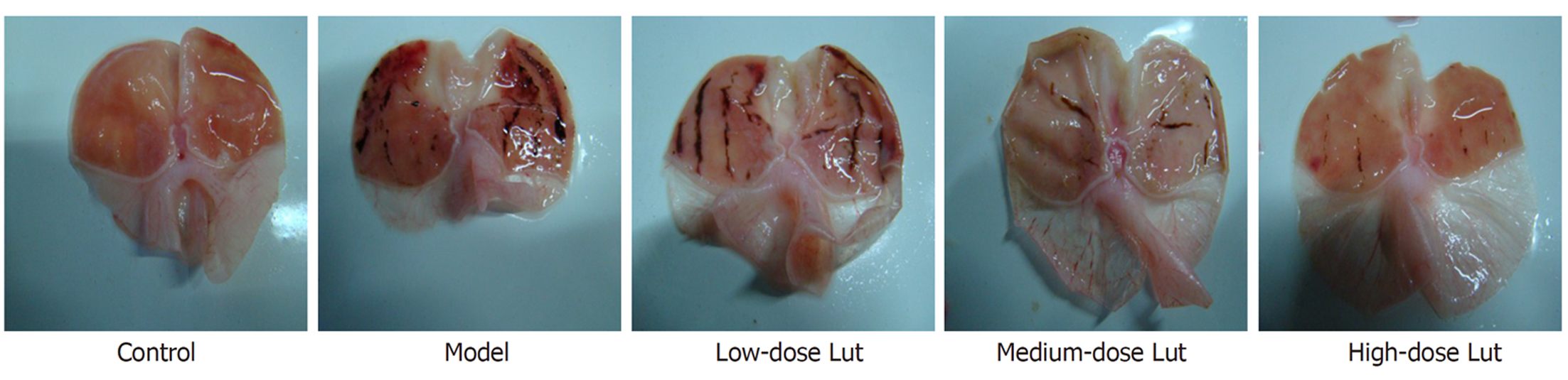
宏观观察图像(图1)显示, 对照组胃粘膜形态正常; 模型组胃粘膜显示大片充血红斑和条索状或斑驳状出血斑; 低剂量Lut组胃粘膜明显充血和条索状出血, 但相对模型组有所减轻; 中剂量Lut组胃粘膜显示少量红肿和散在出血情况; 高剂量Lut组胃粘膜未见明显水肿, 但存在少量出血点. 胃溃疡指数统计结果(表1)显示, 与对照组比较, 模型组胃溃疡指数明显增加; 与模型组比较, Lut能剂量依赖性地降低IND诱导的胃溃疡指数. 综述结果显示, Lut给药能改善IND所致的胃溃疡的外观和指数.
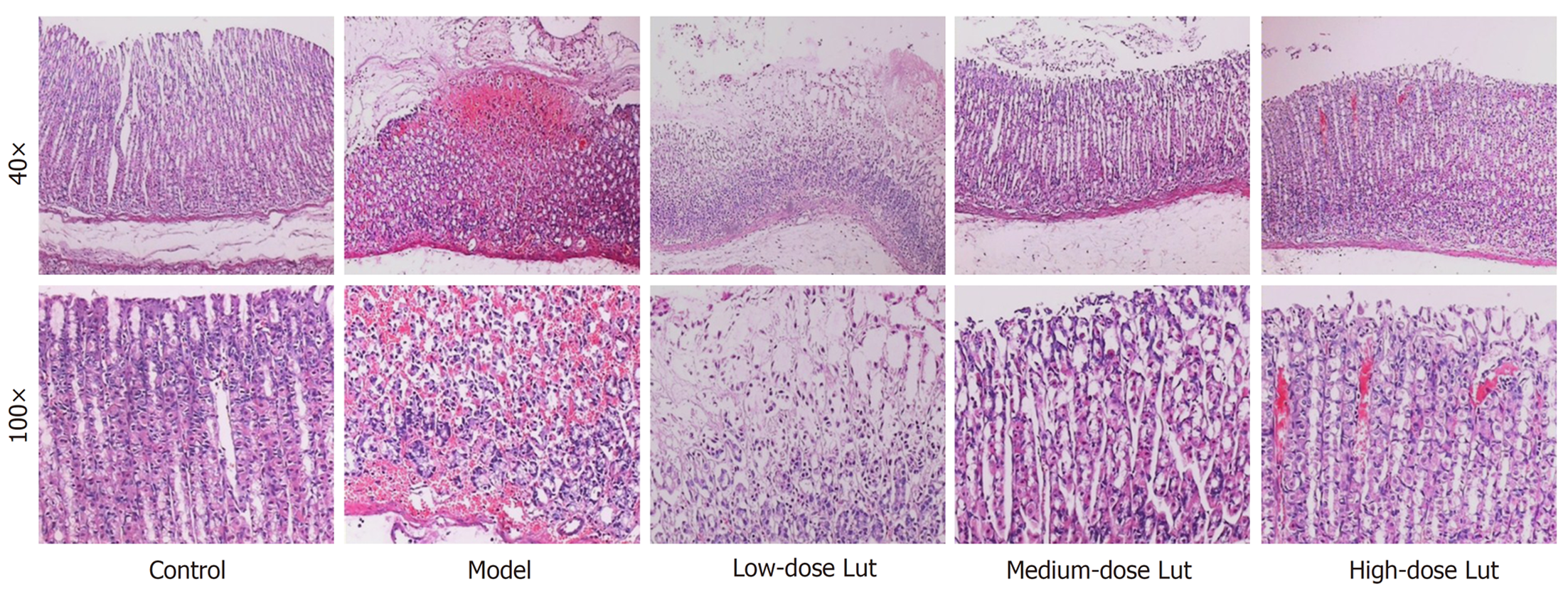
HE染色结果(图2)显示, 对照组胃粘膜结构完整正常和腺体排列整齐; 模型组表层上皮脱落、胃粘膜腺上皮的严重破坏(包括糜烂、粘膜下水肿、炎性细胞浸润、组织间严重充血和局灶性出血)、粘膜腺体结构分辨不清和排列不整齐甚至丧失; 低剂量Lut组胃粘膜表层上皮呈片状脱落, 组织间有水肿和出血情况, 粘膜腺上皮部分破坏、腺体结构边界模糊和排列不整齐, 但上述情况较模型组有所减轻; 中剂量Lut组胃粘膜表层上皮和腺上皮部分破坏, 组织间水肿和出血情况明显减少, 粘膜腺体结构边界趋向清晰且排列趋向整齐; 高剂量Lut组胃粘膜腺上皮基本完整, 但组织间有少量出血点, 粘膜腺体结构完整且排列整齐. 胃粘膜病变总积分统计结果(表2)显示, 与对照组比较, 模型组胃粘膜病变总积分明显增加; 与模型组比较, Lut能剂量依赖性地降低IND诱导的胃粘膜病变总积分. 以上结果显示, Lut给药能改善IND所致的胃黏膜组织的病理形态.
胃黏膜凋亡染色结果(图3、表3)显示, 对照组胃黏膜存在极少量散在的凋亡阳性染色(棕黄), 与对照组比较, 模型组胃黏膜凋亡阳性染色面积明显增加, 且多数富集在腺体; 与模型组比较, Lut组胃黏膜凋亡阳性染色面积明显减少, 其中低剂量Lut组胃黏膜凋亡阳性染色多富集于腺体、中和高剂量Lut组多富集于表层上皮, 且高剂量组效果最优.
长期服用NSAIDs导致的胃溃疡是临床上常见的上消化道疾病之一, 其主要的病理形态学特征为胃黏膜损伤[1,2]. IND是一种常用的NSAIDs, 因此本研究选用IND诱导的大鼠胃溃疡模型来探讨Lut的抗NSAIDs诱发的胃溃疡的作用. 在动物模型中, 胃黏膜损伤指数和组织形态病理学是观察胃黏膜损伤程度的最直观指标[11]. 本研究显示, Lut能剂量依赖性地降低胃黏膜损伤指数和改善IND诱导的胃黏膜病理形态改变, 表明Lut能减轻IND引起的大鼠胃溃疡, 其对胃粘膜发挥保护作用.
另外, 胃粘膜上皮细胞分泌的黏液能防止胃酸和胃蛋白酶对胃黏膜的损害; 而胃粘膜上皮细胞受损则会使得黏液分泌降低, 导致胃酸和胃蛋白酶对胃黏膜的损害加重[12]. 因此, 胃粘膜上皮细胞凋亡是导致胃粘膜损伤的重要机制, 也是胃溃疡形成过程中的重要环节之一. 已有研究表明, 抑制胃粘膜上皮细胞的凋亡能减轻胃粘膜损伤, 并抑制胃溃疡的进展[13]. 本研究表明, Lut可以剂量依赖性地降低胃粘膜细胞的凋亡, 表明Lut在IND诱导的大鼠胃溃疡模型中对胃粘膜上皮细胞具有保护作用.
氧化应激在各种因素导致的胃溃疡的发病和进展中均起着重大作用. 氧自由基是胃溃疡的关键致病因子之一, 氧自由基过高不仅不利于胃粘膜创面的愈合, 其还能加剧溃疡创面的扩大[14]. 胃溃疡的机体氧化应激状态体现在促氧化系统的氧自由基和MDA水平急剧升高以及抑氧化系统的SOD和GSH水平急剧降低[14,15]. SOD是机体内清除氧自由基关键因素, 在胃溃疡疾病中发挥胃粘膜保护作用[14-16]. GSH可维持机体内氧化还原状态, 保护机体组织和细胞免受氧化应激损伤, 其同样也是重要的氧自由基清除的主要分子之一[15,16]. MDA是脂质过氧化的产物, 在胃溃疡疾病中其含量可反应胃粘膜受氧化损伤的程度[14,15]. 本研究显示, Lut组的胃粘膜组织中SOD和GSH水平明显提高而MDA水平明显降低, 说明Lut可能通过清除IND诱导的大鼠胃粘膜组织的氧自由基, 从而抑制氧化应激反应对胃粘膜的损伤, 达到对胃粘膜的保护作用.
综上所述, Lut能改善IND诱导的大鼠胃溃疡, 且其机制可能与其抑制胃粘膜上皮细胞凋亡以及抗氧化应激作用相关. 另外, 本研究还提示, Lut可能是潜在的用于治疗NSAIDs诱导的胃溃疡的替代药物.
吲哚美辛(indomethacin, IND)引起的胃溃疡的机制包含氧化应激、抑制粘液生成和诱导胃黏膜细胞凋亡等.
木犀草素(luteolin, Lut)具有抗炎、抗氧化和加快伤口愈合等多种药理活性, 提示其可能具有修复胃黏膜损伤的作用, 而其在胃溃疡中的作用尚不清楚.
探索Lut对IND引起的胃溃疡是否具有防护作用, 并分析其机制.
按照文献方法, 通过灌胃IND构建大鼠胃溃疡模型, 并给予Lut治疗. 收集胃, 通过肉眼观察胃大体形态, 用HE染色法观察胃组织病理学形态, 通过试剂盒法检测胃组织中氧化应激水平和胃黏膜细胞凋亡水平.
Lut能降低胃溃疡指数, 改善IND所致的胃黏膜组织的病理形态, 降低胃黏膜凋亡水平和氧化应激水平.
Lut具有改善IND所致胃溃疡的作用, 这一作用可能与其抑制胃粘膜凋亡和氧化应激相关.
Lut是潜在的用于IND诱导的胃溃疡的防护剂或治疗剂.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C
D级 (一般): D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Baghdanian AH, Baghdanian AA, Puppala S, Tana M, Ohliger MA. Imaging Manifestations of Peptic Ulcer Disease on Computed Tomography. Semin Ultrasound CT MR. 2018;39:183-192. [PubMed] [DOI] |
| 2. | Patel V, Nicastro J. Upper Gastrointestinal Bleeding. Clin Colon Rectal Surg. 2020;33:42-44. [PubMed] [DOI] |
| 3. | Drini M. Peptic ulcer disease and non-steroidal anti-inflammatory drugs. Aust Prescr. 2017;40:91-93. [PubMed] [DOI] |
| 4. | Melcarne L, García-Iglesias P, Calvet X. Management of NSAID-associated peptic ulcer disease. Expert Rev Gastroenterol Hepatol. 2016;10:723-733. [PubMed] [DOI] |
| 5. | Bindu S, Mazumder S, Dey S, Pal C, Goyal M, Alam A, Iqbal MS, Sarkar S, Azhar Siddiqui A, Banerjee C, Bandyopadhyay U. Nonsteroidal anti-inflammatory drug induces proinflammatory damage in gastric mucosa through NF-κB activation and neutrophil infiltration: anti-inflammatory role of heme oxygenase-1 against nonsteroidal anti-inflammatory drug. Free Radic Biol Med. 2013;65:456-467. [PubMed] [DOI] |
| 6. | Blandizzi C, Tuccori M, Colucci R, Gori G, Fornai M, Antonioli L, Ghisu N, Del Tacca M. Clinical efficacy of esomeprazole in the prevention and healing of gastrointestinal toxicity associated with NSAIDs in elderly patients. Drugs Aging. 2008;25:197-208. [PubMed] [DOI] |
| 7. | Xu H, Yu W, Sun S, Li C, Zhang Y, Ren J. Luteolin Attenuates Doxorubicin-Induced Cardiotoxicity Through Promoting Mitochondrial Autophagy. Front Physiol. 2020;11:113. [PubMed] [DOI] |
| 8. | Sabiu S, Garuba T, Sunmonu T, Ajani E, Sulyman A, Nurain I, Balogun A. Indomethacin-induced gastric ulceration in rats: Protective roles of Spondias mombin and Ficus exasperata. Toxicol Rep. 2015;2:261-267. [PubMed] [DOI] |
| 9. | Wei B, Lin Q, Ji YG, Zhao YC, Ding LN, Zhou WJ, Zhang LH, Gao CY, Zhao W. Luteolin ameliorates rat myocardial ischaemia-reperfusion injury through activation of peroxiredoxin II. Br J Pharmacol. 2018;175:3315-3332. [PubMed] [DOI] |
| 10. | Guth PH, Aures D, Paulsen G. Topical aspirin plus HCl gastric lesions in the rat. Cytoprotective effect of prostaglandin, cimetidine, and probanthine. Gastroenterology. 1979;76:88-93. [PubMed] |
| 11. | Rahman Z, Dwivedi DK, Jena GB. Ethanol-induced gastric ulcer in rats and intervention of tert-butylhydroquinone: Involvement of Nrf2/HO-1 signalling pathway. Hum Exp Toxicol. 2020;39:547-562. [PubMed] [DOI] |
| 12. | Domschke W, Domschke S, Hagel J, Demling L, Croft DN. Gastric epithelial cell turnover, mucus production, and healing of gastric ulcers with carbenoxolone. Gut. 1977;18:817-820. [PubMed] [DOI] |
| 13. | Zhang Y, Xu H, He H, Li X, Feng M, He Y, Jiang W, Wang J, Xu D, Zou K. Total triterpenes from the fruits of Chaenomeles speciosa (Sweet) Nakai protects against indomethacin-induced gastric mucosal injury: involvement of TFF1-mediated EGF/EGFR and apoptotic pathways. J Pharm Pharmacol. 2020;72:409-423. [PubMed] [DOI] |
| 14. | Beiranvand M, Bahramikia S. Ameliorating and protective effects mesalazine on ethanol-induced gastric ulcers in experimental rats. Eur J Pharmacol. 2020;888:173573. [PubMed] [DOI] |
| 15. | Ajayi AF, Olaleye BS. Age-related changes in haematological parameters and biochemical markers of healing in the stomach of rats with acetic acid induced injury. Toxicol Rep. 2020;7:1272-1281. [PubMed] [DOI] |
| 16. | Amirshahrokhi K, Khalili AR. Methylsulfonylmethane is effective against gastric mucosal injury. Eur J Pharmacol. 2017;811:240-248. [PubMed] [DOI] |