修回日期: 2021-03-30
接受日期: 2021-05-25
在线出版日期: 2021-06-28
最近许多报道显示胡椒碱(piperine, PIP)具有抗癌活性, 而其在结肠癌中的具体作用及生物学机制的研究并不完善.
探究PIP对人结肠癌SW480细胞增殖、迁移和侵袭能力的影响及潜在机制.
分别用0(空白对照)、5、10和20 μg/mL的PIP处理SW480细胞24 h, 采用细胞计数试剂盒8(cell counting kit-8, CCK-8)法检测细胞活性; 采用5-乙炔基-2'脱氧尿嘧啶核苷(5-Ethynyl-2'-deoxyuridine, EdU)染色法检测细胞增殖; 采用Transwell法检测细胞迁移和侵袭; 采用蛋白质免疫印迹(Western blotting)法检测细胞中微管相关蛋白轻链3(microtubule-associated light chain 3, LC3)、p53、B细胞淋巴瘤/白血病-2(B cell lymphoma/lewkmia-2, Bcl-2)、Bcl-2相关X蛋白(Bcl-2 associated X protein, Bax)、劈裂的半胱氨酸天冬氨酸蛋白酶-3(cleaved cysteine aspartate proteinase-3, Cleaved caspase 3)蛋白表达水平.
PIP浓度依赖性抑制细胞活力、增殖、迁移和侵袭. Western blotting结果显示, 与空白对照组相比, PIP能升高SW480细胞中p53、Bax、Cleaved caspase 3的表达并降低Bcl-2的表达.
PIP可抑制SW480细胞增殖、迁移和侵袭, 其机制可能与上调p53信号通路和诱导自噬性死亡相关.
核心提要: 胡椒碱(piperine, PIP)能抑制SW480细胞的增殖、迁移和侵袭, 并可上调细胞中p53表达和诱导其自噬性死亡相关.
引文著录: 邵忆闵, 吴湧. 胡椒碱对人结肠癌SW480细胞增殖、迁移和侵袭的抑制作用. 世界华人消化杂志 2021; 29(12): 639-646
Revised: March 30, 2021
Accepted: May 25, 2021
Published online: June 28, 2021
Many recent reports have shown that piperine has anticancer activity, but the specific roles and biological mechanisms of piperine in colon cancer are not well studied.
To investigate the effects and potential mechanisms of piperine on the proliferation, migration, and invasion of human colon cancer SW480 cells.
SW480 cells were treated with 0 (blank control), 5, 10, and 20 μg/mL piperine for 24 h, respectively. Cell viability was detected by cell counting kit-8 (CCK-8) assay. Proliferation was detected by 5-ethynyl-2'-deoxyuridine (EDU) staining. Cell migration and invasion were detected by Transwell assay. The protein expression levels of microtubule-associated light chain 3 (LC3), p53, B cell lymphoma/lewkmia-2 (Bcl-2), Bcl-2 associated X protein (Bax), and cleaved cysteine aspartate proteinase-3 (Cleaved caspase 3) were detected by Western blotting.
Piperine inhibited cell viability, proliferation, migration, and invasion in a concentration-dependent manner. Western blot analysis showed that piperine increased the expression of p53, Bax, and Cleaved caspase 3 but decreased the expression of Bcl-2 in SW480 cells compared with control cells.
Piperine can inhibit the proliferation, migration, and invasion of SW480 cells, and the mechanism may be related to the up-regulation of p53 signaling pathway and the induction of autophagic cell death.
- Citation: Shao YM, Wu Y. Inhibitory effects of piperine on proliferation, migration, and invasion of human colon cancer SW480 cells. Shijie Huaren Xiaohua Zazhi 2021; 29(12): 639-646
- URL: https://www.wjgnet.com/1009-3079/full/v29/i12/639.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v29.i12.639
结直肠癌是一种常见的肠道恶性肿瘤, 其发病率和死亡率呈逐年升高趋势, 且发病年龄呈年轻化趋势[1]. 我国结直肠癌的发病率已跃居所有恶性肿瘤前5位[2]. 肿瘤切除术后辅以化疗仍然是治疗结直肠癌的主要手段, 但由于临床常用的化疗药物常具有较高的毒副作用, 从而严重影响患者的生存质量[3,4]. 因此, 迫切需要寻找新型高效低毒的药物来替代常用的化疗药物. 天然生药提取物因具有丰富的药理活性以及毒性小的特点, 其在肿瘤治疗方面可能具有良好的应用前景[5]. 胡椒碱(piperine, PIP)是一种从黑胡椒中提取的生物碱类活性化合物, 其具有抗氧化、免疫调节、抗肿瘤和促进药物代谢等多种药理活性[6-8]. 虽然, 目前关于PIP的抗肿瘤效应已经进行了一些相关的基础研究[6,7], 但其对结直肠癌细胞的具体生物学功能及机制的研究并不完善. 因此, 本研究选用结肠癌SW480细胞作为研究对象, 旨在探究PIP对SW480细胞细胞迁移和侵袭能力的影响以及潜在的生物学机制, 以评估其作为潜在的抗结肠癌候选药物的可能性.
人结肠癌SW480和HT-29细胞株购于中科院上海细胞库, 人正常结肠粘膜上皮细胞系FHC购于美国典型菌种保藏中心(American Type Culture Collection, ATCC) 细胞库, 人正常结肠粘膜上皮细胞系NCM460购于通派(上海)生物科技有限公司. 改良Eagle培养基(Dulbecco's modification of Eagle's medium Dulbecco, DMEM)、L-15培养基和胎牛血清(fetal bovine serum, FBS)购自Gibco公司; PIP(纯度>98%)购自上海阿拉丁生化科技股份有限公司; 二甲基亚砜(dimethyl sulfoxide, DMSO)试剂购自Sigma公司; 细胞计数试剂盒8(cell counting kit-8, CCK-8)试剂盒、5-乙炔基-2'脱氧尿嘧啶核苷(5-Ethynyl-2'-deoxyuridine, EdU)试剂盒、β-肌动蛋白(beta-Actin, β-Actin)抗体以及辣根过氧化物酶(horseradish peroxidase, HRP)标记的二抗购自上海碧云天生物科技有限公司; Ⅱ型微管相关蛋白轻链3(microtubule-associated light chain 3Ⅱ, LC3Ⅱ)抗体购自Abcam公司; LC3、p53、B细胞淋巴瘤/白血病-2 (B cell lymphoma/lewkmia-2, Bcl-2)、Bcl-2相关X蛋白 (Bcl-2 associated X protein, Bax)、劈裂的半胱氨酸天冬氨酸蛋白酶-3(cleaved cysteine aspartate proteinase-3, Cleaved caspase 3)抗体购自Cell Signaling Technology公司.
1.2.1细胞培养与溶液制备: 将SW480和HT-29细胞培养于含有10%FBS, 100 μU/mL青霉素-链霉素的L-15培养基中, FHC和NCM460细胞培养于含有10%FBS, 100 μU/mL青霉素-链霉素的DMEM培养基中, 上述细胞均置于37 ℃、5%CO2的细胞培养箱中培养.
1.2.2 CCK-8法检测细胞活性: 取对数生长期的SW480、HT-29、FHC和NCM460细胞用胰蛋白酶消化后将其接种在96孔板中(5×103细胞/孔)每孔做3个复孔, 待细胞贴壁后, 分别用不同浓度的PIP(0、5、10、20 μg/mL)处理细胞24 h, 用倒置相差显微镜观察细胞形态后, 每孔加入10 μL CCK-8试剂, 并在37 ℃孵育2 h, 用酶标仪在450 nm波长处检测吸光度值A. 细胞活性 = (A实验组-A对照组)/A对照组×100%.
1.2.3 EdU染色检测细胞增殖: 取对数生长期的SW480细胞用胰蛋白酶消化后将其接种在96孔板中(5.0×103细胞/孔)每孔做3个复孔, 待细胞贴壁后, 分别用不同浓度的PIP(0、5、10、20 μg/mL)处理细胞24 h. 每孔加入50 μM EdU试剂, 并在37 ℃孵育2 h, 按照试剂盒说明书步骤, 对细胞固定和透化后, 每孔加入100 μL Appollo®567染色反应液避光孵育30 min, 然后用DAPI染核. 在荧光显微镜下观察, 随机视野拍照并对EdU阳性细胞计数.
1.2.4 Transwell法检测细胞迁移和侵袭: 用24孔Transwell小室(聚碳酸酯膜, 8 μm孔径)检测细胞的迁移以及侵袭. 收集已被0、5、10、20 μg/mL PIP处理24 h的SW480细胞, 并将其用无血清培养基制成2.0×105个/mL的单细胞悬液. 进行侵袭实验时, Transwell板上室内膜表面铺有Matrigel基质胶, 并取100 μL细胞悬液加入上室, 在下室中加入700 μL含10%FBS的培养基, 常规培养24 h.
迁移实验除了不进行铺Matrigel基质胶外, 其他步骤同细胞侵袭实验. 用棉签擦除聚碳酸酯膜上表面的细胞, 并将膜下表面的细胞用甲醇固定5 min后用0.1%结晶紫染色30 min. 用倒置相差显微镜随机选取5个视野的细胞图像, 并对染色的细胞计数.
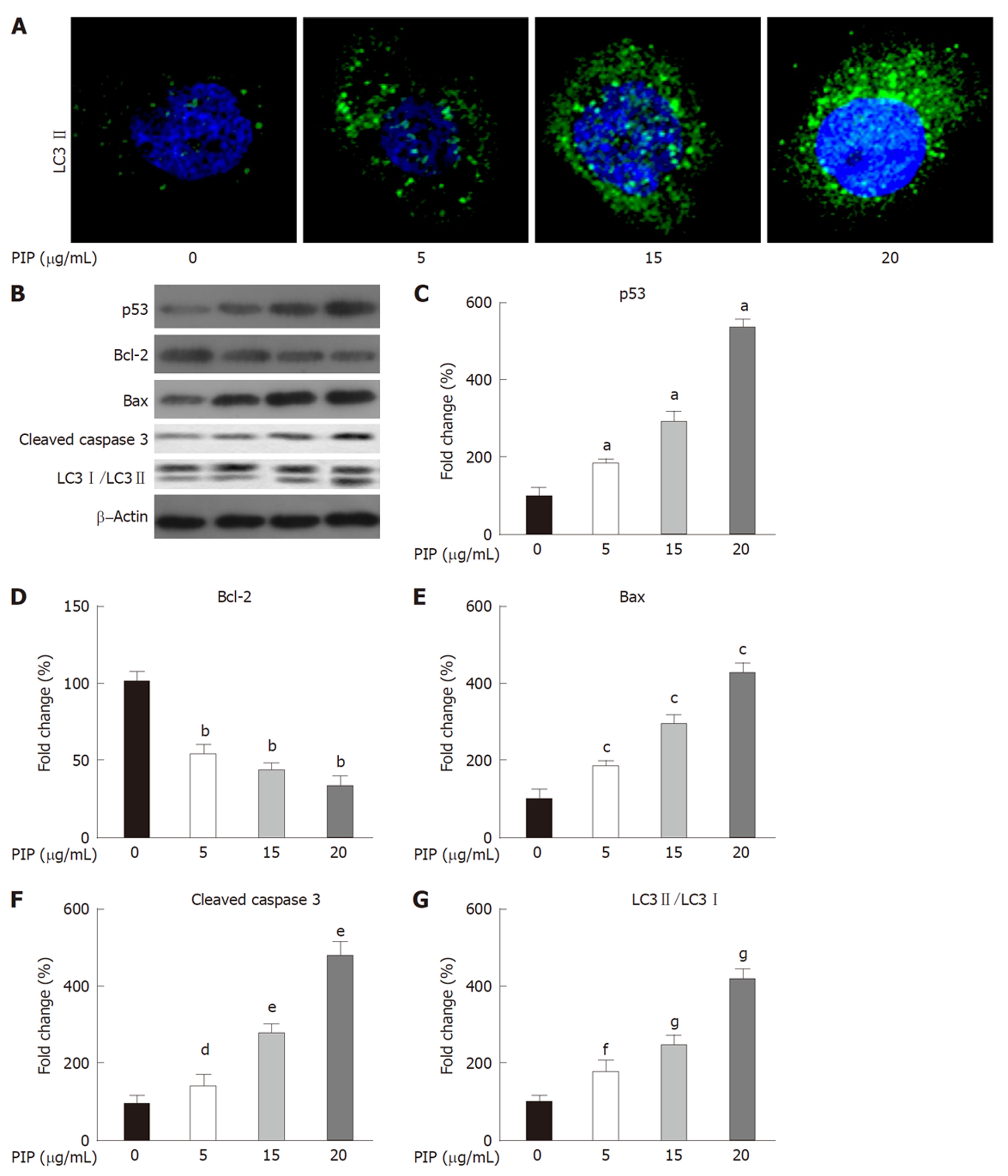
1.2.5 LC3Ⅱ免疫荧光染色: 将SW480细胞接种在24孔板(2.0×105个/孔), 用不同浓度PIP(0、5、10、20 μg/mL)处理24 h后, 收集细胞并用4%多聚甲醛固定20 min, 然后在室温下用Triton X-100透化15 min. 用5%BSA封闭细胞30 min, 然后室温孵育LC3Ⅱ(1:300)2 h. 用PBS洗涤细胞后, 室温孵育荧光标记的二抗(1:300)1 h. 再次用PBS洗涤后, 用DAPI染核, 并在荧光显微镜下观察.
1.2.6 Western blot: 收集已被0、5、10、20 μg/mL PIP处理24 h的SW480细胞, 并用RIPA缓冲液裂解细胞分离得到总蛋白. 用BCA蛋白测定试剂盒测定蛋白浓度. 将等量蛋白质经10% SDS-PAGE凝胶电泳分离后转移到PVDF膜上. 用5%脱脂牛奶封闭2 h后, 分别4 ℃孵育一抗LC3、p53、Bax、Bcl-2和Cleaved caspase 3(均1:1000稀释比例)和β-Actin(1:5000稀释比例)过夜, 经TBS洗涤3次后, 室温孵育1:2000稀释比例的HRP特异性标记的二抗2 h, 最后使用化学发光检测试剂对条带显影. 使用Image J软件对条带进行定量.
统计学处理 所有数据均以mean±SD表示, 并应用SPSS 16.0软件进行统计学分析. 多组间数据比较使用单因素方差分析, 多重比较使用Tukey法. 以P<0.05表示差异有统计学意义.
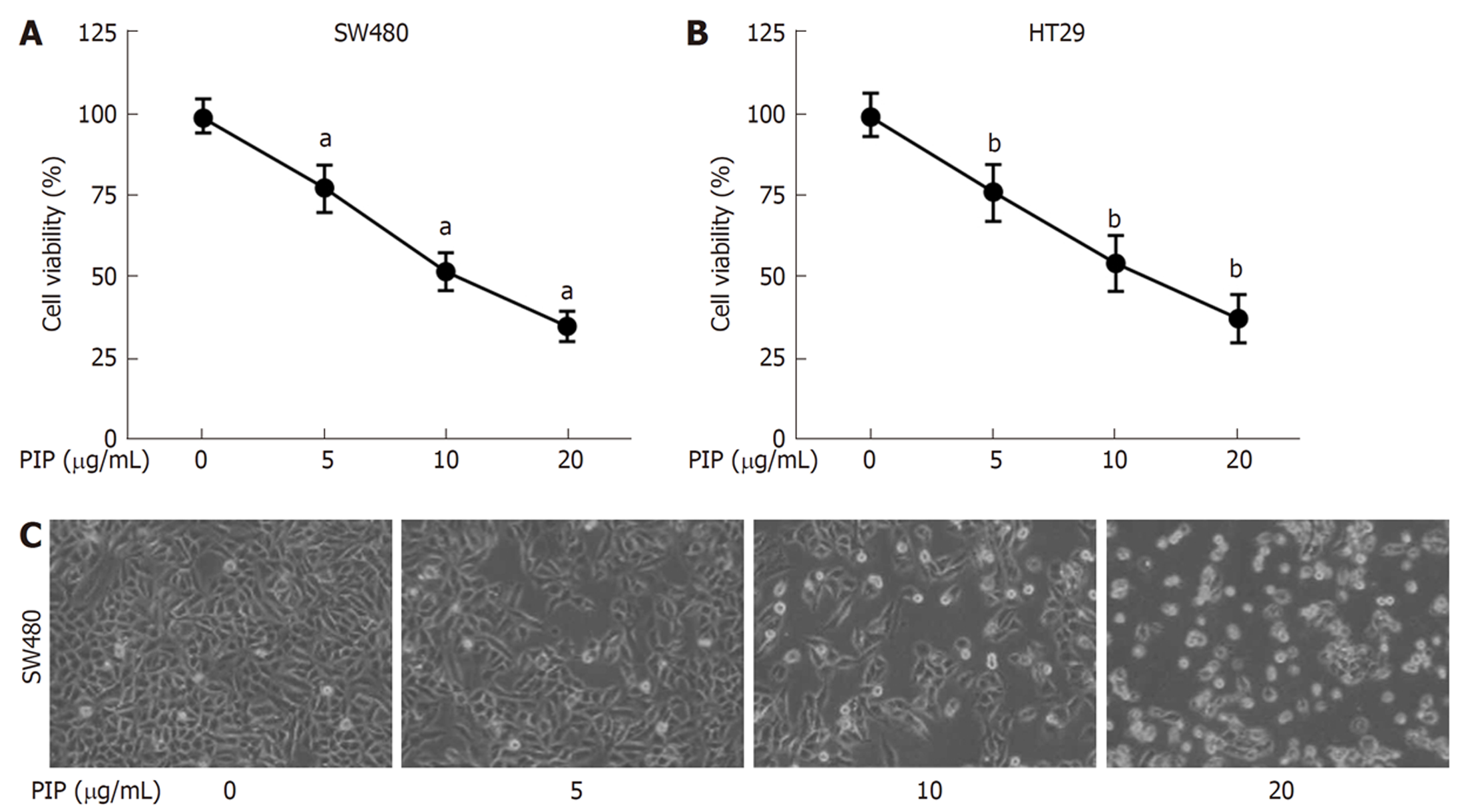
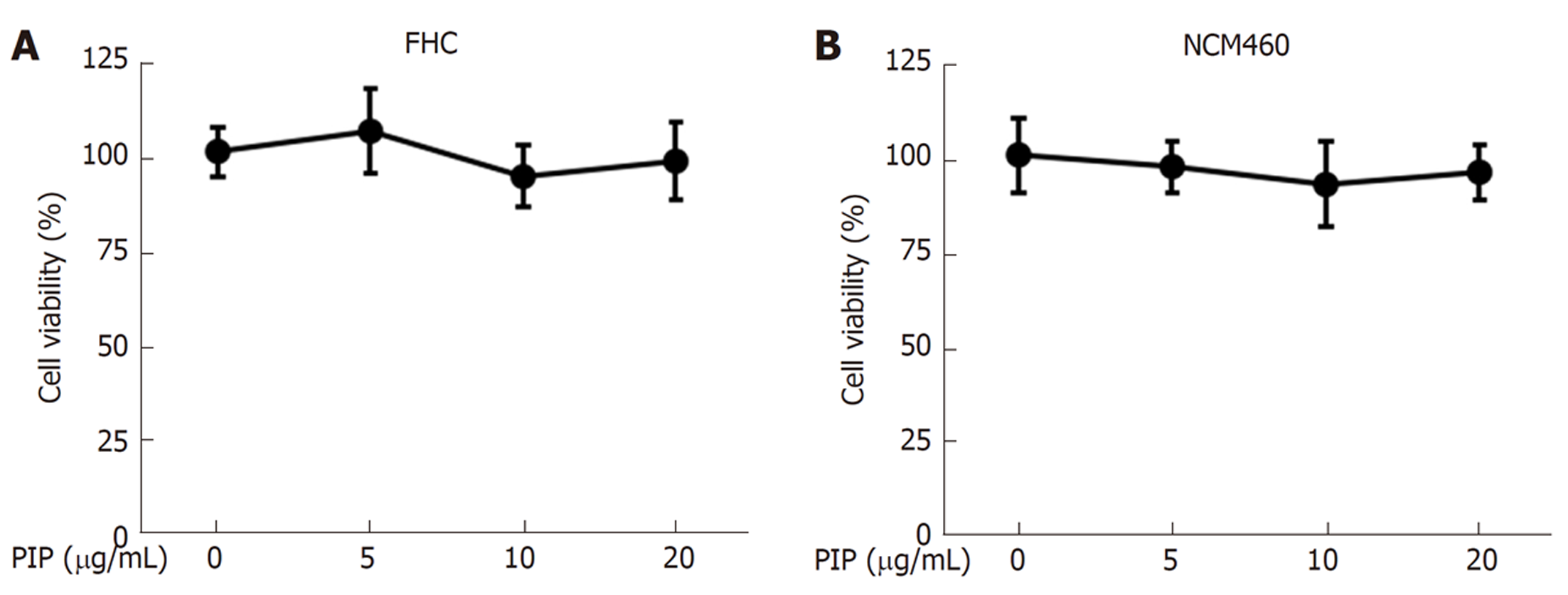
用浓度梯度递增的PIP(0、5、10、20 μg/mL)处理SW480和HT-29细胞24 h, CCK-8结果表明, PIP处理的细胞活性显著降低并呈剂量依赖性(图1A、B), 且在PIP浓度达到20 μg/mL时效果最显著. 形态学观察结果表明, PIP处理后的SW480细胞形态萎缩变圆, 且随着浓度增加, 细胞密度也逐渐降低(图1C), 同样, 当PIP浓度达到20 μg/mL时出现明显的细胞碎片和形态学改变. 另外, 在(5、10和20 μg/mL)剂量下的PIP对人正常结肠粘膜上皮细胞系FHC和NCM460的细胞活性没有影响(图2), 提示在该剂量下PIP对正常细胞无毒. 由此可见, PIP能抑制结肠癌细胞的生长并诱导其凋亡.
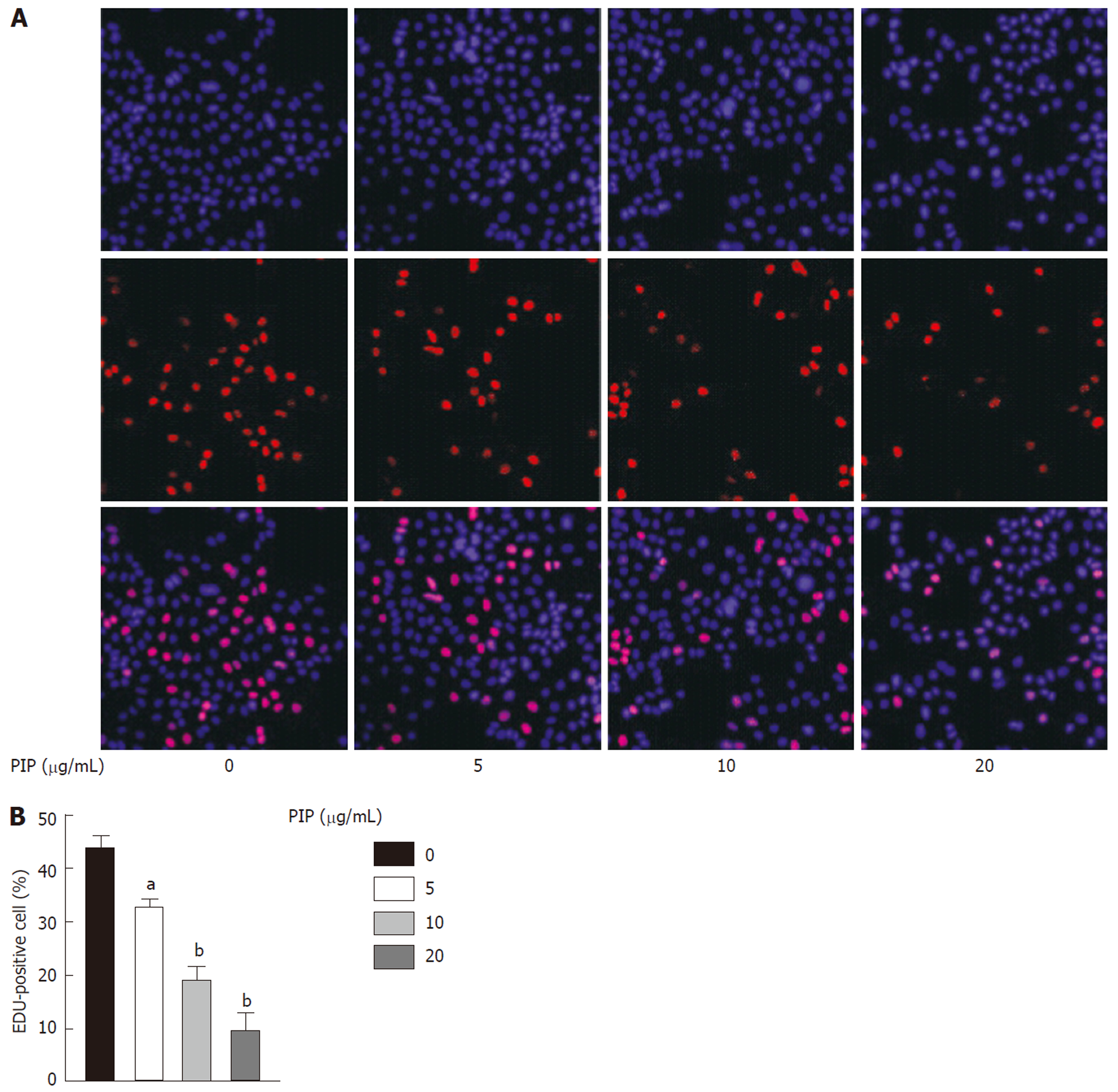
用浓度梯度递增的PIP(0、5、10、20 μg/mL)处理SW480细胞24 h, EdU染色(图3)结果显示, 随着PIP浓度逐渐升高, EdU阳性细胞比例逐渐降低, 提示SW480细胞增殖逐渐降低, 且PIP在浓度为20 μg/mL时对细胞增殖的抑制作用最为明显.
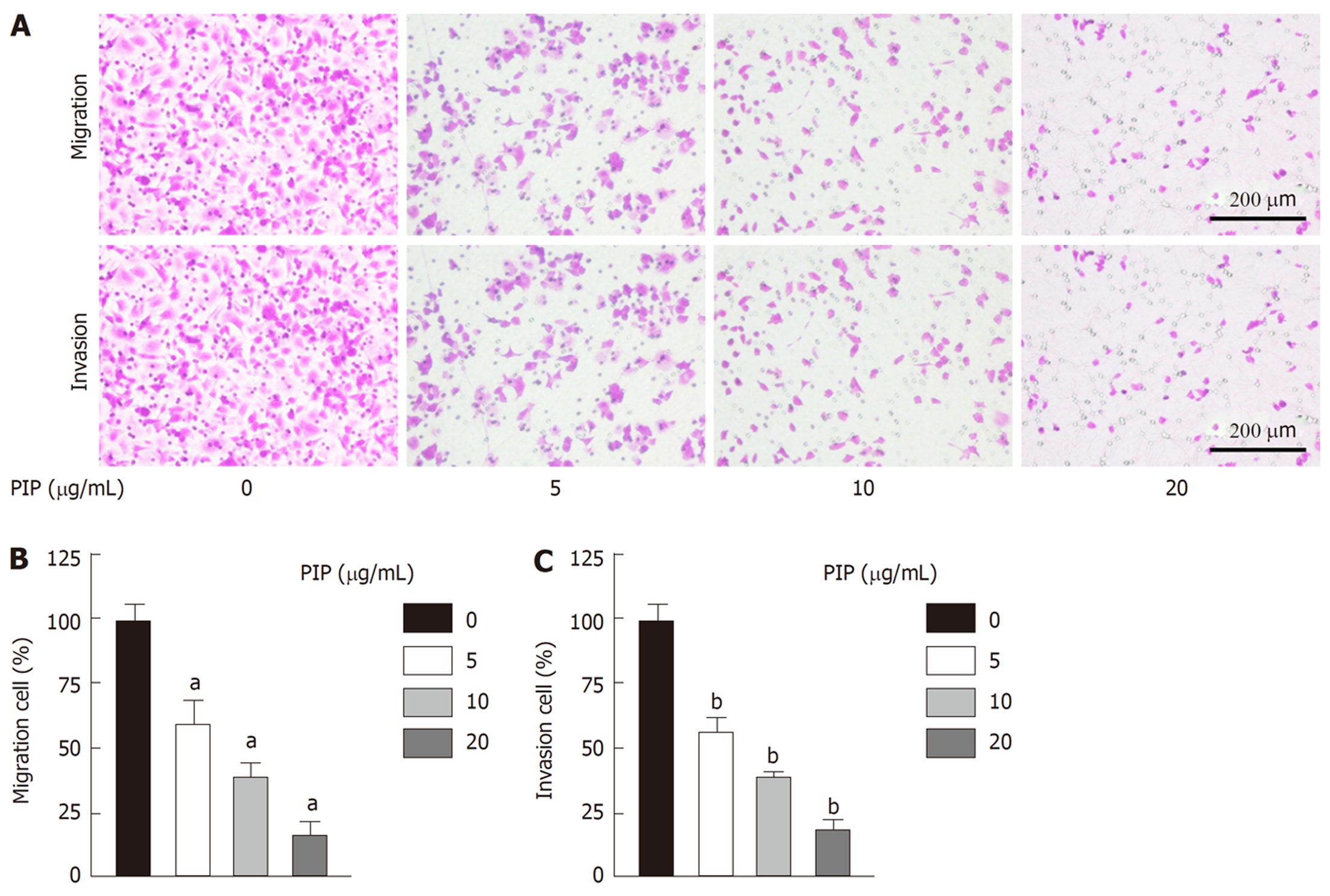
Transwell结果(图4)显示, 随着PIP浓度的升高, 细胞的迁移能力和侵袭能力均呈浓度依赖性减弱, 且PIP在浓度为20 μg/mL时对细胞迁移与侵袭的抑制作用最为明显.
LC3Ⅱ的免疫荧光染色结果(图5A)显示, PIP能诱导SW480细胞自噬. Western blot结果(图5B-G)显示, 随PIP浓度升高, SW480细胞中p53、Bax和Cleaved caspase 3表达以及LC3Ⅱ/LC3Ⅰ比值逐渐增加, Bcl-2表达逐渐降低. 以上结果说明, PIP能诱导SW480细胞发生自噬性死亡并上调p53信号.
结肠癌是临床中十分常见的一种发病率和死亡率均居高不下的恶性肿瘤性疾病[1,2], 据报道, 全球每年约新增120万例, 且每年约60万例因结肠癌而死亡[9]. 目前手术切除辅以术后化疗是结肠癌治疗中的最常用策略, 但随着化疗时间的延长, 肿瘤细胞对化疗药物的敏感性降低, 造成患者对化疗药物耐药性的产生从而阻碍治疗进程[3]. 因我国传统中药具有药理活性丰富、治疗靶点多、且毒副作用相对较低的特性, 其在肿瘤治疗方面的应用中也受到越来越多的关注[5]. 从众多传统中药中筛选具有高活性的抗肿瘤小分子可能会成为筛选新型抗癌药物的潜在途径. PIP作为一种从黑胡椒内提取的具有天然活性的生物碱, 其已被一些临床前研究证明具有抗肿瘤活性[6,7]. 本研究显示, PIP能抑制SW480细胞增殖、迁移与侵袭, 提示其有望成为抗结肠癌的潜在的替代药物.
肿瘤的发生发展与肿瘤细胞的自噬异常存在密切的关系[10,11]. 适度自噬可作为实体肿瘤细胞在对抗缺氧缺营养的不利条件下而发挥促生存的一种保护机制, 但过度自噬则会抑制肿瘤细胞的活性、增殖、迁移与侵袭并最终导致细胞死亡[12]. 研究表明, 伊立替康、奥沙利铂和5-FU等常见的化疗药物均能导致结肠癌细胞自噬性死亡[13,14]. 因此, 诱导结肠癌细胞自噬性死亡已经成为潜在的抗结肠癌治疗策略之一. 故本研究探索PIP对SW480细胞自噬的影响, 结果显示, PIP能增强SW480细胞的LC3Ⅱ的免疫荧光强度并增加LC3Ⅱ/LC3Ⅰ比值和Cleaved caspase 3表达, 说明PIP能诱导结肠癌细胞自噬性细胞死亡, 提示PIP的抗结肠癌的作用至少部分与其诱导结肠癌细胞自噬性细胞死亡相关.
本研究继续对PIP的抗结肠癌的作用机制进行了探索. 已有研究表明, p53可通过上调下游基因p21表达导致G1期阻滞[15]和下调Cyclin B1导致G2/M期阻滞[16], 从而抑制结肠癌细胞增殖; p53也可通过上调Bax和下调Bcl-2的表达来达到促进结肠癌细胞凋亡的作用[17]. 另外, p53能通过下游多信号通路来抑制结肠癌细胞的迁移与侵袭[18,19]. 本研究发现, PIP能浓度依赖性抑制SW480增殖、迁移与侵袭的同时伴随着上调p53、Bax和Cleaved Caspase 3表达并下调Bcl-2的表达, 提示PIP抑制细胞增殖、迁移与侵袭可能在一定程度上与其上调p53信号通路相关. 而p53与细胞自噬的关系相对复杂, 一方面核p53可通过发挥转录因子作用促进细胞自噬[20], 另一方面浆p53以转录活性非依赖性抑制自噬[21]. 此外, 一些毒性应激(比如某些化疗药物)和氧化应激刺激时, 结肠癌细胞自噬也可不依赖p53发生自噬性细胞死亡[13]. 因此, PIP诱导SW480细胞发生自噬性细胞死亡是否通过p53信号仍需进一步研究.
总之, 本研究目前结果显示, PIP能抑制SW480细胞增殖、迁移和侵袭, 其作用机制可能与其诱导SW480细胞自噬性细胞死亡和上调p53信号通路相关. 本研究结果还提示, PIP是潜在的结肠癌治疗剂.
由于常用的化疗药物具有较高的毒副作用, 且易产生化疗耐药, 造成目前结肠癌患者的化疗效果并不太理想. 因此, 寻找新型高效低毒的结肠癌化疗替代药物显得尤为迫切.
据最近研究显示胡椒碱(piperine, PIP)在多种肿瘤中具有抗癌作用, 但其在结肠癌的作用和机制的评估尚不完善.
探讨PIP是否具有抗结肠癌的作用.
分别通过细胞计数试剂盒8(cell counting kit-8, CCK-8)法、5-乙炔基-2'脱氧尿嘧啶核苷(5-Ethynyl-2'-deoxyuridine, EdU)染色法和Transwell法检测PIP对SW480细胞增殖、迁移以及侵袭的影响, 并用免疫荧光法和蛋白质免疫印迹法分析其潜在的机制.
PIP在0-20 μg/mL浓度范围内能以剂量依赖性方式抑制SW480细胞增殖、迁移和侵袭, 并上调细胞中p53表达和诱导其自噬性死亡相关. 另外, 在此剂量范围内对结肠癌上皮细胞无毒性.
PIP具有抗结肠癌的作用, 这一作用体现在PIP能抑制结肠癌增殖、迁移和侵袭并能诱导其自噬性死亡.
PIP是潜在的结肠癌常用化疗药的替代药物.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Siegel RL, Miller KD, Jemal A. Cancer statistics, 2019. CA Cancer J Clin. 2019;69:7-34. [PubMed] [DOI] |
| 2. | Feng RM, Zong YN, Cao SM, Xu RH. Current cancer situation in China: good or bad news from the 2018 Global Cancer Statistics? Cancer Commun (Lond). 2019;39:22. [PubMed] [DOI] |
| 3. | Hu T, Li Z, Gao CY, Cho CH. Mechanisms of drug resistance in colon cancer and its therapeutic strategies. World J Gastroenterol. 2016;22:6876-6889. [PubMed] [DOI] |
| 4. | Booth CM, Nanji S, Wei X, Peng Y, Biagi JJ, Hanna TP, Krzyzanowska MK, Mackillop WJ. Use and Effectiveness of Adjuvant Chemotherapy for Stage III Colon Cancer: A Population-Based Study. J Natl Compr Canc Netw. 2016;14:47-56. [PubMed] [DOI] |
| 5. | Li X, Yang G, Li X, Zhang Y, Yang J, Chang J, Sun X, Zhou X, Guo Y, Xu Y, Liu J, Bensoussan A. Traditional Chinese medicine in cancer care: a review of controlled clinical studies published in chinese. PLoS One. 2013;8:e60338. [PubMed] [DOI] |
| 6. | Manayi A, Nabavi SM, Setzer WN, Jafari S. Piperine as a Potential Anti-cancer Agent: A Review on Preclinical Studies. Curr Med Chem. 2018;25:4918-4928. [PubMed] [DOI] |
| 7. | Zadorozhna M, Tataranni T, Mangieri D. Piperine: role in prevention and progression of cancer. Mol Biol Rep. 2019;46:5617-5629. [PubMed] [DOI] |
| 8. | Meghwal M, Goswami TK. Piper nigrum and piperine: an update. Phytother Res. 2013;27:1121-1130. [PubMed] [DOI] |
| 9. | Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018;68:394-424. [PubMed] [DOI] |
| 10. | Onorati AV, Dyczynski M, Ojha R, Amaravadi RK. Targeting autophagy in cancer. Cancer. 2018;124:3307-3318. [PubMed] [DOI] |
| 11. | Smith AG, Macleod KF. Autophagy, cancer stem cells and drug resistance. J Pathol. 2019;247:708-718. [PubMed] [DOI] |
| 12. | Antunes F, Erustes AG, Costa AJ, Nascimento AC, Bincoletto C, Ureshino RP, Pereira GJS, Smaili SS. Autophagy and intermittent fasting: the connection for cancer therapy? Clinics (Sao Paulo). 2018;73:e814s. [PubMed] [DOI] |
| 13. | Stanislav J, Mls J, Červinka M, Rudolf E. The role of autophagic cell death and apoptosis in irinotecan-treated p53 null colon cancer cells. Anticancer Agents Med Chem. 2013;13:811-820. [PubMed] [DOI] |
| 14. | Jeong S, Kim DY, Kang SH, Yun HK, Kim JL, Kim BR, Park SH, Na YJ, Jo MJ, Jeong YA, Kim BG, Lee DH, Oh SC. Docosahexaenoic acid enhances oxaliplatin-induced autophagic cell death via the ER stress/Sesn2 pathway in colorectal cancer. Cancers (Basel). 2019;11. [PubMed] [DOI] |
| 15. | Lu L, Huang W, Hu W, Jiang L, Li Y, Wu X, Yuan D, Li M. Kruppel-like factor 2 mediated anti-proliferative and anti-metastasis effects of simvastatin in p53 mutant colon cancer. Biochem Biophys Res Commun. 2019;511:772-779. [PubMed] [DOI] |
| 16. | Jo HJ, Song JD, Kim KM, Cho YH, Kim KH, Park YC. Diallyl disulfide induces reversible G2/M phase arrest on a p53-independent mechanism in human colon cancer HCT-116 cells. Oncol Rep. 2008;19:275-280. [PubMed] |
| 17. | Houssein M, Abi Saab W, Khalil M, Khalife H, Fatfat M. Cell Death by Gallotannin Is Associated with Inhibition of the JAK/STAT Pathway in Human Colon Cancer Cells. Curr Ther Res Clin Exp. 2020;92:100589. [PubMed] [DOI] |
| 18. | Chen G, Zhou T, Li Y, Yu Z, Sun L. p53 target miR-29c-3p suppresses colon cancer cell invasion and migration through inhibition of PHLDB2. Biochem Biophys Res Commun. 2017;487:90-95. [PubMed] [DOI] |
| 19. | Liu R, Tang J, Ding C, Liang W, Zhang L, Chen T, Xiong Y, Dai X, Li W, Xu Y, Hu J, Lu L, Liao W, Lu X. The depletion of ATM inhibits colon cancer proliferation and migration via B56γ2-mediated Chk1/p53/CD44 cascades. Cancer Lett. 2017;390:48-57. [PubMed] [DOI] |
| 20. | Goiran T, Duplan E, Rouland L, El Manaa W, Lauritzen I, Dunys J, You H, Checler F, Alves da Costa C. Nuclear p53-mediated repression of autophagy involves PINK1 transcriptional down-regulation. Cell Death Differ. 2018;25:873-884. [PubMed] [DOI] |
| 21. | Sakitani K, Hirata Y, Hikiba Y, Hayakawa Y, Ihara S, Suzuki H, Suzuki N, Serizawa T, Kinoshita H, Sakamoto K, Nakagawa H, Tateishi K, Maeda S, Ikenoue T, Kawazu S, Koike K. Inhibition of autophagy exerts anti-colon cancer effects via apoptosis induced by p53 activation and ER stress. BMC Cancer. 2015;15:795. [PubMed] [DOI] |