修回日期: 2021-03-25
接受日期: 2021-05-11
在线出版日期: 2021-06-08
大肠癌一经发现大多都进入到中晚期, 给治疗和术后恢复带来极大的困难. 如何能在发病早期的不明显阶段发现病灶成为治疗的关键. 胶体金法目前属于快速、简单、准确、经济的诊断方法, 结合发病初期粪便中相关因子水平的变化, 为大肠癌早期确诊提供依据.
探讨胶体金法检测粪便中肿瘤M2型丙酮酸激酶(tumor M2-pyruvate kinase, TU M2PK)、环氧化酶-2(cyclooxygenase-2, COX-2)、波形蛋白(Vimentin)在大肠癌患者中的表达及临床意义.
选取2013-01/2017-01我院124例大肠癌患者作为观察组, 同期41例结肠镜检查阴性者作为对照组. 对比两组及不同病理特征患者TU M2PK、COX-2、Vimentin阳性率, 分析大肠癌患者生存情况相关因素.
观察组TU M2PK、COX-2、Vimentin阳性表达率均高于对照组, 差异有统计学意义(P<0.05); 大肠癌患者TU M2PK、COX-2、Vimentin阳性表达在Dukes分期、分化程度方面相比, 差异有统计学意义(P<0.05); 不同Dukes分期、分化程度、TU M2PK、COX-2、Vimentin表达患者1年生存情况相比, 差异有统计学意义(P<0.05); 纳入Cox回归分析, 调整其他混杂因素后, Dukes分期B期HR值为3.774; C期HR值为4.433; D期HR值为5.536; 分化程度中分化HR值为0.414; 高分化HR值为0.295; TU M2PK表达HR值为5.006; COX-2表达HR值为4.997; Vimentin表达HR值为4.671; TU M2PK、COX-2、Vimentin阳性表达患者1年生存率低于阴性患者, 差异有统计学意义(P<0.05).
大肠癌患者粪便中TU M2PK、COX-2、Vimentin异常表达, 胶体金法检测上述指标对筛查大肠癌及评估患者生存情况具有潜在应用价值.
核心提要: 通过胶体金的方法对大肠癌患者粪便中的肿瘤M2型丙酮酸激酶(tumor M2-pyruvate kinase, TU M2PK)、环氧化酶-2(cyclooxygenase-2, COX-2)、波形蛋白(Vimentin)进行快速、方便的检测, 通过其中含量的变化判断发生大肠癌风险的情况, 对评估患者的患病程度和生存情况提供依据.
引文著录: 楼何飞, 马春梅, 傅英芝, 张术. 胶体金法检测粪便中TU M2PK、COX-2、Vimentin在大肠癌患者中的表达变化及临床意义分析. 世界华人消化杂志 2021; 29(11): 601-608
Revised: March 25, 2021
Accepted: May 11, 2021
Published online: June 8, 2021
Colorectal cancer is often diagnosed at middle or late stage, which brings great difficulties to the treatment and postoperative recoverys. How to find the lesion at the early stage of the disease is the key to treatment. Colloidal gold method is a rapid, simple, accurate, and economical method for the early diagnosis of colorectal cancer. Combined with the changes of related factors in feces at the early stage of disease, it provides a basis for the early diagnosis of colorectal cancer.
To detect tumor M2 pyruvate kinase (TU M2PK), cyclooxygenase-2 (COX-2), and Vimentin expression in feces of patients with colorectal cancer by colloidal gold method and analyze its clinical significanced.
From January 2013 to January 2017, 124 patients with colorectal cancer diagnosed at our hospital were selected as an observation group, and 41 patients with negative colonoscopy during the same period were selected as a control group. The positive rates of TU M2PK, COX-2, and Vimentin between the two groups and patients with different pathological characteristics were compared, and factors related to the survival of patients with colorectal cancer were analyzed.
The positive expression rates of TU M2PK, COX-2, and Vimentin in the observation group were significantly higher than those in the control group (P < 0.05). The positive expression of TU M2PK, COX-2, and Vimentin in patients with colorectal cancer were significantly different among patients with different Dukes stages and tumor differentiation degrees (P < 0.05). There were statistically significant differences in the 1-year survival of patients with different Dukes stages, degrees of differentiation, and TU M2PK, COX-2, and Vimentin expression (P < 0.05). After incorporating Cox regression analysis and adjusting for other confounding factors, the hazard ratio (HR) was 3.774 for Dukes stage B, 4.433 for stage C, and 5.536 for stage D. The HR value was 0.414 for moderate differentiation and 0.295 for high differentiation; . The HR value was 5.006 for TU M2PK expression, 4.997 for COX-2 expression, and 4.671 for Vimentin expression. The 1-year survival rate of patients with positive expression of TU M2PK, COX-2, and Vimentin was significantly lower than that of patients with negative expression (P < 0.05).
TU M2PK, COX-2, and Vimentin are abnormally expressed in the stool of patients with colorectal cancer. The detection of the above indicators by colloidal gold method has potential application value in screening for colorectal cancer and assessing the survival of patients.
- Citation: Lou HF, Ma CM, Fu YZ, Zhang S. Detection of TU M2PK, COX-2, and Vimentin expression in stool by colloidal gold method in patients with colorectal cancer and its clinical significance. Shijie Huaren Xiaohua Zazhi 2021; 29(11): 601-608
- URL: https://www.wjgnet.com/1009-3079/full/v29/i11/601.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v29.i11.601
大肠癌是全世界范围内最常见恶性肿瘤之一, 据世界卫生组织报道, 此疾病是男性第3位, 女性第2位的常见恶性肿瘤[1]. 大肠癌早期缺乏特异性症状, 多数患者发现时已进展至中晚期, 而早发现、早确诊、早治疗是改善患者预后的关键环节. 有研究显示, 一次性筛查可将筛查群体大肠癌累积病死率降低10%以上[2]. 目前结肠镜检查及组织病理学检查是临床诊断大肠癌"金标准", 但此疾病早期无症状或症状不明显, 如何通过简单、患者易接受的手段筛查高危群体是当前急需解决问题之一. 肿瘤M2型丙酮酸激酶(tumor M2 pyruvate kinase, TU M2PK)是丙酮酸激酶同工酶主要成员, 正常情况其以四聚体形式存在, 但在恶性细胞中可转化成二聚体, 参与肿瘤的发生发展过程[3]; 波形蛋白(Vimentin)是一种重要细胞骨架蛋白, 主要在中胚层起源细胞内表达, 主要功能是维持细胞完整性、影响细胞迁移、黏附等过程[4]; 环氧化酶-2(cyclooxygenase-2, COX-2)是一种双功能酶, 具环氧化酶及过氧化氢酶活性. 近年相继有研究表明, TU M2PK、COX-2、Vimentin在肺癌、胃肠道恶性肿瘤中异常表达, 但其对大肠癌筛查价值如何鲜见报道[5,6]. 本研究尝试分析胶体金法检测大肠癌患者粪便中TU M2PK、COX-2、Vimentin表达及临床意义, 为临床完善大肠癌诊疗机制提供参考. 现报告如下.
选取2013-01/2017-01我院124例大肠癌患者作为观察组, 同期41例结肠镜检查阴性者作为对照组. 纳入标准: 经结肠镜检查及组织病理学诊断确诊; 首次确诊, 入组前未经相关治疗; 原发性大肠癌; 对照组体健, 无恶性肿瘤相关疾病; 患者、家属知情理解, 签署同意书. 排除标准: 合并其他恶性肿瘤疾病者; 终末期患者; 有精神、认知功能缺陷者; 不耐受结肠镜检查者. 观察组男73例, 女51例, 年龄43-79岁, 平均(66.38±5.11)岁, 有大肠癌家族史13例, 不良生活习惯: 喜肉食37例, 喜油炸31例, 吸烟58例. 对照组男22例, 女19例, 年龄41-78岁, 平均(65.29±5.30)岁, 有大肠癌家族史3例, 不良生活习惯: 喜肉食10例, 喜油炸8例, 吸烟20例. 两组性别、年龄、有大肠癌家族史、不良生活习惯基础资料均衡可比(P>0.05). 本研究经本院医学伦理委员会审批通过.
采用上海将来实业股份有限公司胶体金法试剂盒测粪便中TU M2PK、COX-2、Vimentin表达. 采用粪便样本独立收集容器采集新鲜粪便样本约5 g, 加稀释液, 振荡, 静置10 min, 再次振荡, 肉眼确认收集装置凹槽内无样本残留, 取稀释管, 采用吸管吸取样本稀释液, 垂直滴加4滴样本于试纸圆形样本孔中, 等待5 min, 确认结果; 结果判断: 视线垂直观察结果显示区测试线, 与质控线对照, 若测试线清晰可见, 即为阳性; 若测试线较弱, 保存图像, 与试剂盒附带正常人质控线阈值图像对比, 测试线较阈值图像深则为阳性; 若仅有质控, 无测试线, 则为阴性.
(1)对比两组TU M2PK、COX-2、Vimentin阳性表达; (2)对比不同病理特征患者TU M2PK、COX-2、Vimentin阳性表达率; (3)统计大肠癌患者1年生存情况; (4)Cox回归分析大肠癌患者生存情况; (5)生存曲线分析.
统计学处理 采用统计学软件SPSS 25.0处理数据, 计数资料以例数描述, 采用χ2检验; COX回归模型分析预后生存情况; Kaplan-Meier生存曲线分析TU M2PK、COX-2、Vimentin阳性表达与患者死亡的关系, 采用Log-Rank检验. 均采用双侧检验, α = 0.05.
观察组TU M2PK、COX-2、Vimentin阳性表达率均高于对照组, 差异有统计学意义(P<0.05). 见表1.
| 组别 | 例数 | TU M2PK | COX-2 | Vimentin |
| 观察组 | 124 | 80(64.52) | 77(62.09) | 71(57.26) |
| 对照组 | 41 | 6(14.63) | 6(14.63) | 3(7.32) |
| t | 30.722 | 27.765 | 31.069 | |
| P | <0.001 | <0.001 | <0.001 |
大肠癌患者TU M2PK、COX-2、Vimentin阳性表达在Dukes分期、分化程度方面相比, 差异有统计学意义(P<0.05), 在性别、年龄、病灶部位、组织学类型及病灶大小方面相比, 差异无统计学意义(P>0.05). 见表2.
| 临床参数 | 例数 | TU M2PK(n = 80) | χ2/P | COX-2(n = 77) | χ2/P | Vimentin(n = 71) | χ2/P |
| 性别 | |||||||
| 男 | 73 | 45(61.64) | 0.440/0.507 | 43(58.90) | 0.769/0.381 | 40(54.79) | 0.640/0.424 |
| 女 | 51 | 35(68.63) | 34(66.67) | 31(60.78) | |||
| 年龄 | |||||||
| <65岁 | 50 | 28(56.00) | 2.654/0.103 | 32(64.00) | 0.129/0.720 | 29(58.00) | 0.019/0.891 |
| ≥65岁 | 74 | 52(70.27) | 45(60.81) | 42(56.78) | |||
| 病灶位置 | |||||||
| 结肠 | 77 | 54(70.13) | 2.797/0.095 | 50(64.94) | 0.695/0.404 | 45(58.44) | 0.116/0.733 |
| 直肠 | 47 | 26(55.32) | 27(57.45) | 26(55.32) | |||
| Dukes分期 | |||||||
| A+B | 68 | 36(52.94) | 8.812/0.003 | 36(52.94) | 5.363/0.021 | 33(48.53) | 4.688/0.030 |
| C+D | 56 | 44(78.57) | 41(73.21) | 38(67.86) | |||
| 分化程度 | |||||||
| 高、中 | 81 | 47(58.02) | 4.300/0.038 | 42(51.85) | 10.416/0.001 | 39(48.15) | 7.921/0.005 |
| 低 | 43 | 33(76.74) | 35(81.40) | 32(74.42) | |||
| 组织学类型 | |||||||
| 腺癌 | 101 | 67(66.34) | 0.788/0.375 | 63(62.38) | 0.018/0.893 | 59(58.42) | 0.298/0.585 |
| 粘液腺癌 | 23 | 13(56.52) | 14(60.87) | 12(52.17) | |||
| 病灶大小 | |||||||
| <5 cm | 82 | 51(62.20) | 0.570/0.450 | 54(65.85) | 1.452/0.228 | 43(52.44) | 2.297/0.130 |
| ≥5 cm | 42 | 29(69.05) | 23(54.76) | 28(66.67) |
不同Dukes分期、分化程度、TU M2PK、COX-2、Vimentin表达患者1年生存情况相比, 差异有统计学意义(P<0.05). 见表3.
| 临床参数 | 例数 | 1年生存情况 | χ2 | P | |
| 生存(n = 108) | 死亡(n = 16) | ||||
| 性别 | |||||
| 男 | 73 | 64(87.67) | 9(12.33) | 0.052 | 0.819 |
| 女 | 51 | 44(86.27) | 7(13.73) | ||
| 年龄 | |||||
| <65岁 | 50 | 45(90.00) | 5(10.00) | 0.628 | 0.428 |
| ≥65岁 | 74 | 63(85.14) | 11(14.86) | ||
| 病灶位置 | |||||
| 结肠 | 77 | 67(87.01) | 10(12.99) | 0.001 | 0.972 |
| 直肠 | 47 | 41(87.23) | 6(12.77) | ||
| Dukes分期 | |||||
| A+B | 68 | 66(97.06) | 2(2.94) | 13.297 | <0.001 |
| C+D | 56 | 42(75.00) | 14(25.00) | ||
| 分化程度 | |||||
| 高、中 | 81 | 78(96.30) | 3(3.70) | 17.590 | <0.001 |
| 低 | 43 | 30(69.77) | 13(30.23) | ||
| 组织学类型 | |||||
| 腺癌 | 101 | 88(87.13) | 13(12.87) | 0.001 | 0.982 |
| 粘液腺癌 | 23 | 20(86.96) | 3(13.04) | ||
| 病灶大小 | |||||
| <5 cm | 82 | 71(86.59) | 11(13.41) | 0.056 | 0.812 |
| ≥5 cm | 42 | 37(88.10) | 5(11.90) | ||
| TU M2PK | |||||
| 阳性 | 80 | 66(82.50) | 14(17.50) | 4.239 | 0.040 |
| 阴性 | 44 | 42(95.45) | 2(4.55) | ||
| COX-2 | |||||
| 阳性 | 77 | 63(81.82) | 14(18.18) | 5.037 | 0.025 |
| 阴性 | 47 | 45(95.74) | 2(4.26) | ||
| Vimentin | |||||
| 阳性 | 71 | 56(78.87) | 15(21.13) | 9.996 | 0.002 |
| 阴性 | 53 | 52(98.11) | 1(1.89) | ||
纳入Cox回归分析, 调整其他混杂因素后, Dukes分期B期HR值为3.774(95%CI为2.079-6.852), 表示B期患者在某时刻死亡的危险度是A期患者的3.774倍; C期HR值为4.433(95%CI为2.525-7.782), 表示C期患者在某时刻死亡的危险度是A期患者的4.433倍; D期HR值为5.536(95%CI为3.124-9.812), 表示D期患者在某时刻死亡的危险度是A期患者的5.536倍; 分化程度中分化HR值为0.414(95%CI为0.245-0.698), 表示中分化患者在某时刻死亡的危险度是低分化患者的0.414倍; 高分化HR值为0.295(95%CI为0.215-0.404), 表示高分化患者在某时刻死亡的危险度是低分化患者的0.295倍; TU M2PK表达HR值为5.006(95%CI为2.741-9.142), 表示阳性患者在某时刻死亡的危险度是阴性患者的5.006倍, COX-2表达HR值为4.997(95%CI为3.025-8.256), 表示阳性患者在某时刻死亡的危险度是阴性患者的4.997倍; Vimentin表达HR值为4.671(95%CI为2.857-7.637), 表示阳性患者在某时刻死亡的危险度是阴性患者的4.671倍. 见表4.
| 因素 | β | S.E. | Wald χ2 | P | HR | 95%CI |
| Dukes分期 | ||||||
| B | 1.328 | 0.312 | 18.123 | <0.05 | 3.774 | 2.079-6.852 |
| C | 1.489 | 0.313 | 22.632 | <0.05 | 4.433 | 2.525-7.782 |
| D | 1.711 | 0.314 | 29.705 | <0.05 | 5.536 | 3.124-9.812 |
| 分化程度 | ||||||
| 中 | -0.883 | 0.251 | 12.376 | <0.05 | 0.414 | 0.245-0.698 |
| 高 | -1.222 | 0.314 | 15.139 | <0.05 | 0.295 | 0.215-0.404 |
| TU M2PK表达 | 1.611 | 0.309 | 27.168 | <0.05 | 5.006 | 2.741-9.142 |
| COX-2表达 | 1.609 | 0.341 | 22.262 | <0.05 | 4.997 | 3.025-8.256 |
| Vimentin表达 | 1.541 | 0.325 | 22.494 | <0.05 | 4.671 | 2.857-7.637 |
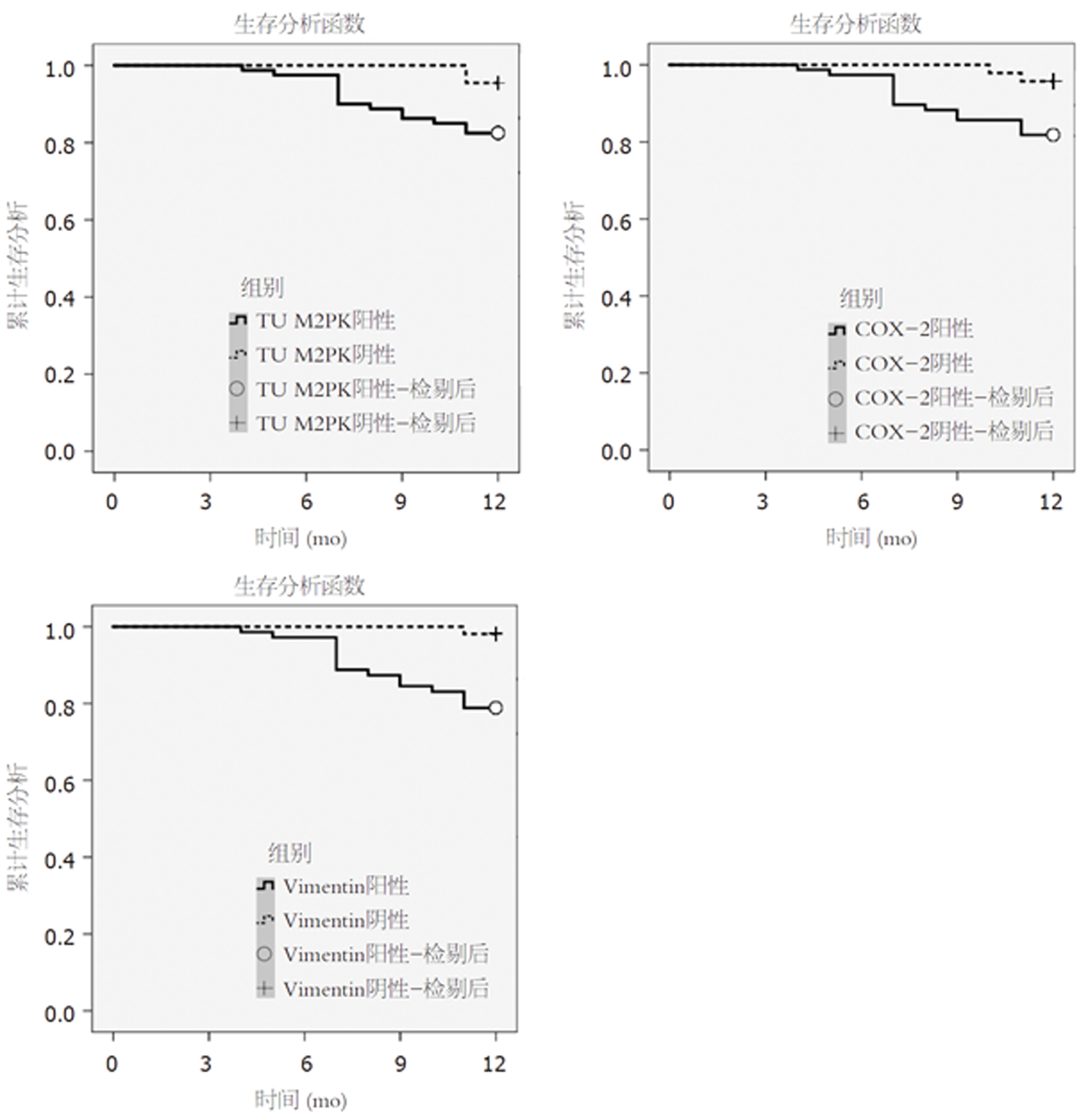
TU M2PK、COX-2、Vimentin阳性表达患者1年生存率低于阴性患者, 差异有统计学意义(χ2 = 4.338、5.070、9.968, P<0.05). 见图1.
大肠癌是我国常见恶性肿瘤之一, 也是近三十年发病率增加最快肿瘤之一, 而如何加强大肠癌筛查, 做到早发现、早治疗是当前急需解决问题之一[7]. 近年基于分子生物学快速发展, 此技术已逐渐成为大肠癌诊断的一项新型无创检测技术, 且有研究表明, 与常规粪便隐血试验对比, 具更高敏感性及特异性, 但哪种指标更具有应用价值尚无定论[8].
目前有关大肠癌的研究较多, 如: 张鑫东等[9]提出常见肿瘤标志物糖类抗原199、癌胚抗原表达与直肠癌转移关系密切, 但根据研究结果不难发现, 其预测预后的敏感度、特异度一般. TU M2PK主要分布在细胞内部, 但随细胞转化、肿瘤坏死等可被释放入体液, 并以无活性二聚体形式存在, 因此, 可在体液内检测到TU M2PK表达, 且有研究发现, U M2PK在消化道肿瘤患者外周血及粪便内高表达, 与肿瘤发生发展密切相关, 且其已被明确作为外周血、粪便内的肿瘤生物标志物[10]. Vimentin是中间丝结合蛋白家族主要成员, 有研究显示, 其对应基因启动子的甲基化与其表达异常关系密切, 此特征与癌前病变、大肠肿瘤等发生有关[11]. Vimentin在粪便内检测敏感性高, 作为大肠癌筛查分子标志物具良好检测性能, 是首次应用粪便DNA甲基化作为大肠癌诊断性检测的靶基因. 本研究采用胶体金法检测大肠癌患者粪便中TU M2PK、Vimentin表达情况, 结果发现, 二者阳性表达率达分别为64.52%, 57.26%, 均存在一定漏诊、误诊情况, 仍需继续完善检测机制. 此外, 正常情况COX-2在体内维持相对稳定状态, 参与前列腺素生成及维持机体正常功能, 但出现炎症反应及发生肿瘤时, 其表达显著升高[12]. 现有研究显示, COX-2在正常分化组织中几乎无表达, 但在结直肠癌等多种恶性肿瘤组织内呈特异性表达[13]. 本研究也发现, 观察组粪便中COX-2阳性表达率62.09%高于对照组(P<0.05). 结合学者张翔、Lin等[14,15]研究分析, 主要是因COX-2能参与细胞增殖、侵袭及抑制细胞凋亡等过程, 具原癌基因活性, 通过抑制CyclinD1等靶基因表达致细胞停滞在G0/G1期继而妨碍细胞进入DNA合成期及有丝分裂期, 阻断分化过程. 上述研究说明, TU M2PK、COX-2、Vimentin可能共同参与大肠癌发生过程, 或可互为补充为临床筛查大肠癌提供新视角.
本研究对不同病理特征患者TU M2PK、COX-2、Vimentin阳性表达率探讨发现, 随大肠癌Dukes分期升高, 分化能力降低, 上述指标阳性表达率升高(P<0.05), 反映TU M2PK、COX-2、Vimentin可能同时参与大肠癌发展过程. 此特征亦符合TU M2PK、COX-2、Vimentin病理生理作用, 均参与、影响细胞分裂过程, 或可为临床评价大肠癌病情、患者生存情况提供参考[16,17]. 但还有研究指出[18], 大肠癌患者预后转归与病灶位置、组织学类型等多种因素有关, 是多过程、多因素共同作用的结果. 本研究对比1年期不同生存情况患者一般资料未发现上述特征, 继续Cox回归分析显示, 粪便中TU M2PK、COX-2、Vimentin阳性表达率每升高1个单位患者病死风险均增加4.6倍以上, 客观说明TU M2PK、COX-2、Vimentin是大肠癌发生发展的独立危险因素. 进一步Kaplan-Meier分析显示, TU M2PK、COX-2、Vimentin阳性表达患者1年生存率低于阴性患者(P<0.05), 证实TU M2PK、COX-2、Vimentin表达水平与患者生存情况关系密切. 但本研究不足之处在于随访时间较短, 在阐明大肠癌患者生存情况与TU M2PK、COX-2、Vimentin间关系层面可能缺乏客观性, 仍需后期继续探究.
综上可知, 大肠癌患者粪便中TU M2PK、COX-2、Vimentin异常表达, 胶体金法检测上述指标对筛查大肠癌及评估患者生存情况具有潜在应用价值.
由于人们不良的饮食习惯和家族遗传等原因, 大肠癌的发病率呈逐年上升趋势. 而且大肠癌发病早期症状不明显, 极易发展恶化. 目前对于大肠癌的检测主要依靠结肠镜和病理学, 鉴于方法较繁琐且有创伤风险, 自愿接受检测的意愿不强烈.
鉴于大肠癌检测手段的局限性和体内检测的微创风险, 体外检测不仅可以实现无创, 而且还能为检测双方带来方便, 提高高危人群的检测意识和积极性. 粪便是反映大肠状态最直接、最灵敏的产物. 作为体外检测主流方法之一的胶体金具有操作方便、检测效率高、检测成本低的特点.
本研究的目标是用无创的胶体金体外检测方法探索大肠癌患者粪便中肿瘤M2型丙酮酸激酶(tumor M2-pyruvate kinase, TU M2PK)、环氧化酶-2(cyclooxygenase-2, COX-2)、波形蛋白(Vimentin)等相关因子含量的变化与其患病程度以及生存健康之间的关系, 以期能够为疾病的早发现、早治疗提供相关依据.
本研究采用胶体金检测粪便中相关因子含量的方法, 通过观察和随访判断患者的身体状况和恢复情况, 最后用统计学回归分析打方法分析粪便中与大肠癌患者病情关系密切的相关因子情况.
大肠癌患者TU M2PK、COX-2、Vimentin阳性表达率均高于阴性对照组, 且不同Dukes分期、分化程度、TU M2PK、COX-2、Vimentin表达患者1年生存情况相比, 差异有统计学意义(P<0.05). TU M2PK、COX-2、Vimentin阳性表达患者1年生存率低于阴性患者.
粪便中TU M2PK、COX-2、Vimentin的表达情况对大肠癌患者的生存期、Dukes分期、分化程度均有显著的影响, 为大肠癌的早期、快速诊断提供一定的借鉴意义.
本研究虽然提供了快速检测大肠癌患者病情的方法, 但是也存在病例数不够多、随访时间较短等问题, 仍需后期继续收集病例数, 增加随访时间等深入探究, 在3个检测指标的基础上继续深入挖掘, 发现更多更灵敏的检测指标.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): 0
E级 (差): E
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Zorzi M, Cavestro GM, Guzzinati S, Dal Maso L, Rugge M; AIRTUM Working Group. Decline in the incidence of colorectal cancer and the associated mortality in young Italian adults. Gut. 2020;69:1902-1903. [PubMed] [DOI] |
| 2. | 陈 万青, 李 霓, 兰 平, 陈 宏达, 杜 灵彬, 孙 凤, 黎 国威, 何 晓生, 王 乐, 李 子一, 朱 陈, 卢 明, 曹 毛毛, 孙 殿钦, 何 思怡, 李 贺, 杨 卓煜. 中国结直肠癌筛查与早诊早治指南(2020, 北京). 中国肿瘤. 2021;30:1-28. [DOI] |
| 3. | Yuan Q, Yu H, Chen J, Song X, Sun L. Knockdown of pyruvate kinase type M2 suppresses tumor survival and invasion in osteosarcoma cells both in vitro and in vivo. Exp Cell Res. 2018;362:209-216. [PubMed] [DOI] |
| 6. | 李 明, 谭 诗云. siRNA介导COX-2基因沉默对大肠癌LoVo细胞侵袭及上皮间质转化的影响. 胃肠病学和肝病学杂志. 2018;27:1363-1366. [DOI] |
| 7. | 蔡 慧, 徐 光寰, 王 珏, 王 烨菁, 高 淑娜, 丁 一波, 杜 琰. 上海市原卢湾区2004-2011年消化系统常见肿瘤的发病和死亡趋势分析. 中国临床医学. 2018;25:542-548. [DOI] |
| 10. | Bandara IA, Baltatzis M, Sanyal S, Siriwardena AK. Evaluation of tumor M2-pyruvate kinase (Tumor M2-PK) as a biomarker for pancreatic cancer. World J Surg Oncol. 2018;16:56. [PubMed] [DOI] |
| 11. | Liu SQ, Xu CY, Wu WH, Fu ZH, He SW, Qin MB, Huang JA. Sphingosine kinase 1 promotes the metastasis of colorectal cancer by inducing the epithelialmesenchymal transition mediated by the FAK/AKT/MMPs axis. Int J Oncol. 2019;54:41-52. [PubMed] [DOI] |
| 12. | 马 家驰, 赵 晓丹, 亓 建波, 郭 庆金, 龚 珍强, 杜 剑波, 陈 晓昌. 前列腺素E2和环氧化酶2在结直肠癌组织中的表达及其临床意义. 中华普通外科杂志. 2018;33:322-325. [DOI] |
| 13. | 孙 鹏, 权 继传, 关 旭, 郁 雷, 刘 正, 姜 争, 王 贵玉, 王 锡山. 环氧合酶-2与结直肠癌的关系及以其为靶点的治疗进展. 肿瘤学杂志. 2019;25:1031-1036. [DOI] |
| 14. | 张 翔, 杨 觅, 胡 静, 李 丽, 史 炯, 刘 宝瑞, 钱 晓萍. 结直肠癌中C-MET、COX-2、MSS、Ki-67的表达及其与预后的相关性分析. 解放军预防医学杂志. 2018;36:598-601. [DOI] |
| 15. | Lin YM, Lu CC, Hsiang YP, Pi SC, Chen CI, Cheng KC, Pan HL, Chien PH, Chen YJ. c-Met inhibition is required for the celecoxib-attenuated stemness property of human colorectal cancer cells. J Cell Physiol. 2019;234:10336-10344. [PubMed] [DOI] |
| 17. | Tomay F, Marinelli A, Leoni V, Caccia C, Matros A, Mock HP, Tonelli C, Petroni K. Purple corn extract induces long-lasting reprogramming and M2 phenotypic switch of adipose tissue macrophages in obese mice. J Transl Med. 2019;17:237. [PubMed] [DOI] |