修回日期: 2021-04-19
接受日期: 2021-05-11
在线出版日期: 2021-06-08
慢传输型便秘(slow transit constipation, STC)的发病率呈现逐年上升趋势, 但目前临床常用的治疗手段的疗效并不完全令人满意. 研究显示, 中医药、针灸、艾灸、 按摩以及中药贴敷等手段对STC的治疗取得了一定的疗效.
研究电针联合六磨汤对STC大鼠的治疗作用和作用机制.
通过饲喂复方苯乙哌啶构建STC大鼠模型, 并分别给予电针、六磨汤或电针联合六磨汤进行治疗. 治疗结束后, 观察大鼠的一般状况, 并统计大鼠24 h内排便粒数、粪便含水量和小肠碳末推进率; ELISA检测血清一氧化氮(nitric oxide, NO)和内皮型一氧化氮合酶(endothelial nitric oxide synthase, eNOS)含量. Western blot检测水通道蛋白3、8、9 (aquaporin 3,8,9, AQP3,8,9)、c-kit和c-kit配体干细胞因子(stem cell factor, SCF)的表达水平以及PI3K/AKT信号通路的活性.
相较于电针或六磨汤单一治疗组, 电针联合六磨汤治疗可显著增加便秘大鼠24 h内的排便粒数和粪便含水量, 同时加快碳末推进率. 同时, 电针联合六磨汤治疗可显著降低便秘大鼠血清中NO和eNOS水平. Western blot的结果显示, 电针联合六磨汤治疗可显著上调便秘大鼠结肠组织中c-kit和SCF的蛋白表达水平, 下调AQP3、AQP8和AQP9的蛋白表达水平; 此外, 还可显著促进大鼠结肠组织中PI3K和AKT的磷酸化.
电针联合六磨汤治疗可改善STC大鼠的症状, 这种作用涉及多个靶点, 主要与调节水液代谢、增加胃肠动力以及促进胃肠蠕动等相关.
核心提要: 电针联合六磨汤可显著改善慢传输型便秘大鼠的症状. 且, 这种治疗作用主要体现在: 促进小肠推进, 调节便秘大鼠的小肠传输功能; 上调SCF/c-kit信号通路促进Cajal间质细胞数量, 影响结肠的慢波电位, 增加肠道动力; 通过PI3K/AKT信号通路抑制eNOS合成NO, 促进胃肠蠕动; 抑制水通道蛋白的表达, 调节水液代谢, 增加粪便的含水量.
引文著录: 王立明, 尚惺杰, 朱雅碧, 叶淑芳, 刘央央, 陈勇. 电针联合六磨汤对慢传输型便秘大鼠的有益作用. 世界华人消化杂志 2021; 29(11): 585-591
Revised: April 19, 2021
Accepted: May 11, 2021
Published online: June 8, 2021
The morbidity of slow transit constipation (STC) has been increasing year by year, but the efficacy of commonly used clinical treatments is not completely satisfactory. Studies have shown that traditional Chinese medicine, acupuncture, moxibustion, massage, and Chinese medicine application have achieved certain curative effects in the treatment of STC.
To investigate the therapeutic effects and mechanisms of electroacupunture combined with Liumotang on STC in rats.
An STC rat model was established by feeding rats diphenoxylate, and then rats were treated with electroacupunture, Liumotang, or electroacupunture combined with Liumotang. After treatment, the general condition of rats was observed and the number of fecal pellets, fecal water content, and carbon propulsion rate were recorded. ELISA was used to assess the levels of serum nitric oxide (NO) and endothelial nitric oxide synthase (eNOS). The expression of aquaporin 3,8,9 (AQP3,8,9), c-kit, and stem cell factor (SCF) and the activity of PI3K/AKT pathway were evaluated by Western blot assay.
Compared with the electroacupunture group or Liumotang group, the treatment of electroacupunture combined with Liumotang could significantly increase the number of fecal pellets in 24 h, fecal water content, and carbon propulsion rate. Meanwhile, the combined treatment significantly decreased serum NO and eNOS levels in STC rats. Western blot results showed that the treatment of electroacupunture combined with Liumotang could up-regulate the protein expression of c-kit and SCF, while down-regulate the protein expression of AQP3, AQP8, and AQP9 in the colon tissue of STC rats. Furthermore, the phosphorylation of PI3K and AKT was promoted in the colon tissue of STC rats after the combined treatment.
Electroacupunture combined with Liumotang could relieve the symptoms of STC rats. And this therapeutic effect involves many targets, which is mainly related to regulating water and fluid metabolism, increasing gastrointestinal motility, and promoting gastrointestinal peristaltic.
- Citation: Wang LM, Shang XJ, Zhu YB, Ye SF, Liu YY, Chen Y. Electroacupuncture combined with Liumotang has beneficial effects on slow transit constipation in rats. Shijie Huaren Xiaohua Zazhi 2021; 29(11): 585-591
- URL: https://www.wjgnet.com/1009-3079/full/v29/i11/585.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v29.i11.585
慢传输型便秘(slow transit constipation, STC)是常见的便秘类型, 主要表现为结肠蠕动动力降低而致使结肠通过时间的延长并导致粪便滞留于结肠部[1]. STC患者除自感腹胀腹痛外, 还可出现恶心、头晕等症状, 严重者甚至可致肠梗阻、肠穿孔等危及事件[1,2]. 流行病学调查研究显示, 随着人口老龄化的出现以及饮食结构的改变, 各类型慢性便秘的发病率呈现逐年上升趋势. STC不仅影响患者的生活质量, 甚至导致一系列精神心理问题和不良心血管事件[3]. 目前, STC的治疗手段主要是手术或西药(西沙比利等), 但这些治疗手段往往存在术后并发症或不良反应, 进一步增加患者的痛苦[2,4]. 而STC的病因复杂, 发病过程中不仅有多种激素和神经递质的参与, 还会同时出现多种胃肠微结构的异常, 这导致了药物的治疗难度[5,6]. 近年来大量研究显示, 中医药、针灸、艾灸、按摩以及中药贴敷等手段对STC的治疗取得了一定的疗效[7-9]. 故本研究拟通过STC大鼠模型, 结合中医对本病的认知及已有的研究成果, 探讨电针疗法联合传统方剂六磨汤在STC中的治疗作用, 并从结肠动力学和水液代谢等方面分析其可能的作用机制.
1.1.1 试剂: 血清NO及eNOS检测试剂盒购自南京建成生物工程研究所; p-PI3K和PI3K抗体购自上海泊湾生物科技有限公司; p-AKT和AKT抗体购自美国Affinity Biosciences公司; AQP3、AQP8和AQP9抗体购自美国Santa Cruz公司; c-kit、SCF、β-actin和GAPDH抗体购自美国Abcam公司; 复方苯乙哌啶片剂购自于常州康普药业有限公司. 六磨汤方剂出自《世医得效方》, 由我院中药房提供并制备水煎剂(2 g/mL).
1.1.2 实验动物: 50只SPF级雄性SD大鼠(200±20 g)购自浙江维通利华实验动物技术有限公司[SCXK(浙)2019-0001], 实验动物均饲养在条件可控(室温维持在22±2 ℃、湿度维持在50%-70%)的动物房.
1.2.1 模型构建和分组处理: 大鼠应用普通饲料适应性饲养一周后完全随机分为两组: 对照组(Con)10只, 给予普通饲料正常喂养; 剩余40只给予含复方苯乙哌啶的饲料(8 mg/kg·d, 连续饲养120 d)建立STC模型. 随后将造模成功的40只大鼠随机分为模型组(STC, 10只), 电针治疗组(EA, 10只), 六磨汤治疗组(LMT, 10只)以及电针和六磨汤联合治疗组(EA+LMT, 10只). 电针治疗组大鼠选取支沟、足三里和上巨虚进行电针治疗(2 Hz/100Hz疏密波, 留针15 min, 共15 d), 六磨汤治疗组每天灌胃六磨汤(10 ml/kg·d, 共15 d), 联合治疗组同时接受电针治疗和六磨汤灌胃. STC组大鼠每天给予等体积生理盐水灌胃.
1.2.2 大鼠一般行为观察与检测: 每日按照肉眼主观观察大鼠的皮毛色泽、精神状态(反应和动作是否灵敏)、食纳(摄食状态)和大便形态, 并记录大鼠体重. 在实验结束时, 按照客观指标统计上述情况, 客观实验描述如下:
皮毛状态按照皮毛泽度和浓密程度评估, 浓密光亮记2分, 浓密无光泽记1分, 稀释枯黄记0分; 精神状态按照旷场实验中大鼠活动度评估. 首先将大鼠在安静、无人的行为实验室适应20 min. 然后将大鼠均放入旷场箱(100 cm×100 cm×50 cm; 长×宽×高; 箱底均分25个20 cm×20 cm的方格)的中间方格, 用视频记录仪录像9 min, 并通过回放记录大鼠中间3 min内穿越的方格数. 大鼠活动度以3 min内穿越的总方格数表示.
摄食和排便情况检测: 将大鼠转移至代谢笼(每笼1只大鼠)中, 允许大鼠自由活动. 早上8:00放入50 g饲料, 次日8:00收集称量剩余饲料, 并计算大鼠24 h摄食量(投放饲料量-剩余饲料量), 大鼠食纳欲望按照大鼠24 h摄食量(g)/体重(g)来评估. 收集24 h内的排便并计数排便粒数. 称量粪便重量(记为湿重); 随后60 ℃烘箱内烘干24 h, 再次称重(记为干重). 粪便含水量(%) = (湿重-干重)/干重×100%.
1.2.3 小肠推进检测: 实验结束时, 大鼠禁食12 h, 然后对大鼠灌胃10%活性炭混悬液, 每只灌胃2 mL. 30 min后, 麻醉处死大鼠并暴露腹腔, 将幽门至回盲部的小肠管取出并轻柔拉直, 测量碳末推进长度(cm)和小肠管的总长度(cm). 炭末推进率(%) = 炭末推进长度/小肠管总长度×100%.
1.2.4 ELISA: 麻醉后提取腹主动脉血液, 室温条件下, 静置30 min, 随后经冷冻离心机以3000 rpm离心10 min收集血清. 依据试剂盒操作说明书步骤, 用ELISA法检测血清中NO和eNOS的含量.
1.2.5 Western Blot: 取各组大鼠结肠组织进行匀浆处理, 并利用RIPA裂解液提取组织总蛋白. 之后依据BCA蛋白定量试剂盒测定所提蛋白的浓度并定量. 每个样品取70 μg蛋白并加入4倍体积的蛋白上样缓冲液, 煮沸变性, 经小型垂直电泳装置行10% SDS-PAGE电泳. 随后将凝胶上的蛋白转移至PVDF膜. 取出PVDF膜置于5%脱脂乳中室温封闭60 min. 按抗体说明书推荐的浓度加入相应的一抗, 置于4 ℃冰箱中振摇孵育过夜. 次日复温并用TBST缓冲液漂洗, 随后加入相对应的HRP标记二抗, 室温条件下振摇孵育90 min. 再次用TBST缓冲液漂洗, 并转移至暗室中洒上ECL化学发光液显影, 利用胶片曝光目的条带. 冲洗后, 采用Image J软件对蛋白的表达进行半定量分析.
统计学处理 所得结果表示为均数±标准差(mean±SD), 并利用Graphpad Prism 8统计学软件进行统计分析. 多组数据之间的比较采用单因素方差分析(one-way ANOWA), 多组数据间均数的两两比较选用Bonferroni法. P<0.05表示差异具有统计学意义.
一般行为资料观察结果(表1)显示, 对照组大鼠精神状态佳、皮毛柔软光亮、食纳佳; 与对照组比较, STC模型组大鼠体型消瘦(体重显著减轻)、皮毛枯黄稀疏(皮毛积分显著降低)、食纳不佳、精神萎靡(旷场试验中大鼠跨越方格数显著降低)、与STC模型组比较, 电针治疗组、六磨汤治疗组以及联合治疗组大鼠体重明显增加、皮毛积分升高、食纳欲增加、精神状态转好.
| Group | Body weight (g) | Hair score | Food intake desire (×10-3) | Locomotor activity (n) |
| Con | 384.25±26.13 | 1.89±0.12 | 73.63±11.78 | 73.26±18.64 |
| STC | 177.38±14.34a | 0.54±0.23a | 40.23±6.24a | 25.78±8.71a |
| EA | 215.43±20.82bc | 1.14±0.32bc | 58.32±9.72bc | 49.56±9.28bc |
| LMT | 236.89±21.25bc | 1.23±0.35bc | 60.62±8.75bc | 52.69±14.25bc |
| EA+LMT | 268.39±18.26b | 1.31±0.38b | 64.75±14.54b | 56.84±15.48b |
大鼠排便情况的统计学结果显示(表2), 与Con组比较, STC组大鼠24 h排便粒数和粪便含水率均显著降低; 此外, 小肠碳末推进率显著减慢. 与STC组相比, 电针治疗、六磨汤治疗以及联合治疗均可显著增加大鼠24 h排便粒数和粪便含水率; 同时加快小肠碳末推进率. 此外, 相较于电针或六磨汤单一治疗, 联合治疗的效果更为显著.
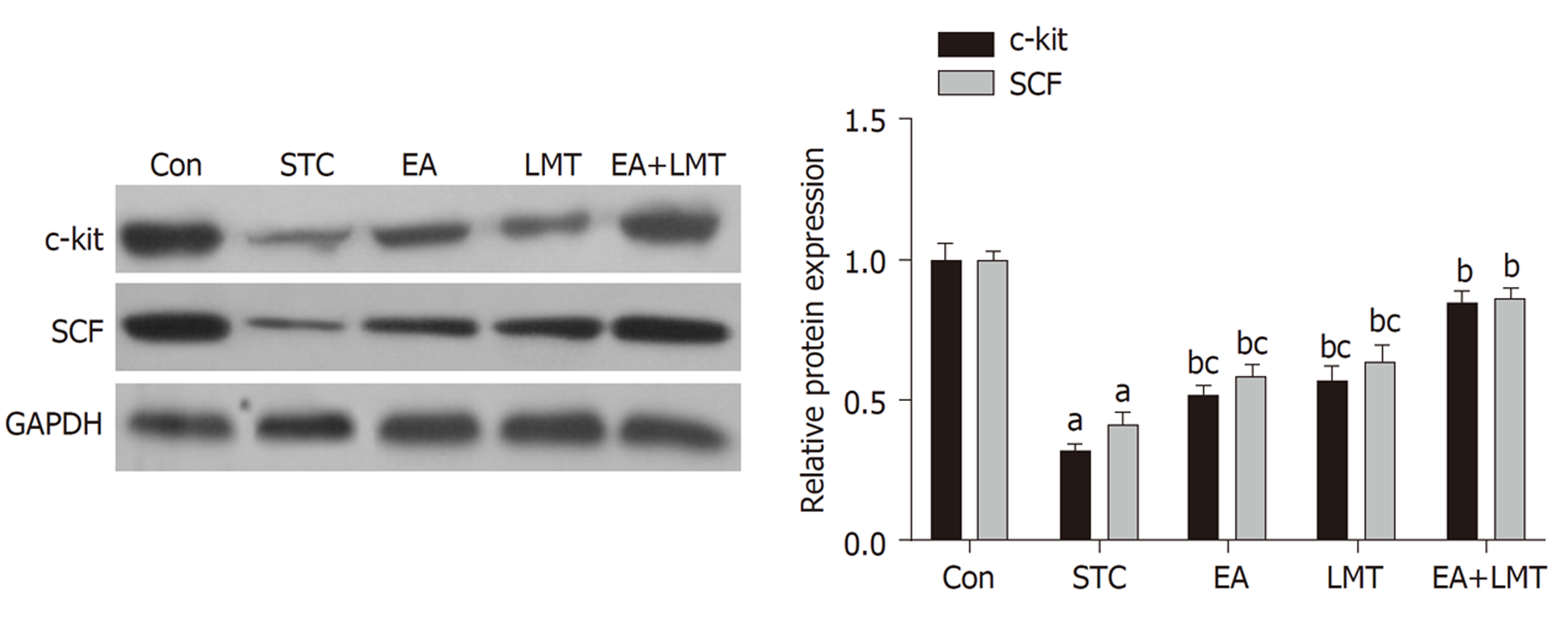
Western blot实验结果显示, 与Con组相比, STC组大鼠结肠组织中c-kit及其配体SCF的蛋白表达水平显著降低; 与STC组比较, 电针治疗、六磨汤治疗以及联合治疗均可显著上调大鼠结肠组织中c-kit及其配体SCF的蛋白表达水平. 相较于EA和LMT组, EA+LMT组大鼠结肠组织中c-kit和SCF的蛋白表达水平显著升高(图1).
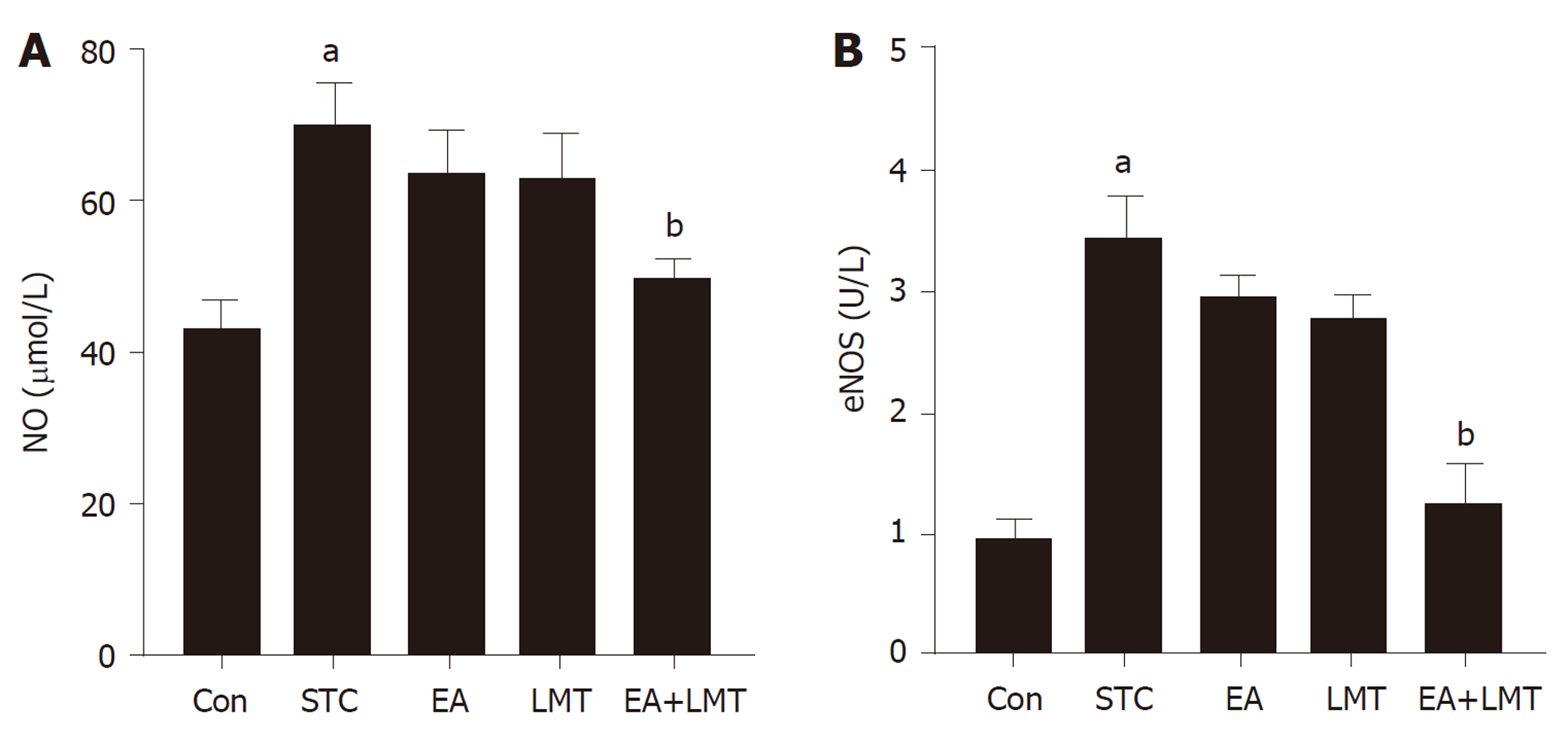
ELISA检测结果(图2)显示, 与Con组相比, STC组大鼠血清中NO和eNOS的含量显著增加(P<0.01); 与STC组比较, EA和LMT组大鼠血清中NO和eNOS水平未出现显著变化, 而EA+LMT组大鼠血清中NO和eNOS水平显著降低.
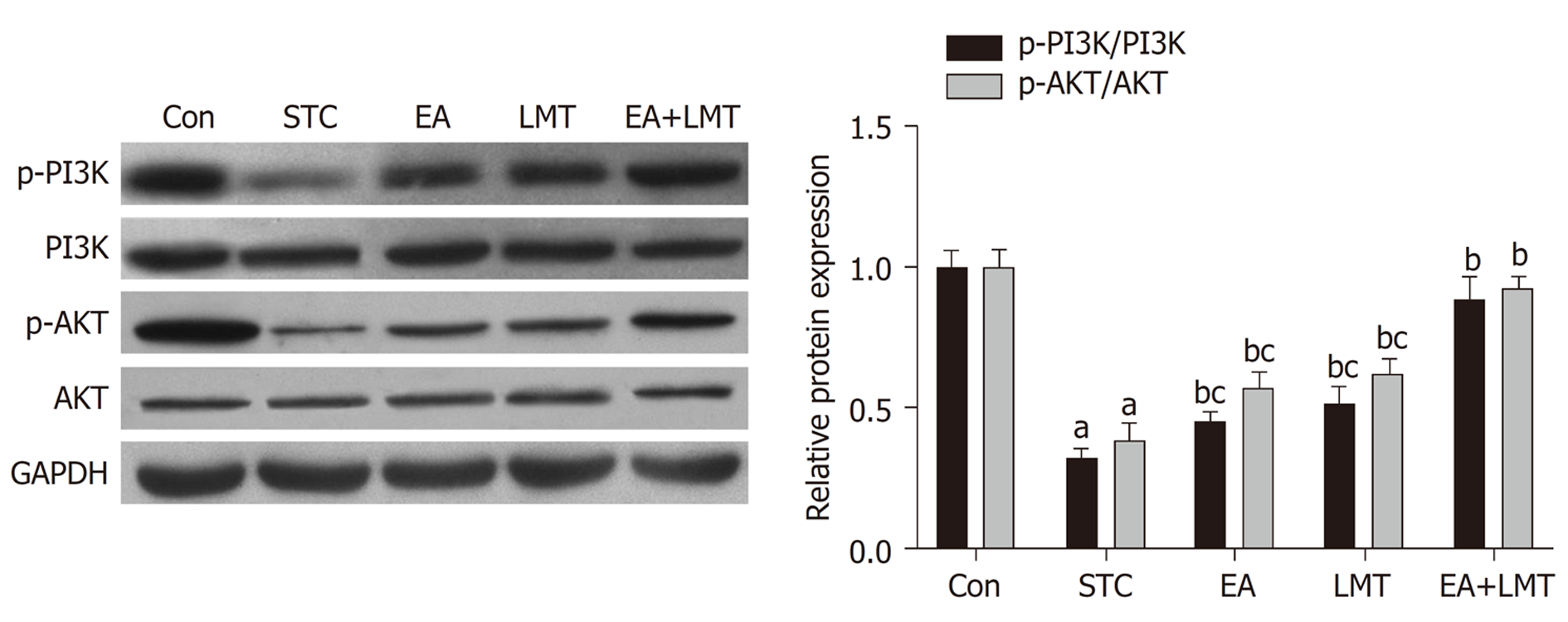
Western blot实验结果显示, 与Con组相比, STC组大鼠结肠组织中p-PI3K/PI3K和p-AKT/AKT的表达水平显著降低; 与STC组比较, 电针治疗、六磨汤治疗以及联合治疗均可显著促进大鼠结肠组织中PI3K和AKT的磷酸化. 相较于EA和LMT组, EA+LMT组大鼠结肠组织中p-PI3K/PI3K和p-AKT/AKT的表达水平显著升高(图3).
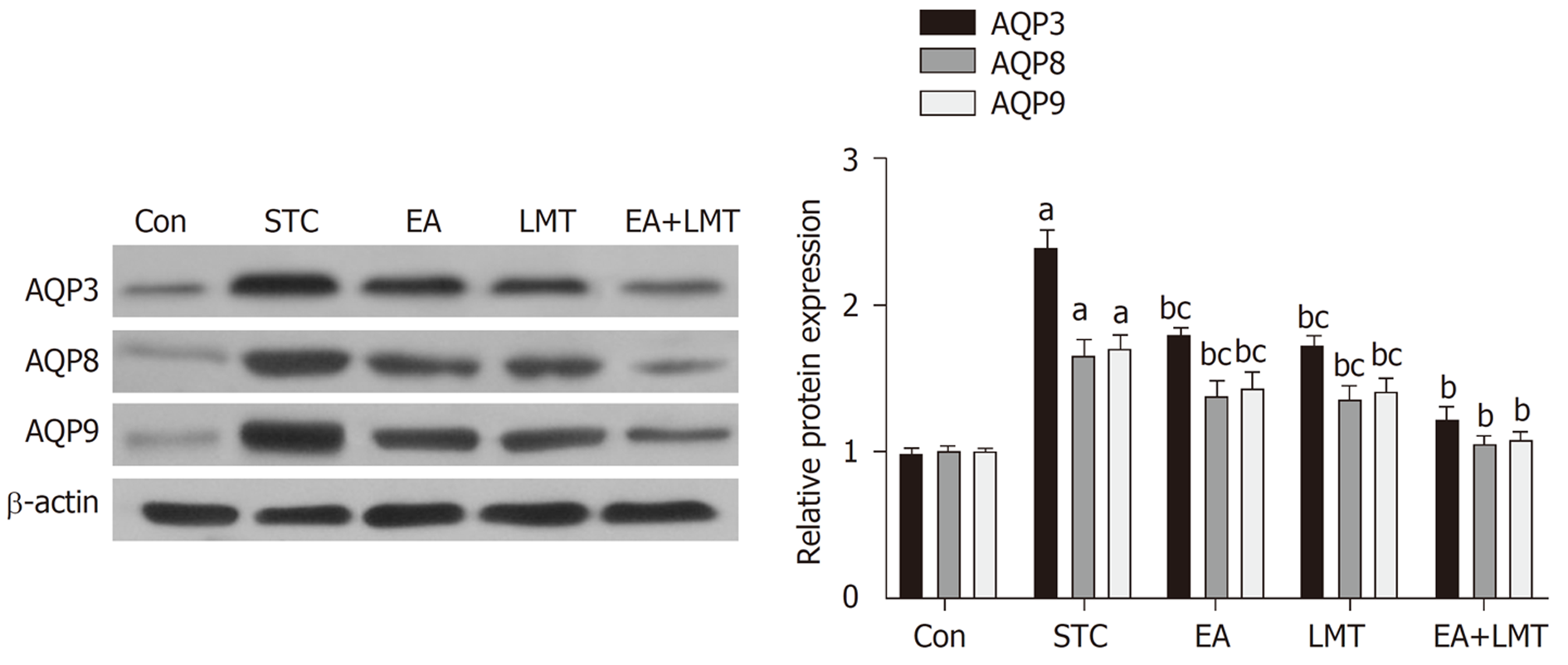
Western blot实验结果显示, 与Con组相比, STC组大鼠结肠组织中AQP3、AQP8和AQP9的蛋白表达水平显著升高; 与STC组比较, 电针治疗、六磨汤治疗以及联合治疗均可显著下调大鼠结肠组织中AQP3、AQP8和AQP9的蛋白表达水平. 相较于EA和LMT组, EA+ LMT组大鼠结肠组织中AQP3、AQP8和AQP9的蛋白表达水平显著降低(图4).
传统中医药在治疗便秘中有着独特的优势和较好的治疗效果, 且近年来, 中医药和针灸疗法在人群中逐渐推广开来, 给STC这种慢性复杂性疾病的治疗提供了更多的治疗手段. 本研究依据前期的实验结果制定了电针取穴联合传统方剂六磨汤的综合调理方案. 根据"和治內腑"的理论, 选取支沟(便秘要穴)、足三里(胃的下合穴)和上巨虚(大肠的下合穴)进行电针治疗. 六磨汤则是出自《世医得效方》治疗便秘的传统方剂, 主要由大黄、木香、乌药、沉香、枳壳和槟榔组方, 起到理气导滞的功效. 研究结果发现, 电针、六磨汤以及电针联合六磨汤治疗均可以改善STC大鼠的精神状态, 还可增加其24 h排便粒数和粪便含水率, 同时加快小肠碳末推进率. 相较于电针或六磨汤单一治疗组, 电针联合六磨汤治疗对于改善大鼠排便情况具有更好的效果. 这一结果提示, 电针与六磨汤可缓解STC, 且两者具有协同作用.
STC的病因复杂, 目前对其发病机制的研究主要集中于肠道神经系统(enteric nervous system, ENS)及神经递质异常、胃肠运动的起搏细胞Cajal间质细胞(interstitial cells of Cajal, ICC)数量和结构的改变、胃肠激素水平异常、肠道菌群失调以及精神心理因素等[4,10-12]. 其中, ICC是位于胃肠道环形肌层和纵行肌层之间的一群间质细胞, 可调节胃肠道平滑肌的运动[4]. Wang等[13]的研究表明, STC便秘患者的结肠ICC密度显著降低, 且基膜消融, 突起间连接杂乱, 不能形成完整的网络. C-kit则是ICC膜上特异性表达的一种酪氨酸激酶受体; 可通过与配体SCF的结合进一步启动下游信号通路, 调控ICC的生长发育并维持其表型[14]. 本研究发现, 电针及六磨汤治疗可显著上调STC大鼠结肠组织中c-kit及其配体SCF的蛋白表达水平, 且两者对于c-kit和SCF表达的调控具有协同作用. 结果表明, 电针联合六磨汤缓解STC可能与调控ICC的生长发育相关.
此外, STC与ENS和神经递质的失调具有密切的关系. NO是ENS中一种主要的抑制性递质, 可通过减少肠道平滑肌细胞内的Ca2+浓度抑制细胞收缩, 减弱肠道蠕动[15]. 而eNOS则是合成内源性NO的主要限速酶, 研究表明, 通过下调NOS抑制NO的产生是缓解便秘的可行途径之一[16]. 本研究发现, 电针联合六磨汤治疗可显著降低STC大鼠血清中NO和eNOS水平. 但电针或六磨汤单一治疗对STC大鼠血清中的NO和eNOS水平影响并不显著, 可能是由于样本量小的缘故. 在调控eNOS合成的上游酶系中, PI3K/AKT信号通路是机体中研究较多, 作用较明确的信号通路之一, 它可广泛参与调控细胞的增殖、凋亡、代谢以及分化等病理生理过程[17,18]. 故而本研究进一步检测了电针联合六磨汤治疗对PI3K/AKT信号通路的影响, 结果显示, 电针及六磨汤可协同促进STC大鼠结肠组织中PI3K和AKT的磷酸化.
众所周知, 结肠中水液代谢异常也可导致粪便干结, 排出困难. 水通道蛋白(AQPs)是细胞膜上的一种跨膜转运蛋白, 主要负责介导水分子的跨膜转运, 其中在哺乳动物的消化系统中存在AQP1、AQP3、AQP4、AQP8、AQP9、AQP10等9种AQPs的表达[19]. 越来越多的研究也证实结肠中AQPs的异常表达与STC的发生密切相关[20,21]. 本研究发现, 电针及六磨汤可协同降低STC大鼠结肠组织中AQP3、AQP8和AQP9的蛋白表达水平. 结果提示, 该电针联合六磨汤治疗方案可能通过减少水通道蛋白的表达, 抑制结肠中水分的重吸收, 增加粪便含水量, 从而改善便秘症状.
综上, 电针联合六磨汤可显著改善STC大鼠的症状. 且, 这种治疗作用主要体现在: 促进小肠推进, 调节便秘大鼠的小肠传输功能; 上调SCF/c-kit信号通路促进ICC数量, 影响结肠的慢波电位, 增加肠道动力; 通过PI3K/AKT信号通路抑制NOS合成NO, 促进胃肠蠕动; 抑制水通道蛋白的表达, 调节水液代谢, 增加粪便的含水量.
随着人口老龄化进程的加快以及饮食结构的改变, 慢传输型便秘(slow transit constipation, STC)的发病率也呈增加趋势. 但, 目前常用的STC治疗策略的疗效差强人意, 且存在明显的不良反应.
中医综合疗法对STC的治疗取得了一定的疗效, 但尚未形成系统治疗方案.
通过建立STC大鼠模型, 探讨电针联合六磨汤对STC的疗效和机制.
将大鼠分为对照组, 模型组, 电针治疗组, 六磨汤治疗组和电针+六磨汤联合治疗组. 观察大鼠的一般行为和排便情况. 收集大鼠的血液样本和结肠组织, 用于后续的ELISA检测和Western blot分析.
电针和六磨汤在改善STC大鼠的症状方面具有协同治疗作用. 机制研究显示, 电针和六磨汤能协同上调结肠组织中SCF、c-kit、p-PI3K和p-AKT的蛋白表达, 下调AQP3、AQP8和AQP9的蛋白表达.
电针联合六磨汤联合治疗方案可通过调节水液代谢、增加胃肠动力以及促进胃肠蠕动来改善STC大鼠的症状.
电针联合六磨汤联合治疗方案是潜在的且有前景的用于STC治疗的方案.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B, B
C级 (良好): C
D级 (一般): 0
E级 (差): 0
科学编辑: 刘继红 制作编辑:张砚梁
| 1. | Sailer M. [Slow Transit Constipation]. Zentralbl Chir. 2019;144:179-189. [PubMed] [DOI] |
| 2. | Camilleri M, Ford AC, Mawe GM, Dinning PG, Rao SS, Chey WD, Simrén M, Lembo A, Young-Fadok TM, Chang L. Chronic constipation. Nat Rev Dis Primers. 2017;3:17095. [PubMed] [DOI] |
| 4. | Sharma A, Rao S. Constipation: Pathophysiology and Current Therapeutic Approaches. Handb Exp Pharmacol. 2017;239:59-74. [PubMed] [DOI] |
| 9. | Sun Y, Yan C, Jin S, Shi C, Zhao J, Li G. Curative Effect and Mechanism of Guiren Runchang Granules on Morphine-Induced Slow Transit Constipation in Mice. Evid Based Complement Alternat Med. 2020;2020:5493192. [PubMed] [DOI] |
| 10. | Frieling T, Kreysel C, Blank M, Müller D, Melchior I, Euler P, Kuhlbusch-Zicklam R, Haarmeier T, Schemann M. Autoimmune encephalitis and gastrointestinal dysmotility: achalasia, gastroparesis, and slow transit constipation. Z Gastroenterol. 2020;58:975-981. [PubMed] [DOI] |
| 11. | Knowles CH, Farrugia G. Gastrointestinal neuromuscular pathology in chronic constipation. B. est Pract Res Clin Gastroenterol. 2011;25:43-57. [PubMed] [DOI] |
| 12. | Yılmaz TU, Taş Hİ, Uçar E, Cerit C, Çelebi A, Güler SA, Utkan Z. Relationship between functional constipation and anal-retentive behavior features. Turk J Surg. 2019;35:165-170. [PubMed] [DOI] |
| 13. | Wang YB, Ling J, Zhang WZ, Li G, Qiu W, Zheng JH, Zhao XH. Effect of bisacodyl on rats with slow transit constipation. Braz J Med Biol Res. 2018;51:e7372. [PubMed] [DOI] |
| 14. | Jiang F, Zhou JY, Wu J, Tian F, Zhu XX, Zhu CL, Yang BL, Chen YG. Yangyin Runchang Decoction Improves Intestinal Motility in Mice with Atropine/Diphenoxylate-Induced Slow-Transit Constipation. Evid Based Complement Alternat Med. 2017;2017:4249016. [PubMed] [DOI] |
| 15. | Groneberg D, Voussen B, Friebe A. Integrative Control of Gastrointestinal Motility by Nitric Oxide. Curr Med Chem. 2016;23:2715-2735. [PubMed] [DOI] |
| 16. | Zhu F, Xu S, Zhang Y, Chen F, Ji J, Xie G. Total Glucosides of Paeony Promote Intestinal Motility in Slow Transit Constipation Rats through Amelioration of Interstitial Cells of Cajal. PLoS One. 2016;11:e0160398. [PubMed] [DOI] |
| 17. | Villegas SN, Gombos R, García-López L, Gutiérrez-Pérez I, García-Castillo J, Vallejo DM, Da Ros VG, Ballesta-Illán E, Mihály J, Dominguez M. PI3K/Akt Cooperates with Oncogenic Notch by Inducing Nitric Oxide-Dependent Inflammation. Cell Rep. 2018;22:2541-2549. [PubMed] [DOI] |
| 18. | Gong AG, Lau KM, Zhang LM, Lin HQ, Dong TT, Tsim KW. Danggui Buxue Tang, Chinese Herbal Decoction Containing Astragali Radix and Angelicae Sinensis Radix, Induces Production of Nitric Oxide in Endothelial Cells: Signaling Mediated by Phosphorylation of Endothelial Nitric Oxide Synthase. Planta Med. 2016;82:418-423. [PubMed] [DOI] |
| 19. | Li C, Wang W. Molecular Biology of Aquaporins. Adv Exp Med Biol. 2017;969:1-34. [PubMed] [DOI] |
| 20. | Zhan Y, Tang X, Xu H, Tang S. Maren Pills Improve Constipation via Regulating AQP3 and NF-κB Signaling Pathway in Slow Transit Constipation In Vitro and In Vivo. Evid Based Complement Alternat Med. 2020;2020:9837384. [PubMed] [DOI] |
| 21. | Sun LL, Jiang HB, Liu BY, Li WD, Du AL, Luo XQ, Li XQ. Effects of rhein on intestinal transmission, colonic electromyography and expression of aquaporin-3 by colonic epithelium cells in constipated mice. Int J Clin Exp Pathol. 2018;11:614-623. [PubMed] |