修回日期: 2020-03-29
接受日期: 2020-04-02
在线出版日期: 2020-05-08
免疫组库(immune repertoire, IR)是指在某一时间, 某个个体的循环系统内所有功能多样性T细胞和B细胞的总和. IR测序是以T淋巴细胞及B淋巴细胞为研究对象, 应用多重聚合酶链式反应或5'RACE技术扩增决定T细胞受体或B细胞受体多样性的互补决定区, 结合高通量测序技术及数据分析, 从而评估免疫系统的多样性, 深入研究IR与疾病的关系. 近年来, IR在肿瘤的生物标记物, 治疗靶点, 疗效监测及预后分析中研究广泛, 本文就IR在消化系统肿瘤的研究进展进行综述.
核心提要: 免疫组库(immune repertoire, IR)是指在某一时间, 某个个体的循环系统内所有功能多样性T细胞和B细胞的总和. 本文就近年来IR在消化系统肿瘤中的生物标记物, 治疗靶点, 疗效监测及预后分析研究进行综述, 并对其研究前景进行展望.
引文著录: 胡海涛, 罗礼华, 田艳涛. 免疫组库技术在消化系统肿瘤中的研究进展. 世界华人消化杂志 2020; 28(9): 335-340
Revised: March 29, 2020
Accepted: April 2, 2020
Published online: May 8, 2020
Immune repertoire refers to the sum of T cells and B cells with functional diversity in the circulatory system of one individual at any given time. Immune repertoire sequencing aims to study T and B lymphocytes, evaluate the diversity of the immune system, and dig deeper into the relationship between immune repertoire and diseases, using multiple polymerase chain reaction or rapid amplification of 5' cDNA ends to amplify the complementary determining regions that determine the diversity of B cell receptors or T cell receptors as well as high-throughput sequencing and data analysis. Recently, immune repertoire has been widely studied in the identification of biomarkers and therapeutic targets, efficacy monitoring, and prognosis analysis in cancer. This paper reviews the progress in the research of immune repertoire of digestive system tumors.
- Citation: Hu HT, Luo LH, Tian YT. Immune repertoire of digestive system tumors. Shijie Huaren Xiaohua Zazhi 2020; 28(9): 335-340
- URL: https://www.wjgnet.com/1009-3079/full/v28/i9/335.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v28.i9.335
免疫组库(immune repertoire, IR)是指在某一时间, 某个个体的循环系统内所有功能多样性T细胞和B细胞的总和. IR测序(IR sequencing, IR-SEQ)是以T淋巴细胞及B淋巴细胞为研究对象, 应用多重聚合酶链式反应(polymerase chain reaction, PCR)或5'RACE技术扩增决定T细胞受体(T cell receptor, TCR)或B细胞受体(B cell receptor, BCR)多样性的互补决定区(complementary determining regions, CDR), 结合高通量测序技术及数据分析, 从而评估免疫系统的多样性, 深入研究IR与疾病的关系[1]. 目前, IR技术在肿瘤疾病研究, 免疫治疗, 疫苗研发, 感染性疾病及自身免疫性疾病等方面的研究中应用广泛[2]. 本文主要就IR技术在消化系统肿瘤的研究进展进行阐述.
T淋巴细胞和B淋巴细胞主要通过TCR和BCR的可变区对不同抗原而产生特异的免疫应答反应, TCR的编码链包括α/β及γ/δ, 而外周血95%的TCR是由α和β两条链构成[3]. 其中α链由胚系基因TRAV、TRAJ、TRAC重排组成; β链由TRBV、TRBD、TRBJ、TRBC重排组成. 在V(D)J基因重排过程中, V-J(或V-D和D-J)连接区随机发生碱基的插入或删除, 而上述区域被认为决定了TCR和抗原表位的识别, 因此也被称为CDR3. BCR包含了两条重链(H)和两条轻链(L). 重链包含了一个可变区(VH)和三个恒定区(CH1/CH2/CH3), 轻链则包含了一个可变区(VL)和一个恒定区(CL), 其中重链可变区CDR3由V、D、J区重排形成(图1), 呈现出丰富的多样性, 决定了BCR的特异性[4,5].
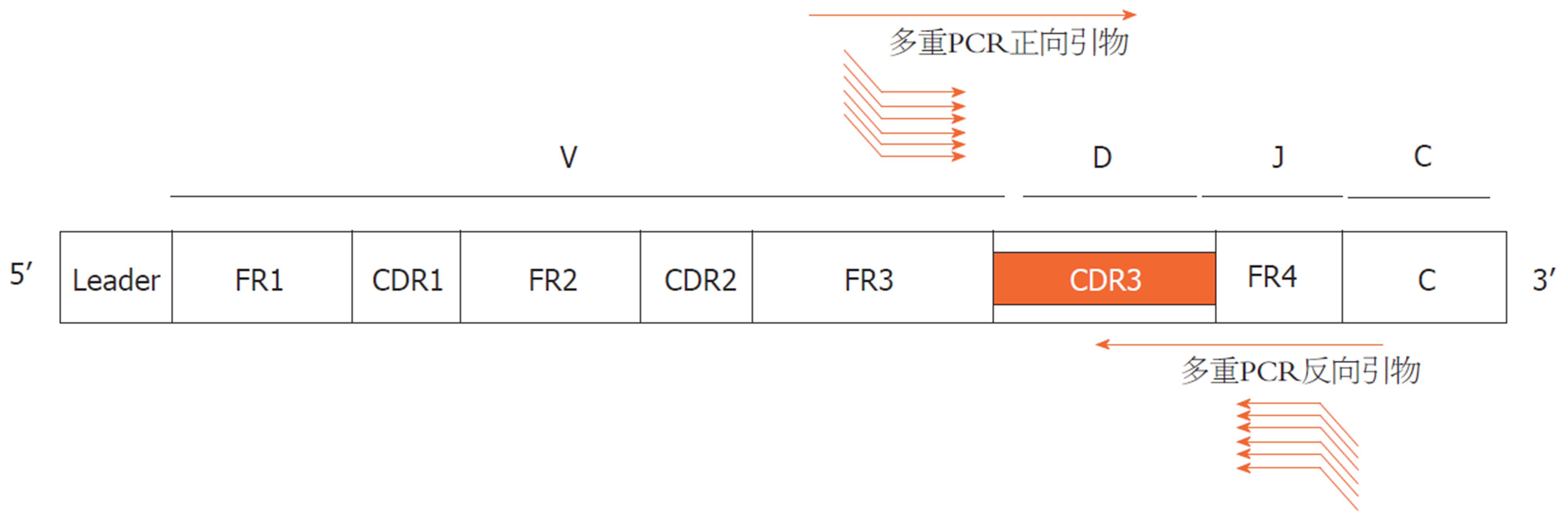
随着高通量测序技术的发展, 使得我们得以全面的分析研究免疫细胞的遗传信息, 可以对TCR或者BCR的进行深度测序来发掘IR的巨大多样性. IR-SEQ中对样本的扩增主要有多重PCR及5'RACE法. 多重PCR是在一个反应体系中, 加入多种覆盖不同长度靶序列的PCR引物, 同时扩增同一基因的多个片段或多个相似序列, 高效率的生产靶序列, 从而进行高通量分析(图2). 但这一方法也存在缺陷, 由于引物固定, 新的V基因突变较难检测; 同时由于扩增偏向性, 某些基因扩增多于其他基因, 产物的相对丰度可能不会正确体现.cDNA末端快速扩增技术(rapid amplification of cDNA ends, RACE)基于逆转录PCR, 从样本中快速扩增cDNA的5′端及3′端[6], 其特点是在仅已知单侧序列可供设计特异性引物时, 利用RACE技术仍能实现扩增.
下一代测序平台(next-generation sequencing, NGS) 现被广泛用于IR-SEQ中[7]. 现主要有两种高通量测序技术: Illumina和Roche 454. Illumina其简要原理为: 首先切断DNA序列后再加接头从而制备基因文库, 再通过PCR形成许多簇相同的正向序列, 接着加入带有不同荧光标记的dNTP(含有叠氮基团)以及聚合酶, 使得带荧光标记的dNTP结合到测序链上, 这些核苷酸是可逆终止子, 其3'-OH处被封闭, 从而确保在每一次循环后仅加入一个核苷酸. 激光扫描检测到添加的核苷酸后, 化学去除荧光阻断标记, 使下一个测序周期开始. 最后统计每一周期收集到的荧光信号结果, 即可取得模板DNA片段的序列信息. Roche 454主要步骤为三步: 首先, 将DNA切割并在两端连接衔接子, 然后将这些片段分别附着到带有互补序列的微磁珠上, 通过PCR进行扩增, 最后将表面带有大量DNA增幅产物的微磁珠置入微孔盘中, 每种dNTP分别添加, 掺入每个核苷酸后, 它将释放出焦磷酸盐, 该焦磷酸盐最终将通过荧光素酶产生光, 光强度与核苷酸的数量成正比, 因此可透过光感测器测得信号从而实现测序. Illumina与Roche 454相比, 其产出较大, 一次Illumina运行可产生多达400千兆碱基的序列, 但另一方面, Illumina平台提供的读取长度约200 bp, 而Roche 454测序能提供更长的读取长度范围, 约400 bp[8].
针对肝癌的流行病学调查显示, 在北美和一些欧洲地区, 肝细胞癌的发病率和死亡率一直在上升, 而在亚洲地区肝癌的发病率和死亡率却在下降[9]. 但在中国, 目前肝癌的死亡率在所有癌症中位列第三, 而在男性群体中, 其发病率位列第四[10]. 目前多个研究组针对肝癌潜在的生物标记物, 治疗靶点, 预后预测等方面进行了研究. Zheng等[11]采集了6例肝癌患者的外周血, 肿瘤组织及瘤旁组织, 对其中分离得到的5063个单个T淋巴细胞TCR进行了深度测序, 根据分子及功能特异性识别11个T细胞亚群, 针对亚群之间的联系及每个亚群的基因表达进行研究, 发现其中耗竭CD8+T细胞及Treg细胞优先富集, 并对特异表达的基因进行了鉴定. 这一研究在单细胞水平上描绘了肝癌微环境的免疫图谱, 提供了肝癌治疗的潜在基因靶点.
肿瘤浸润淋巴细胞(tumor infiltrating lymphocytes, TILs)常见于肿瘤中, 提示肿瘤可在机体内触发免疫反应. 这种肿瘤免疫原性是由肿瘤抗原介导的, 可将肿瘤与健康细胞区分开来, 从而提供免疫刺激[12]. 一项荟萃分析提示, CD3+及CD8+肿瘤浸润淋巴细胞对肿瘤患者预后有正向影响[13]. 近期一项研究分析了TCR IR预测乙肝相关肝细胞癌患者预后[14]. 这项研究分析了23例肝细胞癌患者的肿瘤及瘤旁组织TIL的TCR库, 将肿瘤组织与瘤旁组织的TCR库的重叠性与TNM分期结合进行预后评分, 提示肿瘤组织与瘤旁组织TCR库差异越小, 患者无进展生存期越长(P = 0.006). 此外, 针对HBV相关肝癌, 一些研究发现在不同的临床分期的乙肝患者中, TCRBV11、BV12和BV13.1的出现频率高于TCRBV基因家族的其他成员, 并且TRBV偏移的出现频率与HBVDNA载量呈负相关[15,16].
在肝细胞癌的免疫治疗上, 一项研究发现, 利用鼠类AFP158特异性TCR基因, 重定向人T淋巴细胞, 可以特异性杀伤肝细胞癌细胞, 而对正常原代肝细胞没有明显的毒性[17]. 在肿瘤免疫治疗的疗效评价上, 有研究指出, 外周血TCR库的多样性与临床结局相关, 治疗前外周血中TCR谱系的多样性较低的患者, 其临床获益较差[18].
胰腺癌是恶性程度较高的消化系统肿瘤之一, 在美国, 与胰腺癌相关的死亡在所有癌症中位列第4位[19]. 而在我国, 虽然胰腺癌相关的死亡与发病率未排进前5位, 但其年龄标准化死亡率呈上升趋势, 其导致的死亡在癌症相关死亡中的占比在过去十年中增长了9%[10,20]. 有很多研究团队针对胰腺癌免疫治疗的靶点进行了分析研究. 一项研究分析了16例胰腺癌的肿瘤组织及血液样本和8例健康对照的血液样本, 利用多重PCR和Illumina高通量测序分析TCR组库, 发现两个VJ对(TRBV9: TRBJ2-1和TRBV20-1: TRBJ1-6)在胰腺癌患者中具有明显更高的表达水平, 同时发现在胰腺肿瘤组织中低频率CDR3克隆型数量明显更高; 但是, 该研究同时也发现患者与健康对照组之间的TCR库无显着差异[21]. 而在另外一项针对胰腺导管腺癌TIL的研究中, 发现在同一肿瘤组织的不同区域之间的TCR库重叠程度大于与外周血TCR库的重叠程度, 这一方面说明在肿瘤组织内不同区域之间T细胞克隆是同质的, 另一方面提示胰腺癌中的T细胞克隆与外周血中的T细胞克隆可能存在差异[22].
在有关胰腺癌治疗的研究中, 一批免疫治疗的药物的面世为胰腺癌的治疗提供了新的方向, 比如抗肿瘤疫苗[23,24]及伊匹单抗[25]等. 有研究[26]回顾分析了GVAX瘤苗联合放化疗患者的预后, 发现总淋巴计数(total lymphocyte count, TLC)较少的患者与TLC较多的患者相比, 其在总生存率和无病生存率方面均显示预后不佳. Hopkins等[27]进一步分析了TCR库对转移性胰腺癌患者免疫治疗预后的影响, 研究者发现, 与作用于PD-1受体的纳武单抗相比, 作用于CTLA-4的伊匹单抗使患者TCR库多样性在治疗后变化更显著, 尤其是联用GVAX瘤苗的患者. 而在接受伊匹单抗治疗的患者中, 基线TCR库多样性高的患者相比多样性低的患者而言, 其中位生存时间是后者的近两倍(8.66 mo:4.28 mo, P<0.05), 此外, 治疗后TCR库克隆数量扩增也与较好预后相关.
胃癌目前是全世界第五高发的恶性肿瘤, 在癌症相关死亡中位列第三[28]. 目前嵌合抗原受体T细胞免疫疗法被广泛用于多种癌症的治疗当中[29-31]. 在胃癌上, 多项研究指出, 与单纯化疗相比, 联合细胞免疫疗法可以有效改善胃癌患者生存获益, 尤其是晚期胃癌患者[32,33]. 在胃癌的发生和发展过程中, TIL的功能和分布在该过程中起关键作用, 尤其是其针对肿瘤相关抗原的靶向作用. Kuang等[34]分析了41例处于不同病理阶段的胃组织标本, 包括低级别上皮内瘤变, 高级别上皮内瘤变, 早期胃癌及匹配的邻近组织. 研究发现, 在肿瘤形成过程中, 胃病变组织与邻近正常组织之间TCR库组成的相似性逐渐降低; 而在分析鉴定788个与TCR库变异指数(TCR repertoire variation index, TVI)相关的基因后, 研究者发现了与炎症反应相关的11基因模块, 与胃癌患者的整体生存密切相关, 从而揭示了TVI相关基因在胃癌患者预后中的预测作用. Konishi等[35]研究90例胃癌患者的肿瘤和正常组织, 研究发现BCRs/Igs在正常和肿瘤组织中具有不同的序列水平特征, 其组织水平分类的AUC值为0.826, 从而可以通过检查与癌细胞相邻的B细胞的BCR/Ig组库, 来帮助正确识别胃活检中的假阴性以正确诊断胃癌.
结直肠癌是目前世界第三大常见癌症类型, 而在中国是其发病率位列第五, 在发达国家, 由于早期筛查项目, 其病死率呈下降趋势, 而在我国仍呈上升态势[10,36]. 有研究发现结肠癌组织中TIL多样性远比邻近正常粘膜组织多, 提示肿瘤中的免疫反应与相邻粘膜组织中的免疫反应不同[37]. 还有研究发现与健康人群相比, 结直肠癌患者外周血单核细胞中多个TRBV基因频率存在差异[38]. 在一项针对结肠癌T淋巴细胞的研究中, Zhang等[39]对12例结肠癌患者的11138个T细胞进行测序分析, 通过使用STARTRAC系统性定量分析,发现TCR影响肿瘤浸润CD8+记忆T细胞向耗竭性T细胞及效应T细胞的转化. 之前有研究发现, 表现为微卫星不稳定(microsatellite instability, MSI)的结直肠癌患者与微卫星稳定(microsatellite-stable, MSS)患者相比, 对PD-14的免疫检查点抑制剂免疫应答更好, 其预后改善较为显著[40]; 而在这项研究中, 研究者分析比较了MSI和MSS结肠癌患者, 在MSI结肠癌患者中, CXCL13+ TH1-like细胞明显富集, 而在MSS患者中则表现为TH17细胞的富集, 这提示了免疫治疗的潜在效应靶点. 研究者还与之前肝癌[11]和非小细胞肺癌[41]的研究进行对比, 发现了额外的T细胞亚群, 包括Th17(CD4_C08-IL23R), 滤泡辅助T细胞(CD4_C06-CXCR5), 滤泡调节T细胞(CD4_C11-IL10)以及两个额外的CD8+T细胞亚群(CD8_C05-CD6和CD8_C06-CD160), 这为研究不同种类癌症的免疫反应提供了新的研究方向.
随着IR技术的不断发展, 特别是在NGS高通量测序之后, IR在基础及临床研究中应用广泛. 目前IR技术在血液系统肿瘤中的研究及应用较多, 而在消化系统肿瘤中存在着广阔的研究前景, 在生物标记物, 治疗靶点, 疗效监测及预后分析等方面值得进一步研究.
学科分类: 胃肠病学和肝病学
手稿来源地: 北京市
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): 0
D级 (一般): 0
E级 (差): 0
编辑: 王禹乔 电编:刘继红
| 1. | Robins H. Immunosequencing: applications of immune repertoire deep sequencing. Curr Opin Immunol. 2013;25:646-652. [PubMed] [DOI] |
| 2. | Han Y, Li H, Guan Y, Huang J. Immune repertoire: A potential biomarker and therapeutic for hepatocellular carcinoma. Cancer Lett. 2016;379:206-212. [PubMed] [DOI] |
| 3. | Arstila TP, Casrouge A, Baron V, Even J, Kanellopoulos J, Kourilsky P. A direct estimate of the human alphabeta T cell receptor diversity. Science. 1999;286:958-961. [PubMed] [DOI] |
| 6. | Bertioli D. Rapid amplification of cDNA ends. Methods Mol Biol. 1997;67:233-238. [PubMed] [DOI] |
| 7. | Shendure J, Ji H. Next-generation DNA sequencing. Nat Biotechnol. 2008;26:1135-1145. [PubMed] [DOI] |
| 8. | Benichou J, Ben-Hamo R, Louzoun Y, Efroni S. Rep-Seq: uncovering the immunological repertoire through next-generation sequencing. Immunology. 2012;135:183-191. [PubMed] [DOI] |
| 9. | Kulik L, El-Serag HB. Epidemiology and Management of Hepatocellular Carcinoma. Gastroenterology. 2019;156:477-491.e1. [PubMed] [DOI] |
| 10. | Chen W, Zheng R, Baade PD, Zhang S, Zeng H, Bray F, Jemal A, Yu XQ, He J. Cancer statistics in China, 2015. CA Cancer J Clin. 2016;66:115-132. [PubMed] [DOI] |
| 11. | Zheng C, Zheng L, Yoo JK, Guo H, Zhang Y, Guo X, Kang B, Hu R, Huang JY, Zhang Q, Liu Z, Dong M, Hu X, Ouyang W, Peng J, Zhang Z. Landscape of Infiltrating T Cells in Liver Cancer Revealed by Single-Cell Sequencing. Cell. 2017;169:1342-1356.e16. [PubMed] [DOI] |
| 12. | Kristensen VN. The Antigenicity of the Tumor Cell - Context Matters. N Engl J Med. 2017;376:491-493. [PubMed] [DOI] |
| 13. | Gooden MJ, de Bock GH, Leffers N, Daemen T, Nijman HW. The prognostic influence of tumour-infiltrating lymphocytes in cancer: a systematic review with meta-analysis. Br J Cancer. 2011;105:93-103. [PubMed] [DOI] |
| 14. | Lin KR, Deng FW, Jin YB, Chen XP, Pan YM, Cui JH, You ZX, Chen HW, Luo W. T cell receptor repertoire profiling predicts the prognosis of HBV-associated hepatocellular carcinoma. Cancer Med. 2018;7:3755-3762. [PubMed] [DOI] |
| 15. | Yang J, Chen J, Mao H, Yi P, Yan D, He J, Li L. Skewed T-cell receptor beta chain variable gene (TCRBV) usage among different clinical types of patients with chronic HBV infection. FEMS Immunol Med Microbiol. 2012;65:448-455. [PubMed] [DOI] |
| 16. | Yang JZ, Li MW, Wang JG, Lu HF, Yao XS, He JQ, Li LJ. Rapid detection of clonal expansion of T-cell receptor-beta gene in patients with HBV using the real-time PCR with DNA melting curve analysis. Hepatol Res. 2010;40:407-414. [PubMed] [DOI] |
| 17. | Zhu W, Peng Y, Wang L, Hong Y, Jiang X, Li Q, Liu H, Huang L, Wu J, Celis E, Merchen T, Kruse E, He Y. Identification of α-fetoprotein-specific T-cell receptors for hepatocellular carcinoma immunotherapy. Hepatology. 2018;68:574-589. [PubMed] [DOI] |
| 18. | Postow MA, Manuel M, Wong P, Yuan J, Dong Z, Liu C, Perez S, Tanneau I, Noel M, Courtier A, Pasqual N, Wolchok JD. Peripheral T cell receptor diversity is associated with clinical outcomes following ipilimumab treatment in metastatic melanoma. J Immunother Cancer. 2015;3:23. [PubMed] [DOI] |
| 19. | Siegel RL, Miller KD, Jemal A. Cancer statistics, 2019. CA Cancer J Clin. 2019;69:7-34. [PubMed] [DOI] |
| 20. | Feng RM, Zong YN, Cao SM, Xu RH. Current cancer situation in China: good or bad news from the 2018 Global Cancer Statistics? Cancer Commun (Lond). 2019;39:22. [PubMed] [DOI] |
| 21. | Bai X, Zhang Q, Wu S, Zhang X, Wang M, He F, Wei T, Yang J, Lou Y, Cai Z, Liang T. Characteristics of Tumor Infiltrating Lymphocyte and Circulating Lymphocyte Repertoires in Pancreatic Cancer by the Sequencing of T Cell Receptors. Sci Rep. 2015;5:13664. [PubMed] [DOI] |
| 22. | Cui C, Tian X, Wu J, Zhang C, Tan Q, Guan X, Dong B, Zhao M, Lu Z, Hao C. T cell receptor β-chain repertoire analysis of tumor-infiltrating lymphocytes in pancreatic cancer. Cancer Sci. 2019;110:61-71. [PubMed] [DOI] |
| 23. | Bocchia M, Bronte V, Colombo MP, De Vincentiis A, Di Nicola M, Forni G, Lanata L, Lemoli RM, Massaia M, Rondelli D, Zanon P, Tura S. Antitumor vaccination: where we stand. Haematologica. 2000;85:1172-1206. [PubMed] |
| 25. | Le DT, Lutz E, Uram JN, Sugar EA, Onners B, Solt S, Zheng L, Diaz LA, Donehower RC, Jaffee EM, Laheru DA. Evaluation of ipilimumab in combination with allogeneic pancreatic tumor cells transfected with a GM-CSF gene in previously treated pancreatic cancer. J Immunother. 2013;36:382-389. [PubMed] [DOI] |
| 26. | Schueneman AJ, Sugar EA, Uram J, Bigelow E, Herman JM, Edil BH, Jaffee EM, Zheng L, Laheru DA. Low total lymphocyte count is associated with poor survival in patients with resected pancreatic adenocarcinoma receiving a GM-CSF secreting pancreatic tumor vaccine. Ann Surg Oncol. 2013;20 Suppl 3:S725-S730. [PubMed] [DOI] |
| 27. | Hopkins AC, Yarchoan M, Durham JN, Yusko EC, Rytlewski JA, Robins HS, Laheru DA, Le DT, Lutz ER, Jaffee EM. T cell receptor repertoire features associated with survival in immunotherapy-treated pancreatic ductal adenocarcinoma. JCI Insight. 2018;3. [PubMed] [DOI] |
| 28. | Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018;68:394-424. [PubMed] [DOI] |
| 29. | Li D, Li N, Zhang YF, Fu H, Feng M, Schneider D, Su L, Wu X, Zhou J, Mackay S, Kramer J, Duan Z, Yang H, Kolluri A, Hummer AM, Torres MB, Zhu H, Hall MD, Luo X, Chen J, Wang Q, Abate-Daga D, Dropublic B, Hewitt SM, Orentas RJ, Greten TF, Ho M. Persistent Polyfunctional Chimeric Antigen Receptor T Cells That Target Glypican 3 Eliminate Orthotopic Hepatocellular Carcinomas in Mice. Gastroenterology. 2020. [PubMed] [DOI] |
| 30. | Richards RM, Sotillo E, Majzner RG. CAR T Cell Therapy for Neuroblastoma. Front Immunol. 2018;9:2380. [PubMed] [DOI] |
| 31. | Wang Z, Wu Z, Liu Y, Han W. New development in CAR-T cell therapy. J Hematol Oncol. 2017;10:53. [PubMed] [DOI] |
| 32. | Cui J, Li L, Wang C, Jin H, Yao C, Wang Y, Li D, Tian H, Niu C, Wang G, Han W, Xu J, Chen J, Li W. Combined cellular immunotherapy and chemotherapy improves clinical outcome in patients with gastric carcinoma. Cytotherapy. 2015;17:979-988. [PubMed] [DOI] |
| 33. | Kono K, Takahashi A, Ichihara F, Amemiya H, Iizuka H, Fujii H, Sekikawa T, Matsumoto Y. Prognostic significance of adoptive immunotherapy with tumor-associated lymphocytes in patients with advanced gastric cancer: a randomized trial. Clin Cancer Res. 2002;8:1767-1771. [PubMed] |
| 34. | Kuang M, Cheng J, Zhang C, Feng L, Xu X, Zhang Y, Zu M, Cui J, Yu H, Zhang K, Yang A, Cheng S. A novel signature for stratifying the molecular heterogeneity of the tissue-infiltrating T-cell receptor repertoire reflects gastric cancer prognosis. Sci Rep. 2017;7:7762. [PubMed] [DOI] |
| 35. | Konishi H, Komura D, Katoh H, Atsumi S, Koda H, Yamamoto A, Seto Y, Fukayama M, Yamaguchi R, Imoto S, Ishikawa S. Capturing the differences between humoral immunity in the normal and tumor environments from repertoire-seq of B-cell receptors using supervised machine learning. BMC Bioinformatics. 2019;20:267. [PubMed] [DOI] |
| 36. | Siegel RL, Miller KD, Fedewa SA, Ahnen DJ, Meester RGS, Barzi A, Jemal A. Colorectal cancer statistics, 2017. CA Cancer J Clin. 2017;67:177-193. [PubMed] [DOI] |
| 37. | Sherwood AM, Emerson RO, Scherer D, Habermann N, Buck K, Staffa J, Desmarais C, Halama N, Jaeger D, Schirmacher P, Herpel E, Kloor M, Ulrich A, Schneider M, Ulrich CM, Robins H. Tumor-infiltrating lymphocytes in colorectal tumors display a diversity of T cell receptor sequences that differ from the T cells in adjacent mucosal tissue. Cancer Immunol Immunother. 2013;62:1453-1461. [PubMed] [DOI] |
| 38. | Liu X, Cui Y, Zhang Y, Liu Z, Zhang Q, Wu W, Zheng Z, Li S, Zhang Z, Li Y. A comprehensive study of immunology repertoires in both preoperative stage and postoperative stage in patients with colorectal cancer. Mol Genet Genomic Med. 2019;7:e504. [PubMed] [DOI] |
| 39. | Zhang L, Yu X, Zheng L, Zhang Y, Li Y, Fang Q, Gao R, Kang B, Zhang Q, Huang JY, Konno H, Guo X, Ye Y, Gao S, Wang S, Hu X, Ren X, Shen Z, Ouyang W, Zhang Z. Lineage tracking reveals dynamic relationships of T cells in colorectal cancer. Nature. 2018;564:268-272. [PubMed] [DOI] |
| 40. | Le DT, Uram JN, Wang H, Bartlett BR, Kemberling H, Eyring AD, Skora AD, Luber BS, Azad NS, Laheru D, Biedrzycki B, Donehower RC, Zaheer A, Fisher GA, Crocenzi TS, Lee JJ, Duffy SM, Goldberg RM, de la Chapelle A, Koshiji M, Bhaijee F, Huebner T, Hruban RH, Wood LD, Cuka N, Pardoll DM, Papadopoulos N, Kinzler KW, Zhou S, Cornish TC, Taube JM, Anders RA, Eshleman JR, Vogelstein B, Diaz LA. PD-1 Blockade in Tumors with Mismatch-Repair Deficiency. N Engl J Med. 2015;372:2509-2520. [PubMed] [DOI] |