修回日期: 2020-04-10
接受日期: 2020-04-21
在线出版日期: 2020-05-08
随着非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)的深入研究, 近几年来发现与心血管疾病(cardiovascular disease, CVD)密切相关. 现已证明, NAFLD是CVD发生的重要危险因素 , 也是年青人动脉硬化、冠心病、高血压发病的重要机制. 本文就NAFLD对动脉粥样硬化和CVD的影响、发病机制进行综述, 以提高肝病和CVD医师的认识水平, 为做好防治提供资源.
核心提要: 随着对非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)研究的全面开展, 众多证据表明肝外并发病多于肝病的并发病, 因此提出了心-肝轴和心-脑轴的概念, 引起了肝病和心血管疾病(cardiovascular disease, CVD)学者们的广泛重视和兴趣. 现已确定NAFLD时心血管不良事件主要包括冠状动脉疾病、高血压、亚临床动脉粥样硬化、心脏结构改变(左心室肥厚、心外膜脂肪厚度增加)、瓣膜钙化、舒张功能障碍和心律失常, 最终导致心梗、心衰、脑卒中等严重并发症发生. 本文针对NAFLD与CVD的相关性、发病机制作了全面综述, 强调需进一步明确发病机制, 提出新的、疗效确切的防治策略是今后几年研究的中心环节.
引文著录: 池肇春. 非酒精性脂肪性肝病与心血管疾病相关性研究进展与现状. 世界华人消化杂志 2020; 28(9): 313-329
Revised: April 10, 2020
Accepted: April 21, 2020
Published online: May 8, 2020
With the in-depth study of non-alcoholic fatty liver disease (NAFLD), it has been found in recent years that NAFLD is closely related to cardiovascular disease (CVD). It has been proved that NAFLD is not only an important risk factor for CVD, but it is also an important mechanism of atherosclerosis, coronary heart disease, and hypertension in young people. This article reviews the recent progress in the understanding of the relationship between NAFLD and CVD, with an aim to improve the knowledge of CVD physicians on liver disease and provide reference for prevention and treatment of these conditions.
- Citation: Chi ZC. Relationship between non-alcoholic fatty liver disease and cardiovascular disease. Shijie Huaren Xiaohua Zazhi 2020; 28(9): 313-329
- URL: https://www.wjgnet.com/1009-3079/full/v28/i9/313.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v28.i9.313
据世界卫生组织统计, 心血管疾病(cardiovascular disease, CVD)仍然是世界范围内死亡的主要原因, 每年约有1800万人死亡. 然而, 在过去的几十年里, 全球范围内的代谢性疾病, 如2型糖尿病、肥胖症和非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD), 也被认为是CVD的常见危险因素. NAFLD约占慢性肝病的75%, 已成为困扰世界的主要疾病之一, 同时也是世界各国最常见的肝病病因. 目前, NAFLD最常见的死亡原因仍然是CVD. 通过多种机制, 包括低级别的全身炎症反应, 氧化应激, 脂肪细胞因子, 内质网应激, 脂毒性和微生物群失调, 也可能受其他因素, 如遗传和表观遗传变异的影响NAFLD与CVD. 尽管有这些证据, 但NAFLD如何导致CVD的确切机制还没有完全阐明, 有很多方面还不清楚. 此外, 目前的文献支持并有越来越多的证据表明NAFLD与一些心血管(cardiovascular, CV)不良事件相关, 包括冠状动脉疾病(coronary artery disease, CAD)、亚临床动脉粥样硬化风险增加、结构改变主要是左心室肥厚、心外膜脂肪厚度(epicardial fat thickness, EFT)增加, 瓣膜钙化包括主动脉瓣硬化和二尖瓣环钙化, 功能性心脏改变主要是舒张功能障碍, 此外还有房颤、室性心律失常等心律失常和房室传导阻滞、束支传导阻滞等传导缺陷. 因此, 对NAFLD患者应进行相应的评估和管理, 以防止进一步的并发症发生. 可能的治疗方法包括非药理学策略, 包括生活方式改变、药理学治疗以及外科治疗[1].
一些研究表明[2,3]NAFLD与CVD之间存在着直接的联系, 提出肝-心轴概念, NALFD应被视为一个重要的独立危险因素, 而传统的CV危险因素和亚临床和临床CVD与代谢综合征(metabolic syndrome, MetS)则不相关.
目前的文献表明, NAFLD与CV并发症如CAD、亚临床动脉粥样硬化、心律失常以及传导、结构和功能改变有关. 与NAFLD相关的额外CVD可进一步增加CV发病率和死亡率[4]. 与脂肪肝相关的致病因素是多因素的. 其中包括炎症、脂肪因子、肠道菌群失调、遗传学、氧化应激以及心理应激, 如焦虑和抑郁, 这些都是CVD的标志物. 这表明需要进一步的研究和采取措施, 以减轻NAFLD造成的负担和不良影响[5,6].
一些研究评估了脂肪肝(fatty liver disease, FLD)与CAD之间的关联, 大多数研究结果显示FLD的存在显著增加了冠状动脉粥样硬化的风险. 冠状动脉钙化(coronary artery calcium, CAC)是不良CV事件的独立标志, 导致血管顺应性降低、心肌灌注受损, 导致冠心病(coronary heart disease, CHD)发病风险增加, 以及血管运动异常反应和长期死亡率增加[7]. 当前文献中大多数已发表的研究使用多探测器计算机断层扫描和计算CAC评分来评估CHD风险, 这是一种评估无症状的中等CV风险受试者的合适方法. 另一方面, 脂肪肝主要通过超声或磁共振成像-质子密度脂肪分数(proton density fat fraction, PDFF)进行诊断.
Chang等[7]最近进行了一项横断面研究, 评估了105328名受试者的酒精和非酒精病因的CAC评分与脂肪性肝病的相关性. 研究表明, 酒精性肝病和NAFLD与CAC评分升高有关. 此外, 他们还发现, 即使在控制了传统的CV危险因素、MetS和C-反应蛋白(C-reactive protein, CRP)后, 胰岛素抵抗(insulin resistance, IR)指数也被证明是一个稳健和独立的CAC评分预测因子. 此外, Kim等[8]对来自Rancho Bernardo研究预期人群的250名受试者进行了横断面研究, 主要涉及南加州郊区的白人成年人. 表明尽管NAFLD与CAC密切相关, 但它并不是绝经后妇女冠状动脉粥样硬化的独立因素.
Wolff等[9]评估了基于人群的Rotterdam研究中的2351名受试者, 并证明肝脂肪的比例增加与EFT (epicardial fat thicknee, 心外膜脂肪厚度)和CAC的增加相关, 独立于传统的CV危险因素. 另一方面, Kim等[10]对2238名患者进行了横断面研究, 报告称尽管CAC与EFT和肝脂肪的增加有关, 但与NAFLD相比, EFT与CAC的关系更为密切.
此外, 一项横断面研究发现, 尽管老年受试者的NAFLD患病率较低, 但他们仍然表现出CAC评分和内脏脂肪组织(visceral adipose tissue, VAT)增加. Lee等[11]研究21335名受试者参加了一个筛选项目, 表明与腹部肥胖相比, NAFLD与CAC的关系更为显著.
另一项Jung等[12]旨在研究1218名受试者肝脂肪和血清丙氨酸转氨酶(alanine aminotransferase, ALT)与CAC的关系的横断面研究. 结果提示同时伴有肝脂肪变性和ALT升高的受试者被发现与较高的CAC评分相关. 有报告称, 在NAFLD患者中, 较高的CAC评分与使用瞬时弹性成像评估的肝硬度值独立相关.
NAFLD患者CAC、高血压、主动脉瓣硬化、舒张功能障碍、动脉粥样硬化斑块和颈动脉内膜中层厚度(carotid intima-media thickness, CIMT)增加的发生率高于非NAFLD患者[13]. 越来越多的研究表明NAFLD与CHD之间存在关系[14]. 据估计, 癌症和CVD是NAFLD患者死亡的主要原因. 51%的轻度和不明显冠状动脉狭窄患者和100%的三支受影响冠状动脉患者中观察到NAFLD. Perera等[15]注意到46.7%的急性冠状动脉综合征患者存在NAFLD. NAFLD患者钙化和非钙化冠状动脉斑块的患病率明显高于健康人, 而与MetS的发病率无关[16]. 再次, 冠状动脉血流储备(coronary flow reserve, CFR)在NAFLD患者比健康受试者显著降低[17].
CIMT与NAFLD、亚临床动脉粥样硬化、心肌梗死和卒中独立相关[18]. CIMT测量和超声斑块负荷可用于筛查无症状个体, 因为它是一种有效且广泛接受的预测CVD的筛查工具.
一项包括27项研究的荟萃分析得出结论[19], 即使调整了年龄、性别、体重指数、吸烟、低密度脂蛋白(low-density lipoprotein, LDL)胆固醇、IR和MetS等传统危险因素, NAFLD仍与亚临床动脉粥样硬化独立相关. 此外, NAFLD患者颈动脉斑块的出现频率更高.
此外, Kim等[20]研究了FLD中动脉粥样硬化疾病与性别差异的关系, 得出结论: 男性FLD、颈动脉斑块的患病率高于女性. Martínez-Alvarado Mdel等[21]提示IR可能是女性代谢异常和亚临床动脉粥样硬化的介质. Li等[22]最近对1007名绝经后妇女进行了一项研究. 据报道, NAFLD与绝经后妇女动脉僵硬风险增高相关, 而与是否存在MetS无关. 最近进行的研究发现[23], NAFLD严重程度和肝功能增加试验显示对动脉粥样硬化严重程度有影响.
NAFLD组织学特征的严重程度也与CIMT升高有关. Bhatia等[24]使用磁共振波谱和肝坏死炎症标记物血清细胞角蛋白-18评估的NAFLD严重程度改善与CIMT进展减少相关.
目前大多数研究报告NAFLD与左室功能和结构改变, 即使在校正了常见的CV代谢危险因素后仍有显著相关性. 在无病态肥胖、高血压和糖尿病的NAFLD患者中, 存在轻度改变的左室几何结构和左室舒张功能障碍的早期特征. 无症状NAFLD患者也发现有亚临床心功能不全, 其因为左室功能不全和左室质量与IR以及随后的预后密切相关. 有报告称肝脂肪的量与舒张功能障碍和IR之间存在强烈的正相关, 这是研究中发现的与NAFLD相关的唯一独立参数[25]. 组织学评价的肝纤维化与超声心动图评价的几个心脏参数有关. Petta等[26]对147例经活检证实的NAFLD患者进行了评估肝纤维化和心脏并发症严重程度的研究. 报道了几种心脏结构的改变, 如舒张后壁厚度、左室质量、相对壁厚、左房容积以及左室舒张功能障碍、射血分数、下侧组织多普勒成像、舒张早期二尖瓣环的速度峰值(E值)和重力血流峰值比率, 由心房收缩引起的舒张早期(E波)至舒张晚期(A波)的峰值流速(E/A比值)均与严重肝纤维化有关. 通过评价冠状动脉微血管循环的完整性. 他们得出结论, 与健康对照组相比, 即使在校正了肥胖、传统CV危险因素和MetS之后NAFLD患者的CFR (coronary flow reserve, 冠状动脉血流储备)仍较低[27].
Mahfouz等[28]最近进行的一项研究. 有人认为NAFLD患者的心房厚度和左房硬度指数的增加可以解释房颤发病率增加的原因.
有几篇文章描述了EFT与NAFLD之间的重要联系. Oğuz等[29]进行横断面研究, 得出结论: NAFLD患者的EFT和骨保护素水平升高, 而使主动脉血流传播速度降低. 另一项研究涉及868名受试者, 来自Baragetti等[30]进行的PLIC研究. 据报道, 肝脂肪变性和EFT与心外斑块的发病率增加有关.
NAFLD与心律失常风险以及相关传导异常的关系最近引起了医学界的兴趣. 多项研究评估了NAFLD与若干心电图表现之间的关系, 并证明房颤风险增加、QTc间期延长、束支和房室传导阻滞. 此外, 糖尿病合并NAFLD患者出现室性心律失常的风险也增加.
最常见的持续性心律失常是房颤, 它是一个主要的健康问题, 因为发病率和死亡率增加. 多项研究评估了NAFLD与房颤之间的关系. 最近的一项荟萃分析评估了9项共364919名受试者的横断面和纵向研究[31], 报告称NAFLD与中老年受试者, 尤其是2型糖尿病患者房颤风险增加相关. 一项横断面研究显示患有NAFLD的老年受试者在调整年龄、性别、收缩压、空腹血糖、GGT、高密度脂蛋白(high-density lipoprotein, HDL)胆固醇、三酰甘油、总胆固醇和白蛋白后仍有显著的房颤患病率. 另一方面, Markus等[32]对3090名受试者进行了一项基于人群的博美尼亚健康研究, 得出结论: 超声诊断的患者血清肝酶中度升高而与非肝脂肪变性患者相比, 前者有较高的房颤患病率. 他们认为, 这种相关性背后的一个可能的致病机制可能是因促炎、促凝血因子水平升高, 以及血清肝酶水平升高相关, 导致心房结构和电生理改变, 从而导致更高的房颤风险发生, Mantovani[33]认为高尿酸血症可能在NAFLD和房颤之间的联系中起着重要作用, 有待进一步研究.
NAFLD加速动脉粥样硬化的发生和发展. 已有研究表明NAFLD与亚临床动脉粥样硬化之间存在关联. 他们中的大多数人证明这种联系独立于MetS和传统CV危险因素.
CAC是动脉粥样硬化负荷的替代指标, 也是CHD风险的独立指标. 一份研究[34]分析了10153名接受腹部超声检查评估脂肪肝和心脏CT CAC评分的职业人群的数据. 脂肪肝与CAC评分>0相关, 与所有MetS特征无关(OR = 1.21; 95%CI: 1.01-1.45). 对505名无糖尿病、无症状、无已知CHD的男性患者的评估显示, 超声诊断的肝脂肪变性与电子束断层扫描量化的CAC呈正相关. 肝脂肪变性患者中CAC的患病率较高(52% vs 37%, P = 0.001).
另一项研究[35]包括2424名年轻人冠状动脉风险发展研究的参与者. 本研究使用CT来量化肝脏脂肪、CAC和腹主动脉钙化(calcification of abdominal aorta, AAC). NAFLD患者CAC(37.9% vs 26.0%, P<0.001)和AAC(65.1% vs 49.9%, P<0.001)的患病率增加. NAFLD与CAC和AAC的关系在人口统计学和健康行为调整后持续存在. 然而, 在调整VAT (visceral adipose tissue, 内脏脂肪组织)后, 这种关联并没有达到统计学意义[35]. 最近的一项研究[36]涉及多民族与动脉粥样硬化相关性的研究, 计3796名参与者的横断面分析. 这项研究表明NAFLD与炎症和CAC的增加有关, 而与传统危险因素、肥胖和MetS无关. 但NAFLD、肥胖和MetS与炎症和CAC分级相关.
超声测量CIMT是亚临床动脉粥样硬化的标志. CIMT是预测未来血管事件的有力指标, 与心肌梗死相比, 它能更好地预测中风风险. 印度人群的横断面研究显示[37], NAFLD患者的平均和最大CIMT高于对照组. NAFLD的存在是调整肥胖、MetS、IR和血脂参数后, 具有较高的平均CIMT和高的CIMT独立预测因子. 另一项病例对照研究[38]将50名从诊所招募的患者与40名匹配的健康志愿者进行对比, 结果显示, 在非酒精性脂肪性肝炎(non-alcoholic steatohepatitis, NASH)患者、单纯性脂肪变性患者和对照组之间, CIMT存在统计学上的显著差异. 调整年龄、性别、稳态模型评估IR评分和MetS后, 各组间的差异具有统计学意义.
一项上海交通大学瑞金医院的研究报告[34], 针对8632名参与者的大规模横断面研究显示, 与未患NAFLD的人相比, NAFLD患者CIMT在统计学上显著升高. Logistic回归分析显示, 与常规危险因素和MetS的存在无关, NAFLD增加了35%的CIMT升高的几率[39]. 更大的荟萃分析包括4项研究[40], 1947名患者, 35.1%的NAFLD患者存在病理性CIMT, 而非NAFLD患者为21.8%(P<0.0001).
心踝血管指数(cardio ankle vascular index, CAVI)表示从主动脉到足踝的整个动脉段的硬度. CAVI反映动脉硬化的进展, 与冠状动脉粥样硬化的严重程度呈正相关. CAVI也预测颈动脉硬化和中风. 在对2954名受试者的横断面分析中, NAFLD与动脉硬化风险增加42%相关. 动脉僵硬的风险随着NAFLD的严重程度而增加. 在校正了包括体重指数、腰围、吸烟状况、糖尿病和高血压在内的其他危险因素后, 这种相关性具有统计学意义[41].
动脉硬度的另一个测量指标是肱踝脉搏波速度(brachial-ankle pulse wave velocity, baPWV). 一项前瞻性研究[42]包括728名无高血压和糖尿病的男性和497名女性. 随访5年. 在研究期间, NAFLD组的baPWV变化明显大于非NAFLD组. 多元回归分析[43]显示NAFLD是baPWV变化的独立且显著的预测因子. 另一项针对中国人群的横断面研究[43]包括1296名接受常规体检的非肥胖、非高血压和非糖尿病青壮年受试者. NAFLD组baPWV水平显著高于对照组(1321 cm/s±158 cm/s, 1244 cm/s±154 cm/s, P<0.001). baPWV升高组NAFLD患病率高于baPWV正常组(29.3% vs 16.9%, P<0.001). 多元线性Logistic回归分析显示NAFLD与baPWV呈正相关且独立相关[43]. 另一项研究还表明[44], 与未患NAFLD的受试者相比, 患有NAFLD的受试者的baPWV高(1665 cm/s±424 cm/s vs 1558 cm/s±430 cm/s, P<0.0001). Logistic回归显示baPWV升高的几率增加了30%, 独立于常规危险因素和MetS的存在[44].
多项流行病学研究表明NAFLD与CVD风险增加有关. NAFLD组动脉粥样硬化性CVD (CHD、缺血性卒中和脑出血)的发生率高于非NAFLD组. 多变量分析表明, NAFLD是CVD的独立预测因子.
一项对80名接受冠状动脉造影的MetS患者进行的前瞻性研究[44]评估了NAFLD与CHD严重程度之间的关系. 冠状动脉造影显示NAFLD患者有更多的血管受累(2.5±0.9 vs 1.0±1.0, P<0.001)和更严重的CAD严重程度评分(Gensini评分, 90.2±40.0 vs 36.4±28.9, P<0.001). 在多元回归分析中, NAFLD是影响CAD严重程度评分的唯一独立因素[44]. 另一项研究[45]调查了355名接受冠状动脉造影的患者的横断面分析, 得出了类似的结论. 单因素分析显示NAFLD的存在对CAD有独立影响(OR = 2.58; P<0.01), 对Gensini评分也有独立影响(OR = 2.02; P<0.05)[45]. Sun等[46]纳入542名计划接受冠状动脉造影的患者. 冠状动脉造影前进行腹部电脑断层扫描(CT)检查NAFLD. Logistic回归分析显示, NAFLD的存在独立地增加了冠状动脉造影显示CHD的风险(OR = 7.585; 95%CI: 4.617-12.461). CHD严重程度的增加, 在NAFLD在患者中更为常见.
Pisto等[47]1991/2009共有988名芬兰参与者参与了调查. 根据肝脏脂肪含量将患者分为三组. 随访期间, 13.5%的非脂肪肝患者、24.2%的中度脂肪肝患者和29.2%的重度脂肪肝患者发生CV事件(P<0.001). 当根据年龄、性别和研究组进行调整时, 严重肝脂肪含量可预测未来CV事件的风险(HR = 1.92; 95%CI: 1.32-2.80). 在进一步调整吸烟、饮酒、LDL胆固醇、体重指数和收缩压后, 风险仍具有统计学意义(HR = 1.74, 95%CI: 1.16-2.63), 但在进一步调整定量胰岛素敏感性检查指数后风险消失.
NAFLD与较高的平均CIMT、最大CIMT和病理CIMT的存在相关[32,33]. CIMT可预测包括中风在内的未来动脉粥样硬化性CVD的风险. 然而, 有一些不确定的数据将NAFLD与中风联系起来. 一项横断面研究[48]研究了急性缺血性卒中与NAFLD生化标志物的相关性. 以ALT升高≥95%作为炎症性NAFLD的生化指标. 在校正年龄、性别、当前吸烟、当前大量饮酒、高血压病史、房颤、LDL胆固醇、血糖和血清肌酐后, ALT升高患者中风的比值比矫正前为3.5(95%CI: 1.7-7.6), 矫正后为3.3(95%CI: 1.3-8.4)[48]. 调整年龄和性别后, NAFLD与缺血性卒中显著相关(OR = 2.15; 95%CI: 1.25-3.71).
综上所述, 大多数研究表明NAFLD与CVD有关. NAFLD影响CVD的多个方面. NAFLD与亚临床动脉粥样硬化和动脉硬化有关. 过去人们普遍认为这种联系是由肥胖、MetS和糖尿病等共同危险因素造成的. 然而, 多项研究已经证明这种联系独立于MetS和传统的CV危险因素. 一项前瞻性研究还表明[42], NAFLD独立且显著地预测了baPWV的变化.
此外, Chung等[41]的研究. 也显示了NAFLD与亚临床动脉粥样硬化之间的关系, 其严重程度依赖于NAFLD. 多变量分析显示, 55岁以下年龄组的NAFLD与动脉僵硬(中重度NAFLD: OR = 1.97, 95%CI: 1.28-3.01, 趋势P = 0.002)之间存在严重依赖关系. 流行病学数据存在直接连接到NAFLD的CAD. 这些研究表明, 与未患NAFLD的受试者相比, 患有NAFLD的受试者CHD的发病率更高, CHD的严重程度更高, 未来CV事件的风险更高, 动脉粥样硬化性CVD增加. 目前的认识是, IR是胰岛素抗脂解作用抵抗的原因, 并与NAFLD内脏和病理异位脂肪堆积相结合, 导致游离脂肪酸(free fatty acid, FFA)的可用性增加. 持续的慢性亚临床炎症、氧化应激增加和内皮功能障碍增加了FFA的可利用性, 从而促进动脉粥样硬化和CV功能不良发生.
最近大量证据表明, NAFLD患者有患CVD的高风险. 更严重的肝病与致命和非致命CV事件的风险增加相关[49]. 尽管许多证据表明NAFLD与CVD密切相关, 通过治疗 NAFLD可减少CVD的发生, 然而其发病机制目前知之甚少.
遗传因素似乎在NAFLD的发展和严重程度中起着关键作用, 在高加索人群中遗传率约为27%. 在拉美裔和非裔美国人中也观察到类似的结果, 尽管不同人群之间存在一些差异(33%的拉美裔和14%的非裔美国人)[50]. patatin样磷脂酶结构域蛋白3(patatin-like phospholipase domain-containing protein 3, PNPLA3)基因的patatin样磷脂酶结构域多态性被认为是NAFLD最相关的遗传危险因素[51]. 有趣的是, 一些证据表明这种基因变异也可能在CV疾病的易感性中起作用. 特别是, 意大利的一项研究表明[52], 在组织学诊断为NAFLD的年轻患者中, PNPLA3-GG多态性与颈动脉斑块和CIMT增厚的患病率高于CC/CG基因型(分别为53% vs 32%, P = 0.02; 62% vs 28%, P<0.001), 但在随访期间, CIMT增厚也有进展. PNPLA3是一种在脂肪细胞和肝细胞中高表达的跨膜水解酶, 参与三酰甘油的代谢, 其遗传变异可能促进动脉粥样硬化斑块的发生和发展. 此外, 其他PNPLA3多态性与内皮细胞的炎症活性增加有关, 特别是rs738409多态性似乎与内皮源性炎症分子(即细胞间黏附分子-1, 又叫做CD54, 属于黏附分子中免疫球蛋白超家族中的成员, 是介导黏附反应重要的一个黏附分子)的异常循环水平有关. 其他基因也与NAFLD的发生有关, 如跨膜6超家族成员2(transmembrane 6 superfamily member 2, TM6SF2)的多态性, TM6SF2是一种编码蛋白质的基因, 其整体功能尚不清楚, 但可能与肝脏脂质代谢有关. 然而, 该基因的一些变异体似乎与对CV系统的不同影响有关[53,54]. 其他的遗传多态性具有优先的有害作用, 例如谷氨酸-L-赖氨酸(TM6SF2基因上的一个异义突变的变异编码)与较高的心肌梗死风险相关[55]. 最后, 一些遗传多态性NAFLD患者对CV疾病的高易感性相关. 编码脂联素或瘦素受体的基因变异与更严重的肝损伤有关, 但也与严重的血脂异常、糖尿病和肥胖有关, 证实NAFLD患者易发生共同的CV代谢并发症[56].
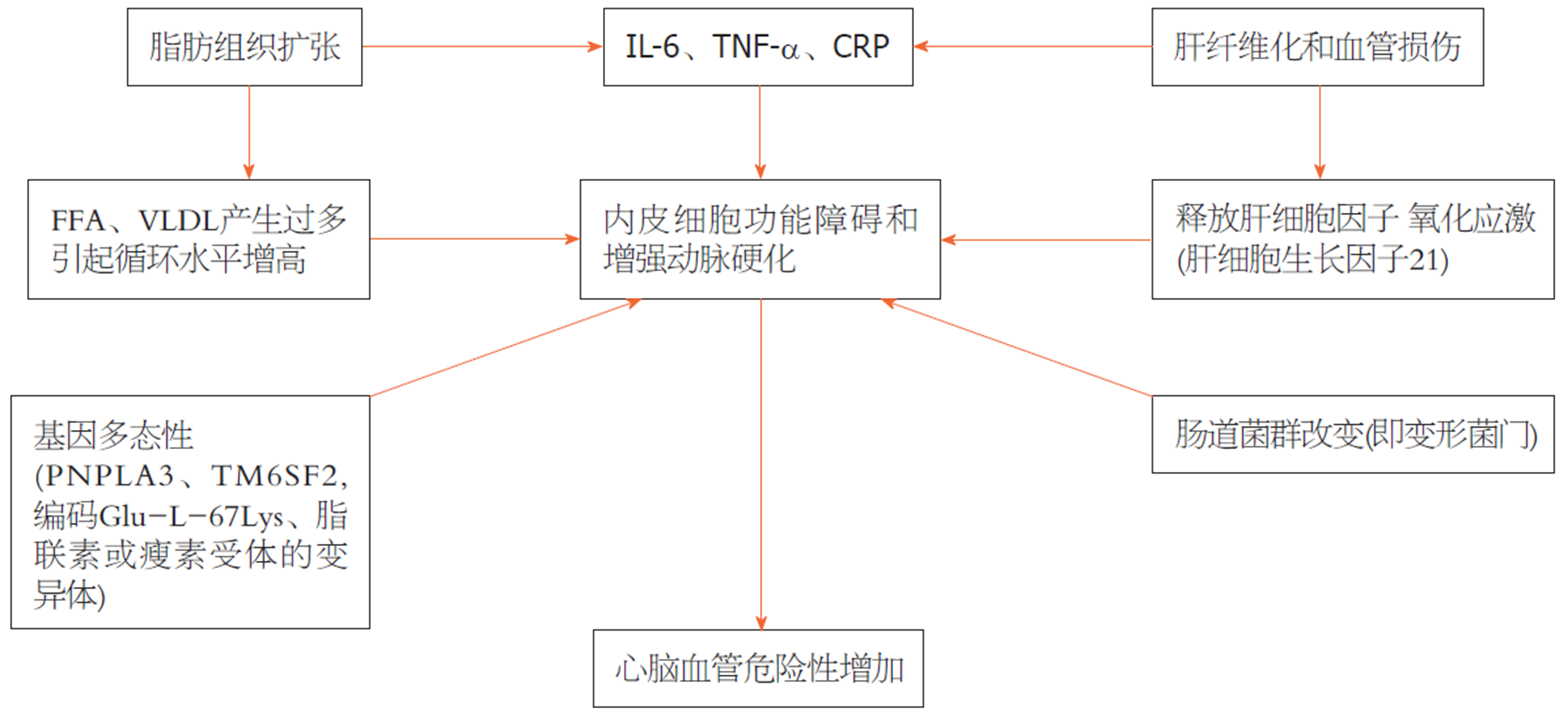
2.1.1 脂肪组织与血脂异常, NAFLD与CVD的联系点: 考虑到MetS、肥胖等代谢性疾病与NAFLD发生的密切关系, 脂肪组织扩张和功能障碍可能是肝脏疾病与CV代谢性并发症最重要的共同点. 事实上, 过量饮食和卡路里摄入通常是MetS、NAFLD发病机制和CV表现的主要决定因素, 导致血清FFA水平升高, 超过脂肪组织的储存能力, 从而导致脂肪团增大、内脏和异位脂肪沉积, 也包括肝脏. 脂肪组织的异常扩张导致脂肪细胞功能障碍, 持续产生脂肪源性细胞因子[白细胞介素(interleukin, IL)-6, 肿瘤坏死因子(tumor necrosis factor, TNF)-α]和CRP. 持续性炎症的存在不仅与IR的发展有关, 还与CVD的直接发病有关[57].
此外, 由于脂肪团增大, 脂肪生成增加, 导致高循环水平的FFA、超低密度脂蛋白(very low-density lipoprotein, VLDL)过多产生, 以及进一步的脂质代谢异常, 从而导致显著的动脉粥样硬化性血脂异常. NAFLD患者的血脂异常可能具有更严重的致动脉粥样硬化潜能, 此外, NAFLD患者的脂质参数与肝损伤和炎症的组织学严重程度之间存在正相关[58], 证实了这两种情况之间的密切关系.
2.1.2 NAFLD患者微血管损伤、内皮功能障碍与CV风险: 系统性微血管损伤的存在, 以及持续性炎症引起的内皮功能障碍和氧化应激可能是增加NAFLD人群CV风险的主要机制[59]. 除了脂肪生成增加的直接影响外, 动脉僵硬的增加还可以增加NAFLD患者的CV风险[60].
此外, 有证据表明[61], 不吸烟患者中NAFLD的患病率较高, 同时也有证据表明[62], NAFLD的严重程度似乎与该人群中动脉高血压的发病率同时增加, 这支持了一种强烈的双重关系.
2.1.3 肝特异性异常与CV系统: 如上所述, 除了动脉粥样硬化性血脂异常、肥胖和动脉高压等对CV系统的直接影响外, 肝病似乎显著的且可直接地促进CV风险. 肝内血管功能受损(窦性变形或微血管形成丢失)和纤维化的存在, 本身可导致内皮功能障碍, 并增加血栓前分子和血管生成因子的产生, 这可能涉及系统血管. 肝脏中的巨噬细胞数量最多, 大量细胞因子(尤其是TNF-α、IL-6、CRP)可慢性释放到全身循环中, 促进慢性炎症和血栓易感性[63].
NAFLD患者可能有重要的肝血管重塑, 可能导致动脉功能障碍和CV风险. 与对照组相比, NAFLD患者的血清血管内皮生长因子水平升高. 血栓前因子的大量产生, 特别是因子VIII、IX、XI和XII, 与肝脂肪含量呈正相关, 因此可能与这些患者的CV风险增加相关. 纤溶酶原激活物抑制物-1的释放增加, 通过抑制组织纤溶酶原激活物与血栓前风险相关, 可进一步增加CV事件的风险[64].
最近, 也有研究表明肝脏组织特异性分子在系统中起作用, 它似乎影响多种代谢途径. 这些分子, 也被称为"肝细胞因子", 可能在NAFLD患者CV并发症的发生中起相关作用. 成纤维细胞生长因子-21(fibroblast growth factor-21, FGF-21)是肝脏分泌的一种多肽, 参与人体的稳态过程. 它在CV系统中的作用还不完全清楚, 但一些研究表明它对CV系统有负面影响. 血清FGF-21水平的升高与颈动脉CIMT增厚、动脉粥样硬化和CAD有关. 胎球蛋白-A是由肝脏合成的一种分子, 似乎参与胰岛素信号传导. 在胎球蛋白A水平较高的糖尿病患者中观察到对CV系统的负面影响, 而在非糖尿病患者中观察到相反的影响[65].
在NAFLD和CV疾病中, 如心肌梗死和中风, 人类肠道微生物的状态都发生了改变[66,67]. 实验研究表明[68], 肠道微生物的变化可能会影响自然稳态, 特别是通过降低能量消耗和胰岛素敏感性. 在人类中, 食物的不正常摄入与肥胖、糖尿病和NAFLD的发生有关, 并影响肠道微生物组成. 三聚氰胺N-氧化物是一种由肠道微生物转化为膳食磷脂酰胆碱的分子, 与动脉粥样硬化疾病的发展有关. 此外, 在动脉粥样硬化斑块中发现了大量肠杆菌DNA, 如细菌蛋白[69]. 这些发现表明, 肠道失调在饮食、代谢疾病、NAFLD和CV事件的十字路口起着重要作用. 图1显示了NAFLD与CVD之间的多种联系机制.
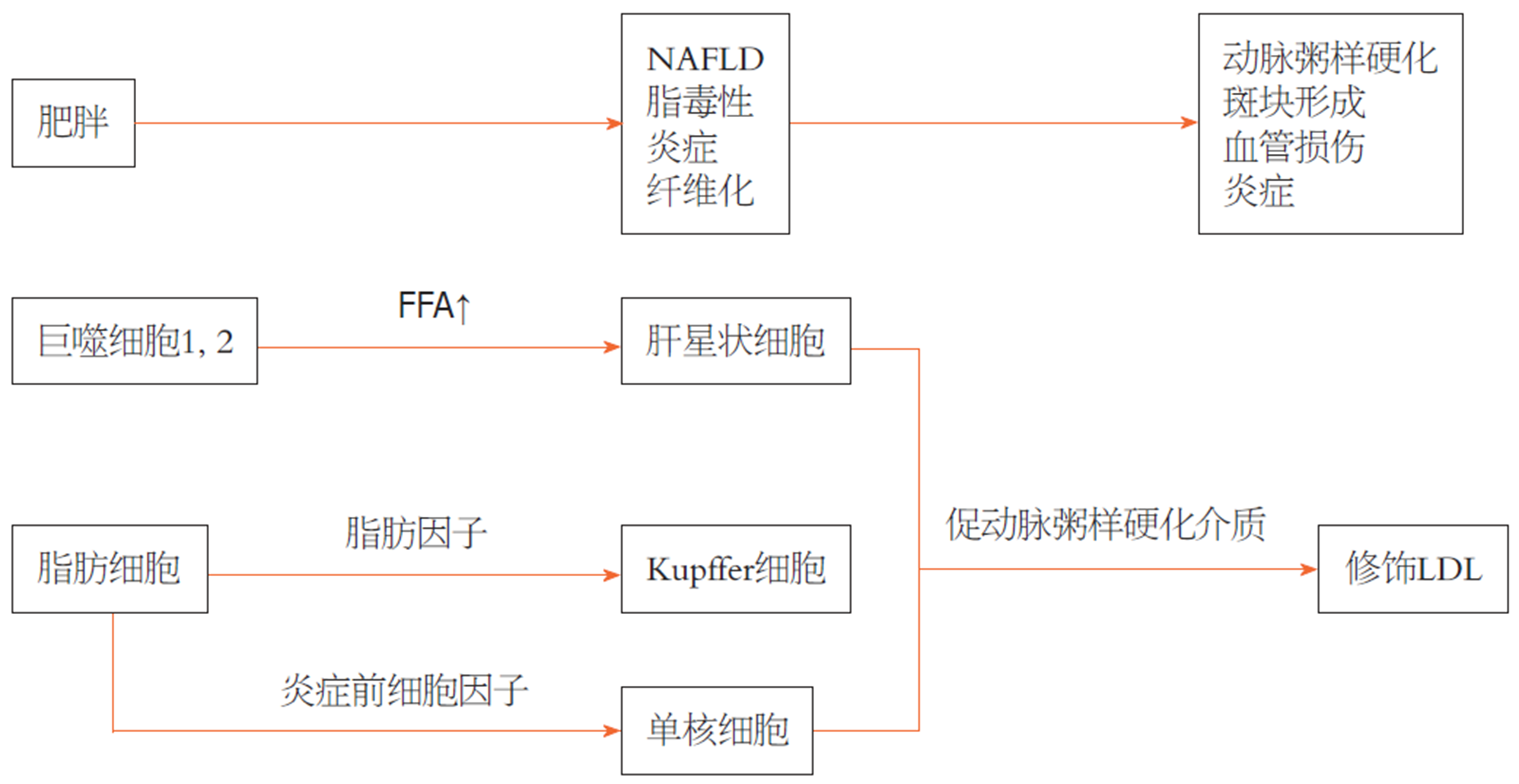
肝脂肪堆积可能是NAFLD与动脉粥样硬化关系的重要决定因素. 最近, 有人提出脂肪肝本身不是动脉粥样硬化的危险因素, 除非它与代谢紊乱有关. 有人认为[70], 脂肪肝可能有两种不同的形式: 一种主要与代谢异常有关, 另一种主要由遗传因素引起, 其特征是有更高的进行性肝损伤风险.
NAFLD与不良代谢和动脉粥样硬化风险状况相关. 从代谢角度来看, NAFLD相关动脉粥样硬化形成的生物学机制可能是VAT、肠道、肌肉组织和肝脏之间的串扰[71]. 事实上, 扩张和炎症的VAT释放的分子, 如脂肪因子、IL-6和TNF-α, 可能参与IR和CVD的发展[72]. 此外, 饮食中的乳糜微粒和从头脂肪生成有助于增加肝脏FFA池以及NAFLD的发生[73].
肝脏中的脂质积聚导致亚急性炎症, 随后通过核因子κB(nuclear factor-kappa B, NF-κB)途径产生细胞因子. 尤其是, NF-κB的激活导致一些促炎症基因的转录增加, 这些基因介导全身和低级别炎症的进展. 脂肪组织的增加和慢性炎症也会导致脂肪因子分泌的不平衡, 特别是脂联素的减少. 脂联素已被证明具有抗炎和抗纤维化能力(DI Maira等[74], 2018), 其低水平分别与高脂肪含量和从脂肪变性及CVD到NASH与CV动脉粥样硬化的进展有关[75]. NASH通过系统释放促动脉粥样硬化介质(CRP、IL-6和TNF-α)和纤维蛋白原、因子VII和纤溶酶原激活物抑制物-1介导的高凝和低纤溶可诱导参与动脉粥样硬化形成,通过这种方式, 肝脏成为促动脉粥样硬化分子的来源, 从而放大动脉损伤. 越来越多的证据表明动脉粥样硬化与肝损伤的严重程度成正比[76](图2).
MerTK显示出清除凋亡小体的显著能力. 已经证明M2c极化与MerTK上调密切相关, 检测M2c受体可预测MerTK的表达[77]. 此外, M2c巨噬细胞能够释放Gas-6, 而Gas-6又可以通过MerTK信号以自分泌方式放大IL-10的分泌[77].
MerTK是巨噬细胞表面的一类蛋白质, 它能够调节炎症修复, 效应细胞增生. 通过与凋亡细胞表面翻转的磷酯酰丝氨酸结合, 能够发生吞噬作用. 此外, 巨噬细胞还能够抑制NF-κB信号通路. 有研究表明[70], MerTK信号能够促进SPM(炎症损伤修复过程依赖于特定的调节因子)的合成. MerTKGIP 还可调节巨噬细胞活化, 促进凋亡细胞的吞噬, 帮助血小板聚集, 并维持体内血块的稳定. MerTK是酪氨酸-3、Axl和Mer(TAM)受体酪氨酸激酶家族的第二个成员. 这些受体的特征是细胞外区域的黏附分子样结构域, 模拟了细胞-细胞接触中重要的神经细胞黏附分子的结构, 其中包含五个Ig结构域和两个纤维连接蛋白Ⅲ型结构域, 研究最多的MerTK配体是Vit-K修饰的Gas-6和蛋白S.
MerTK通常在单核细胞/巨噬细胞、树突状细胞、自然杀伤细胞、自然杀伤T细胞、肝星状细胞(hepatic stellate cell, HSC)、巨核细胞、血小板、上皮组织和生殖组织中表达[78]. M2c巨噬细胞高水平表达. 巨噬细胞极化是调节炎症反应的重要机制, 它受核受体超家族成员过氧化物酶体增殖物激活受体(peroxisome proliferators-activated receptors, PPAR) (α, β, δ, γ等位型)和肝X受体(liver X receptor, LXRs) (LXRα和LXRβ)的控制[79]. 这些转录因子与维甲酸X受体(α和β等型)形成异二聚体, 在结合脂质或合成配体时, 通过反式激活介导基因表达. 核受体在巨噬细胞功能的调节中起着重要作用. 它们的配体影响调节脂质稳态、促炎症细胞因子产生、炎症分解和促进组织愈合的介质合成的基因转录[80]. PPARγ激活通过清道夫受体CD36引起脂质摄取, 脂肪酸β氧化与巨噬细胞极化成M2a细胞有关. PPARγ和LXR (肝X受体α和β)活性是相互协调的, PPARγ实际上能激活LXRs, 但在一定条件下, PPARγ和LXRS发挥相反的作用. 在M2a巨噬细胞中, IL-4刺激PPARγ表达和LXR-α下调[81].
巨噬细胞中过量脂蛋白衍生胆固醇的积累激活LXR, 进而触发ABC转运体的诱导, 介导胆固醇外流以及小鼠(A-Gonzalez)和人类[77]中MerTK的上调. 证明指出, 吞噬凋亡细胞激活LXRs, 可能是通过膜源性胆固醇的积累. LXRs反过来激活MerTK的转录, 产生正反馈以促进进一步的传出细胞, 该过程介导ABC转运体基因(如ABCA-1和ABCG-1)的增加表达, 参与过量胆固醇的流出和免疫抑制. 这些结果表明, MerTK的LXR依赖性调节对正常的免疫内稳态具有重要意义. MerTK-/-和LXRs-DKO小鼠具有一系列特征, 包括炎症反应增强和对自身免疫和动脉粥样硬化的易感性增加[82].
MerTK通过不同的机制, 包括效应细胞作用, 维持中枢和外周耐受. 事实上, 在全基因组相关研究中, 有报道称[83], MerTK位点rs4374383 G>A与肝脏MerTK表达减少相关, 从而保护慢性丙型肝炎和NAFLD患者免受肝纤维化的影响. 同样的G>A变异被发现与心脏代谢紊乱和营养性炎症有关, 并可能以这种方式导致肝脏和心脏代谢疾病[83]. 此外, 研究表明[78], 在人类NAFLD标本中, MerTK主要在巨噬细胞和炎症灶内松散聚集的HSC中表达.
动脉粥样硬化病变在临床上是无症状的, 急性CV事件可能是由坏死斑块演变而来. 首先, 凋亡细胞被邻近的巨噬细胞有效清除, 以限制整个损伤细胞的数量. 在这里, 传出细胞增生迅速, 没有炎症. 在生理条件下, 凋亡细胞在吞噬体中被吞噬和降解, 巨噬细胞被大分子成分和胆固醇超载. 在晚期动脉粥样硬化中, 慢性炎症刺激的持续存在促进了病变的不稳定性和对心脏病发作和中风的易感性. 炎症在促进动脉粥样硬化中的作用已被充分证明. 在晚期斑块中, 由慢性内质网应激诱导的凋亡泡沫细胞引起炎症反应[84]. 此外, 内质网应激与斑块破裂密切相关. 两个过程有助于凋亡后坏死和有缺陷的传出细胞增多, 并损害了炎症反应的解决. 在最后一个阶段, 传出细胞功能受损, 有缺陷的MerTK至少部分地促进坏死斑块的扩张. 在这方面, 有证据表明缺乏MerTK的小鼠表现出了有效细胞增生的缺陷, 这与斑块内炎症和坏死的增加有关. 此外, 人类动脉粥样硬化坏死核心附近的巨噬细胞显示, MerTK表达低于周围病变[85]. 最后, 在晚期动脉粥样硬化中, 脂质和ROS的积累增加了氧化磷脂的水平. 这些脂质可与清道夫受体结合, 并可能竞争凋亡细胞识别, 损害有效细胞增生机制. 最近的一项研究表明[86], 在病变中, 死亡细胞摄取的预防是通过一些凋亡细胞介导的, 这些细胞显示一种叫做CD47的分子, 这种分子通常在凋亡过程中丢失.
在某些炎症条件下, MerTK的失活可能会损害传出细胞. 氧化LDL可诱导Toll样受体(Toll-like receptor, TLR) 4的表达, 增加TNF-α和IL-1β等促动脉粥样硬化细胞因子的分泌, 减少TGF-β和IL-10的分泌[87]. 这种促炎性环境损害了巨噬细胞的传出细胞, 促进了脂质摄取的增加, 从而增强了吞噬作用, 降低了巨噬细胞表面的MerTK表达水平. MerTK表达的减少与解除整合素金属蛋白酶17 (Disintegrin metalloproteinase 17, ADAM17)的裂解有关. 在人类动脉粥样硬化中, 坏死核心附近的巨噬细胞比周围病变中的巨噬细胞具有更高的ADAM17[85]. 多种动脉粥样硬化炎性刺激, 如氧化应激、缺氧和氧化配体, 能够促进ADAM17活性[88]. 通过破坏受体和产生可溶性Mer (sol-Mer, 溶胶聚合GAS-6物), 抑制竞争性细胞增多症, 其竞争结合分子Gas-6和蛋白S. 有趣的是, 氧化LDLs促进MerTK裂解和有缺陷的吞噬细胞增多, 可以激活高级斑块内的坏死通路. 有利于坏死核的发育[88]. 在最近的研究中[89], 已经证明, 氧化LDL能够增加sol-Mer水平并降低野生型巨噬细胞表面的MerTK表达.
CVD是全世界, 特别是发达国家的主要死因, 包括动脉粥样硬化、高血压、中风和心力衰竭等多种疾病[90]. 越来越多证据表明NAFLD 时有菌群失调, 引起细菌易位、内毒素血症、肠道屏障功能障碍和继发先天和适应性免疫异常等是CVD发生的主要危险因素. Wang等[91]报告了CVD的肠道微生物依赖机制, 强调了肠道微生物与CVD之间错综复杂的关系. 最近, 肠道微生物失调被认为是导致动脉粥样硬化和高血压发展的重要因素, 动脉粥样硬化和高血压是CVD的两个主要危险因素[92].
动脉粥样硬化是CVD的主要危险因素, 其特征是胆固醇积聚和巨噬细胞进入动脉壁, 从而导致动脉粥样硬化斑块的形成. 最近的研究表明[93], 肠道菌群失调也有助于动脉粥样硬化的发展. 通过对有或无动脉粥样硬化症状的患者的肠道基因组进行测序发现, 与健康对照组相比, 动脉粥样硬化患者的罗氏菌属和真细菌的相对丰度较低, 而柯林斯氏菌较高. 此外, 研究发现[94], 艾克曼菌能够改善肠道屏障功能, 并对动脉粥样硬化起到保护作用. 尽管荟萃分析显示, 抗生素治疗对CHD患者没有明显的益处, 但是, 越来越多的证据表明, 肠道微生物群通过调节炎症和微生物代谢产物的产生在动脉粥样硬化中起到了病因作用[95].
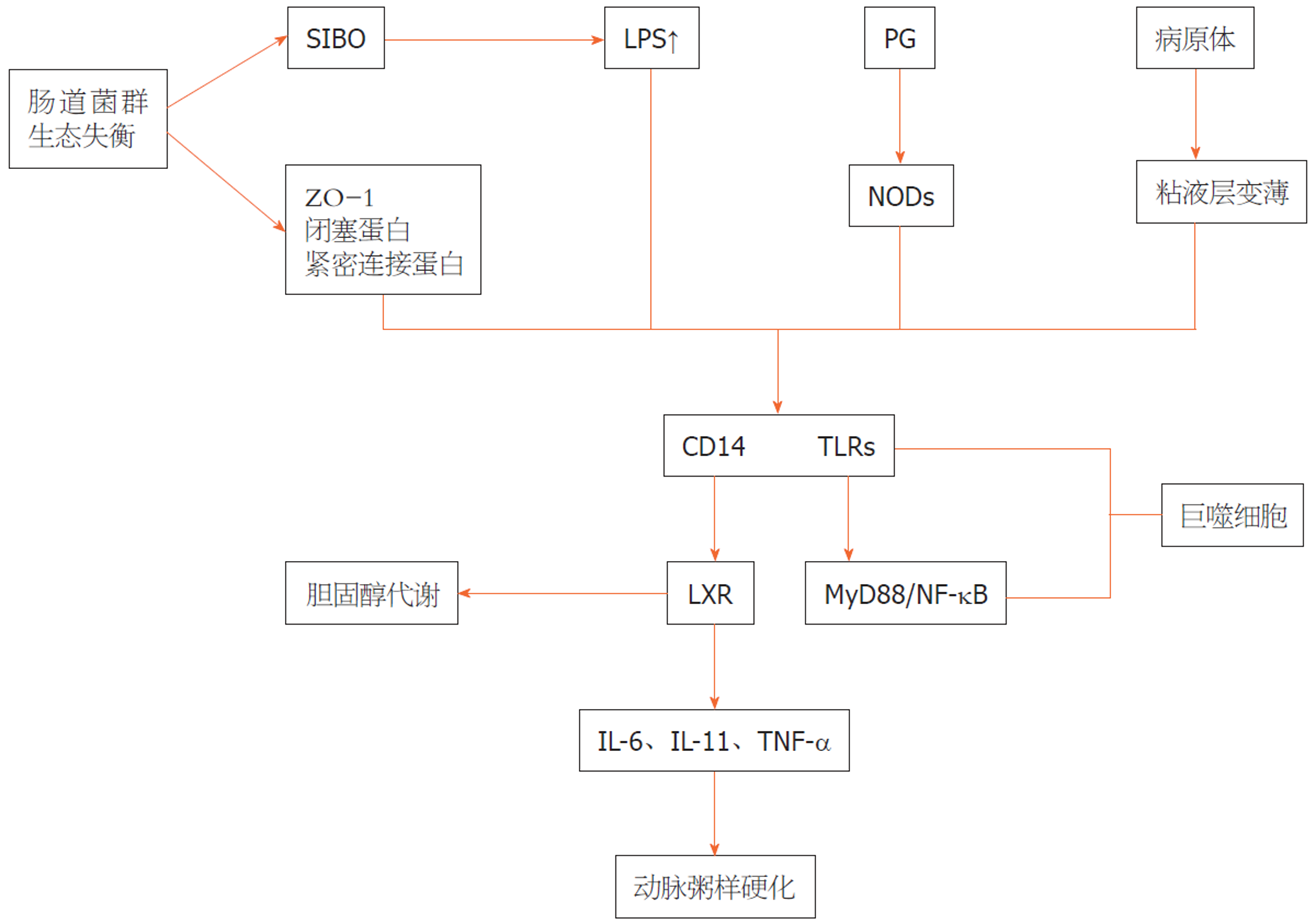
3.1.1 动脉粥样硬化中的肠道微生物失调和炎症: 炎症通常与许多疾病有关, 包括动脉粥样硬化, 这是一种典型的慢性炎症疾病. 肠道上皮是宿主的第一道屏障, 可防止病原体入侵. 鉴于其在防止肠道内容物(主要是细菌成分)易位方面的关键作用, 肠道屏障的完整性对于维持宿主的健康至关重要. 肠道通透性与紧密连接蛋白(包括胞质小带闭塞蛋白1、紧密连接蛋白和闭塞蛋白的表达减少以及肠上皮细胞死亡和再生之间的不平衡有关[96]. 如果肠上皮屏障受损, 病原体相关分子模式(pathogenic molecular model, PAMPs)的入侵会驱动免疫反应, 并导致全身和组织特异性炎症. 因此, 由肠道微生物失调引起的肠道屏障完整性损害被认为是各种疾病慢性炎症的危险因素. 值得注意的是, 脂多糖(lipopolysacchride, LPS)和肽聚糖(peptidoglycan, PG)是公认的CVD危险因素.
LPS是革兰阴性细菌的细胞壁成分, 因其是参与CVD风险的PAMPs之一而被广泛研究. 在一项研究中得出结论, 循环内毒素血症水平在CVD负担最高的患者中最为显著. Cani等[97]发现肠道微生物失调抑制紧密连接蛋白的表达, 导致肠道通透性增加, 随后LPS转移到血液中. 肠道菌群失调衍生的LPS可能通过调节TLR及其下游靶点发挥重要作用[98]. 作为模式识别受体家族的一部分, TLRs可以识别细菌产物并调节宿主免疫系统. 采用TLR4和LDL受体双基因敲除小鼠, Ding等[99]发现TLR4缺乏可减少动脉粥样硬化, 但对炎症无影响. 一直以来, 临床研究表明, TLRs的上调与人类动脉粥样硬化的炎症激活有关, 并促进动脉粥样硬化. 然而, 2012年Zhang等[100]的荟萃分析表明Asp299Gly (TLR4基因), 一种TLR4多态性, 在动脉粥样硬化的发展中没有明显的作用. 此外, LPS与TLR4的结合激活了其下游途径, 包括MyD88和NF-κB, 促进了促炎性细胞因子如IL-6、IL-1、IL-27和TNF-α的产生, 从而增加了发生CVD的风险[101], 缺乏MyD88可通过减少巨噬细胞募集而减少动脉粥样硬化. 肠道微生物群与炎症之间的主要相互作用如图3所示.
此外, 另一种细菌PAMP, PG(peptidoglycan, 肽聚糖)也被发现通过损害肠上皮屏障与CVD风险相关. PG是革兰阴性细菌的一个次要细胞壁成分, 但也是革兰阳性细菌的一个主要成分. 利用亚基因组测序发现动脉粥样硬化患者富含编码PG合成的基因[102]. 事实上, 在动脉粥样硬化动脉中观察到促炎性细菌PG, 并与易损斑块相关. 通过PG识别, 核苷酸结合寡聚结构域(nucleotide binding oligomeric domain, NOD)蛋白NOD1和NOD2通过涉及NF-κB和丝裂原活化蛋白激酶信号途径的程序. 促进细胞内细菌清除[103]. 对NOD2缺陷小鼠的研究表明, NOD2是肠道细菌免疫的关键调节因子, 有助于维持肠道屏障的完整性. 近年来, 科学家利用NOD1基因敲除小鼠研究了NOD1在动脉粥样硬化中的潜在作用. 数据显示, 小鼠载脂蛋白E和NOD1基因敲除显著减少动脉粥样硬化病变的发展[104]. 此外, 还有其他PAMP可以通过参与宿主模式识别受体来促进炎症过程, 如CpG(胞嘧啶-鸟嘧啶二核苷酸)寡核苷酸鞭毛蛋白、脂肽等[105].
3.1.2 TMAO与动脉粥样硬化: 膳食磷脂酰胆碱或左旋肉碱在肠道内由肠道微生物群代谢为三甲胺(trimethylamine, TMA). 它是氧化三甲胺(trimethylamine oxide, TMAO)的前体, TMA被转运到肝脏并被含黄素单氧化酶(flavin-containing monooxygenase 3, FMO)3氧化, 这是肝脏FMO酶家族的一个成员, 导致TMAO的产生[106]. 使用反义寡核苷酸的小鼠肝脏中FMO3的敲除通过刺激基础代谢和激活巨噬细胞反向胆固醇转运降低了循环TMAO水平并减轻动脉粥样硬化[107]. 同时Chen等[108]还发现, 肠道微生物膳食磷脂酰胆碱代谢物的血浆水平和产生相关分子(左旋肉碱和γ-丁基甜菜碱)的TMAO水平与CVD风险相关. 血浆TMAO水平的升高与动脉粥样硬化形成和动脉粥样硬化斑块面积的范围相关. 对有或无慢性心力衰竭患者的前瞻性和观察性临床研究表明[109], 血浆TMAO水平与慢性心力衰竭风险呈正相关. 提示循环中TMAO水平是CVD发病的重要危险因素.
为了探讨TMAO促进动脉粥样硬化的可能机制, Ma等[93]给ApoE-/-小鼠补充了一种膳食胆碱, 测定了与动脉粥样硬化有关的两种巨噬细胞清除剂受体CD36(脂肪酸转运蛋白, 属于B类清道夫受体家族)和类固醇受体核糖核酸激活剂A1类清道夫受体(scavenger receptor class A1, SR-A1)的表达. 结果显示, 与正常对照组相比, TMAO治疗小鼠的巨噬细胞中CD36和SR-A1水平升高. TMAO可通过抑制RCT和调节巨噬细胞中胆固醇转运蛋白的活性而导致动脉粥样硬化. 此外, TMAO可抑制肝胆汁酸(bile acid, BA)合成酶(Cyp7a1和Cyp27a1)和BA转运蛋白(Oatp1、Oatp4、Mrp2和Ntcp)的水平, 导致BA相关通路和动脉粥样硬化的发生[110], 提示TMAO促进动脉粥样硬化的作用也与BA代谢的变化有关. 法尼酯衍生物X受体(famesoid X receptor, FXR)是控制BA代谢的重要核受体, 它还可以调节肝脏FMO3的表达, 从而改变TMAO的产生. FXR激动剂抑制ApoE-/-小鼠中的CYP7A1和CYP8B1的表达, 并保护小鼠免受动脉粥样硬化[107]. 最近, 发现TMAO上调血管细胞黏附分子-1、活化蛋白激酶C和NF-κB的表达[93], 提示TMAO可能通过诱导内皮细胞功能障碍和增加单核细胞黏附而加速动脉粥样硬化的发展. 此外, 血小板直接暴露于TMAO可通过提高细胞内存储的Ca2+释放, 增加刺激依赖性血小板激活, 从而增加血栓形成和斑块不稳定的风险[111]. 总的来说, TMAO通过促进胆固醇内流、抑制胆固醇外流、阻断BA途径和/或引起血小板过度激活来加速动脉粥样硬化的发展. 所有这些发现都证实TMAO是CVD风险的生物标记物和动脉粥样硬化疾病的启动子[112]. TMAO被认为是最有前途的代谢产物之一, 在大量实验和临床资料的基础上, TMAO不仅可能是CVD的独立危险因素, 而且可能是CVD的潜在治疗靶点. 然而, 也观察到不一致的结果. 值得注意的是, 由不同国家进行的几项大规模人群研究表明[113,114], 饮食中胆碱和甜菜碱的摄入与CVD的发病无关. 因此, 需要更多的研究来证实TMAO在动脉粥样硬化中的确切作用, 以及通过靶向TMAO产生菌或酶来验证其治疗潜力.
3.1.3 BA与动脉粥样硬化: BA是另一组与各种代谢疾病有关的肠道微生物衍生代谢物,这些代谢物储存在胆囊中并释放到肠道中, 以促进膳食脂质和脂溶性维生素的吸收. Zheng等[115]研究发现, 抑制肝BA生物合成可抑制HFD诱导的肠道微生物群改变, 这凸显了肝-肠-肠道微生物群落代谢轴. 因此, 肠道微生物群与BA代谢之间存在双向关系.
BA也是调节宿主代谢和能量消耗过程的重要信号分子[116]. 胆汁盐可以通过肠道微生物群在富含胆汁盐的微环境中生存, 从而分化为具有生物活性的物种. 肠道微生物群介导的脑血管病中的BA代谢最近受到广泛关注[117]. 然而, 到目前为止, BAs在CVD发展中的作用仍不清楚. 众所周知, BAs主要通过胆盐水解酶(bile salt hydrolase, BSH)和BA受体促进动脉粥样硬化的发展. 细菌介导的BSH活性可通过增加胆固醇积聚、泡沫细胞形成和动脉粥样硬化斑块的大小而影响动脉粥样硬化发病的潜在过程. BSH存在于多种细菌中, 如甲烷杆菌、梭菌、肠球菌等[118].
除BA自身外, FXR是一种最重要且研究得很好的BA受体, 通过影响参与初级BA合成的基因转录来调节葡萄糖和脂质代谢[119]. 与野生型小鼠相比, FXR-/-小鼠血浆HDL胆固醇、非HDL胆固醇和三酰甘油水平升高, 说明FXR在调节胆固醇代谢中的关键作用. 在先前的一项研究中[120], 载脂蛋白E缺乏(ApoE-/-)小鼠(动脉粥样硬化小鼠模型)的功能性FXR缺失可导致更严重的脂质代谢缺陷和主动脉斑块形成增强. 此外, FXR缺乏可导致血浆LDL胆固醇和巨噬细胞CD36表达减少, 导致LDLR基因敲除(LDLR-/-)小鼠动脉粥样硬化风险降低. 另一方面, 研究表明在LDLR-/-和ApoE-/-小鼠中, 用激动剂激活FXR可以保护动脉粥样硬化, 这可能与抑制参与BAs合成的基因有关. G蛋白偶联的胆汁酸受体(G protein-coupled bile receptor, TGR)5, 是另一种对BAs敏感的重要宿主BA受体. 最近的研究表明[121], 激活TGR5可以抑制动脉粥样硬化的形成, TGR5的激活也有助于提高能量消耗和改善血糖控制. 孕烷X受体(pregnane X-receptor, PXR)是另一种核激素受体, 调节参与BAs生物合成、运输和代谢的基因表达, 也可被石胆酸(lithocholic acid, LCA)等次级BAs激活. PXR的缺失会减弱PXR和apoE双基因敲除(PXR-/-和apoE-/-)小鼠动脉粥样硬化的发展, 这可能与减少巨噬细胞CD36表达和脂质摄取有关. 据报道[122], PXR激动剂激活PXR可增加致动脉粥样硬化脂蛋白VLDL和LDL的水平, PXR激活可加速ApoE-/-小鼠的动脉粥样硬化. 此外, 维生素D3受体(Vitamin D3 receptor, VDR3)是细菌诱导的BA的传感器, 它比其他核受体对LCA及其代谢物(3-oxo-LCA)更敏感. 已经发现巨噬细胞VDR3信号通过抑制局部肾素-血管紧张素系统部分地减轻小鼠动脉粥样硬化. 最后, 鞘氨醇-1-磷酸酯受体2 (sphingosine-1-phosphatereceptor 2, S1PR2)可被各种结合的BAs激活, 然后通过调节巨噬细胞滞留和炎性细胞因子分泌促进动脉粥样硬化, 而S1PR2基因敲除可减轻ApoE-/-小鼠的动脉粥样硬化[123].
总之, 肠道菌群衍生的次级BAs通过调节各种BA受体, 如FXR、PXR、TGR5、VDR和S1PR2在动脉粥样硬化的发生发展中发挥重要作用. 这一发现凸显了以肠道微生物群为靶点的新型动脉粥样硬化治疗的巨大潜力.
高血压是遗传易感性和环境因素共同诱发的CVD的另一个重要风险. 鉴于人们越来越认识到肠道菌群在代谢性疾病中的作用[124], 近年来也对肠道菌群与高血压的关系进行了评估. 在自发性高血压大鼠中, Yang等[125]发现微生物丰度和多样性显著降低, 硬壁菌/类杆菌比例增加. 在另一项研究中, 与常规饲养小鼠相比, 注射血管紧张素2 (angiot6ensin II, AngII)的小鼠显示, 对AngII的血压升高反应减弱, 表明肠道微生物群促进了AngII诱导的血管功能障碍和高血压. 因此, 肠道微生物群可能与高血压的发生有关. 虽然肠道菌群和高血压的关系和机制尚未完全阐明, 现有的证据突出了临界脂肪酸和氧化LDL (OX-LDL)在高血压中的关键作用.
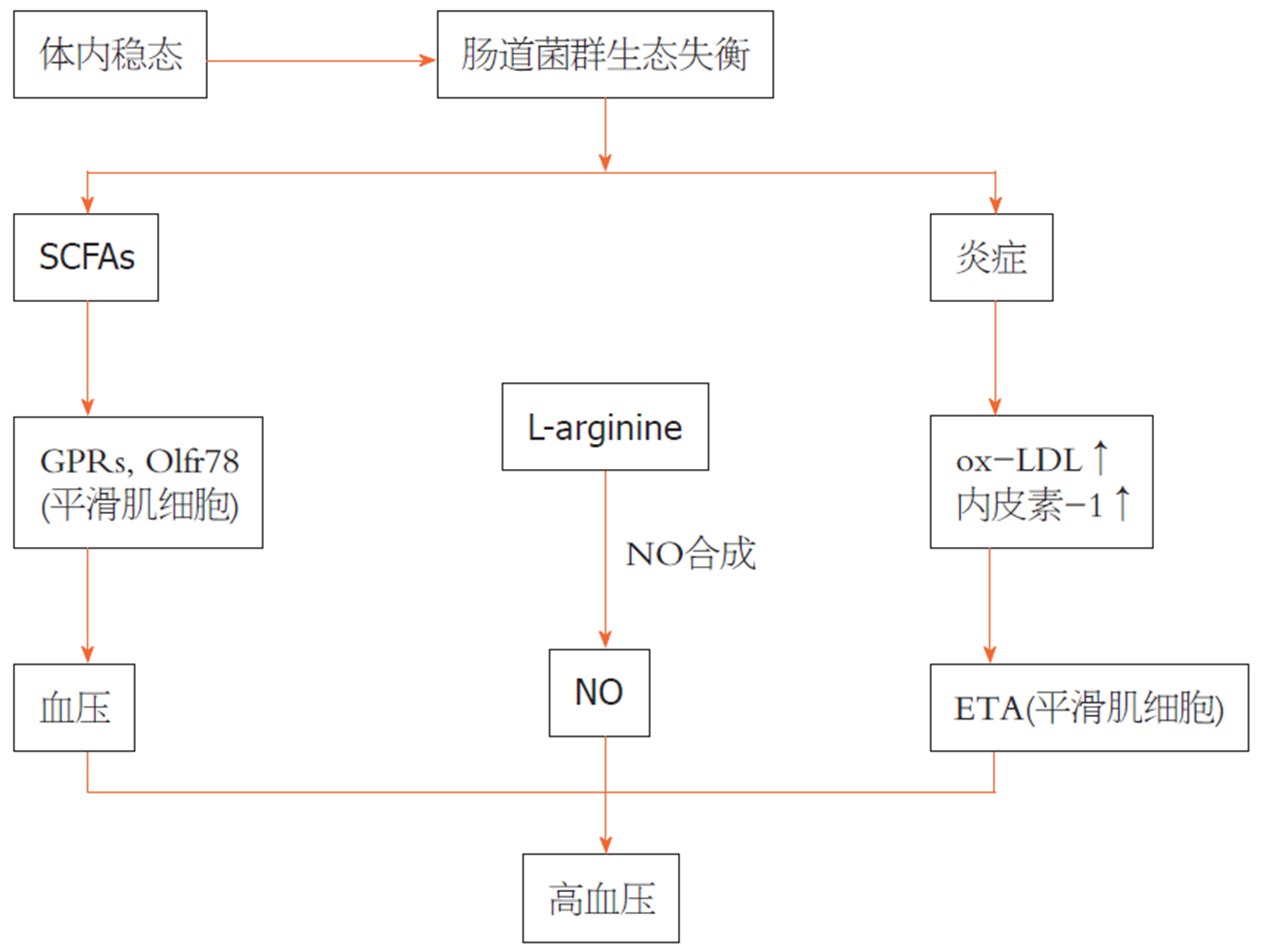
3.2.1 短链脂肪酸与高血压: 来自膳食纤维(主要是多糖)的短链脂肪酸(如乙酸、丙酸和丁酸)在维持肠道微生物群的稳态和宿主免疫方面发挥着关键作用[126]. 有趣的是, 将多糖代谢成不同类型短链脂肪酸(short-chain fatty acids, SCFAs)的细菌是特殊的. 例如, 主要的产醋酸细菌是链球菌属、普雷沃菌属、双歧杆菌属、梭菌属、嗜粘杆菌属等[127]. 丙酸盐是由拟杆菌属、沙门氏菌属、二烯链球菌属、维氏菌属、菊苣苔藓菌属、卡氏黄连菌属、阑尾菌属等的碳水化合物发酵产生的[128], 而丁酸盐则是由蓝螺旋菌科、瘤胃球菌科和酸性氨基球菌科产生的. 最近的一项研究发现[129], 补充纤维和醋酸盐改善了肠道菌群失调, 与嗜酸类杆菌增多有关, 这可能在高血压小鼠的高血压和心力衰竭中起到保护作用.
迄今为止, 至少有三个宿主G蛋白偶联受体受SCFA监管, 包括G蛋白偶联受体(G protein-coupled receptors, GPR) 41、GPR43和GPR109A. SCFAs可以刺激宿主GPCRs调节的途径, 导致肾素分泌, 从而影响血压, SCFAs通过调节内皮细胞GPR41来降低血压[130]. 嗅觉受体78 (olfactory receptor 78, Olfr78)是另一种在肾脏中表达的GPCR, 它也可以被SCFAs如醋酸盐和丙酸盐调节. 此外, Olfr78和GPR41均在小阻力血管的平滑肌细胞中表达. 丙酸盐可通过调节Olfr78和GPR41活性诱导小鼠血管舒张并产生急性低血压反应[131]. 另一方面, 刺激GPR41可导致低血压反应降低, 而刺激Olfr78可对抗这种效应[132]. 总之, 虽然所有这些发现都揭示了肠道微生物群可能通过产生微生物SCFAs在调节宿主血压方面发挥重要作用, 但SCFAs作为CVD治疗靶点的潜力需要在未来的进一步研究中得到证实.
3.2.2 OX-LDL与高血压: 一般来说, 血压的调节除了各种受体的调节外, 肠道疾病也通过氧化LDL介导的血管收缩参与高血压的发生. 肠道微生物失调可以促进促炎性细胞因子的表达, 并诱导氧化应激, 这可以刺激OX-LDL, 较高水平的OX-LDL通过抑制NO和内皮素的产生而有助于高血压. NO是通过NO合成酶氧化L-精氨酸而产生的良好的血管扩张剂. OX-LDL降低NO的生成, 降低血管舒张的程度. 此外, 内皮素-1在维持基本血管张力和CV系统稳态方面起着关键作用. 内皮素-1通过激活内皮受体B和促进NO的产生, 在低浓度时产生血管舒张作用, 但在高浓度时通过增加斑块中OX-LDL的产生和激活内皮受体A[93].
尽管肠道菌群失调与高血压之间的因果关系已经得到证实[104,133], 但肠道菌群在介导高血压中的确切作用仍需进一步广泛研究. 与肠道微生物群和高血压相关的主要机制如图4.
大量临床证据表明NAFLD可能先于和/或促进T2D、高血压和动脉粥样硬化/CVD的发展. 发生这些CV代谢疾病的风险与NAFLD的潜在严重程度相似[134]. 越来越多的证据表明NAFLD的存在和严重程度与T2D和高血压的发病风险增加有关, 就其相关机制、临床的联系和治疗的探索有待进一步作深入的研究, 通过不懈的努力, 提供治疗的新策略, 为改善NAFLD和CVD的预后提供新途径, 是今后几年研究的中心环节.
学科分类: 胃肠病学和肝病学
手稿来源地: 山东省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): 0
D级 (一般): 0
E级 (差): 0
编辑: 王禹乔 电编:刘继红
| 1. | Ismaiel A, Dumitraşcu DL. Cardiovascular Risk in Fatty Liver Disease: The Liver-Heart Axis-Literature Review. Front Med (Lausanne). 2019;6:202. [PubMed] [DOI] |
| 2. | Söderberg C, Stål P, Askling J, Glaumann H, Lindberg G, Marmur J, Hultcrantz R. Decreased survival of subjects with elevated liver function tests during a 28-year follow-up. Hepatology. 2010;51:595-602. [PubMed] [DOI] |
| 3. | Ekstedt M, Hagström H, Nasr P, Fredrikson M, Stål P, Kechagias S, Hultcrantz R. Fibrosis stage is the strongest predictor for disease-specific mortality in NAFLD after up to 33 years of follow-up. Hepatology. 2015;61:1547-1554. [PubMed] [DOI] |
| 4. | Sporea I, Popescu A, Dumitrașcu D, Brisc C, Nedelcu L, Trifan A, Gheorghe L, Fierbințeanu Braticevici C. Nonalcoholic Fatty Liver Disease: Status Quo. J Gastrointestin Liver Dis. 2018;27:439-448. [PubMed] [DOI] |
| 5. | Dumitrascu DL, Neuman MG. Non-alcoholic fatty liver disease: an update on diagnosis. Clujul Med. 2018;91:147-150. [PubMed] [DOI] |
| 6. | Macavei B, Baban A, Dumitrascu DL. Psychological factors associated with NAFLD/NASH: a systematic review. Eur Rev Med Pharmacol Sci. 2016;20:5081-5097. [PubMed] |
| 7. | Chang Y, Ryu S, Sung KC, Cho YK, Sung E, Kim HN, Jung HS, Yun KE, Ahn J, Shin H, Wild SH, Byrne CD. Alcoholic and non-alcoholic fatty liver disease and associations with coronary artery calcification: evidence from the Kangbuk Samsung Health Study. Gut. 2019;68:1667-1675. [PubMed] [DOI] |
| 8. | Kim MK, Ahn CW, Nam JS, Kang S, Park JS, Kim KR. Association between nonalcoholic fatty liver disease and coronary artery calcification in postmenopausal women. Menopause. 2015;22:1323-1327. [PubMed] [DOI] |
| 9. | Wolff L, Bos D, Murad SD, Franco OH, Krestin GP, Hofman A, Vernooij MW, van der Lugt A. Liver fat is related to cardiovascular risk factors and subclinical vascular disease: the Rotterdam Study. Eur Heart J Cardiovasc Imaging. 2016;17:1361-1367. [PubMed] [DOI] |
| 10. | Kim BJ, Cheong ES, Kang JG, Kim BS, Kang JH. Relationship of epicardial fat thickness and nonalcoholic fatty liver disease to coronary artery calcification: From the CAESAR study. J Clin Lipidol. 2016;10:619-626.e1. [PubMed] [DOI] |
| 11. | Lee MK, Park HJ, Jeon WS, Park SE, Park CY, Lee WY, Oh KW, Park SW, Rhee EJ. Higher association of coronary artery calcification with non-alcoholic fatty liver disease than with abdominal obesity in middle-aged Korean men: the Kangbuk Samsung Health Study. Cardiovasc Diabetol. 2015;14:88. [PubMed] [DOI] |
| 12. | Jung DH, Lee YJ, Ahn HY, Shim JY, Lee HR. Relationship of hepatic steatosis and alanine aminotransferase with coronary calcification. Clin Chem Lab Med. 2010;48:1829-1834. [PubMed] [DOI] |
| 13. | Wójcik-Cichy K, Koślińska-Berkan E, Piekarska A. The influence of NAFLD on the risk of atherosclerosis and cardiovascular diseases. Clin Exp Hepatol. 2018;4:1-6. [PubMed] [DOI] |
| 14. | Baharvand-Ahmadi B, Sharifi K, Namdari M. Prevalence of non-alcoholic fatty liver disease in patients with coronary artery disease. ARYA Atheroscler. 2016;12:201-205. [PubMed] |
| 15. | Perera N, Indrakumar J, Abeysinghe WV, Fernando V, Samaraweera WM, Lawrence JS. Non alcoholic fatty liver disease increases the mortality from acute coronary syndrome: an observational study from Sri Lanka. BMC Cardiovasc Disord. 2016;16:37. [PubMed] [DOI] |
| 16. | Assy N, Djibre A, Farah R, Grosovski M, Marmor A. Presence of coronary plaques in patients with nonalcoholic fatty liver disease. Radiology. 2010;254:393-400. [PubMed] [DOI] |
| 17. | Pinarbaşi B, Demır K, Oflaz H, Ahishali E, Akyüz F, Elıtok A, Çımen AO, Gölcük E, Güllüoğlu M, İşsever H, Beşişik F, Kaymakoğlu S, Ökten A. Measurement of the coronary flow velocity reserve in patients with non-alcoholic fatty liver disease. Turk J Gastroenterol. 2012;23:720-726. [PubMed] [DOI] |
| 18. | Cobble M, Bale B. Carotid intima-media thickness: knowledge and application to everyday practice. Postgrad Med. 2010;122:10-18. [PubMed] [DOI] |
| 19. | Oni ET, Agatston AS, Blaha MJ, Fialkow J, Cury R, Sposito A, Erbel R, Blankstein R, Feldman T, Al-Mallah MH, Santos RD, Budoff MJ, Nasir K. A systematic review: burden and severity of subclinical cardiovascular disease among those with nonalcoholic fatty liver; should we care? Atherosclerosis. 2013;230:258-267. [PubMed] [DOI] |
| 20. | Kim HJ, Lim CW, Lee JH, Park HB, Suh Y, Cho YH, Choi TY, Hwang ES, Cho DK. Gender-based differences in the relationship between fatty liver disease and atherosclerosis. Cardiovasc J Afr. 2016;27:281-286. [PubMed] [DOI] |
| 21. | Martínez-Alvarado Mdel R, Juárez-Rojas JG, Medina-Urrutia AX, Cardoso-Saldaña GC, González-Salazar Mdel C, Posadas-Sánchez R, Jorge-Galarza E, Mendoza-Pérez E, Vargas-Alarcón G, Posadas-Romero C. Association of fatty liver with cardiovascular risk factors and subclinical atherosclerosis in a Mexican population. Rev Invest Clin. 2014;66:407-414. [PubMed] |
| 22. | Li X, Shi H, Wang Z, Chang L, Zhang M, Dong X. Arterial stiffness is increased in nondiabetic, nonhypertensive postmenopausal women with nonalcoholic fatty liver disease. J Hypertens. 2017;35:1226-1234. [PubMed] [DOI] |
| 23. | Nahandi MZ, Khoshbaten M, Ramazanzadeh E, Abbaszadeh L, Javadrashid R, Shirazi KM, Gholami N. Effect of non-alcoholic fatty liver disease on carotid artery intima-media thickness as a risk factor for atherosclerosis. Gastroenterol Hepatol Bed Bench. 2014;7:55-62. [PubMed] |
| 24. | Bhatia L, Scorletti E, Curzen N, Clough GF, Calder PC, Byrne CD. Improvement in non-alcoholic fatty liver disease severity is associated with a reduction in carotid intima-media thickness progression. Atherosclerosis. 2016;246:13-20. [PubMed] [DOI] |
| 25. | Azzam H, Malnick S. Non-alcoholic fatty liver disease - the heart of the matter. World J Hepatol. 2015;7:1369-1376. [PubMed] [DOI] |
| 26. | Petta S, Argano C, Colomba D, Cammà C, Di Marco V, Cabibi D, Tuttolomondo A, Marchesini G, Pinto A, Licata G, Craxì A. Epicardial fat, cardiac geometry and cardiac function in patients with non-alcoholic fatty liver disease: association with the severity of liver disease. J Hepatol. 2015;62:928-933. [PubMed] [DOI] |
| 27. | Yilmaz Y, Kurt R, Yonal O, Polat N, Celikel CA, Gurdal A, Oflaz H, Ozdogan O, Imeryuz N, Kalayci C, Avsar E. Coronary flow reserve is impaired in patients with nonalcoholic fatty liver disease: association with liver fibrosis. Atherosclerosis. 2010;211:182-186. [PubMed] [DOI] |
| 28. | Mahfouz RA, Gouda M, Galal I, Ghareb MS. Interatrial septal fat thickness and left atrial stiffness are mechanistic links between nonalcoholic fatty liver disease and incident atrial fibrillation. Echocardiography. 2019;36:249-256. [PubMed] [DOI] |
| 29. | Oğuz D, Ünal HÜ, Eroğlu H, Gülmez Ö, Çevik H, Altun A. Aortic flow propagation velocity, epicardial fat thickness, and osteoprotegerin level to predict subclinical atherosclerosis in patients with nonalcoholic fatty liver disease. Anatol J Cardiol. 2016;16:974-979. [PubMed] [DOI] |
| 30. | Baragetti A, Pisano G, Bertelli C, Garlaschelli K, Grigore L, Fracanzani AL, Fargion S, Norata GD, Catapano AL. Subclinical atherosclerosis is associated with Epicardial Fat Thickness and hepatic steatosis in the general population. Nutr Metab Cardiovasc Dis. 2016;26:141-153. [PubMed] [DOI] |
| 31. | Mantovani A, Dauriz M, Sandri D, Bonapace S, Zoppini G, Tilg H, Byrne CD, Targher G. Association between non-alcoholic fatty liver disease and risk of atrial fibrillation in adult individuals: An updated meta-analysis. Liver Int. 2019;39:758-769. [PubMed] [DOI] |
| 32. | Markus MR, Meffert PJ, Baumeister SE, Lieb W, Siewert U, Schipf S, Koch M, Kors JA, Felix SB, Dörr M, Targher G, Völzke H. Association between hepatic steatosis and serum liver enzyme levels with atrial fibrillation in the general population: The Study of Health in Pomerania (SHIP). Atherosclerosis. 2016;245:123-131. [PubMed] [DOI] |
| 33. | Mantovani A. NAFLD and risk of cardiac arrhythmias: Is hyperuricemia a neglected pathogenic mechanism? Dig Liver Dis. 2018;50:518-520. [PubMed] [DOI] |
| 34. | Sao R, Aronow WS. Association of non-alcoholic fatty liver disease with cardiovascular disease and subclinical atherosclerosis. Arch Med Sci. 2018;14:1233-1244. [PubMed] [DOI] |
| 35. | VanWagner LB, Ning H, Lewis CE, Shay CM, Wilkins J, Carr JJ, Terry JG, Lloyd-Jones DM, Jacobs DR, Carnethon MR. Associations between nonalcoholic fatty liver disease and subclinical atherosclerosis in middle-aged adults: the Coronary Artery Risk Development in Young Adults Study. Atherosclerosis. 2014;235:599-605. [PubMed] [DOI] |
| 36. | Al Rifai M, Silverman MG, Nasir K, Budoff MJ, Blankstein R, Szklo M, Katz R, Blumenthal RS, Blaha MJ. The association of nonalcoholic fatty liver disease, obesity, and metabolic syndrome, with systemic inflammation and subclinical atherosclerosis: the Multi-Ethnic Study of Atherosclerosis (MESA). Atherosclerosis. 2015;239:629-633. [PubMed] [DOI] |
| 37. | Thakur ML, Sharma S, Kumar A, Bhatt SP, Luthra K, Guleria R, Pandey RM, Vikram NK. Nonalcoholic fatty liver disease is associated with subclinical atherosclerosis independent of obesity and metabolic syndrome in Asian Indians. Atherosclerosis. 2012;223:507-511. [PubMed] [DOI] |
| 38. | Targher G, Bertolini L, Padovani R, Zoppini G, Zenari L, Falezza G. Associations between liver histology and carotid intima-media thickness in patients with nonalcoholic fatty liver disease. Arterioscler Thromb Vasc Biol. 2005;25:2687-2688. [PubMed] [DOI] |
| 39. | Huang Y, Bi Y, Xu M, Ma Z, Xu Y, Wang T, Li M, Liu Y, Lu J, Chen Y, Huang F, Xu B, Zhang J, Wang W, Li X, Ning G. Nonalcoholic fatty liver disease is associated with atherosclerosis in middle-aged and elderly Chinese. Arterioscler Thromb Vasc Biol. 2012;32:2321-2326. [PubMed] [DOI] |
| 40. | Kang JH, Cho KI, Kim SM, Lee JY, Kim JJ, Goo JJ, Kim KN, Jhi JH, Kim DJ, Lee HG, Kim TI. Relationship between Nonalcoholic Fatty Liver Disease and Carotid Artery Atherosclerosis Beyond Metabolic Disorders in Non-Diabetic Patients. J Cardiovasc Ultrasound. 2012;20:126-133. [PubMed] [DOI] |
| 41. | Chung GE, Choi SY, Kim D, Kwak MS, Park HE, Kim MK, Yim JY. Nonalcoholic fatty liver disease as a risk factor of arterial stiffness measured by the cardioankle vascular index. Medicine (Baltimore). 2015;94:e654. [PubMed] [DOI] |
| 42. | Li N, Zhang GW, Zhang JR, Jin D, Li Y, Liu T, Wang RT. Non-alcoholic fatty liver disease is associated with progression of arterial stiffness. Nutr Metab Cardiovasc Dis. 2015;25:218-223. [PubMed] [DOI] |
| 43. | Yu XY, Zhao Y, Song XX, Song ZY. Association between non-alcoholic fatty liver disease and arterial stiffness in the non-obese, non-hypertensive, and non-diabetic young and middle-aged Chinese population. J Zhejiang Univ Sci B. 2014;15:879-887. [PubMed] [DOI] |
| 44. | Alper AT, Hasdemir H, Sahin S, Ontürk E, Akyol A, Nurkalem Z, Cakmak N, Erdinler I, Gürkan K. The relationship between nonalcoholic fatty liver disease and the severity of coronary artery disease in patients with metabolic syndrome. Turk Kardiyol Dern Ars. 2008;36:376-381. [PubMed] |
| 45. | Açikel M, Sunay S, Koplay M, Gündoğdu F, Karakelleoğlu S. Evaluation of ultrasonographic fatty liver and severity of coronary atherosclerosis, and obesity in patients undergoing coronary angiography. Anadolu Kardiyol Derg. 2009;9:273-279. [PubMed] |
| 46. | Sun L, Lü SZ. Association between non-alcoholic fatty liver disease and coronary artery disease severity. Chin Med J (Engl). 2011;124:867-872. [PubMed] |
| 47. | Pisto P, Santaniemi M, Bloigu R, Ukkola O, Kesäniemi YA. Fatty liver predicts the risk for cardiovascular events in middle-aged population: a population-based cohort study. BMJ Open. 2014;4:e004973. [PubMed] [DOI] |
| 48. | Ying I, Saposnik G, Vermeulen MJ, Leung A, Ray JG. Nonalcoholic fatty liver disease and acute ischemic stroke. Epidemiology. 2011;22:129-130. [PubMed] [DOI] |
| 49. | Tana C, Ballestri S, Ricci F, Di Vincenzo A, Ticinesi A, Gallina S, Giamberardino MA, Cipollone F, Sutton R, Vettor R, Fedorowski A, Meschi T. Cardiovascular Risk in Non-Alcoholic Fatty Liver Disease: Mechanisms and Therapeutic Implications. Int J Environ Res Public Health. 2019;16. [PubMed] [DOI] |
| 50. | Palmer ND, Musani SK, Yerges-Armstrong LM, Feitosa MF, Bielak LF, Hernaez R, Kahali B, Carr JJ, Harris TB, Jhun MA, Kardia SL, Langefeld CD, Mosley TH, Norris JM, Smith AV, Taylor HA, Wagenknecht LE, Liu J, Borecki IB, Peyser PA, Speliotes EK. Characterization of European ancestry nonalcoholic fatty liver disease-associated variants in individuals of African and Hispanic descent. Hepatology. 2013;58:966-975. [PubMed] [DOI] |
| 51. | Sookoian S, Pirola CJ. Meta-analysis of the influence of I148M variant of patatin-like phospholipase domain containing 3 gene (PNPLA3) on the susceptibility and histological severity of nonalcoholic fatty liver disease. Hepatology. 2011;53:1883-1894. [PubMed] [DOI] |
| 52. | Paré G, Ridker PM, Rose L, Barbalic M, Dupuis J, Dehghan A, Bis JC, Benjamin EJ, Shiffman D, Parker AN, Chasman DI. Genome-wide association analysis of soluble ICAM-1 concentration reveals novel associations at the NFKBIK, PNPLA3, RELA, and SH2B3 loci. PLoS Genet. 2011;7:e1001374. [PubMed] [DOI] |
| 53. | Kozlitina J, Smagris E, Stender S, Nordestgaard BG, Zhou HH, Tybjærg-Hansen A, Vogt TF, Hobbs HH, Cohen JC. Exome-wide association study identifies a TM6SF2 variant that confers susceptibility to nonalcoholic fatty liver disease. Nat Genet. 2014;46:352-356. [PubMed] [DOI] |
| 54. | Dongiovanni P, Petta S, Maglio C, Fracanzani AL, Pipitone R, Mozzi E, Motta BM, Kaminska D, Rametta R, Grimaudo S, Pelusi S, Montalcini T, Alisi A, Maggioni M, Kärjä V, Borén J, Käkelä P, Di Marco V, Xing C, Nobili V, Dallapiccola B, Craxi A, Pihlajamäki J, Fargion S, Sjöström L, Carlsson LM, Romeo S, Valenti L. Transmembrane 6 superfamily member 2 gene variant disentangles nonalcoholic steatohepatitis from cardiovascular disease. Hepatology. 2015;61:506-514. [PubMed] [DOI] |
| 55. | Holmen OL, Zhang H, Fan Y, Hovelson DH, Schmidt EM, Zhou W, Guo Y, Zhang J, Langhammer A, Løchen ML, Ganesh SK, Vatten L, Skorpen F, Dalen H, Zhang J, Pennathur S, Chen J, Platou C, Mathiesen EB, Wilsgaard T, Njølstad I, Boehnke M, Chen YE, Abecasis GR, Hveem K, Willer CJ. Systematic evaluation of coding variation identifies a candidate causal variant in TM6SF2 influencing total cholesterol and myocardial infarction risk. Nat Genet. 2014;46:345-351. [PubMed] [DOI] |
| 56. | Kailasapathy K, Chin J. Survival and therapeutic potential of probiotic organisms with reference to Lactobacillus acidophilus and Bifidobacterium spp. Immunol Cell Biol. 2000;78:80-88. [PubMed] [DOI] |
| 57. | Loria P, Marchesini G, Nascimbeni F, Ballestri S, Maurantonio M, Carubbi F, Ratziu V, Lonardo A. Cardiovascular risk, lipidemic phenotype and steatosis. A comparative analysis of cirrhotic and non-cirrhotic liver disease due to varying etiology. Atherosclerosis. 2014;232:99-109. [PubMed] [DOI] |
| 58. | Kamo T, Akazawa H, Suda W, Saga-Kamo A, Shimizu Y, Yagi H, Liu Q, Nomura S, Naito AT, Takeda N, Harada M, Toko H, Kumagai H, Ikeda Y, Takimoto E, Suzuki JI, Honda K, Morita H, Hattori M, Komuro I. Dysbiosis and compositional alterations with aging in the gut microbiota of patients with heart failure. PLoS One. 2017;12:e0174099. [PubMed] [DOI] |
| 59. | Pereira ENGDS, Silvares RR, Flores EEI, Rodrigues KL, Ramos IP, da Silva IJ, Machado MP, Miranda RA, Pazos-Moura CC, Gonçalves-de-Albuquerque CF, Faria-Neto HCC, Tibiriça E, Daliry A. Hepatic microvascular dysfunction and increased advanced glycation end products are components of non-alcoholic fatty liver disease. PLoS One. 2017;12:e0179654. [PubMed] [DOI] |
| 60. | Karbach SH, Schönfelder T, Brandão I, Wilms E, Hörmann N, Jäckel S, Schüler R, Finger S, Knorr M, Lagrange J, Brandt M, Waisman A, Kossmann S, Schäfer K, Münzel T, Reinhardt C, Wenzel P. Gut Microbiota Promote Angiotensin II-Induced Arterial Hypertension and Vascular Dysfunction. J Am Heart Assoc. 2016;5. [PubMed] [DOI] |
| 61. | Latea L, Negrea S, Bolboaca S. Primary non-alcoholic fatty liver disease in hypertensive patients. Australas Med J. 2013;6:325-330. [PubMed] [DOI] |
| 62. | Ryoo JH, Suh YJ, Shin HC, Cho YK, Choi JM, Park SK. Clinical association between non-alcoholic fatty liver disease and the development of hypertension. J Gastroenterol Hepatol. 2014;29:1926-1931. [PubMed] [DOI] |
| 63. | Vonghia L, Magrone T, Verrijken A, Michielsen P, Van Gaal L, Jirillo E, Francque S. Peripheral and Hepatic Vein Cytokine Levels in Correlation with Non-Alcoholic Fatty Liver Disease (NAFLD)-Related Metabolic, Histological, and Haemodynamic Features. PLoS One. 2015;10:e0143380. [PubMed] [DOI] |
| 64. | Verrijken A, Francque S, Mertens I, Prawitt J, Caron S, Hubens G, Van Marck E, Staels B, Michielsen P, Van Gaal L. Prothrombotic factors in histologically proven nonalcoholic fatty liver disease and nonalcoholic steatohepatitis. Hepatology. 2014;59:121-129. [PubMed] [DOI] |
| 65. | Jensen MK, Bartz TM, Mukamal KJ, Djoussé L, Kizer JR, Tracy RP, Zieman SJ, Rimm EB, Siscovick DS, Shlipak M, Ix JH. Fetuin-A, type 2 diabetes, and risk of cardiovascular disease in older adults: the cardiovascular health study. Diabetes Care. 2013;36:1222-1228. [PubMed] [DOI] |
| 66. | Ticinesi A, Tana C, Nouvenne A. The intestinal microbiome and its relevance for functionality in older persons. Curr Opin Clin Nutr Metab Care. 2019;22:4-12. [PubMed] [DOI] |
| 67. | Ticinesi A, Nouvenne A, Tana C, Prati B, Cerundolo N, Miraglia C, De' Angelis GL, Di Mario F, Meschi T. The impact of intestinal microbiota on bio-medical research: definitions, techniques and physiology of a "new frontier". Acta Biomed. 2018;89:52-59. [PubMed] [DOI] |
| 68. | Nouvenne A, Ticinesi A, Tana C, Prati B, Catania P, Miraglia C, De' Angelis GL, Di Mario F, Meschi T. Digestive disorders and Intestinal microbiota. Acta Biomed. 2018;89:47-51. [PubMed] [DOI] |
| 69. | Koren O, Spor A, Felin J, Fåk F, Stombaugh J, Tremaroli V, Behre CJ, Knight R, Fagerberg B, Ley RE, Bäckhed F. Human oral, gut, and plaque microbiota in patients with atherosclerosis. Proc Natl Acad Sci USA. 2011;108 Suppl 1:4592-4598. [PubMed] [DOI] |
| 70. | Pastore M, Grimaudo S, Pipitone RM, Lori G, Raggi C, Petta S, Marra F. Role of Myeloid-Epithelial-Reproductive Tyrosine Kinase and Macrophage Polarization in the Progression of Atherosclerotic Lesions Associated With Nonalcoholic Fatty Liver Disease. Front Pharmacol. 2019;10:604. [PubMed] [DOI] |
| 71. | Tilg H, Moschen AR. Evolution of inflammation in nonalcoholic fatty liver disease: the multiple parallel hits hypothesis. Hepatology. 2010;52:1836-1846. [PubMed] [DOI] |
| 72. | Fargion S, Porzio M, Fracanzani AL. Nonalcoholic fatty liver disease and vascular disease: state-of-the-art. World J Gastroenterol. 2014;20:13306-13324. [PubMed] [DOI] |
| 73. | Kleiner DE, Brunt EM. Nonalcoholic fatty liver disease: pathologic patterns and biopsy evaluation in clinical research. Semin Liver Dis. 2012;32:3-13. [PubMed] [DOI] |
| 74. | DI Maira G, Pastore M, Marra F. Liver fibrosis in the context of nonalcoholic steatohepatitis: the role of adipokines. Minerva Gastroenterol Dietol. 2018;64:39-50. [PubMed] [DOI] |
| 75. | Matsuzawa Y, Funahashi T, Kihara S, Shimomura I. Adiponectin and metabolic syndrome. Arterioscler Thromb Vasc Biol. 2004;24:29-33. [PubMed] [DOI] |
| 76. | Alkhouri N, Tamimi TA, Yerian L, Lopez R, Zein NN, Feldstein AE. The inflamed liver and atherosclerosis: a link between histologic severity of nonalcoholic fatty liver disease and increased cardiovascular risk. Dig Dis Sci. 2010;55:2644-2650. [PubMed] [DOI] |
| 77. | Zizzo G, Cohen PL. The PPAR-γ antagonist GW9662 elicits differentiation of M2c-like cells and upregulation of the MerTK/Gas6 axis: a key role for PPAR-γ in human macrophage polarization. J Inflamm (Lond). 2015;12:36. [PubMed] [DOI] |
| 78. | Petta S, Valenti L, Marra F, Grimaudo S, Tripodo C, Bugianesi E, Cammà C, Cappon A, Di Marco V, Di Maira G, Dongiovanni P, Rametta R, Gulino A, Mozzi E, Orlando E, Maggioni M, Pipitone RM, Fargion S, Craxì A. MERTK rs4374383 polymorphism affects the severity of fibrosis in non-alcoholic fatty liver disease. J Hepatol. 2016;64:682-690. [PubMed] [DOI] |
| 79. | Rigamonti E, Chinetti-Gbaguidi G, Staels B. Regulation of macrophage functions by PPAR-alpha, PPAR-gamma, and LXRs in mice and men. Arterioscler Thromb Vasc Biol. 2008;28:1050-1059. [PubMed] [DOI] |
| 80. | Rőszer T, Menéndez-Gutiérrez MP, Cedenilla M, Ricote M. Retinoid X receptors in macrophage biology. Trends Endocrinol Metab. 2013;24:460-468. [PubMed] [DOI] |
| 81. | Chinetti-Gbaguidi G, Baron M, Bouhlel MA, Vanhoutte J, Copin C, Sebti Y, Derudas B, Mayi T, Bories G, Tailleux A, Haulon S, Zawadzki C, Jude B, Staels B. Human atherosclerotic plaque alternative macrophages display low cholesterol handling but high phagocytosis because of distinct activities of the PPARγ and LXRα pathways. Circ Res. 2011;108:985-995. [PubMed] [DOI] |
| 82. | Ait-Oufella H, Pouresmail V, Simon T, Blanc-Brude O, Kinugawa K, Merval R, Offenstadt G, Lesèche G, Cohen PL, Tedgui A, Mallat Z. Defective mer receptor tyrosine kinase signaling in bone marrow cells promotes apoptotic cell accumulation and accelerates atherosclerosis. Arterioscler Thromb Vasc Biol. 2008;28:1429-1431. [PubMed] [DOI] |
| 83. | Musso G, Cassader M, De Michieli F, Paschetta E, Pinach S, Saba F, Bongiovanni D, Framarin L, Berrutti M, Leone N, Corvisieri S, Parente R, Molinaro F, Sircana A, Bo S, Gambino R. MERTK rs4374383 variant predicts incident nonalcoholic fatty liver disease and diabetes: role of mononuclear cell activation and adipokine response to dietary fat. Hum Mol Genet. 2017;26:1785. [PubMed] [DOI] |
| 84. | Li Y, Dalli J, Chiang N, Baron RM, Quintana C, Serhan CN. Plasticity of leukocytic exudates in resolving acute inflammation is regulated by MicroRNA and proresolving mediators. Immunity. 2013;39:885-898. [PubMed] [DOI] |
| 85. | Garbin U, Baggio E, Stranieri C, Pasini A, Manfro S, Mozzini C, Vallerio P, Lipari G, Merigo F, Guidi G, Cominacini L, Fratta Pasini A. Expansion of necrotic core and shedding of Mertk receptor in human carotid plaques: a role for oxidized polyunsaturated fatty acids? Cardiovasc Res. 2013;97:125-133. [PubMed] [DOI] |
| 86. | Kojima Y, Volkmer JP, McKenna K, Civelek M, Lusis AJ, Miller CL, Direnzo D, Nanda V, Ye J, Connolly AJ, Schadt EE, Quertermous T, Betancur P, Maegdefessel L, Matic LP, Hedin U, Weissman IL, Leeper NJ. CD47-blocking antibodies restore phagocytosis and prevent atherosclerosis. Nature. 2016;536:86-90. [PubMed] [DOI] |
| 87. | Bae YS, Lee JH, Choi SH, Kim S, Almazan F, Witztum JL, Miller YI. Macrophages generate reactive oxygen species in response to minimally oxidized low-density lipoprotein: toll-like receptor 4- and spleen tyrosine kinase-dependent activation of NADPH oxidase 2. Circ Res. 2009;104:210-218, 21p following 218. [PubMed] [DOI] |
| 88. | Karunakaran D, Geoffrion M, Wei L, Gan W, Richards L, Shangari P, DeKemp EM, Beanlands RA, Perisic L, Maegdefessel L, Hedin U, Sad S, Guo L, Kolodgie FD, Virmani R, Ruddy T, Rayner KJ. Targeting macrophage necroptosis for therapeutic and diagnostic interventions in atherosclerosis. Sci Adv. 2016;2:e1600224. [PubMed] [DOI] |
| 89. | Cai B, Thorp EB, Doran AC, Subramanian M, Sansbury BE, Lin CS, Spite M, Fredman G, Tabas I. MerTK cleavage limits proresolving mediator biosynthesis and exacerbates tissue inflammation. Proc Natl Acad Sci USA. 2016;113:6526-6531. [PubMed] [DOI] |
| 90. | Mozaffarian D, Benjamin EJ, Go AS, Arnett DK, Blaha MJ, Cushman M, de Ferranti S, Després JP, Fullerton HJ, Howard VJ, Huffman MD, Judd SE, Kissela BM, Lackland DT, Lichtman JH, Lisabeth LD, Liu S, Mackey RH, Matchar DB, McGuire DK, Mohler ER, Moy CS, Muntner P, Mussolino ME, Nasir K, Neumar RW, Nichol G, Palaniappan L, Pandey DK, Reeves MJ, Rodriguez CJ, Sorlie PD, Stein J, Towfighi A, Turan TN, Virani SS, Willey JZ, Woo D, Yeh RW, Turner MB; American Heart Association Statistics Committee and Stroke Statistics Subcommittee. Heart disease and stroke statistics--2015 update: a report from the American Heart Association. Circulation. 2015;131:e29-322. [PubMed] [DOI] |
| 91. | Wang Z, Klipfell E, Bennett BJ, Koeth R, Levison BS, Dugar B, Feldstein AE, Britt EB, Fu X, Chung YM, Wu Y, Schauer P, Smith JD, Allayee H, Tang WH, DiDonato JA, Lusis AJ, Hazen SL. Gut flora metabolism of phosphatidylcholine promotes cardiovascular disease. Nature. 2011;472:57-63. [PubMed] [DOI] |
| 92. | Lau K, Srivatsav V, Rizwan A, Nashed A, Liu R, Shen R, Akhtar M. Bridging the Gap between Gut Microbial Dysbiosis and Cardiovascular Diseases. Nutrients. 2017;9. [PubMed] [DOI] |
| 93. | Ma J, Li H. The Role of Gut Microbiota in Atherosclerosis and Hypertension. Front Pharmacol. 2018;9:1082. [PubMed] [DOI] |
| 94. | Li J, Lin S, Vanhoutte PM, Woo CW, Xu A. Akkermansia Muciniphila Protects Against Atherosclerosis by Preventing Metabolic Endotoxemia-Induced Inflammation in Apoe-/- Mice. Circulation. 2016;133:2434-2446. [PubMed] [DOI] |
| 95. | Kasahara K, Tanoue T, Yamashita T, Yodoi K, Matsumoto T, Emoto T, Mizoguchi T, Hayashi T, Kitano N, Sasaki N, Atarashi K, Honda K, Hirata KI. Commensal bacteria at the crossroad between cholesterol homeostasis and chronic inflammation in atherosclerosis. J Lipid Res. 2017;58:519-528. [PubMed] [DOI] |
| 96. | Chen WY, Wang M, Zhang J, Barve SS, McClain CJ, Joshi-Barve S. Acrolein Disrupts Tight Junction Proteins and Causes Endoplasmic Reticulum Stress-Mediated Epithelial Cell Death Leading to Intestinal Barrier Dysfunction and Permeability. Am J Pathol. 2017;187:2686-2697. [PubMed] [DOI] |
| 97. | Cani PD, Amar J, Iglesias MA, Poggi M, Knauf C, Bastelica D, Neyrinck AM, Fava F, Tuohy KM, Chabo C, Waget A, Delmée E, Cousin B, Sulpice T, Chamontin B, Ferrières J, Tanti JF, Gibson GR, Casteilla L, Delzenne NM, Alessi MC, Burcelin R. Metabolic endotoxemia initiates obesity and insulin resistance. Diabetes. 2007;56:1761-1772. [PubMed] [DOI] |
| 98. | Chacón MR, Lozano-Bartolomé J, Portero-Otín M, Rodríguez MM, Xifra G, Puig J, Blasco G, Ricart W, Chaves FJ, Fernández-Real JM. The gut mycobiome composition is linked to carotid atherosclerosis. Benef Microbes. 2018;9:185-198. [PubMed] [DOI] |
| 99. | Ding Y, Subramanian S, Montes VN, Goodspeed L, Wang S, Han C, Teresa AS, Kim J, O'Brien KD, Chait A. Toll-like receptor 4 deficiency decreases atherosclerosis but does not protect against inflammation in obese low-density lipoprotein receptor-deficient mice. Arterioscler Thromb Vasc Biol. 2012;32:1596-1604. [PubMed] [DOI] |
| 100. | Zhang K, Zhang L, Zhou B, Wang Y, Song Y, Rao L, Zhang L. Lack of association between TLR4 Asp299Gly polymorphism and atherosclerosis: evidence from meta-analysis. Thromb Res. 2012;130:e203-e208. [PubMed] [DOI] |
| 101. | Guzzo C, Ayer A, Basta S, Banfield BW, Gee K. IL-27 enhances LPS-induced proinflammatory cytokine production via upregulation of TLR4 expression and signaling in human monocytes. J Immunol. 2012;188:864-873. [PubMed] [DOI] |
| 102. | Karlsson FH, Fåk F, Nookaew I, Tremaroli V, Fagerberg B, Petranovic D, Bäckhed F, Nielsen J. Symptomatic atherosclerosis is associated with an altered gut metagenome. Nat Commun. 2012;3:1245. [PubMed] [DOI] |
| 103. | Philpott DJ, Sorbara MT, Robertson SJ, Croitoru K, Girardin SE. NOD proteins: regulators of inflammation in health and disease. Nat Rev Immunol. 2014;14:9-23. [PubMed] [DOI] |
| 104. | Kanno S, Nishio H, Tanaka T, Motomura Y, Murata K, Ihara K, Onimaru M, Yamasaki S, Kono H, Sueishi K, Hara T. Activation of an innate immune receptor, Nod1, accelerates atherogenesis in Apoe-/- mice. J Immunol. 2015;194:773-780. [PubMed] [DOI] |
| 105. | Kholy KE, Genco RJ, Van Dyke TE. Oral infections and cardiovascular disease. Trends Endocrinol Metab. 2015;26:315-321. [PubMed] [DOI] |
| 106. | Wang Z, Tang WH, Buffa JA, Fu X, Britt EB, Koeth RA, Levison BS, Fan Y, Wu Y, Hazen SL. Prognostic value of choline and betaine depends on intestinal microbiota-generated metabolite trimethylamine-N-oxide. Eur Heart J. 2014;35:904-910. [PubMed] [DOI] |
| 107. | Miao J, Ling AV, Manthena PV, Gearing ME, Graham MJ, Crooke RM, Croce KJ, Esquejo RM, Clish CB; Morbid Obesity Study Group, Vicent D, Biddinger SB. Flavin-containing monooxygenase 3 as a potential player in diabetes-associated atherosclerosis. Nat Commun. 2015;6:6498. [PubMed] [DOI] |
| 108. | Chen K, Zheng X, Feng M, Li D, Zhang H. Gut Microbiota-Dependent Metabolite Trimethylamine N-Oxide Contributes to Cardiac Dysfunction in Western Diet-Induced Obese Mice. Front Physiol. 2017;8:139. [PubMed] [DOI] |
| 109. | Trøseid M, Ueland T, Hov JR, Svardal A, Gregersen I, Dahl CP, Aakhus S, Gude E, Bjørndal B, Halvorsen B, Karlsen TH, Aukrust P, Gullestad L, Berge RK, Yndestad A. Microbiota-dependent metabolite trimethylamine-N-oxide is associated with disease severity and survival of patients with chronic heart failure. J Intern Med. 2015;277:717-726. [PubMed] [DOI] |
| 110. | Koeth RA, Wang Z, Levison BS, Buffa JA, Org E, Sheehy BT, Britt EB, Fu X, Wu Y, Li L, Smith JD, DiDonato JA, Chen J, Li H, Wu GD, Lewis JD, Warrier M, Brown JM, Krauss RM, Tang WH, Bushman FD, Lusis AJ, Hazen SL. Intestinal microbiota metabolism of L-carnitine, a nutrient in red meat, promotes atherosclerosis. Nat Med. 2013;19:576-585. [PubMed] [DOI] |
| 111. | Zhu W, Gregory JC, Org E, Buffa JA, Gupta N, Wang Z, Li L, Fu X, Wu Y, Mehrabian M, Sartor RB, McIntyre TM, Silverstein RL, Tang WHW, DiDonato JA, Brown JM, Lusis AJ, Hazen SL. Gut Microbial Metabolite TMAO Enhances Platelet Hyperreactivity and Thrombosis Risk. Cell. 2016;165:111-124. [PubMed] [DOI] |
| 112. | Zheng Y, Li Y, Rimm EB, Hu FB, Albert CM, Rexrode KM, Manson JE, Qi L. Dietary phosphatidylcholine and risk of all-cause and cardiovascular-specific mortality among US women and men. Am J Clin Nutr. 2016;104:173-180. [PubMed] [DOI] |
| 113. | Bidulescu A, Chambless LE, Siega-Riz AM, Zeisel SH, Heiss G. Usual choline and betaine dietary intake and incident coronary heart disease: the Atherosclerosis Risk in Communities (ARIC) study. BMC Cardiovasc Disord. 2007;7:20. [PubMed] [DOI] |
| 114. | Dalmeijer GW, Olthof MR, Verhoef P, Bots ML, van der Schouw YT. Prospective study on dietary intakes of folate, betaine, and choline and cardiovascular disease risk in women. Eur J Clin Nutr. 2008;62:386-394. [PubMed] [DOI] |
| 115. | Zheng X, Huang F, Zhao A, Lei S, Zhang Y, Xie G, Chen T, Qu C, Rajani C, Dong B, Li D, Jia W. Bile acid is a significant host factor shaping the gut microbiome of diet-induced obese mice. BMC Biol. 2017;15:120. [PubMed] [DOI] |
| 116. | Joyce SA, Gahan CG. Disease-Associated Changes in Bile Acid Profiles and Links to Altered Gut Microbiota. Dig Dis. 2017;35:169-177. [PubMed] [DOI] |
| 117. | Brown JM, Hazen SL. Microbial modulation of cardiovascular disease. Nat Rev Microbiol. 2018;16:171-181. [PubMed] [DOI] |
| 118. | Tremaroli V, Bäckhed F. Functional interactions between the gut microbiota and host metabolism. Nature. 2012;489:242-249. [PubMed] [DOI] |
| 119. | Wahlström A, Sayin SI, Marschall HU, Bäckhed F. Intestinal Crosstalk between Bile Acids and Microbiota and Its Impact on Host Metabolism. Cell Metab. 2016;24:41-50. [PubMed] [DOI] |
| 120. | Li T, Chiang JY. Bile acids as metabolic regulators. Curr Opin Gastroenterol. 2015;31:159-165. [PubMed] [DOI] |
| 121. | Sui Y, Xu J, Rios-Pilier J, Zhou C. Deficiency of PXR decreases atherosclerosis in apoE-deficient mice. J Lipid Res. 2011;52:1652-1659. [PubMed] [DOI] |
| 122. | Szeto FL, Reardon CA, Yoon D, Wang Y, Wong KE, Chen Y, Kong J, Liu SQ, Thadhani R, Getz GS, Li YC. Vitamin D receptor signaling inhibits atherosclerosis in mice. Mol Endocrinol. 2012;26:1091-1101. [PubMed] [DOI] |
| 123. | Skoura A, Michaud J, Im DS, Thangada S, Xiong Y, Smith JD, Hla T. Sphingosine-1-phosphate receptor-2 function in myeloid cells regulates vascular inflammation and atherosclerosis. Arterioscler Thromb Vasc Biol. 2011;31:81-85. [PubMed] [DOI] |
| 124. | Yamashiro K, Tanaka R, Urabe T, Ueno Y, Yamashiro Y, Nomoto K, Takahashi T, Tsuji H, Asahara T, Hattori N. Gut dysbiosis is associated with metabolism and systemic inflammation in patients with ischemic stroke. PLoS One. 2017;12:e0171521. [PubMed] [DOI] |
| 125. | Yang T, Santisteban MM, Rodriguez V, Li E, Ahmari N, Carvajal JM, Zadeh M, Gong M, Qi Y, Zubcevic J, Sahay B, Pepine CJ, Raizada MK, Mohamadzadeh M. Gut dysbiosis is linked to hypertension. Hypertension. 2015;65:1331-1340. [PubMed] [DOI] |
| 126. | Koh A, De Vadder F, Kovatcheva-Datchary P, Bäckhed F. From Dietary Fiber to Host Physiology: Short-Chain Fatty Acids as Key Bacterial Metabolites. Cell. 2016;165:1332-1345. [PubMed] [DOI] |
| 127. | Rey FE, Faith JJ, Bain J, Muehlbauer MJ, Stevens RD, Newgard CB, Gordon JI. Dissecting the in vivo metabolic potential of two human gut acetogens. J Biol Chem. 2010;285:22082-22090. [PubMed] [DOI] |
| 128. | Louis P, Flint HJ. Formation of propionate and butyrate by the human colonic microbiota. Environ Microbiol. 2017;19:29-41. [PubMed] [DOI] |
| 129. | Marques FZ, Nelson E, Chu PY, Horlock D, Fiedler A, Ziemann M, Tan JK, Kuruppu S, Rajapakse NW, El-Osta A, Mackay CR, Kaye DM. High-Fiber Diet and Acetate Supplementation Change the Gut Microbiota and Prevent the Development of Hypertension and Heart Failure in Hypertensive Mice. Circulation. 2017;135:964-977. [PubMed] [DOI] |
| 130. | Natarajan N, Hori D, Flavahan S, Steppan J, Flavahan NA, Berkowitz DE, Pluznick JL. Microbial short chain fatty acid metabolites lower blood pressure via endothelial G protein-coupled receptor 41. Physiol Genomics. 2016;48:826-834. [PubMed] [DOI] |
| 131. | Miyamoto J, Kasubuchi M, Nakajima A, Irie J, Itoh H, Kimura I. The role of short-chain fatty acid on blood pressure regulation. Curr Opin Nephrol Hypertens. 2016;25:379-383. [PubMed] [DOI] |
| 132. | Pluznick JL. Renal and cardiovascular sensory receptors and blood pressure regulation. Am J Physiol Renal Physiol. 2013;305:F439-F444. [PubMed] [DOI] |
| 133. | Santisteban MM, Qi Y, Zubcevic J, Kim S, Yang T, Shenoy V, Cole-Jeffrey CT, Lobaton GO, Stewart DC, Rubiano A, Simmons CS, Garcia-Pereira F, Johnson RD, Pepine CJ, Raizada MK. Hypertension-Linked Pathophysiological Alterations in the Gut. Circ Res. 2017;120:312-323. [PubMed] [DOI] |
| 134. | Shao C, Ye J, Li F, Lin Y, Wu T, Wang W, Feng S, Zhong B. Early Predictors of Cardiovascular Disease Risk in Nonalcoholic Fatty Liver Disease: Non-obese Versus Obese Patients. Dig Dis Sci. 2019;. [PubMed] [DOI] |