修回日期: 2020-03-31
接受日期: 2020-04-11
在线出版日期: 2020-04-28
消化内镜和外科手术是治疗坏死性胰腺炎的两种主要有创方式, 但比较二者疗效和安全性的研究尚缺乏.
系统评价消化内镜和外科手术治疗坏死性胰腺炎的疗效和安全性.
检索PubMed、EMBASE、Cochrane Library、中国知网、万方和中国生物医学文献数据库2000-01/2019-06发表的比较内镜和手术治疗坏死性胰腺炎的随机对照研究(randomized control trials, RCT)和队列研究, 使用Revman5.3软件进行数据分析.
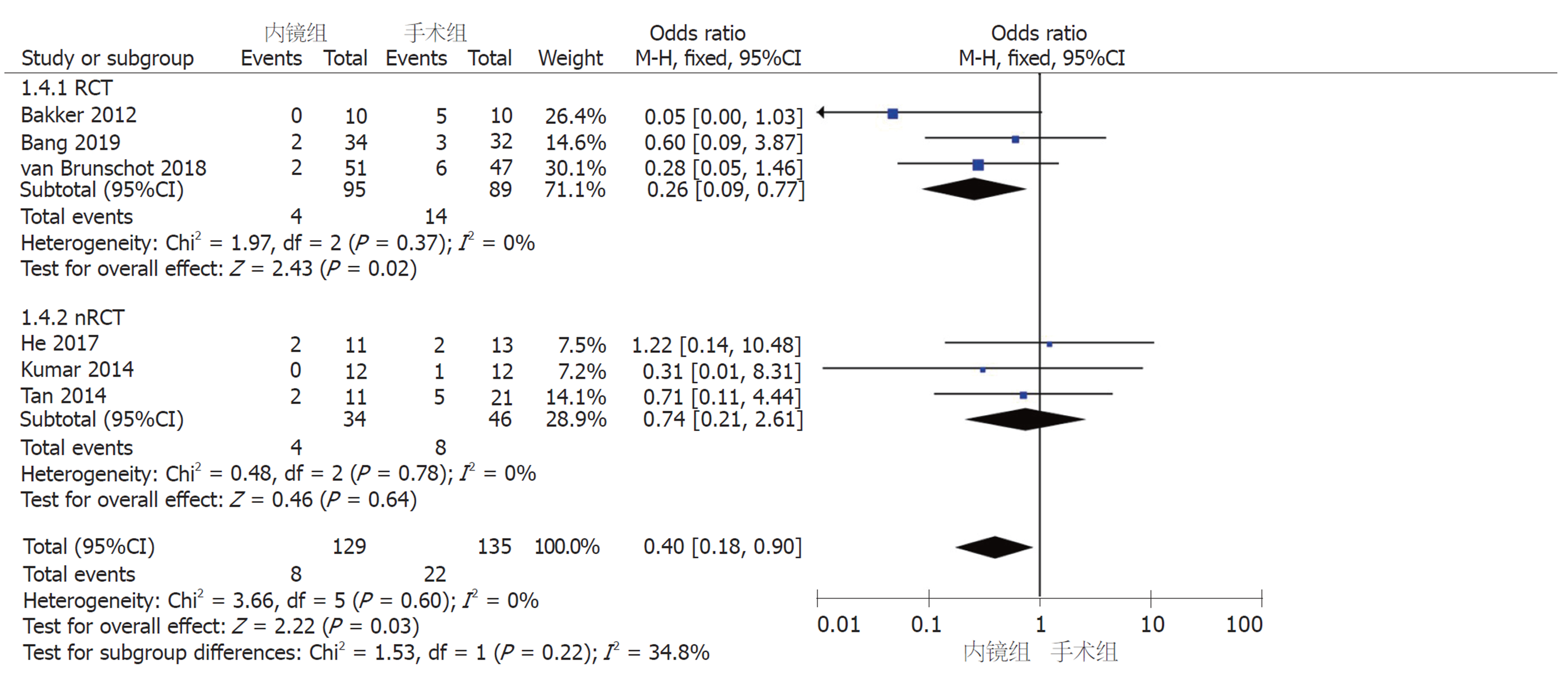
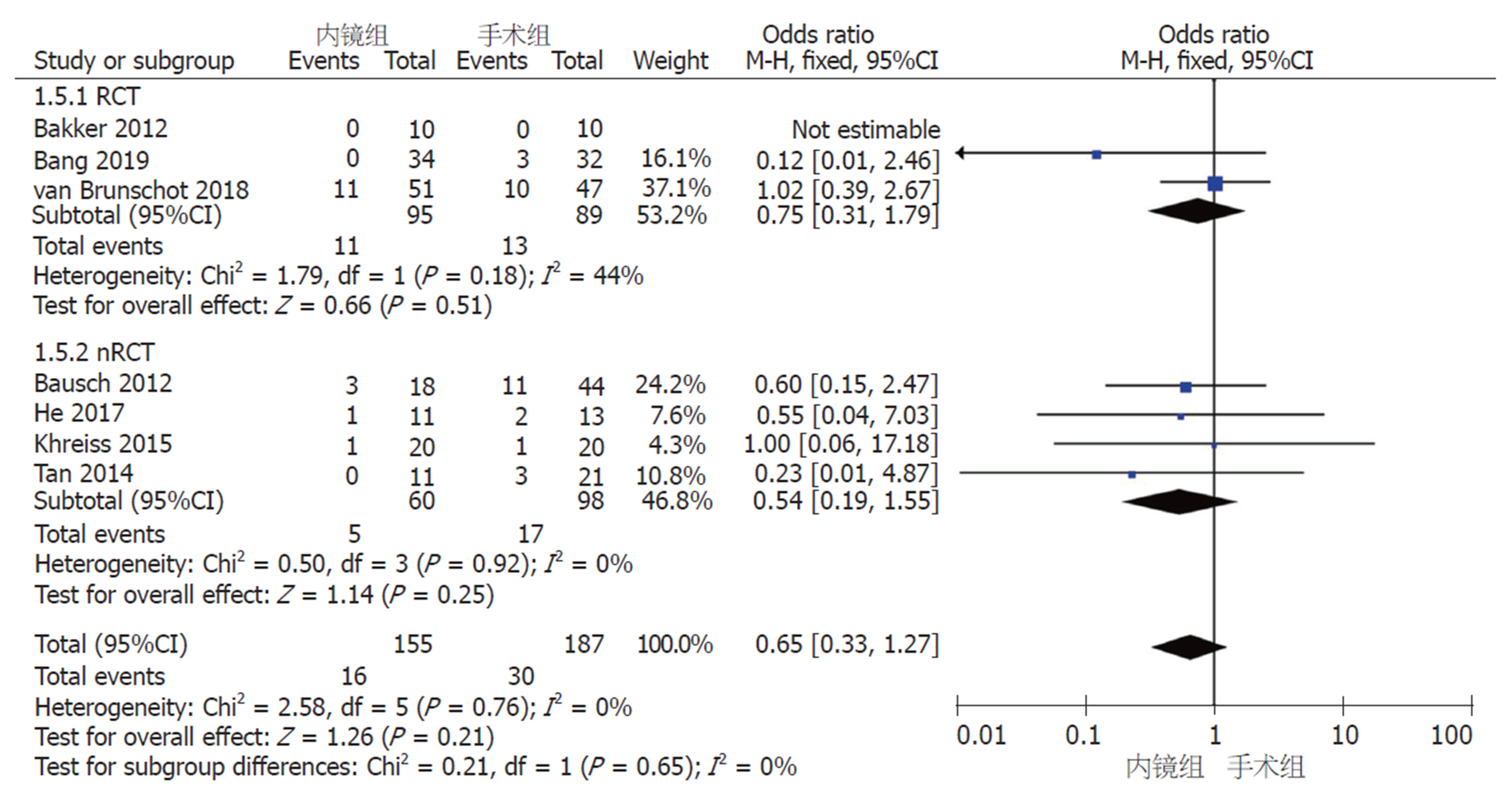
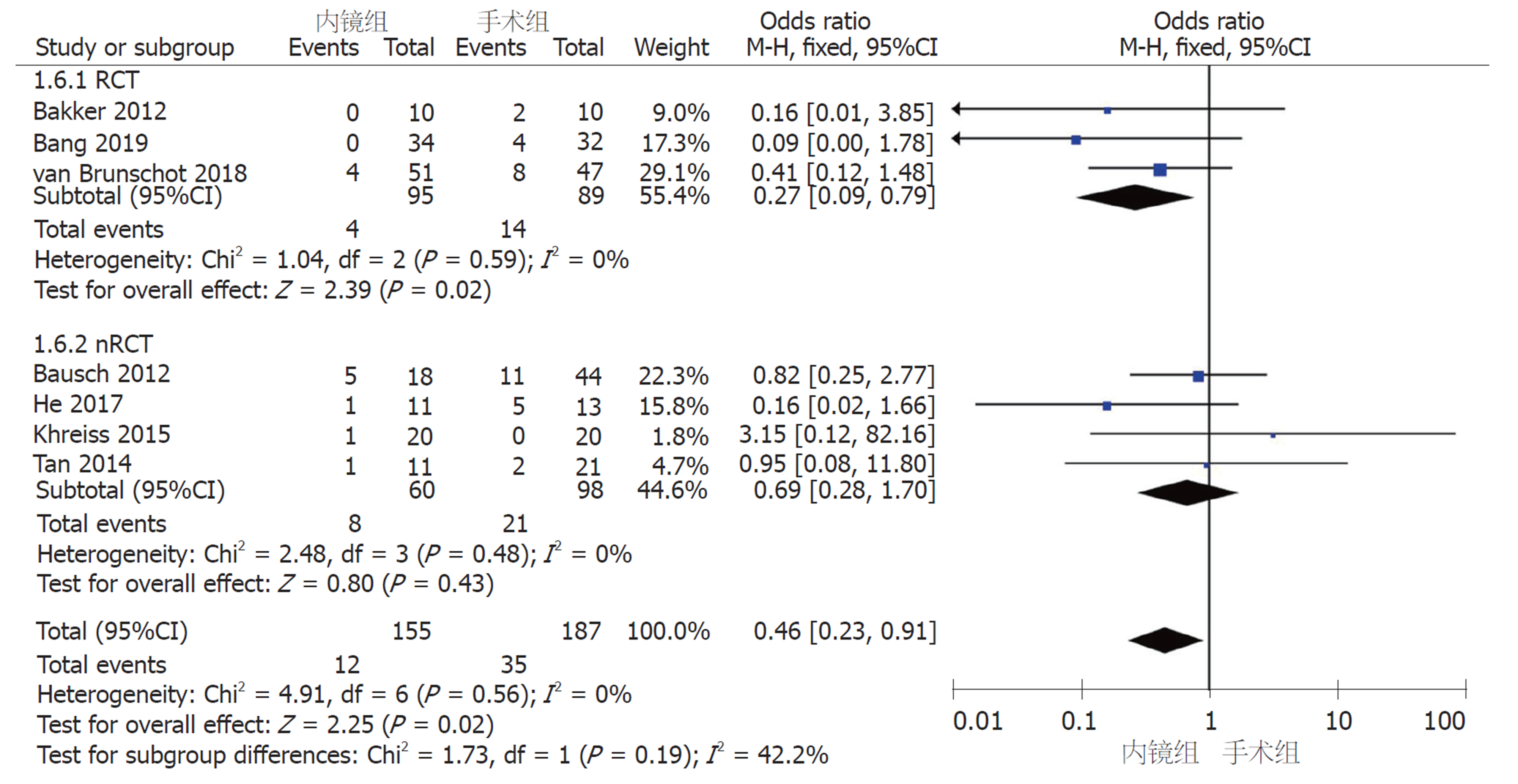
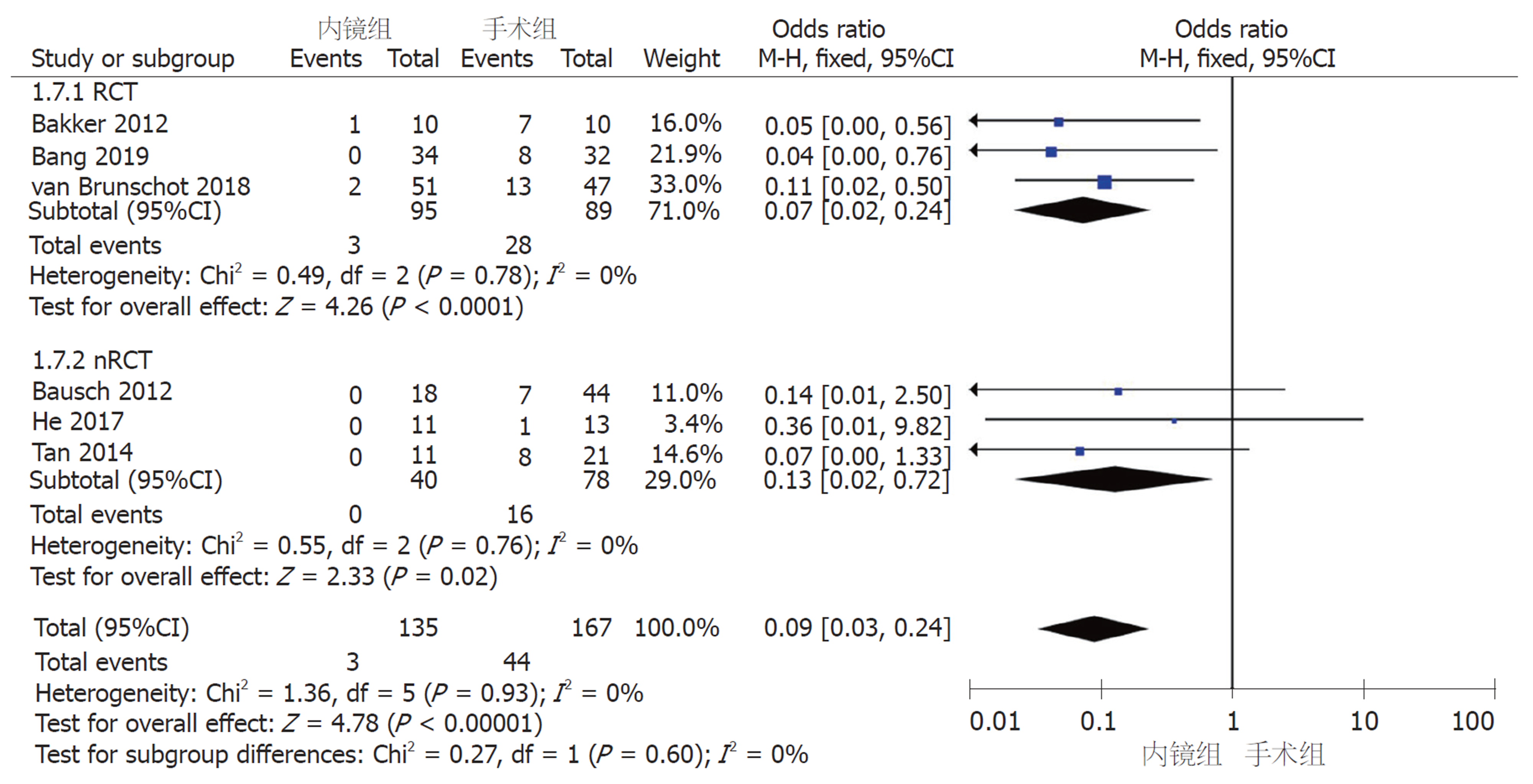
共纳入8篇文献, 其中3篇为RCT, 5篇为队列研究. 患者总数366例, 其中内镜组167例, 手术组199例. Meta分析结果显示: 内镜组和手术组在临床缓解率(OR = 1.3, 95%CI: 0.58-2.92, P = 0.52)、复合结局变量--主要并发症或死亡(RR = 0.46, 95%CI: 0.17-1.27, P = 0.14)和死亡率(OR = 0.78, 95%CI: 0.37-1.56, P = 0.52)上无统计学差异. 术后并发症中, 内镜组相比于手术组, 新发器官衰竭(OR = 0.40, 95%CI: 0.18-0.90, P = 0.03)、肠皮瘘或消化道穿孔(OR = 0.46, 95%CI: 0.23-0.91, P = 0.02)、胰瘘(OR = 0.09, 95%CI: 0.03-0.24, P<0.00001)的发生率显著降低; 而两组间术后腹腔出血、胰腺内分泌和胰腺外分泌功能不全的发生率无统计学差异.
内镜和手术治疗坏死性胰腺炎的疗效无显著差异, 但内镜可显著降低术后并发症的发生率.
核心提要: 目前比较内镜和手术治疗治疗坏死性胰腺炎疗效和安全性的研究较少. 本研究通过Meta分析发现两种治疗方法疗效相当, 但内镜可显著降低术后并发症的发生率, 提示内镜治疗的安全性显著高于手术.
引文著录: 周颖, 高志强, 张学松. 内镜与手术治疗坏死性胰腺炎疗效和安全性的Meta分析. 世界华人消化杂志 2020; 28(8): 285-295
Revised: March 31, 2020
Accepted: April 11, 2020
Published online: April 28, 2020
Endoscopy and surgery are the two major invasive interventions for necrotizing pancreatitis. However, studies comparing their efficacy and safety are lacking.
To systemically compare the efficacy and safety of endoscopic and surgical interventions for necrotizing pancreatitis.
PubMed, EMBASE, Cochrane Library, CNKI, Wanfang database, and Sino Med were searched to identify all randomized control trials (RCT) and cohort studies comparing the efficacy and safety of endoscopic vs surgical management of necrotizing pancreatitis from January 2000 to June 2019. Revman 5.3 was used for statistical analysis.
A total of eight studies were included, with three RCT and five cohort studies. The total number of patients involved was 366, with 167 in the endoscopy group and 199 in the surgery group. Meta-analysis showed no significant difference between the two groups in clinical remission (odds ratio [OR] = 1.3, 95% confidence interval [CI]: 0.58-2.92, P = 0.52), primary composite endpoint (relative risk [RR] = 0.46, 95%CI: 0.17-1.27, P = 0.14), or mortality (OR = 0.78, 95%CI: 0.37-1.56, P = 0.52). Compared to surgery, endoscopic therapy significantly reduced the rates of postoperative complications including new-onset organ failure (OR = 0.40, 95%CI: 0.18-0.90, P = 0.03), enterocutaneous fistula or perforation of a visceral organ (OR = 0.46, 95%CI: 0.23-0.91, P = 0.02), and pancreatic fistula (OR = 0.09, 95%CI: 0.03-0.24, P < 0.00001).
Endoscopic treatment, as compared to surgery, significantly reduces complications in patients with necrotizing pancreatitis.
- Citation: Zhou Y, Gao ZQ, Zhang XS. Efficacy and safety of endoscopic vs surgical management of necrotizing pancreatitis: A meta-analysis. Shijie Huaren Xiaohua Zazhi 2020; 28(8): 285-295
- URL: https://www.wjgnet.com/1009-3079/full/v28/i8/285.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v28.i8.285
急性坏死型胰腺炎(acute necrotizing pancreatitis, ANP)约占所有急性胰腺炎的20%, ANP有创干预率(38%)较急性间质水肿型胰腺炎显著升高[1]. ANP中约30%患者出现坏死组织的继发感染, 即感染性胰腺坏死(infected pancreatic necrosis, IPN), 往往需要有创干预治疗; 此外有持续症状的包裹性坏死也是有创干预的指征[2,3].
传统的有创干预方法是开放性手术清除坏死组织, 但随着微创技术的普及, 经皮穿刺引流(percutaneous catheter drainage, PCD)、腹腔镜下胰腺囊肿胃吻合引流术(laparoscopic cystogastrostomy, LC)和可视镜下后腹膜清创术(video-assisted retroperitoneal debridement, VARD)逐渐作为外科首选治疗[1]. 近年来, 随着内镜技术的发展, 内镜下经胃后腹膜胰腺坏死引流(endoscopic transgastric drainage, ETD)和清创术(endoscopic transgastric necrosectomy, ETN)不断得到推广和应用[4]. 外科和内镜治疗方法均可以采用升阶梯方法, PCD或ETD引流效果欠佳者可进一步进行腔镜或内镜下清创术[5]. 比较内镜和手术治疗ANP疗效和安全性的研究不多, 多为回顾性观察性研究, 近期有两个随机对照试验结果发表[6,7], 为ANP的有创治疗提供了更高级别的循证医学证据. 本文通过对2000-01/2019-06间有关消化内镜和手术治疗ANP的研究进行Meta分析, 并就二者的疗效和安全性进行比较.
1.1.1 文献检索方法: 检索英文数据库PubMed、EMBASE、Cochrane Library, 中文数据库中国知网、万方和中国生物医学文献数据库. 英文检索词(包括主题词和自由词): necrotizing pancreatitis, endoscopy, surgery; 中文检索词: 坏死性胰腺炎、内镜、手术. 检索年限: 2000-01/2019-06. 检索语言为英语和中文. 检索员至少2人.
1.1.2 文献纳入标准: (1)诊断为坏死性胰腺炎且有指征进行有创治疗, 包括IPN和有持续性症状的无菌性坏死/包裹性坏死; (2)有创干预方式包括内镜治疗和手术治疗, 且同时比较两种治疗方式; 内镜治疗包括ETD和ETN, 以及上述内镜治疗方式的升阶梯方法; 手术治疗方式包括PCD、LC、VARD和开腹清创术(open necrosectomy, ON), 以及上述手术方式的升阶梯方法; (3)研究类型: 前瞻性随机对照研究(randomized control trials, RCT)、前瞻性或回顾性队列研究.
1.1.3 文献排除标准: (1)病例报道和未对内镜、手术治疗方式进行比较的观察性研究; (2)未汇报主要结局变量的研究; (3)手术治疗中仅采用PCD、即使治疗效果不佳也未采用微创或开放手术清创的研究; (4)既往接受过坏死性胰腺炎的有创治疗.
1.1.4 结局变量: 临床缓解率、复合结局变量(主要并发症或死亡)、死亡率、主要并发症(包括新发器官衰竭、腹腔出血、肠皮瘘或消化道穿孔、胰瘘)和次要并发症(胰腺内分泌功能不全、外分泌功能不全).
1.2.1 干预方法: 分为内镜治疗组和手术治疗组.
1.2.2 数据提取: 由两位研究员使用统一的表格独立进行数据提取, 不一致的地方进行协商后决定. 提取的数据包括: 文献题目、作者、发表时间、研究设计方法、样本量、基线疾病严重程度(包括APACHE评分、器官衰竭、CTSI评分)、临床缓解率、复合结局变量、死亡率、主要并发症和次要并发症.
1.2.3 文献的质量评价: (1)RCT采用Cochrane随机试验风险评估工具, 包括7个条目--随机序列产生(选择偏倚)、分配偏倚(选择偏倚)、对研究者和受试者施盲(实施偏倚)、结局数据的完整性(随访偏倚)、选择性报告研究结果(报告偏倚)及其他来源(其他偏倚)对偏倚风险的评估; (2)队列研究: 采用Newcastle-Ottawa量表. 通过三大块共8个条目的方法评价队列研究, 具体包括研究人群选择、可比性、暴露评价或结果评价. Newcastle-Ottawa量表采用星级系统的半量化原则, 满分为9分.
统计学处理 使用Review Manager 5.3软件进行Meta分析, 对二分类变量计算OR或RR, 各效应量均以95%CI表示, P<0.05为差异有统计学意义. 用I2定量分析异质性, I2<50%认为无明显异质性, 采用固定效应模型分析; I2≥50%认为存在明显异质性, 则采用随机效应模型分析. 因同时纳入RCT和观察性研究, 根据研究类型(是否为RCT)进行亚组分析以分析异质性来源. 通过逐一剔除单个研究进行敏感性分析, 以判断其对合并效应量的影响及Meta分析结果的稳定性. 根据Cochrane推荐, 如果纳入文献数量不少于10篇, 发表偏倚通过漏斗图来识别.
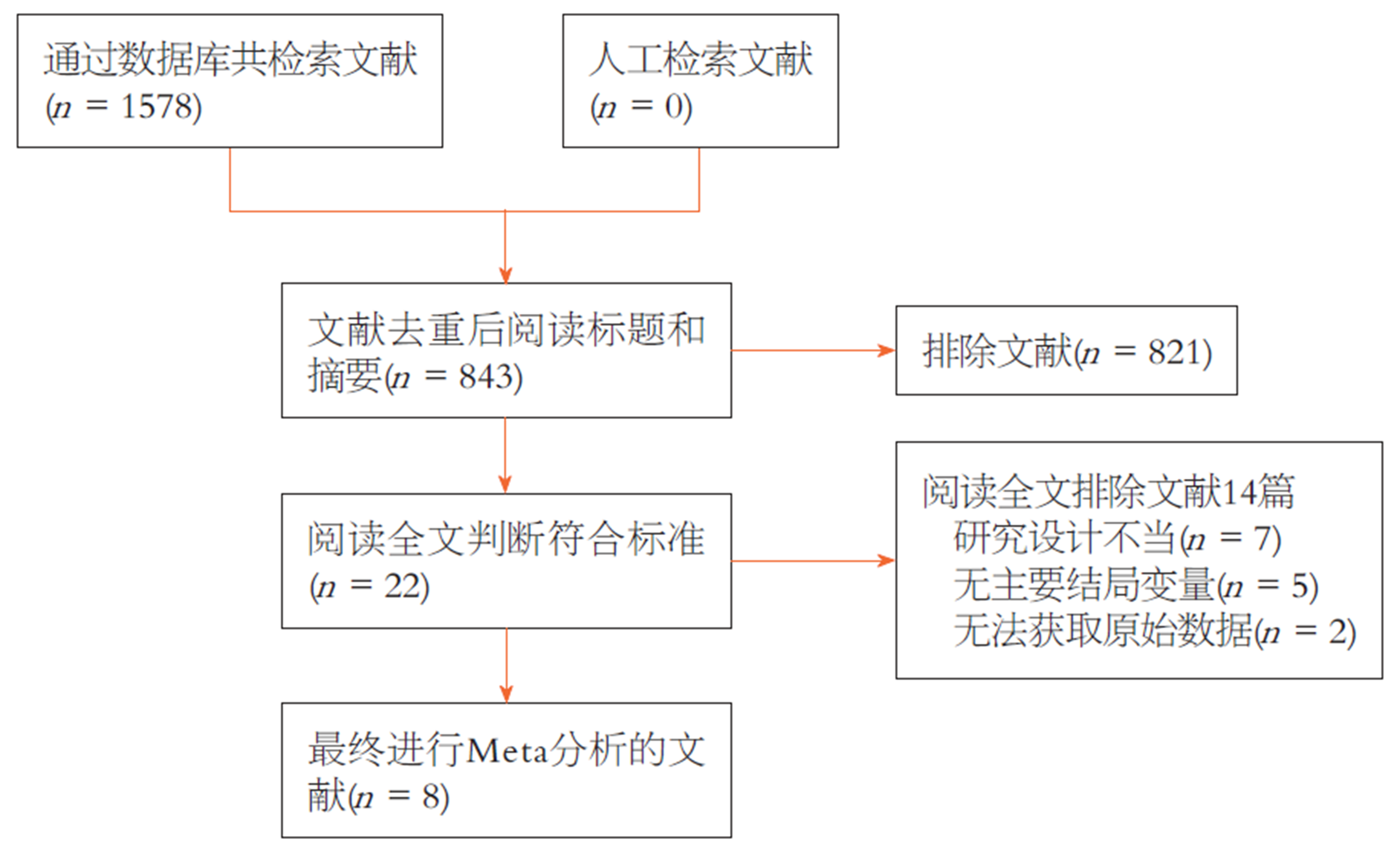
根据Cochrane系统检索策略, 共检索文献1578篇. 通过剔除重复、浏览标题、摘要和阅读全文等筛选后, 最终纳入8篇文献进行Meta分析, 检索流程图见图1. 纳入的8篇文献中3篇为RCT[6-8], 1篇为前瞻性队列研究[9], 4篇为回顾性队列研究[10-13]. 患者总数366例, 其中内镜组167例, 手术组199例. 纳入研究的基线资料见表1. RCT和队列研究的质量评估分别见表2和表3.
| Ref. | 国家 | 研究设计 | 纳入患者 | 干预措施 | 例数 | APACHE II (IQR) | 器官衰竭, n (%) | CTSI (IQR) | |||
| 内镜/手术 | 内镜 | 手术 | 内镜 | 手术 | 内镜 | 手术 | |||||
| Bakker et al[8], 2012 | 荷兰 | RCT | IPN | ETN vs VARD+ON1 | 10/10 | 10 (6-14) | 11 (7-14) | 4 (40) | 4 (40) | 8 (4-10) | 8 (4-10) |
| van Brunschot et al [18], 2018 | 荷兰 | RCT | IPN | ETN+ETN vs PCD+VARD | 51/47 | 9 (5-13) | 10 (6-13) | 22 (43) | 21 (45) | 6 (6-8) | 8 (6-10) |
| Bang et al[7], 2019 | 美国 | RCT | IPN | ETD+ETN vs LC+VARD1 | 34/32 | 30 (26-35) | 21 (16-23) | 9 (26.5) | 10 (31.3) | 33 (97.1)a | 29 (90.6)a |
| Bausch et al[10], 2012 | 德国 | RCS | IPN/WON | ETN vs VARD+ON | 18/44 | NA | NA | 0 | 24 (54.5) | NA | NA |
| Kumar et al[11], 2014 | 美国 | RCS | IPN/WON | ETN vs LC+ON | 12/12 | 10.1±1.1 | 9.4±1.2 | 0 | 1 (8.3) | 8.3±0.8 | 7.8±0.8 |
| Tan et al[12], 2014 | 法国 | RCS | IPN | ETD+ETN vs ON | 11/21 | 9 (5-11) | 12 (10-16) | 1 (9) | 13 (60) | 8 (5-8) | 6 (5-6) |
| Khreiss et al[13], 2015 | 美国 | RCS | WON | ETD+ETN vs LC | 20/20 | NA | NA | NA | NA | NA | NA |
| He et al[9], 2017 | 中国 | PCS | IPN | ETD+ETN vs PCD+ON | 11/13 | 7 (6-10) | 10 (8-14) | 2 (18.2) | 4 (30.8) | 5 (4-8) | 6 (4-8) |
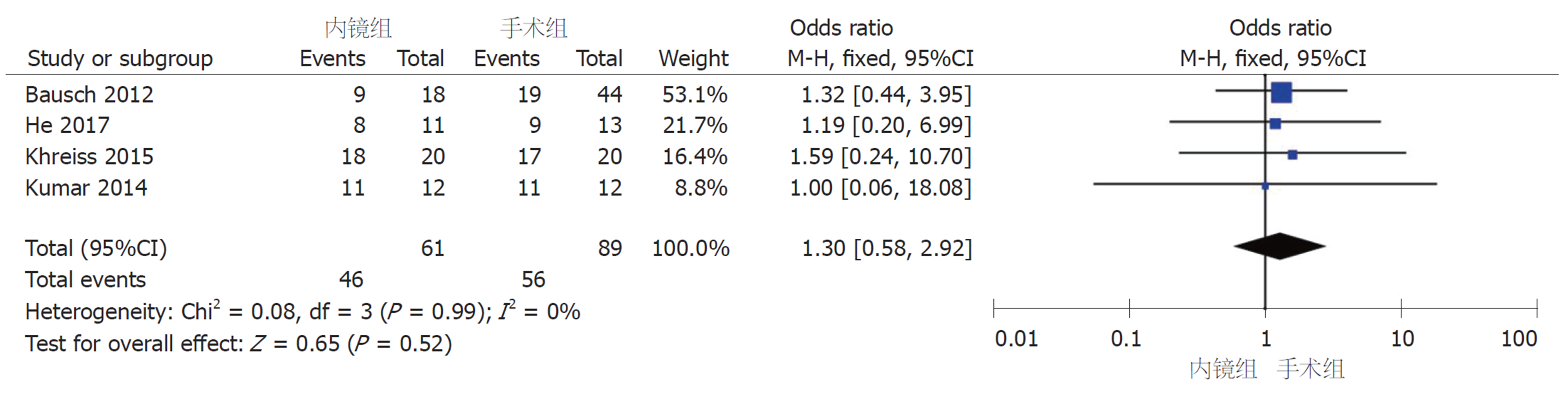
2.2.1 临床缓解率: 4篇队列研究报道了临床缓解率, 组间无明显异质性(I2 = 0%, P = 0.99), 采用固定效应模型进行Meta分析, 结果显示内镜组和手术组的临床缓解率无显著差异(OR = 1.3, 95%CI: 0.58-2.92, P = 0.52)(图2).
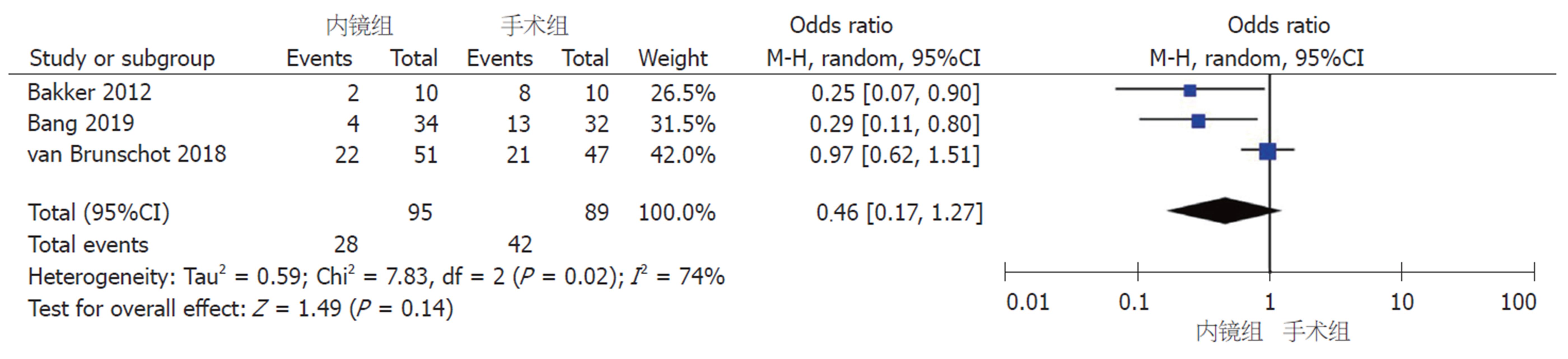
2.2.2 复合结局变量(主要并发症或死亡): 3个RCT均报道了随访6 mo期间出现的复合结局变量. 组间异质性显著(I2 = 74%, P = 0.02), 采用随机效应模型进行Meta分析, 结果显示内镜组和手术组之间无显著差异(RR = 0.46, 95%CI: 0.17-1.27, P = 0.14)(图3).
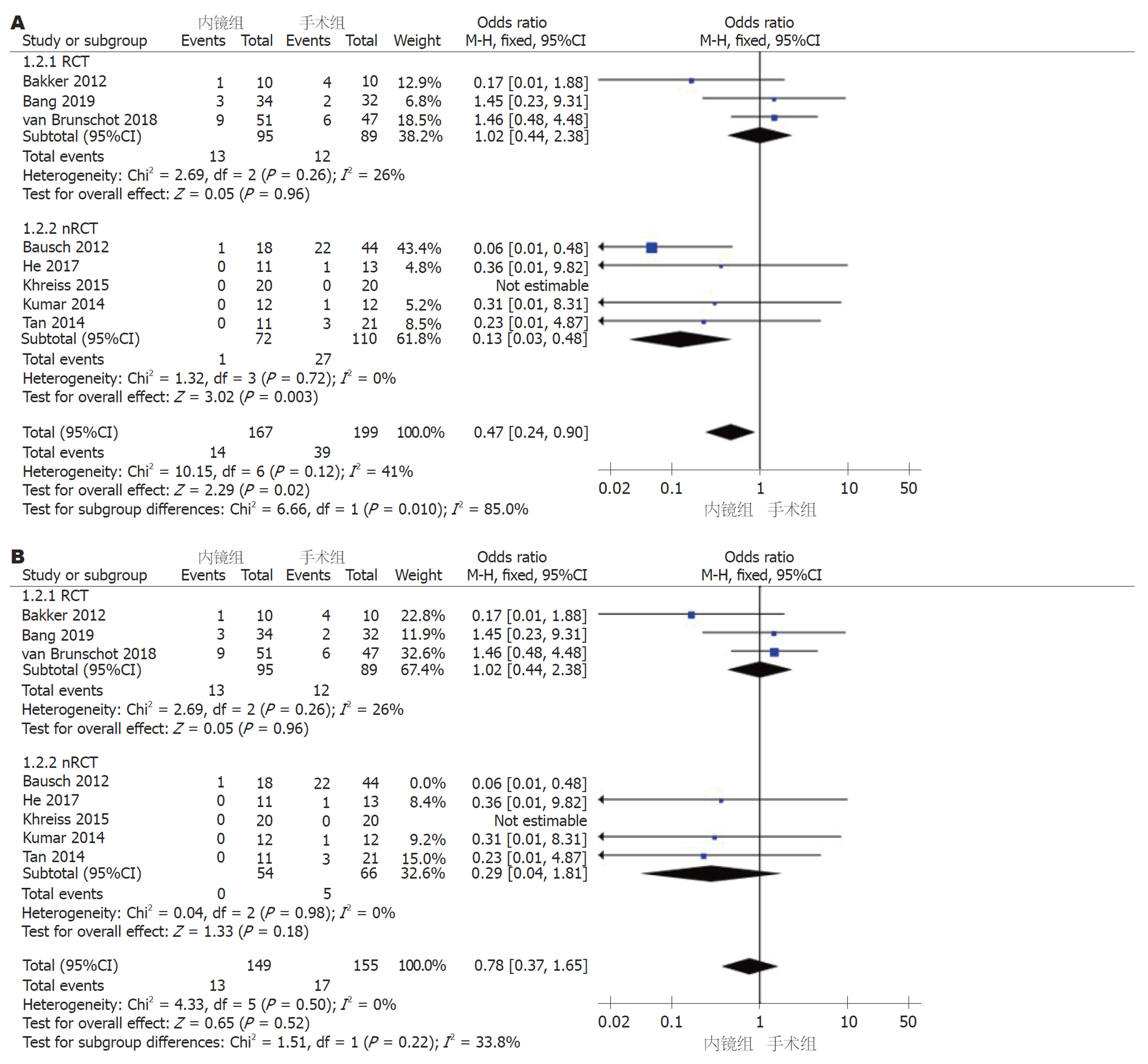
2.2.3 死亡率: 8篇文献均报道了死亡率, 采用固定效应模型(I2 = 41%, P = 0.12)进行Meta分析, 汇总8个研究及nRCT亚组中内镜组和手术组间的死亡率存在显著差异(nRCT亚组: OR = 0.13, 95%CI: 0.03-0.48, P = 0.003; OR = 0.47, 95%CI: 0.24-0.90, P = 0.02); RCT亚组中, 两组间无显著差异(OR = 1.02, 95%CI: 0.44-2.38, P = 0.96)(图4A). 通过敏感性分析剔除一个研究(Bausch等[10], 2012)后可以得到同质性更高的结果(I2 = 0%, P = 0.50), 汇总及nRCT亚组中内镜组与手术组间的死亡率亦无显著性差异(nRCT亚组: OR = 0.29, 95%CI: 0.04-1.81, P = 0.18; 汇总: OR = 0.78, 95%CI: 0.37-1.56, P = 0.52)(图4B).
2.2.4 术后并发症: (1)新发器官衰竭: 6篇研究报道了术后新发器官衰竭例数. 采用固定效应模型(I2 = 0%, P = 0.60)进行Meta分析, nRCT亚组中, 内镜组和手术组间无显著差异(OR = 0.74, 95%CI: 0.21-2.61, P = 0.64); RCT亚组及汇总6篇研究, 两组间存在显著性差异(RCT亚组: OR = 0.26, 95%CI: 0.09-0.77, P = 0.02; 汇总: OR = 0.40, 95%CI: 0.18-0.90, P = 0.03)(图5); (2)腹腔出血: 7篇研究报道了术后腹腔出血例数. 采用固定效应模型(I2 = 0%, P = 0.76)进行Meta分析, 无论是RCT和nRCT亚组还是汇总7个研究, 内镜组和手术组间均无显著差异(RCT亚组: OR = 0.75, 95%CI: 0.31-1.79, P = 0.51; nRCT亚组: OR = 0.54, 95%CI: 0.19-1.55, P = 0.25; 汇总: OR = 0.65, 95%CI: 0.33-1.27, P = 0.21)(图6); (3)肠皮瘘或消化道穿孔: 7篇研究报道了术后肠皮瘘或消化道穿孔例数. 采用固定效应模型(I2 = 0%, P = 0.56)进行Meta分析, nRCT亚组中, 内镜组和手术组间无显著差异(OR = 0.69, 95%CI: 0.28-1.70, P = 0.43); RCT亚组及汇总7篇研究, 两组间存在显著性差异(RCT亚组: OR = 0.27, 95%CI: 0.09-0.79, P = 0.02; 汇总: OR = 0.46, 95%CI: 0.23-0.91, P = 0.02)(图7); (4)胰瘘: 6篇研究报道了术后胰瘘例数. 采用固定效应模型(I2 = 0%, P = 0.93)进行Meta分析, 无论是RCT和nRCT亚组还是汇总6个研究, 内镜组和手术组间均存在显著差异(RCT亚组: OR = 0.07, 95%CI: 0.02-0.24, P<0.0001; nRCT亚组: OR = 0.13, 95%CI: 0.02-0.72, P = 0.02; 汇总: OR = 0.09, 95%CI: 0.03-0.24, P<0.00001)(图8).
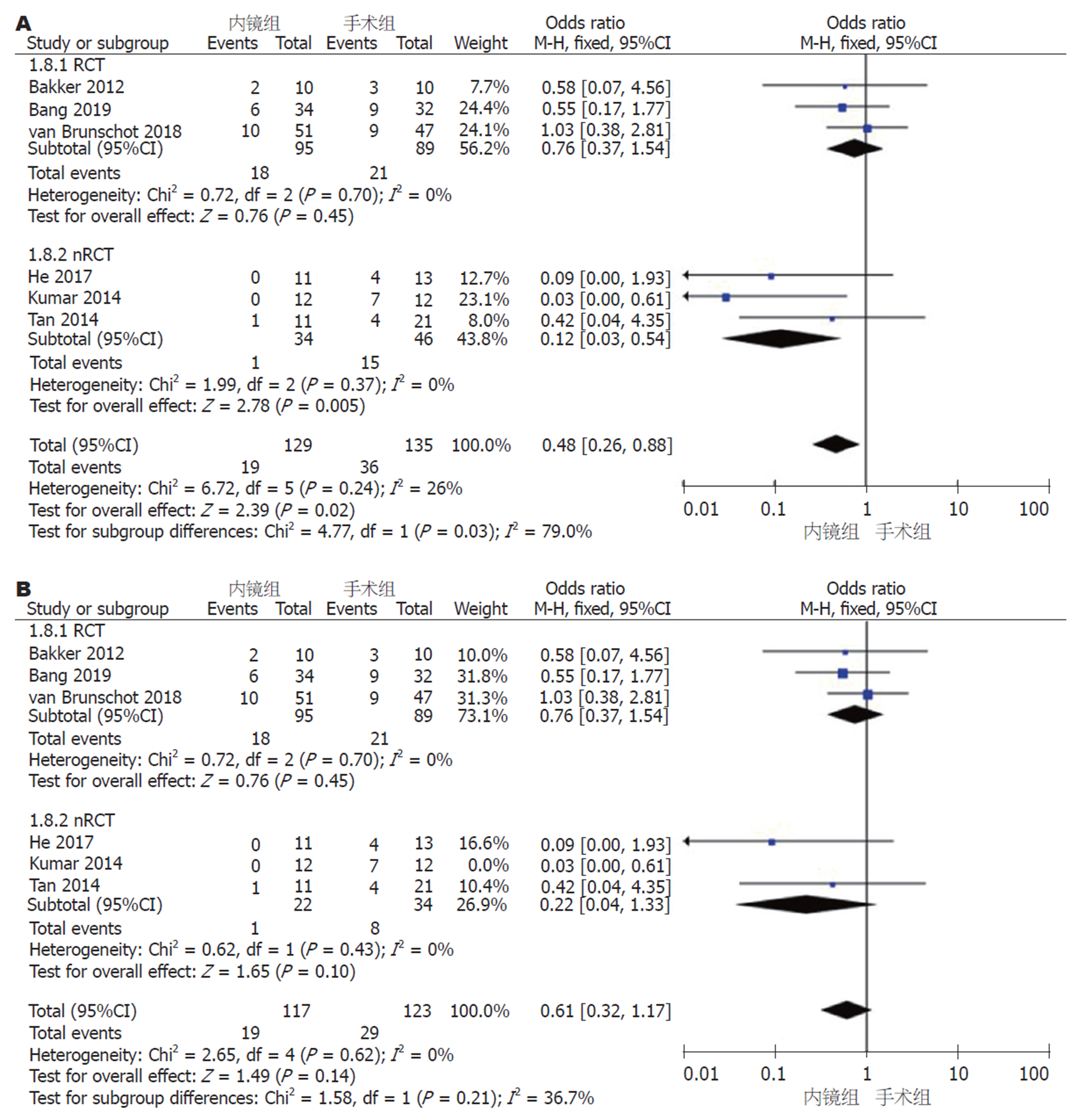
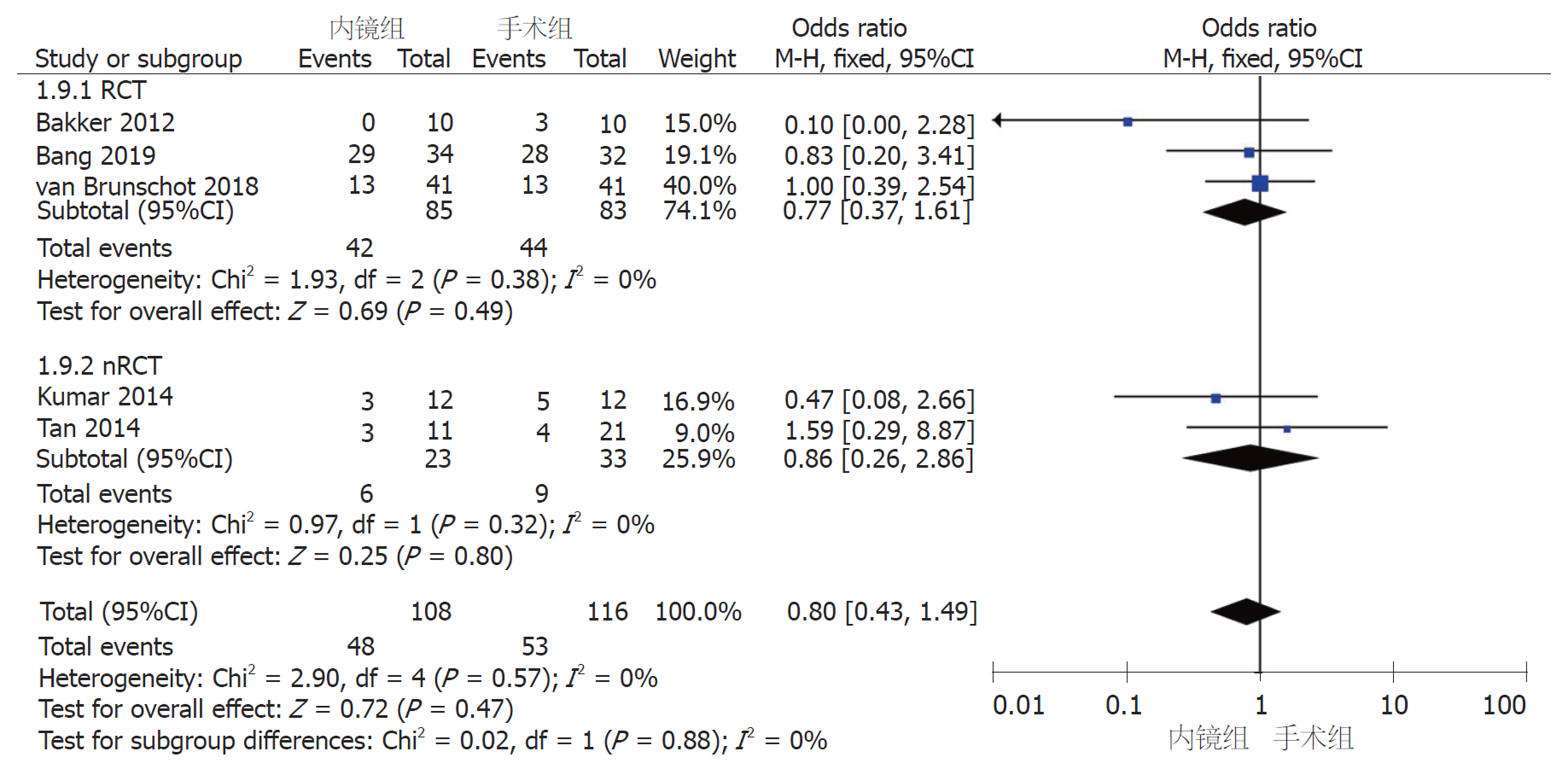
2.2.5 次要并发症: (1)胰腺内分泌功能不全: 6篇文献报道了术后内分泌功能不全例数. 采用固定效应模型(I2 = 26%, P = 0.24)进行Meta分析, nRCT亚组和汇总结果中, 内镜组和手术组间存在显著差异(nRCT亚组: OR = 0.12, 95%CI: 0.03-0.54, P = 0.005; 汇总: OR = 0.48, 95%CI: 0.26-0.88, P = 0.02); RCT亚组中, 两组间无显著差异(OR = 0.76, 95%CI: 0.37-2.38, I2 = 0%, P = 0.45)(图9A). 通过敏感性分析剔除一个研究(Kumar等[11], 2014)后可以得到同质性更高的结果(I2 = 0%, P = 0.62), nRCT亚组和汇总的术后内分泌功能不全均无显著性差异(nRCT亚组: OR = 0.22, 95%CI: 0.04-1.33, P = 0.10; 汇总: OR = 0.61, 95%CI: 0.32-1.17, P = 0.14)(图9B); (2)胰腺外分泌功能不全: 5篇研究报道了术后胰腺外分泌功能不全的例数. 采用固定效应模型(I2 = 0%, P = 0.57)进行Meta分析, 无论是RCT和nRCT亚组还是汇总5个研究, 内镜组和手术组间均无显著差异(RCT亚组: OR = 0.77, 95%CI: 0.37-1.61, P = 0.49; nRCT亚组: OR = 0.86, 95%CI: 0.26-2.86, P = 0.80; 汇总: OR = 0.80, 95%CI: 0.43-1.49, P = 0.47)(图10).
本研究通过Meta分析比较了内镜和手术治疗坏死性胰腺炎的疗效和安全性. 结果表明, 两组间临床缓解率无显著差异, 提示疗效相当; 但内镜治疗相比于手术可显著降低复合结局变量中3种并发症的发生率, 分别是新发器官衰竭、肠皮瘘或消化道穿孔以及胰瘘, 说明内镜治疗的安全性高于手术治疗. 该研究结果有利于指导未来坏死性胰腺炎的首选有创治疗方式.
最新版《中国急性胰腺炎诊治指南(2019, 沈阳)》[14]指出, 感染性坏死和有症状的无菌性坏死是有创治疗的主要适应症. 过去十余年, 坏死性胰腺炎的有创治疗方法中传统开腹清创已逐渐被微创外科手术取代[1,15,16]. 2010年发表的一项高质量RCT结果显示, 微创手术可显著降低死亡率和术后并发症, 此后发表的多篇系统评价也得出了相同的结论[15,17,18]. 随着内镜技术的发展, 内镜下引流和清创技术(ETD和ETN)不断得到应用, 单臂荟萃分析也肯定了内镜治疗的有效性和安全性[4,19].
一直到近期, 比较内镜和手术治疗坏死性胰腺炎优劣的研究不多, 大多是回顾性队列研究, 存在大量混杂因素导致结果可信度不高. 近两年发表的两篇RCT为该领域提供了较高质量循证医学证据[6,7]. 到目前为止共有3个RCT比较内镜和手术治疗坏死性胰腺炎的疗效和安全性, 但单个研究的病例数有限, 且每个研究采用的内镜或手术治疗方法不尽相同, 研究结果也有差异; 此外RCT仅纳入IPN患者, 而未考虑有症状的无菌性坏死, 结论适用范围受到限制. 因此本研究综合已发表的所有临床研究结果, 共纳入3个RCT和5个研究质量较高的队列研究, 系统评价内镜和手术治疗坏死性胰腺炎(包括IPN和WON)的优劣, 为指导坏死性胰腺炎的有创治疗选择提供了中级证据.
检索文献发现既往也有该主题的Meta分析发表[20-22]. 2018年和2019年分别发表了一篇该领域最新且样本量较大的RCT研究[6,7], 罗德等[20]和Hu等[22]的Meta分析未纳入这两个RCT, 此外罗德等的研究未纳入一篇质量较高的前瞻性队列研究[9]. Bang等[21]的研究仅纳入了3个RCT, 研究对象局限于感染性胰腺坏死患者, 虽然研究方法质量较高, 但病例数少、不适用于有症状的无菌性坏死患者. 本研究对上述Meta分析进行了更新, 且同时纳入RCT和质量较高的队列研究, 研究对象同时覆盖感染性胰腺坏死和有症状的无菌性坏死, 研究结果更全面、更具可推广性.
当然, 本研究也存在一定局限性. 因考虑到研究和病例数量有限, 同时纳入了RCT和队列研究, 不同的研究方法可能导致纳入研究的异质性增加, 产生偏倚. 本研究设定了严格的纳入和排除标准, 对各结局变量进行RCT和非RCT亚组分析, 并对异质性较高的结局变量进行敏感性分析. 通过以上三种方法, 本研究纳入的研究质量较高, 各结局变量不同研究间的异质性低, 保证了最终Meta分析结果的可靠性. 此外, 因纳入文献总数不足10篇, 通过漏斗图识别发表偏倚存在一定困难性.
综上所述, 我们的Meta分析结果显示, 内镜和手术治疗坏死性胰腺炎的疗效无显著差异; 但相比于手术, 内镜治疗可显著降低术后并发症(包括新发器官衰竭、肠皮瘘或消化道穿孔和胰瘘)的发生率. 因此, 在内镜操作技术成熟、胰腺坏死位于内镜操作可及位置的情况下, 可将内镜作为坏死性胰腺炎有创治疗的一线方法. 未来的研究应关注操作技术的规范化以及治疗流程的优化, 为临床医生提供更具操作性的治疗方案.
坏死性胰腺炎的有创治疗方式主要有消化内镜和外科手术. 以往比较两者安全性和疗效的研究较少且多为回顾性研究, 但近期发表了两篇该领域高质量随机对照研究(randomized control trials, RCT)结果. 因此对已有研究进行荟萃分析有望为该领域提供更高级别的循证医学证据.
本研究拟就内镜和手术治疗坏死性胰腺炎的临床研究进系统评价和荟萃分析, 对二者的疗效和安全性进行比较. 为临床工作中选择坏死性胰腺炎的有创治疗方式提供可靠指导.
本研究的目标是对比较内镜和手术治疗坏死性胰腺炎的RCT和队列研究进行Meta分析, 得出两者在疗效和安全性上的优劣, 为指导坏死性胰腺炎的有创治疗选择提供更高级别的循证医学证据.
本研究检索了多个中英文数据库2000-01/2019-06发表的比较内镜和手术治疗坏死性胰腺炎的RCT和队列研究, 提取临床缓解率、复合结局变量(主要并发症或死亡)、死亡率、主要和次要并发症等结局变量, 采用Revman 5.3软件进行数据分析, 并进行亚组分析和敏感性分析.
本研究通过Meta分析比较了内镜和手术治疗坏死性胰腺炎在疗效和安全性上的优劣, 达到了上述实验目标. 共纳入3篇RCT和5篇队列研究, 患者总数366例, 内镜组和手术组分别为167和199例. Meta分析结果显示: 内镜组和手术组在临床缓解率、复合结局变量(主要并发症或死亡)和死亡率上无统计学差异. 术后并发症中, 内镜组相比于手术组, 新发器官衰竭(OR = 0.40, 95%CI: 0.18-0.90, P = 0.03)、肠皮瘘或消化道穿孔(OR = 0.46, 95%CI: 0.23-0.91, P = 0.02)、胰瘘(OR = 0.09, 95%CI: 0.03-0.24, P<0.00001)的发生率显著降低; 两组间术后腹腔出血、胰腺内分泌和外分泌功能不全的发生率无统计学差异. 本研究结果更新了该领域的循证医学证据, 为指导坏死性胰腺炎的有创治疗选择提供了中级证据.
本研究通过Meta分析发现内镜和手术治疗坏死性胰腺炎的疗效相当, 但相比手术, 内镜可显著降低新发器官衰竭、肠皮瘘或消化道穿孔和胰瘘等术后并发症的发生率, 提示内镜治疗的安全性高于手术. 该结果有利于指导临床工作中对坏死性胰腺炎有创治疗方式的选择.
本研究虽然通过严格的纳入和排除标准对纳入研究进行了层层筛选, 但各研究间的研究方法尤其是内镜和手术的具体操作技术和流程仍存在较大异质性. 因此, 未来的研究应关注操作技术的规范化以及治疗流程的优化, 为临床医生提供更具操作性的治疗方案.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): A
B级 (非常好): 0
C级 (良好): 0
D级 (一般): 0
E级 (差): 0
编辑: 王禹乔 电编:刘继红
| 1. | van Santvoort HC, Bakker OJ, Bollen TL, Besselink MG, Ahmed Ali U, Schrijver AM, Boermeester MA, van Goor H, Dejong CH, van Eijck CH, van Ramshorst B, Schaapherder AF, van der Harst E, Hofker S, Nieuwenhuijs VB, Brink MA, Kruyt PM, Manusama ER, van der Schelling GP, Karsten T, Hesselink EJ, van Laarhoven CJ, Rosman C, Bosscha K, de Wit RJ, Houdijk AP, Cuesta MA, Wahab PJ, Gooszen HG; Dutch Pancreatitis Study Group. A conservative and minimally invasive approach to necrotizing pancreatitis improves outcome. Gastroenterology. 2011;141:1254-1263. [PubMed] [DOI] |
| 2. | Arvanitakis M, Dumonceau JM, Albert J, Badaoui A, Bali MA, Barthet M, Besselink M, Deviere J, Oliveira Ferreira A, Gyökeres T, Hritz I, Hucl T, Milashka M, Papanikolaou IS, Poley JW, Seewald S, Vanbiervliet G, van Lienden K, van Santvoort H, Voermans R, Delhaye M, van Hooft J. Endoscopic management of acute necrotizing pancreatitis: European Society of Gastrointestinal Endoscopy (ESGE) evidence-based multidisciplinary guidelines. Endoscopy. 2018;50:524-546. [PubMed] [DOI] |
| 3. | Gluck M, Ross A, Irani S, Lin O, Hauptmann E, Siegal J, Fotoohi M, Crane R, Robinson D, Kozarek RA. Endoscopic and percutaneous drainage of symptomatic walled-off pancreatic necrosis reduces hospital stay and radiographic resources. Clin Gastroenterol Hepatol. 2010;8:1083-1088. [PubMed] [DOI] |
| 4. | van Brunschot S, Fockens P, Bakker OJ, Besselink MG, Voermans RP, Poley JW, Gooszen HG, Bruno M, van Santvoort HC. Endoscopic transluminal necrosectomy in necrotising pancreatitis: a systematic review. Surg Endosc. 2014;28:1425-1438. [PubMed] [DOI] |
| 5. | Baron TH, DiMaio CJ, Wang AY, Morgan KA. American Gastroenterological Association Clinical Practice Update: Management of Pancreatic Necrosis. Gastroenterology. 2020;158:67-75.e1. [PubMed] [DOI] |
| 6. | van Brunschot S, van Grinsven J, van Santvoort HC, Bakker OJ, Besselink MG, Boermeester MA, Bollen TL, Bosscha K, Bouwense SA, Bruno MJ, Cappendijk VC, Consten EC, Dejong CH, van Eijck CH, Erkelens WG, van Goor H, van Grevenstein WMU, Haveman JW, Hofker SH, Jansen JM, Laméris JS, van Lienden KP, Meijssen MA, Mulder CJ, Nieuwenhuijs VB, Poley JW, Quispel R, de Ridder RJ, Römkens TE, Scheepers JJ, Schepers NJ, Schwartz MP, Seerden T, Spanier BWM, Straathof JWA, Strijker M, Timmer R, Venneman NG, Vleggaar FP, Voermans RP, Witteman BJ, Gooszen HG, Dijkgraaf MG, Fockens P; Dutch Pancreatitis Study Group. Endoscopic or surgical step-up approach for infected necrotising pancreatitis: a multicentre randomised trial. Lancet. 2018;391:51-58. [PubMed] [DOI] |
| 7. | Bang JY, Arnoletti JP, Holt BA, Sutton B, Hasan MK, Navaneethan U, Feranec N, Wilcox CM, Tharian B, Hawes RH, Varadarajulu S. An Endoscopic Transluminal Approach, Compared With Minimally Invasive Surgery, Reduces Complications and Costs for Patients With Necrotizing Pancreatitis. Gastroenterology. 2019;156:1027-1040.e3. [PubMed] [DOI] |
| 8. | Bakker OJ, van Santvoort HC, van Brunschot S, Geskus RB, Besselink MG, Bollen TL, van Eijck CH, Fockens P, Hazebroek EJ, Nijmeijer RM, Poley JW, van Ramshorst B, Vleggaar FP, Boermeester MA, Gooszen HG, Weusten BL, Timmer R; Dutch Pancreatitis Study Group. Endoscopic transgastric vs surgical necrosectomy for infected necrotizing pancreatitis: a randomized trial. JAMA. 2012;307:1053-1061. [PubMed] [DOI] |
| 9. | He WH, Zhu Y, Zhu Y, Liu P, Zeng H, Xia L, Yu C, Chen HM, Shu X, Liu ZJ, Chen YX, Lu NH. The outcomes of initial endoscopic transluminal drainage are superior to percutaneous drainage for patients with infected pancreatic necrosis: a prospective cohort study. Surg Endosc. 2017;31:3004-3013. [PubMed] [DOI] |
| 10. | Bausch D, Wellner U, Kahl S, Kuesters S, Richter-Schrag HJ, Utzolino S, Hopt UT, Keck T, Fischer A. Minimally invasive operations for acute necrotizing pancreatitis: comparison of minimally invasive retroperitoneal necrosectomy with endoscopic transgastric necrosectomy. Surgery. 2012;152:S128-S134. [PubMed] [DOI] |
| 11. | Kumar N, Conwell DL, Thompson CC. Direct endoscopic necrosectomy versus step-up approach for walled-off pancreatic necrosis: comparison of clinical outcome and health care utilization. Pancreas. 2014;43:1334-1339. [PubMed] [DOI] |
| 12. | Tan V, Charachon A, Lescot T, Chafaï N, Le Baleur Y, Delchier JC, Paye F. Endoscopic transgastric versus surgical necrosectomy in infected pancreatic necrosis. Clin Res Hepatol Gastroenterol. 2014;38:770-776. [PubMed] [DOI] |
| 13. | Khreiss M, Zenati M, Clifford A, Lee KK, Hogg ME, Slivka A, Chennat J, Gelrud A, Zeh HJ, Papachristou GI, Zureikat AH. Cyst Gastrostomy and Necrosectomy for the Management of Sterile Walled-Off Pancreatic Necrosis: a Comparison of Minimally Invasive Surgical and Endoscopic Outcomes at a High-Volume Pancreatic Center. J Gastrointest Surg. 2015;19:1441-1448. [PubMed] [DOI] |
| 14. | 中华医学会消化病学分会胰腺疾病学组, 《中华胰腺病杂志》编辑委员会, 《中华消化杂志》编辑委员会. 中国急性胰腺炎诊治指南(2019,沈阳). 中华胰腺病杂志. 2019;19:321-331. [DOI] |
| 15. | van Santvoort HC, Besselink MG, Bakker OJ, Hofker HS, Boermeester MA, Dejong CH, van Goor H, Schaapherder AF, van Eijck CH, Bollen TL, van Ramshorst B, Nieuwenhuijs VB, Timmer R, Laméris JS, Kruyt PM, Manusama ER, van der Harst E, van der Schelling GP, Karsten T, Hesselink EJ, van Laarhoven CJ, Rosman C, Bosscha K, de Wit RJ, Houdijk AP, van Leeuwen MS, Buskens E, Gooszen HG; Dutch Pancreatitis Study Group. A step-up approach or open necrosectomy for necrotizing pancreatitis. N Engl J Med. 2010;362:1491-1502. [PubMed] [DOI] |
| 16. | 勾 善淼, 吴 河水, 张 宇舜, 熊 炯炘, 周 峰, 赵 刚, 殷 涛, 杨 明, 彭 涛, 崔 静, 周 伟, 郭 尧, 王 博, 刘 志强, 周 笑笑, 王 春友. 坏死性胰腺炎外科干预模式的变迁及其疗效分析. 中华外科杂志. 2019;57:733-737. [DOI] |
| 17. | Gurusamy KS, Belgaumkar AP, Haswell A, Pereira SP, Davidson BR. Interventions for necrotising pancreatitis. Cochrane Database Syst Rev. 2016;4:CD011383. [PubMed] [DOI] |
| 18. | van Brunschot S, Hollemans RA, Bakker OJ, Besselink MG, Baron TH, Beger HG, Boermeester MA, Bollen TL, Bruno MJ, Carter R, French JJ, Coelho D, Dahl B, Dijkgraaf MG, Doctor N, Fagenholz PJ, Farkas G, Castillo CFD, Fockens P, Freeman ML, Gardner TB, Goor HV, Gooszen HG, Hannink G, Lochan R, McKay CJ, Neoptolemos JP, Oláh A, Parks RW, Peev MP, Raraty M, Rau B, Rösch T, Rovers M, Seifert H, Siriwardena AK, Horvath KD, van Santvoort HC. Minimally invasive and endoscopic versus open necrosectomy for necrotising pancreatitis: a pooled analysis of individual data for 1980 patients. Gut. 2018;67:697-706. [PubMed] [DOI] |
| 19. | Puli SR, Graumlich JF, Pamulaparthy SR, Kalva N. Endoscopic transmural necrosectomy for walled-off pancreatic necrosis: a systematic review and meta-analysis. Can J Gastroenterol Hepatol. 2014;28:50-53. [PubMed] [DOI] |
| 20. | 罗 德, 苏 松, 刘 向东, 杜 鹃, 刘 江, 陈 鑫培, 周 鹏程, 李 波. 内镜经胃方式对比外科方式治疗感染坏死性胰腺炎的Meta分析. 中国内镜杂志. 2018;24:17-25. [DOI] |
| 21. | Bang JY, Wilcox CM, Arnoletti JP, Varadarajulu S. Superiority of endoscopic interventions over minimally invasive surgery for infected necrotizing pancreatitis: meta-analysis of randomized trials. Dig Endosc. 2020;32:298-308. [PubMed] [DOI] |
| 22. | Hu Y, Li C, Zhao X, Cui Y. An endoscopic or minimally invasive surgical approach for infected necrotizing pancreatitis: a systematic review and meta-analysis. Rev Esp Enferm Dig. 2019;111:471-480. [PubMed] [DOI] |