修回日期: 2020-03-08
接受日期: 2020-03-11
在线出版日期: 2020-04-08
解痉多肽表达化生(spasmolytic polypeptide expressing metaplasia, SPEM)作为胃癌前病变的初始步骤, 慢性炎症持续刺激可进展至异型增生甚至癌变. 现有基于SPEM特性的动物模型研究显示, 幽门螺杆菌感染所致的胃黏膜免疫应答失调可能为SPEM进展至肠化生直至胃癌的机制之一. 因此, 进一步研究SPEM的起源及进展机制, 有望遏制SPEM病理形态的产生, 阻断SPEM进展到肠化生, 从而真正减少肠型胃癌的发病率. 故本文将近10年来有关SPEM的研究进展进行简要综述.
核心提要: 解痉多肽表达化生是胃黏膜受损后的初始化生应答, 乃癌前化生的初始步骤, 在调节肠化生、异型增生和癌变的下游事件中起到了重要作用.
引文著录: 陈万群, 杨小军, 张金卫. 胃癌前病变解痉多肽表达化生的研究进展. 世界华人消化杂志 2020; 28(7): 254-259
Revised: March 8, 2020
Accepted: March 11, 2020
Published online: April 8, 2020
Spasmolytic polypeptide expressing metaplasia (SPEM) is a critical precursor of gastric precancerous lesions and can lead to dysplasia or neoplasia in the presence of continuous chronic inflammation. Current research on SPEM using mouse models implies that the immune dysfunction of the gastric mucosa triggered by Helicobacter pylori infection might result in the progression of SPEM to intestinal metaplasia and even gastric cancer. Therefore, elucidating the origin and mechanism of progression of SPEM can help avoid the occurrence of SPEM, prevent SPEM progressing to intestinal metaplasia, and reduce the incidence of gastric cancer. In this paper, we will review the progress in the research of SPEM over the recent 10 years.
- Citation: Chen WQ, Yang XJ, Zhang JW. Progress in research of gastric spasmolytic polypeptide expressing metaplasia. Shijie Huaren Xiaohua Zazhi 2020; 28(7): 254-259
- URL: https://www.wjgnet.com/1009-3079/full/v28/i7/254.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v28.i7.254
目前, 胃癌仍然是发病率及致死率均位居世界前列的恶性肿瘤, 我国作为胃癌高发国家之一, 防治胃癌一直是我国医学研究的重要任务[1]. 幽门螺杆菌(Helicobacter pylori, H. pylori)持续感染, 由慢性非萎缩性胃炎-萎缩(chronic atrophic gastritis, CAG)-肠化(intestinal metaplasia, I M)-异型增生进展至胃癌这一经典瀑布式反应已成为 业界共识[2].
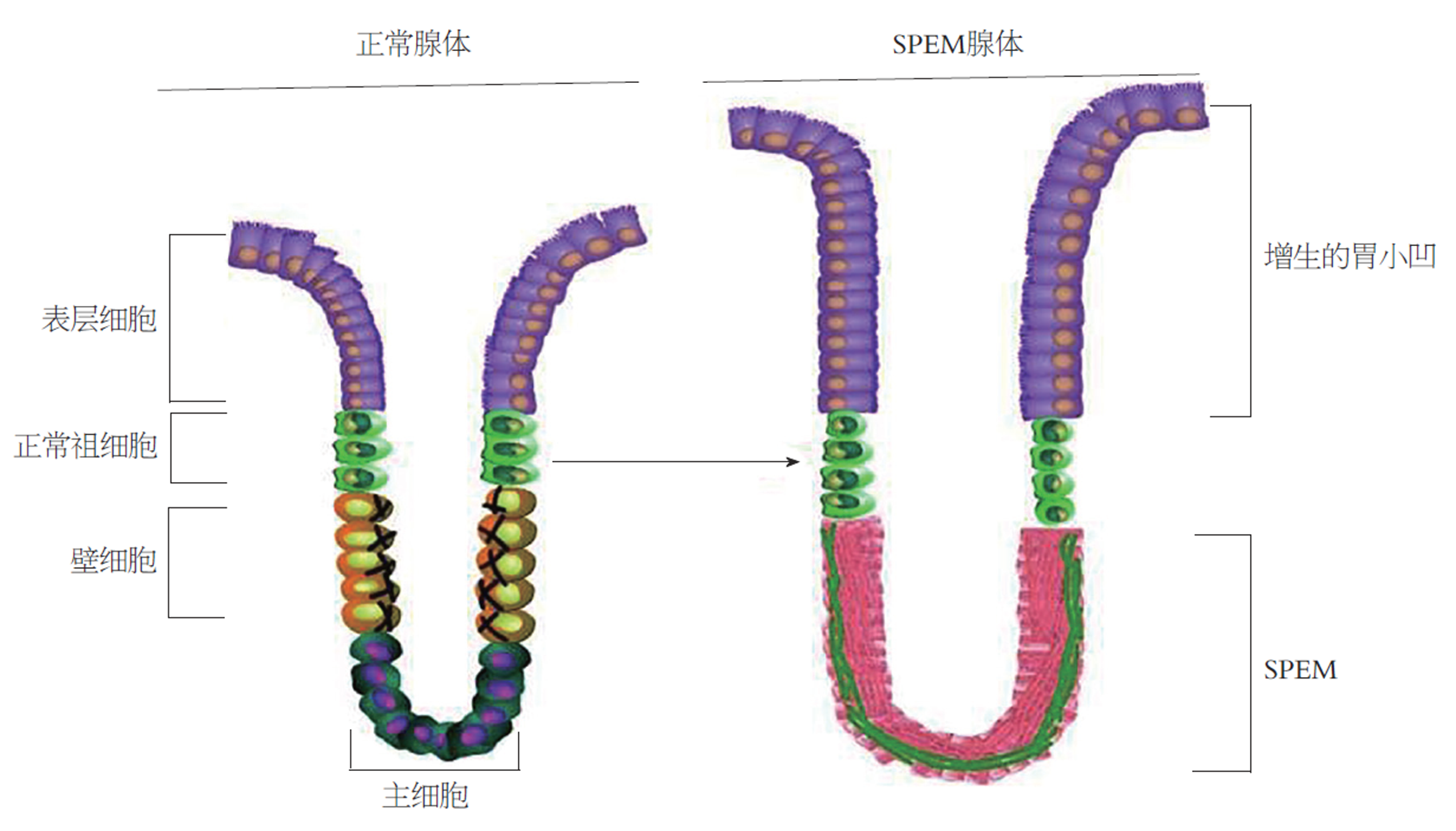
现有研究认为胃黏膜细胞系改变可加速胃癌的发生及发展, 并且显示H. pylori感染可诱导胃黏膜细胞系改变, 即以慢性炎症应答为主要表现, 继而出现以壁细胞缺损为主要特征的泌酸腺体萎缩. 在胃体中, 壁细胞缺损引起与肠型胃癌高度相关的两种化生形式: 以肠型细胞为主要特征的IM, 和以深部胃窦腺体表达三叶因子2(trefoil factor 2, TFF2)为主要特征的解痉多肽表达化生(spasmolytic polypeptide expressing metaplasia, SPEM), 此两种化生形式均被称为胃癌前病变[3](图1).
肠化生已经被公认为肠型胃癌的癌前病理形式, 现有报道关于肠化的治疗手段极其有限, 如作为推荐治疗手段之一的内镜下射频消融术, 随访发现虽然该手术的确可使大部分患者胃黏膜病理得到改善, 但IM病灶仍不能完全消除而持续存在[4]. 其原因在于IM乃至胃癌的形成是多因素综合作用的结果, 不管在人体还是动物实验中, 人们对于胃黏膜细胞化生的来源的认识仍很局限. 既往多个动物实验研究已经证实IM起源于SPEM, 虽然亦有动物实验发现幽门螺杆菌属感染所致的造模SPEM小鼠仅进展到异型增生, 而不会进展至肠化, 但这些实验均证实SPEM为癌前级联反应的初始步骤[5-8]. 因此, 探索SPEM的起源及进展机制, 即可有效遏制SPEM病理形态的产生, 阻断SPEM进展到IM或异型增生, 从而真正减少肠型胃癌的发病率.
SPEM在既往研究中曾被描述为假幽门腺化生、黏膜化生或胃体的胃窦化, 而只有SPEM这一描述兼顾强调了细胞系来源, 现在普遍认为胃体萎缩与SPEM的进展相关, 而CAG的病理诊断即为固有腺体萎缩, 故CAG这一疾病实际涵盖了SPEM这一病理形态[7]. 化生与胃癌的关系早在20年前就已被提出, 早在1999年, Schmidt等[9]报道了胃癌旁化生胃体表达TFF2而被称为解痉多肽. 在美国的初始队列研究中, 相比包含杯状细胞的肠化生而言, SPEM被发现的概率更高, 而且在苏格兰有关早癌的研究中同样被证实[10]. SPEM谱系具有深部胃窦腺体或十二指肠腺体细胞的特征, 在最初的描述中, SPEM谱系进一步被描述为淀粉酶PAS阳性谱系, 同时表达TFF2及GSII凝集素结合Muc6, 与黏液分泌的深部胃窦腺体相似[11]. 同时, SPEM谱系也表达CD44v9及clusterin在内的窦系标记物[12-14]. 蛋白酶抑制剂HE4在SPEM中表达特异, 但在胃窦中表达阴性[15,16]. 所有这些研究都显示SPEM谱系与深部胃窦腺体具有强烈的相似性. 既然基底部SPEM腺体通常表达TFF1/Muc5AC, 这些可修复腺体包含了胃窦腺体形态[17,18]. 因此, SPEM代表了描述假幽门腺化生或幽门化生组织类型的分子形态.
SPEM和假幽门腺化生可以用耐淀粉酶胭脂进行组织染色得以辨识[19], 但仅依赖于组织染色并不能确定细胞系中分子性质为修复性还是癌前性质. SPEM起源于一系列急性损伤或溃疡内[14,18,20,21]. 通过试验观察发现, 经DMP-777、L635以及高剂量他莫昔芬处理后, 因急性壁细胞缺失导致SPEM快速形成[8,18,22]. SPEM似乎解决了黏膜受损所致的问题, 并且通常可表现为高度局部化的黏膜现象[10,18,22]. 因此, 急性胃黏膜溃疡受损与溃疡周边形成SPEM相关, 继而SPEM有助于这些病灶的黏膜愈合[14,21,23]. 正如数十年前被证实的十二指肠球部溃疡愈合一样, 局部胃黏膜受损导致幽门化生的进展--SPEM, 代表黏膜愈合后的应答方式. 但是, 最近研究已显示SPEM在炎症因子(尤其是活跃的巨噬细胞)影响下更易进展到肠化生[13,24,25]. 此外, 越来越多的证据显示SPEM代表了胃黏膜受损后的初始化生应答, 而慢性黏膜损害及炎症可能引起SPEM进一步向杯状细胞为特征的肠化生进展[11,26]. 因此, 胃黏膜幽门腺化生起初为黏膜的自我修复, 而慢性炎症条件下的长期持续则可导致恶性肿瘤.
为了研究SPEM产生及进展的机制, 经过持续研究构建了SPEM的稳定模型: 即分别运用猫胃螺杆菌(Helicobacter Felis, H. felis)慢性感染、缺乏炎症的DMP-777干预、炎症状态下L635干预以及注射选择性雌激素受体调节剂他莫昔芬, 上述四种方法均可引起壁细胞缺失, 进而在小鼠胃基底部形成SPEM[7,24,27]. 区别在于: H. felis造模胃黏膜形成慢性炎症且可进展至异型增生, DMP-777、L635试剂价格昂贵而难以获得, 他莫昔芬造模不仅胃黏膜缺乏炎症且在3 wk后可自恢复. 通过H. felis慢性感染小鼠后, 炎症所致大量壁细胞缺损, 引起几乎全部来源于主细胞转化的SPEM细胞系增殖, 持续感染1年后, SPEM进展至异型增生; DMP-777模型证实壁细胞缺损为SPEM起源的充分条件, 而炎症为SPEM进展至异型增生的必要条件; L635作为缺乏弹性蛋白酶抑制剂的DMP-777的质子载体类似物, 可引起类似于H. felis感染所致的炎症应答, 该模型提示炎症为化生进展到异型增生的前提条件. 综上所述, 只有在炎症状态下, SPEM才会进展为IM或异型增生. 但SPEM的起源一直具有争议, 现有关SPEM的研究主要基于机制探索、起源等方面.
经持续研究发现, 化生的形成均需要调控表皮生长因子(epidermal growth factor, EGF)配体或受体(Areg、 EGF受体), 激活内分泌通路(胃泌素、组胺)及炎症因子[γ-干扰素(Interferon-γ, IFN-γ)、白细胞介素(interleukin, IL)-11]; 使用动物模型证实, 壁细胞缺失的SPEM可诱导化生及巨噬细胞极化, 其机制为调控细胞因子信号通路IL-33/IL-13, 联合应答因内在黏膜及浸润的M2巨噬细胞所造成的损害[25]. 最新研究发现在慢性炎症条件下所产生的细胞因子IFN-γ可直接促进胃上皮细胞凋亡, 进而形成慢性萎缩性胃炎及SPEM, 故其可被视为一个至关重要的决定胃癌风险的因子[28].
此后相关研究多以上述模型构建方式为原型, 如在此基础上敲除相关免疫因子, 结果发现小鼠模型化生组织中M2巨噬细胞在炎症状态下促进了SPEM的进展[13]. 此后研究发现在壁细胞缺损条件下, 表皮相关细胞因子IL-33、IL-13为主细胞转化成化生的必要条件; 壁细胞缺损后, 通过调节IL-33/IL-13细胞因子信号通路, 诱导化生和巨噬细胞两极化相辅相成, 构成了由内源性黏膜机制和M2巨噬细胞浸润共同存在的损伤应答, 因此拮抗IL-33/IL-13可作为逆转胃黏膜化生的潜在治疗方法[25]. 由此可见, H. pylori感染所致的胃黏膜免疫应答失调可能为SPEM进展至IM直至胃癌的机制之一.
SPEM细胞的来源一直具有争议, 目前主要有两种来源假设: 起源于干细胞增殖或分化, 或者起源于胃腺基底部胃酶主细胞有丝分裂后. 但研究证实具有干细胞功能的G蛋白偶联受体5存在于胃泌酸黏膜小弯侧, 虽然具有转录活性, 但未发现其与化生具有相关性[29]. 通过观察小鼠模型发现在受损的泌酸胃黏膜中, 同样具有干细胞特性的免疫球蛋白样域1可使起源于胃体的上皮细胞具有再生能力, 进而分化成正常胃黏膜细胞, 为未来靶向治疗受损胃黏膜快速修复提供了方向[30]. 然而上述研究均未提供令人信服的证据证实SPEM细胞起源于干细胞, 最新研究通过分析胃腺癌患者手术后标本组织发现, 正常的胃酶主细胞仅在腺体基底部转化成SPEM细胞, 而并不在干细胞增殖区域, 进而推测SPEM可起源于现有细胞(主细胞)的重组[31]. Chen等[32]研究者通过激光捕获显微切割分辨SPEM细胞后以检测微卫星稳定性, 结果发现SPEM腺体具有基因不稳定性所致癌变倾向极为显著, 但提示SPEM并非胃癌变的单一起源,而干细胞所具有的基因不稳定性在癌变过程中起了关键作用. 由此可见, 胃内细胞突变可能是SPEM的起源, 而研究导致原细胞突变的关键因素可能成为解密SPEM起源的重要突破口.
既往研究显示化生及癌变均以基因表达谱改变为特征, 作为基因表达调节器之一的非编码小RNA (microRNAs, miRNAs), 可以调节转录后的基因表达, 可能参与调节SPEM的起源与进展. 现有从miRNAs着手研究SPEM的报道相对较少, 如通过检测人肠型胃癌术后标本及动物模型组织发现, miR-30和miR-194共同调节转录因子肝细胞核因子4γ及核受体亚家族, F组, 第2号成员NR2F2, 调节肠化关键因子CDX2, 可抑制肠化的发生发展[33]. 此研究显示在胃癌形成的级联反应过程中, 胃黏膜化生组织中miRNA改变可能为早期事件, 癌前病灶中早期miRNA改变的辨识及其分子效应特征有望发展成为早期诊断及治疗胃癌的生物学标记物.
壁细胞缺失后, 主细胞转化成黏液细胞化生--SPEM. Shimizu等[34]研究者检测了主细胞中miRNAs的表达, 以及所涉及的主细胞转换成SPEM中的miRNAs表达, 结果显示miR-148a在主细胞中表达强阳性且具有特异性, 而在主细胞转换过程中其表达显著降低. 此外, 在永生主细胞系中, 抑制miR-148a表达可诱导SPEM早期发展阶段的转录子--CD44多样体9, 以及miR-148a的靶标脱氧核糖核酸甲基转移酶1(DNA methyltransferase 1, Dnmt1)的上调. 免疫染色显示在使用DMP-777或L635诱导出现急性泌酸腺体萎缩的小鼠模型之前, Dnmt1在SPEM细胞及主细胞中均上调. 同时, 不管在敲除xCT的小鼠或在使用柳氮磺胺吡啶抑制xCT所导致的急性泌酸腺体萎缩模型中, miR-148a表达均下调. 这些发现证实在主细胞转化成SPEM的过程中, miR-148a表达改变是一个早期事件.
Gastroenterology最新研究证实, SPEM为H. pylori破坏胃黏膜提供了庇护所: 即H. pylori通过胃黏膜上皮的结合位点SabA, 连接到SPEM腺体增加的糖基化受体路易斯寡糖(sialyl-Lewis X, sLex)上, 从而使H. pylori由胃窦扩展到胃体并最终致癌[35]. H. pylori通过深部连接与受损的胃体上皮相互作用, 以sLex表达升高为特征性表现, 在腺体修复的细胞增殖和分化改变过程中, 可以诱导化生细胞累积突变. 实际上, sLex表达升高为胃腺癌预后不良的一个标记物. 总之, 在慢性炎症条件下, H. pylori与SPEM腺体中sLex相互作用不仅关键决定了胃黏膜发展的自然史, 而且对胃癌前病变的产生及对患者整个致癌风险具有重要的影响. 此外, 为了研究H. pylori感染诱导下胃炎到胃癌的发展过程, Muthupalani等[36]研究者发现: MUC5AC具有保持胃窦上皮稳态, 抑制H. pylori定植及相关炎性病变(如SPEM)的作用.
那么, 如果没有H. pylori诱导情况下, SPEM的产生与进展又与哪些蛋白相关呢?胃黏膜上皮细胞骨架构成了胃黏膜屏障, 该屏障可抵御包括胃酸在内的胃内物质的侵袭, 既往研究已经证实胃型紧密连接蛋白18(stomach-type claudin-18, stCldn18)在胃炎及胃癌中表达下降, 为了进一步研究stCldn18的病理作用, Suzuki等[37]作者研究了长期缺乏stCldn18小鼠胃病理改变过程, 研究认为缺乏stCldn18诱导的慢性活动性胃炎促进了SPEM细胞中肿瘤导向的改变.
同时, 为了研究急性药物及慢性炎症对胃黏膜的损害所导致的转录改变, Bockerstett等[38]通过单细胞RNA测序的方法, 发现SPEM相关的经典基因在急性药物损害及慢性炎症所致SPEM中均表达, 而在慢性炎症诱导的SPEM细胞中更常发现许多免疫调节相关的基因. 这个研究证实SPEM是一个高度保守的转录程序, 在正常黏膜中并不表现. 同时, 这个研究扩展了SPEM的内涵和外延为: 在慢性炎症条件下, TFF2转录表达细胞阳性而成熟主细胞基因表达阴性即为SPEM. 在炎症条件下, SPEM同时扮演转录角色参与免疫应答, 对于调节肠化生、异型增生、癌变的下游事件起到了重要作用.
某种损伤导致胃黏膜泌酸壁细胞凋亡, 进而引起以共表达主细胞及颈黏液细胞基因的创伤应答标记物(如TFF2、解痉多肽), 该病灶即被称为SPEM. 既往多个基于追踪基因谱系的实验均证实SPEM细胞起源于主细胞的可塑性. 但仍有人质疑主细胞是SPEM主要来源这一观点, 尤其在人胃黏膜稳定模型中更难辨识, 因为颈黏液细胞的主要使命是变成主细胞, 而主细胞主要由颈黏液细胞分化提供. 为了研究损伤诱导化生的相关稳态表现, Burclaff等[39]作者通过分别给予他莫昔芬构建SPEM小鼠模型, 以及幽门螺杆菌灌胃导致小鼠慢性胃黏膜损伤, 通过采取不同方式给予溴尿苷干预后, 研究者发现颈黏液细胞在稳态条件下不会变成主细胞, 而主细胞可能通过不频繁的自我复制维持其原有数量保持不变. 而在化生诱导损伤条件下, 主细胞变成SPEM细胞, 在损伤恢复后SPEM细胞可再转化为主细胞, 即二者可相互转换.
综上所述, SPEM与IM均为胃癌前病变, SPEM为癌前病变初始步骤, 现有研究显示从炎症应答及主细胞系改变入手, 探索化生细胞来源及形成机制成为逆转化生、减少胃癌发病率的关键.
学科分类: 胃肠病学和肝病学
手稿来源地: 重庆市
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C
D级 (一般): D
E级 (差): 0
编辑: 王禹乔 电编:刘继红
| 1. | Torre LA, Bray F, Siegel RL, Ferlay J, Lortet-Tieulent J, Jemal A. Global cancer statistics, 2012. CA Cancer J Clin. 2015;65:87-108. [PubMed] [DOI] |
| 2. | Correa P, Houghton J. Carcinogenesis of Helicobacter pylori. Gastroenterology. 2007;133:659-672. [PubMed] [DOI] |
| 4. | Leung WK, Tong DK, Leung SY, Chan FS, Tong TS, Ho RS, Chu KM, Law SY. Treatment of Gastric Metaplasia or Dysplasia by Endoscopic Radiofrequency Ablation: A Pilot Study. Hepatogastroenterology. 2015;62:748-751. [PubMed] |
| 5. | Yoshizawa N, Takenaka Y, Yamaguchi H, Tetsuya T, Tanaka H, Tatematsu M, Nomura S, Goldenring JR, Kaminishi M. Emergence of spasmolytic polypeptide-expressing metaplasia in Mongolian gerbils infected with Helicobacter pylori. Lab Invest. 2007;87:1265-1276. [PubMed] [DOI] |
| 6. | Nam KT, Lee HJ, Mok H, Romero-Gallo J, Crowe JE, Peek RM, Goldenring JR. Amphiregulin-deficient mice develop spasmolytic polypeptide expressing metaplasia and intestinal metaplasia. Gastroenterology. 2009;136:1288-1296. [PubMed] [DOI] |
| 7. | Goldenring JR, Nam KT, Wang TC, Mills JC, Wright NA. Spasmolytic polypeptide-expressing metaplasia and intestinal metaplasia: time for reevaluation of metaplasias and the origins of gastric cancer. Gastroenterology. 2010;138:2207-2210, 2210.e1. [PubMed] [DOI] |
| 8. | Nam KT, Lee HJ, Sousa JF, Weis VG, O'Neal RL, Finke PE, Romero-Gallo J, Shi G, Mills JC, Peek RM, Konieczny SF, Goldenring JR. Mature chief cells are cryptic progenitors for metaplasia in the stomach. Gastroenterology. 2010;139:2028-2037.e9. [PubMed] [DOI] |
| 9. | Schmidt PH, Lee JR, Joshi V, Playford RJ, Poulsom R, Wright NA, Goldenring JR. Identification of a metaplastic cell lineage associated with human gastric adenocarcinoma. Lab Invest. 1999;79:639-646. [PubMed] |
| 10. | Halldórsdóttir AM, Sigurdardóttrir M, Jónasson JG, Oddsdóttir M, Magnússon J, Lee JR, Goldenring JR. Spasmolytic polypeptide-expressing metaplasia (SPEM) associated with gastric cancer in Iceland. Dig Dis Sci. 2003;48:431-441. [PubMed] [DOI] |
| 11. | Lennerz JK, Kim SH, Oates EL, Huh WJ, Doherty JM, Tian X, Bredemeyer AJ, Goldenring JR, Lauwers GY, Shin YK, Mills JC. The transcription factor MIST1 is a novel human gastric chief cell marker whose expression is lost in metaplasia, dysplasia, and carcinoma. Am J Pathol. 2010;177:1514-1533. [PubMed] [DOI] |
| 12. | Wada T, Ishimoto T, Seishima R, Tsuchihashi K, Yoshikawa M, Oshima H, Oshima M, Masuko T, Wright NA, Furuhashi S, Hirashima K, Baba H, Kitagawa Y, Saya H, Nagano O. Functional role of CD44v-xCT system in the development of spasmolytic polypeptide-expressing metaplasia. Cancer Sci. 2013;104:1323-1329. [PubMed] [DOI] |
| 13. | Petersen CP, Weis VG, Nam KT, Sousa JF, Fingleton B, Goldenring JR. Macrophages promote progression of spasmolytic polypeptide-expressing metaplasia after acute loss of parietal cells. Gastroenterology. 2014;146:1727-38.e8. [PubMed] [DOI] |
| 14. | Bertaux-Skeirik N, Wunderlich M, Teal E, Chakrabarti J, Biesiada J, Mahe M, Sundaram N, Gabre J, Hawkins J, Jian G, Engevik AC, Yang L, Wang J, Goldenring JR, Qualls JE, Medvedovic M, Helmrath MA, Diwan T, Mulloy JC, Zavros Y. CD44 variant isoform 9 emerges in response to injury and contributes to the regeneration of the gastric epithelium. J Pathol. 2017;242:463-475. [PubMed] [DOI] |
| 15. | Nozaki K, Ogawa M, Williams JA, Lafleur BJ, Ng V, Drapkin RI, Mills JC, Konieczny SF, Nomura S, Goldenring JR. A molecular signature of gastric metaplasia arising in response to acute parietal cell loss. Gastroenterology. 2008;134:511-522. [PubMed] [DOI] |
| 16. | O'Neal RL, Nam KT, LaFleur BJ, Barlow B, Nozaki K, Lee HJ, Kim WH, Yang HK, Shi C, Maitra A, Montgomery E, Washington MK, El Rifai W, Drapkin RI, Goldenring JR. Human epididymis protein 4 is up-regulated in gastric and pancreatic adenocarcinomas. Hum Pathol. 2013;44:734-742. [PubMed] [DOI] |
| 17. | Nomura S, Baxter T, Yamaguchi H, Leys C, Vartapetian AB, Fox JG, Lee JR, Wang TC, Goldenring JR. Spasmolytic polypeptide expressing metaplasia to preneoplasia in H. felis-infected mice. Gastroenterology. 2004;127:582-594. [PubMed] [DOI] |
| 18. | Nomura S, Yamaguchi H, Ogawa M, Wang TC, Lee JR, Goldenring JR. Alterations in gastric mucosal lineages induced by acute oxyntic atrophy in wild-type and gastrin-deficient mice. Am J Physiol Gastrointest Liver Physiol. 2005;288:G362-G375. [PubMed] [DOI] |
| 19. | Goldenring JR, Nomura S. Differentiation of the gastric mucosa III. Animal models of oxyntic atrophy and metaplasia. Am J Physiol Gastrointest Liver Physiol. 2006;291:G999-1004. [PubMed] [DOI] |
| 20. | Goldenring JR, Ray GS, Coffey RJ, Meunier PC, Haley PJ, Barnes TB, Car BD. Reversible drug-induced oxyntic atrophy in rats. Gastroenterology. 2000;118:1080-1093. [PubMed] [DOI] |
| 21. | Engevik AC, Feng R, Choi E, White S, Bertaux-Skeirik N, Li J, Mahe MM, Aihara E, Yang L, DiPasquale B, Oh S, Engevik KA, Giraud AS, Montrose MH, Medvedovic M, Helmrath MA, Goldenring JR, Zavros Y. The Development of Spasmolytic Polypeptide/TFF2-Expressing Metaplasia (SPEM) During Gastric Repair Is Absent in the Aged Stomach. Cell Mol Gastroenterol Hepatol. 2016;2:605-624. [PubMed] [DOI] |
| 22. | Huh WJ, Khurana SS, Geahlen JH, Kohli K, Waller RA, Mills JC. Tamoxifen induces rapid, reversible atrophy, and metaplasia in mouse stomach. Gastroenterology. 2012;142:21-24.e7. [PubMed] [DOI] |
| 23. | Aihara E, Matthis AL, Karns RA, Engevik KA, Jiang P, Wang J, Yacyshyn BR, Montrose MH. Epithelial Regeneration After Gastric Ulceration Causes Prolonged Cell-Type Alterations. Cell Mol Gastroenterol Hepatol. 2016;2:625-647. [PubMed] [DOI] |
| 24. | Weis VG, Sousa JF, LaFleur BJ, Nam KT, Weis JA, Finke PE, Ameen NA, Fox JG, Goldenring JR. Heterogeneity in mouse spasmolytic polypeptide-expressing metaplasia lineages identifies markers of metaplastic progression. Gut. 2013;62:1270-1279. [PubMed] [DOI] |
| 25. | Petersen CP, Meyer AR, De Salvo C, Choi E, Schlegel C, Petersen A, Engevik AC, Prasad N, Levy SE, Peebles RS, Pizarro TT, Goldenring JR. A signalling cascade of IL-33 to IL-13 regulates metaplasia in the mouse stomach. Gut. 2018;67:805-817. [PubMed] [DOI] |
| 26. | Choi E, Hendley AM, Bailey JM, Leach SD, Goldenring JR. Expression of Activated Ras in Gastric Chief Cells of Mice Leads to the Full Spectrum of Metaplastic Lineage Transitions. Gastroenterology. 2016;150:918-30.e13. [PubMed] [DOI] |
| 27. | Saenz JB, Burclaff J, Mills JC. Modeling Murine Gastric Metaplasia Through Tamoxifen-Induced Acute Parietal Cell Loss. Methods Mol Biol. 2016;1422:329-339. [PubMed] [DOI] |
| 28. | Osaki LH, Bockerstett KA, Wong CF, Ford EL, Madison BB, DiPaolo RJ, Mills JC. Interferon-γ directly induces gastric epithelial cell death and is required for progression to metaplasia. J Pathol. 2019;247:513-523. [PubMed] [DOI] |
| 29. | Nam KT, O'Neal RL, Coffey RJ, Finke PE, Barker N, Goldenring JR. Spasmolytic polypeptide-expressing metaplasia (SPEM) in the gastric oxyntic mucosa does not arise from Lgr5-expressing cells. Gut. 2012;61:1678-1685. [PubMed] [DOI] |
| 30. | Choi E, Lantz TL, Vlacich G, Keeley TM, Samuelson LC, Coffey RJ, Goldenring JR, Powell AE. Lrig1+ gastric isthmal progenitor cells restore normal gastric lineage cells during damage recovery in adult mouse stomach. Gut. 2018;67:1595-1605. [PubMed] [DOI] |
| 31. | Radyk MD, Burclaff J, Willet SG, Mills JC. Metaplastic Cells in the Stomach Arise, Independently of Stem Cells, via Dedifferentiation or Transdifferentiation of Chief Cells. Gastroenterology. 2018;154:839-843.e2. [PubMed] [DOI] |
| 32. | Chen J, Zhu C, Wang C, Hu C, Czajkowsky DM, Guo Y, Liu B, Shao Z. Evidence for heightened genetic instability in precancerous spasmolytic polypeptide expressing gastric glands. J Med Genet. 2019;. [PubMed] [DOI] |
| 33. | Sousa JF, Nam KT, Petersen CP, Lee HJ, Yang HK, Kim WH, Goldenring JR. miR-30-HNF4γ and miR-194-NR2F2 regulatory networks contribute to the upregulation of metaplasia markers in the stomach. Gut. 2016;65:914-924. [PubMed] [DOI] |
| 34. | Shimizu T, Sohn Y, Choi E, Petersen CP, Prasad N, Goldenring JR. Decrease in MiR-148a Expression During Initiation of Chief Cell Transdifferentiation. Cell Mol Gastroenterol Hepatol. 2020;9:61-78. [PubMed] [DOI] |
| 35. | Sáenz JB, Vargas N, Mills JC. Tropism for Spasmolytic Polypeptide-Expressing Metaplasia Allows Helicobacter pylori to Expand Its Intragastric Niche. Gastroenterology. 2019;156:160-174.e7. [PubMed] [DOI] |
| 36. | Muthupalani S, Ge Z, Joy J, Feng Y, Dobey C, Cho HY, Langenbach R, Wang TC, Hagen SJ, Fox JG. Muc5ac null mice are predisposed to spontaneous gastric antro-pyloric hyperplasia and adenomas coupled with attenuated H. pylori-induced corpus mucous metaplasia. Lab Invest. 2019;99:1887-1905. [PubMed] [DOI] |
| 37. | Suzuki K, Sentani K, Tanaka H, Yano T, Suzuki K, Oshima M, Yasui W, Tamura A, Tsukita S. Deficiency of Stomach-Type Claudin-18 in Mice Induces Gastric Tumor Formation Independent of H pylori Infection. Cell Mol Gastroenterol Hepatol. 2019;8:119-142. [PubMed] [DOI] |
| 38. | Bockerstett KA, Lewis SA, Wolf KJ, Noto CN, Jackson NM, Ford EL, Ahn TH, DiPaolo RJ. Single-cell transcriptional analyses of spasmolytic polypeptide-expressing metaplasia arising from acute drug injury and chronic inflammation in the stomach. Gut. 2019;. [PubMed] [DOI] |
| 39. | Burclaff J, Willet S, Sáenz JB, Mills J. Proliferation and Differentiation of Gastric Mucous Neck and Chief Cells During Homeostasis and Injury-induced Metaplasia. Gastroenterology. 2019;. [PubMed] [DOI] |