修回日期: 2020-02-14
接受日期: 2020-02-25
在线出版日期: 2020-03-08
内镜下胰腺假性囊肿(pancreatic pseudocyst, PPC)内引流已经成为PPC治疗重要方式之一, 随着新型蕈型覆膜金属支架(lumen-apposing metal stents, LAMS)在假性囊肿引流中的不断应用, 展现出较好的疗效和临床实用价值, 本文就PPC内引流现状, 特别是超声内镜引导LAMS治疗疗效、并发症及处理对策做一综述.
核心提要: 相比早先开展的胰腺假性囊肿内镜下支架内引流治疗, 新型蕈型覆膜金属支架引流操作成功率高达97.7%-100%, 临床成功率为95.5%-100%; 尽管已有相应对策, 但出血等并发症仍较高, 将来能否成为新的一线治疗仍需进一步临床研究验证.
引文著录: 冉文斌, 单晶, 孙晓滨. 胰腺假性囊肿内引流及超声内镜引导新型蕈型覆膜金属支架治疗进展. 世界华人消化杂志 2020; 28(5): 189-196
Revised: February 14, 2020
Accepted: February 25, 2020
Published online: March 8, 2020
Endoscopic pancreatic pseudocyst (PPC) drainage has become one of the most important methods for the treatment of PPC. With the continuous application of the new lumen-apposing metal stent (LAMS), it has shown better efficacy and clinical practical value. This paper focuses on the current situation of endoscopic PPC drainage, especially the therapeutic effect, complications, and countermeasures with endoscopic ultrasound-guided LAMS.
- Citation: Ran WB, Shan J, Sun XB. Recent advances in treatment of pancreatic pseudocyst with endoscopic ultrasonography guided lumen-apposing metal stents. Shijie Huaren Xiaohua Zazhi 2020; 28(5): 189-196
- URL: https://www.wjgnet.com/1009-3079/full/v28/i5/189.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v28.i5.189
胰周液体积聚(pancreatic fluid collections, PFCs)是对因急、慢性胰腺疾病引起的胰腺损伤而造成局部渗出相关炎性并发症的统称. 通常分为4类, 其中发病4 wk后炎性渗出等形成包裹和囊壁后分别称为胰腺假性囊肿(pancreatic pseudocyst, PPC)和包裹性坏死(walled-off necrosis, WON)[1]. 相对于WON, 临床关于假性囊肿的引流治疗有其固有特点, 本文就PPC内引流现状, 特别是超声内镜(endoscopic ultrasonography, EUS)引导下新型蕈型覆膜金属支架(lumen-apposing metal stents, LAMS)治疗相关方面做一汇报.
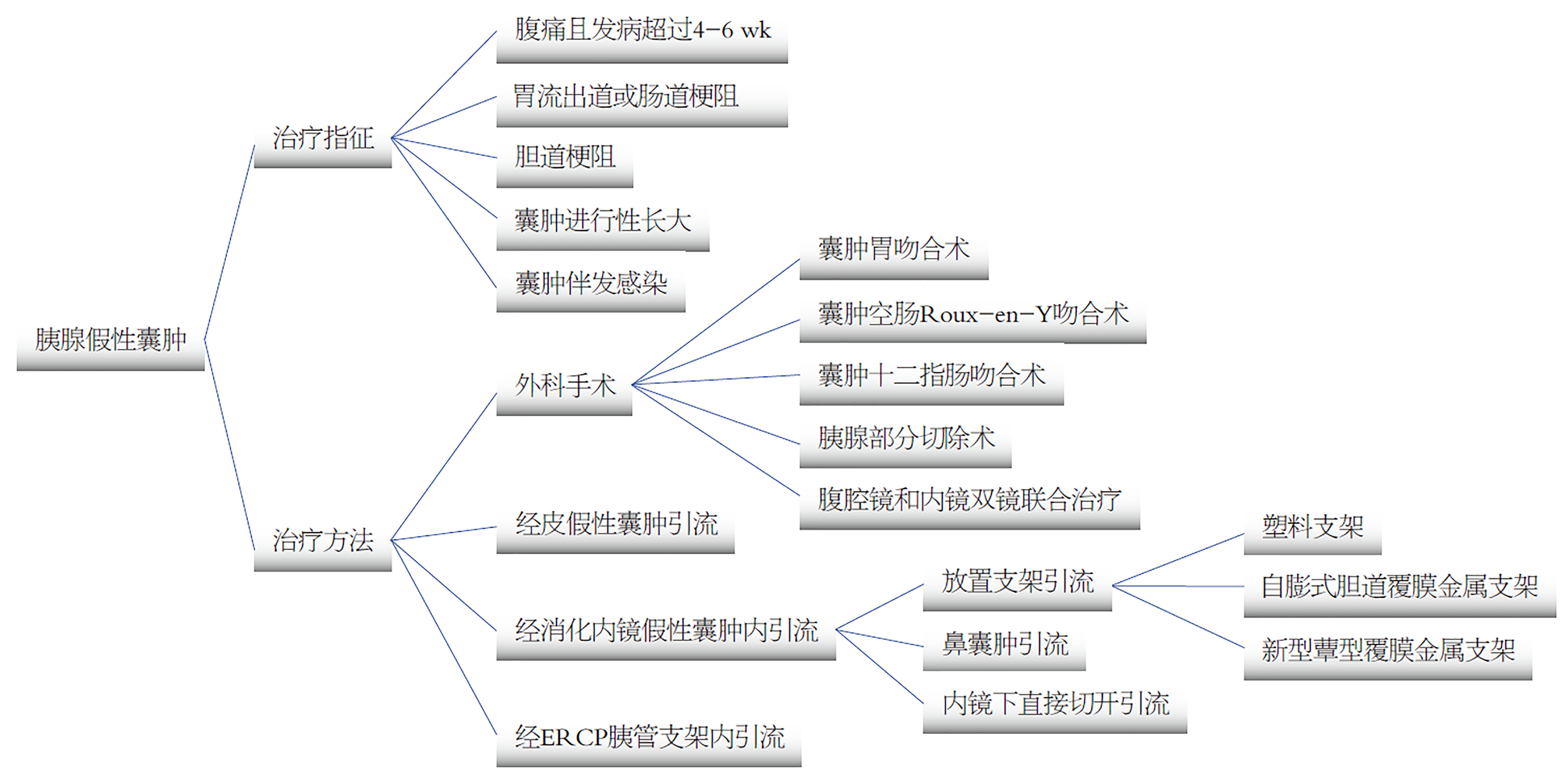
急性胰腺炎患者中PPC发生率为5%-15%, 慢性胰腺炎中为20%-40%, 以酒精性胰腺炎患者更易出现. 假性囊肿感染很少发生, 一旦出现感染, 应考虑同WON及WON伴感染相鉴别. 目前研究发现未经特殊治疗的PPC一年后86%的可以自行吸收, 只有3%-9%出现严重的并发症, 需积极干预[2]. 因此PPC治疗以观察保守治疗为主, 只有当囊肿出现症状或区域并发症时才建议积极处理, 具体可参考如下: (1)出现腹痛症状, 且发病时间超过4-6 wk; (2)胃流出道或肠道梗阻; (3)胆道梗阻; (4)囊肿进行性长大; (5)伴发感染, 而囊肿大小、部位和范围已经不作为处理的主要标准[3].
PPC治疗早期主要以外科手术为主, 并发症可高达64%-95%, 致死率15%-40%, 随着技术改进和临床经验数据的积累, 目前的外科治疗主要包括囊肿胃吻合术、囊肿空肠Roux-en-Y吻合术、囊肿十二指肠吻合术、胰腺部分切除术及腹腔镜和内镜双镜联合治疗. 腹腔镜手术中经胃前壁和经网膜囊胃后壁的腹腔镜胰胃吻合术成功率为95%, 死亡率为1%, 并发症发生率为12%, 中转开腹手术率为10%, 均明显低于传统开腹手术[4,5]. 经皮假性囊肿引流尽管创伤也小, 但同样因为术后经皮瘘的发生率高、逆行性感染居高不下, 且容易给后续外科或内镜治疗造成不必要的麻烦, 应用也有减少趋势; 主要应用于和胃肠道管腔距离较远且未和胰管相通的PFCs患者, 特别是尚未形成明显囊壁包裹的早期假性囊肿伴感染者或者身体条件差不能承受手术治疗者[4]. 目前内镜下PPC内引流治疗可以通过放置多种类型引流支架、鼻囊肿引流、内镜下切开引流等方式开展, 具有创伤小, 恢复快, 并发症轻和患者生活质量高等优点(图1); 而胰管中断引起的PPC尚可通过内镜逆行胰胆管造影治疗一次性解决. 同时胃肠壁和假性囊肿间形成的人工瘘可以减少囊肿复发的风险, 即使部分研究认为内镜引流不比外科手术和经皮引流术更有效, 但因其治疗后总体复发率和并发症率较低, 仍被认为是假性囊肿治疗的一线选择[6].
EUS引导下的PPC引流相比传统的直视下内镜引流, 可在治疗前排除以囊性病变表现的囊性肿瘤和假性动脉瘤, 实现实时的图像引导, 避开重要脏器和大血管, 准确评估穿刺道的血流情况、假性囊肿的大小及囊壁厚度、寻找最短的距离, 明显减少医源性损害, 而成为PPC引流的一线治疗方式. 具体入路可从胃或十二指肠进入, 在多数情况下选择经胃入路[7], 可以通过放置单根塑料支架(plastic stents, PS)、多根塑料支架、自膨式胆道覆膜金属支架(self-expanding metallic stent, SEMS)和LAMS等多种方式, 尚可联合使用. 2015年以前, EUS引导下假性囊肿的治疗首选塑料支架居多, 成功率为82%-100%, 具有价格便宜, 不宜引起黏膜损伤, 出血风险低等优点; 其缺点为塑料支架管腔直径小, 容易造成支架阻塞和可能需要多次更换等, 多根塑料支架联合引流一定程度上可增加囊肿引流效率, 但仍存在堵塞风险, 尚且在部分囊肿引流后期, 因囊内固体残留而无法清理, 影响治疗效果[8]. SEMS具有内径孔道大, 操作时间短, 部分支架尚可一步操作完成, 特别对于伴有感染及少量坏死的假性囊肿, 可迅速减小囊肿, 加速囊肿的愈合, 不易发生堵塞, 引流效果更好等特点, 近年报道应用有增多趋势, 总体成功率为85%-95%. Sharaiha等[9]在230例的PPC患者中发现SEMS比塑料支架临床效果好, 并发症更低(16% vs 31%). 然而一项随机对照试验发现相比塑料支架, SEMS在成功率方面并无明显优势, 其成功率分别为87%和91%, SEMS引流的唯一优势是操作时间短, 15 min vs 29.5 min[10]. 而Bang等[8]的Meta分析共纳入17个研究, 发现无论是塑料支架还是SEMS, 其总体的成功率没有差异, 不良反应发生、复发率亦没有差别.
基于塑料支架和SEMS的临床效果不尽完美, 从2012年开始有学者开始应用新型覆膜金属支架用于PPC的内引流治疗中. 该类支架目前国内尚无统一翻译或命名, 临床常称为"双蘑菇头覆膜金属支架、蕈型覆膜金属支架、腔壁贴合型金属支架、新型哑铃状覆膜金属支架"等[11-14]. 本文暂称其为新型蕈型覆膜金属支架, 简称LAMS. 该类支架目前常见的品牌有(Nagi, 韩国)、(Axios, 加拿大)和我国南京微创公司的产品(尚未正式上市), 其支架内径通常可达10-16 mm, 鞍部长度约10 mm, 更容易将囊壁和消化道管腔拉近, 实现更快速、充分的引流, 且支架两端膨大的末端可以起到很好的固定作用, 内部覆膜部分明显减少囊壁与胃肠道间隙瘘的形成. 特别是对于合并感染及部分坏死的PPC, 由于支架内径较大, 普通胃镜就可通过支架深入囊肿内部进一步实施灌洗、清创和坏死物清理等治疗, 且相对多根塑料支架置入的繁琐, 该类支架尚可以一步法置入, 明显节约操作时间, 减少置入失败率, 报道的使用数量在增多[15].
Itoi等[16]报道使用LAMS治疗15例假性囊肿患者, 成功率100%, 中位随访11.4 mo内均没有囊肿复发, 且无并发症发生. 澳大利亚学者Chandran等[6]于2015年发表的一项纳入38例假性囊肿研究中, 无菌性囊肿占28例, 感染性囊肿11例, 总的LAMS置入成功率为84.2%, 其中76.3%的病人经引流后囊肿消失并未再复发, 仅2.6%的囊肿治疗后复发. 但术后早期并发症高达21.1%, 其中菌血症10.5%, 支架堵塞5.3%, 支架移位2.6%, 出血2.6%, 需要输血治疗; 迟发性并发症发生率为18.4%, 其中支架移位、堵塞和支架部分包埋发生率均为5.3%, 支架完全包埋发生率为2.6%. 意大利学者Petrone等[17]发表的一项多中心研究显示在44例PPC中, LAMS的置入成功率为97.7%, 临床成功率为95.5%, 治疗期间相关并发症发生率为15.9%, 其中术前为2.3%, 术后早期为6.8%, 术后晚期为6.8%; 支架安置时间平均为48.1 d±35.2 d, 囊肿复发率为2.3%; 同WON组治疗相比, 并发症明显降低, 特别是支架移位和堵塞. 另一项英国和爱尔兰多中心经验显示, LAMS用于46个PPC中的技术成功率为98%, 临床成功率为95.6%, 囊肿消失率为95%, 消失所需中位时间为48 d (7-203), 支架中位在位时间为1 d (0-91), 随访期仅1例囊肿复发, 而并发症发生率仅为8.7%, 其中支架堵塞、支架包埋、大出血和菌血症均为1例(2.2%); 值得注意的一点是, 该研究中LAMS在位中位时间仅为1 d的原因为54.5%的病人采用LAMS置入1 d引流囊肿的方法, 因此作者认为可以在日间采用LAMS引流假性囊肿, 且安全有效[18].
我国学者孙思予教授团队2017年发表的研究显示, 在纳入的52例PPC患者中, 40例使用塑料支架引流, 12例使用LAMS, 总的技术成功率和临床成功率均为100%, 并发症发生率为7.7%, 其中出血3.85%, 支架移位1.92%, 囊肿破裂1.92%; 需要再次干预率为15.38%, 平均住院日为7.8 d±4.922 d; 多元回归分析显示使用塑料支架和较大的囊肿是治疗干预的危险因素, 多元线性分析显示假性囊肿的病因和住院时间延长有关. 遗憾的是未能就LAMS和塑料支架两组做详细报道和分析[19]. 美国学者Yang等[20]发表的一项多中心研究评价LAMS对PPC的安全性和迟发性并发症发生情况结果显示, 58例PPC患者中, LAMS置入后中位时间4 wk时, 囊肿消失率为96.5%, 并发症发生率为17.5%, 无迟发性出血和支架包埋发生. 置入LAMS技术成功率为98.3%, 即刻并发症中无穿孔发生, 出血和感染发生率均为1.7%, 影像学复查间期感染发生率为3.5%, 支架堵塞为17.5%, LAMS部分包埋为1.8%; LAMS在移除过程中并发1例出血(1.7%)无穿孔、感染、胰腺炎及食管黏膜撕裂等情况发生. Logistic回归分析发现使用电切LAMS置入是影响治疗失败的唯一因素(OR = 13.2; 95%CI: 3.33-51.82, P = 0.02). 无患者、操作人员或手术相关因素可预测支架阻塞. 支架堵塞成为最常见的迟发性并发症, 理论上假性囊肿内部没有固体碎片残留等, 但17.5%的患者仍发生支架闭塞, 与Aburajab等[21]最近报道的结果一致, 推测可能因食物残渣引起支架阻塞是主要原因. 美国学者Aburajab等[21]将PPC患者分为2组, 1组单纯置入LAMS, 1组在置入LAMS的同时置入双猪尾支架, 结果发现单纯置入LAMS组技术成功率为96%, 支架移除成功率为100%, 临床成功率为91%, 并发症中穿孔发生率为4%, 假性囊肿感染率为17%, 支架移位为4%, 而LAMS联合双猪尾支架组技术成功率、支架移除率、临床成功率均为100%, 无并发症发生. 因此, 作者认为同既往WON结果相比, LAMS对假性囊肿的内镜引流也是有效的, 不足之处是囊肿感染并发症发生率高, 但可以通过LAMS联合放置双猪尾支架将这一风险降到最低.
目前关于LAMS用于PPC治疗比较的最大样本量研究来自美国学者Yang等[22]发表的多中心研究结果, 其比较LAMS和塑料支架在假性囊肿中的价值, 共纳入205例假性囊肿, 其中80例使用LAMS, 125例使用PS, 分别比较了两组在支架置入成功率、临床成功率、并发症处理和复发率、术后平均住院日等方面差异, 发现两组之间的技术成功率相当(97.5% vs 99.2%); 临床成功率LAMS高于PS(96.3% vs 87.2%); 两组需要手术干预的相仿(1.3% vs 4.9%, P = 0.17), LAMS组联合经皮引流明显低于PS组(1.3% vs 8.8%); 6个月后两组复发率相仿(6.7% vs 18.8%, P = 0.12); PS组不良反应明显高于LAMS组(17.6% vs 7.5%); 研究中LAMS组并发症发生率为7.5%, 轻中重分别为2.5%、3.8%、1.3%; 分别为感染1.3%, 支架移位3.8%, 其他2.5%, 无出血、穿孔、腹膜炎. 而PS组并发症发生率为17.6%, 轻中重分别为4.8%、8.8%、4%; 分别为感染8.8%, 无支架移位, 穿孔1.6%, 无腹膜炎, 出血5.6%, 其他1.6%. 术后住院平均住院日无差异; 结论认为LAMS比PS有优势.
不同于单纯技术探讨, 当采用卫生经济学研究LAMS对PPC的治疗效价比时, 美国学者Chen等[23]对PPC引流治疗6 mo后的患者进行疗效和费用比较, 结果显示LAMS组和PS组成功率分别为93.9%和96.96%, 每例囊肿消失的医疗费用在两组分别为18129美元(LAMS)和10403美元(PS), 结论认为LAMS对PPC的治疗效果并不优于PS且治疗费用较高, 因此应优先考虑使用PS而不是LAMS作为PPC的初始治疗.
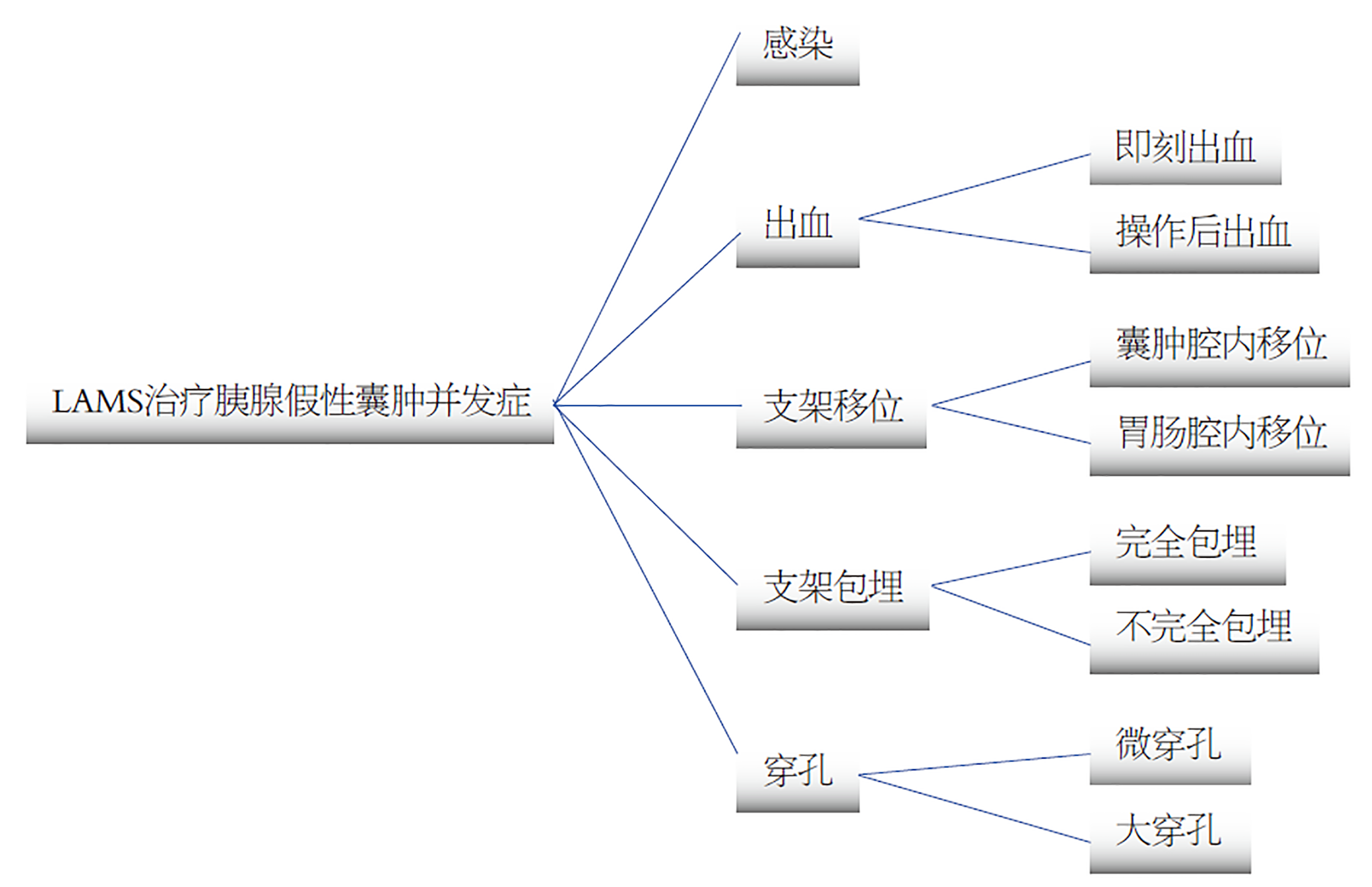
EUS引导的内镜下LAMS置入治疗常见并发症包括继发性感染、出血、支架移位及包埋和穿孔. 早期的研究报道LAMS术后感染发生率最高, 随着抗生素使用, 目前已经有所减少[15]. 穿孔通常发生在操作的即刻, 多能立即发现, 较小的穿孔或腹膜后穿孔可继续支架安置, 辅助强有力的抗感染治疗, 必要时联合经皮引流等, 通常不引起明显不适, 较大的穿孔则需要尽早中转外科手术治疗, 以免增加严重致死性并发症. 而出血及支架移位及包埋已成为目前最常见的并发症(图2).
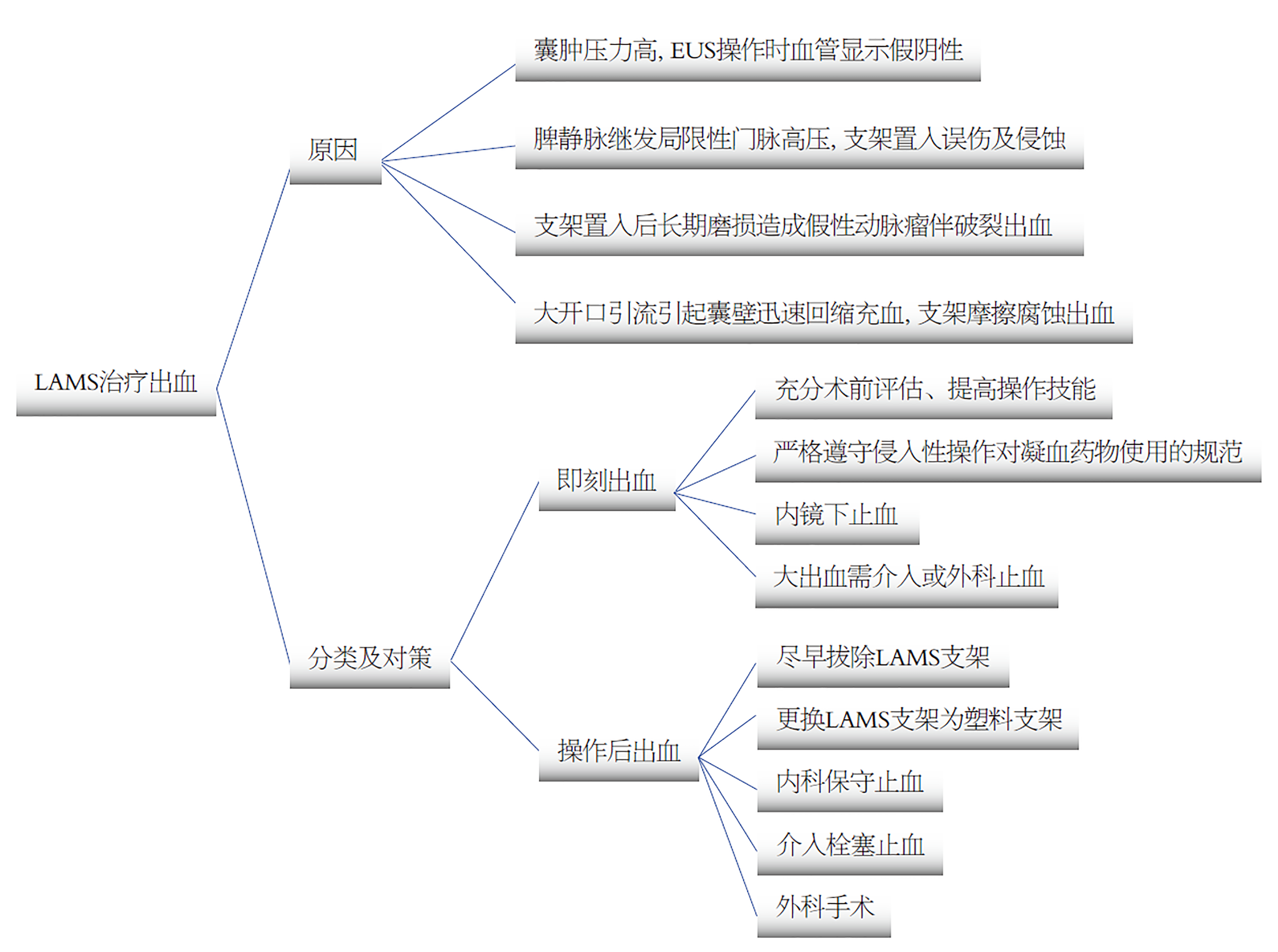
LAMS治疗过程中的出血通常分为早期出血和迟发性出血, 然而如何界定早期还是迟发性出血, 尚未达成共识. 另一种分类是将出血分为操作相关的即刻出血和操作后出血, 一般认为即刻出血发生率为1%-2%, 操作后出血更为常见[24]. LAMS置入时间越长, 发生出血的风险越高, 置入3 mo后出血率明显增加, 如Enrique等[25]研究发现大部分出血为迟发性出血, 且发生在LAMS引流术后3-6 mo, 更为有意思的是在迟发出血患者中, 64%合并脾静脉栓塞引起的区域性门脉高压, 并且同时使用抗血小板药物治疗血栓. 另外出血尚可发生在支架拔除的过程, 一般均为少量出血, 不引起严重的后果.
关于出血的原因, 目前认为有以下可能: (1)PPC在未行穿刺置管引流前, 其囊内较大的压力可明显压闭囊壁血管, 从而在EUS操作时不显示血流信息, 造成操作时的即刻出血; (2)部分PPC患者合并脾静脉血栓, 从而造成胰腺体尾部侧枝血管和胃壁侧枝血管的相对高压, 操作过程中容易误伤和支架置入后侵蚀, 造成出血; (3)置入的支架可能同囊壁作用, 造成操作相关的脾动脉假性动脉瘤, 动脉瘤的破裂直接造成出血发生; (4)置入支架, 特别是金属支架造成PPC在短时间内囊壁迅速回缩, 原本囊壁的血管急速充血, 加之物理摩擦、腐蚀等作用, 造成囊壁相关性出血[26].
关于如何减少出血, 首先需要做好术前评估, 提高操作技能, 会明显减少即刻出血的发生. 其次应严格遵守侵入性操作对凝血相关指标的把握, 如国际标准化比值>1.5、血小板计数<50×109/L应避免操作; 如果患者肾功能受损, 直接口服抗凝药物应至少停药48 h或更长时间; 此外, 动脉或静脉血管不应出现在穿刺针道内, 囊肿壁应尽量靠近EUS探头. 对于在操作过程中已经出现的即刻出血, 可以使用组织钳或球囊扩张压迫止血, 亦可选择继续放置LAMS来压迫止血; 在支架拔除过程中的出血, 多数为黏膜出血, 可通过喷洒肾上腺素或黏膜下注射治疗等止血, 少数的囊壁出血可通过内镜金属夹或电灼术止血[27]. 达到引流效果后尽早拔除支架能明显减少迟发性出血的发生和严重程度, 比如将CT复查提至术后3 wk以指导尽早拔除支架[28]. 迟发性出血一旦发生, 因为其出血点常常位于囊腔内, 内镜治疗往往因为视野的局限性和无合适的止血设备, 常常无计可施, 只能采用保守及介入治疗, 而最终80%以上的病人需要血管造影来干预胃左动脉[29]; 尚有部分出血病例可选择拔除LAMS或将LAMS更换为PS, 达到止血和减少出血的次数及严重程度的目的; 而快速的出血, 无论是即刻出血还是迟发性出血, 均只有血管介入栓塞或手术治疗(图3).
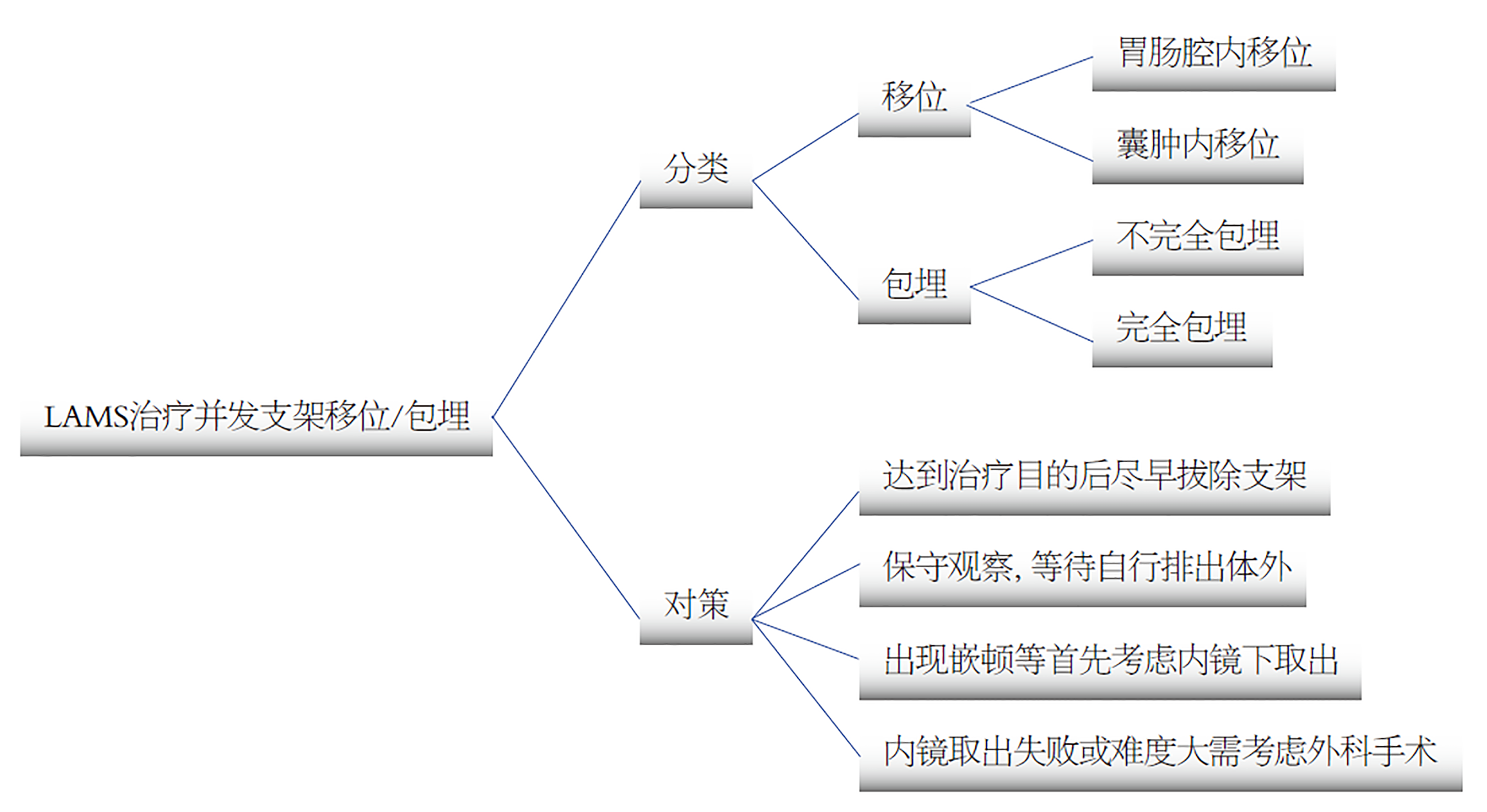
支架移位包括自发的移位和治疗过程中的医源性移位, 可以分为向胃肠腔内和囊肿腔内移位2种, 可以发生在治疗的早期, 亦可以发生在数月之后, 总的发生率为0%-19%[30]. 大多数的支架移位并不引起严重的并发症, 可通过内镜、X线、彩超等监测, 及时发现和处理, 预后均较好. 移位到胃肠腔内的支架, 部分可通过肛门自行排出, 无需特殊处理; 若及时发现支架尚在胃内或近端小肠者, 适合经胃镜下直接取出者, 建议经内镜取出; 一旦支架移位超过胃镜所能达到的部位, 亦可临床密切观察等待支架自行排出, 有条件者可尝试经小肠镜取出支架; 然而一旦支架在小肠出现明显嵌顿并出现梗阻情况, 则需要手术取出. 相对于移位到胃肠腔内的支架, 移位到囊肿腔内的支架更容易引起囊肿出口堵塞、继发感染和出血等并发症, 处理上更为棘手, 通常使用导丝、扩张球囊扩张原有的支架置入腔道, 重新建立胃肠腔与囊肿之间的腔道, 或内镜直接进入囊肿腔内使用活检钳或圈套器将支架取出, 若经过上述方法仍无法成功, 就只能外科手术治疗[31]. 当支架移位不完全时就可能发生包埋, 支架部分或完全包埋通常和支架置入时间过长有关, 部分包埋一般对囊肿引流无明显影响, 亦可顺利取出, 完全包埋等同于囊肿内移位, 处理起来相对棘手, 可尝试尽早拔除支架以避免发生(图4).
综上, PPC内引流展现良好的效果, 而EUS引导下的LAMS在假性囊肿的引流中表现出诸多优势, 但是其并发症仍不能忽视. 为此, 基于现有LAMS的设计改进也在不断的产生, Cho等[32]近期就开发了带有防迁移皮瓣和防回流阀的新型LAMS支架, 以防止并发症(例如支架迁移和肠内容物反流)发生, 从而改善支架通畅性并最大程度缩短手术后的禁食期, 初步小样本研究结果显示同塑料支架比较, 新设计的支架在置入成功率、临床有效率功和并发症发生率均没有统计学差异, 因此为EUS引导下内引流提供了另一种可信靠的选择. 将来基于LAMS的内引流能否成为假性囊肿引流的一线推荐治疗方法, 后续还需进一步更大规模的前瞻性、随机临床对症试验来验证.
学科分类: 胃肠病学和肝病学
手稿来源地: 四川省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C
D级 (一般): D, D
E级 (差): 0
编辑: 王禹乔 电编:刘继红
| 1. | Banks PA, Bollen TL, Dervenis C, Gooszen HG, Johnson CD, Sarr MG, Tsiotos GG, Vege SS; Acute Pancreatitis Classification Working Group. Classification of acute pancreatitis--2012: revision of the Atlanta classification and definitions by international consensus. Gut. 2013;62:102-111. [PubMed] [DOI] |
| 2. | Rodrigues-Pinto E, Baron TH. Evaluation of the AXIOS stent for the treatment of pancreatic fluid collections. Expert Rev Med Devices. 2016;13:793-805. [PubMed] [DOI] |
| 3. | Working Group IAP/APA Acute Pancreatitis Guidelines. IAP/APA evidence-based guidelines for the management of acute pancreatitis. Pancreatology. 2013;13:e1-15. [PubMed] [DOI] |
| 4. | Ge PS, Weizmann M, Watson RR. Pancreatic Pseudocysts: Advances in Endoscopic Management. Gastroenterol Clin North Am. 2016;45:9-27. [PubMed] [DOI] |
| 5. | Alali A, Mosko J, May G, Teshima C. Endoscopic Ultrasound-Guided Management of Pancreatic Fluid Collections: Update and Review of the Literature. Clin Endosc. 2017;50:117-125. [PubMed] [DOI] |
| 6. | Chandran S, Efthymiou M, Kaffes A, Chen JW, Kwan V, Murray M, Williams D, Nguyen NQ, Tam W, Welch C, Chong A, Gupta S, Devereaux B, Tagkalidis P, Parker F, Vaughan R. Management of pancreatic collections with a novel endoscopically placed fully covered self-expandable metal stent: a national experience (with videos). Gastrointest Endosc. 2015;81:127-135. [PubMed] [DOI] |
| 7. | Gurusamy KS, Pallari E, Hawkins N, Pereira SP, Davidson BR. Management strategies for pancreatic pseudocysts. Cochrane Database Syst Rev. 2016;4:CD011392. [PubMed] [DOI] |
| 8. | Bang JY, Hawes R, Bartolucci A, Varadarajulu S. Efficacy of metal and plastic stents for transmural drainage of pancreatic fluid collections: a systematic review. Dig Endosc. 2015;27:486-498. [PubMed] [DOI] |
| 9. | Sharaiha RZ, DeFilippis EM, Kedia P, Gaidhane M, Boumitri C, Lim HW, Han E, Singh H, Ghumman SS, Kowalski T, Loren D, Kahaleh M, Siddiqui A. Metal versus plastic for pancreatic pseudocyst drainage: clinical outcomes and success. Gastrointest Endosc. 2015;82:822-827. [PubMed] [DOI] |
| 10. | Lee BU, Song TJ, Lee SS, Park DH, Seo DW, Lee SK, Kim MH. Newly designed, fully covered metal stents for endoscopic ultrasound (EUS)-guided transmural drainage of peripancreatic fluid collections: a prospective randomized study. Endoscopy. 2014;46:1078-1084. [PubMed] [DOI] |
| 14. | 唐 宇, 高 羚芯, 孙 晓滨, 奚 维东, 姜 琳, 胡 霞, 史 维. 内镜超声引导下经胃壁置入蕈型金属支架治疗儿童胰腺周围包裹性坏死一例. 中华消化内镜杂志. 2019;36:56-57. [DOI] |
| 15. | Walter D, Will U, Sanchez-Yague A, Brenke D, Hampe J, Wollny H, López-Jamar JM, Jechart G, Vilmann P, Gornals JB, Ullrich S, Fähndrich M, de Tejada AH, Junquera F, Gonzalez-Huix F, Siersema PD, Vleggaar FP. A novel lumen-apposing metal stent for endoscopic ultrasound-guided drainage of pancreatic fluid collections: a prospective cohort study. Endoscopy. 2015;47:63-67. [PubMed] [DOI] |
| 16. | Itoi T, Binmoeller KF, Shah J, Sofuni A, Itokawa F, Kurihara T, Tsuchiya T, Ishii K, Tsuji S, Ikeuchi N, Moriyasu F. Clinical evaluation of a novel lumen-apposing metal stent for endosonography-guided pancreatic pseudocyst and gallbladder drainage (with videos). Gastrointest Endosc. 2012;75:870-876. [PubMed] [DOI] |
| 17. | Petrone MC, Archibugi L, Forti E, Conigliaro R, Di Mitri R, Tarantino I, Fabbri C, Larghi A, Testoni SGG, Mutignani M, Arcidiacono PG. Novel lumen-apposing metal stent for the drainage of pancreatic fluid collections: An Italian multicentre experience. United European Gastroenterol J. 2018;6:1363-1371. [PubMed] [DOI] |
| 18. | Venkatachalapathy SV, Bekkali N, Pereira S, Johnson G, Oppong K, Nayar M, Leeds J, Paranandi B, Penman I, Carroll N, Godfrey E, James M, Aithal G, McKay C, Devlin J, Wong T, Makin A, Ryan B, Huggett M. Multicenter experience from the UK and Ireland of use of lumen-apposing metal stent for transluminal drainage of pancreatic fluid collections. Endosc Int Open. 2018;6:E259-E265. [PubMed] [DOI] |
| 19. | Ge N, Hu J, Sun S, Linghu E, Jin Z, Li Z. Endoscopic Ultrasound-guided Pancreatic Pseudocyst Drainage with Lumen-apposing Metal Stents or Plastic Double-pigtail Stents: A Multifactorial Analysis. J Transl Int Med. 2017;5:213-219. [PubMed] [DOI] |
| 20. | Yang D, Perbtani YB, Mramba LK, Kerdsirichairat T, Prabhu A, Manvar A, Ho S, Pannu D, Keswani RN, Strand DS, Wang AY, Quintero E, Buscaglia JM, Muniraj T, Aslanian HR, Draganov PV, Siddiqui AS. Safety and rate of delayed adverse events with lumen-apposing metal stents (LAMS) for pancreatic fluid collections: a multicenter study. Endosc Int Open. 2018;6:E1267-E1275. [PubMed] [DOI] |
| 21. | Aburajab M, Smith Z, Khan A, Dua K. Safety and efficacy of lumen-apposing metal stents with and without simultaneous double-pigtail plastic stents for draining pancreatic pseudocyst. Gastrointest Endosc. 2018;87:1248-1255. [PubMed] [DOI] |
| 22. | Yang J, Chen YI, Friedland S, Holmes I, Paiji C, Law R, Hosmer A, Stevens T, Matheus F, Pawa R, Mathur N, Sejpal D, Inamdar S, Berzin TM, DiMaio CJ, Gupta S, Yachimski PS, Anderloni A, Repici A, James T, Jamil LH, Ona M, Lo SK, Gaddam S, Dollhopf M, Alammar N, Shieh E, Bukhari M, Kumbhari V, Singh V, Brewer O, Sanaei O, Fayad L, Ngamruengphong S, Shin EJ, Baron TH, Khashab MA. Lumen-apposing stents versus plastic stents in the management of pancreatic pseudocysts: a large, comparative, international, multicenter study. Endoscopy. 2019;51:1035-1043. [PubMed] [DOI] |
| 23. | Chen YI, Khashab MA, Adam V, Bai G, Singh VK, Bukhari M, Brewer Gutierrez O, Elmunzer BJ, Moran RA, Fayad L, El Zein M, Kumbhari V, Repici A, Barkun AN. Plastic stents are more cost-effective than lumen-apposing metal stents in management of pancreatic pseudocysts. Endosc Int Open. 2018;6:E780-E788. [PubMed] [DOI] |
| 24. | Ahn JY, Seo DW, Eum J, Song TJ, Moon SH, Park DH, Lee SS, Lee SK, Kim MH. Single-Step EUS-Guided Transmural Drainage of Pancreatic Pseudocysts: Analysis of Technical Feasibility, Efficacy, and Safety. Gut Liver. 2010;4:524-529. [PubMed] [DOI] |
| 25. | Vazquez-Sequeiros E, Baron TH, Pérez-Miranda M, Sánchez-Yagüe A, Gornals J, Gonzalez-Huix F, de la Serna C, Gonzalez Martin JA, Gimeno-Garcia AZ, Marra-Lopez C, Castellot A, Alberca F, Fernandez-Urien I, Aparicio JR, Legaz ML, Sendino O, Loras C, Subtil JC, Nerin J, Perez-Carreras M, Diaz-Tasende J, Perez G, Repiso A, Vilella A, Dolz C, Alvarez A, Rodriguez S, Esteban JM, Juzgado D, Albillos A; Spanish Group for FCSEMS in Pancreas Collections. Evaluation of the short- and long-term effectiveness and safety of fully covered self-expandable metal stents for drainage of pancreatic fluid collections: results of a Spanish nationwide registry. Gastrointest Endosc. 2016;84:450-457.e2. [PubMed] [DOI] |
| 26. | Săftoiu A, Ciobanu L, Seicean A, Tantău M. Arterial bleeding during EUS-guided pseudocyst drainage stopped by placement of a covered self-expandable metal stent. BMC Gastroenterol. 2013;13:93. [PubMed] [DOI] |
| 27. | Escorsell A, Bosch J. Self-expandable metal stents in the treatment of acute esophageal variceal bleeding. Gastroenterol Res Pract. 2011;2011:910986. [PubMed] [DOI] |
| 28. | DeSimone ML, Asombang AW, Berzin TM. Lumen apposing metal stents for pancreatic fluid collections: Recognition and management of complications. World J Gastrointest Endosc. 2017;9:456-463. [PubMed] [DOI] |
| 29. | Stecher SS, Simon P, Friesecke S, Glitsch A, Kühn JP, Lerch MM, Mayerle J. Delayed severe bleeding complications after treatment of pancreatic fluid collections with lumen-apposing metal stents. Gut. 2017;66:1871-1872. [PubMed] [DOI] |
| 30. | McVay T, Adler DG. EUS-guided drainage of pancreatic fluid collections: Double pigtails, metal biliary, or dedicated transluminal stents? Endosc Ultrasound. 2015;4:1-3. [PubMed] [DOI] |
| 31. | Razzak A, Larsen M, Irani S, Gan SI, Ross A. Small-bowel obstruction due to a migrated lumen-apposing metal stent. Gastrointest Endosc. 2016;84:867-869. [PubMed] [DOI] |