修回日期: 2020-01-12
接受日期: 2020-02-20
在线出版日期: 2020-02-28
现有研究对胡桃苷在非酒精性脂肪性肝病(nonalcoholic fatty liver disease, NAFLD)中的治疗作用尚未得到充分关注.
本研究通过高脂饮食(high fatty diet, HFD)小鼠模型评估了胡桃苷在NAFLD中的治疗效果.
C57BL/6小鼠分为标准饮食组、HFD组、胡桃苷低、中和高剂量治疗组. 给药方案结束后, 采集小鼠血样和组织(肝和小肠)进行生化及组织学测定.
胡桃苷抑制了HFD诱导的肝组织形态学改变和肝脂质沉积, 并降低了血清中谷草转氨酶、谷丙转氨酶和胆固醇含量以及葡萄糖、血清胰岛素水平和胰岛素抵抗稳态模型值. 胡桃苷显著改善了HFD引起的代谢损伤, 增加了肝脏过氧化物酶体增殖体激活受体及其下游调节基因成纤维细胞生长因子21的mRNA水平, 并且提高了乙酰辅酶A羧化酶的磷酸化水平和肉碱-棕榈酰基转移酶的mRNA水平. 此外, 胡桃苷还减少了肝脏炎症, 恢复了肠道屏障的完整性和功能(FITC-dextran通透性下降和小肠组织紧密连接蛋白1表达增加).
胡桃苷可恢复NAFLD引起的脂肪变性、减少肝脏炎症、恢复葡萄糖稳态和改善肠道完整性.
核心提要: 目前对非酒精性脂肪肝(nonalcoholic fatty liver disease, NAFLD)的防治效果并不十分理想. 本实验发现, 胡桃苷可改善NAFLD小鼠的肝脂肪变性、肝损伤、炎症反应、脂质代谢紊乱以及小肠通透性受损, 提示胡桃苷是一种潜在的抗NAFLD药物.
引文著录: 虞玲燕, 李卫英, 林佳. 控胡桃苷对非酒精性脂肪性肝小鼠中肝脂质代谢紊乱、肝损伤以及小肠完整性的改善作用. 世界华人消化杂志 2020; 28(4): 113-121
Revised: January 12, 2020
Accepted: February 20, 2020
Published online: February 28, 2020
The potential therapeutic effects of Juglanin in nonalcoholic fatty liver disease (NAFLD) have not been clearly explored.
To evaluate the therapeutic effects of Juglanin in NAFLD by using a mouse model fed a high-fat diet (HFD).
C57BL/6 mice were divided into a standard diet group, an HFD group, and low-, medium-, and high-dose Juglanin treatment groups. After administration, blood samples and tissues (liver and small intestine) were collected for biochemical and histological measurements.
Juglanin attenuated the HFD-induced hepatic histomorphological changes and lipid deposition and reduced the contents of serum aspartate aminotransferase, alanine transaminase, and cholesterol, as well as the levels of blood glucose, serum insulin, and homeostasis assessment of insulin resistance. Juglanin significantly improved the metabolic damage induced with an HFD, increased the mRNA levels of liver peroxisome proliferator-activated receptor α and its downstream regulatory gene fibroblast growth factor 21, and increased the phosphorylation level of acetyl CoA carboxylase and the mRNA level of carnitine-palmitoyl transferase. In addition, Juglanin also reduced liver inflammation and restored intestinal barrier integrity and function with regard to decreasing FITC-dextran permeability and increasing the expression of tight junction protein zonula occludens-1 in small intestinal tissues.
Juglanin can restore NAFLD-induced steatosis, reduce liver inflammation, restore glucose homeostasis, and improve intestinal integrity in mice.
- Citation: Yu LY, Li WY, Lin J. Juglanin improves lipid metabolism disorder, liver injury, and intestinal integrity in nonalcoholic fatty liver mice. Shijie Huaren Xiaohua Zazhi 2020; 28(4): 113-121
- URL: https://www.wjgnet.com/1009-3079/full/v28/i4/113.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v28.i4.113
非酒精性脂肪肝(nonalcoholic fatty liver disease, NAFLD)是以肝细胞中异常的脂质积累和脂肪变性为特征并伴随肝损伤的慢性代谢异常性肝病[1]. 该类疾病若治疗不当或重视度不足, 会最终进展为肝纤维化或肝癌[2]. 据报道[3], 全球约有30%成年人口罹患NAFLD, 因此, NAFLD己成为一种全球性质的严重威胁人类健康的代谢性疾病. 而目前现有的NAFLD治疗措施的效果并不十分的理想.
NAFLD的发病机制复杂, 主要包括胰岛素抵抗(insulin resistance, IR)引发的肝脂代谢紊乱并进一步触发的氧化应激和内质网应激, 最终引起肝细胞的脂质炎症反应、细胞损伤和凋亡[4]. 细胞炎症因子如肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、白细胞介素6(interleukin 6, IL-6)等可通过抑制胰岛素信号传导和肝细胞凋亡的机制, 在IR和肝细胞炎症的发展中起着关键作用[5]. 并且, 研究[6]发现, 核受体家族的一些成员不仅是肝脏脂肪生成的关键调节因子, 而且也是肝脏和全身炎症的关键调节因子, 特别是过氧化物酶体增殖体激活受体α(peroxisome proliferators-activated receptors, PPAR-α), 其主要表达于肝脏, 通过控制脂质合成基因的表达参与体内脂质循环和细胞脂质的代谢. 因此, 它与脂肪变性的发生和发展密切相关, 目前它是该疾病的治疗靶点. 近年来, 胡桃苷作为从胡桃楸的绿色果壳、胡桃叶、茴香茎叶和透骨草中提取的天然化合物, 对炎症反应和肿瘤生长有抑制作用[7]. Zhou等[8]在果糖诱导的肝炎大鼠模型中研究发现, 胡桃苷可抑制果糖诱导的肝损伤和肝炎. 由以上背景推测, 胡桃苷可能会对NAFLD产生一定的治疗作用. 然而, 目前关于胡桃苷对NAFLD中作用的研究尚未见报道. 因此, 本实验采用高脂饮食(high fat diet, HFD)的实验模型来诱导小鼠NAFLD, 观察胡桃苷对HFD诱导的肝脂肪变性和肝损伤、炎症和脂质代谢紊乱以及小肠通透性受损的影响, 并分析其中的机制.
1.1.1 实验动物: 30只8周龄SPF级C57BL/6小鼠购自浙江维通利华实验动物技术有限公司[SCXK(浙)2019-0001], 饲养于台州恩泽医疗中心(集团)动物实验中心SPF级动物房[SYXK(浙)2014-0020], 饲养环境为模拟昼夜12 h/12 h交替、室温22-25 ℃、50%-60%湿度, 小鼠可自由饮水.
1.1.2 实验试剂: 胡桃苷购于上海酶联生物公司; 苏木精-伊红(hematoxylin-eosin, HE)染液试剂盒、油红O染液、小鼠胰岛素(insulin) ELISA试剂盒和FITC-Dextran购于上海雅吉生物公司; 小鼠谷丙转氨酶(alanine transaminase, ALT) ELISA试剂盒和小鼠谷草转氨酶(aspartate aminotransferase, AST) ELISA试剂盒购于南京建成生物公司; 胆固醇(cholesterol, CHOL)试剂盒购于美国Biovision公司; TRIzol试剂购于美国Invitrogen公司; Prime Script RT Master Mix试剂盒购于大连TaKaRa公司; 乙酰辅酶A羧化酶(Acetyl CoA carboxylase, ACC)、磷酸化ACC(phospho-ACC, p-ACC)、IL-6、IL-1β、TNF-α和β-Actin抗体购自美国Cell Signaling Technology公司; 紧密连接蛋白1(tight junction protein zonula occludens-1, ZO-1)抗体购自美国Abcame公司.
1.2.1 小鼠分组与处理: 30只C57BL/6小鼠, 随机分成标准饮食组(standard diet, STD)、高脂饮食组(high fat diet, HFD)、胡桃苷低剂量治疗组(HFD+Low dose, HFD+L)、胡桃苷中剂量治疗组(HFD+Middle dose, HFD+M)、胡桃苷高剂量治疗组(HFD+High dose, HFD+H), 每组6只小鼠. STD饲料含有15%脂肪、22%蛋白质和63%碳水化合物, 而HFD饲料含有58%脂肪、18%蛋白质和24%碳水化合物. STD组采用STD饲料连续喂养8 wk; HFD组采用HFD饲料连续喂养8 wk; 胡桃苷低、中、高剂量治疗组采用HFD饲料连续喂养8 wk, 并在第5周末分别给予5、10和20 mg/kg·d胡桃苷灌胃, 连续3 wk.
1.2.2 血液生化检测: 小鼠在给药方案结束后, 禁食禁水12 h, 并通过腹腔注射氯胺酮麻醉小鼠, 摘取眼球采血, 取血清. 血清ALT、AST、CHOL、空腹血糖和空腹insulin根据试剂盒说明书步骤进行检测. 并通过稳态模式评估公式: (homeostasis assessment of insulin resistance, HOMA-IR) = [空腹血糖(mmol/L)×空腹insulin (μU/mL)]/22.5计算IR程度.
1.2.3 FITC-Dextran检测肠道通透性: 小鼠在给药方案结束后, 禁食禁水12 h, 并通过腹腔注射氯胺酮麻醉小鼠, 经口灌胃0.5 g/kg FITC-Dextran后, 4 h后, 通过门静脉取血, 用荧光酶标仪测量门静脉血中490 nm激发波长和520 nm发射波长下荧光值来评估肠道通透性变化.
1.2.4 组织收集: 给药结束后, 通过腹腔注射氯胺酮麻醉小鼠, 暴露腹部并解剖肝脏和十二指肠组织. 每种组织分两部分, 一部分冷冻于液氮中, 用于随后的组织学染色分析, 一部分用4%多聚甲醛固定24 h后用于石蜡包埋处理.
1.2.5 肝组织HE染色: 取肝脏石蜡组织, 切为5 μL厚度的切片, 并脱蜡至水后, 根据HE试剂盒说明书步骤行常规HE染色, 显微镜下观察肝组织形态学变化.
1.2.6 肝组织油红O染色: 取肝脏石蜡组织, 切为5 μL厚度的切片, 并脱蜡至水后, 根据HE试剂盒说明书步骤行油红O染色, 显微镜下观察肝组织油红O染色情况, 以评估肝组织脂质蓄积情况.
1.2.7 实时荧光定量聚合酶链反应(real-time quantitative polymerase chain reaction, RT-qPCR): 用TRIzol试剂从肝组织中提取总RNA, 并使用Prime Script RT Master Mix逆转录合成cDNA, 并以cDNA作为模板, 在2×Power SYBR Green PCR体系中分别加入2 μg总RNA、PCR引物, 进行RT-qPCR反应. 以GAPDH作为内参, 用2-ΔΔCT方法计算目的基因相对表达水平. 本实验应用的PCR引物序列为: PPAR-α(正向): 5'-GTGCCTGTCCGTCGGGATGT-3', PPAR-α(反向): 5'-GTGAGCTCGGTGACGGTCTC-3'; 肉碱-棕榈酰基转移酶(carnitine palmitoyltransferase 1a, CPT1a)(正向): 5'-CGCTCATGGTCAACAGCAACTACT-3', CPT1a(反向): 5'-CTCACGGTCTAATGTGCGACGA-3'; 成纤维细胞生长因子21(fibroblast growth factor 21, FGF21)(正向): 5'-AGATCAGGGAGGATGGAACA-3', FGF21(反向): 5'-ATCAAAGTGAGGCGATCCATA-3'; GAPDH(正向): 5'-GGCACAGTCAAGGCTGAGAATG-3', GAPDH(反向): 5'-ATGGTGGTGAAGACGCCAGTA-3'.
1.2.8 免疫组化检测: 取石蜡组织, 切为5 μL厚度的切片, 并脱蜡至水后, 根据免疫组化试剂盒说明书进行操作. 其中, 肝组织室温孵育TNF-α、IL-6和IL-1β抗体(1:500)2 h, 小肠组织室温孵育ZO-1抗体(1:500)1.5 h, 并孵育辣根过氧化物标记二抗(1:500)1 h, DAB显色10 min, 苏木精复染5 min, 显微镜下观察组织染色情况.
1.2.9 蛋白免疫印迹实验: 肝组织匀浆后, 加入RIPA缓冲液(150 mmol/L NaCl, 5 mmol/L 乙二胺四乙酸, 50 mmol/L Tris-HCl, 1%Nonidet P-40, 0.5%脱氧胆酸钠, 0.1%SDS)萃取蛋白. 蛋白在10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳中分离, 并通过半干法将凝胶上蛋白转移到硝酸纤维素膜上. 用5%(w/v)脱脂乳室温下封闭1 h, 然后一抗(ACC、p-ACC、TNF-α和β-Actin抗体, 1:1000)4 ℃孵育过夜, 第二天用洗膜液洗膜后, 用辣根过氧化物标记二抗(1:10000)在室温下孵育2 h. 用洗膜液洗膜后通过ECL发光液显现目的条带, 以β-Actin作为内参, 通过Image J量化目的条带相对表达量.
统计学处理 结果采用平均值±标准误(mean±SE)表示, 使用Graphpad Prism 7.0软件对数据进行分析. 数据的多重比较下采用采用方差分析后Fisher's最小显著差异法(least significant difference, LSD)进行比较. P<0.05认为有统计学差异.
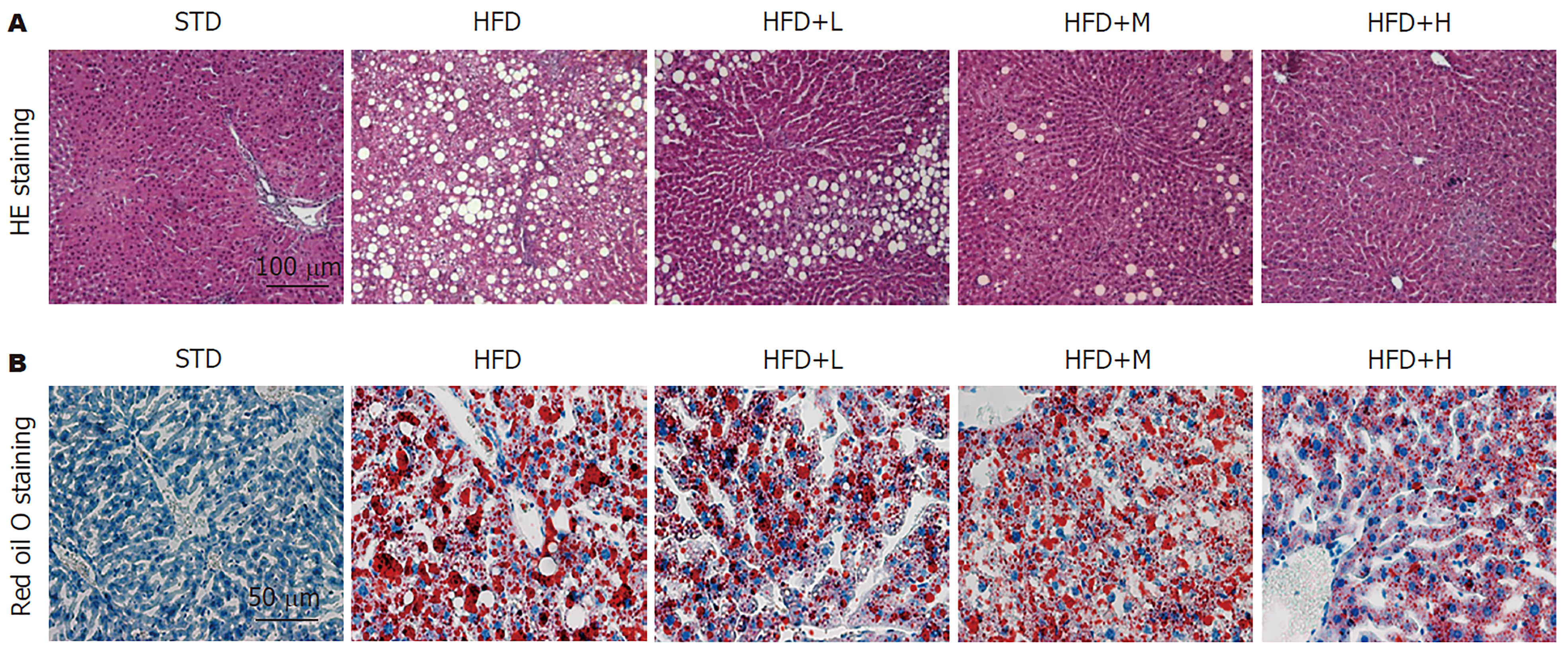
肝组织以HE染色和油红O染色分析其炎症损伤和脂肪变性程度. HE染色结果(图1A)显示, STD组肝组织形态学正常, 肝细胞结构清晰, 未见炎性细胞浸润现象; HFD组肝组织中肝细胞结构不清并呈现膨胀坏死现象, 大量混合性炎性细胞浸润; 而胡桃苷治疗组呈剂量依赖地显著逆转HFD诱导的肝组织结构变性. 油红O染色结果(图1B)显示, STD组肝组织未见明显的油红O染色; HFD组肝组织中呈现大量油红O染色液滴, 提示微泡脂肪变性并脂质蓄积; 而胡桃苷治疗组呈剂量依赖地显著逆转HFD诱导的肝组织脂质蓄积. 以上结果提示, 胡桃苷可以抑制HFD诱导的小鼠肝组织炎性病变和脂肪变性.
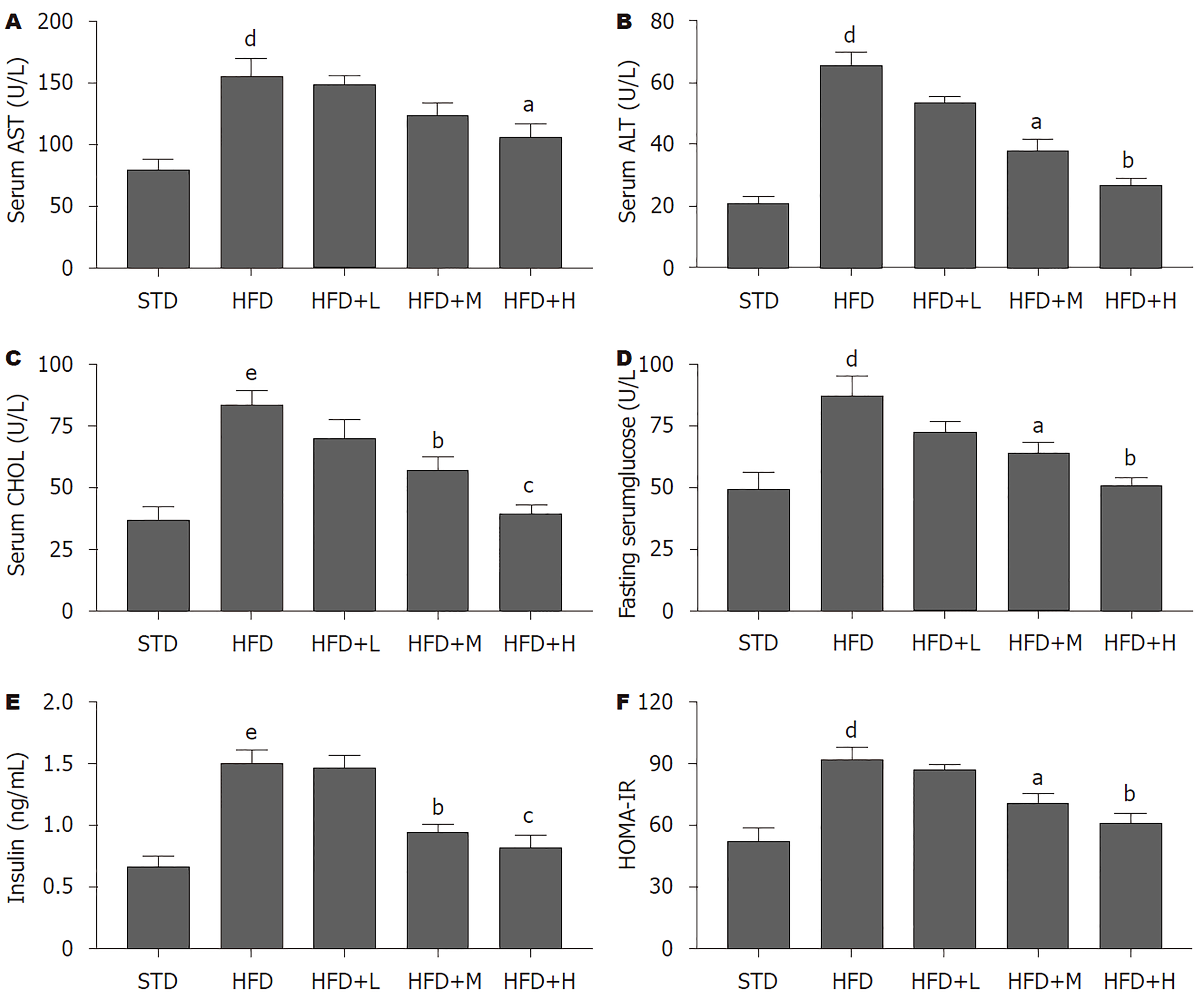
在肝功能方面(图2A-C), 相比于STD组, HFD组血清AST、ALT和CHOL含量均上升(P<0.01), 说明HFD对小鼠肝功能造成了一定程度的损伤; 相比于HFD组, 高剂量胡桃苷治疗组血清AST(P<0.05)、ALT(P<0.01)和CHOL(P<0.001)含量均下降, 中剂量胡桃苷治疗组血清ALT(P<0.05)和CHOL(P<0.01)含量下降, 低剂量胡桃苷治疗对这三种指标AST、ALT和CHOL含量均无显著影响. 在糖代谢方面(图2D-F), 相比于STD组, HFD组葡萄糖(P<0.01)、胰岛素(P<0.001)和IR水平(P<0.01)指标(HOMA-IR)明显升高; 相比于HFD组, 中、高剂量胡桃苷治疗组以上糖代谢相关指标明显降低(P<0.05或P<0.01), 低剂量胡桃苷治疗组并未显示出明显的治疗效果. 以上结果提示, 胡桃苷能改善HFD造成小鼠肝功能损伤和血糖稳态紊乱.
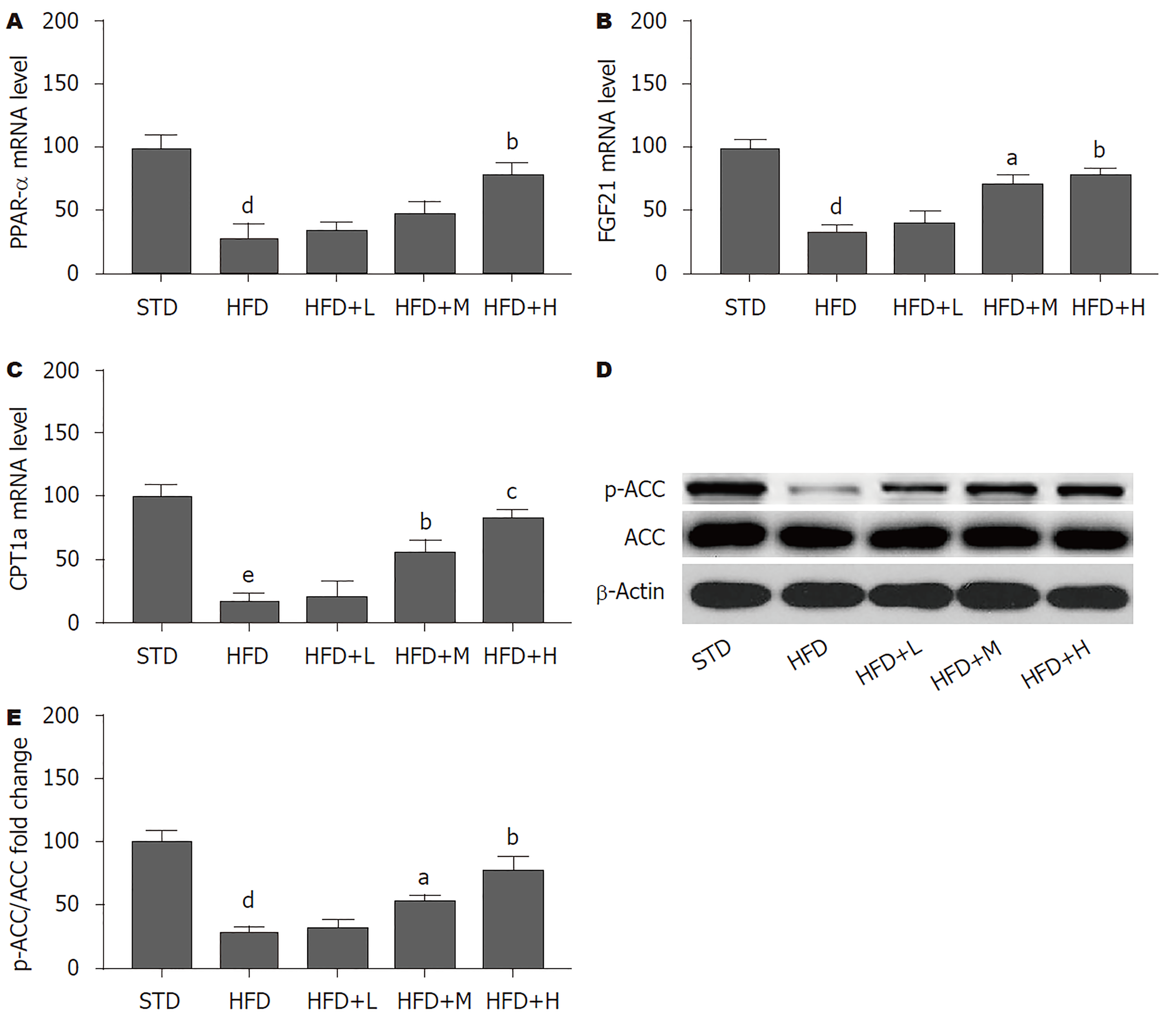
RT-qPCR实验结果(图3A-C)显示, 相比于STD组, HFD组肝组织PPAR-α的mRNA水平以及PPAR-α下游FGF21和以及CPT1a 的mRNA水平均明显降低(P<0.01或P<0.001); 相比于HFD组, 中、高剂量胡桃苷治疗组以上指标明显升高(P<0.05或P<0.01). 蛋白免疫印迹结果(图3D、E)显示, 相比于STD组, HFD组肝组织ACC的磷酸化水平明显降低(P<0.001); 相比于HFD组, 中、高剂量胡桃苷治疗组肝组织ACC的磷酸化水平明显增加(P<0.05或P<0.01). 以上结果提示, 胡桃苷可部分逆转HFD导致的小鼠肝脏脂质代谢障碍以及降低其对脂肪酸氧化的影响.
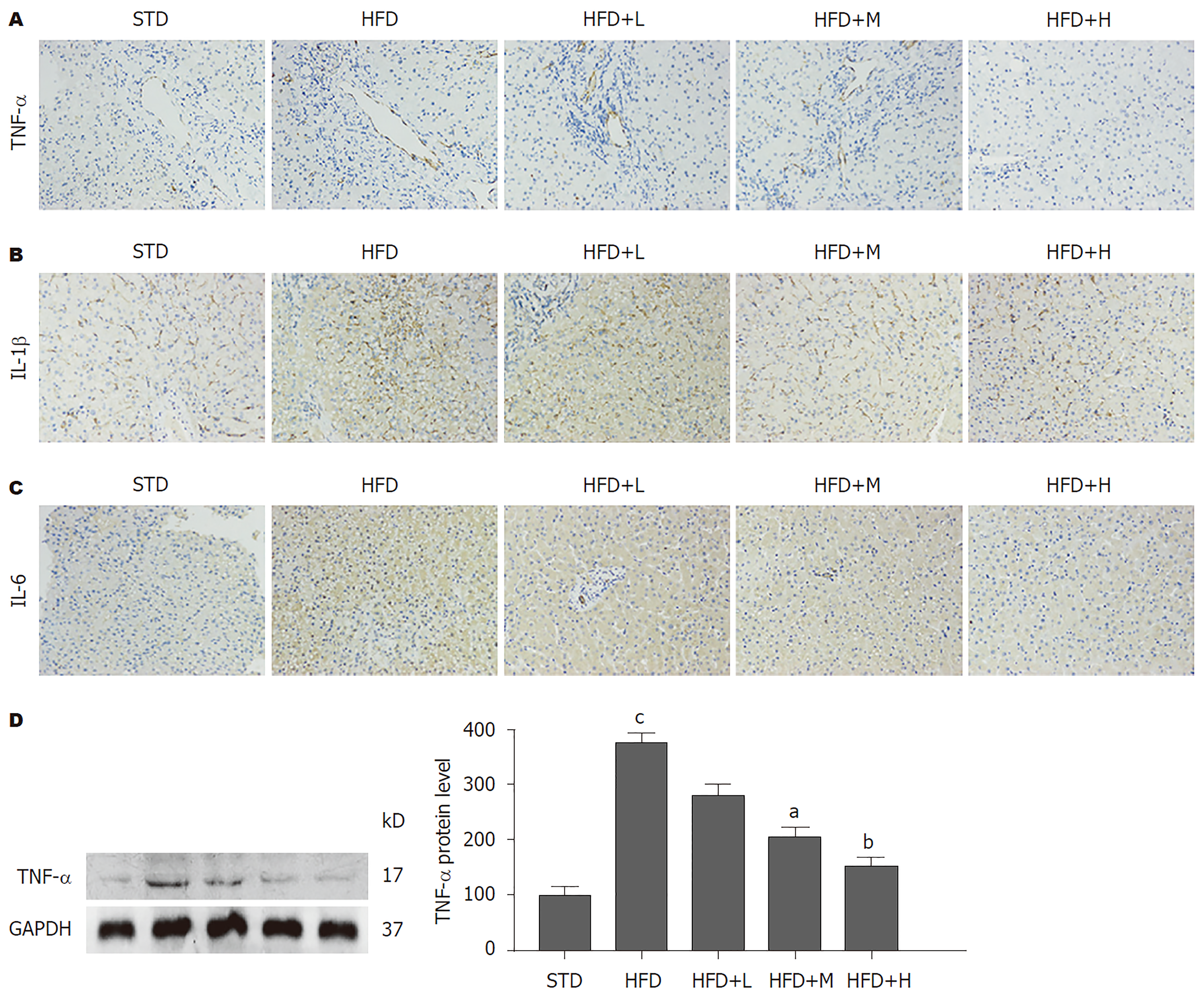
在免疫组化结果(图4A-C)显示, STD组小鼠肝组织TNF-α(图4A)、IL-1β(图4B)和IL-6(图4C)的表达呈低水平或未检测出, HFD组小鼠肝组织中TNF-α(图4A)、IL-1β(图4B)和IL-6(图4C)表达呈高水平, 而胡桃苷治疗组呈剂量依赖地抑制HFD诱导的肝组织中此三种炎症因子的水平. 蛋白免疫印记结果(图4D)显示, 相比于STD组, HFD组小鼠肝组织中TNF-α的蛋白表达量明显增加(P<0.001); 相比于HFD组, 中、高剂量胡桃苷治疗组肝组织中TNF-α的蛋白表达量明显降低(P<0.01; P<0.001). 这些结果进一步验证了胡桃苷能有效逆转HFD带来的炎症的影响. 以上结果提示, 胡桃苷可抑制HFD导致的小鼠肝脏炎症因子的合成.
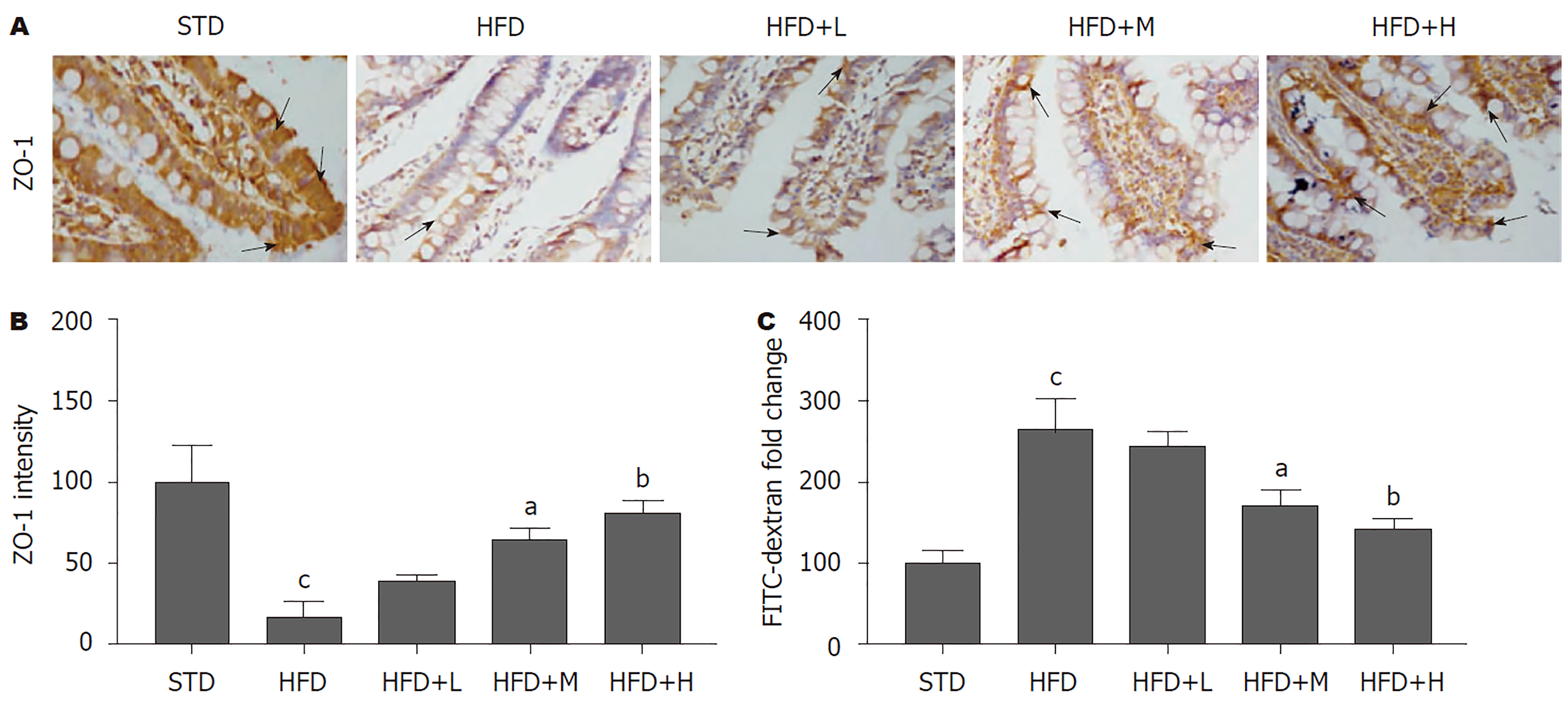
为研究胡桃苷对肝肠轴的影响, 用免疫组化技术观察小鼠小肠ZO-1的表达情况. 免疫组化结果(图5A、B)显示, 相比于STD组, HFD组小鼠小肠组织中ZO-1含量明显降低(P<0.01); 相比于HFD组, 中、高剂量胡桃苷治疗组肝组织中ZO-1的表达量明显增加(P<0.05; P<0.01). 此结果说明胡桃苷一定程度逆转了HFD对小鼠小肠通透性的损伤. FITC-dextran结果(图5C)同样显示, 相比于STD组, HFD组小鼠血液中FITC荧光水平明显增加(P<0.01), 提示, 肠道通透性明显增加; 相比于HFD组, 中、高剂量胡桃苷治疗组血液中FITC荧光水平明显降低(P<0.05; P<0.01), 提示, 肠道通透性明显降低. 以上结果共同提示, 胡桃苷可抑制HFD导致的小鼠肠道通透性增加.
NAFLD是一种无症状的慢性肝病, 是导致肝功能紊乱的主要原因之一[1]. NAFLD的典型特征是肝细胞脂质积累超过5.5%, 使肝脏对炎症和损伤过于敏感[9]. NAFLD诱导的肝细胞损伤具有广泛的病理表现, 如IR、肝脏脂肪堆积或肠道通透性增加[10]. 已有报道[11], 8 wk HFD诱导NAFLD小鼠的造模时间以模拟肝脏脂肪变性的早期阶段. 本研究采用8 wk HFD诱导NAFLD小鼠, 研究结果显示, 胡桃苷对肝脏在早期炎症方面的保护作用, 并揭示了其在改善肝脏代谢损伤方面的作用.
NAFLD早期阶段的主要发病机制是IR造成肝脂代谢障碍[12]. 本实验结果显示, 胡桃苷能恢复葡萄糖稳态和胰岛素敏感性, 降低空腹血糖、胰岛素浓度和HOMA指数, 并可抑制AST和ALT等肝损伤标志物的增加, 并改善HFD引起的脂肪变性等组织学改变.
在NAFLD中, 已证实PPAR-α信号途径发生改变, HFD的PPAR-α-/-小鼠肝组织的肝细胞中存在异常的脂质积累[13]. 在本实验中, HFD喂养的小鼠肝脏中PPAR-α表达降低, 而胡桃苷可恢复PPAR-α表达水平. 并且, 我们还发现, HFD喂养可降低ACC的磷酸化. 有文献[14]指出: ACC是AMPK途径中的下游调节蛋白, 参与调节CPT1a活性. AMPK诱导ACC磷酸化, 使丙二酰辅酶A(Malonyl-CoA)合成减少. Malonyl-CoA的减少反过来又降低了对肝脏CPT1a的抑制, 从而促使脂肪酸充分进入线粒体氧化[15]. 在这里, 我们发现胡桃苷增加了ACC的磷酸化和肝脏CPT1a的转录, 而这两者都被HFD显著降低. CPT1a表达的水平的上升与其转录调节因子PPAR-α的恢复一致. 并且, 我们还观察到, 胡桃苷治疗不仅增加了PPAR-α的表达水平, 而且还恢复了其下游调节基因FGF21在肝脏中的表达. FGF21是一种细胞因子, 其转录受PPAR-α调节[16]. FGF21是肝脏脂质氧化和甘油三酯代谢的关键蛋白[17]. 综上, 我们的数据表明胡桃苷可增加脂肪酸代谢能力和并提高胰岛素敏感性.
由脂质积聚触发的肝细胞炎症是导致NAFLD进展至肝细胞凋亡的关键步骤之一[18]. 在我们的研究中, 还证实了胡桃苷在抗肝组织炎性反应的作用. 本实验结果显示, 胡桃苷显著降低了肝脏中的炎性细胞因子(TNF-α、IL-6和IL-1β)的表达, 证实了其抗炎的作用, 这可能与其通过PPAR-α调节代谢的能力有关. 脂代谢紊乱、线粒体损伤和氧化应激在肝细胞损伤方面具有重要作用, 其加速了炎症和NAFLD进展[12,18].
NAFLD发病和进展过程中的另一个关键因素是肠道内毒素. 肠道的完整性主要靠肠上皮细胞通过微绒毛、紧密连接和抗菌肽等物质维持. 包括ZO-1在内的紧密连接蛋白是影响各种物质从肠道到血液转运的细胞粘附因子[19]. 当肠道通透性增加时, 内毒素从门静脉流入肝脏, 损害肝内代谢平衡并引发组织炎症[20]. 胡桃苷可以恢复肠道完整性, 这一点被血浆FITC-dextran水平降低和小肠ZO-1(一种重要的紧密连接蛋白, 被HFD喂养后显著降低)表达增加所证明.
总之, 本实验表明, 胡桃苷能够抑制HFD诱导的肝脂肪变性和早期肝损伤、减少炎症并调节脂质代谢, 最后, 本研究也证明了胡桃苷能够改善脂肪摄取过多导致的小肠通透性受损. 本实验结果还提示, 胡桃苷可能是NAFLD潜在的治疗药物.
非酒精性脂肪肝(nonalcoholic fatty liver disease, NAFLD)已成为一种世界性公共卫生问题, 而目前对NAFLD的防治效果并不十分理想. 因此, 需要继续对抗NAFLD药物进行继续筛选.
在果糖诱导的肝炎大鼠模型中研究发现, 胡桃苷可抑制果糖诱导的肝损伤和肝炎. 推测, 胡桃苷可能具有改善NAFLD的作用. 而, 胡桃苷对NAFLD中作用的研究尚未见报道.
以高脂饮食(high fat diet, HFD)诱导小鼠NAFLD, 观察胡桃苷对HFD诱导的肝损伤、肝炎、脂质代谢紊乱以及小肠通透性受损的影响, 并分析其中的机制.
收集小鼠血液样品, 并分离血清, ELISA检测血清谷草转氨酶、谷丙转氨酶、胆固醇、空腹血糖和空腹胰岛素水平. FITC-Dextran检测肠道通透性. 收集肝组织, HE染色观察肝组织形态学变化; 油红O染色观察肝组织脂质蓄积情况; 实时荧光定量聚合酶链反应检测肝组织过氧化物酶体增殖体激活受体α(peroxisome proliferators-activated receptors, PPAR-α)、成纤维细胞生长因子21(fibroblast growth factor 21, FGF21)以及肉碱-棕榈酰基转移酶(carnitine palmitoyltransferase 1a, CPT1a)的mRNA水平; Western blot检测肝组织乙酰辅酶A羧化酶(Acetyl CoA carboxylase, ACC)磷酸化水平以及肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)表达; 免疫组化检测肝组织TNF-α、白细胞介素(interleukin, IL)-1β和IL-6表达. 收集十二指肠组织, 免疫组化检测小肠组织紧密连接蛋白1表达情况.
胡桃苷可改善HFD诱导的肝炎性反应和肝脂质沉积, 并降低肝损伤与胰岛素抵抗, 增加肝脏PPAR-α、FGF21和CPT1a的mRNA水平和ACC的磷酸化水平. 并且, 胡桃苷能恢复了肠道屏障的完整性.
胡桃苷可恢复HFD引起的肝脂肪变性和减少肝损伤, 并能恢复葡萄糖稳态和改善十二指肠的肠道完整性.
在小鼠NAFLD模型中发现, 胡桃苷可抑制肝脂肪变性和肝损伤、减少炎性反应并调节脂质代谢, 且能改善小肠通透性受损, 这些结果提示, 胡桃苷是潜在的抗NAFLD药物.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C, C
D级 (一般): 0
E级 (差): 0
编辑: 王禹乔 电编:刘继红
| 1. | Sookoian S, Pirola CJ. Systems biology elucidates common pathogenic mechanisms between nonalcoholic and alcoholic-fatty liver disease. PLoS One. 2013;8:e58895. [PubMed] [DOI] |
| 2. | Lonardo A, Nascimbeni F, Maurantonio M, Marrazzo A, Rinaldi L, Adinolfi LE. Nonalcoholic fatty liver disease: Evolving paradigms. World J Gastroenterol. 2017;23:6571-6592. [PubMed] [DOI] |
| 3. | Perumpail BJ, Khan MA, Yoo ER, Cholankeril G, Kim D, Ahmed A. Clinical epidemiology and disease burden of nonalcoholic fatty liver disease. World J Gastroenterol. 2017;23:8263-8276. [PubMed] [DOI] |
| 4. | Wu W, Hu X, Zhou X, Klenotic PA, Zhou Q, Lin Z. Myeloid deficiency of CCN3 exacerbates liver injury in a mouse model of nonalcoholic fatty liver disease. J Cell Commun Signal. 2018;12:389-399. [PubMed] [DOI] |
| 5. | Mehal WZ. The inflammasome in liver injury and non-alcoholic fatty liver disease. Dig Dis. 2014;32:507-515. [PubMed] [DOI] |
| 6. | Li MH, Chen W, Wang LL, Sun JL, Zhou L, Shi YC, Wang CH, Zhong BH, Shi WG, Guo ZW. RLA8-A New and Highly Effective Quadruple PPAR-α/γ/δ and GPR40 Agonist to Reverse Nonalcoholic Steatohepatitis and Fibrosis. J Pharmacol Exp Ther. 2019;369:67-77. [PubMed] [DOI] |
| 7. | Sun ZL, Dong JL, Wu J. Juglanin induces apoptosis and autophagy in human breast cancer progression via ROS/JNK promotion. Biomed Pharmacother. 2017;85:303-312. [PubMed] [DOI] |
| 8. | Zhou GY, Yi YX, Jin LX, Lin W, Fang PP, Lin XZ, Zheng Y, Pan CW. The protective effect of juglanin on fructose-induced hepatitis by inhibiting inflammation and apoptosis through TLR4 and JAK2/STAT3 signaling pathways in fructose-fed rats. Biomed Pharmacother. 2016;81:318-328. [PubMed] [DOI] |
| 10. | Sharpton SR, Maraj B, Harding-Theobald E, Vittinghoff E, Terrault NA. Gut microbiome-targeted therapies in nonalcoholic fatty liver disease: a systematic review, meta-analysis, and meta-regression. Am J Clin Nutr. 2019;110:139-149. [PubMed] [DOI] |
| 11. | Zhou D, Pan Q, Shen F, Cao HX, Ding WJ, Chen YW, Fan JG. Total fecal microbiota transplantation alleviates high-fat diet-induced steatohepatitis in mice via beneficial regulation of gut microbiota. Sci Rep. 2017;7:1529. [PubMed] [DOI] |
| 12. | Liu Y, Xu W, Zhai T, You J, Chen Y. Silibinin ameliorates hepatic lipid accumulation and oxidative stress in mice with non-alcoholic steatohepatitis by regulating CFLAR-JNK pathway. Acta Pharm Sin B. 2019;9:745-757. [PubMed] [DOI] |
| 13. | Marathe C, Bradley MN, Hong C, Chao L, Wilpitz D, Salazar J, Tontonoz P. Preserved glucose tolerance in high-fat-fed C57BL/6 mice transplanted with PPARgamma-/-, PPARdelta-/-, PPARgammadelta-/-, or LXRalphabeta-/- bone marrow. J Lipid Res. 2009;50:214-224. [PubMed] [DOI] |
| 14. | Hardie DG, Pan DA. Regulation of fatty acid synthesis and oxidation by the AMP-activated protein kinase. Biochem Soc Trans. 2002;30:1064-1070. [PubMed] [DOI] |
| 15. | Nakamura MT, Yudell BE, Loor JJ. Regulation of energy metabolism by long-chain fatty acids. Prog Lipid Res. 2014;53:124-144. [PubMed] [DOI] |
| 16. | Inagaki T, Dutchak P, Zhao G, Ding X, Gautron L, Parameswara V, Li Y, Goetz R, Mohammadi M, Esser V, Elmquist JK, Gerard RD, Burgess SC, Hammer RE, Mangelsdorf DJ, Kliewer SA. Endocrine regulation of the fasting response by PPARalpha-mediated induction of fibroblast growth factor 21. Cell Metab. 2007;5:415-425. [PubMed] [DOI] |
| 17. | Su X, Kong Y, Peng D. Fibroblast growth factor 21 in lipid metabolism and non-alcoholic fatty liver disease. Clin Chim Acta. 2019;498:30-37. [PubMed] [DOI] |
| 18. | Tilg H, Moschen AR, Szabo G. Interleukin-1 and inflammasomes in alcoholic liver disease/acute alcoholic hepatitis and nonalcoholic fatty liver disease/nonalcoholic steatohepatitis. Hepatology. 2016;64:955-965. [PubMed] [DOI] |