修回日期: 2020-09-28
接受日期: 2020-11-10
在线出版日期: 2020-12-28
预切开内镜下黏膜切除术(endoscopic mucosal resection with precutting, Pre-cut-EMR)是一种在EMR基础上进行改良, 融合了EMR和内镜黏膜下剥离术(endoscopic submucosal dissection, ESD)的技术优势, 形成的一种新的内镜下切除方法, 在临床上应用越来越广泛. 本研究通过回顾性分析, 初步探讨Pre-cut-EMR对结直肠侧向发育型肿瘤(laterally spreading tumor, LST)治疗的临床价值.
初步探讨Pre-cut-EMR在LST治疗中的应用价值.
选择2016-01/2019-12我科就诊的84例结直肠LST患者为研究对象, 回顾性分析所有患者临床资料, 总结结直肠LST的临床特征. 所有患者均行Pre-cut-EMR, 计算平均手术时间、整块切除率、完整切除率、并发症发生率; 术后第3、6、12 mo复查肠镜, 评估复发情况. 通过中国知网和万方数据库检索ESD治疗结直肠LST相关文献, 比较Pre-cut-EMR组与ESD组对结直肠LST治疗疗效有无统计学差异.
本研究中84例结直肠LST平均直径25.6 mm; 内镜下形态分型以颗粒型为主. 按工藤pit分型, 以Ⅲ型和Ⅳ型多见, 其中ⅢL最常见. 病理类型以管状腺瘤和绒毛状腺瘤多见. 84例结直肠LST患者均成功内镜下切除, 其中1例中转ESD手术、1例中转EPMR, Pre-cut-EMR整块切除率为97.6%, 共有3例基底切缘阳性, 完整切除率为96.4%, 平均手术时间24.5 min. 术中共出现2例出血、1例穿孔, 并发症发生率3.6%. 已完成随访的78例患者均未见复发, 复发率0%. 经统计学分析, 与徐美东等、于红刚等、加拿提·秋海等研究数据相比较, Pre-cut-EMR组在手术时间方面明显低于ESD组, 差异有统计学意义(χ2 = 21.037, P = 0.001); 而在整块切除率、完整切除率、并发症发生率和复发率方面与ESD组相比均无统计学差异(P>0.05).
Pre-cut-EMR对结直肠LST治疗的疗效确切、安全性高, 有较高临床价值. 该手术方法因操作简单、易于掌握、设备要求低等特点值得大范围推广.
核心提要: 预切开内镜下黏膜切除术(endoscopic mucosal resection with precutting, Pre-cut-EMR)是一种在EMR基础上进行改良, 同时融合了EMR和内镜黏膜下剥离术的技术优势, 形成了一种新的内镜下切除方法, 该方法具有操作简单、易于掌握、疗效确切和安全性高等优势, 在临床上具有广阔的应用前景. 本研究通过回顾性分析, 初步总结了Pre-cut-EMR对结直肠结直肠侧向发育型肿瘤的治疗价值, 为该技术的进一步临床推广提供依据.
引文著录: 谈涛, 李蜀豫. 预切开内镜下黏膜切除术在结直肠侧向发育型肿瘤治疗中的应用价值. 世界华人消化杂志 2020; 28(24): 1272-1278
Revised: September 28, 2020
Accepted: November 10, 2020
Published online: December 28, 2020
Endoscopic mucosal resection (EMR) with precutting (Pre-cut-EMR) is an improvement on the basis of EMR, which combines the technical advantages of EMR and endoscopic submucosal dissection (ESD) to form a new endoscopic resection method and is more and more widely used in clinical practice. This study preliminarily explored the clinical value of Pre-cut-EMR in the treatment of colorectal laterally spreading tumors (LSTs) through retrospective analysis.
To explore the application value of Pre-cut-EMR in the treatment of colorectal LSTs.
A total of 84 patients with colorectal LSTs who were treated at our department from January 2016 to December 2019 were selected as the research subjects. The clinical data of all patients were retrospectively analyzed to summarize the clinical characteristics of colorectal LSTs. All patients underwent Pre-cut-EMR, and the average operation time, overall resection rate, complete resection rate, and the incidence of complications were recorded. Colonoscopy was performed at 3, 6, and 12 mo after the operation to evaluate the recurrence. The relevant literature on ESD treatment of colorectal LSTs was retrieved through China HowNet and Wanfang Database, and the pre-cut-EMR group and ESD group were compared for the curative effect on colorectal LSTs.
The average diameter of colorectal LSTs in the 84 cases was 25.6 mm. The endoscopic morphological classification was mainly granular. According to Kudo pit classification, types Ⅲ and Ⅳ were common, with type ⅢL being the most common. Tubular adenoma and villous adenoma were common pathological types. All 84 patients with colorectal LSTs underwent endoscopic resection successfully. One of them converted to ESD and one to EPMR. The pre-cut-EMR resection rate was 97.6%, and the average operation time was 24.5 min. There were three cases with positive basal margins, and the complete resection rate was 96.4%. Two cases of bleeding and one case of perforation occurred during the operation, and the complication rate was 3.6%. None of the 78 patients who were followed had recurrence, and the recurrence rate was 0%. Compared with the research data obtained by Xu et al, Yu et al, and Qiuhai et al, the operation time of the Pre-cut-EMR group was significantly lower than that of the ESD group (χ2 = 21.037, P = 0.001), but there was no statistical difference in the overall resection rate, complication rate, complete resection rate, or recurrence rate compared with the ESD group (P > 0.05).
Pre-cut-EMR is effective and safe for colorectal LST treatment, and has high clinical value. This surgical method deserves to be widely promoted due to its simplicity, being easy to learn, and low equipment requirements.
- Citation: Tan T, Li SY. Application value of pre-cutting endoscopic mucosal resection in treatment of colorectal laterally spreading tumors. Shijie Huaren Xiaohua Zazhi 2020; 28(24): 1272-1278
- URL: https://www.wjgnet.com/1009-3079/full/v28/i24/1272.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v28.i24.1272
结直肠侧向发育型肿瘤(laterally spreading tumor, LST)最早由日本学者Kudo[1]报道, 是指直径大于10 mm, 以侧向生长而非垂直生长为特点的一类结直肠黏膜来源的平坦型病变, 因其特殊的生长方式及形态特点, 内镜漏诊率高. 结直肠LST与结直肠癌关系密切, 较一般结直肠腺瘤具有更高的恶变潜能[2]. 随着病变直径的增加, 结直肠LST癌变率逐步增高, 黏膜下浸润癌的发生率可以达到8.4%-52.5%, 且动态观察病变可在3年内发展为进展期癌[3]. 目前, 结直肠LST的治疗一般采用内镜下黏膜切除术(endoscopic mucosal resection, EMR)、分片黏膜切除术(endoscopy piecemeal mucosal resection, EPMR)、内镜黏膜下剥离术(endoscopic submucosal dissection, ESD)或外科手术, 然而各种手术方式均存在不同的弊端[4-6], 如EMR受到病变大小的限制, 2 cm以上病变EMR切除困难; EPMR不能获取完整组织, 且复发率高; ESD操作复杂、技术难度高, 难以大规模开展; 外科手术创伤大、恢复慢等. 近年来, 有学者在EMR基础上进行改良, 融合了EMR和ESD的技术优势, 形成了一种新的手术方法, 即预切开内镜下黏膜切除术(EMR with precutting, Pre-cut-EMR)[7]. 为评估Pre-cut-EMR对结直肠LST治疗疗效, 本研究回顾性分析了我院行Pre-cut-EMR治疗的84例结直肠LST患者临床资料, 并以文献报道的ESD组相比较, 初步探讨Pre-cut-EMR对结直肠LST治疗的临床价值, 现总结如下.
研究对象: 选择2016-01/2019-12经肠镜检查确诊并行Pre-cut-EMR治疗的84例结直肠LST患者为研究对象, 其中男性49名, 女性35名(男:女 = 1.4:1), 平均年龄58.5岁(58.5±12.4岁). 纳入标准: (1)病变直径大于10 mm; (2)术前超声内镜检查提示病变未超过黏膜下层, 或通过NBI放大染色进行评估, Pit分型未达到Vn型者; (3)抬举征阳性者; (4)术前充分沟通, 如出现严重并发症同意转外科手术的患者. 排除标准: (1)术前超声内镜或染色放大考虑病变已浸润至黏膜下层者; (2)病变直径超过40 mm; (3)抬举征阴性者; (4)严重心肺疾病不能耐受内镜操作者; (5)不同意中转外科手术者. 所有患者术前均签署知情同意书, 本研究通过医院伦理委员会批准.
1.2.1 术前准备: 术前充分肠道准备, 肠道清洁度Boston评分6分以上. 术前常规行血常规、凝血功能、心电图、胸片等检查, 评估心肺及凝血功能. 术前签署知情同意书, 并联系外科做好中转手术的准备.
1.2.2 器械与药品: PCF-Q260J、CF-HQ290I型电子结肠镜(日本Olympus公司)、 VIO 200D电外科工作站(德国ERBE公司)、Dual Knife(日本Olympus公司)、NM-4L-1注射针(日本Olympus公司)、FD-410LR热活检钳(日本Olympus公司)、和谐夹(南京微创公司)等. 0.4%靛胭脂溶液、1%氢溴酸山莨菪碱注射液、亚甲蓝+生理盐水混合溶液、玻璃酸钠注射液等.
1.2.3 病变观察: 先用清水冲洗病灶表面残留粪水, 冲洗干净后进行观察. (1)记录病灶大小、位置、表面形态等信息, 进行内镜下分型; (2)调节到NBI模式观察病灶表面腺管开口, 记录pit分型; (3)内镜下喷洒0.4%靛胭脂溶液, 进一步明确病灶边界.
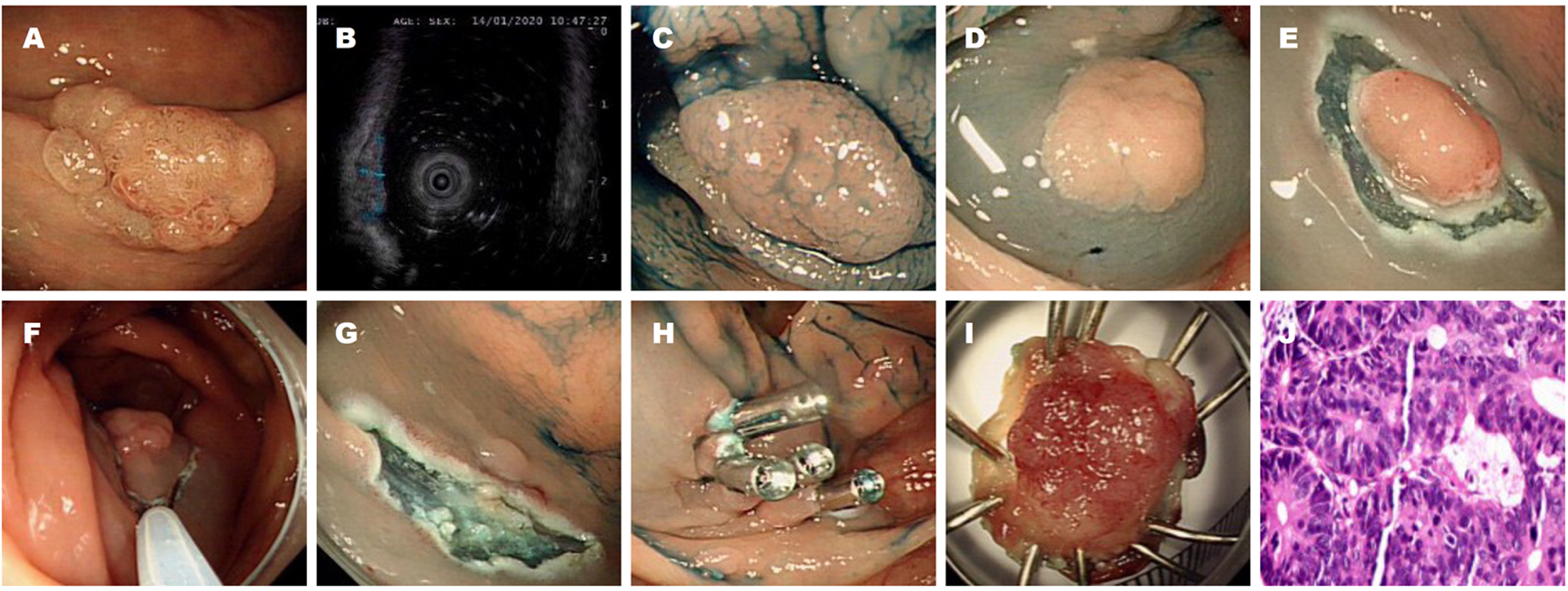
1.2.4 治疗过程: Pre-cut-EMR操作过程如下: (1)确定边界: NBI模式下观察或内镜下喷洒0.4%靛胭脂溶液染色, 均可以清晰的勾勒出病灶边界, 必要时用Dual Knife进行标记; (2)黏膜下注射: 用注射针黏膜下注射含亚甲蓝的生理盐水混合溶液, 充分抬高病灶; (3)预切开: 用Dual Knife沿病灶外缘环周切开, 病灶过大时适当进行黏膜下剥离; (4)圈套切除: 用圈套器沿病灶环切边缘套住病灶基底部, 电凝电切至病灶完整切除; (5)并发症处理: 术中如出现出血或穿孔等并发症, 通过热活检钳、金属夹等进行处理, 内镜无法处理时中转外科手术; (6)标本处理: 标本平展至固定板上, 标记口侧、肛侧, 测量标本大小, 最后用福尔马林溶液固定后送检, 见图1.
1.2.5 观察指标: 一般指标: 包括病灶位置、直径、内镜分型、pit分型和病理类型等.
疗效指标: 包括手术时间、整块切除率、完整切除率、并发症发生率和复发率等; 其中并发症发生率 = 并发症例数/总例数×100%、复发率 = 复发例数/总例数×100%.
1.2.6 建立对照组: 通过中国知网数据库、万方数据库进行文献检索, 输入关键词"LST"和"ESD", 阅读相关文献, 选择高质量文献作为本研究对照组[8-10].
统计学处理 采用SPSS 19.0进行数据处理与分析, 计数资料采用n (%)进行表示, 计量资料以mean±SD表示; 组间率的比较采用χ2检验, 定义P<0.05差异有统计学意义.
经统计, 本研究中84例结直肠LST以直肠常见, 病灶平均大小25.6 mm. 根据内镜下形态分型, 颗粒型(granular type, LST-G)较常见, 非颗粒型(non-granular type, LST-NG)相对少见. 按工藤pit分型, 以Ⅲ型和Ⅳ型多见, 其中ⅢL型最常见, 而Ⅰ型、Ⅱ型和Ⅴ型相对较少. 病理类型以管状腺瘤和绒毛状腺瘤多见, 其余病理类型较少, 见表1.
| 类别 | LST-G (n = 58) | LST-NG (n = 26) | Total (n = 84) |
| 直径(mm) | 24.3±2.2 | 26.1±1.8 | 25.6±2.4 |
| 部位(n) | |||
| 右半结肠 | 17 | 9 | 26 |
| 左半结肠 | 14 | 5 | 19 |
| 直肠 | 27 | 12 | 39 |
| Pit分型 | |||
| Ⅱ | 2 | 0 | 2 |
| ⅢL | 31 | 9 | 40 |
| ⅢS | 8 | 3 | 11 |
| Ⅳ | 16 | 12 | 28 |
| Vi | 1 | 2 | 3 |
| Vn | 0 | 0 | 0 |
| 病理类型 | |||
| 炎性/增生性息肉 | 2 | 0 | 2 |
| 管状腺瘤 | 28 | 9 | 37 |
| 绒毛状腺瘤 | 11 | 11 | 22 |
| 管状绒毛状腺瘤 | 12 | 2 | 14 |
| 黏膜内癌/伴HGIN | 5 | 4 | 9 |
84例结直肠LST患者均成功内镜下切除, 平均手术时间24.5 min, 其中1例因术中改行ESD, 手术时间67 min. 84例患者均拟行Pre-cut-EMR, 其中1例因病灶位置问题术中改行ESD; 另1例因病灶过大术中改行EPMR, Pre-cut-EMR整块切除率为97.6%, 共有3例基底切缘阳性, 完整切除率为96.4%. 术中共出现2例出血、1例穿孔, 均内镜下成功处理, 并发症发生率3.6%. 术后第3、6、12 mo复查肠镜, 已随访的78例患者原手术部位见瘢痕形成, 未见复发, 复发率0%, 见表2.
| 类别 | LST-G (n = 58) | LST-NG (n = 26) | Total (n = 84) |
| 手术时间(min) | 22.6±3.8 | 26.1±4.2 | 24.5±5.6 |
| 整块切除率 | 98.3% | 96.2% | 97.6% |
| 完整切除率 | 96.6% | 96.2% | 96.4% |
| 并发症发生率 | 3.4% | 3.8% | 3.6% |
| 复发率 | 0% | 0% | 0% |
通过文献检索, 选择徐美东等、于红刚等、加拿提·秋海等研究数据作为对照组, 经统计学分析, Pre-cut-EMR组在手术时间方面明显低于ESD组, 差异有统计学意义(χ2 = 21.037, P = 0.001); 而在整块切除率、完整切除率、并发症发生率和复发率方面和ESD组相比均无统计学差异(P>0.05), 见表3.
结直肠LST与结肠癌的关系密切, 一旦发现应积极治疗[11]. 既往多采用外科手术, 随着内镜技术的发展, EMR、EPMR、ESD逐渐取代外科手术成为首选方法[12]. 然而不管哪种方法均存在些许弊端, 如2017年欧洲胃肠内镜学会(european society of gastrointestinal endoscopy, ESGE) 推荐整块EMR切除应限于结肠病变≤20 mm及直肠病变≤25 mm, 对于直径超过25 mm的病灶难以EMR切除[13]. EPMR虽可以分次切除较大病灶, 但常缺乏完整的组织病理学评估, 且复发率高. 而对于复发病灶, 由于常伴有瘢痕组织, 再次内镜下切除更加困难, 出血、穿孔等并发症明显增多[14]. ESD虽不受病灶大小的限制, 但ESD操作复杂、技术难度大、操作时间长、设备要求高, 需具有相当操作经验的医师方能完成, 难以在基层医院广泛开展[15]. 外科手术是一种传统的切除方法, 但由于LST水平生长的特点, 肠壁外难以发现病灶, 常需术前定位或术中内镜辅助, 增加了手术难度; 同时由于外科手术创伤大、恢复慢等劣势已逐步被内镜手术取代, 一般仅作为内镜手术失败或失去内镜手术机会的补救措施[16].
Pre-cut-EMR是在EMR基础上进行改良, 融合了EMR和ESD的优势而逐步形成的一种新的内镜切除方法, 即"确定边界-黏膜下注射-预切开-圈套切除-创面处理", 而对于较大病灶, 预切开后可以进行适当的黏膜下剥离, 再行圈套切除. 该方法在国外有文献报道称为优化的混合ESD (optimized hybrid ESD), 而国内医生多称之为Pre-cut-EMR[17]. Pre-cut-EMR虽越来越被内镜医师所接受, 但仍未广泛开展, 其在结直肠LST的治疗疗效文献报道较少, 也缺乏大样本、多中心的随访资料. 为了初步探讨Pre-cut-EMR在结直肠LST治疗的应用价值, 本研究纳入了84名接受Pre-cut-EMR治疗的结直肠LST患者临床资料, 分析了Pre-cut-EMR治疗的平均手术时间、整块切除率、并发症发生率和复发率等指标, 同时与文献报道的ESD术式比较, 结果表明Pre-cut-EMR组在手术时间方面明显低于ESD组, 同时在整块切除率、并发症发生率和复发率方面与ESD组相当, 这也进一步说明了Pre-cut-EMR在结直肠LST治疗的疗效确切、安全性高, 手术时间明显缩短表明该技术操作难度明显较ESD低, 同时具有与ESD相同的疗效. 本研究涉及的三组文献报道数据, 因不同文献报道的LST大小与本研究中LST大小不尽相同, 可能存在一定数据偏倚. 同时由于随访时间不足, 共有6名患者未完成随访或失访, 随访时间较短对评估复发率存在一定影响, 我们将继续对患者进行追踪随访, 期待获得更有说服力的数据. 本研究也存在样本量偏小的缺陷, 更完备的数据尚需进一步研究.
Pre-cut-EMR受病灶大小、部位、形态、肿瘤浸润深度等因素影响[18,19], 为了更好的开展Pre-cut-EMR技术, 术前对于病灶的评估尤为重要. 笔者总结经验如下: (1)因受圈套器大小的限制, 病灶大小是决定能否一次性切除的关键因素. 一般认为Pre-cut-EMR对病灶要求直径3.0 cm以下, 以2.0-3.0 cm最宜. 但对于较大病灶可以通过预切开后继续适当黏膜下剥离后缩小病灶根部直径, 因此Pre-cut-EMR因病灶大小的限制逐渐降低; (2)术前超声内镜或放大染色内镜对病灶深度的评估相当重要. 对于超声内镜评估病灶浸润深度超过黏膜下层或放大染色观察pit分型达到Vn型者, 一般认为不具备Pre-cut-EMR手术指针, 建议外科手术; (3)抬举征是决定能否成功切除的重要参考因素. 术中黏膜下注射后病灶抬举征阴性的病灶一般难以Pre-cut-EMR切除, 这可能由于肿瘤浸润过深或术前活检导致瘢痕组织形成, 对于抬举征阴性的病灶出血、穿孔发生率高, 建议尝试ESD或外科手术. 严格把握适应证是手术成功的关键, 完备而准确的术前、术中评估提高了Pre-cut-EMR切除成功率.
Pre-cut-EMR相比ESD最大的优势是操作简单、操作时间短, 且不增加并发症的发生[20,21]. 如何更好的完成Pre-cut-EMR手术, 笔者的经验总结如下: (1)充分判断病灶边界, 可以通过0.4%靛胭脂溶液染色或NBI观察, 染色后的病灶边界更加清晰, 与正常黏膜对比更突出; (2)黏膜下注射时多点注射, 将病灶完全抬举, 可以加入玻璃酸钠等高渗液体以提高黏膜下液体保留时间. 注射时宜先口侧、后肛侧, 以免影响视野; (3)切开时沿病灶外缘切开, 使用电切模式, 黏膜下出血时改为电凝模式止血, 出血量大时使用止血钳止血, 充分止血以保证视野清晰; (4)圈套前应再次补充黏膜下注射, 同时判断病灶是否环周完全切开, 病灶过大时适当进行黏膜下剥离, 以保证一次完全切除病灶; (5)圈套切除后观察有无出血、穿孔等并发症, 及时处理. 病灶需按ESD标本处理原则进行平展固定, 标记口侧、肛侧, 及时送检.
综上所述, Pre-cut-EMR作为一种融合了EMR和ESD优势的手术方法[22], 在结直肠LST治疗中疗效确切、安全性高, 但术前、术中需把握手术适应证, 以提高手术成功率. Pre-cut-EMR因其操作简单、易于掌握、设备要求低等特点在临床上具有广阔应用前景, 值得广泛推广.
结直肠LST与结直肠癌关系密切, 具有明显的恶变潜能. 目前, 结直肠侧向发育型肿瘤(laterally spreading tumor, LST)的治疗一般采用内镜下黏膜切除术(endoscopic mucosal resection, EMR)、分片黏膜切除术(endoscopy piecemeal mucosal resection, EPMR)、内镜黏膜下剥离术(endoscopic submucosal dissection, ESD)或外科手术, 然而各种手术方式均存在不同的弊端, 这为临床选择带来困扰. 预切开内镜下黏膜切除术(EMR with precutting, Pre-cut-EMR)作为一种新的手术方法, 因其具有操作简单、疗效确切、设备要求低等优势, 具有广阔的应用前景.
Pre-cut-EMR具有广阔的临床应用前景, 但其对结直肠LST治疗的定量指标研究较少, 临床上缺乏相关数据.
初步探讨Pre-cut-EMR在LST治疗中的应用价值.
本研究通过回顾性分析研究我院行Pre-cut-EMR的结直肠LST患者临床资料, 计算平均手术时间、整块切除率、完整切除率、并发症发生率、复发情况. 通过中国知网和万方数据库检索ESD治疗结直肠LST相关文献, 比较Pre-cut-EMR组与ESD组对结直肠LST治疗疗效有无统计学差异.
本研究中84例结直肠LST平均直径25.6 mm; 内镜下形态分型以颗粒型为主. 按工藤pit分型, 以Ⅲ型和Ⅳ型多见, 其中ⅢL最常见. 病理类型以管状腺瘤和绒毛状腺瘤多见. 84例结直肠LST患者均成功内镜下切除, Pre-cut-EMR整块切除率为97.6%, 完整切除率为96.4%, 平均手术时间24.5 min, 并发症发生率3.6%. 已完成随访的78例患者均未见复发, 复发率0%. 经统计学分析, Pre-cut-EMR组在手术时间方面明显低于ESD组(P = 0.001); 而在整块切除率、完整切除率、并发症发生率和复发率方面与ESD组相比均无统计学差异(P>0.05).
Pre-cut-EMR对结直肠LST治疗的疗效确切、安全性高, 有较高临床价值.
Pre-cut-EMR作为一种融合了EMR和ESD优势的手术方法, 在结直肠LST治疗中疗效确切、安全性高, 但术前、术中需把握手术适应证, 以提高手术成功率. Pre-cut-EMR因其操作简单、易于掌握、设备要求低等特点在临床上具有广阔应用前景, 值得广泛推广.
学科分类: 胃肠病学和肝病学
手稿来源地: 湖北省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): D, D
E级 (差): E
科学编辑: 刘继红 制作编辑:张砚梁
| 1. | Kudo S. Endoscopic mucosal resection of flat and depressed types of early colorectal cancer. Endoscopy. 1993;25:455-461. [PubMed] [DOI] |
| 3. | Wu HHL, East JE. Will endoscopic submucosal dissection (ESD) become the gold standard for laterally spreading tumors (LST)? Endosc Int Open. 2019;7:E260-E263. [PubMed] [DOI] |
| 6. | Saito T, Kobayashi K, Sada M, Matsumoto Y, Mukae M, Kawagishi K, Yokoyama K, Koizumi W, Saegusa M, Murakami Y. Comparison of the histopathological characteristics of large colorectal laterally spreading tumors according to growth pattern. J Anus Rectum Colon. 2019;3:152-159. [PubMed] [DOI] |
| 7. | 金 燕, 龚 镭, 唐 学军, 彭 晓斌, 谈 春晓, 王 小云, 华 萍, 任 元梅, 周 平红. 预切开内镜黏膜切除术诊治结肠侧向发育型肿瘤的临床疗效评价. 中国内镜杂志. 2016;22:94-98. [DOI] |
| 8. | 张 晨, 徐 美东, 姚 礼庆. 内镜黏膜下剥离术治疗直肠侧向发育型肿瘤的临床价值. 中华结直肠疾病电子杂志. 2014;3:447-452. [DOI] |
| 10. | 加拿提· 秋海, 赖 力. 内镜黏膜下剥离术对大直径结直肠LSTs病变的远期疗效分析. 现代消化与介入诊疗杂志. 2018;23:362-364. [DOI] |
| 11. | Yamashita K, Oka S, Tanaka S, Nagata S, Kuwai T, Furudoi A, Tamura T, Kunihiro M, Okanobu H, Nakadoi K, Kanao H, Higashiyama M, Arihiro K, Kuraoka K, Shimamoto F, Chayama K. Long-term prognosis after treatment for T1 carcinoma of laterally spreading tumors: a multicenter retrospective study. Int J Colorectal Dis. 2019;34:481-490. [PubMed] [DOI] |
| 12. | Nagai K, Hayashi Y, Honma K, Sakatani A, Yoshii S, Fujinaga T, Maekawa A, Tsujii Y, Hiyama S, Shinzaki S, Watabe K, Iijima H, Tsujii M, Mizushima T, Morii E, Takehara T. Adenoma of colorectal laterally spreading tumor nongranular type with biological phenotypic features similar to cancer. J Gastroenterol Hepatol. 2018;33:1853-1863. [PubMed] [DOI] |
| 13. | Ferlitsch M, Moss A, Hassan C, Bhandari P, Dumonceau JM, Paspatis G, Jover R, Langner C, Bronzwaer M, Nalankilli K, Fockens P, Hazzan R, Gralnek IM, Gschwantler M, Waldmann E, Jeschek P, Penz D, Heresbach D, Moons L, Lemmers A, Paraskeva K, Pohl J, Ponchon T, Regula J, Repici A, Rutter MD, Burgess NG, Bourke MJ. Colorectal polypectomy and endoscopic mucosal resection (EMR): European Society of Gastrointestinal Endoscopy (ESGE) Clinical Guideline. Endoscopy. 2017;49:270-297. [PubMed] [DOI] |
| 16. | Lee SP, Sung IK, Kim JH, Lee SY, Park HS, Shim CS. Effect of Preceding Biopsy on the Results of Endoscopic Submucosal Dissection for Colorectal Laterally Spreading Tumor. Dig Dis Sci. 2019;64:2972-2981. [PubMed] [DOI] |
| 17. | 李 小娜, 常 宇峰, 赵 江维, 刘 莉, 杨 占领, 宋 捷, 金 鹏, 盛 剑秋. 预切开内镜下黏膜切除术在治疗结直肠侧向发育性肿瘤中的临床效果. 胃肠病学和肝病学杂志. 2019;28:205-208. [DOI] |
| 18. | D'Amico F, Maselli R, Galtieri PA, Spadaccini M, Repici A. Endoscopic submucosal dissection of a rectal nongranular laterally spreading tumor with the use of a new endoscopic platform. VideoGIE. 2019;4:140-141. [PubMed] [DOI] |
| 19. | Guo HM, Ling TS, Wang L, Lv Y, Zhang XQ, Yang T, Xu GF, Sun Q, Nie L, Zou XP. Clinical outcomes of endoscopic submucosal dissection for laterally spreading tumors involving the dentate line. J Dig Dis. 2019;20:83-88. [PubMed] [DOI] |
| 20. | Park EY, Baek DH, Song GA, Kim GH, Lee BE, Park DY. Long-term outcomes of endoscopically resected laterally spreading tumors with a positive histological lateral margin. Surg Endosc. 2020;34:3999-4010. [PubMed] [DOI] |
| 21. | Emmanuel A, Ghosh A, Lapa C, Gulati S, Burt M, Hayee B, Haji A. Endoscopic resection of colorectal circumferential and near-circumferential laterally spreading lesions: outcomes and risk of stenosis. Int J Colorectal Dis. 2019;34:829-836. [PubMed] [DOI] |