修回日期: 2020-10-14
接受日期: 2020-11-24
在线出版日期: 2020-12-28
胃食管反流病(gastroesophageal reflux disease, GERD)是一种慢性疾病, 其发病率在世界范围内呈上升趋势. 质子泵抑制剂(proton pump inhibitors, PPIs) 作为抑酸药物, 在临床上常用于治疗GERD, 经肝脏中CYP2C19代谢后, 血药浓度逐渐降低. 先前的研究已证明CYP2C19基因多态性导致PPIs在代谢速率、半衰期和药效等方面个体差异大, 影响疗效.
筛选正常代谢型(*1/*1)的GERD患者CYP2C19基因启动子区的变异, 并在细胞水平验证基因变异对启动子功能的影响, 进而分析CYP2C19启动子区功能改变与GERD经PPIs治疗效果的相关性.
收集入院治疗的散发性GERD患者全血163例, 实验组患者经 PPIs诊断性治疗后, 症状积分降低>50%, 症状未完全消失(n = 82); 对照组患者治疗后症状完全消失(n = 81); 全部患者CYP2C19基因型经检测为*1/*1. 利用PCR扩增并结合Sanger测序筛选入组患者CYP2C19启动子区的基因变异; 将CYP2C19启动子片段(野生型/变异型)克隆至pGL3 basic载体, 并转染HEK 293T细胞, 通过双荧光素酶报告基因系统, 检测基因变异对启动子功能的影响.
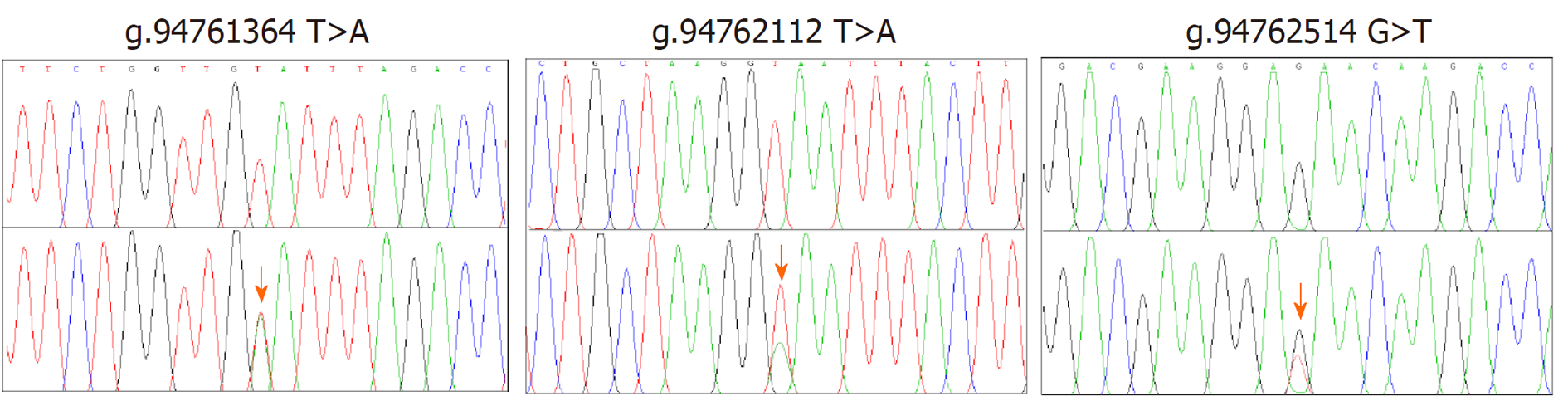
我们在3个正常代谢型GERD患者的CYP2C19基因启动子中分别发现了3个新的杂合变异: g.94761364 T>A, g.94762112 T>A, g.94762514 G>T; 与野生型相比, 携带g.94761364 T>A变异的CYP2C19启动子的转录活性显著升高(P = 0.034).
变异位点g.94761364 T>A使得CYP2C19启动子转录活性在细胞水平升高, 可能会进一步影响PPIs的代谢和血药浓度, 这一发现为中国人群中GERD患者的临床用药和治疗提供了新的思路.
核心提要: 本研究在3例正常代谢型胃食管反流病(gastroesophageal reflux disease, GERD)患者的CYP2C19基因启动子区发现的3个基因变异, 均在细胞水平下调了CYP2C19启动子转录活性, 可能进一步影响质子泵抑制剂的代谢和治疗效果, 这一发现为中国人群中GERD患者的临床用药和治疗提供了新的思路.
引文著录: 王珏磊, 南寿山, 王柏清, 王超, 李朝霞, 窦广仙, 孙光斌. 胃食管反流病患者CYP2C19基因启动子的遗传变异和功能分析. 世界华人消化杂志 2020; 28(24): 1229-1234
Revised: October 14, 2020
Accepted: November 24, 2020
Published online: December 28, 2020
Gastroesophageal reflux disease (GERD) is a chronic, progressive condition, and its prevalence is increasing worldwide. The risk factors for GERD are complex and the pathogenesis of GERD has not been fully elucidated. As acid-suppressive drugs, proton pump inhibitors (PPIs) are commonly used to treat GERD; after being metabolized by CYP2C19 in the human liver, the blood concentration of PPIs gradually decreases. Previous studies have shown that CYP2C19 gene polymorphism leads to considerable individual differences of PPIs in terms of metabolic rate and efficacy.
To identify potential variations in CYP2C19 promoter from patients (normal metabolizers, NMs, *1/*1) with GERD, verify the activity of promoter with variations in HEK 293T, and analyze the correlation between variations in CYP2C19 promoter and PPI treatment effect for GERD in the Chinese population.
A total of 163 patients with sporadic GERD were collected. After diagnostic treatment with PPIs, the symptom score decreased by 50%, but the symptoms did not completely disappear in the study group (n = 82). In the control group (n = 81), the symptoms completely disappeared after treatment. The CYP2C19 genotype of all patients was detected as *1/*1. The PCR and Sanger sequencing were used to identify variations in the CYP2C19 promoter. The luciferase activities of pGL3 basic-CYP2C19 promoters with or without variation were detected by dual-luciferase assay.
Three novel heterozygous variations were identified in the CYP2C19 gene promoters isolated from three NM patients with GERD: g.94761364 T>A, g.94762112 T>A, and g.94762514 G>T. Compared to the wild type, the transcriptional activity of the CYP2C19 promoter with g.94761364 T>A was significantly increased (P = 0.034).
The transcriptional activity of the CYP2C19 promoter is significantly increased in the presence of g.94761364 T>A, which may further affect the metabolism and blood concentration of PPIs. This finding provides a new insight for the medication and treatment of GERD patients in the Chinese population.
- Citation: Wang JL, Nan SS, Wang BQ, Wang C, Li ZX, Dou GX, Sun GB. Functional genetic variations of CYP2C19 promoter from patients with gastroesophageal reflux disease. Shijie Huaren Xiaohua Zazhi 2020; 28(24): 1229-1234
- URL: https://www.wjgnet.com/1009-3079/full/v28/i24/1229.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v28.i24.1229
胃食管反流病(gastroesophageal reflux disease, GERD)是一种常见的慢性进行性消化系统疾病, 主要表现为胃内容物反流而引起的不适症状或并发症. 近些年, GERD的发病率在世界范围内呈上升趋势[1,2]. 一项基于全球范围内GERD发病率的系统性回顾分析显示, 北美发病率为18.1%-27.8%, 欧洲8.8%-25.9%, 东亚2.5%-7.8%, 中东8.7%-33.1%, 澳大利亚11.6%, 南美23.0%[3]. 我国因上消化道症状于消化科门诊就诊的GERD患者占13%[4].
GERD的诊断主要依赖于上消化道内镜检查、食管高分辨测压、食管24 h pH-阻抗监测等[5]. GERD典型症状为反酸、烧心, 常伴有胸痛、嗳气、恶心、吞咽困难等, 亦可伴有食管外症状如胸痛、咳嗽、哮喘、喉炎、牙蚀症等, 常见的并发症为反流性食管炎、消化道出血、消化道狭窄、Barrett食管和腺癌[6]. GERD的危险因素复杂, 可大致分为环境因素和遗传因素, 包括吸烟、饮酒、幽门螺杆菌感染、心理因素、肥胖、年龄、性别、基因突变等[7-9].
质子泵抑制剂(proton pump inhibitors, PPIs)是临床上用于GERD治疗的主要药物, 其中奥美拉唑、兰索拉唑、泮托拉唑等第一代PPIs, 通过抑制胃壁上分泌胃酸的质子泵发挥抑酸作用, 经肝脏中CYP2C19代谢后, 血药浓度逐渐降低[10]. 既往研究表明, CYP2C19基因具有高度多态性, 已发现超过25个单核苷酸多态性(single nucleotide polymorphisms, SNPs)[11]. CYP2C19基因多态性与药物代谢能力相关, 显著影响PPIs如奥美拉唑、兰索拉唑、泮托拉唑等, 抗血小板药物氯吡格雷和部分抗抑郁药物的疗效和安全性[11-14]. CYP2C19基因分型不同的患者, 其PPIs的药代动力学改变较大, 进而影响了GERD的治疗[15]. 中国人群中CYP2C19基因多态性位点主要包括*2 (G681A)、*3 (G636A), 这两个突变位点均可导致CYP2C19酶活性降低; 没有突变的野生型以*1表示. 按照药物代谢动力学特征, 不同基因型对应的代谢类型分别为正常代谢型(*1/*1; normal metabolizers, NMs), 中间代谢型(*1/*2, *1/*3; intermediate metabolizers, IMs), 慢代谢型(*2/*2, *2/*3, *3/*3; poor metabolizers, PMs)[16]. 但是在临床上, 我们发现部分正常代谢型GERD患者, 经PPIs诊断性治疗后效果不明显, 说明可能还有其他因素发挥作用.
基因启动子区是控制基因表达的重要调控元件; CYP2C19启动子区如发生基因变异, 可能影响基因表达, 进而改变其生物学功能. 在本研究中, 我们将筛选正常代谢型GERD患者CYP2C19基因启动子区的潜在变异, 并在细胞水平验证基因变异对CYP2C19启动子功能的影响, 进而分析CYP2C19启动子区功能改变与GERD患者经PPI治疗效果的相关性, 为中国人群中GERD患者的临床用药和治疗提供了新的思路.
1 材料和方法
研究对象: 收集2019-01/2020-06来我院治疗的经胃镜或24 h食管pH-阻抗监测确诊的散发性GERD患者全血163例, 经奥美拉唑2倍剂量治疗2 wk, 按烧心症状的严重程度及频率评分. 其中实验组患者经 PPIs诊断性治疗后, 症状积分降低>50%, 症状未完全消失(n = 82); 对照组患者治疗后症状完全消失(n = 81). 全部患者CYP2C19基因型经检测为*1/*1, 并按照种族、性别和年龄进行匹配. 本研究方案符合《赫尔辛基宣言》的原则, 经天津市第五中心医院人类伦理委员会批准, 所有受试者均获得知情同意.
DNA序列分析及基因变异筛选: 按照BloodZol试剂盒(北京全式金生物科技有限公司)说明书操作, 从全部样本的外周血淋巴提取细胞基因组DNA. 参考NCBI中从人类CYP2C19基因序列(NCBI, NC_000010.11), 设计PCR引物, 扩增CYP2C19基因启动子区(1665bp); PCR产物经ABI 3730基因分析仪进行Sanger测序分析并筛选基因变异. 扩增和测序用引物序列在表1中.
| 引物名称 | 序列 | 长度(bp) |
| CYP2C19 promoter | F: 5'-AGACACCATGTTCTTGGCTACAG-3' | 1665 |
| R: 5'-CTCCTCTTGTTAAGACAACCGT-3' | ||
| Sanger sequencing | SF1: 5'-ACTGAATCACGAAATACTGAACCA-3' | 693 |
| SR1: 5'-CTCCTGGTCTCCTCCAGACA-3' | ||
| SF2: 5'-GACCAGGAGGTCAAGAAGCC-3' | 516 | |
| SR2: 5'-ACACCTTTACCATTTAACCCCCT-3' | ||
| SF3: 5'-AGGGGGTTAAATGGTAAAGGTGT-3' | 658 | |
| SR3: 5'-AGCACAAGGACCACAAAAGGA-3' |
1.3 细胞转染和双荧光素酶报告基因检测 将CYP2C19基因启动子片段(野生型/变异型)克隆到萤火虫荧光素酶报告基因载体pGL3 basic, 并分别转染HEK 293T细胞; 作为内参质粒, 表达海肾素荧光素酶的载体pRL-TK同时进行共转染. 细胞转染48 h后, 按照双荧光素酶报告基因检测试剂盒(北京全式金生物科技有限公司)操作说明, 检测萤火虫和海肾荧光素酶的荧光值.
统计学处理 以测定的萤火虫萤光素酶荧光值除以海肾萤光素酶的荧光值, 得到相对荧光值来反映CYP2C19基因启动子的转录活性, 所有的实验均独立进行3次. 数据采用非配对t检验进行处理和分析, P值小于0.05被认为具有统计学意义.
本研究从3例实验组GERD患者CYP2C19基因(*1/*1)启动子序列中分别筛查并发现了3个新发杂合变异, g.94761364 T>A, g.94762112 T>A和 g.94762514 G>T, Sanger测序峰图如图1所示; 对照组中没有发现基因变异. 经NCBI dbSNP和PubMed数据库搜索比对, 这3个基因变异均未曾报道过.
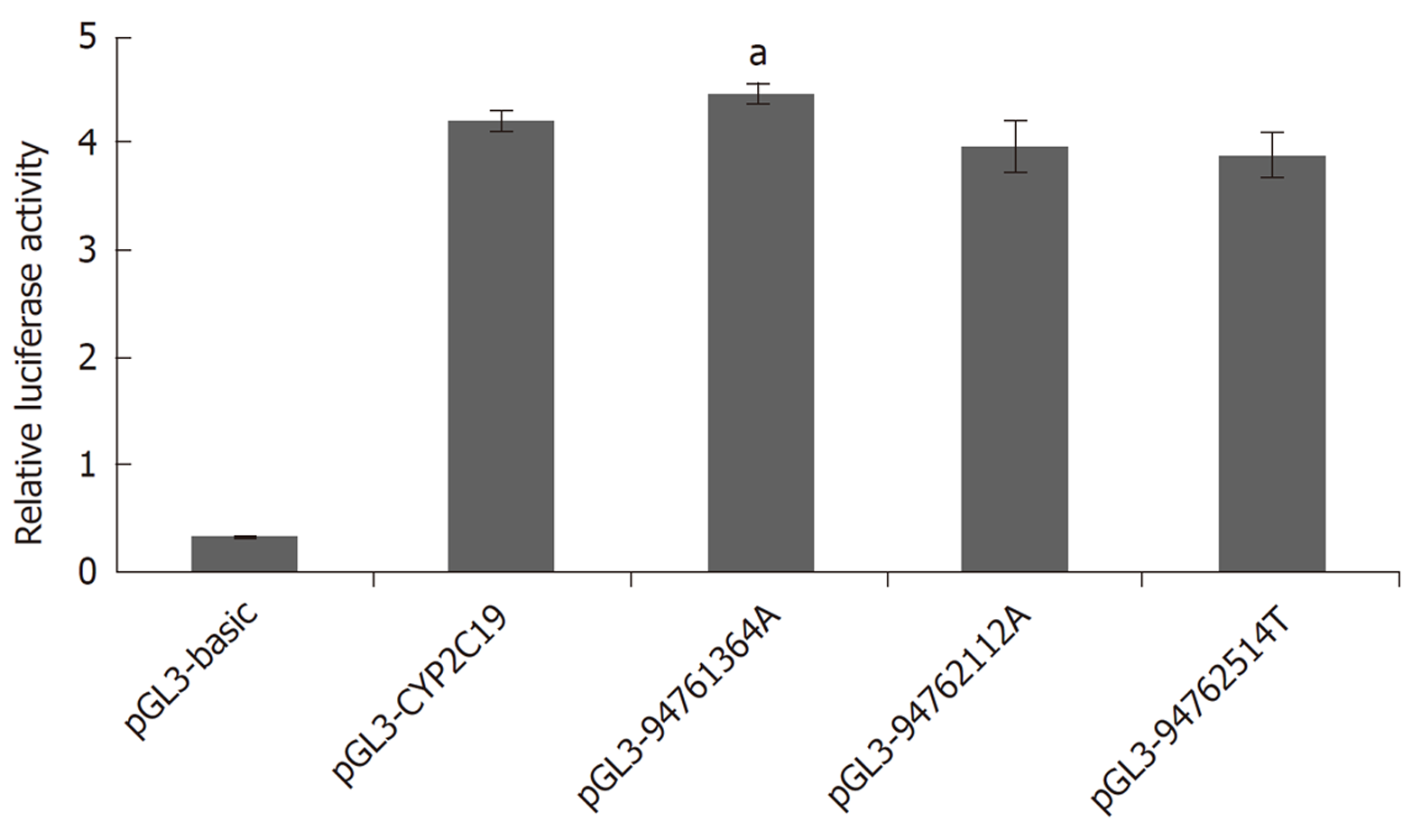
为了研究CYP2C19启动子区的3个基因变异对其转录活性的影响, 我们构建了表达载体pGL3 basic-CYP2C19启动子(野生型/变异型), 并与内参质粒pRL-TK分别共转染到HEK 293T细胞中, 48 h后检测双荧光素酶的相对荧光值, 分别为pGL3-basic (0.31); pGL3-CYP2C19 (4.21); pGL3-94761364A (4.47); pGL3-94762112A (3.97); pGL3-94762514T (3.89), 用于评价CYP2C19启动子的转录活性. 结果如图2所示, 携带基因变异的CYP2C19启动子的活性均受到影响; 其中携带94761364A变异位点的CYP2C19启动子, 与野生型相比, 其活性显著升高(P = 0.034).
GERD是一种多因素疾病, 发病机制复杂. 随着高通量测序技术的快速发展和测序成本的降低, 通过测序直接分析GERD的遗传因素成为可能, 越来越多与GERD发病相关的基因多态性或变异被发现[17].
近期研究表明, 人的GNB3基因发生突变后, 将通过介导食管初级传入纤维末梢和中心对内脏刺激的反应, 从而提高食管黏膜对胃酸的敏感性, 可能成为GERD易感人群[18]. 白细胞介素-1 (IL-1)基因多态性及其单倍型与GERD的发生密切相关, GERD患者中IL-1基因TCCL单体型频率明显高于对照组(P = 0.016); 同时, GERD患者与对照组之间IL-1RN 1/2基因型差异有统计学意义[19]. Lam发现FOXF1 rs9936833 (C allele)和MHC rs9257809 (A allele)的基因多态性与胃酸反流的存在相关性, 有可能是一个潜在的遗传水平的GERD发病机制[20]. BARX1基因和ADAMTS17基因在食管分化中起重要作用, Argyrou对来自希腊人群的160名GERD患者和180名健康对照受试者进行了前瞻性队列研究, 发现了BARX1和ADAMTS17基因多态性(rs11789015和rs4965272)与GERD的发生发展显著相关[21].
细胞色素P450酶系(CYP450)对目前临床广泛使用的约70-80%的药物代谢起重要作用. CYP2C19作为重要的药物代谢酶, 是CYP450超家族成员之一, 参与约10%药物的体内代谢[22,23]. CYP2C19基因多态性显著影响许多药物的疗效和安全性. 例如, BMS-823778是治疗2型糖尿病的潜在候选药物, CYP2C19基因多态性显著影响该药物的在生物体内的代谢途径[13]. CYP2C19基因型与氯吡格雷的抗凝作用密切有关, 部分患者(*2/*2, *2/*3, *3/*3) 服用常规剂量氯吡格雷后会发生血栓性心血管不良事件; 因此, 对于经皮冠状动脉介入治疗合并药物洗脱支架植入术后的冠状动脉疾病患者, 在使用氯吡格雷药物前, 对患者进行CYP2C19基因多态性检测, 并指导其调整用药剂量, 具有重要的临床意义[24].
CYP2C19基因型与大多数主要通过CYP2C19代谢为非活性代谢物的PPIs的使用剂量、疗效和副作用密切相关. 利用CYP2C19基因型数据指导PPI治疗的潜在好处包括: (1)通过基因型预测较低血药浓度的患者, 为其开出更高剂量的处方, 从而增加疗效的可能性; (2)通过基因型预测较高血药浓度的慢性治疗患者, 为其开出低剂量的处方, 以尽量减少与长期使用PPIs相关的毒性风险[25].
在本研究中, 我们分别在3例散发性正常代谢型(*1/*1) GERD患者CYP2C19启动子基因序列中发现了3个新的杂合变异. 细胞功能验证结果表明, 三种变异均导致CYP2C19基因启动子转录活性的改变, 其中携带94761364 T>A变异位点的CYP2C19启动子, 其转录活性比野生型显著升高(P = 0.034), 有可能加快PPIs的代谢, 并降低血药浓度, 可能是患者治疗效果较差的因素之一; 临床上可考虑更换非酶途径代谢的药物如雷贝拉唑等, 开展进一步治疗.
本实验的结果表明, CYP2C19启动子区碱基发生变异, 也可能导致CYP2C19酶活性的改变, 具有一定的临床意义, 这一发现为中国人群中GERD患者的临床指导用药和治疗提供了新的思路.
胃食管反流病(gastroesophageal reflux disease, GERD) 是一种慢性疾病, 主要治疗方法为口服质子泵抑制剂(proton pump inhibitors, PPIs), 临床上常用的第一代PPIs, 经肝脏中CYP2C19代谢, 血药浓度逐渐降低. 先前的研究已证明CYP2C19基因多态性导致PPIs在代谢速率、半衰期和药效等方面个体差异大, 影响疗效.
基因启动子区是控制基因表达的重要调控元件; CYP2C19启动子区如发生基因变异, 可能影响基因表达, 进而改变其生物学功能及PPIs在体内的代谢速率.
在本研究中, 我们将筛选正常代谢型(*1/*1)的GERD患者CYP2C19基因启动子区的变异, 并在细胞水平验证基因变异对启动子功能的影响, 进而分析CYP2C19启动子区功能改变与GERD经PPIs治疗效果的相关性.
收集入院治疗的散发性GERD患者全血163例, 实验组患者经PPIs诊断性治疗后, 症状积分降低>50%, 症状未完全消失(n = 82); 对照组患者治疗后症状完全消失(n = 81); 全部患者CYP2C19基因型经检测为*1/*1. 利用PCR扩增并结合Sanger测序筛选入组患者CYP2C19启动子区的基因变异; 将CYP2C19启动子片段克隆至pGL3 basic载体, 并转染HEK 293T细胞, 检测基因变异对启动子功能的影响.
本研究在3个正常代谢型GERD患者的CYP2C19基因启动子中分别发现了3个新的杂合变异: g.94761364 T>A, g.94762112 T>A, g.94762514 G>T; 与野生型相比, 携带g.94761364 T>A变异的CYP2C19启动子的转录活性显著升高(P = 0.034).
CYP2C19启动子区碱基发生变异可能影响其转录活性, 进而改变PPIs的代谢和血药浓度, 这一发现为中国人群中GERD患者的临床用药和治疗提供了新的思路.
本研究主要在分子和细胞水平对CYP2C19启动子区功能改变与GERD经PPIs治疗效果的相关性进行了研究, 具有一定的临床意义, 将为GERD的分子诊疗提供一定的理论依据.
学科分类: 胃肠病学和肝病学
手稿来源地: 天津市
同行评议报告学术质量分类
A级 (优秀): A
B级 (非常好): 0
C级 (良好): 0
D级 (一般): D
E级 (差): 0
科学编辑: 刘继红 制作编辑:张砚梁
| 1. | Jeong ID. A Review of Diagnosis of GERD. Korean J Gastroenterol. 2017;69:96-101. [PubMed] [DOI] |
| 2. | Surdea-Blaga T, Negrutiu DE, Palage M, Dumitrascu DL. Food and Gastroesophageal Reflux Disease. Curr Med Chem. 2019;26:3497-3511. [PubMed] [DOI] |
| 3. | El-Serag HB, Sweet S, Winchester CC, Dent J. Update on the epidemiology of gastro-oesophageal reflux disease: a systematic review. Gut. 2014;63:871-880. [PubMed] [DOI] |
| 4. | 周 丽雅, 郝 建宇, 李 兆申, 陈 旻湖, 姜 泊, 李 瑜元, 侯 晓华, 唐 承薇, 王 邦茂, 牛 占岳, 薛 艳, 林 三仁. 胃食管反流病量表和质子泵抑制剂试验对胃食管反流病的诊断价值的多中心研究. 中华消化杂志. 2016;36:241-245. [DOI] |
| 5. | Kethman W, Hawn M. New Approaches to Gastroesophageal Reflux Disease. J Gastrointest Surg. 2017;21:1544-1552. [PubMed] [DOI] |
| 6. | 林 果为, 王 吉耀, 葛 均波. 实用内科学(15版). 北京: 人民卫生出版社 2017; 1494. |
| 7. | Kellerman R, Kintanar T. Gastroesophageal Reflux Disease. Prim Care. 2017;44:561-573. [PubMed] [DOI] |
| 8. | Hunt R, Armstrong D, Katelaris P, Afihene M, Bane A, Bhatia S, Chen MH, Choi MG, Melo AC, Fock KM, Ford A, Hongo M, Khan A, Lazebnik L, Lindberg G, Lizarzabal M, Myint T, Moraes-Filho JP, Salis G, Lin JT, Vaidya R, Abdo A, LeMair A; Review Team:. World Gastroenterology Organisation Global Guidelines: GERD Global Perspective on Gastroesophageal Reflux Disease. J Clin Gastroenterol. 2017;51:467-478. [PubMed] [DOI] |
| 9. | Chen J, Brady P. Gastroesophageal Reflux Disease: Pathophysiology, Diagnosis, and Treatment. Gastroenterol Nurs. 2019;42:20-28. [PubMed] [DOI] |
| 10. | Jonaitis P, Jonaitis L, Kupcinskas J. Role of Genetic Polymorphisms of Cytochrome P450 2C19 in Pantoprazole Metabolism and Pantoprazole-based Helicobacter pylori Eradication Regimens. Curr Drug Metab. 2020;. [PubMed] [DOI] |
| 11. | Scott SA, Sangkuhl K, Gardner EE, Stein CM, Hulot JS, Johnson JA, Roden DM, Klein TE, Shuldiner AR; Clinical Pharmacogenetics Implementation Consortium. Clinical Pharmacogenetics Implementation Consortium guidelines for cytochrome P450-2C19 (CYP2C19) genotype and clopidogrel therapy. Clin Pharmacol Ther. 2011;90:328-332. [PubMed] [DOI] |
| 12. | Karaźniewicz-Łada M, Krzyżańska D, Danielak D, Rzeźniczak J, Główka F, Słomczyński M, Burchardt P. Impact of genetic variants of selected cytochrome P450 isoenzymes on pharmacokinetics and pharmacodynamics of clopidogrel in patients co-treated with atorvastatin or rosuvastatin. Eur J Clin Pharmacol. 2020;76:419-430. [PubMed] [DOI] |
| 13. | Cheng Y, Wang L, Iacono L, Zhang D, Chen W, Gong J, Humphreys WG, Gan J. Clinical significance of CYP2C19 polymorphisms on the metabolism and pharmacokinetics of 11β-hydroxysteroid dehydrogenase type-1 inhibitor BMS-823778. Br J Clin Pharmacol. 2018;84:130-141. [PubMed] [DOI] |
| 14. | Zhu WY, Zhao T, Xiong XY, Li J, Wang L, Zhou Y, Gong ZL, Cheng SY, Liu Y, Shuai J, Yang QW. Association of CYP2C19 Polymorphisms with the Clinical Efficacy of Clopidogrel Therapy in Patients Undergoing Carotid Artery Stenting in Asia. Sci Rep. 2016;6:25478. [PubMed] [DOI] |
| 15. | Zheng CL, Alzghari SK. Putting Out the Fire: The Relationship of Pharmacogenetics and Proton Pump Inhibitors for the Treatment of Gastroesophageal Reflux Disease. Cureus. 2018;10:e2687. [PubMed] [DOI] |
| 17. | Böhmer AC, Schumacher J. Insights into the genetics of gastroesophageal reflux disease (GERD) and GERD-related disorders. Neurogastroenterol Motil. 2017;29. [PubMed] [DOI] |
| 18. | Patel A, Hasak S, Nix BD, Sayuk GS, Newberry RD, Gyawali CP. Genetic risk factors for perception of symptoms in GERD: an observational cohort study. Aliment Pharmacol Ther. 2018;47:289-297. [PubMed] [DOI] |
| 19. | Izakovicova Holla L, Borilova Linhartova P, Hrdlickova B, Marek F, Dolina J, Rihak V, Kala Z. Haplotypes of the IL-1 gene cluster are associated with gastroesophageal reflux disease and Barrett's esophagus. Hum Immunol. 2013;74:1161-1169. [PubMed] [DOI] |
| 20. | Lam C, Liu WF, Bel RD, Chan K, Miller L, Brown MC, Chen Z, Cheng D, Patel D, Xu W, Darling GE, Liu G. Polymorphisms of the FOXF1 and MHC locus genes in individuals undergoing esophageal acid reflux assessments. Dis Esophagus. 2017;30:1-7. [PubMed] [DOI] |
| 21. | Argyrou A, Legaki E, Koutserimpas C, Gazouli M, Papaconstantinou I, Gkiokas G, Karamanolis G. Polymorphisms of the BARX1 and ADAMTS17 Locus Genes in Individuals With Gastroesophageal Reflux Disease. J Neurogastroenterol Motil. 2019;25:436-441. [PubMed] [DOI] |
| 22. | Lan T, Yuan LJ, Hu XX, Zhou Q, Wang J, Huang XX, Dai DP, Cai JP, Hu GX. Effects of CYP2C19 variants on methadone metabolism in vitro. Drug Test Anal. 2017;9:634-639. [PubMed] [DOI] |
| 23. | Damkier P, Kjærsgaard A, Barker KA, Cronin-Fenton D, Crawford A, Hellberg Y, Janssen EAM, Langefeld C, Ahern TP, Lash TL. CYP2C19*2 and CYP2C19*17 variants and effect of tamoxifen on breast cancer recurrence: Analysis of the International Tamoxifen Pharmacogenomics Consortium dataset. Sci Rep. 2017;7:7727. [PubMed] [DOI] |
| 24. | Zhong Z, Hou J, Zhang Q, Li B, Li C, Liu Z, Yang M, Zhong W, He X, Wu H, Zhong M, Zhao P. Effect of cytochrome P450 2C19 polymorphism on adverse cardiovascular events after drug-eluting stent implantation in a large Hakka population with acute coronary syndrome receiving clopidogrel in southern China. Eur J Clin Pharmacol. 2018;74:423-431. [PubMed] [DOI] |
| 25. | Lima JJ, Thomas CD, Barbarino J, Desta Z, Van Driest SL, El Rouby N, Johnson JA, Cavallari LH, Shakhnovich V, Thacker DL, Scott SA, Schwab M, Uppugunduri CRS, Formea CM, Franciosi JP, Sangkuhl K, Gaedigk A, Klein TE, Gammal RS, Furuta T. Clinical Pharmacogenetics Implementation Consortium (CPIC) Guideline for CYP2C19 and Proton Pump Inhibitor Dosing. Clin Pharmacol Ther. 2020;. [PubMed] [DOI] |