修回日期: 2020-09-07
接受日期: 2020-09-21
在线出版日期: 2020-10-28
本研究采用Meta分析的方法对国内外2005-2019年发表的有关益生菌治疗重症急性胰腺炎(severe acute pancreatitis, SAP)的临床随机对照试验(randomized controlled trials, RCTs)进行综合分析, 以明确益生菌治SAP对患者的住院时间, 痛持续时间, 死亡, 继发感染, 多器官功能衰竭等预后相关指标是否有积极的统计学意义.
评价益生菌制剂治疗SAP的临床疗效.
在CNKI, 万方全文数据库, 维普中文期刊, PubMed、Cochrane等文献数据库中检索益生菌治疗SAP的临床RCTs. 评价符合纳入标准的文献的文献质量, 分析文献是否存在偏倚, 用Review Manager 5.3进行统计学分析.
14项RCTs, 共921 (n = 921)名患者纳入研究, 分析结果显示, 益生菌治疗SAP的治疗过程中继发感染(hP<0.05)、平均住院时间(dP<0.05)、平均腹痛缓解时间(lP<0.05)、死亡(fP<0.05), SAP继发性多器官功能障碍(jP<0.05)等方面治疗组较对照组均有统计学意义.
益生菌可减少患者住院时间以及腹痛时间以及继发感染的风险, 减少患者的死亡以及继发性多器官功能衰竭的发生.
核心提要: 本研究发现益生菌治疗重症急性胰腺炎在减少患者住院时间, 缩短患者的腹痛时间, 减少患者继发感染的发生, 减少患者死亡率, 继发多器官功能障碍发生率方面有统计学意义, 这与国内已有Meta分析结论有部分差异, 本研究通过分析差异产生的原因并得出积极的结论.
引文著录: 陈炜, 谢思明, 龚菊, 徐若欣, 黄坚. 益生菌应用于重症急性胰腺炎治疗效果的Meta分析. 世界华人消化杂志 2020; 28(20): 1016-1024
Revised: September 7, 2020
Accepted: September 21, 2020
Published online: October 28, 2020
In this study, we performed a meta-analysis to comprehensively evaluate both domestic and foreign randomized controlled trials (RCTs) related to the treatment of severe acute pancreatitis with probiotics published between 2005 and 2019 to clarify if probiotic treatment has a positive impact on patients' hospital stay, duration of abdominal pain, death, secondary infection, multiple organ failure, and other prognostic-related indicators.
To evaluate the clinical efficacy of probiotics in the treatment of SAP.
RCTs evaluating the effectiveness of probiotic therapy in SAP patients were searched in databases such as CNKI, Wanfang Med Online, VIP, PubMed, and Cochrane. The quality of the included articles was assessed and possible biases among them were analyzed. We performed all statistical analyses with Revman 5.3 software.
A total of 14 trials with 921 patients were involved in the study. Meta-analysis showed that there were significant differences in secondary infection (P < 0.0001), mean hospital stay (P < 0.0001), mean time to abdominal pain relief (P < 0.0001), mortality (P = 0.03), and the incidence of secondary multiorgan failure (P = 0.01) between the study group and control group.
According to this meta-analysis, probiotic treatment could significantly shorten the length of hospital stay, alleviate abdominal pain, and reduce the risk of secondary infection, death, and secondary multiple organ failure.
- Citation: Chen W, Xu RX, Gong J, Xie SM, Huang J. Efficacy of probiotics for treatment of severe acute pancreatitis: A meta-analysis. Shijie Huaren Xiaohua Zazhi 2020; 28(20): 1016-1024
- URL: https://www.wjgnet.com/1009-3079/full/v28/i20/1016.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v28.i20.1016
急性胰腺炎(acute pancreatitis, AP)是急诊内科常见的消化系统急症, 常见的病因有: 胆道疾病、酒精、胰管阻塞、十二指肠降段疾病、手术与创伤、代谢障碍等. 随着我国人民生活水平的提高以及饮食结构的改变, 急性胰腺炎的发病率逐年上升, 且发病年龄有年轻化趋势. 虽然急性胰腺炎整体死亡率在3%-6%, 但患者在住院过程中可有继发感染, 继发多器官功能衰竭等严重并发症, 重症急性胰腺炎(severe acute pancreatitis, SAP)死亡率可以高达约30%[1]. 因此, 临床医生和医学工作者十分重视AP的治疗研究, 已有证据显示SAP的治疗在禁食、抑酸抑酶、补液, 器官功能维护的传统治疗基础上应早期开放肠内营养, 早期肠内营养能显著减少患者的死亡率和继发感染并发症的发生[2]. 益生菌是指当有足够数量时给宿主带来益处的活菌的统称, 常来源于正常人肠道的共生菌群, 所以益生菌能模仿正常人肠道菌群的稳态效应, 有助于保护肠黏膜屏障及减少菌群异位, 从而降低感染及其他严重并发症的风险[3-5]. 近年来, 大量临床医生和研究人员进行了相关的试验和临床研究来评价益生菌应用于SAP的疗效, 但是却没有得出统一的结论. 本研究通过分析近年间益生菌用于治疗症急性胰腺炎的临床试验, 为益生菌的临床应用提供参考.
1.1.1 文献检索: 本Meta分析依照PRISMA声明进行研究[6], 以"益生菌"、"重症急性胰腺炎"为关键词检索中国知网学术文献库, 万方全文数据库, 维普中文等数据库, 以"probiotic"或者"prebiotics"和"acute pancreatitis"或"acute edematous pancreatitis"或"Pancreatic Parenchyma with Edema"或"Pancreatic Parenchymal Edema"或"Pancreatitis, Acute"或"Pancreatitis, Acute Edematous"或"Peripancreatic Fat Necrosis"为规范主题词, 以"probiotics"或"prebiotics"和"acute pancreatitis"自由词搜索PubMed、Cochrane等英文数据库. 文献检索时间范围为2005-01/2019-12, 文献语种限定为英语和中文.
1.1.2 纳入标准: (1)研究对象为有典型腹痛症状, 血清淀粉酶升高3倍以上, CT表现为AP典型影像学改变, 经临床诊断为SAP的患者; (2)研究类型为临床随机对照试验(randomized controlled trials, RCTs), 无论是否采用盲法; (3)研究内容为益生菌治疗急性胰腺炎患者, 文献能提供相关数据(死亡率、病程时间、继发感染情况等)进行分析; (4)试验干预措施为在常规治疗基础上, 试验组早期开放肠内营养, 加用益生菌; 对照组为单用常规治疗联合早期肠内营养, 加用安慰剂.
1.1.3 排除标准: (1)非RCTs(综述、动物试验、其他Meta分析、系统回顾等); (2)文献无相关试验数据可供分析; (3)重复文献.
1.2.1 文献筛选和数据提取: 由2名独立的研究员严格按照文献纳入和排除标准进行文献筛选、数据提取, 如遇分歧则通过组内会议讨论或参考第三名研究员的选择意见综合考虑. 文献内容包括作者的姓名、文献的发表时间、治疗组和对照组的基本信息、具体干预措施以及结局指标.
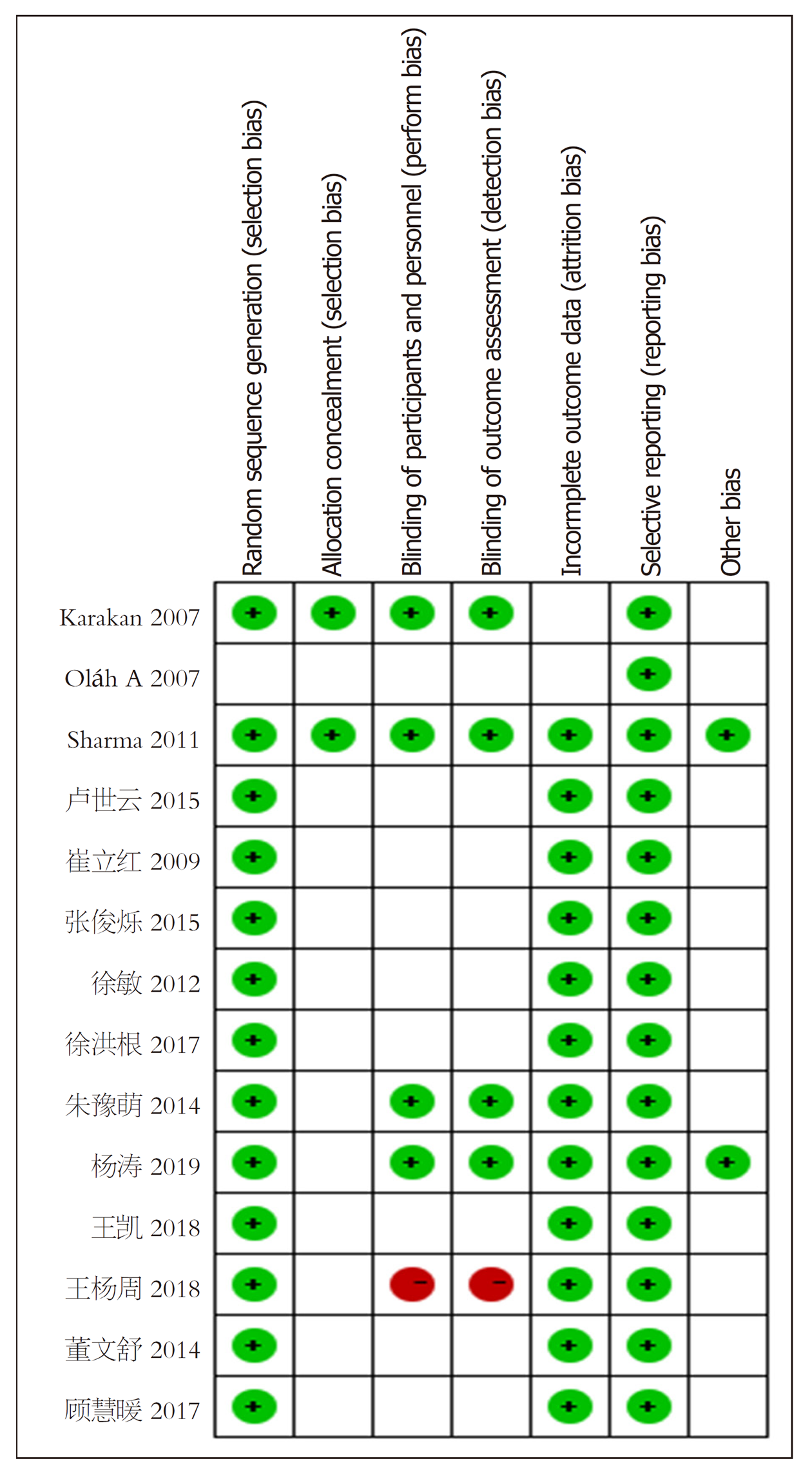
1.2.2 文献质量评价: 采用Cochrane文献偏倚评价工具评价文献质量, 评价内容包括: (1)是否采用随机分配; (2)有无隐藏方案或描述具体细节; (3)是否采用盲法; (4)结果数据是否完整, 有无失访或数据缺失; (5)是否存在发表偏倚; (6)其他偏倚的来源. 基于以上6项指标, 将文献分为三个质量等级: 低度偏倚: 完全满足以上的内容, 提示存在偏倚的可能性小; 中度偏倚: 部分满足以上的内容, 说明可能存在偏倚; 高度偏倚; 完全不满足以上的内容, 说明极有可能存在相应偏倚.
统计学处理 使用Cochrane网提供的Revman 5.3软件对所提取数据进行统计分析. 分类变量的统计选择相对危险度(risk ratio, RR)为合并统计量, 数值变量的统计选择加权均数差(weighted mean difference, WMD)为合并统计量, 所有合并统计量均计算95%CI. 异质性检验采用P值和I2作为判断标准, 当P>0.1和I2<50%时, 提示纳入的数据来源存在同质性, 选择固定效应模型进行分析; 当P≤0.1和I2≥50%, 提示纳入数据来源存在异质性, 应先从试验设计, 具体实施方案等方面进行亚组分析, 分析异质性的可能来源, 若亚组分析后各组之间仍具有异质性, 才可选择随机效应模型来进行统计量合并; 绘制漏斗图分析发表偏倚.
根据检索方法, 初步检索到相关文献202篇, 其中中文77篇, 英文125篇, 最终纳入14[7-20]个研究, 合计921例急性重症胰腺炎患者, 其中试验组有461例, 对照组有460例. 具体文献信息见表1.
| Ref. | 时间 | 试验组人数 | 对照组人数 | 干预药物 | 用药剂量 | 结局指标 |
| Karakan等[7] | 2007 | 15/ | 15 | 益生菌 | 24 g | 住院时间, ICU治疗时间, 死亡, 多器官功能衰竭等 |
| Oláh等[8] | 2007 | 33 | 29 | 益生菌 | 不清楚 | 继发感染, 多器官功能衰竭, 住院时间, 死亡等 |
| Sharma等[9] | 2011 | 24 | 26 | 四联益生菌 | 不清楚 | IgG, IgM, 腹痛缓解时间, 住院时间, ICU治疗时间, 死亡, 多器官功能衰竭等 |
| 杨涛等[10] | 2019 | 27 | 24 | 培菲康 | 420 mg | 腹痛时间, 继发感染, 死亡, 住院时间, C反应蛋白等 |
| 王凯等[11] | 2018 | 100 | 100 | 双歧三联益生菌胶囊 | 2粒 | C反应蛋白, TNF-α, IL-6, IL-10, 白蛋白等 |
| 王杨周等[12] | 2018 | 28 | 29 | 贝飞达 | 0.63 g | 继发感染, ICU治疗时间, 死亡等 |
| 顾慧媛等[13] | 2017 | 17 | 17 | 培菲康 | 2粒 | C反应蛋白, TNF-α, IL-6等 |
| 徐洪根等[14] | 2017 | 34 | 34 | 双歧三联活菌胶囊 | 420 mg | 继发感染, 多器官功能衰竭, 死亡, 住院时间等 |
| 张俊烁等[16] | 2015 | 25 | 25 | 培菲康 | 2粒 | 住院时间, 腹痛缓解时间, 白蛋白, C反应蛋白等 |
| 卢世云等[15] | 2015 | 48 | 48 | 金双歧 | 2 g | 住院时间, 腹痛缓解时间, 继发感染, C反应蛋白恢复正常值时间等 |
| 朱豫萌等[17] | 2014 | 20 | 19 | 米雅 | 2片 | 继发感染, ICU治疗时间, 引流率, 肠缺血率等 |
| 董文舒等[18] | 2014 | 52 | 52 | 四联益生菌制剂 | 270 g | 住院时间, 腹痛缓解时间, 继发感染 |
| 徐敏等[19] | 2012 | 18 | 17 | 常美安 | 500 mg | 腹痛缓解时间, 住院时间, CRP恢复时间, 死亡, 手术率等 |
| 崔立红等[20] | 2009 | 20 | 25 | 培菲康 | 420 mg | 死亡, 胰周感染和胰周脓肿, 住院时间, 肾功能衰竭等 |
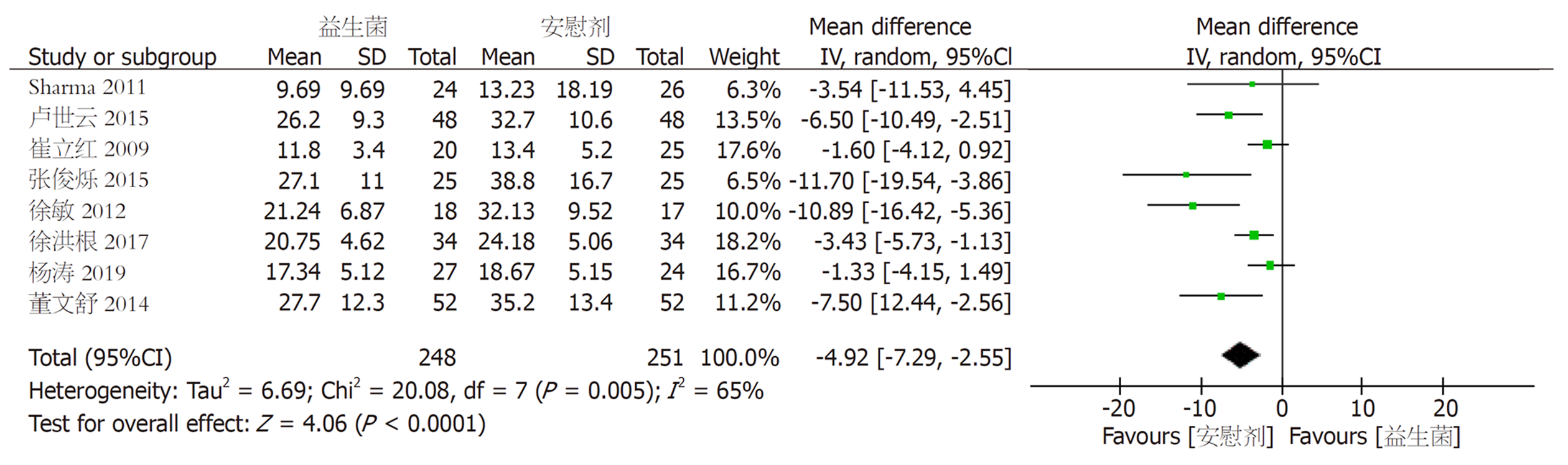
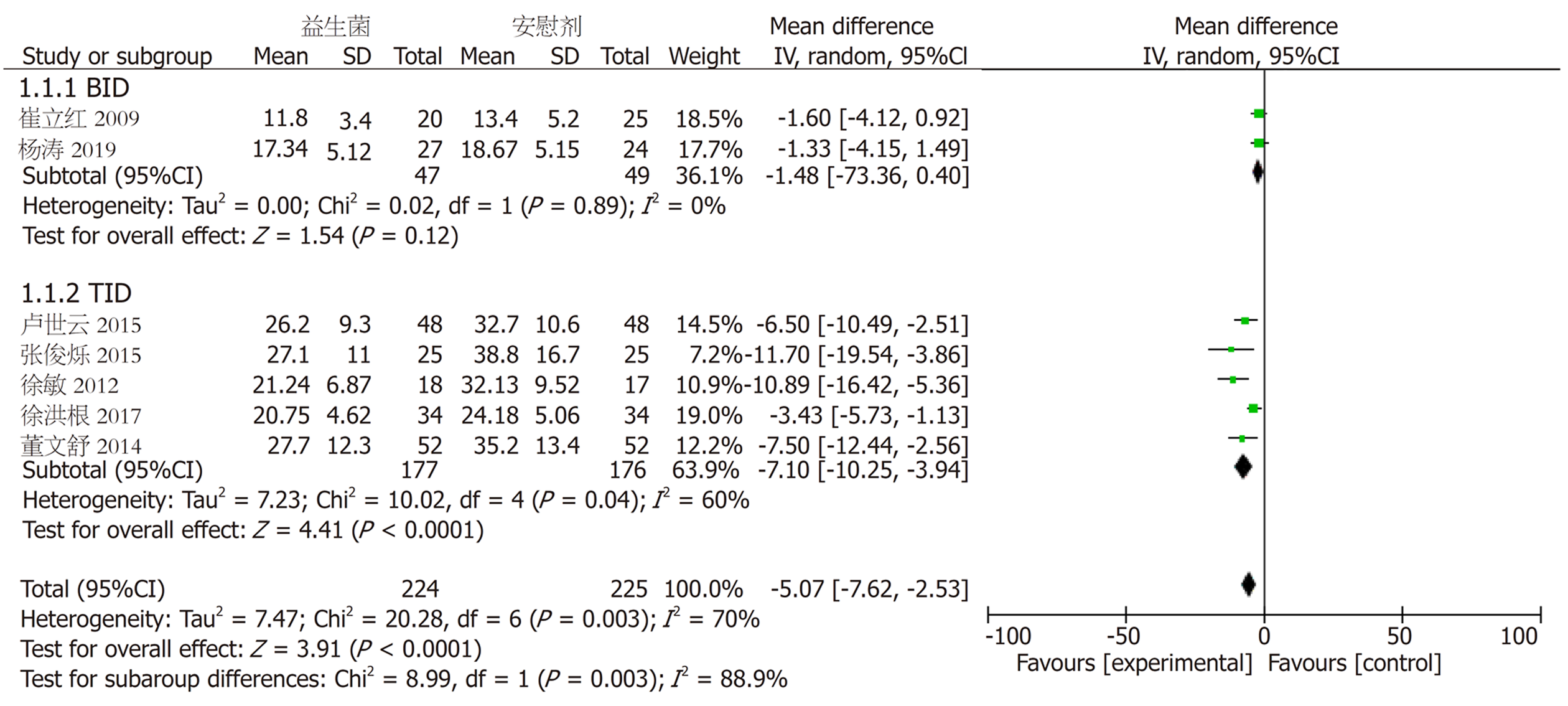
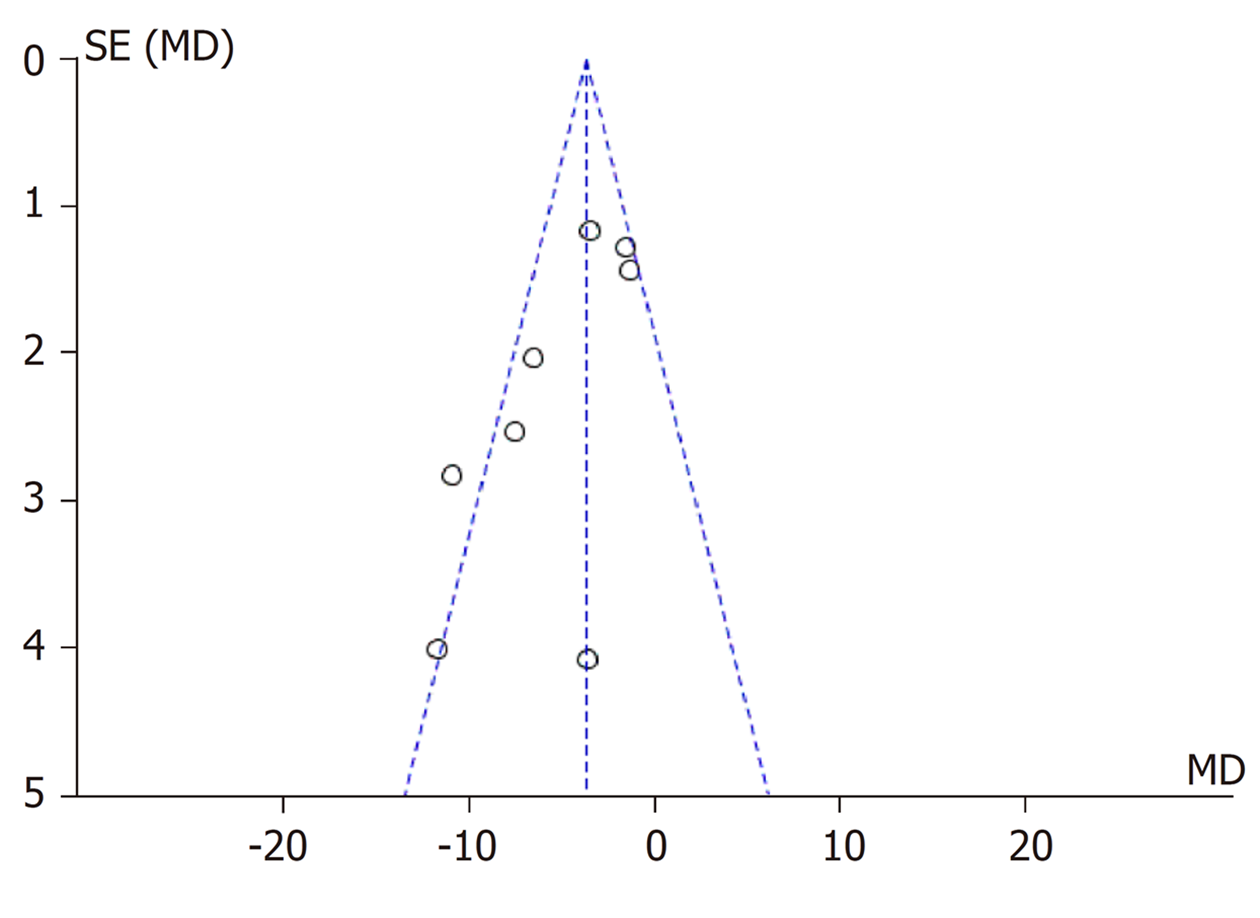
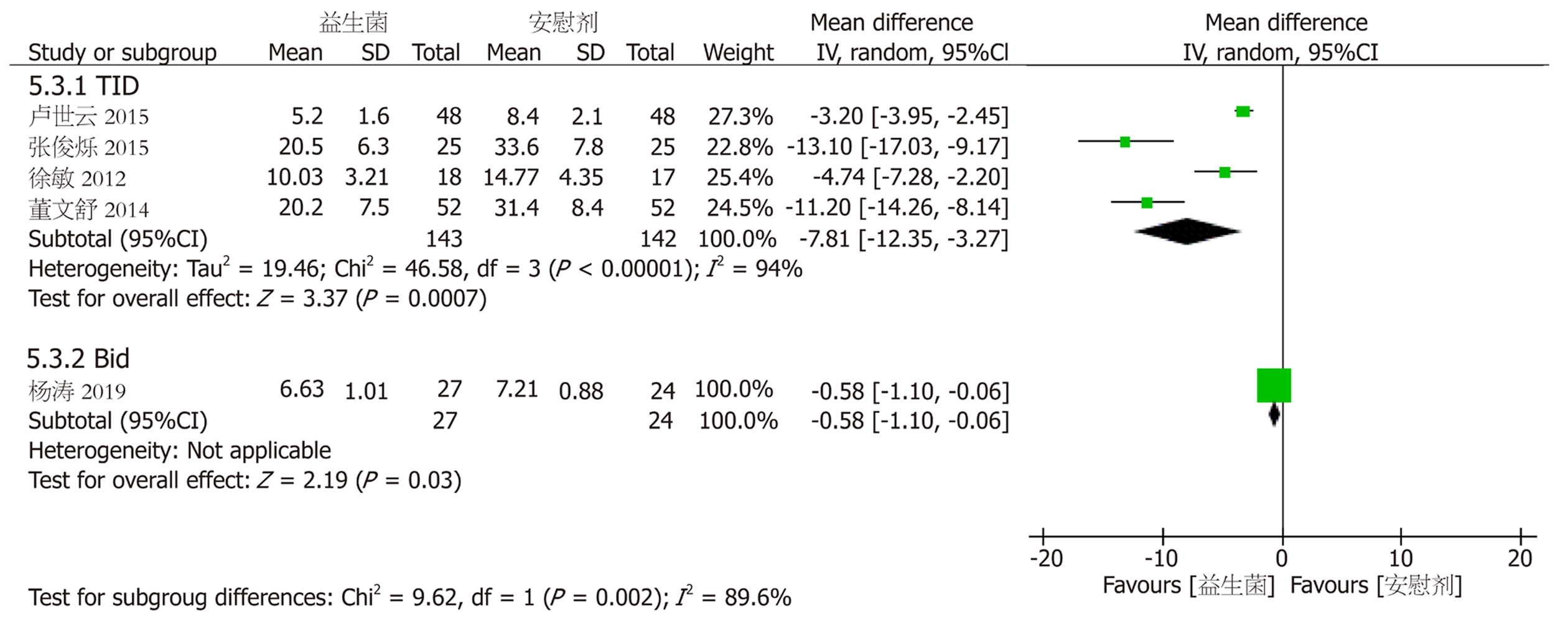
2.3.1 住院时间: 共对8组试验[9,10,14-16,18-20]进行分析(图2), 异质性检验显示8组试验存在异质性(aP = 0.005, aI² = 65%), 将纳入研究按照给药频次不同分为2次/日(bis in die, BID)组[10,20]和3次/日(ter in die, TID)[14-16,18,19]组进行亚组分析, 分析不同给药频次是否是异质性的来源. 将2个BID频次给药的试验分为一个亚组, 结果显示[WMD = -1.48, 95%CI = (-3.36, 0.40), bP = 0.89, bI² = 0%](图3), 不存在异质性, 但是无统计学意义; 将5组TID频次给药的试验分为一个亚组, 结果显示[WMD = -7.10, 95%CI = (-10.25, -3.94), cP = 0.04, cI² = 60%](图3), 仍有异质性, 故选择随机效应模型进行统计量合并分析, 有统计学意义(dP<0.05). 漏斗图显示无明显发表偏倚(图4).
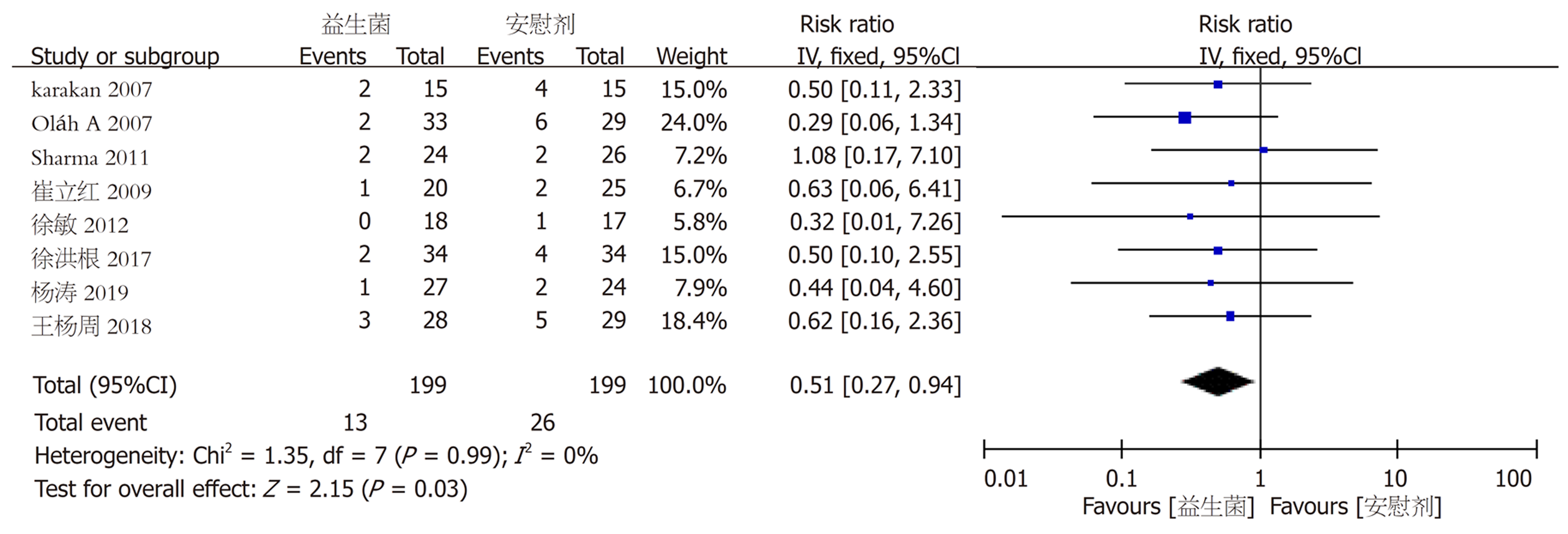
2.3.2 死亡: 共有8个试验[7-10,12,14,19,20]对胰腺炎患者的死亡人数进行了统计. 首先进行异质性检验, 结果显示试验结果不存在异质性(eP = 0.99, eI² = 0%), 选择固定效应模型进行统计, 结果显示差异具有统计学意义[RR = 0.51, 95%CI (0.27, 0.94), fP<0.05](图5).
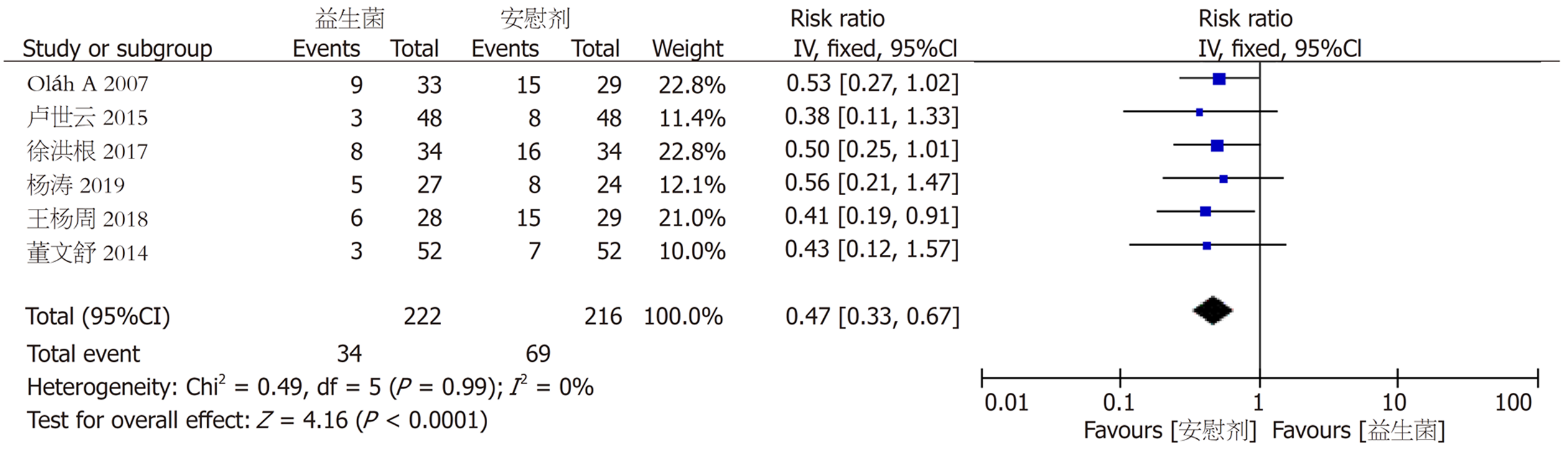
2.3.3 继发感染: 共有6个试验[8,10,11,14,15,18]对胰腺炎患者的继发感染情况进行了分析. 经过异质性检验, 结果显示各项试验数据不存在异质性(gP = 0.99, gI² = 0%), 选择固定效应模型合并统计量, 结果显示试验组和对照组的继发感染情况差异有显著统计学意义[RR = 0.47, 95%CI (0.33, 0.67), hP<0.05](图6).
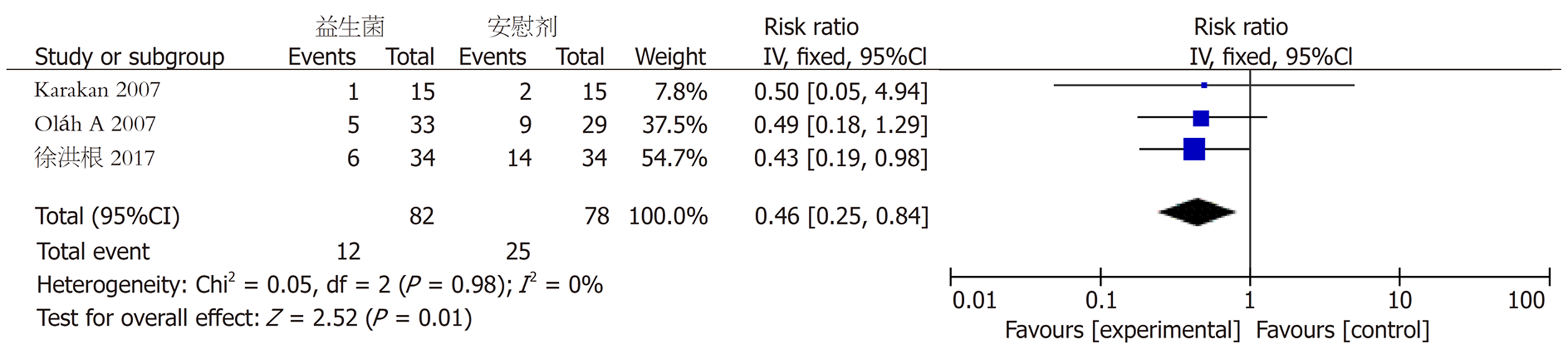
2.3.4 多器官功能衰竭: 共有3个试验[7,8,14]对SAP患者继发多器官功能衰竭进行了描述. 异质性检验结果显示数据来源不存在异质性(iP = 0.98, iI² = 0%, 图7), 采用固定效应模型, 合并统计结果显示[RR = 0.46, 95%CI (0.25, 0.84), jP<0.05], 差异有统计学意义.
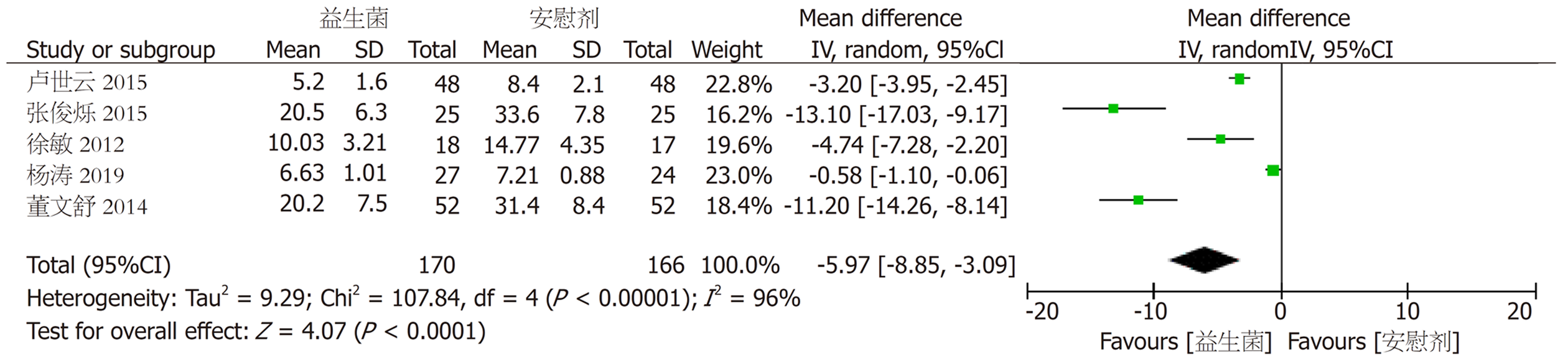
2.3.5 腹痛持续时间: 共有5个试验[10,15,16,18,19]对胰腺炎患者的腹痛持续时间进行了统计. 先进行异质性检验, 结果显示数据来源存在异质性(kP<0.05, kI² = 96%, 图8), 需进行亚组分析, 按照给药频率分为两组: BID组[10]和TID组[15,16,18,19], 结果显示两个亚组仍存在异质性(图9), 选择随机效应模型进行合并统计, 结果显示[WMD = -5.97, 95%CI (-8.85, -3.09), lP<0.05], 有统计学意义.
敏感性分析采用选择模型分析法, 将上述试验数据分别进行固定, 随机效应模型统计分析, 结果都相同. 剔除各疗效评价内的低质量文献, 重新估计分析后提示, 住院时间, 继发感染, 继发多器官功能衰竭与原分析结果变化不大, 说明敏感性低, 结果较为稳健可信; 急性胰腺炎患者死亡、治疗后腹痛持续时间出现较大差异, 提示敏感性较高, 结果稳健性较低. 住院时间分析、死亡分析、继发感染分析、继发多器官功能衰竭漏斗图提示无明显发表偏倚, 腹痛时间分析漏斗图提示有发表偏倚. 试验数据样本量小, 所有试验均未描述退出试验的详细信息, 未描述具体盲法措施可能是存在偏倚的原因.
本Meta分析结果显示: 早期开放肠内营养合并使用益生菌可有效减少SAP患者的住院时间, 降低患者的死亡率, 减少SAP继发感染的发生率, 降低多器官衰竭的发生以及缩短患者的腹痛时间.
2015年牛天天等[21]发表的Meta分析显示, SAP益生菌试验组与安慰剂对照组在病死率, 多器官衰竭发生率, 继发感染发生率方面没有统计学意义, 与本Meta分析结果有较大分歧. 本Meta分析共纳入14篇中外文献, 其中2015年后发表的文献有7篇[10-16], 牛天天等纳入的文献为7篇中外文文献, 且纳入一篇争议较大的大样本随机对照试验[22], 2010年《The Lancet》发表了荷兰卫生保健监察局对该试验进行的调查结果[23], 调查发现该试验设计, 准入原则以及试验的实施均有重大缺陷. 将Besselink等[22]的试验结果纳入本Meta分析的相关文献进行敏感性分析, 结果显示: 试验组与对照组患者的死亡率无统计学意义, 继发多器官功能衰竭发生率无统计学意义, 提示该文献敏感性高, 纳入后产生较大偏倚, 故本Meta分析予以剔除.
胃肠道周围分布着丰富的黏膜相关淋巴组织(mucosal-associated lymphoid tissue, MALT), MALT在肠道粘膜形成免疫屏障, 是粘膜免疫防御功能的最关键部分. MALT中存在着大量的B细胞可产生分泌免疫球蛋白-A (secretory immunoglobulin-A, SIgA), SIgA与相应的病原体(细菌, 病毒等)结合, 可阻止病原体黏附到细胞表面, 从而发挥抗感染作用. 正常情况下人体消化道内存在由多种细菌, 病毒等微生物组成的菌群, 正常的消化道菌群与消化道粘膜之间形成复杂的, 平衡的微生态系统, 有助于消化道粘膜屏障功能的形成. SAP患者病程中发生全身炎症反应综合征, 大量炎症介质释放后肠道微循环改变, 导致肠黏膜细胞发生萎缩甚至坏死, 破坏肠道的免疫屏障功能, 增加肠黏膜通透性; 同时, 由于长期禁食、抗生素的过度应用、休克等多种情况, 极易造成肠道菌群紊乱, 进而导致肠道菌群移位, 引起全身感染. Kadiyala等[24]和Choi等[25]认为感染和多器官功能障碍是影响SAP预后的独立危险因素. Singh等[26]和Erickson等[27]认为益生菌应用后直接增加了肠道正常菌群数量, 促使SAP患者肠道菌群趋于稳定; 同时, 益生菌代谢过程中产生多种酸性代谢产物, 降低肠道Ph, 抑制腐败菌生长; 最主要的是, 益生菌能促进肠黏膜生长, 刺激黏液素的分泌, 修复肠道免疫屏障, 降低肠道通透性, 从而有效防止肠道细菌穿透肠壁导致菌群移位.
综上所述, 早期应用益生菌治疗SAP的疗效优于常规治疗治疗组, 根据本Meta分析的结果, 益生菌值得在临床推广, 同时针对研究中出现的问题, 以后还需进行大样本, 多中心随机双盲临床试验加以证明益生菌治疗SAP的疗效.
与轻症急性胰腺炎提倡禁食不同, 重症胰腺炎(severe acute pancreatitis, SAP)的治疗应当早期开放肠内营养(24-72 h之内), 有助于保护肠粘膜屏障以及减少肠道菌群移位, 从而降低SAP相关并发症的风险. 益生菌是一类来源于正常人肠道的共生菌群制剂, 在肠道内能产生正常肠道菌群效应, 纠正肠道菌群紊乱, 维持肠道微环境的平衡, 外源性地保护肠黏膜屏障, 从而改善SAP的预后. 近年来国内外学者开展了多项益生菌治疗SAP的随机对照试验, 但是由于各个独立研究样本量小, 试验设计不统一, 观察指标不一致, 最终都没有得出一个益生菌治疗SAP的指导性意见.
本研究通过大量收集国内外益生菌治疗SAP的随机对照试验数据并加以分析, 用多个指标来综合评价疾病的预后, 从而得出益生菌用于SAP治疗的是否有效的结果, 为临床使用益生菌治疗SAP提供理论依据, 从而有效地减轻患者痛苦, 减少患者住院时间, 降低患者的死亡率等具有重要意义.
本研究目标是通过Meta分析的方法, 合并统计多个独立的随机对照试验结果, 增加统计学检验效能, 分析试验组和对照组SAP患者的住院时间, 腹痛持续时间, 继发感染, 继发多器官功能障碍以及死亡率, 得出试验组较对照组在缩短住院时间、腹痛持续时间, 降低继发感染, 继发多器官功能衰竭, 降低死亡率方面部分或全部有统计学意义, 证明益生菌较安慰剂有积极治疗效果. 为临床推广益生菌应用治疗SAP, 改善患者预后有着积极的意义.
本研究通过检索2005-2019年国内外发表的益生菌治疗SAP的随机对照试验, 按照严格的纳入和排除标准, 共纳入14项符合标准的试验, 经过精读文献, 收集住院时间(mean±SD), 腹痛持续时间(mean±SD), 继发感染(n), 继发多器官功能衰竭(n), 死亡(n)等数据, 使用Revman 5.3软件进行合并统计分析, 得出合并P值并分析试验组和对照组的差异是否有统计学意义.
本实验通过综合分析14项临床对照试验的研究结果, 最终得出结论: 益生菌治疗组的住院时间, 腹痛持续时间, 继发感染率, 继发多器官功能发生率以及死亡率与安慰剂对照组的差异均有统计学意义. 证明了益生菌治疗SAP能改善患者的预后, 为益生菌广泛应用于临床治疗SAP提供了证据支持, 为更多的SAP患者提供新的, 有效的, 温和的治疗手段, 减轻患者痛苦, 降低并发症的风险.
本研究发现: 纳入Besselink等的临床随机对照试验(randomized controlled trials, RCTs)的试验数据, 分析结果中的死亡率以及多器官功能衰竭发生率在试验组和对照组之间无统计学意义, 排除该文献后重新计算, 试验组和对照组的死亡率和多器官功能发生率的差异有统计学意义, 提示该文献的敏感性较高, 且再次检索相关文献, 发现该试验的设计及实施有缺陷, 纳入分析该文献必然会导致较大的偏倚出现. 故本研究排除了该文献, 得出与其他类似的Meta分析不同的结论, 本研究认为, 益生菌治疗SAP有显著的疗效. 通过精读文献, 归纳分析益生菌产生治疗效果的基本原理: 维持肠道菌群稳定; 改变肠道微环境, 抑制病原菌过度增殖; 修复肠道粘膜屏障. 本研究的结论为推广益生菌治疗SAP提供理论支持, 改善SAP患者的预后, 减少患者的死亡, 为临床治疗SAP提供新方法.
经验教训: 文献检索: 本研究在检索外文文献时单纯搜索自由词"probiotics"或"prebiotics"和"acute pancreatitis", 搜出的文献数量多, 符合纳入指标的文献少, 效率低下. 通过学习规范词搜索和高级检索, 快速, 准确地搜索出符合纳入标准的文献, 再通过精读文献, 选择最终纳入的RCTs. 未来的研究方向: 抗炎症因子抗体治疗SAP的研究. 最佳方法: 细胞实验, 动物实验, 临床随机对照试验.
学科分类: 胃肠病学和肝病学
手稿来源地: 江苏省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): 0
E级 (差): 0
科学编辑: 张晗 制作编辑:刘继红
| 1. | Dumnicka P, Maduzia D, Ceranowicz P, Olszanecki R, Drożdż R, Kuśnierz-Cabala B. The Interplay between Inflammation, Coagulation and Endothelial Injury in the Early Phase of Acute Pancreatitis: Clinical Implications. Int J Mol Sci. 2017;18:354. [PubMed] [DOI] |
| 2. | Petrov MS, Kukosh MV, Emelyanov NV. A randomized controlled trial of enteral versus parenteral feeding in patients with predicted severe acute pancreatitis shows a significant reduction in mortality and in infected pancreatic complications with total enteral nutrition. Dig Surg. 2006;23:336-44; discussion 344-5. [PubMed] [DOI] |
| 4. | Sanders ME. Probiotics in 2015: Their Scope and Use. J Clin Gastroenterol. 2015;49 Suppl 1:S2-S6. [PubMed] [DOI] |
| 5. | Abraham BP, Quigley EMM. Probiotics in Inflammatory Bowel Disease. Gastroenterol Clin North Am. 2017;46:769-782. [PubMed] [DOI] |
| 6. | Moher D, Liberati A, Tetzlaff J, Altman DG; PRISMA Group. Preferred reporting items for systematic reviews and meta-analyses: the PRISMA statement. PLoS Med. 2009;6:e1000097. [PubMed] [DOI] |
| 7. | Karakan T, Ergun M, Dogan I, Cindoruk M, Unal S. Comparison of early enteral nutrition in severe acute pancreatitis with prebiotic fiber supplementation versus standard enteral solution: a prospective randomized double-blind study. World J Gastroenterol. 2007;13:2733-2737. [PubMed] [DOI] |
| 8. | Oláh A, Belágyi T, Pótó L, Romics L, Bengmark S. Synbiotic control of inflammation and infection in severe acute pancreatitis: a prospective, randomized, double blind study. Hepatogastroenterology. 2007;54:590-594. [PubMed] |
| 9. | Sharma B, Srivastava S, Singh N, Sachdev V, Kapur S, Saraya A. Role of probiotics on gut permeability and endotoxemia in patients with acute pancreatitis: a double-blind randomized controlled trial. J Clin Gastroenterol. 2011;45:442-448. [PubMed] [DOI] |
| 10. | 杨 涛. 益生菌联合早期肠内营养对重症急性胰腺炎的疗效观察. 郑州市: 郑州大学 2019; . |
| 20. | 崔 立红, 王 少鑫, 王 晓辉, 浦 江, 刘 超群, 付 山峰, 于 兰. 早期应用微生态制剂对急性重症胰腺炎患者血清炎性介质水平的影响. 中国新药杂志. 2009;18:1854-1857. |
| 22. | Besselink MG, van Santvoort HC, Buskens E, Boermeester MA, van Goor H, Timmerman HM, Nieuwenhuijs VB, Bollen TL, van Ramshorst B, Witteman BJ, Rosman C, Ploeg RJ, Brink MA, Schaapherder AF, Dejong CH, Wahab PJ, van Laarhoven CJ, van der Harst E, van Eijck CH, Cuesta MA, Akkermans LM, Gooszen HG; Dutch Acute Pancreatitis Study Group. Probiotic prophylaxis in predicted severe acute pancreatitis: a randomised, double-blind, placebo-controlled trial. Lancet. 2008;371:651-659. [PubMed] [DOI] |
| 23. | Expression of concern--Probiotic prophylaxis in predicted severe acute pancreatitis: a randomised, double-blind, placebo-controlled trial. Lancet. 2010;375:875-876. [PubMed] [DOI] |
| 24. | Kadiyala V, Suleiman SL, McNabb-Baltar J, Wu BU, Banks PA, Singh VK. The Atlanta Classification, Revised Atlanta Classification, and Determinant-Based Classification of Acute Pancreatitis: Which Is Best at Stratifying Outcomes? Pancreas. 2016;45:510-515. [PubMed] [DOI] |
| 25. | Choi JH, Kim MH, Cho DH, Oh D, Lee HW, Song TJ, Park DH, Lee SS, Seo DW, Lee SK. Revised Atlanta classification and determinant-based classification: Which one better at stratifying outcomes of patients with acute pancreatitis? Pancreatology. 2017;17:194-200. [PubMed] [DOI] |
| 26. | Singh VP, Sharma J, Babu S, Rizwanulla, Singla A. Role of probiotics in health and disease: a review. J Pak Med Assoc. 2013;63:253-257. [PubMed] |