修回日期: 2019-12-20
接受日期: 2020-01-07
在线出版日期: 2020-01-28
ARHI已经被证实表达缺失与肿瘤的发生与进展相关. 但是, 目前尚不清楚ARHI基因对胃癌(gastric cancer, GC)是否具有增殖抑制作用, 此次实验以GC细胞株MKN28为例, 构建高表达pcDNA3.1-ARHI质粒, 通过细胞转染技术转染MKN28细胞株, 进一步研究ARHI基因对GC细胞增殖、侵袭及凋亡的影响.
以GC细胞MKN28为例, 研究ARHI基因对GC细胞增殖、侵袭及凋亡的影响, 并探讨其机制.
构建pcDNA3.1-ARHI质粒, 通过细胞转染技术转染MKN28细胞株, 取处于对数期的空白对照组、阴性对照Mock组及ARHI高表达克隆株clone4细胞进行实验, 以MTT比色法检测细胞增殖; 细胞划痕检测细胞迁移能力; Transwell法检测细胞侵袭能力; 流式细胞术检测细胞凋亡率; Western blot检测相关蛋白表达.
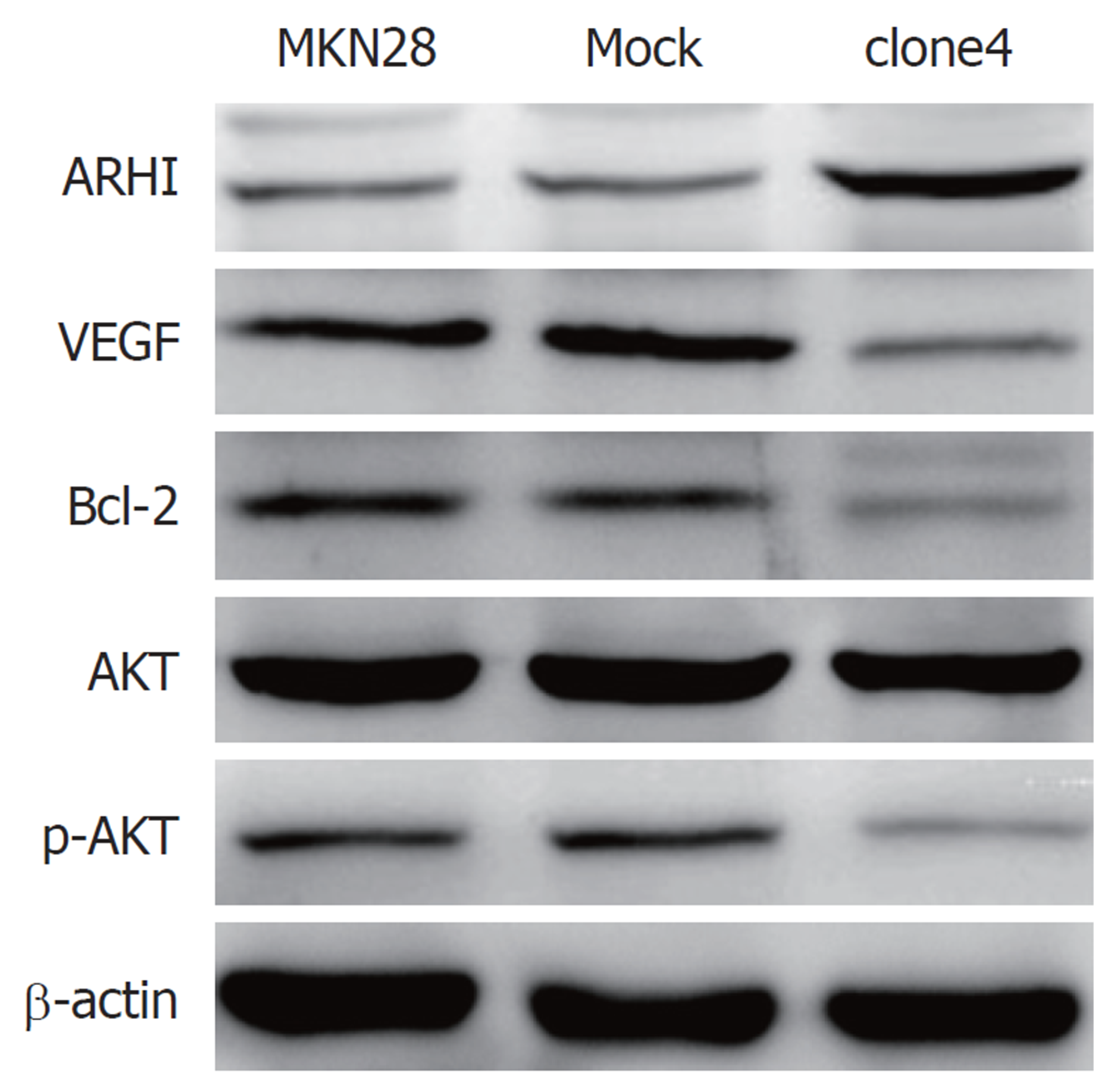
与正常MKN28细胞48 h增殖率1.257%±0.006%相比, Mock组与ARHI高表达克隆株48h细胞增殖率分别为1.163%±0.003%(P>0.05), 0.826%±0.005%(P<0.05); 与正常MKN28细胞48 h迁移率(19.918%±0.233%)相比, Mock组与ARHI高表达克隆株48 h细胞迁移率分别为18.295%±0.534%(P>0.05), 4.299%±1.572%(P<0.05); 与正常MKN28细胞48 h侵袭率(234±3.61)相比, Mock组与ARHI高表达克隆株48 h细胞侵袭率分别为235±4.51(P>0.05), 93.3±2.08(P<0.05); 与正常MKN28细胞48 h总凋亡率(3.513%±0.015%)相比, Mock组与ARHI高表达克隆株48 h细胞总凋亡率分别为3.597%±0.25%(P>0.05), 14.133%±0.032%(P<0.05); Western blot检测各组细胞内蛋白结果显示: 与MKN28细胞相比, Mock组中ARHI蛋白为1.037±0.003(P>0.05), 血管内皮生长因子(vascular endothelial growth factor, VEGF)蛋白为1.026±0.008(P>0.05), B淋巴细胞瘤-2(B-cell lymphoma-2, Bcl-2)蛋白为1.014±0.010(P>0.05), 蛋白激酶B(protein kinase B, AKT)蛋白为1.001±0.005(P>0.05), 磷酸化AKT(p-AKT)蛋白为0.977±0.003(P>0.05); 高表达克隆株clone4中ARHI蛋白为2.088±0.007(P<0.05), VEGF蛋白为0.456±0.004(P<0.05), Bcl-2蛋白为0.468±0.005(P<0.05), AKT蛋白为0.969±0.005(P>0.05), p-AKT蛋白为0.502±0.001(P<0.05).
ARHI基因过表达可抑制GC细胞MKN28的增殖, 促进细胞凋亡, 这可能与ARHI基因高表达后导致磷脂酰肌醇3-激酶/AKT通路中的VEGF、p-AKT蛋白表达降低有关.
核心提要: 本实验创新性的构建pcDNA3.1-ARHI质粒, 通过细胞转染技术转染MKN28细胞株,研究结果提示: ARHI基因过表达可抑制胃癌细胞MKN28的增殖, 促进细胞凋亡, 这可能与ARHI基因高表达后导致磷脂酰肌醇3-激酶/蛋白激酶B通路中的血管内皮生长因子、磷酸化蛋白激酶B蛋白表达降低有关. 这将为临床治疗提供给新的基因靶点.
引文著录: 张晓威. ARHI基因对胃癌细胞株MKN28增殖、侵袭、凋亡的影响及其机制研究. 世界华人消化杂志 2020; 28(2): 50-57
Revised: December 20, 2019
Accepted: January 7, 2020
Published online: January 28, 2020
ARHI has been proved to be associated with tumorigenesis and progression. However, it is not clear whether ARHI gene overexpression can inhibit the proliferation of gastric cancer (GC). In this study, we investigated the effect of ARHI gene overexpression on cell proliferation, invasion, and apoptosis in GC cell line MKN28.
To investigate the effect of ARHI overexpression on the proliferation, invasion, and apoptosis of gastric carcinoma MKN28 cells and to explore the possible mechanisms involved.
The pcDNA 3.1-ARHI plasmid was constructed and used to transfect MKN28 cells. Meanwhile, a blank control group and a negative control mock group were set. Cell proliferation was detected by MTT assay. Cell scratch wound assay was used to detect the ability of cell migration. Transwell method was used to detect cell invasion ability. Flow cytometry was used to detect cell apoptosis. Western blot was used for detection of related protein expression.
Compared with blank control MKN28 cells (1.257% ± 0.006%), the proliferation rates at 48 h after transfection in the mock group was comparable (1.257% ± 0.006% vs 1.163% ± 0.003%, P > 0.05), while that of the ARHI overexpression group was significantly decreased (1.257% ± 0.006% vs 0.826% ± 0.005%, P < 0.05); the migration ability in the mock group was not significantly changed (19.918% ± 0.233% vs 18.295% ± 0.534%, P > 0.05), while that of the ARHI overexpression group was significantly decreased (19.918% ± 0.233% vs 4.299% ± 1.572 %, P < 0.05); the invasion ability in the mock group was not significantly changed (234 ± 3.61 vs 235 ± 4.51, P > 0.05), while that of the ARHI overexpression group was significantly decreased (234 ± 3.61 vs 93.3 ± 2.08, P < 0.05); the total apoptosis rate in the mock group was not significantly changed (3.513% ± 0.015% vs 3.597% ± 0.25%, P > 0.05), while that of the ARHI overexpression group was significantly increased (3.513% ± 0.015% vs 14.133% ± 0.032%, P < 0.05). Western blot results showed that, compared with blank control MKN28 cells, the relative expression of ARHI protein (1.037 ± 0.003), vascular endothelial growth factor (VEGF) (1.026 ± 0.008), B-cell lymphoma-2 (Bcl-2) (1.014 ± 0.010), protein kinase B (AKT) (1.001 ± 0.005), and p-AKT protein (0.977 ± 0.003) was not significantly changed (P > 0.05), while the expression of ARHI protein (2.088 ± 0.007) was significantly up-regulated (P < 0.05), that of VEGF protein (0.456 ± 0.004), Bcl-2 protein (0.468 ± 0.005), and p-AKT protein (0.502 ± 0.001) was significantly down-regulated (P < 0.05), and that of AKT protein was not significantly changed (P > 0.05).
Excessive expression of ARHI gene can inhibit the proliferation of MKN28 cells and promote their apoptosis, which may be related to the reduction of VEGF and p-AKT protein expression.
- Citation: Zhang XW. ARHI overexpression inhibits proliferation and invasion and promotes apoptosis of gastric carcinoma MKN28 cells. Shijie Huaren Xiaohua Zazhi 2020; 28(2): 50-57
- URL: https://www.wjgnet.com/1009-3079/full/v28/i2/50.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v28.i2.50
根据最新2018年全球癌症统计报告, 胃癌(gastric cancer, GC)的死亡率在中国位居第二, 仅次于肺癌, 达39万, 占比13.6%[1]. 较大多数GC患者确诊时已是晚期, 5年生存率不足30%[2,3]. 目前研究已证实, 肿瘤的发生发展与表观遗传学总基因的甲基化修饰密切相关[4-6]. ARHI为Ras超家族中的一员, 现已经被证实可以抑制多种肿瘤生长, 其表达缺失与肿瘤的发生与进展密切相关[7-9]. 但是, 针对ARHI基因对GC是否具有增殖抑制作用, 尚无报道, 此次实验以GC细胞株MKN28为例, 研究ARHI基因对GC细胞增殖、侵袭及凋亡的影响, 并探讨其机制, 为临床研究提供基础.
MKN28细胞由锦州医科大学附属第一医院脑与脊髓实验室馈赠, RPMI-1640培养基、胎牛血清、二甲亚砜、结晶紫、及碘化丙啶购买于美国Sigma公司, 检测细胞凋亡所用试剂盒购买于南京凯基生物科技有限公司. ARHI、B淋巴细胞瘤-2(B-cell lymphoma-2, Bcl-2)、血管内皮生长因子(vascular endothelial growth factor, VEGF)、蛋白激酶B(protein kinase B, AKT)、磷酸化AKT(p-AKT)、β-actin抗体、兔Ⅱ抗、鼠Ⅱ抗购买于Santa Cruz公司.
1.2.1 细胞培养: MKN28细胞在含10%浓度胎牛血清的RPMI 1640培养基内, 5% CO2、37 ℃温度的孵箱内培养, 每36-60 h传代. 取处于对数生长期的MKN28细胞进行相关实验.
1.2.2 质粒转染: 以pcDNA3.1为载体, 由上海舜百生物科技有限公司构建pcDNA3.1-ARHI质粒并检测; 稳定转染法转染细胞, 步骤如下: 取处于对数生长期的MKN28细胞, 以3×105个/mL浓度接种至6 cm培养皿内, 5% CO2、37 ℃的孵箱内培养24 h后, 更换新培养基, 将配置好的转染体系(9 μL转染试剂+200 μL培养基+2.4 μg质粒)加入6 cm培养皿内, 混匀后于5% CO2、37 ℃的孵箱内培养12 h后更换培养基, 24 h后加入G418(终浓度为500 μg/mL), 每日观察细胞增殖情况, 每2-3 d更换培养基, 同时加入G418(终浓度为500 μg/mL), 直至细胞为单个群落, 挑取单克隆细胞株至24孔板内孵育. 逆转录-聚合酶链反应(reverse transcription-polymerase chain reaction, RT-PCR)与Western blot实验挑取稳定高表达克隆株, 实验重复3次. 空载体Mock组做阴性对照组.
1.2.3 RT-PCR检测各克隆细胞株ARHI基因mRNA表达水平: 收集处于对数生长的各组细胞, 加入Trizol液(每1×107个细胞加入1 mL), 取样器反复吹打至混匀; 每1 mL Trizol加入0.2 mL氯仿后震荡15 s后室温放置5 min. 12000 g(4 ℃)下离心5 min, 取上层水相至新EP管内; 加入等体积的异丙醇, 混匀, -20 ℃放置30 min; 2000 r/min 4 ℃离心10 min, 弃去上清, 加入预冷的75%乙醇(DEPC水配制); 7500 r/min 4 ℃离心5 min, 弃去上清, 室温内放置晾干后加入DEPC水20 μL; 检测mRNA浓度, 以最低浓度样品为标准, 配制各实验组上机样品并进行检测, 实验重复3次.
1.2.4 Western Blot检测蛋白表达: 收集对数期的MKN28细胞及各实验组细胞, 加入适量蛋白裂解缓冲液, 震荡, 于冰上裂解10 min, 然后13000 g 4 ℃温度离心10 min. 取上清, 弃去沉淀. 以标准BCA试剂确定蛋白浓度定量. 通过聚丙烯酰胺凝胶电泳将不同大小蛋白分离, 然后转印蛋白至PVDF膜, 通过浓度为5%的脱脂牛奶封闭膜内非特异性抗体. 通过加入相应一抗后与PVDF膜上的目的蛋白相反应, 4 ℃环境孵育12 h. 洗涤PVDF膜后与相应二抗在室温环境下孵育1 h, 洗涤PVDF膜3次. 在PVDF膜上滴加化学发光试剂, 后通过X射线片曝光、显像, 记录. 内参对照选β-actin, 观察ARHI、VEGF、Bcl-2、AKT、p-AKT、β-actin蛋白的表达情况. 实验重复3次.
1.2.5 MTT比色法检测细胞增殖: 取生长处于对数期的MKN28细胞及各实验组细胞株接种于96孔板, 每空接种细胞约8×103个, 每组设5个重复孔, 5% CO2、37 ℃温度的孵育箱内培养24 h、48 h及72 h后, 在96孔板内每孔加入20 μL MTT, 继续孵育4 h, 弃去上清, 每孔加入150 μL二甲亚砜, 震荡混匀, 通过酶标仪测定96孔板中每孔在490 nm波长处的吸光度值, 取平均值, 绘制生长曲线, 计算各组细胞增殖率. 实验重复3次.
1.2.6 细胞划痕实验检测各组细胞株迁移能力: 将MKN28细胞、Mock组及clone4细胞株接种于6孔板5×105个/孔, 培养至单层铺满, PBS液冲洗1次, 10 μL枪头尖端分别在6孔板细胞上垂直划痕, 后用PBS液再清洗2次, 加入含1%胎牛血清的1640培育基中, 余为对照组, 均设2个复孔. 分别于0 h、48 h倒置相差显微镜(×400)下观测划痕细胞迁徙状况并照相, 测定划痕间距, 计算迁移率并进行统计学分析. 实验重复3次.
1.2.7 Transwell实验检测各组细胞株侵袭能力: 分别将处于对数生长期的MKN28细胞、Mock组及clone4细胞株, 制成细胞密度为1×105个/mL的细胞悬液, 取200 μL滴入Transwell上小室6孔板, 下室加500 μL含10%FBS的1640培育基, 均设2个复孔. 于7 ℃培育48 h 后, 棉签去掉小室内表面残存细胞, 4%多聚甲醛固定后通过0.1%结晶紫染色, PBS液清洗, 生物显微镜进行拍照并计数. 实验重复3次.
1.2.8 流式细胞术检测细胞凋亡: 培养MKN28细胞、Mock组及clone4细胞株至对数生长期, 更换培养基为无胎牛血清的RPMI 1640培养24 h后, 5% CO2、37 ℃温度的孵箱内培养48 h后, 收集不同处理组细胞, 4 ℃PBS洗涤3次, 调整每组样品中细胞浓度约为1.5×109/L ,分别按Annexin V FITC及PI试剂盒操作步骤及周期试剂盒操作步骤进行实验, 检测各组细胞凋亡率, 其中Annexin V FITC+/PI-的细胞百分率即为早期凋亡细胞率, Annexin V FITC+/PI+的细胞百分率即晚期细胞凋亡率, 二者之和为总凋亡率. 实验重复3次.
统计学处理 以SPSS 20.0进行统计学分析, 通过t检验分析比较数据, P<0.05为差异有统计学意义.
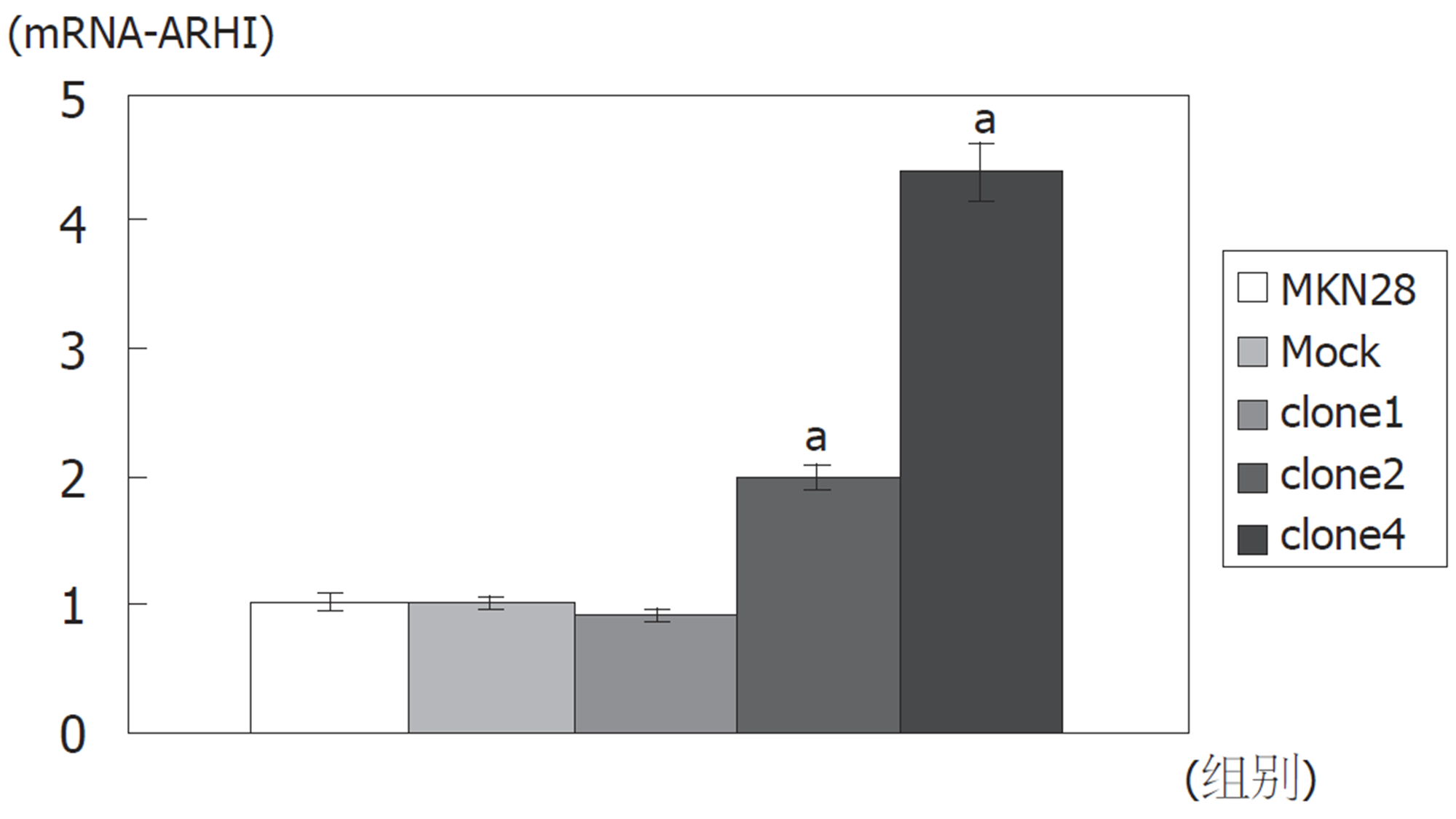
与MKN28细胞株相比, Mock组ARHI基因mRNA表达量1.003±0.073(P>0.05); clone1细胞株ARHI基因mRNA表达量0.899±0.056(P>0.05); clone2细胞株ARHI基因mRNA表达量1.995±0.0127(P<0.05); clone4细胞株ARHI基因mRNA表达量4.383±0.329(P<0.05)(图1、表1).
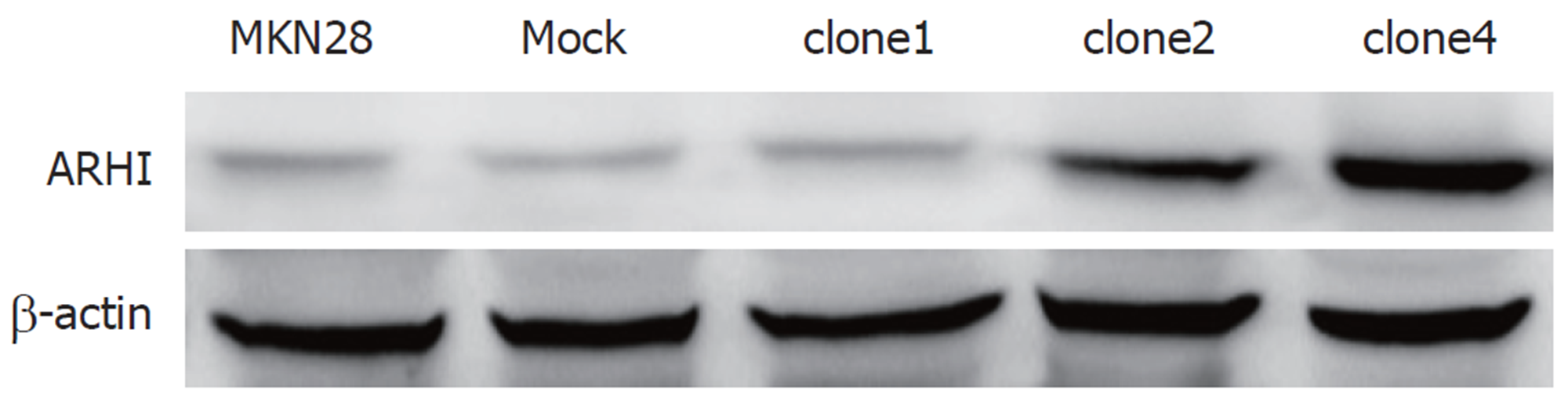
与MKN28细胞株相比, Mock组ARHI蛋白表达量0.252±0.007(P>0.05); clone1细胞株ARHI蛋白表达量0.254±0.004(P>0.05); clone2细胞株ARHI蛋白表达量0.524±0.001(P<0.05); clone4细胞株ARHI蛋白表达量0.997±0.012(P<0.05)(图2、表2). 结合RT-PCR结果, clone4细胞株内ARHI基因转录mRNA水平及ARHI蛋白水平均较高, 故选取clone4高表达株作实验组.
与MKN28细胞株相比, Mock组细胞增殖能力无统计学差异(P>0.05); clone4细胞株48 h增殖能力为0.826±0.005(P<0.05), 72 h增殖能力为1.589±0.006(P<0.05)(图3、表3).
与MKN28细胞株迁移率(19.92%±0.23%)相比, Mock组细胞迁移率(18.30%±0.53%)无统计学差异(P>0.05); clone4细胞株48 h迁移率为4.30%±1.57%(P<0.05)(图4、表4).
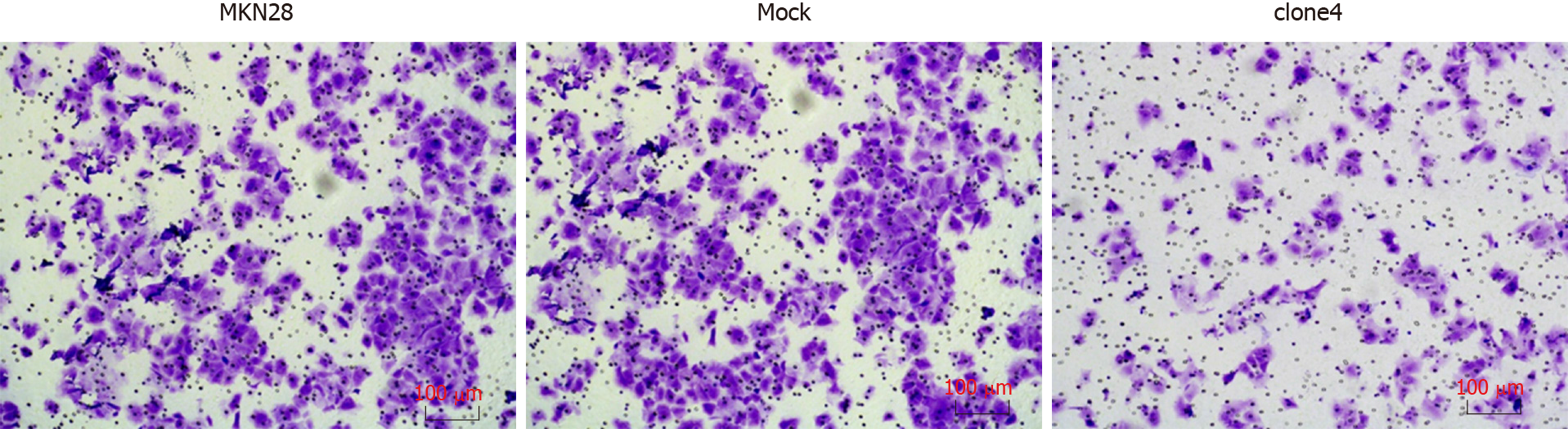
与MKN28细胞株48 h侵袭(234±3.61)相比, Mock组细胞侵袭能力(235±4.51), 无统计学差异(P>0.05); clone4细胞株侵袭能力为93.3±2.08(P<0.05)(图5、表5).
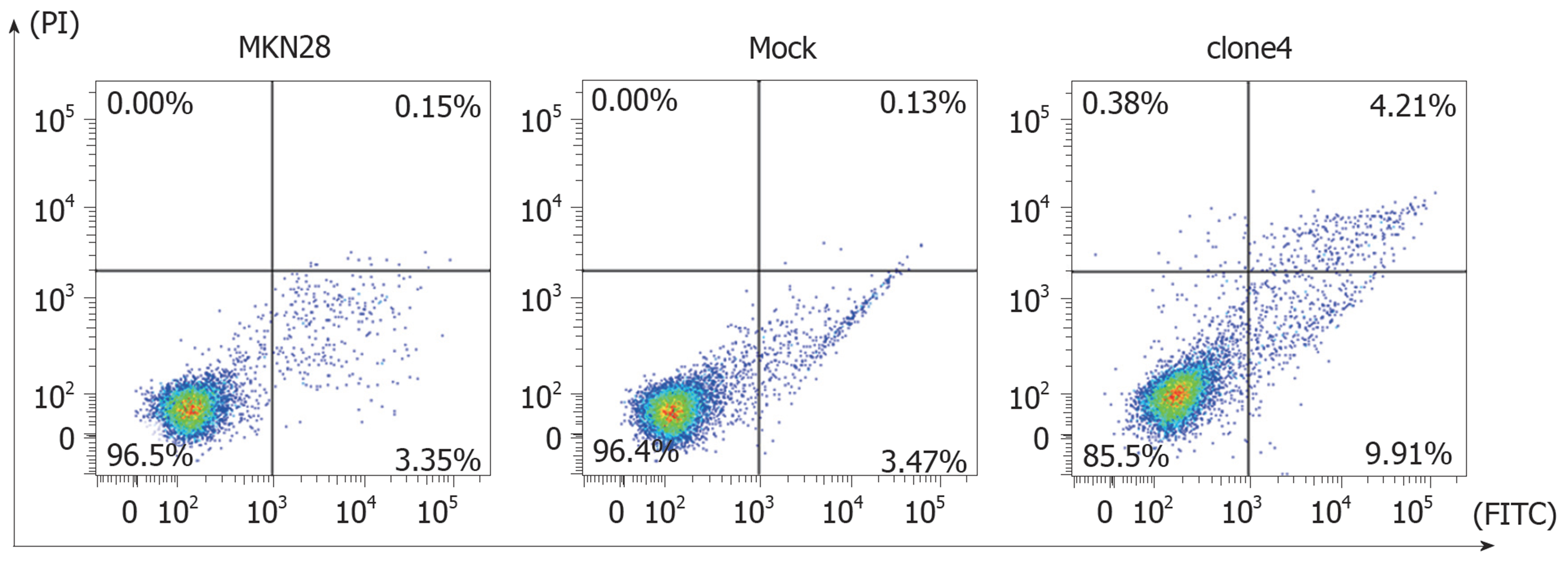
流式细胞术检测各组细胞48 h总凋亡率显示, 与MKN28细胞株总凋亡率(3.51%±0.02%)相比, Mock组细胞总凋亡率为(3.60%±0.03%), 无统计学差异(P>0.05); clone4细胞株总凋亡率为14.13%±0.03%(P<0.05)(图6、表6).
众所周知, 肿瘤的发生发展与癌基因的激活和抑癌基因的失活密切相关[10-12]. ARHI基因, 作为Ras家族中的一员, 长度大约为8 kb, 包含2个外显子及1个内含子. 相关研究证实: 其编码蛋白已经证实在人乳腺、卵巢内表达, 结肠癌、胰腺癌、宫颈癌、肝细胞癌、卵巢癌及喉鳞癌内ARHI蛋白表达降低[13-16].
本实验以GC细胞株MKN28为例, 稳定转染pcDNA3.1-ARHI质粒,通过RT-PCR及Western blot筛选高表达细胞克隆株作为实验组, 空载体MOCK组做阴性对照组, 结果提示ARHI过表达后可抑制GC细胞株MKN28增殖, 降低其侵袭和迁移能力, 并促进其凋亡, 这与多数研究相一致, 为此, 我们进一步检测了相关蛋白, 进一步明确相关机制. 大量研究显示Ras基因相关的信号通路与肿瘤的发生发展关系密切[17], 而Ras启动的下游信号通路, 目前公认的主要有两个, 一个是Ras-Raf-MAPKK-MAPK通路, 另外一个则是磷脂酰肌醇3-激酶(phosphoinositide 3-kinase, PI3K)/AKT通路. 针对PI3K/AKT通路, PI3Ks蛋白家族参与细胞增殖、分化、凋亡和葡萄糖转运等多种细胞功能的调节, 活化的p-AKT可下调上皮型钙黏蛋白及β-连环蛋白和上调间充质细胞中的波形蛋白表达, 促进细胞上皮间充质转化, 进而降低了细胞黏附力, 促进肿瘤细胞的侵袭和转移[18], 这与本实验结果相一致, ARHI高表达克隆株细胞迁移能力降低, 侵袭能力降低, 差异具有统计学意义, 提示ARHI高表达可抑制肿瘤细胞迁移及侵袭能力. 活化的AKT通过磷酸化多种酶、激酶和转录因子等, 在调节细胞凋亡中起着至关重要的作用. 研究证实: PI3K/AKT通路在被激活后, 会导致细胞周期蛋白D1的降解减少, 推动细胞周期进行, 促进肿瘤细胞增殖. 陆英等[19]报道显示ARHI基因表达增高可以抑制细胞周期内G2期向M期进展, 进而抑制细胞分裂; 此外, Li[20]报道称ARHI基因过表达可导致乳腺癌细胞周期内G1期向S期进展抑制细胞分裂, 这可能与细胞类型不同有关.
Bcl-2基因是公认的癌基因, 可通过阻止细胞色素c从线粒体释放至细胞质, 从而抑制肿瘤细胞凋亡, 促进增殖. AKT作为Bcl-2的上游蛋白, 当AKT磷酸化水平降低后, 引起Bcl-2蛋白表达降低, 进而导致细胞增殖能力降低, 凋亡率增加, 这与本实验凋亡结果相一致, 提示ARHI蛋白可以通过调节PI3K/AKT通路进而调节细胞凋亡.
总之, 本实验结果表明ARHI基因过表达可抑制GC细胞MKN28的增殖, 促进细胞凋亡, 这可能与ARHI高表达后导致PI3K/AKT通路中的VEGF、p-AKT蛋白表达降低有关, 这也可能为GC的治疗提供新的基因靶点.
胃癌(gastric cancer, GC)作为消化道最常见的肿瘤之一, 在诊断时往往伴有腹腔内广泛转移, 因此进一步明确GC侵袭转移的机制至关重要, ARHI基因已经被证实对多种肿瘤细胞具有抑制作用. 进一步明确ARHI基因高表达对GC细胞的影响, 可为GC的诊断提供新思路.
本研究拟明确: ARHI基因是否抑制GC细胞株增殖能力、迁移能力、侵袭能力; 是否可促进GC细胞株凋亡. 实验结果将为GC患者的治疗提供新的基因靶点.
本研究结果显示ARHI基因可以抑制GC细胞株增殖能力、迁移能力、侵袭能力; 并促进GC细胞株MKN28的凋亡, 进一步明确了ARHI基因的功能, 为动物实验、临床实验提供了基础.
实验首选通过构建pcDNA3.1-ARHI质粒, 后转染至MKN28细胞内, 为进一步明确转然后单克隆细胞内ARHI基因及蛋白表达情况, 后进行了RT-PCR及Western blot实验; 筛选出高表达克隆株clone4后, 通过MTT实验检测细胞增殖能力; 细胞划痕实验检验细胞迁移能力; 流式细胞术检测细胞凋亡能力; Western blot实验检测细胞内蛋白表达情况.
本项实验达到预期实验结果, ARHI基因可以抑制GC细胞株增殖能力、迁移能力、侵袭能力; 并促进GC细胞株MKN28的凋亡. 为接下来动物实验及临床实验提供基础及指导.
ARHI基因过表达可抑制GC细胞MKN28的增殖, 促进细胞凋亡, 这可能与ARHI基因高表达后导致PI3K/AKT通路中的VEGF、p-AKT蛋白表达降低有关. 通过此次实验, 有望将ARHI基因作为新的基因靶点, 为GC患者的治疗提供新方案, 同时有望成为GC是否发生转移的监测指标.
实验未来研究的方向, 主要是: (1)构建动物模型, 进行组织学水平实验; (2)收集临床标本, 通过免疫组化、组织芯片等技术进一步提高说服力.
学科分类: 胃肠病学和肝病学
手稿来源地: 辽宁省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): 0
E级 (差): 0
编辑: 王禹乔 电编:刘继红
| 1. | 王 宁, 刘 硕, 杨 雷, 张 希, 袁 延楠, 李 慧超, 季 加孚. 2018全球癌症统计报告解读. 肿瘤综合治疗电子杂志. 2019;5:87-97. |
| 2. | Limprukkasem T, Chotivitayatarakorn P, Vilaichone RK. Mo1307 Clinical Predictors and Survival Rates of Diffuse and Intestinal Type of Gastric Cancer Patients: A 5-Year Longitudinal Study. Gastrointest Endosc. 2019;89. [DOI] |
| 3. | Li ZY, Zhang QW, Teng LM, Zhang CH, Huang Y. Comparable rates of lymph node metastasis and survival between diffuse type and intestinal type early gastric cancer patients: a large population-based study. Gastrointest Endosc. 2019;90:84-95.e10. [PubMed] [DOI] |
| 4. | Bouras E, Karakioulaki M, Bougioukas KI, Aivaliotis M, Tzimagiorgis G, Chourdakis M. Gene promoter methylation and cancer: An umbrella review. Gene. 2019;710:333-340. [PubMed] [DOI] |
| 6. | Ishihara H, Yamashita S, Fujii S, Tanabe K, Mukai H, Ushijima T. DNA methylation marker to estimate the breast cancer cell fraction in DNA samples. Med Oncol. 2018;35:147. [PubMed] [DOI] |
| 8. | Xiang S, Dauchy RT, Hoffman AE, Pointer D, Frasch T, Blask DE, Hill SM. Epigenetic inhibition of the tumor suppressor ARHI by light at night-induced circadian melatonin disruption mediates STAT3-driven paclitaxel resistance in breast cancer. J Pineal Res. 2019;67:e12586. [PubMed] [DOI] |
| 12. | Hayama T, Hashiguchi Y, Okamoto K, Okada Y, Ono K, Shimada R, Ozawa T, Toyoda T, Tsuchiya T, Iinuma H, Nozawa K, Matsuda K. G12V and G12C mutations in the gene KRAS are associated with a poorer prognosis in primary colorectal cancer. Int J Colorectal Dis. 2019;34:1491-1496. [PubMed] [DOI] |
| 15. | Ye K, Wang S, Wang J, Han H, Ma B, Yang Y. Zebularine enhances apoptosis of human osteosarcoma cells by suppressing methylation of ARHI. Cancer Sci. 2016;107:1851-1857. [PubMed] [DOI] |
| 16. | 陈 欣, 姜 政. 过表达海兔属Ras同源物I(ARHI)增加人SW480结肠癌细胞凋亡. 细胞与分子免疫学杂志. 2016;32:1503-1506. [DOI] |
| 18. | Bisogno LS, Friedersdorf MB, Keene JD. Ras Post-transcriptionally Enhances a Pre-malignantly Primed EMT to Promote Invasion. iScience. 2018;4:97-108. [PubMed] [DOI] |
| 19. | 陆 英, 刘 相富, 刘 玲玲, 李 芳, 覃 雪玲, 林 东军. ARHI基因抑制U937白血病细胞株生长并诱导其G_2/M期阻滞及凋亡. 中国病理生理杂志. 2015;31:1950-1955. [DOI] |
| 20. | Li Y, Shi L, Han C, Wang Y, Yang J, Cao C, Jiao S. Effects of ARHI on cell cycle progression and apoptosis levels of breast cancer cells. Tumour Biol. 2012;33:1403-1410. [PubMed] [DOI] |