修回日期: 2020-08-04
接受日期: 2020-08-14
在线出版日期: 2020-09-08
miR-145-3p在头颈癌、肺癌和胃癌等肿瘤可发挥抑癌的作用, 而其在肝癌中的表达和作用并不清楚.
探讨miR-145-3p在肝癌中的表达及其对肝癌细胞的增殖与凋亡的调控作用.
用RT-qPCR法检测肝癌组织、癌旁组织、肝细胞株(Hep3B、Huh-7、HepG2和SMMC-7721)与正常肝细胞株L-02中miR-145-3p的表达水平; 将miR-145-3p mimic或miR-145-3p inhibitor转入Hep3B细胞, 用CCK-8法、流式细胞术、TUNEL法和Western blot法分别检测细胞活力、细胞周期、细胞凋亡和4型黏蛋白(mucin4, MUC4)表达. 用荧光素酶报告基因实验鉴定miR-145-3p的靶基因. 将pcDNA-MUC4转入已转染miR-145-3p mimic的细胞, 用CCK-8法和TUNEL法分别检测细胞活力与细胞凋亡.
miR-145-3p在肝癌组织和细胞中呈低表达. 过表达miR-145-3p能抑制细胞增值和G0/G1期到S期转换, 促进凋亡和降低MUC4表达; 而敲减miR-145-3p则作用相反. MUC4是miR-145-3p的靶基因. 过表达MUC4能逆转miR-145-3p mimic对细胞存活的抑制作用.
miR-145-3p在肝癌低表达, 且其表达与T分期呈负相关. 过表达miR-145-3p可抑制肝癌细胞存活与生长, 而敲减miR-145-3p能促进肝癌细胞存活与生长.
核心提要: miR-145-3p在肝癌中低表达, 过表达miR-145-3p可通过靶向4型黏蛋白来抑制肝癌细胞增殖并诱导凋亡, 提示上调miR-145-3p表达可能是肝癌的潜在的治疗策略.
引文著录: 叶小荣, 潘德标, 王理富. miR-145-3p在肝癌中的表达及其对肝癌细胞生长的调控作用. 世界华人消化杂志 2020; 28(17): 827-833
Revised: August 4, 2020
Accepted: August 14, 2020
Published online: September 8, 2020
miR-145-3p can play a tumor suppressive role in head and neck cancer, lung cancer, gastric cancer, and other tumors, while its expression and role in liver cancer are not clear.
To investigate the expression of miR-145-3p in hepatocellular cancer and its regulatory role in the proliferation and apoptosis of hepatocellular cancer cells.
The expression levels of miR-145-3p in liver cancer tissues, paracancer tissues, liver cell lines (Hep3B, Huh-7, HepG2, and SMMC-7721), and the normal liver cell line L-02 were detected by RT-qPCR. After transfection of Hep3B cells with miR-145-3p mimic and miR-145-3p inhibitor, the cell viability, cell cycle, apoptosis, and the expression of mucin4 (MUC4) were detected by CCK-8 assay, flow cytometry, TUNEL assay, and Western blot, respectively. The target gene of miR-145-3p was identified by luciferase reporter assay. pcDNA-MUC4 was transfected into miR-145-3p mimic-transfected cells, and cell viability and apoptosis were detected by CCK-8 and TUNEL assays, respectively.
miR-145-3p was lowly expressed in hepatocellular cancer tissues and cells. Overexpression of miR-145-3p inhibited cell proliferation and transition from G0/G1 phase to S phase, promoted apoptosis, and decreased MUC4 expression, while knockdown of miR-145-3p had the opposite effect. MUC4 was identified to be a target gene of miR-145-3p. Overexpression of MUC4 reversed the inhibitory effect of miR-145-3p mimic on cell survival.
miR-145-3p is lowly expressed in hepatocellular cancer, and its expression is negatively correlated with T stage. Overexpression of miR-145-3p can inhibit the survival and growth of hepatocellular cancer cells, while knockdown of miR-145-3p can promote the survival and growth of hepatocellular cancer cells.
- Citation: Ye XR, Pan DB, Wang LF. Expression of miR-145-3p in hepatocellular cancer and its regulatory effect on growth of hepatocellular cancer cells. Shijie Huaren Xiaohua Zazhi 2020; 28(17): 827-833
- URL: https://www.wjgnet.com/1009-3079/full/v28/i17/827.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v28.i17.827
肝癌是全球第六大常见的恶性肿瘤, 且其死亡率在所有恶性肿瘤中排名前三[1]. 据流行病学统计[2], 肝癌患者主要分布在亚洲和非洲; 尤其是在我国, 由于丙型肝炎和乙型肝炎患者众多, 造成肝癌发病率一直居高不下. 此外, 脂肪肝也具有进展为原发性肝癌的风险[3]. 证据[4]表明, 肝癌的关键调控基因的改变与肝癌的发生、发展和预后相关. 因此, 迫切需要对肝癌发生发展的关键基因进行研究.
微小RNA (microRNAs, miRNAs)是指一类大约22个核苷酸的内源性非编码小RNA, 它们可与靶基因以碱基互补配对模式一一结合, 并在转录后水平参与调节细胞增殖、分化、凋亡等多种生物学功能[5]. 研究[5]表明, 许多miRNAs在肿瘤的发生和进展中发挥着促癌或抑癌的作用. 其中, miR-145-3p在头颈癌、肺癌和胃癌等肿瘤中表达下调, 且其可发挥抑癌的作用[6-8]. 而miR-145-3p在肝癌中的表达和作用并不清楚, 因此, 本研究旨在调查miR-145-3p在肝癌进展中的作用, 以及其对肝癌细胞生长的调控作用.
1.1.1 一般材料: 胎牛血清和MEM培养基购于美国Gbico公司; miScipt II RT试剂盒、miScript SYBR Green PCR试剂盒、miR-145-3p引物和U6引物均购于美国Qiagen公司; Trizol和Lipofectamine 2000试剂购自美国Invitrogen公司; miR-145-3p抑制剂(miR-145-3p inhibitor)、miR-145-3p模拟物(miR-145-3p mimic)、miR阴性对照(miR negative control, miR-NC)、pcDNA3.1-4型黏蛋白(mucin4, MUC4)和pcDNA3.1-空载体(pcDNA3.1-vector)购自广州锐博生物科技有限公司; CCK-8细胞增殖计数试剂盒、TUNEL荧光(绿色)检测试剂盒、双荧光素酶报告基因检测试剂盒和细胞周期检测试剂盒购自上海碧云天生物科技有限公司; MUC4和GAPDH抗体以及二抗购自武汉菲恩生物科技有限公司.
1.1.2 组织样本收集: 本研究收集的临床样本来自于2017-09/2018-09间在我院行肿瘤切除术的25例肝癌患者(男女比例: 男20例、女5例; 年龄: 38-63岁, 平均年龄51.5岁±4.3岁; T分期: T1期5例、T2期7例、T3期8例、T4期5例; 病理分型: 肝细胞型22例、胆管细胞型2例、混合细胞型: 1例), 收集肝癌和癌旁组织样本. 本实验获得了所有受试者的知情同意书以及医院伦理委员会的同意和批准.
1.1.3 细胞培养: 人肝癌细胞株Hep3B和人正常肝细胞株L-02购自于武汉普诺赛生命科技有限公司, 肝癌细胞株Huh7、SMMC-7721和HepG2为本实验室留存. 所有细胞在含有10%胎牛血清的MEM培养基培养.
1.2.1 瞬时转染: 按照说明书步骤, 使用Lipofectamine 2000转染试剂分别将miR-145-3p mimic、miR-145-3p inhibitor或miR-NC分别转入Hep3B细胞中, 转染剂量为20 nmol/L. 转染48 h后, 通过RT-qPCR鉴定转染效率.
1.2.2 CCK-8分析: 取已转染miR-145-3p mimic、miR-145-3p inhibitor或miR-NC的Hep3B细胞, 种植于96孔板(1×104个/孔), 分别培养1-4 d后, 按照CCK-8细胞增殖计数试剂盒说明书步骤, 用酶标仪检测490 nm波长处吸光度值, 并根据标准曲线计算细胞数.
1.2.3 细胞周期分析: 取已转染miR-145-3p mimic、miR-145-3p inhibitor或miR-NC的Hep3B细胞, 用70%乙醇溶液在4℃下固定过夜, 用PBS洗涤细胞2次后, 用RNase A (100 μg/mL)和PI (50 μg/mL)孵育细胞30 min. 用FACS Canto流式细胞仪(BD Biosciences)测定DNA含量, 并通过FACS Diva Software(BD Biosciences)来评估细胞周期谱.
1.2.4 TUNEL分析: 取已转染miR-145-3p mimic、miR-145-3p inhibitor或miR-NC的Hep3B细胞, 继续培养48 h后, 按照TUNEL荧光检测试剂盒说明书步骤, 用携带荧光素的dUTP (绿色)和DAPI (绿色)对其进行避光染色. 通过荧光显微镜观察细胞凋亡情况.
1.2.5 Western blot分析: 取已转染miR-145-3p mimic、miR-145-3p inhibitor或miR-NC的Hep3B细胞, 继续培养48 h后, 用RIPA提取蛋白, 并通过常规Western blot法检测细胞MUC4蛋白的表达, 其中MUC4的稀释浓度为1:1000, 并以GAPDH为内参, 通过Image J软件量化MUC4的相对表达量.
1.2.6 RT-qPCR分析: 按照说明书步骤, 用Trizol试剂从组织或细胞系中提取的RNA, 并通过miScipt II RT 试剂盒对提取的RNA逆转录为cDNA, 然后以cDNA为模板混合miR-145-3p引物和U6引物, 使用miScript SYBR Green PCR试剂盒通过实时定量PCR仪进行RT-qPCR反应, 反应程序设置为95℃预变性5 min, 然后进行40个循环(95℃ 5 s, 60℃ 30 s). 引物序列: miR-145-3p (正向引物: 5'-GCGTCCAGTTTTCCCAGGA-3', 反向引物: 5'-TGGTGTCGTGGAGTCG-3'); U6(正向引物: 5'-CTCGCTTCGGCAGCACATATACT-3', 反向引物: 5'-ACGCTTCACGAATTTGCGTGTC-3'); MUC4 (正向引物: 5'-GCCCAAGCTACAGTGTGACTCA-3, 反向引物: 5'-ATGGTGCCGTTGTAATTTGTTGT-3'); GAPDH (正向引物: 5'-GGTGGTCTCCTCTGACTTCAACA-3', 反向引物: 5'-GTTGCTGTAGCCAAATTCGTTGT-3'). 并以U6作为miR-145-3p的内参, 以GAPDH作为MUC4的内参, 用2-△△CT法计算目的基因的表达水平.
1.2.7 双荧光素酶报告基因分析: 将含有miR-145-3p假定结合位点的MUC4野生型或突变型的3'非翻译区(UTR)克隆到psiCHECK-2载体上. 将构建的质粒转入已转染miR-145-3p mimic、miR-145-3p inhibitor或miR-NC的Hep3B细胞中. 48 h后, 根据双荧光素酶报告基因检测试剂盒说明书使用Dual-Luciferase Reporter系统评估细胞裂解物中的荧光素酶活性.
1.2.8 共转染分析: 取已转染miR-145-3p mimic的Hep3B细胞, 用Lipofectamine 2000转染试剂分别将20 nmol/L剂量的pcDNA-vector或pcDNA-MUC4分别转入细胞中. 转染48 h后用Western blot鉴定转染效率. 取共转成功的细胞, 继续培养48 h后, 用CCK-8法检测细胞活力, 用TUNEL染色法检测细胞凋亡.
统计学处理 实验数据采用mean±SD表示, 利用SPSS 17.0统计软件进行分析. 俩组数据比较采用t检验, 多组数据两两比较, 采用方差分析后Bonfferoni检验. P<0.05被认为具有统计学意义.
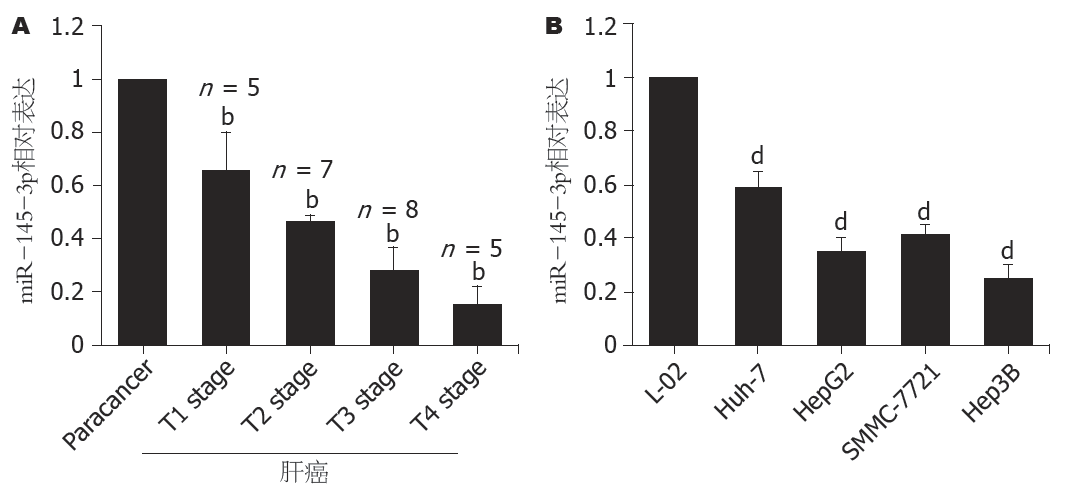
图1A显示, 与癌旁组织比较, 肝癌组织中miR-145-3p表达水平明显降低(P<0.01), 且随着T分期呈现递减现象. 与正常肝细胞系L-02比较, 肝癌细胞系中miR-145-3p也呈低表达水平(P<0.01, 图1B). 这些结果表明miR-145-3p的表达水平与肝癌之间存在密切的关系.
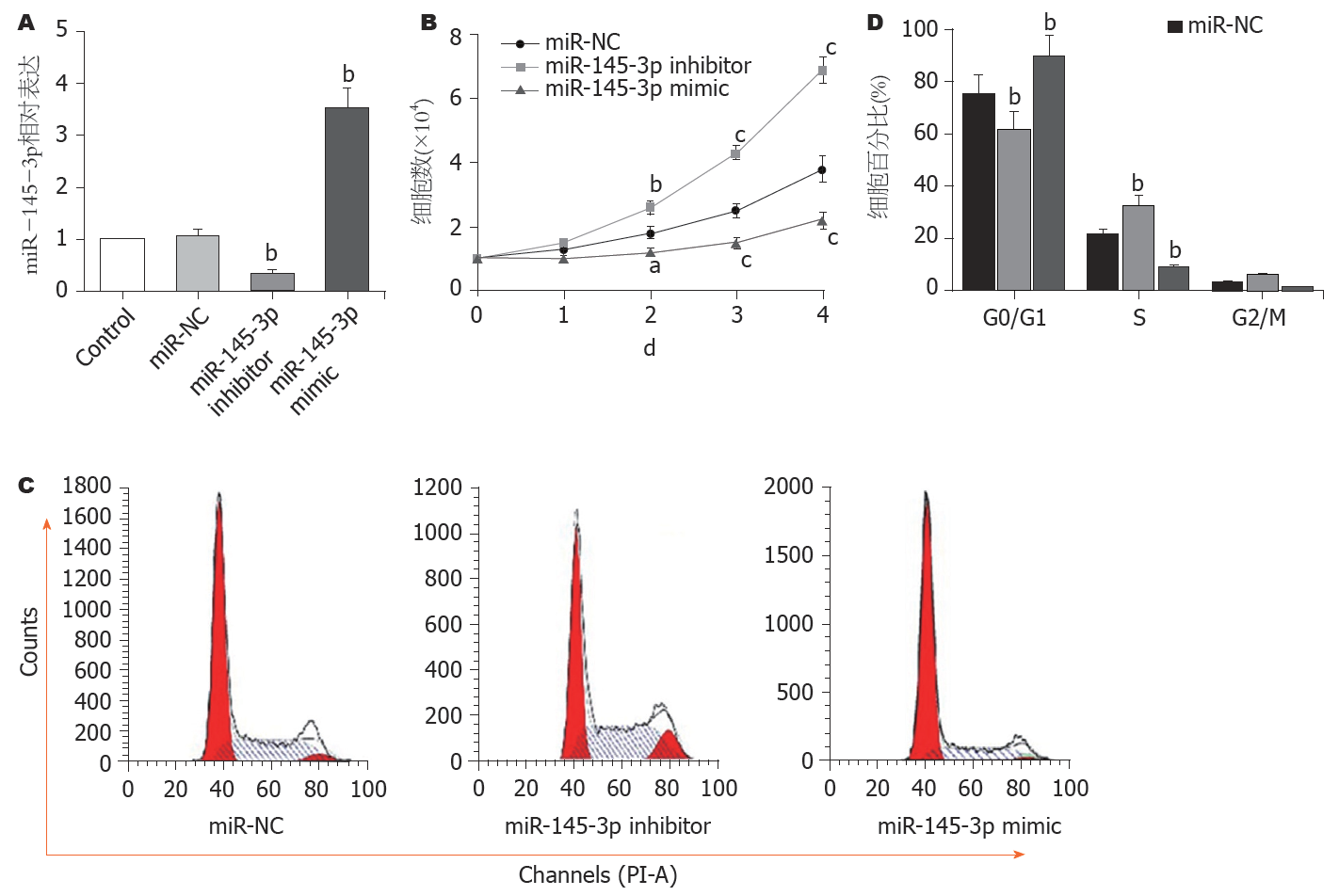
图2A显示, 与miR-NC组比较, miR-145-3p inhibitor组中miR-145-3p表达水平明显降低(P<0.01), miR-145-3p mimic组中miR-145-3p表达水平明显增加(P<0.01), 说明成功构建了转染细胞. CCK-8细胞计数结果(图2B)显示, 与转染miR-NC的细胞比较, 敲减miR-145-3p的Hep3B细胞生长明显加快(P<0.01), 过表达miR-145-3p的Hep3B细胞生长明显减缓(P<0.05或P<0.01); 细胞周期检测(图2C和D)结果显示, 与转染miR-NC的细胞比较, 敲减miR-145-3p的Hep3B细胞中S期比例明显增多(P<0.01)和G0/G1期比例明显减少(P<0.01), 过表达miR-145-3p的Hep3B细胞中S期比例明显减少(P<0.01)和G0/G1期比例明显增多(P<0.01).
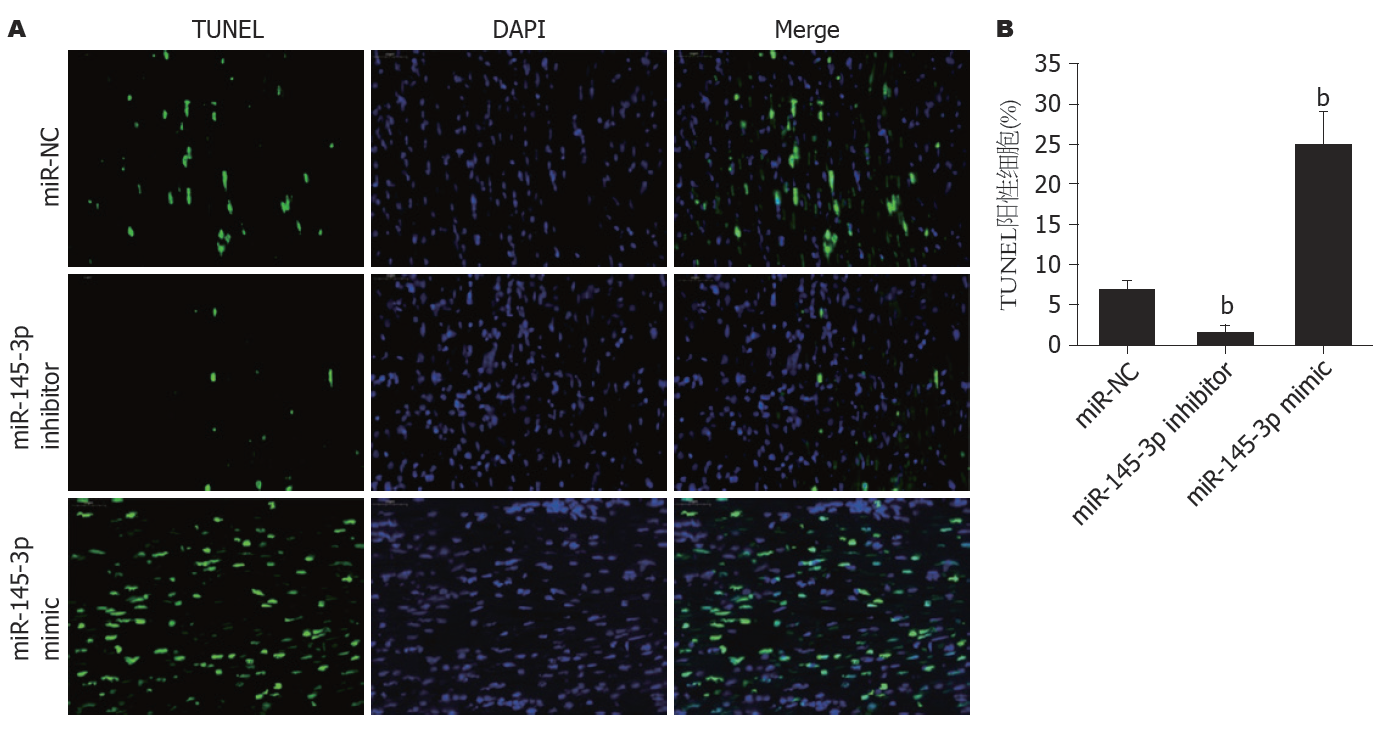
TUNEL法结果(图3)显示, 与转染miR-NC的细胞比较, 敲减miR-145-3p的Hep3B细胞中TUNEL阳性细胞比例明显减少(P<0.01), 过表达miR-145-3p的Hep3B细胞中TUNEL阳性细胞比例明显增多(P<0.01).
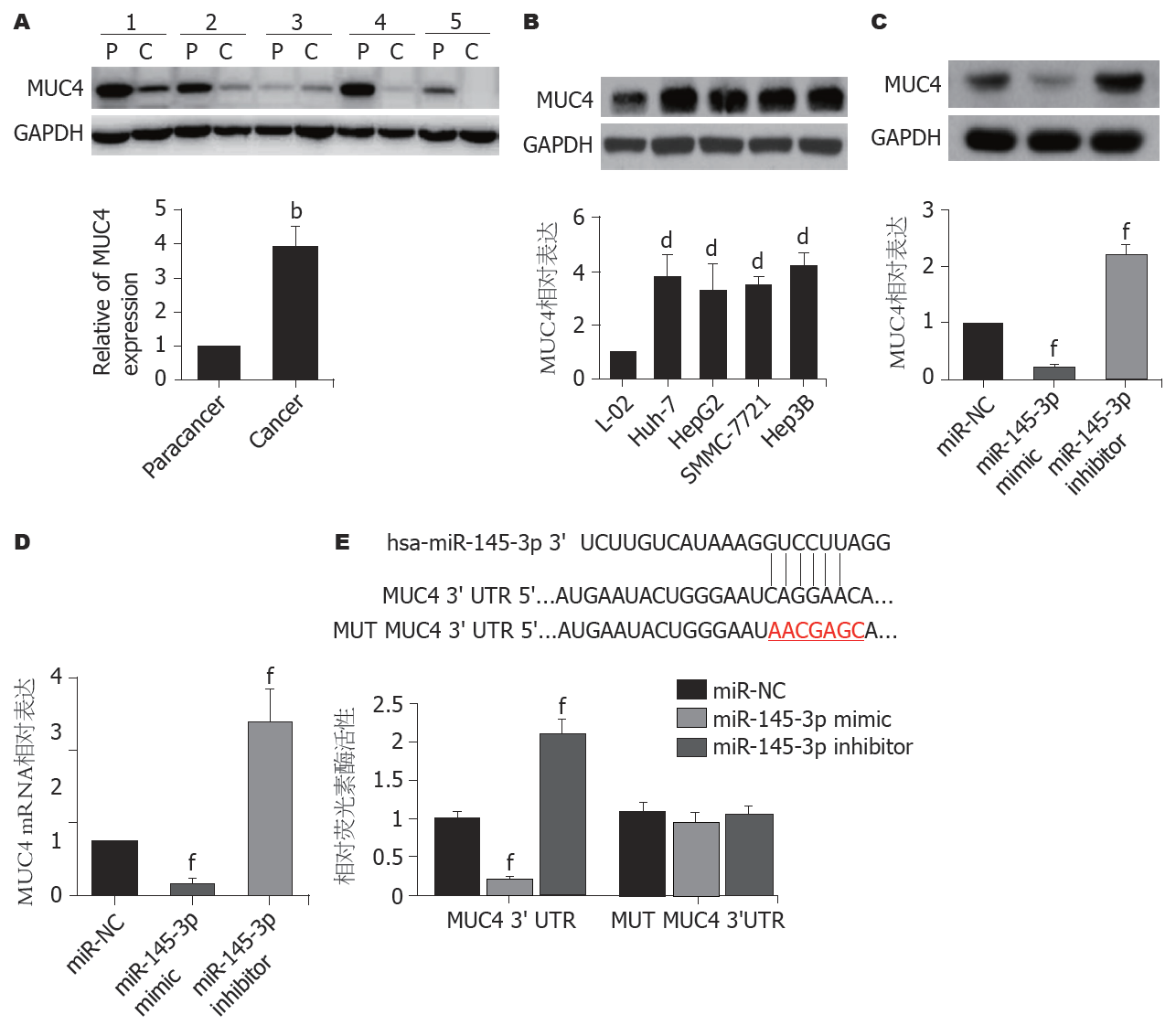
MUC4是miR-145-3p的预测靶基因之一. Western blot结果(图4A和B)显示, 在肝癌组织(图4A)和肝癌细胞系(图4B)中MUC4表达明显增加(P<0.01). 进一步检测的结果(图4C和D)显示, 与转染miR-NC的细胞比较, 过表达miR-145-3p的Hep3B细胞中MUC4蛋白和mRNA表达显著下调(P<0.01), 敲减miR-145-3p的Hep3B细胞中MUC4蛋白和mRNA表达上调(P<0.01). 双荧光素酶报告基因分析结果(图4E)显示, 在转染MUC4的野生型Hep3B细胞中, 与miR-NC组比较, miR-145-3p mimic组荧光素酶活性显著降低(P<0.01), 而miR-145-3p inhibitor组荧光素酶活性明显增加(P<0.01).
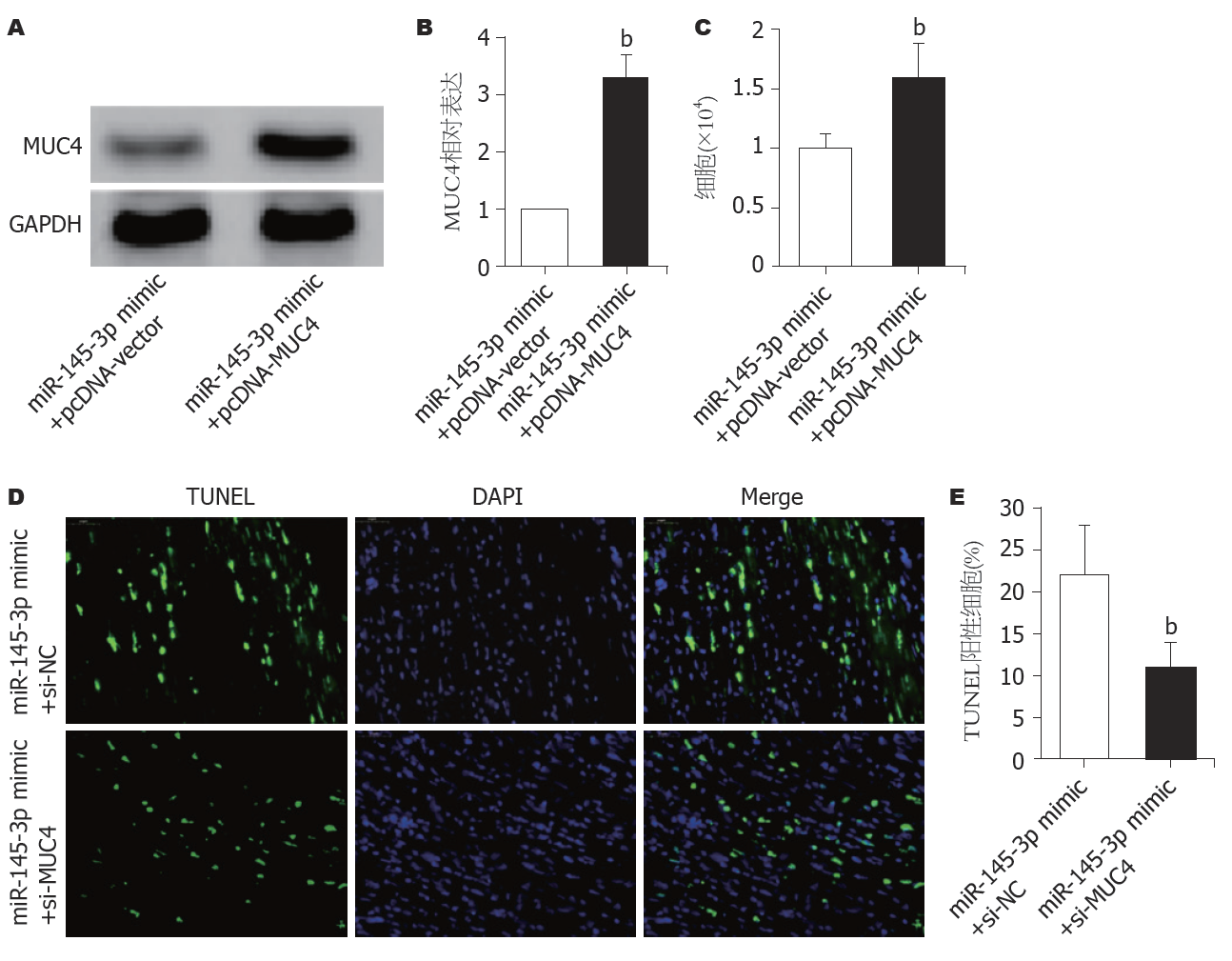
图5A和B显示, miR-145-3p mimic+pCDNA-MUC4转染细胞构建成功. CCK-8细胞计数结果(图5C)显示, 与转染miR-145-3p mimic+pCDNA-vector的细胞比较, miR-145-3p mimic+pCDNA-MUC4的Hep3B细胞数明显增加(P<0.01). TUNEL染色结果(图5D和E)显示, 与转染miR-145-3p mimic+pCDNA-vector的细胞比较, miR-145-3p mimic+pCDNA-MUC4的Hep3B细胞的TUNEL阳性细胞数明显减少(P<0.01). 以上结果表明: 过表达MUC4能逆转过表达miR-145-3p对细胞存活的抑制作用.
近年来, 肝癌的发病率呈高速增长趋势[1,2], 而肝癌的治疗效果并不太理想. 因此, 需要进一步研究肝癌治疗的新策略, 而研究肝癌发生与进展机制可为肝癌的治疗策略提供参考依据.
miRNAs在包含肿瘤在内的众多疾病类型中发挥着重大作用. 在肝癌中, 也已发现许多miRNAs参与调控肝癌发生与进展[9], 但miRNAs成员众多, 依然有许多miRNAs未得到充分鉴定. miR-145-3p作为miRNAs成员之一, 已被证明其在头颈癌、肺癌和胃癌中发挥抑癌作用[6-8]. 本研究结果也显示, miR-145-3p在肝癌组织和细胞中低表达, 且与T分期呈负相关关系, 提示, miR-145-3p可能参与肝癌的进展. 为证明这一观点, 本研究进一步将miR-145-3p mimic或miR-145-3p inhibitor转入Hep3B细胞, 发现过表达miR-145-3p能抑制细胞增殖、周期转换和促进凋亡; 而敲减miR-145-3p呈相反作用, 这些结果说明了, miR-145-3p在肝癌中发挥抑癌作用.
miRNA通过与靶基因的3'UTR区以碱基互补配对方式结合, 来达到调节靶基因表达, 最终发挥后续生物学作用[5]. 因此本研究通过靶基因预测软件targetScan 7.2筛选miR-145-3p潜在的靶基因, 结果发现miR-145-3p与MUC4的3'UTR (142-148位点)存在潜在的结合序列; 且本研究进一步通过点突变与荧光素酶法证明了MUC4是miR-145-3p的靶基因. 已有研究表明, MUC4在多种肿瘤细胞中高表达, 且其高表达能促进肿瘤细胞增殖与迁移[10,11]. 因此, 本研究进一步检测miR-145-3p对MUC4表达的影响, 结果显示miR-145-3p能负调控靶基因MUC4的表达. 另外, 本研究通过外源性引入MUC4过表达载体, 发现过表达MUC4可解除过表达miR-145-3p对细胞存活的抑制作用. 以上结果表明, miR-145-3p在肝癌中发挥抑癌作用可能与下调MUC4的表达相关.
综上, 本研究表明miR-145-3p在肝癌中表达降低, 且过表达miR-145-3p可通过靶向MUC4来抑制肝癌细胞增殖并诱导凋亡. 另外本研究还表明miR-145-3p可能是肝癌的潜在治疗靶点.
miRNAs在肝癌的发生与进展中发挥着重要作用. 目前有许多参与肝癌发生与进展的miRNAs的功能并未得到鉴定. 因此, 继续筛选并鉴定参与肝癌发生与进展的miRNAs可能会为肝癌的诊断与治疗提供靶点.
miR-145-3p在头颈癌、肺癌和胃癌中发挥抑癌作用, 但其在肝癌中的表达模式和作用并不清楚.
探讨miR-145-3p对肝癌细胞的增殖与凋亡的影响, 并分析其机制.
检测miR-145-3p在不同T分期的肝癌组织和不同的肝癌细胞中的表达情况; 进一步研究过表达或敲减miR-145-3p表达对肝癌细胞的增殖与凋亡的影响, 并分析其潜在的靶基因.
miR-145-3p在肝癌组织和肝癌细胞中低表达. 上调miR-145-3p能通过靶向4型黏蛋白来抑制肝癌细胞的增值并促进凋亡.
上调miR-145-3p能抑制肝癌细胞增殖并促进其凋亡.
上调miR-145-3p可能是肝癌的潜在的治疗策略.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B, B, B
C级 (良好): C, C
D级 (一般): D, D
E级 (差): E, E
科学编辑: 张晗 制作编辑:刘继红
| 1. | Roskilly A, Rowe IA. Surveillance for hepatocellular cancer. Clin Med (Lond). 2018;18:s66-s69. [PubMed] [DOI] |
| 2. | Sayiner M, Golabi P, Younossi ZM. Disease Burden of Hepatocellular Carcinoma: A Global Perspective. Dig Dis Sci. 2019;64:910-917. [PubMed] [DOI] |
| 3. | Marengo A, Rosso C, Bugianesi E. Liver Cancer: Connections with Obesity, Fatty Liver, and Cirrhosis. Annu Rev Med. 2016;67:103-117. [PubMed] [DOI] |
| 4. | Rao CV, Asch AS, Yamada HY. Frequently mutated genes/pathways and genomic instability as prevention targets in liver cancer. Carcinogenesis. 2017;38:2-11. [PubMed] [DOI] |
| 5. | Li X, Yu X, He Y, Meng Y, Liang J, Huang L, Du H, Wang X, Liu W. Integrated Analysis of MicroRNA (miRNA) and mRNA Profiles Reveals Reduced Correlation between MicroRNA and Target Gene in Cancer. Biomed Res Int. 2018;2018:1972606. [PubMed] [DOI] |
| 6. | Yamada Y, Koshizuka K, Hanazawa T, Kikkawa N, Okato A, Idichi T, Arai T, Sugawara S, Katada K, Okamoto Y, Seki N. Passenger strand of miR-145-3p acts as a tumor-suppressor by targeting MYO1B in head and neck squamous cell carcinoma. Int J Oncol. 2018;52:166-178. [PubMed] [DOI] |
| 7. | Misono S, Seki N, Mizuno K, Yamada Y, Uchida A, Arai T, Kumamoto T, Sanada H, Suetsugu T, Inoue H. Dual strands of the miR-145 duplex (miR-145-5p and miR-145-3p) regulate oncogenes in lung adenocarcinoma pathogenesis. J Hum Genet. 2018;63:1015-1028. [PubMed] [DOI] |
| 8. | Zhang C, Zhang CD, Ma MH, Dai DQ. Three-microRNA signature identified by bioinformatics analysis predicts prognosis of gastric cancer patients. World J Gastroenterol. 2018;24:1206-1215. [PubMed] [DOI] |
| 9. | Nagy Á, Lánczky A, Menyhárt O, Győrffy B. Validation of miRNA prognostic power in hepatocellular carcinoma using expression data of independent datasets. Sci Rep. 2018;8:9227. [PubMed] [DOI] |
| 10. | Senapati S, Gnanapragassam VS, Moniaux N, Momi N, Batra SK. Role of MUC4-NIDO domain in the MUC4-mediated metastasis of pancreatic cancer cells. Oncogene. 2012;31:3346-3356. [PubMed] [DOI] |
| 11. | Singh AP, Moniaux N, Chauhan SC, Meza JL, Batra SK. Inhibition of MUC4 expression suppresses pancreatic tumor cell growth and metastasis. Cancer Res. 2004;64:622-630. [PubMed] [DOI] |