修回日期: 2020-05-24
接受日期: 2020-07-15
在线出版日期: 2020-09-08
研究证实胰腺星状细胞激活是胰腺疾病胰腺纤维化(pancreatic fibrosis, PF)起始与发展的中心环节, 但是PF的具体机制尚不清楚, 针对PF也无特异性治疗措施. 部分基础研究证实中药成分氧化苦参碱(oxymatrine, OMT)对PF有一定的治疗作用, 但需要进一步深入研究. 可以预见OMT对防治PF具有深远的研究前景和良好的临床应用价值, 也有利于更好地开发和利用传统中草药苦参.
核心提要: 本述评预见氧化苦参碱在防治胰腺疾病胰腺纤维化方面具有深远的研究前景和良好的临床应用价值, 有利于更好地开发和利用传统中草药苦参.
引文著录: 夏时海. 氧化苦参碱在防治胰腺纤维化的研究前景及临床应用价值. 世界华人消化杂志 2020; 28(17): 819-826
Revised: May 24, 2020
Accepted: July 15, 2020
Published online: September 8, 2020
Studies have confirmed that pancreatic stellate cell activation is the central event in the initiation and development of pancreatic fibrosis (PF), but the specific mechanism of PF is still unknown, and there is no specific treatment for PF. Some basic studies have confirmed that oxymatrine (OMT) has a certain therapeutic effect on PF, but further research is needed. It can be predicted that OMT has a far-reaching research prospect and good clinical application value for the prevention and treatment of PF, and is also conducive to the better development and utilization of traditional Chinese herbal medicine radix sophorae flavescentis.
- Citation: Xia SH. Prospect and clinical value of oxymatrine in prevention and treatment of pancreatic fibrosis. Shijie Huaren Xiaohua Zazhi 2020; 28(17): 819-826
- URL: https://www.wjgnet.com/1009-3079/full/v28/i17/819.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v28.i17.819
目前最常见的胰腺疾病主要包括急性胰腺炎(acute pancreatitis, AP), 慢性胰腺炎(chronic pancreatitis, CP)和胰腺癌(pancreatic carcinoma, PC), 胰腺纤维化(pancreatic fibrosis, PF)在AP, CP和PC的发生发展过程中均发挥了重要的作用[1,2]. PF主要是指由于胰腺炎症或损伤引起的胰腺实质细胞即腺泡细胞减少, 胰腺星状细胞(pancreatic stellate cell, PSC)激活, 以胶原为主的细胞外基质(extracellular matrix, ECM)合成增多, 降解相对减少, 两者失去动态平衡而导致过多的ECM沉积为主要特点的病理改变. 中医基于PF脾不主运的病机特点提出了运脾法是其治疗的有效方法; 同时结合肝纤维化发生的病生基础及中医的"同因异病", "异病同治"理论, 以及中医药在防治肝、肺、肾和脑纤维化方面已积累了一定的经验, 所以研究PF具有很好的借鉴意义[3]. 目前尚无针对PF有效的治疗措施, 但有大量研究证实中药成分氧化苦参碱(oxymatrine, OMT)对肝脏等器官的纤维化有明显的治疗作用并用于临床, PF与肝脏纤维化的病理变化和发生机制类似. 所以本文结合作者研究团队的前期研究工作就OMT在防治PF的研究前景及临床应用价值方面进行综述[4,5].
1982年, Watari等[6]首次报道了在鼠的胰腺中发现了具有维生素A储存能力的细胞. Apte等[7]从大鼠胰腺组织中成功分离并培养出PSC, 该细胞分布在胰腺腺泡周围, 大约占所有胰腺细胞的4%, 研究发现它们与肝星状细胞有以下相似的特性: (1)在细胞静息期, 细胞呈梭形或星形; (2)在细胞质中有大量富含维生素A的脂滴; (3)结蛋白和细胞骨架蛋白染色均呈阳性; (4)体外培养48 h后, 细胞进入激活状态, α-SMA染色呈阳性. 1998年德国学者Bachem等[8]又成功地从人和鼠的胰腺基质中分离出这种细胞, 并命名为PSC; 并发现静止的PSC受到致病因子的刺激而激活, 细胞发生以下特征性变化: (1)视黄醇类消失; (2)有收缩性; (3)明显增殖; (4)趋化集聚; (5)生成大量ECM; (6)释放多种细胞因子.
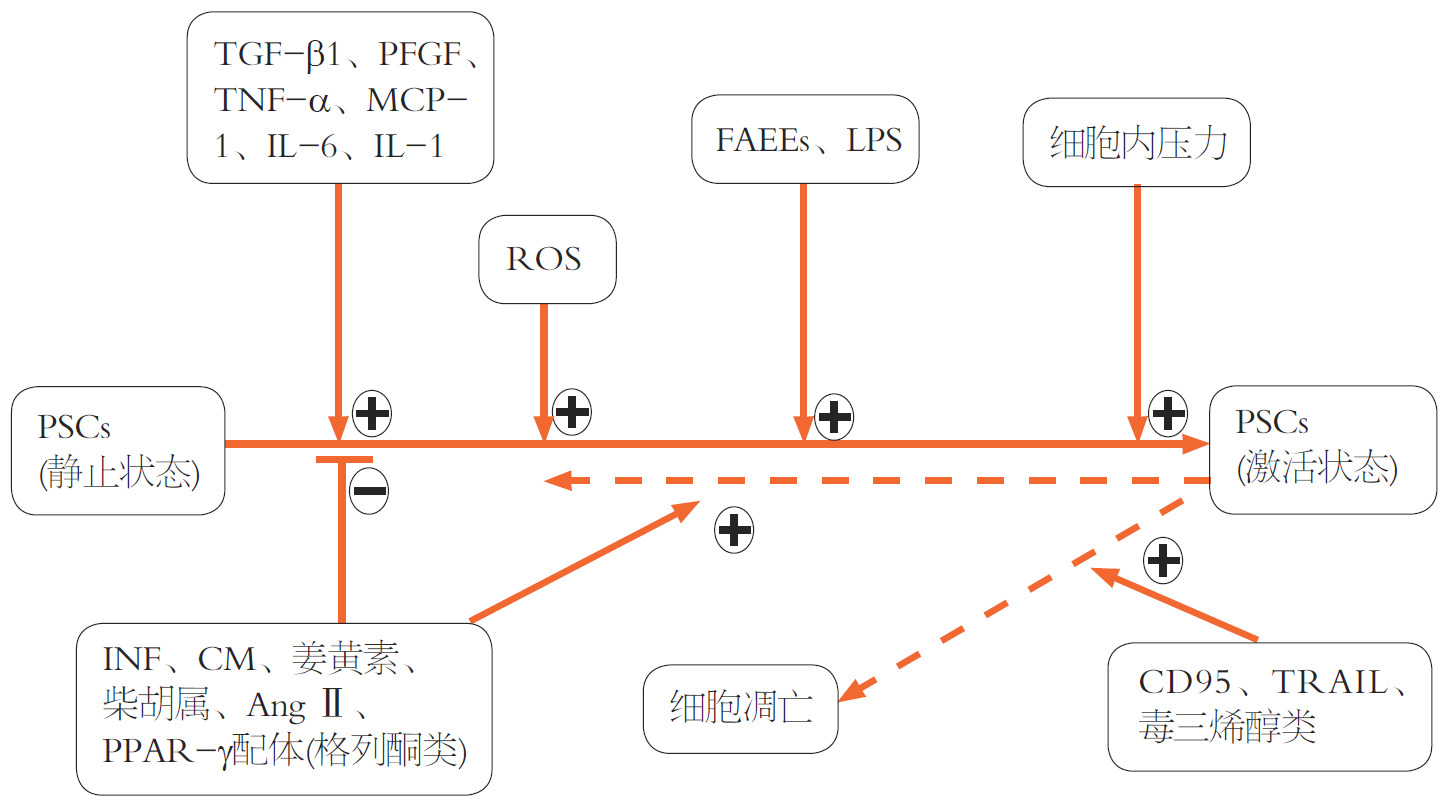
PSC在正常的胰腺组织中呈静止状态, 胰腺损伤后, 激活的PSC增殖活跃, 趋化, 集聚, 合成和分泌大量的I型, Ⅲ型胶原及纤连蛋白(fibronectin, FN)等ECM成分, 使ECM生成增多, 而ECM的降解减少, 两者失去平衡, 致使过多的ECM沉积, 从而导致PF的发生[9]. 可见, PSC激活是PF发生发展的关键环节. 大量研究证实, PSC的激活主要受细胞因子和乙醇及其代谢产物的影响[10,11], 细胞因子主要有: 转化生长因子(transforming growth factor, TGF) -β家族中的TGF-β1, PDGF, TGF-α, 激活蛋白A, 肿瘤坏死因子(tumor necrosis factor, TNF) -α, 白介素(interleukin, IL) -1和IL-6等. 当胰腺损伤时, 巨噬细胞, 腺泡细胞以及血小板被激活, 可分别分泌TGF-β1, TNF-α, IL-1, IL-6和PDGF; 激活的PSC也可通过自体分泌的方式释放TGF-β1, TNF-α, IL-1, IL-6, PDGF和ET-1[12-14]. 由此可见, 当外源性刺激因子激活PSC后, 其自体分泌作用将形成恶性循环, 从而加快PF的进程.
在病理因素刺激下, 如发生急慢性胰腺炎, 胰腺肿瘤和自身免疫性胰腺炎时, ECM 增生明显且刺激持续时, ECM合成远远超过它的降解, 胰腺的纤维化就会出现并逐渐加重, 最终导致CP的形成[16,17]. PF是各种原因所致CP的共同特征, 同时也是与其伴随的组织病理学特点, 表现为大量成纤维细胞增生和富含连接组织的ECM在胰腺内沉积, 导致胰腺实质纤维化, 胰腺功能性组织丧失, 腺泡细胞萎缩,胰管狭窄或扩张, 胰管结石以及炎症细胞浸润等后果, 但是PF的发病机制及其调控过程迄今为止还未完全明确.
随着对CP纤维化发病机制研究的深入, 发现胰腺间质中的PSC, 巨噬细胞[17]及肥大细胞在PF中发挥了重要作用[18], 并对其调控因素及机制已有所认识, 从而有助于抗PF治疗的研究. 近年来大量研究显示CP病人PSC的激活程度与胰腺组织纤维化程度呈正相关, PSC在胰腺慢性纤维化的进程中具有重要作用, 是各种诱因作用的靶点, 也是导致CP纤维化的重要物质基础[19]. PSC激活所致的胰腺慢性纤维化是CP和PC共同的病理经过, 认为激活的PSC有望成为CP和PC治疗的一个新靶标[20,21].
PSC激活是PF的关键, 然而又是什么因素导致了PSC的激活?PSC激活后的调控与转归也是极其复杂的(图1)[22-24], 其具体机制也不完全清楚. 近来的研究显示细胞因子在PSC激活中具有重要作用[25], 而最重要的促纤维化因子是TGF-β1[26]. TGF-β是一种多肽类细胞生长因子, 可来源于血小板, 炎症细胞, 胰腺腺泡细胞, 导管上皮细胞及PSC等, 通过与细胞表面高亲和力受体TGF-β受体(TGF-β receptor, TβR)结合, 调节细胞生长分化, 能刺激间质细胞增生, 抑制上皮类细胞生长, 促进ECM合成并抑制其降解, 在组织的修复和纤维化形成中起关键作用[27]. 在TGF-β超家族中包括有6种TGF-β分子, 其中TGF-β1与PF密切相关. 研究表明在二丁基二氯化物诱发的CP大鼠和自发性胰腺炎WBN/Kob大鼠可见TGF-β1的过度表达[28]. TGF-β1通过促进PSC的激活和增殖来影响ECM的合成和沉淀, 从而促进PF形成[28,29]. TGF-β1是目前已知的最强效的致纤维化细胞因子[30], 并由TβR介导, 目前认为至少有5种不同类型受体(Ⅰ-Ⅴ型), Ⅰ型和Ⅱ型属于丝氨酸/苏氨酸的激酶受体家族, Ⅳ型和Ⅴ型受体的作用目前尚不清楚. TGF-β1的信号转导通过Ⅰ, Ⅱ型受体传递, Ⅲ型受体又称附属受体, 本身不传递信号, 但是它能增强TGF-β1与TβRⅠ/Ⅱ的结合率, 调节TGF-β1与信号受体的结合[31]. TGF-β1首先与TβRⅡ结合, 形成复合物, 此时TGF-β1构象发生改变, 从而可被TβRⅠ识别并结合, TβRⅠ发生自身磷酸化而激活, 形成TβRⅡ-TGF-β1-TβRⅠ异源四聚体复合物, 进而启动下游转导信号蛋白, 发挥调节细胞生长增殖, 分化等一系列生物学作用[32,33], 激活的Ⅱ型受体蛋白激酶使Ⅰ型受体磷酸化, 激活的Ⅰ型受体蛋白激酶直接作用于Smad2, 3, 使其MH2结构域的SSXS基序磷酸化, 随后Smad2, 3与Smad4形成异源寡聚体复合物, 移入核内. 在核内通过直接与DNA结合, 与其他转录因子协同作用及与转录复合激活物或复合抑制物结合调节靶基因转录. 在纤维化胰腺组织中, TGF-β1的表达与Smad3的表达呈正相关, 而与Smad7的表达呈负相关. 推测Smad7作为TGF-β/smad信号转导通路中的负调节因子, 对PSC的激活及PF可能也会起到抑制作用. 近年来, 信号转导通路对PSC功能的调节作用受到广泛关注, 对信号通路的深入研究为进一步探索抑制PF的治疗策略提供了理论基础. 常见的一些信号通路有[24,34-36]: (1)TGF-β/smad信号通路; (2)MAPK信号通路; (3)PI3K/AKT信号通路; (4)JAK-STAT通路; (5)Hedgehog信号通路; (6)Rho-ROCK信号通路; (7)PPAR-γ信号通路; (8)LPS信号通路; (9)Wnt/β-catenin信号通路; (10)活性氧信号通路等. 其中TGF-β/smad信号通路与其他信号通路存在相互作用[37], 对PF的发生发展起到关键性作用[38,39]. TGF-β的主要作用包括[29,32,33,40]: (1)增加PSC合成分泌ECM; (2)通过抑制PSC分泌蛋白酶及刺激PSC分泌蛋白酶抑制剂而减少ECM降解; (3)上调PSC表达TGF-β及TGF-β受体, 产生自身放大效应; (4)调节其他细胞因子如PDGF, IL的生成. 但是关于TGF-β1引发PSC激活的分子机制尚需进一步研究.
由于PSC在CP的具体机制尚未完全阐明, 目前临床治疗上缺乏特异性的方法, 更没有针对PF的有效药物, 治疗也仅限于缓解症状或对其并发症的处理, 如中医中药, 外科手术, 内镜治疗及胰酶替代治疗等, 治疗效果并不理想, 而且复发率较高. 甲磺酸卡莫司他(camostat mesilate, CM)在日本用于治疗CP, CM是一种合成的低分子量的丝氨酸蛋白酶抑制剂, 它能抑制胰酶, 激肽释放酶, 凝血酶和纤溶酶等, 它的作用机制目前不明确[41], 并没有得到广泛认可和应用. 自从发现PSC在PF中的重要作用后, 学者们提出了旨在抗PSC方面取得了一些进展.
首要环节是抑制PSC激活. 研究显示维生素E, 表没食子酸儿茶素-3-没食子,鞣花酸, 异泽兰黄素, 中草药丹参等主要通过抗氧化的作用抑制PSC的激活[1,42]; 维生素D, 干扰素, 姜黄素, PPAR-γ配体-曲格列酮, Ⅰ型血管紧张素Ⅱ受体拮抗剂AngⅡ和IL-17抗体等主要通过抗炎, 抗增殖和免疫调节的作用抑制PSC的激活[43,44]. 最近发现洛伐他汀联合赖诺普利对胰腺远端切除的小鼠慢性酒精性胰腺炎具有重要作用, 通过抑制PSC的活性, 减少ECM的合成, 促进纤维化的分解消散, 从而在胰腺的修复再生过程中发挥重要作用, 其机制是降低α-SMA, 结蛋白, 波形蛋白, 胶质纤维酸性蛋白和TIMP-2的表达, 而使MMP-1与TIMP-2比值升[45]. 还有一些抑制剂也显示能抑制PSC的激活[46], 比如蛋白酶抑制剂CM, HMG-CoA还原酶抑制剂洛伐他汀, TGF-β抑制物柴胡, TNF-α抑制剂乙酮可可碱, PDGF抑制剂曲匹地尔和内皮素受体拮抗剂波生坦等.
抗PSC的第二个环节是让激活的PSC转变为静止状态. 静止的PSC富含维生素A脂滴, 激活的PSC脂滴消失, 因此补充维生素A及其代谢物维甲酸能否使激活的PSC转变为静止状态日渐引起人们的关注. 研究发现维甲酸能使小鼠胰腺炎中激活的PSC转变为静止状态, 并且改变细胞骨架蛋白和细胞因子等影响PSC增殖, 形态变化和迁移[47], 其作用机制为抑制MPAK途径(ERK, JNK, P38)调节的PSC激活进程使其转变为静止状态[48]. 同时, 研究还发现, 维甲酸在PC中则能使周围的癌细胞凋亡[49], 这可能为PC的治疗提供新思路. IL-6与多种肿瘤的致瘤作用, 增殖, 迁移, 药物耐受相关, 肿瘤相关成纤维细胞(cancer-associated fibroblast, CAFs)分泌大量的IL-6参与肿瘤上皮间质分化, 增强癌细胞转移能力. 维甲酸能通过抑制CAFs分泌IL-6来抗癌细胞迁移和上皮间质分化, 进一步提示维甲酸可能成为临床治疗PC的新药.
抗PSC的第三个环节是促PSC凋亡. CD95L和肿瘤坏死因子相关凋亡诱导配体(TNF-related apoptosis-inducing ligand, TRAIL)可促使PSC凋亡, 在体外培养的PSC中分别加入CD95L和TRAIL后, PSC发生凋亡, 且其程度与体外培养天数和CD95L和TRAIL的剂量正相关, 而胰腺腺泡细胞则对CD95L和TRAIL不敏感[50]. 研究发现骨髓间充质干细胞转染NF-κBα基因突变体形成IkBαM-MSCs后注射给CP的小鼠模型, 可以使激活的PSC凋亡, 还能减少ColⅠ, Ⅲ及FN的表达, 升高MMP-1, 2, 3, 9及降低TIMP-1, 2的表达水平[51]. 另外, RAS抑制剂赖诺普利等通过减缓胰腺腺泡细胞凋亡来促进PSC凋亡. 而生育三烯酚类可以通过线粒体途径诱导PSC凋亡. 另外, 胰腺再生蛋白(pancreas regeneration protein, reg)逐渐受到特别关注, reg由胰腺腺泡细胞分泌. 李玲等[52]报道reg在促胰岛β细胞再生的同时, 抑制了PSC的活性, 使PSC增殖和迁移等生物学行为受限,从而使病变局部PSC的数目减少, 且reg可降低TIMP-1和TIMP-2的合成和分泌, 促进ECM的降解在胰腺修复再生过程中发挥作用; 这也提示胰腺损伤时, 腺泡细胞大量分泌reg可能是一种自我保护机制.
总之, 目前PF的治疗仍然停留在动物和体外实验阶段, 主要是由于PF的病生机制尚不明确, 因此阐明PF发生的分子机制, 将为PF的治疗奠定基础.
苦参系药用豆科槐属植物苦参的干燥根, 性寒味苦, 始载于我国最早的药学文献《神农本草经》. 随着分离提取技术的进步, 发现在苦参, 苦豆子, 广豆根中存在同一类以苦参碱为代表的生物碱. 苦参碱和OMT化学分子式分别为C15H24N2O和C15H24N2O2, 分子量分别为266和282, 是苦参型生物碱的主要活性成分, 二者在一定条件下可以转化, 有多方面的药理作用, 如抗菌, 抗炎, 抗风湿, 抗肿瘤, 抗过敏, 免疫和生物反应调节作用等[53-55].
近年大量的实验和临床研究结果表明OMT具有明显的抗器官纤维化作用, 如抗肝纤维化, 抗心肌纤维化和抗肾间质纤维化等, 其中以抗肝纤维化研究得较为深入[56-58]. 临床研究发现, OMT在慢性肝炎和肝纤维化的治疗中可明显降低肝纤维化指标透明质酸, 前Ⅲ型胶原, Ⅳ型胶原和层黏连蛋白等, 对于肝纤维化具有明显的治疗作用[59,60]. OMT抗肝纤维的作用机制可能有以下几方面[61-66]: (1)抑制或下调TGF-β1的表达; (2)抑制TNF-α活性及Fas, FasL表达, 从而阻断LPS所致肝细胞凋亡及坏死; (3)抑制肝星状细胞, 贮脂细胞, 成纤维细胞的增殖和ECM的合成; (4)抑制乙肝病毒复制, 促进肝细胞生长, 阻断肝细胞凋亡等; (5)抑制蛋白激酶C活性从而抑制枯否细胞释放TNF及IL-6; (6)可通过抑制细胞自噬, 减少肝星状细胞活化实现其减轻肝纤维化的作用等.
中医药学认为不同的疾病若病因相同, 病机吻合, 可采用相同的治法, 即"异病同治". 研究表明, 病理状态下体内大部分脏器多会发生纤维化的病理改变, 尽管不同器官纤维化的致病因素并不完全相同, 但纤维化发生的基本机理则可能相同, 因此可以通过相同的细胞和分子调控治疗不同器官的纤维化. 如肝纤维化与PF在发病机制上有许多相似之处, 二者有相同的细胞病理学基础, 即激活的肝胰星状细胞是纤维化发生的主要效应细胞, 因此防治肝纤维的思路和方法也同样可以用于PF的研究, 从激活的PSC的生物学特性入手探讨其发生, 发展以及抗纤维化药物的作用机制. 因此OMT也可以将其推广来治疗PF, 这不仅为祖国医学"异病同治"理论提供重要的实验依据, 也为中医药防治PF的研究开拓了新的思路和方法.
作者研究团队前期也发现OMT可以抑制PSC从静止向激活的转化, 通过减少胰腺组织内胶原的生成及α-SMA 的表达抑制PF的发展[4,5,34,67,68]. 在脂多糖诱导的胰腺微血管内皮细胞中, OMT可明显抑制TLR4/MyD88/NF-κB p65通路和炎症因子IL-1β的表达[69]. 近期研究发现OMT可能通过促进大鼠胰腺星状细胞LTC-14中Gli2表达而发挥抗PF作用[70]; 发现PSC中的miR-211-5p通过调节TLR4/NF-κB信号通路调节炎症反应, OMT可以调节炎症模型中miR-211-5p的表达, OMT调节炎症反应的作用机制可能是通过miR-211-5p调节TLR4/NF-κB信号通路实现的[71]. 然而OMT抑制PF的具体分子机制尚需深入研究.
针对PSC激活环节, PF逆转机制和OMT对PF的作用机制等均是研究的热点问题. 国内外的研究人员在OMT在防治PF的研究方面已经取得了长足的进步, 而且有着广泛的研究前景及较高的临床应用价值, 主要基于以下三个方面.
第一, 随着研究人员对OMT本身研究的深入, 其需要越来越多, 需求量也日益增加, 其资源的保护也被重视, 推动了国内产学研这一链条的发展. 为此, 建立规范化栽培种植基地是保护OMT资源的有效手段, OMT药理活性的研究也应该与中医理论相结合, 以及分子靶点的作用机制, 提高其生物活性研究的意义和价值. 因此, 我们需要在中医药理论的指导下, 加强对苦参活性成分, 药理作用及炮制方法的研究, 合理开发资源, 推动中医药产业的蓬勃发展.
第二, 近二十年来, 每年发表的关于PSC的论文数量呈稳定的线性增长, 越来越多的研究工作致力于揭示控制PSC生理的信号通路. 由于PSC的激活是胰腺疾病发病机制的基础也是关键, 因此细胞表型转变的信号通路引起了人们的特别关注, 这些信号的靶向操作可能阻止甚至逆转PSC的激活, 成为治疗CP和PC的有效工具, PSC激活途径相关的靶向治疗的方法也成为研究的热点[72]. 另外, 为了能够更好地探索CP和PC的发生和发展的机制, PSC永生化的问题目前也是值得积极探索的方向[73]. 总之, 对于PSC领域的进一步研究可能为CP和PC治疗提供重大突破.
第三, CP是由多种病因所致的复杂的消化系统疾病, 其发病机制虽尚未完全阐明, 但大量的研究使CP的发病机制形成了一定的共识, 即PF是不同病因所致CP的共同病理学改变, PSC因其可产生ECM, 被作为PF的核心靶点进行深入研究. 同时认为被激活的PSC是胰腺过度纤维化的重要前体, 是CP及PC发生发展的重要标志之一. 因此, 抗纤维化治疗已被确定为一种新的非常重要的治疗策略之一, 那就是通过靶向PSC来治疗CP及PC[74]. 近年来发现的具有潜在抗纤维化作用的药物除了OMT外还包括黄芩苷, 雷公藤甲素, 姜黄素, 白藜芦醇, 大黄素, 绿茶儿茶素衍生物, 二甲双胍, 鞣花酸等[75,76]. 这些药物是植物性药物, 并已被证明是有前途的临床应用, 但是他们单独或联合作用机制和相关的分子靶点还不清楚, 仅仅局限于基础研究和Ⅰ/Ⅱ期临床试验, 其中大部分工作是进行CP和PC模型基础研究. 未来抗PF的研究要探索植物性药物的生物利用度, 药物设计, 各种配方及其分子机制等问题, 以实现具有良好活性和耐受性的临床应用类药物.
系统阐述了PSC, PF和OMT三者各自的研究进展及其相互之间的关系以及提出了需要进一步解决的关键问题.
已经认识到PSC激活是PF起始与发展的中心环节, 但是PF的发病机制尚不完全清楚, 针对PF的特异性治疗也是空白. 但是与之相对应的肝纤维化的发病机制研究得较为深入, 其治疗也有很大的进步. 研究发现PF与肝纤维化的病理变化和发生机制又类似. 基于这些理论, 实验和事实依据以及我国中医的"异病同治理论", 为了更接近临床实践, 所以研究PSC在CP和PC胰腺的动态变化(包括形态学, 生化指标, 差异基因, 差异蛋白和信号转导途径等), 以及研究OMT对CP和PC中PSC的动态影响, 筛选CP和PC中PSC与正常PSC的差异基因和差异蛋白, 甚至进行生物信息学分析和研究, 寻找CP和PC信号转导网络关系以及寻找新的针对CP和PC治疗靶点, 将对临床防治CP和PC具有深远的研究意义和良好的应用价值, 也有利于更好地开发和利用传统中草药苦参等, 为临床提供一种安全, 廉价的中药制剂.
学科分类: 胃肠病学和肝病学
手稿来源地: 天津市
同行评议报告学术质量分类
A级 (优秀): A, A
B级 (非常好): B, B
C级 (良好): 0
D级 (一般): 0
E级 (差): 0
科学编辑: 张晗 制作编辑:刘继红
| 1. | Sherman MH, Yu RT, Engle DD, Ding N, Atkins AR, Tiriac H, Collisson EA, Connor F, Van Dyke T, Kozlov S, Martin P, Tseng TW, Dawson DW, Donahue TR, Masamune A, Shimosegawa T, Apte MV, Wilson JS, Ng B, Lau SL, Gunton JE, Wahl GM, Hunter T, Drebin JA, O'Dwyer PJ, Liddle C, Tuveson DA, Downes M, Evans RM. Vitamin D receptor-mediated stromal reprogramming suppresses pancreatitis and enhances pancreatic cancer therapy. Cell. 2014;159:80-93. [PubMed] [DOI] |
| 2. | Kanno A, Masamune A, Hanada K, Kikuyama M, Kitano M. Advances in Early Detection of Pancreatic Cancer. Diagnostics (Basel). 2019;9:18. [PubMed] [DOI] |
| 5. | 陈 伟, 许 威, 向 晓辉, 陈 凯, 张 青, 夏 时海. 氧化苦参碱对脂多糖诱导的胰腺星状细胞NOD样受体蛋白3活化的影响. 药物评价研究. 2019;42:2159-2164. [DOI] |
| 6. | Watari N, Hotta Y, Mabuchi Y. Morphological studies on a vitamin A-storing cell and its complex with macrophage observed in mouse pancreatic tissues following excess vitamin A administration. Okajimas Folia Anat Jpn. 1982;58:837-858. [PubMed] [DOI] |
| 7. | Apte MV, Haber PS, Applegate TL, Norton ID, McCaughan GW, Korsten MA, Pirola RC, Wilson JS. Periacinar stellate shaped cells in rat pancreas: identification, isolation, and culture. Gut. 1998;43:128-133. [PubMed] [DOI] |
| 8. | Bachem MG, Schneider E, Gross H, Weidenbach H, Schmid RM, Menke A, Siech M, Beger H, Grünert A, Adler G. Identification, culture, and characterization of pancreatic stellate cells in rats and humans. Gastroenterology. 1998;115:421-432. [PubMed] [DOI] |
| 9. | Jaster R, Emmrich J. Crucial role of fibrogenesis in pancreatic diseases. Best Pract Res Clin Gastroenterol. 2008;22:17-29. [PubMed] [DOI] |
| 10. | Mews P, Phillips P, Fahmy R, Korsten M, Pirola R, Wilson J, Apte M. Pancreatic stellate cells respond to inflammatory cytokines: potential role in chronic pancreatitis. Gut. 2002;50:535-541. [PubMed] [DOI] |
| 11. | Aoki H, Ohnishi H, Hama K, Shinozaki S, Kita H, Yamamoto H, Osawa H, Sato K, Tamada K, Sugano K. Existence of autocrine loop between interleukin-6 and transforming growth factor-beta1 in activated rat pancreatic stellate cells. J Cell Biochem. 2006;99:221-228. [PubMed] [DOI] |
| 12. | Vonlaufen A, Phillips PA, Xu Z, Zhang X, Yang L, Pirola RC, Wilson JS, Apte MV. Withdrawal of alcohol promotes regression while continued alcohol intake promotes persistence of LPS-induced pancreatic injury in alcohol-fed rats. Gut. 2011;60:238-246. [PubMed] [DOI] |
| 13. | 严 豪杰, 崔 乃强, 张 淑坤, 赵 二鹏, 卢 洪军. 胰腺星状细胞在胰腺纤维化进程中的作用. 中国中西医结合外科杂志. 2015;21:204-207. [DOI] |
| 14. | Hamada S, Masamune A, Yoshida N, Takikawa T, Shimosegawa T. IL-6/STAT3 Plays a Regulatory Role in the Interaction Between Pancreatic Stellate Cells and Cancer Cells. Dig Dis Sci. 2016;61:1561-1571. [PubMed] [DOI] |
| 15. | Kang ZS, Wang C, Han XL, Du JJ, Li YY, Zhang C. Design, synthesis and biological evaluation of non-secosteriodal vitamin D receptor ligand bearing double side chain for the treatment of chronic pancreatitis. Eur J Med Chem. 2018;146:541-553. [PubMed] [DOI] |
| 17. | Gatti R, Marchi AG. [Condiderations on 2 cases of vitamin-resistant rickets]. Minerva Pediatr. 1966;18:1151-1155. [PubMed] [DOI] |
| 18. | Araki Y, Andoh A, Fujiyama Y, Bamba T. Do mast cells play any role in the pathogenesis of experimental pancreatic fibrosis in rats? Pancreas. 2002;25:415-417. [PubMed] [DOI] |
| 19. | Masamune A, Watanabe T, Kikuta K, Shimosegawa T. Roles of pancreatic stellate cells in pancreatic inflammation and fibrosis. Clin Gastroenterol Hepatol. 2009;7:S48-S54. [PubMed] [DOI] |
| 20. | Thomas D, Radhakrishnan P. Pancreatic Stellate Cells: The Key Orchestrator of The Pancreatic Tumor Microenvironment. Adv Exp Med Biol. 2020;1234:57-70. [PubMed] [DOI] |
| 21. | Lee L, Ito T, Nakamura T, Jensen RT, Igarashi H, Takayanagi R. Antifibrotic Effect of Saturated Fatty Acids via Endoplasmic Reticulum Stress Response in Rat Pancreatic Stellate Cells. Pancreas. 2017;46:385-394. [PubMed] [DOI] |
| 23. | Storck H, Hild B, Schimmelpfennig S, Sargin S, Nielsen N, Zaccagnino A, Budde T, Novak I, Kalthoff H, Schwab A. Ion channels in control of pancreatic stellate cell migration. Oncotarget. 2017;8:769-784. [PubMed] [DOI] |
| 24. | Bynigeri RR, Jakkampudi A, Jangala R, Subramanyam C, Sasikala M, Rao GV, Reddy DN, Talukdar R. Pancreatic stellate cell: Pandora's box for pancreatic disease biology. World J Gastroenterol. 2017;23:382-405. [PubMed] [DOI] |
| 25. | Jaskiewicz K, Nalecz A, Rzepko R, Sledzinski Z. Immunocytes and activated stellate cells in pancreatic fibrogenesis. Pancreas. 2003;26:239-242. [PubMed] [DOI] |
| 26. | Su SB, Motoo Y, Xie MJ, Miyazono K, Sawabu N. Expression of transforming growth factor-beta in spontaneous chronic pancreatitis in the WBN/Kob rat. Dig Dis Sci. 2000;45:151-159. [PubMed] [DOI] |
| 27. | Talukdar R, Tandon RK. Pancreatic stellate cells: new target in the treatment of chronic pancreatitis. J Gastroenterol Hepatol. 2008;23:34-41. [PubMed] [DOI] |
| 28. | Hama K, Ohnishi H, Aoki H, Kita H, Yamamoto H, Osawa H, Sato K, Tamada K, Mashima H, Yasuda H, Sugano K. Angiotensin II promotes the proliferation of activated pancreatic stellate cells by Smad7 induction through a protein kinase C pathway. Biochem Biophys Res Commun. 2006;340:742-750. [PubMed] [DOI] |
| 29. | Sun L, Xiu M, Wang S, Brigstock DR, Li H, Qu L, Gao R. Lipopolysaccharide enhances TGF-β1 signalling pathway and rat pancreatic fibrosis. J Cell Mol Med. 2018;22:2346-2356. [PubMed] [DOI] |
| 30. | Makino S, Sugai S. Potentiometric titration of poly-S-carboxymethyl-L-cysteine in aqueous NaCl solution. Biopolymers. 1970;9:1049-1058. [PubMed] [DOI] |
| 31. | Chen C, Wang XF, Sun L. Expression of transforming growth factor beta (TGFbeta) type III receptor restores autocrine TGFbeta1 activity in human breast cancer MCF-7 cells. J Biol Chem. 1997;272:12862-12867. [PubMed] [DOI] |
| 32. | Apte M, Pirola R, Wilson J. The fibrosis of chronic pancreatitis: new insights into the role of pancreatic stellate cells. Antioxid Redox Signal. 2011;15:2711-2722. [PubMed] [DOI] |
| 34. | Zhou Q, Xia S, Guo F, Hu F, Wang Z, Ni Y, Wei T, Xiang H, Shang D. Transforming growth factor-β in pancreatic diseases: Mechanisms and therapeutic potential. Pharmacol Res. 2019;142:58-69. [PubMed] [DOI] |
| 35. | Hou XJ, Jin ZD, Jiang F, Zhu JW, Li ZS. Expression of Smad7 and Smad ubiquitin regulatory factor 2 in a rat model of chronic pancreatitis. J Dig Dis. 2015;16:408-415. [PubMed] [DOI] |
| 36. | Song H, Zhang Y. Regulation of pancreatic stellate cell activation by Notch3. BMC Cancer. 2018;18:36. [PubMed] [DOI] |
| 37. | Tung CW, Hsu YC, Cai CJ, Shih YH, Wang CJ, Chang PJ, Lin CL. Trichostatin A ameliorates renal tubulointerstitial fibrosis through modulation of the JNK-dependent Notch-2 signaling pathway. Sci Rep. 2017;7:14495. [PubMed] [DOI] |
| 38. | Li X, Nania S, Fejzibegovic N, Moro CF, Klopp-Schulze L, Verbeke C, Löhr JM, Heuchel RL. Cerulein-induced pancreatic fibrosis is modulated by Smad7, the major negative regulator of transforming growth factor-β signaling. Biochim Biophys Acta. 2016;1862:1839-1846. [PubMed] [DOI] |
| 39. | Tang D, Wu Q, Zhang J, Zhang H, Yuan Z, Xu J, Chong Y, Huang Y, Xiong Q, Wang S, Tian Y, Lu Y, Ge X, Shen W, Wang D. Galectin-1 expression in activated pancreatic satellite cells promotes fibrosis in chronic pancreatitis/pancreatic cancer via the TGF-β1/Smad pathway. Oncol Rep. 2018;39:1347-1355. [PubMed] [DOI] |
| 40. | Yasuda M, Ito T, Oono T, Kawabe K, Kaku T, Igarashi H, Nakamura T, Takayanagi R. Fractalkine and TGF-beta1 levels reflect the severity of chronic pancreatitis in humans. World J Gastroenterol. 2008;14:6488-6495. [PubMed] [DOI] |
| 41. | Okuno M, Akita K, Moriwaki H, Kawada N, Ikeda K, Kaneda K, Suzuki Y, Kojima S. Prevention of rat hepatic fibrosis by the protease inhibitor, camostat mesilate, via reduced generation of active TGF-beta. Gastroenterology. 2001;120:1784-1800. [PubMed] [DOI] |
| 42. | Jiang F, Liao Z, Hu LH, Du YQ, Man XH, Gu JJ, Gao J, Gong YF, Li ZS. Comparison of antioxidative and antifibrotic effects of α-tocopherol with those of tocotrienol-rich fraction in a rat model of chronic pancreatitis. Pancreas. 2011;40:1091-1096. [PubMed] [DOI] |
| 43. | Lee BJ, Lee HS, Kim CD, Jung SW, Seo YS, Kim YS, Jeen YT, Chun HJ, Um SH, Lee SW, Choi JH, Ryu HS. The Effects of Combined Treatment with an HMG-CoA Reductase Inhibitor and PPARγ Agonist on the Activation of Rat Pancreatic Stellate Cells. Gut Liver. 2012;6:262-269. [PubMed] [DOI] |
| 44. | Zhao Q, Manohar M, Wei Y, Pandol SJ, Habtezion A. STING signalling protects against chronic pancreatitis by modulating Th17 response. Gut. 2019;68:1827-1837. [PubMed] [DOI] |
| 45. | Nichitaĭlo ME, Kravchenko DA, Shpon'ka IS, Medvetskiĭ EB, Savitskaia IM, Bulik II, Khil'ko IuA. [Inhibition of the stellate cells using lisinopril and lovastatin for prophylaxis of pancreatic stump fibrosis after performance of distal resection in a model of chronic alcoholic pancreatitis]. Klin Khir. 2013;64-66. [PubMed] |
| 47. | Froeling FE, Feig C, Chelala C, Dobson R, Mein CE, Tuveson DA, Clevers H, Hart IR, Kocher HM. Retinoic acid-induced pancreatic stellate cell quiescence reduces paracrine Wnt-β-catenin signaling to slow tumor progression. Gastroenterology. 2011;141:1486-1497, 1497.e1-1497.14. [PubMed] [DOI] |
| 48. | Erkan M, Adler G, Apte MV, Bachem MG, Buchholz M, Detlefsen S, Esposito I, Friess H, Gress TM, Habisch HJ, Hwang RF, Jaster R, Kleeff J, Klöppel G, Kordes C, Logsdon CD, Masamune A, Michalski CW, Oh J, Phillips PA, Pinzani M, Reiser-Erkan C, Tsukamoto H, Wilson J. StellaTUM: current consensus and discussion on pancreatic stellate cell research. Gut. 2012;61:172-178. [PubMed] [DOI] |
| 49. | Guan J, Zhang H, Wen Z, Gu Y, Cheng Y, Sun Y, Zhang T, Jia C, Lu Z, Chen J. Retinoic acid inhibits pancreatic cancer cell migration and EMT through the downregulation of IL-6 in cancer associated fibroblast cells. Cancer Lett. 2014;345:132-139. [PubMed] [DOI] |
| 51. | Qin T, Liu CJ, Zhang HW, Pan YF, Tang Q, Liu JK, Wang YZ, Hu MX, Xue F. Effect of the IkBα mutant gene delivery to mesenchymal stem cells on rat chronic pancreatitis. Genet Mol Res. 2014;13:371-385. [PubMed] [DOI] |
| 52. | Li L, Bimmler D, Graf R, Zhou S, Sun Z, Chen J, Siech M, Bachem MG. PSP/reg inhibits cultured pancreatic stellate cell and regulates MMP/ TIMP ratio. Eur J Clin Invest. 2011;41:151-158. [PubMed] [DOI] |
| 55. | Jiang Y, Zhu Y, Mu Q, Luo H, Zhi Y, Shen X. Oxymatrine provides protection against Coxsackievirus B3-induced myocarditis in BALB/c mice. Antiviral Res. 2017;141:133-139. [PubMed] [DOI] |
| 56. | Huang XY, Chen CX. Effect of oxymatrine, the active component from Radix Sophorae flavescentis (Kushen), on ventricular remodeling in spontaneously hypertensive rats. Phytomedicine. 2013;20:202-212. [PubMed] [DOI] |
| 57. | Jiang X, Xie L, Huang C, Liu Y, Liu H, Liu B, Zheng L. Oral oxymatrine for hepatitis B cirrhosis: A systematic review protocol. Medicine (Baltimore). 2018;97:e13482. [PubMed] [DOI] |
| 58. | Liu L, Wang Y, Yan R, Li S, Shi M, Xiao Y, Guo B. Oxymatrine Inhibits Renal Tubular EMT Induced by High Glucose via Upregulation of SnoN and Inhibition of TGF-β1/Smad Signaling Pathway. PLoS One. 2016;11:e0151986. [PubMed] [DOI] |
| 60. | Yang J, Hou Y, Ji G, Song Z, Liu Y, Dai G, Zhang Y, Chen J. Targeted delivery of the RGD-labeled biodegradable polymersomes loaded with the hydrophilic drug oxymatrine on cultured hepatic stellate cells and liver fibrosis in rats. Eur J Pharm Sci. 2014;52:180-190. [PubMed] [DOI] |
| 61. | Wu J, Pan L, Jin X, Li W, Li H, Chen J, Yang W. The role of oxymatrine in regulating TGF-β1 in rats with hepatic fibrosis. Acta Cir Bras. 2018;33:207-215. [PubMed] [DOI] |
| 63. | Parvez MK, Arbab AH, Al-Dosari MS, Al-Rehaily AJ. Antiviral Natural Products Against Chronic Hepatitis B: Recent Developments. Curr Pharm Des. 2016;22:286-293. [PubMed] [DOI] |
| 64. | Zhao HW, Zhang ZF, Chai X, Li GQ, Cui HR, Wang HB, Meng YK, Liu HM, Wang JB, Li RS, Bai ZF, Xiao XH. Oxymatrine attenuates CCl4-induced hepatic fibrosis via modulation of TLR4-dependent inflammatory and TGF-β1 signaling pathways. Int Immunopharmacol. 2016;36:249-255. [PubMed] [DOI] |
| 66. | 马 子华, 张 景允, 杨 柳, 田 甜, 汤 雷, 郑 璐, 蔡 爽, 韩 冰, 谢 汝佳, 杨 婷, 杨 勤. 氧化苦参碱干预砷致肝星状细胞活化中细胞自噬的研究. 中国病理生理杂志. 2019;35:1662-1667. [DOI] |
| 67. | 王 昱良, 郑 永青, 夏 时海, 汪 海燕, 苏 丽婷, 吴 双. 氧化苦参碱对慢性胰腺炎胰腺组织中Ⅰ型胶原及α-SMA的影响. 世界华人消化杂志. 2010;18:1331-1336. [DOI] |
| 68. | Lu ML, Xiang XH, Xia SH. Potential Signaling Pathways Involved in the Clinical Application of Oxymatrine. Phytother Res. 2016;30:1104-1112. [PubMed] [DOI] |
| 69. | Lu M, Zhang Q, Chen K, Xu W, Xiang X, Xia S. The regulatory effect of oxymatrine on the TLR4/MyD88/NF-κB signaling pathway in lipopolysaccharide-induced MS1 cells. Phytomedicine. 2017;36:153-159. [PubMed] [DOI] |
| 70. | 李 嫚华, 陈 凯, 张 青, 向 晓辉, 许 威, 夏 时海. 氧化苦参碱通过促进胰腺星状细胞株中Gli2 表达发挥抗胰腺纤维化作用. 中草药. 2018;49:3069-3072. [DOI] |
| 71. | 李 如月, 向 晓辉, 张 斌, 张 青, 夏 时海. 氧化苦参碱通过胰腺星状细胞中miRNA-211-5p调节TLR4/NF-κB 通路调控炎性反应. 药物评价研究. 2018;41:540-546. [DOI] |
| 72. | Kusiak AA, Szopa MD, Jakubowska MA, Ferdek PE. Signaling in the Physiology and Pathophysiology of Pancreatic Stellate Cells - a Brief Review of Recent Advances. Front Physiol. 2020;11:78. [PubMed] [DOI] |
| 73. | Sun L, Qu L, Brigstock DR, Li H, Li Y, Gao R. Biological and Proteomic Characteristics of an Immortalized Human Pancreatic Stellate Cell Line. Int J Med Sci. 2020;17:137-144. [PubMed] [DOI] |
| 74. | Ramakrishnan P, Loh WM, Gopinath SCB, Bonam SR, Fareez IM, Mac Guad R, Sim MS, Wu YS. Selective phytochemicals targeting pancreatic stellate cells as new anti-fibrotic agents for chronic pancreatitis and pancreatic cancer. Acta Pharm Sin B. 2020;10:399-413. [PubMed] [DOI] |